다이클로로카벤
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
다이클로로카벤은 화학식 CCl₂를 갖는 카벤의 일종이다. 클로로포름과 염기의 반응, 에틸 트리클로로아세테이트와 소듐 메톡사이드의 반응, 페닐(트리클로로메틸)수은의 열분해, 다이클로로다이아지린의 광분해, 사염화 탄소의 탈염소화 반응 등을 통해 합성된다. 다이클로로카벤은 알켄과 반응하여 다이클로로사이클로프로페인을 생성하며, 라이머-티만 반응과 카빌아민 반응의 중간체로 사용된다. 1835년 오귀스트 로랑에 의해 처음 예측되었으며, 1954년 윌리엄 데링에 의해 클로로포름으로부터의 제조법과 합성에서의 유용성이 보고되었다. 관련 반응으로 도링-라플람 알렌 합성, 스카테볼 재배열 등이 있으며, 디브로모카벤, 클로로카벤과 관련이 있다.
더 읽어볼만한 페이지
- 카벤 - 다이하이드록시메틸리덴
다이하이드록시메틸리덴은 화학식 C(OH)₂를 가지며 극저온에서 안정하고 굽은 분자 구조를 갖는 분자로, 옥살산의 진공 열분해를 통해 생성되지만 온도가 상승하면 폼산으로 이성질체화된다. - 카벤 - 메틸렌 (화합물)
메틸렌은 분자식 CH₂를 갖는 매우 반응성이 높은 중성 분자로, 유기화학에서 중요한 중간체 역할을 하며, 삼중항 상태와 단일항 상태로 존재하면서 첨가 반응, 삽입 반응 등 다양한 화학 반응에 참여하고 금속-메틸렌 착물을 형성하기도 한다.
2. 합성
다이클로로카벤(CCl2)은 다양한 방법으로 합성될 수 있다. 가장 일반적인 방법은 클로로포름(HCCl3)을 칼륨 tert-부톡사이드나 수성 수산화 나트륨(NaOH)과 같은 강한 염기와 반응시키는 것이다.[1][12] 이 반응의 효율을 높이기 위해 벤질트리에틸암모늄 브로마이드와 같은 상 이동 촉매가 사용되기도 한다.[1][12]
다른 전구체를 이용한 합성 방법도 존재한다. 에틸 트리클로로아세테이트를 소듐 메톡사이드로 처리하거나,[2][13] 페닐(트리클로로메틸)수은을 열분해하여 다이클로로카벤을 얻을 수 있다.[3][14] 또한, 다이클로로다이아지린을 빛을 이용하여 광분해하거나,[4][15] 사염화 탄소(CCl4)를 마그네슘(Mg)으로 탈염소화하는 방법도 알려져 있다.[5][17] 특히 사염화 탄소를 이용하는 방법은 강염기를 사용하지 않아 에스터나 카보닐 화합물과 같은 특정 작용기에 영향을 주지 않는다는 장점이 있다.[5][17]
2. 1. 클로로포름과 염기의 반응
다이클로로카벤은 일반적으로 클로로포름(HCCl3)과 칼륨 ''tert''-부톡사이드 또는 수성 수산화 나트륨(NaOH)과 같은 강염기의 반응을 통해 생성된다.[1][12] 이 반응에서는 상 이동 촉매를 사용하기도 하는데, 예를 들어 벤질트리에틸암모늄 브로마이드와 같은 촉매는 수산화물 이온(OH-)이 물 층(수성상)에서 클로로포름이 녹아 있는 유기 용매 층(유기상)으로 이동하는 것을 도와 반응 효율을 높인다.[1][12]수산화 나트륨을 사용했을 때의 반응식은 다음과 같다.
:HCCl3 + NaOH → CCl2 + NaCl + H2O
2. 2. 기타 시약 및 경로
에틸 트리클로로아세테이트는 다이클로로카벤의 또 다른 전구체이다. 이를 소듐 메톡사이드로 처리하면 CCl2가 생성된다.[2][13]페닐(트리클로로메틸)수은을 열분해하여 CCl2를 얻는 경로도 있다.[3][14]
: PhHgCCl3 → CCl2 + PhHgCl
어둠 속에서 안정적인 다이클로로다이아지린은 광분해를 통해 다이클로로카벤과 질소(N2)로 화학적 분해될 수 있다.[4][15]

또한, 사염화 탄소(CCl4)를 마그네슘(Mg)으로 탈염소화하고 초음파 화학을 이용하여 다이클로로카벤을 얻는 방법도 있다.[5][17] 이 방법은 강염기를 사용하지 않기 때문에 에스터나 카보닐 화합물이 반응 조건에 영향을 받지 않는다는 장점이 있다.
3. 반응
다이클로로카벤은 높은 반응성을 가지는 화학종으로, 다양한 유기 화합물과 반응하여 유용한 생성물을 만든다. 주요 반응으로는 알켄과의 [1+2] 고리화 첨가 반응을 통한 사이클로프로페인 유도체 합성, 페놀과의 반응을 통한 오쏘-포름화(라이머-티만 반응), 그리고 1차 아민과의 반응을 통한 이소시아나이드 합성(카빌아민 반응) 등이 있다.[6][7] 이러한 반응들은 유기 합성에서 중요한 중간체를 제공하며, 각각의 반응은 특정 조건 하에서 진행되어 목표 화합물을 선택적으로 얻는 데 활용된다.
3. 1. 알켄과의 반응
다이클로로카벤은 알켄과 형식적인 [1+2] 고리화 첨가 반응을 통해 반응하여 제미날 다이클로로사이클로프로페인을 생성한다. 생성된 다이클로로사이클로프로페인은 유기 환원을 통해 사이클로프로페인으로 환원되거나, 가수분해를 통해 사이클로프로파논을 생성할 수 있다. 또한, 다이클로로사이클로프로페인은 Skattebøl 재배열을 통해 알렌으로 전환될 수도 있다. 클로로포름으로부터 다이클로로카벤을 합성하는 방법과 그 실용성은 1954년 윌리엄 데링에 의해 보고되었다.
라이머-티만 반응에서는 다이클로로카벤이 페놀과 반응하여 살리실알데하이드를 생성한다.
3. 2. 페놀과의 반응 (라이머-티만 반응)
라이머-티만 반응에서 다이클로로카벤은 페놀과 반응하여 오쏘(ortho)-포름화된 생성물을 만든다.[6] 예를 들어, 페놀은 살리실알데히드로 변환된다.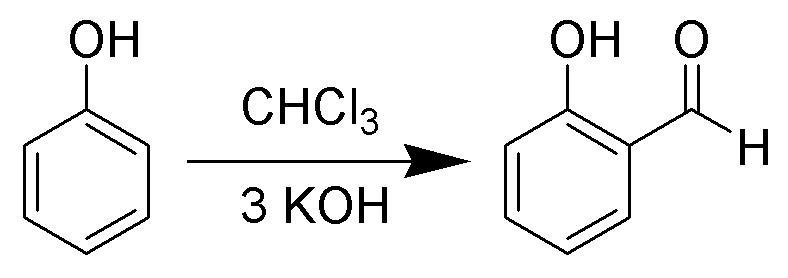
3. 3. 아민과의 반응 (카빌아민 반응)
다이클로로카벤은 카빌아민 반응에서 중간체로 작용한다. 이 변환에서 1차 아민의 디클로로메탄 용액은 클로로포름과 수성 수산화 나트륨을 상 이동 촉매의 촉매량과 함께 처리한다. 이를 통해 이소시아나이드(카빌아민)를 합성한다. 예를 들어, ''tert''-부틸 이소시아나이드는 다음과 같이 합성될 수 있다:[7]:Me3CNH2 + CHCl3 + 3 NaOH → Me3CNC + 3 NaCl + 3 H2O
4. 역사
1835년, 프랑스 화학자 오귀스트 로랑은 클로로포름을 CCl2•HCl (당시에는 C8Cl8•H4Cl4로 표기)로 인식했다. 그는 또한 다이클로로카벤 두 부분으로 구성된 것으로 보이는 화합물을 예측하고 '클로레테로스'(Chlorétherose)라고 명명했는데, 이는 당시에는 알려지지 않았던 테트라클로로에틸렌일 가능성이 있다.[8]
반응 중간체로서의 다이클로로카벤은 1862년 안톤 가이터가 처음 제안했으며, 그는 클로로포름을 CCl2·HCl로 보았다.[9][19] 다이클로로카벤의 생성은 1950년 Hine에 의해 재조사되었다.[10][20] 1954년에는 윌리엄 폰 에거스 되링이 클로로포름으로부터 다이클로로카벤을 제조하는 방법과 이것이 화학 합성에서 유용하다는 점을 보고했다.[11]
5. 관련 반응
도링-라플람 알렌 합성은 다이클로로카벤과 알켄의 반응을 통해 알켄을 알렌으로 전환하는 반응이다. 이 과정에서 사슬이 연장되며, 마그네슘이나 나트륨 금속이 사용된다. 비슷한 반응 순서가 스카테볼 재배열에서도 나타나는데, 이 경우 사이클로펜타다이엔이 생성된다.
다이클로로카벤과 유사한 물질로는 디브로모카벤(CBr2)이 있으며, 이는 다이클로로카벤보다 반응성이 더 크다.
6. 클로로카벤
'''클로로카벤'''(ClHC)은 메틸리튬과 다이클로로메탄으로부터 생성될 수 있으며, 스피로펜타디엔의 합성에 사용된다.
참조
[1]
간행물
2-Oxa-7,7-dichloronorcarane
[2]
간행물
1,6-Methano[10]annulene
[3]
간행물
Phenyl(trichloromethyl)mercury
[4]
간행물
Dichlorodiazirine: A Nitrogenous Precursor for Dichlorocarbene
[5]
간행물
A Facile Procedure for the Generation of Dichlorocarbene from the Reaction of Carbon Tetrachloride and Magnesium using Ultrasonic Irradiation
http://www.mdpi.org/[...]
[6]
간행물
The Reimer-Tiemann Reaction
[7]
간행물
Phase-transfer Hofmann carbylamine reaction: tert-butyl isocyanide
[8]
간행물
Note sur les Chlorure, Bromure et Iodure d'Aldehydène
https://archive.org/[...]
[9]
간행물
Ueber die Zersetzung des Chloroforms durch alkoholische Kalilösung
1862
[10]
간행물
Carbon Dichloride as an Intermediate in the Basic Hydrolysis of Chloroform. A Mechanism for Substitution Reactions at a Saturated Carbon Atom
[11]
간행물
The Addition of Dichlorocarbene to Olefins
[12]
간행물
Organic Syntheses
http://www.orgsyn.or[...]
[13]
간행물
Organic Syntheses
http://www.orgsyn.or[...]
[14]
간행물
Organic Syntheses
http://www.orgsyn.or[...]
[15]
간행물
Dichlorodiazirine: A Nitrogenous Precursor for Dichlorocarbene
[16]
문서
a) [[페놀]]과[[지시안]]의 반응으로[[페닐기|페닐]][[시아네이트]]가 생じる。b) [[히드록실아민]]과 반응しN-히드록시-O-페닐이소尿素となる。c) [[염화메탄술포닐]]과의 반응で[[메실라트]]となり[[히드록시기]]가[[탈리기]]になる。d) [[차아염소산나트륨]]により[[분자내반응|분자내]]폐환이 起こり[[지아지린]]となる。e) [[테트라플루오로호우산니트로니움]]で[[니트로화]]。f) [[이온액체]]中において[[염화세슘]]、[[염화테트라부틸암모늄]]で[[구핵치환반응]]
[17]
간행물
A Facile Procedure for the Generation of Dichlorocarbene from the Reaction of Carbon Tetrachloride and Magnesium using Ultrasonic Irradiation
http://www.mdpi.org/[...]
[18]
간행물
The Addition of Dichlorocarbene to Olefins
[19]
간행물
Ueber die Zersetzung des Chloroforms durch alkoholische Kalilösung
1862
[20]
간행물
Carbon Dichloride as an Intermediate in the Basic Hydrolysis of Chloroform. A Mechanism for Substitution Reactions at a Saturated Carbon Atom
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
