옵소닌
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
옵소닌은 표적, 주로 세균에 결합하여 탐식 세포의 탐식을 유도하는 물질이다. 이는 표적과 탐식 세포 사이의 연결 분자 역할을 하며, 선천 면역계와 적응 면역계 모두에 관여한다. 선천 면역에서는 보체 단백질 C4b, C3b, iC3b 등이 옵소닌으로 작용하며, 적응 면역에서는 항체가 항원에 결합하여 Fc 수용체를 통해 탐식을 유도한다. 옵소닌은 세포자멸사 세포와 병원체를 표적으로 하며, 보체 활성화와 항체 의존성 세포 독성(ADCC)을 통해 면역 반응을 증진시킨다.
옵소닌은 표적(예: 세균)에 결합한 다음, 탐식 세포의 탐식 수용체에도 결합하여 표적의 탐식을 유도한다. 따라서 옵소닌은 표적과 탐식 세포 사이의 연결 분자 역할을 하여 이들을 접촉시키고, 일반적으로 탐식 수용체를 활성화하여 탐식 세포가 표적을 포획하도록 유도한다.[2]
옵소닌은 적응 면역계와 선천 면역계, 두 가지 유형의 면역계와 관련이 있다.
옵소닌은 탐식 세포의 탐식 수용체와 결합하여 표적(예: 세균)의 탐식을 유도하는 연결 분자 역할을 한다. 옵소닌은 탐식 수용체를 활성화하여 탐식 세포가 표적을 포획하도록 돕는다.[2]
2. 작동 기전
모든 세포막은 음전하(제타 전위)를 띠고 있어 두 세포가 서로 가까이 접근하기 어렵다. 옵소닌이 표적에 결합하면, 면역 세포의 옵소닌 및 세포 표면 수용체 간의 상호 작용을 촉진하여 탐식 작용의 역학을 향상시킨다.[6] 이는 세포막의 음전하를 무시하게 한다.
탐식이 표적의 소화 및 파괴로 이어지므로, 옵소닌이 건강하고 비병원성 세포에 탐식 꼬리표를 붙이지 않는 것이 중요하다. 따라서 일부 옵소닌(일부 보체 단백질 포함)은 병원체 표면에서만 발견되는 분자인 병원체 관련 분자 패턴에 결합하도록 진화하여, 이러한 병원체의 탐식을 가능하게 하고, 선천 면역을 유도한다. 항체는 병원체 표면의 항원에 결합하여 적응 면역을 가능하게 한다. 숙주 신체 세포를 옵소닌화하는 옵소닌(예: 사멸 세포를 옵소닌화하는 GAS6)은 죽거나, 죽어가는, 또는 스트레스를 받은 세포에 노출된 "먹으세요" 신호(예: 포스파티딜세린)에 결합한다.[2]
3. 옵소닌의 종류
항체는 B 세포에 의해 합성되어 특정 항원 항원 결정기를 인식하여 분비되며, 항원에 있는 특정 항원 결정기에만 결합한다.[5] 항체는 Fab 부위와 Fc 부위의 두 단편으로 구성된다.[5] IgG의 Fc 부위는 Fc 수용체 (FcR)에 의해 자연 살해 세포 및 기타 이펙터 세포에서 인식된다. 항체는 종양 세포 또는 바이러스에 감염된 세포에 표지를 붙일 수 있으며, NK 세포는 FcR을 통해 반응한다. 이 과정을 항체 의존성 세포 독성 (ADCC)이라고 한다.[5]
IgM과 IgG는 모두 항원에 결합하면 입체 구조 변화를 겪어 보체 단백질 C1q가 항체의 Fc 부위와 결합할 수 있다.[4] C1q 결합은 결국 보체 C4b 및 C3b의 모집으로 이어지며, 이들은 대부분의 포식 세포에 존재하는 CR1, CR3, CR4에 의해 인식된다.[4]
B 세포에서 처음 만들어지는 면역글로불린은 IgM이지만, 병원체와의 친화성은 낮은 경우가 많다. 대신 IgM은 IgG에 비해 보체 활성능이 크므로 보체계의 고전 경로를 사용하여 옵소닌화를 수행한다.
과거에 특정 병원체 감염이 있었을 경우, 이에 대해 친화성이 강한 항체인 IgG를 생성할 수 있다. 2차 감염에서는 IgG가 IgM보다 훨씬 많이 생성되며 수명도 길지만, IgG는 보체 활성화 능력이 IgM만큼 높지 않다.
3. 1. 선천 면역
보체계는 적응 면역 반응과 독립적으로, 적응 면역이 필요하기 전에 병원체를 옵소닌화할 수 있다.[4] 선천적 옵소닌화에 관여하는 보체 단백질에는 C4b, C3b 및 iC3b가 포함된다.[7] 보체 활성화의 대체 경로에서 순환하는 C3b는 그람 음성 세균의 지질다당류와 같은 특정 PAMP를 가진 항원에 직접 침착된다.[7] C3b는 식세포의 CR1에 의해 인식된다. iC3b는 세포사멸 세포 및 사체에 부착되어 식세포의 CR3 및 CR4와의 상호 작용을 통해 염증 경로를 시작하지 않고 죽은 세포 및 잔해물을 제거하는 것을 촉진한다.[4]
만노스 결합 렉틴, 또는 피콜린은 펜트락신 및 콜렉틴과 함께 세균, 곰팡이, 바이러스 및 기생충의 세포막에 발현되는 특정 유형의 탄수화물을 인식할 수 있으며, 보체계 및 식세포를 활성화하여 옵소닌으로 작용할 수 있다.[4][7]
3. 2. 적응 면역
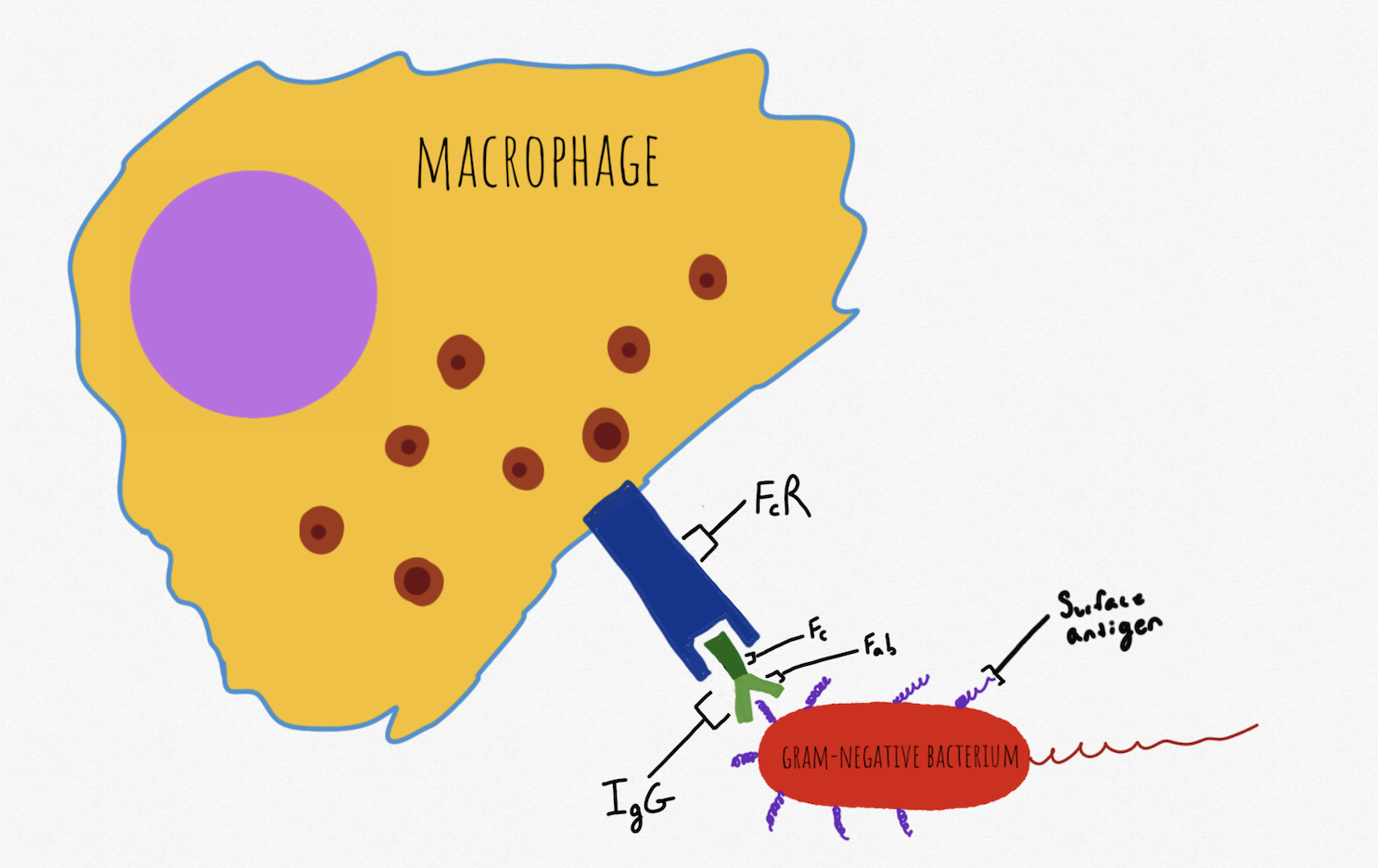
항체는 B 세포에 의해 합성되어 특정 항원 항원 결정기의 인식을 통해 분비되며, 항원에 있는 특정 항원 결정기(영역)에만 결합한다.[5] 항체는 적응 옵소닌화 경로를 구성하며, 항원 결합 부위 (Fab 부위)와 Fc 부위의 두 단편으로 구성된다.[5] Fab 부위는 세균 표면 단백질의 특정 부위와 같은 항원의 특정 항원 결정기에 결합할 수 있다.[5] IgG의 Fc 부위는 Fc 수용체 (FcR)에 의해 자연 살해 세포 및 기타 이펙터 세포에서 인식된다. IgG가 항원에 결합하면 FcR이 Fc 부위에 결합하여 용해성 생성물의 방출을 통해 병원체에 대한 공격을 시작할 수 있도록 입체 구조 변화가 발생한다.[5] 항체는 또한 종양 세포 또는 바이러스에 감염된 세포에 표지를 붙일 수 있으며, NK 세포는 FcR을 통해 반응한다. 이 과정을 항체 의존성 세포 독성 (ADCC)이라고 한다.[5]
IgM과 IgG는 모두 항원에 결합하면 입체 구조 변화를 겪어 보체 단백질 C1q가 항체의 Fc 부위와 결합할 수 있다.[4] C1q 결합은 결국 보체 C4b 및 C3b의 모집으로 이어지며, 이들은 대부분의 포식 세포에 존재하는 보체 수용체 1, 3, 4 (CR1, CR3, CR4)에 의해 인식된다.[4] 이러한 방식으로 보체계는 적응 면역 반응에 참여한다.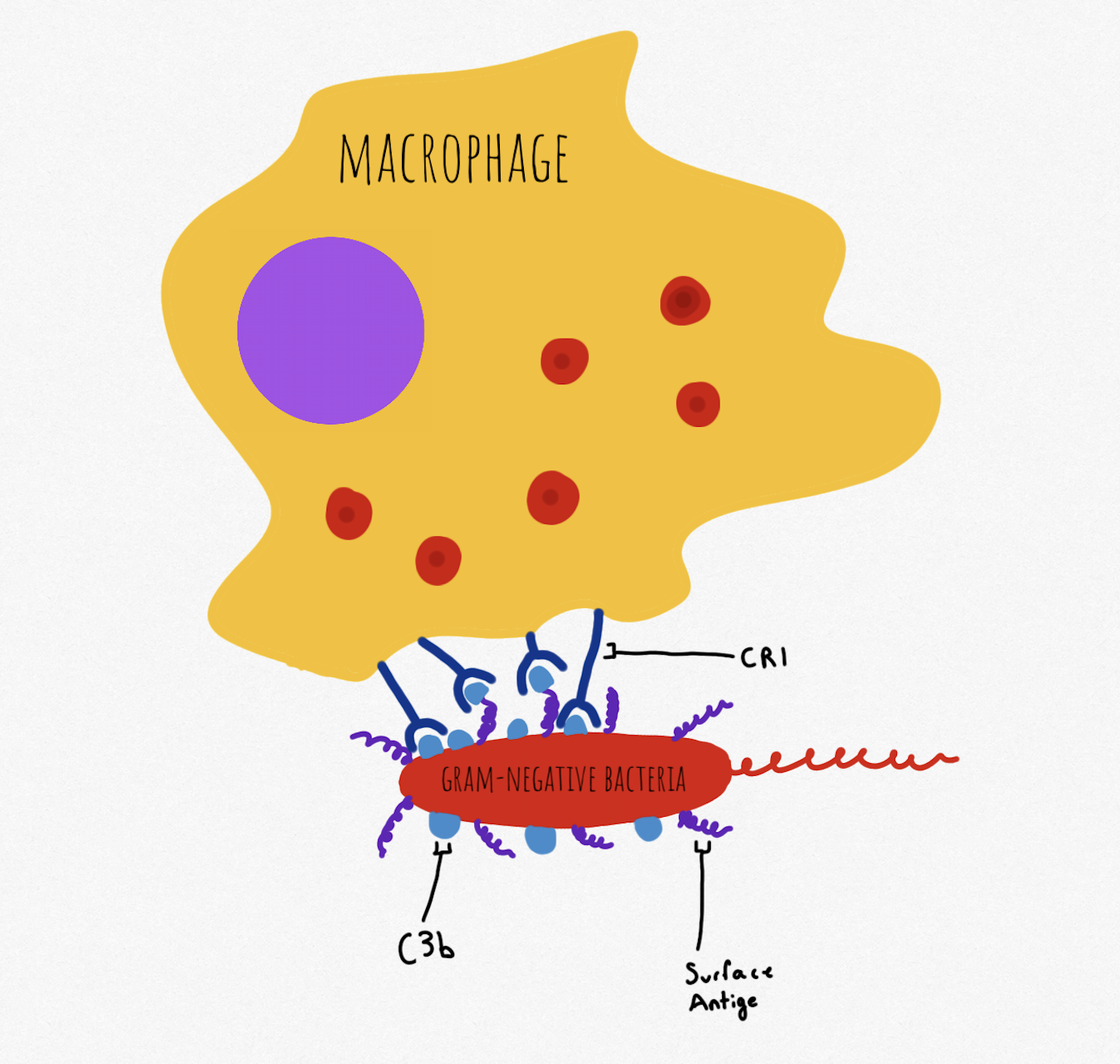
C3의 분해 생성물인 C3d는 병원체 관련 분자 패턴 (PAMP)을 인식하며 B 세포의 CR2 수용체에 분자를 옵소닌화할 수 있다.[4] 이는 B 세포 수용체를 통해 B 세포 활성화에 필요한 상호 작용의 임계값을 낮추고, 적응 반응의 활성화를 돕는다.[4]
4. 표적
4. 1. 세포자멸사 세포
모든 세포막은 음전하(제타 전위)를 띠고 있어 세포끼리 서로 가까이 접근하기 어렵다. 옵소닌이 표적에 결합하면, 면역 세포의 옵소닌 및 세포 표면 수용체 간의 상호 작용을 촉진하여 탐식 작용을 돕는다.[6]
여러 옵소닌은 염증 반응 없이 탐식을 위해 세포자멸사 세포를 표시하는 역할을 한다.[8] 펜트락신 계열 구성원은 포스파티딜콜린 및 포스파티딜에탄올아민과 같은 세포자멸사 세포 막 구성요소에 결합할 수 있다. IgM 항체 또한 포스파티딜콜린에 결합한다. 콜렉틴 분자 (예: 만노스 결합 렉틴, 계면활성 단백질 A, SP-D)는 세포자멸사 세포 막의 알려지지 않은 리간드와 상호 작용한다. 적절한 리간드에 결합되면 이러한 분자는 탐식 세포 수용체와 상호 작용하여 표시된 세포의 탐식을 향상시킨다.[6]
C1q는 세포자멸사 세포에 직접 결합할 수 있다. 또한 IgM 자가항체, 만노스 결합 렉틴, 펜트락신과 같은 매개체를 통해 간접적으로 세포자멸사 세포에 결합할 수 있다. 두 경우 모두 C1q는 보체를 활성화시켜 세포가 C3b 및 C4b에 의해 탐식되도록 표시된다. C1q는 세포자멸사 세포와 잔해 제거에 중요한 기여를 한다. 이 과정은 일반적으로 후기 세포자멸사 세포에서 발생한다.[6]
세포자멸사 세포의 옵소닌화는 조직 의존적 패턴으로 다른 메커니즘에 의해 발생한다. 예를 들어, C1q는 복강 내에서 적절한 세포자멸사 세포 제거에 필요하지만, SP-D가 중요한 역할을 하는 폐에서는 중요하지 않다.[6]
4. 2. 병원체
모든 세포막은 음전하(제타 전위)를 띠고 있어 서로 가까이 접근하기 어렵다. 옵소닌이 표적에 결합하면, 면역 세포의 옵소닌 및 세포 표면 수용체 간의 상호 작용을 촉진하여 탐식 작용을 향상시킨다.[6] 이는 세포막의 음전하를 무시하게 한다.
탐식은 표적의 소화 및 파괴로 이어지므로, 옵소닌이 건강한 세포에 탐식 꼬리표를 붙이지 않는 것이 중요하다. 따라서 일부 옵소닌은 병원체 표면에서만 발견되는 병원체 관련 분자 패턴에 결합하여, 병원체의 탐식을 유도하고 선천성 면역을 일으킨다. 항체는 병원체 표면의 항원에 결합하여 적응 면역을 가능하게 한다. 숙주 세포를 옵소닌화하는 옵소닌(예: 사멸 세포를 옵소닌화하는 GAS6)은 죽거나, 죽어가는 세포에 노출된 "먹으세요" 신호(예: 포스파티딜세린)에 결합한다.[2]
항체는 B 세포에서 합성되어 특정 항원 항원 결정기를 인식하여 분비되며, 항원의 특정 항원 결정기에만 결합한다.[5] 항체는 항원 결합 부위 (Fab 부위)와 Fc 부위로 구성된다.[5] Fab 부위는 세균 표면 단백질의 특정 부위와 같은 항원의 특정 항원 결정기에 결합한다.[5] IgG의 Fc 부위는 FcR에 의해 자연 살해 세포 및 기타 이펙터 세포에서 인식된다. IgG가 항원에 결합하면 FcR이 Fc 부위에 결합하여 입체 구조 변화가 발생하고, 용해성 생성물을 방출하여 병원체를 공격한다.[5] 항체는 종양 세포나 바이러스 감염 세포에 표지를 붙일 수 있으며, NK 세포는 FcR을 통해 반응한다. 이 과정을 항체 의존성 세포 독성 (ADCC)이라고 한다.[5]
IgM과 IgG는 모두 항원에 결합하면 입체 구조 변화를 겪어 보체 단백질 C1q가 항체의 Fc 부위에 결합할 수 있다.[4] C1q 결합은 보체 C4b 및 C3b의 모집으로 이어지며, 이들은 대부분의 포식 세포에 존재하는 CR1, CR3, CR4에 의해 인식된다.[4] 이러한 방식으로 보체계는 적응 면역 반응에 참여한다.
C3의 분해 생성물인 C3d는 PAMP를 인식하며 B 세포의 CR2 수용체에 분자를 옵소닌화할 수 있다.[4] 이는 B 세포 수용체를 통해 B 세포 활성화에 필요한 상호 작용의 임계값을 낮추고, 적응 반응의 활성화를 돕는다.[4] 보체계는 적응 면역 반응과 독립적으로, 적응 면역이 필요하기 전에 병원체를 옵소닌화할 수 있다.[4] 선천적 옵소닌화에 관여하는 보체 단백질에는 C4b, C3b 및 iC3b가 포함된다.[7] 보체 활성화의 대체 경로에서 순환하는 C3b는 그람 음성 세균의 지질다당류와 같은 특정 PAMP를 가진 항원에 직접 침착된다.[7] C3b는 식세포의 CR1에 의해 인식된다. iC3b는 세포사멸 세포 및 사체에 부착되어 식세포의 CR3 및 CR4와의 상호 작용을 통해 염증 경로를 시작하지 않고 죽은 세포 및 잔해물을 제거한다.[4]
만노스 결합 렉틴, 피콜린은 펜트락신 및 콜렉틴과 함께 세균, 곰팡이, 바이러스, 기생충의 세포막에 발현되는 특정 유형의 탄수화물을 인식하며, 보체계 및 식세포를 활성화하여 옵소닌으로 작용한다.[4][7] 후기 적응 면역 반응의 일환으로, 병원체 및 기타 입자는 IgG 항체에 의해 표시된다. 이러한 항체는 대식세포 및 호중구의 Fc 수용체와 상호 작용하여 식세포 작용을 일으킨다.[9] C1 보체 복합체는 IgG 및 IgM 면역 복합체의 Fc 부위와 상호 작용하여 고전적 보체 경로를 활성화하고 항원에 C3b를 표시할 수도 있다. C3b는 대안적 보체 경로를 통해 병원체 표면에 자발적으로 결합할 수 있다. 또한, 펜탁신은 C1 복합체의 C1q에 직접 결합할 수 있다.[10]
B 세포 분화에서 처음 만들어지는 면역글로불린은 IgM이지만, IgM은 체세포 과돌연변이와 친화성 성숙 전에 생산되므로 병원체와의 친화성은 낮은 경우가 많다. 대신 IgM은 IgG에 비해 보체 활성능이 크므로 보체계의 고전 경로를 사용하여 옵소닌화를 수행한다. 먼저, IgM이 병원체에 결합하면 평판 형태에서 호치키스 모양으로 입체 구조를 바꾸므로, C1 복합체가 IgM에 결합할 수 있게 된다. C1 복합체는 C2를 절단하여 생기는 C2b 등에 의해 C3b를 생성하고, 이것이 병원체에 결합한다. C3b는 대식세포 등의 식세포에 있는 CR1이라는 보체 수용체에 의해 인식되지만, 동시에 C2b에 의해 C5로부터 만들어지는 C5a에 의해 식세포가 활성화되어 식작용이 유도된다.
세포내 기생균인 결핵균은 C2b를 포획하고, C3을 분해하여 보체를 활성화함으로써 대식세포에 섭취되려고 한다. 과거 특정 병원체 감염이 있었을 경우, 이에 대해 친화성이 강한 항체인 IgG를 생성할 수 있다. 2차 감염에서는 IgG가 IgM보다 많이 생성되며 수명도 길다. IgG는 보체 활성화 능력이 IgM만큼 높지 않지만, 병원체와의 친화성이 강하고, 충분한 양의 IgG가 결합할 수 있으므로 식세포는 FcγR (IgG의 Fc 영역에 대한 수용체)을 통해 병원체를 인식하고 탐식한다.
5. 보체에 의한 옵소닌화 (일본어 문서 번역)
B 세포 분화에서 처음 만들어지는 면역글로불린은 IgM이지만, IgM은 체세포 과돌연변이와 친화성 성숙이 일어나기 전에 생산되므로 병원체와의 친화성은 낮은 경우가 많다. 그 대신, IgM은 IgG에 비해 보체 활성능이 크므로 보체계의 고전 경로를 사용하여 옵소닌화를 수행하는 것이 가능하다. 먼저, IgM이 병원체에 결합하면 평판 형태에서 호치키스 모양으로 입체 구조를 바꾸므로, C1 복합체가 IgM에 결합할 수 있게 된다. 이후 C1 복합체는 C2를 절단하여 생기는 C2b (←C2의 분해 산물 중 분자량이 큰 쪽. 역사적인 이름으로는 C2a) 등에 의해 C3b를 생성하고, 이것이 병원체에 결합한다. C3b는 대식세포 등의 식세포에 있는 CR1이라는 보체 수용체에 의해 인식되지만, 동시에 C2b에 의해 C5로부터 만들어지는 C5a에 의해 식세포가 활성화되어 식작용이 유도된다.[1]
세포내 기생균인 결핵균은 C2b를 포획하고, 이것을 이용하여 C3을 분해함으로써 보체를 활성화하여 적극적으로 대식세포에 섭취되려고 한다.[1]
6. 항체에 의한 옵소닌화 (일본어 문서 번역)
항체는 B 세포에 의해 합성되어 특정 항원 항원 결정기의 인식을 통해 분비되며, 항원에 있는 특정 항원 결정기(영역)에만 결합한다.[5] 항체는 적응 옵소닌화 경로를 구성하며, 항원 결합 부위(Fab 부위)와 Fc 부위 두 개의 단편으로 구성된다.[5] Fab 부위는 세균 표면 단백질의 특정 부위와 같은 항원의 특정 항원 결정기에 결합할 수 있다.[5] IgG의 Fc 부위는 Fc 수용체(FcR)에 의해 자연 살해 세포 및 기타 이펙터 세포에서 인식된다. IgG가 항원에 결합하면 FcR이 Fc 부위에 결합하여 용해성 생성물의 방출을 통해 병원체에 대한 공격을 시작할 수 있도록 입체 구조 변화가 발생한다.[5] 항체는 또한 종양 세포 또는 바이러스에 감염된 세포에 표지를 붙일 수 있으며, NK 세포는 FcR을 통해 반응한다. 이 과정을 항체 의존성 세포 독성(ADCC)이라고 한다.[5]
IgM과 IgG는 모두 항원에 결합하면 입체 구조 변화를 겪어 보체 단백질 C1q가 항체의 Fc 부위와 결합할 수 있다.[4] C1q 결합은 결국 보체 C4b 및 C3b의 모집으로 이어지며, 이들은 대부분의 포식 세포에 존재하는 보체 수용체 1, 3, 4 (CR1, CR3, CR4)에 의해 인식된다.[4] 이러한 방식으로 보체계는 적응 면역 반응에 참여한다.
C3의 분해 생성물인 C3d는 병원체 관련 분자 패턴 (PAMP)을 인식하며 B 세포의 CR2 수용체에 분자를 옵소닌화할 수 있다.[4] 이는 B 세포 수용체를 통해 B 세포 활성화에 필요한 상호 작용의 임계값을 낮추고, 적응 반응의 활성화를 돕는다.[4]
과거에 특정 병원체 감염이 있었을 경우, 이에 대해 친화성이 강한 항체인 IgG를 생성할 수 있다. 또한 2차 감염에서는 IgG가 IgM보다 훨씬 많이 생성되며 수명도 길다. 하지만 IgG는 보체 활성화 능력이 IgM만큼 높지 않다. 다만, 병원체와의 친화성이 강하고, 병원체에 충분한 양의 IgG가 결합할 수 있으므로 식세포는 FcγR (IgG의 Fc 영역에 대한 수용체)을 통해 병원체를 인식하고 탐식한다.
참조
[1]
서적
Kuby immunology
https://www.worldcat[...]
2019
[2]
논문
The Phagocytic Code Regulating Phagocytosis of Mammalian Cells
2021
[3]
논문
An experimental investigation of the rôle of the blood fluids in connection with phagocytosis. 1903
https://royalsociety[...]
1989-09
[4]
논문
Complement System Part II: Role in Immunity
2015
[5]
논문
Antibody Structure and Function: The Basis for Engineering Therapeutics
2019-12
[6]
논문
Mini-review: A pivotal role for innate immunity in the clearance of apoptotic cells
2004-04
[7]
논문
Complement: a key system for immune surveillance and homeostasis
2010-09
[8]
논문
Review: Soluble innate immune pattern-recognition proteins for clearing dying cells and cellular components: implications on exacerbating or resolving inflammation
2010-06
[9]
논문
Coordination of Fc receptor signaling regulates cellular commitment to phagocytosis
2010-11
[10]
논문
The complement system
2011-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com