폴리페놀 산화효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
폴리페놀 산화효소는 식물 조직 손상 시 엽록체와 액포 파열로 방출되는 효소로, 카테콜 산화효소 등을 포함한다. 이 효소는 오르토-퀴논을 생성하여 멜라닌을 형성, 상처 부위에 불용성 장벽을 만들어 병원균 침입을 막는 역할을 한다. 카테콜 산화효소는 핵에서 암호화되어 엽록체 틸라코이드 루멘으로 이동하며, 단백질 분해 과정을 거쳐 활성화된다. 효소는 구리 이온을 포함하는 활성 부위를 가지며, 과일 및 채소의 갈변 현상에 관여하여 산업적, 경제적으로 중요한 영향을 미친다. 이러한 갈변 현상을 억제하기 위해 pH 조절 등의 방법이 사용되며, 인공 효소 연구를 통해 효소 모방체 개발도 진행되고 있다.
더 읽어볼만한 페이지
- EC 1.14.18 - 티로시네이스
티로시네이스는 산소 분자를 사용하여 페놀 화합물을 산화시키는 효소로, 멜라닌 생성, 상처 치유 등 생물학적 기능에 관여하며, 식품 및 화장품 산업에서 억제제 연구가 활발히 진행되고 유전자 돌연변이는 유전 질환을 유발할 수 있다. - EC 1.10.3 - 광계 II
광계 II는 남세균과 녹색 식물에서 발견되는 단백질 복합체로, 광합성 명반응에서 빛 에너지를 이용해 물을 분해하고 산소를 발생시키며, D1, D2 단백질 이종이량체를 핵심 구조로 엽록소, 카로틴, 헴 등의 보조 인자를 포함하고, 물 분해 반응의 핵심 장소인 산소 발생 복합체에 대한 연구가 활발히 진행되고 있다. - EC 1.10.3 - 대체 산화효소
대체 산화 효소는 유비퀴논 풀에서 시토크롬 연결 전자전달계로부터 분기되는 대사 경로에 관여하는 효소로, ATP 생산 효율이 낮고 식물 스트레스 반응, 일부 균류의 살균제 내성 유발, 트리파노소마 브루세이 생존 필수 기능 등으로 연구된다. - 구리 효소 - ATP가수분해효소
ATP가수분해효소는 아데노신 삼인산을 아데노신 이인산과 무기 인산으로 분해하여 에너지를 방출하고, 이 에너지는 근수축, 세포 내 물질 수송, 이온 농도 기울기 생성과 같은 생체 내 작용에 사용되며, 워커 모티프를 특징으로 하는 ATP 합성 효소, P형 ATP가수분해효소, ABC ATP가수분해효소 등이 있다. - 구리 효소 - 사이토크롬 c 산화효소
사이토크롬 c 산화효소는 미토콘드리아 내막에 위치하며, 복합체 III에서 전자를 받아 산소를 물로 환원하는 효소이다.
2. 생물학적 기능
폴리페놀 산화효소는 티로시나아제와 카테콜 산화효소를 포함하는 2구리 금속효소의 일종이다.[4] 식물에서 두 효소 모두 오르토-디페놀 기질을 해당 오르토-퀴논으로 산화시킬 수 있다. 티로시나아제는 모노페놀을 디페놀로 수산화시키는 것(모노페놀라아제 활성)뿐만 아니라 o-디페놀을 o-퀴논으로 산화시키는 것(디페놀라아제 활성)도 촉매할 수 있지만, 카테콜 산화효소는 디페놀라아제 활성만 가지고 있다는 점이 두 효소의 주요 차이점이다.[5] 카테콜 산화효소는 식물의 상처 치유 및 방어 기작에 중요한 역할을 한다.
2. 1. 식물 조직 손상과 효소 활성화
식물 조직이 손상되면 엽록체와 액포가 파열되면서 카테콜 산화효소와 기질인 카테콜이 세포질로 방출된다.[6] 조직 손상으로 인해 산소가 세포 내부로 유입되면 카테콜 산화효소가 기질과 반응하여 o-벤조퀴논을 생성하며, 이는 비효소적으로 중합되어 상처 부위에 불용성 장벽을 형성하는 멜라닌을 생성한다.[6]3. 단백질 분해 과정
카테콜 산화효소는 핵에서 프로-효소 형태로 전사된 후, 틸라코이드 루멘으로 이동하기 전에 두 번의 단백질 분해 처리와 수송 과정을 거친다. 좀머(Sommer) 등은 완두, 토마토, 옥수수 등 다양한 식물에서 이러한 단백질 분해 처리 경로를 밝혀냈다.[8] 이 과정에서 67 kDa의 전구체는 스트로마로 ATP 의존적인 방식으로 수입되어 스트로마 펩티다아제에 의해 62 kDa의 중간체로 처리된다. 이후 빛에 의존하여 틸라코이드 루멘으로 이동, 성숙한 59 kDa의 효소가 된다.[9] 이 과정에서 N-말단 수송 펩타이드와 효소 활성 부위를 덮는 C-말단 도메인이 제거된다.[10]
3. 1. 전구체 생성 및 스트로마 이동
카테콜 산화효소는 핵에서 암호화되며, N-말단에는 단백질을 엽록체 틸라코이드 루멘으로 안내하는 신호 펩타이드가 포함되어 있다.[7] 카테콜 산화효소 전구체는 처음에는 프로-효소로 전사된 후 틸라코이드 루멘에 들어가기 전에 두 번의 단백질 분해 처리와 수송 과정을 거친다.Sommer 등은 35S 메티오닌으로 표지된 전구체 단백질을 사용하여 완두(''Pisum sativum''), 토마토(''Lycopersicon esculentum''), 옥수수(''Zea mays'')를 포함한 다양한 식물에서 공통적으로 나타나는 단백질 분해 처리 경로를 밝혀냈다.[8] 67 kD의 전구체는 스트로마로 ATP 의존적인 방식으로 수입되었으며, 여기서 스트로마 펩티다아제가 전구체를 62 kD의 중간체로 처리한다. 이 중간체의 틸라코이드 루멘으로의 이동은 빛에 의존적이며, 성숙한 59 kD 효소가 생성된다.[9] ''Ipomoea batatas''에서 정제된 전구체 및 성숙한 카테콜 산화효소의 분석을 기반으로, 단백질 분해 처리는 N-말단 수송 펩타이드뿐만 아니라 효소 활성 부위를 덮는 C-말단 도메인도 제거한다.[10]
3. 2. 틸라코이드 루멘 이동 및 성숙
카테콜 산화효소 전구체는 처음에는 프로-효소로 전사된 후 틸라코이드 루멘에 들어가기 전에 두 번의 단백질 분해 처리와 수송 과정을 거친다.[7]Sommer 등은 [35S] 메티오닌으로 표지된 전구체 단백질을 사용하여 완두(''Pisum sativum''), 토마토(''Lycopersicon esculentum''), 옥수수(''Zea mays'')를 포함한 다양한 식물에서 공통적으로 나타나는 단백질 분해 처리 경로를 밝혀냈다.[8] 67 kD의 전구체는 스트로마로 ATP 의존적인 방식으로 수입되었으며, 여기서 스트로마 펩티다아제가 전구체를 62 kD의 중간체로 처리한다. 이 중간체의 틸라코이드 루멘으로의 이동은 빛에 의존적이며, 성숙한 59 kD 효소가 생성된다.[9] ''Ipomoea batatas''에서 정제된 전구체 및 성숙한 카테콜 산화효소의 분석을 기반으로, 단백질 분해 처리는 N-말단 수송 펩타이드뿐만 아니라 효소 활성 부위를 덮는 C-말단 도메인도 제거한다.[10]
4. 효소 구조
카테콜 산화효소는 구형의 단일 도메인 단량체 효소이다. Ipomoea batatas(고구마)에서 정제된 카테콜 산화효소의 결정 구조는 산화 및 환원된 상태 모두에서 활성 형태로 분석되었다.[11]
4. 1. 활성 부위 구조
''Ipomoea batatas''(고구마)에서 정제된 카테콜 산화효소의 결정 구조는 산화된 Cu(II)-Cu(II) 상태와 환원된 Cu(I)-Cu(I) 상태 모두에서 활성 형태로 분석되었다.[11] 이 효소는 약 55 x 45 x 45 Å 크기의 타원형 모양을 가진 구형의 단일 도메인 단량체 효소이다. 4개의 α-나선 묶음은 이구리 중심을 포함하는 활성 부위를 감싸는 효소 코어를 구성한다.[12] His88, His109, His118의 이미다졸 측쇄에 있는 질소는 첫 번째 촉매 구리와 결합하는 반면, His240, His244 및 His274의 이미다졸 측쇄에 있는 질소는 두 번째 촉매 구리 이온과 결합한다. 산화된 Cu(II)-Cu(II) 상태에서 각 구리 이온은 사면체 삼각 피라미드 기하학을 가지며, 3개의 히스티딘 잔기와 가교 수산화물 분자가 각 구리 이온에 4개의 리간드를 형성한다. 효소의 환원된 (Cu(I)-Cu(I)) 상태와 네이티브 (Cu(II)-Cu(II)) 상태를 비교하면, 핵심적인 차이점은 두 구리 중심 사이의 거리이다. 산화된 Cu(II)-Cu(II) 상태에서 Cu-Cu 거리는 3.3Å인 반면, 환원된 Cu(I)-Cu(I)) 상태에서는 거리가 4.4Å로 증가한다.[1]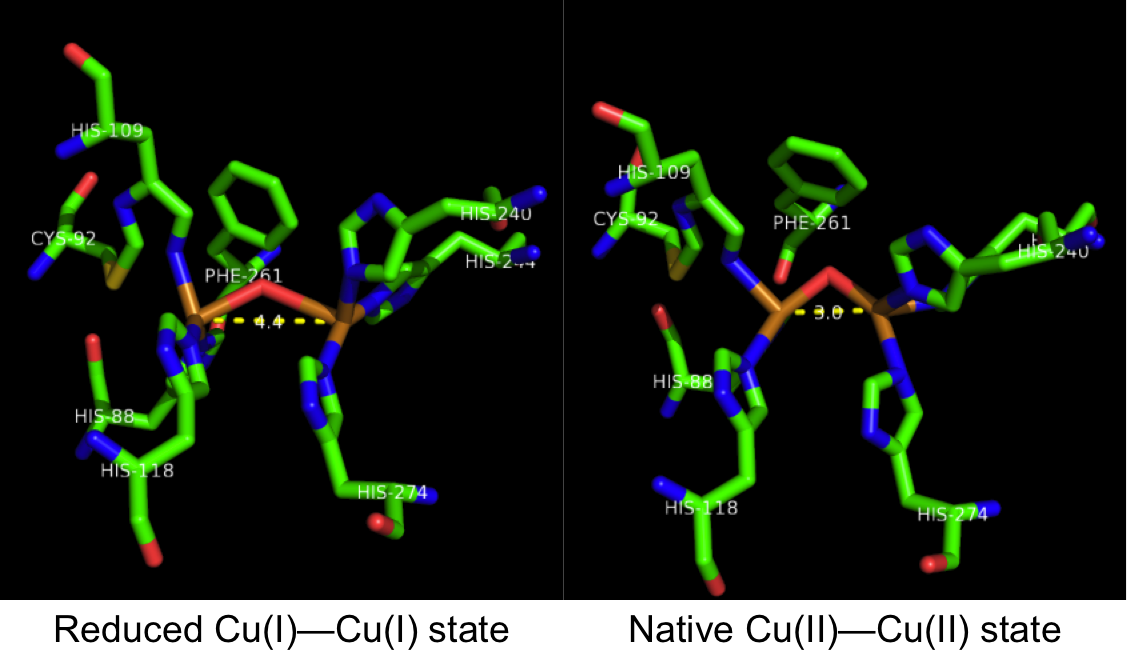
티로시나아제와 카테콜 산화효소의 활성 부위 모두 이구리 중심을 포함하지만, 각 효소의 구조적 차이로 인해 활성에도 차이가 발생한다. 카테콜 산화효소의 경우, 페닐알라닌 측쇄(Phe261)가 구리 중심 중 하나 위에 위치하여 기질이 활성 부위의 두 구리 이온과 결합하는 것을 방지한다. 이는 티로시나아제의 특징이지만 카테콜 산화효소에서는 나타나지 않는, 이페놀레이트 수산화 반응에 필요한 2좌 배위 착물을 배제한다.[13] 또한, 구리 중심 중 하나에 결합된 His109는 티오에테르 브리지를 통해 Cys192와 공유 결합을 이루고 있다.[14] 이 시스테인-히스티딘 가교는 티로시나제에서 쉽게 형성되는 2좌 배위 착물을 효소 활성 부위가 취하는 것을 더욱 제한할 수 있다.
4. 2. 티로시나아제와의 차이점
티로시나아제와 카테콜 산화효소는 활성 부위에 이구리 중심을 포함하지만, 구조적 차이로 인해 활성에 차이가 있다. 카테콜 산화효소는 페닐알라닌 측쇄(Phe261)가 구리 중심 중 하나 위에 위치하여 기질이 활성 부위의 두 구리 이온과 결합하는 것을 막는다. 이는 티로시나제에는 있지만 카테콜 산화효소에는 없는 특징으로, 이페놀레이트 수산화 반응에 필요한 2좌 배위 착물 형성을 방해한다.[13] 또한, 구리 중심 중 하나에 결합된 His109는 티오에테르 다리를 통해 Cys192와 공유 결합을 형성한다.[14] 이 시스테인-히스티딘 가교는 티로시나제에서 쉽게 형성되는 2좌 배위 착물을 효소 활성 부위가 취하는 것을 더욱 제한한다.
5. 촉매 순환 및 메커니즘
카테콜 산화효소의 결정 구조는 밝혀졌지만, 반응의 정확한 메커니즘에 대해서는 여러 가설이 제기되고 있다. Eicken 등이 제안한 메커니즘 외에도 DFT 계산 및 결정 구조를 통해 밝혀진 다른 촉매 사이클이 존재한다. 이들은 사이클 전체에서 활성 부위의 전하를 동일하게 유지하여 근처 염기를 필요로 하지 않는다는 장점이 있다.[15][16] 그러나 이러한 메커니즘들은 산소가 없을 때 카테콜 첨가 후 화학량론적 양의 o-퀴논이 형성된다는 실험적 결과와 일치하지 않는다.[16]
5. 1. Eicken 등의 제안 메커니즘
카테콜 산화효소의 결정 구조는 밝혀졌지만, 반응의 정확한 메커니즘에 대한 의문은 여전히 남아있다. Eicken 등은 ''Ipomoea batatas''에서 정제된 카테콜 산화효소의 결정 구조를 기반으로 메커니즘을 제안했다.[11] 촉매 사이클은 두 구리 중심을 가교하는 배위된 수산화 이온을 가진 카테콜 산화효소가 네이티브 산화된 Cu(II)-Cu(II) 상태에서 시작된다. 카테콜이 활성 부위로 들어가면서, 하나의 알코올에서 양성자가 추출된다. 카테콜은 단좌 방식으로 Cu(II) 중심과 배위되어 배위된 히스티딘 잔기 중 하나를 대체한다. 배위된 수산화 이온은 카테콜에서 다른 양성자를 추출하여 물을 형성하고, 카테콜은 o-퀴논으로 산화된다. 두 개의 결과적인 전자는 두 구리 중심을 Cu(I)-Cu(I) 상태로 환원시킨다. 그런 다음 이산소는 하나의 구리 중심에 결합하여 배위된 물 분자를 대체하고, 다른 카테콜 분자는 다른 구리 중심에 결합하여 다른 히스티딘 잔기를 대체한다. 이것은 하나의 구리 중심이 His240, His244 및 이산소 분자로 사각 평면 배위를 갖는 복합체를 형성한다. 다른 구리 중심은 적도 위치에 이산소, His88 및 His118, 축 위치에 His109를 유지하면서 초기 사각 피라미드 기하학을 유지한다.[3] 이 상태에서 효소 활성 부위는 삼원 카테콜 산화효소–O22−–카테콜 복합체에 있다. 두 개의 전자가 기질에서 이산소로 전달된 다음 O–O 결합이 절단된다. 물이 방출되고, 두 번째 o-퀴논 생성물이 초기 Cu(II)-Cu(II) 상태를 복원하여 촉매 사이클을 완료한다.[15]
이 제안된 촉매 사이클은 산소가 없을 때에도 효소에 카테콜을 첨가한 후 화학량론적 양의 o-퀴논이 형성된다는 실험적 관찰에 의해 뒷받침된다.[15] 또한 산화된 Cu(II)-Cu(II) 상태와 환원된 Cu(I)-Cu(I) 상태 모두 ''Ipomoea batatas''의 결정 구조에 의해 확인된 두 가지 상태였다. 카테콜의 구리 중심에 대한 단좌 결합은 구리 중심에도 단좌 방식으로 결합하는 기질 유사체인 반응 억제제 페닐티오카르바미드와 결합된 카테콜 산화효소의 결정 구조에 의해 뒷받침되었다.[11] 그러나 이 촉매 사이클의 한 가지 문제는 활성 부위의 전하가 촉매 사이클 동안 +1에서 +3으로 변경된다는 것이다. 이는 양성자를 저장할 수 있는 근처 염기의 존재를 필요로 하지만, X선 결정 구조는 히스티딘 잔기가 구리 중심과 배위되어 있기 때문에 그러한 염기의 존재를 나타내지 않는다.[16] DFT 계산 및 결정 구조로 밝혀진 다른 촉매 사이클은 사이클 전체에서 동일한 활성 부위의 전하를 유지하므로 근처 염기를 필요로 하지 않는다.[15][16] 그러나 제안된 사이클의 특정 중간체는 산소가 없을 때 카테콜 첨가 후 화학량론적 양의 o-퀴논이 형성될 수 있다는 실험적 결과와 일치하지 않는다.[16]
5. 2. 논란 및 다른 제안
Eicken 등이 제안한 카테콜 산화효소의 촉매 사이클은 ''Ipomoea batatas'' (고구마)에서 정제된 효소의 결정 구조를 기반으로 한다.[11] 이 사이클은 활성 부위의 전하가 +1에서 +3으로 변한다는 문제점이 있다. 이는 양성자를 저장할 수 있는 근처 염기의 존재를 필요로 하지만, X선 결정 구조에서는 구리 중심과 배위된 히스티딘 잔기 외에 다른 염기의 존재가 나타나지 않는다.[16]이러한 문제점을 해결하기 위해 DFT 계산 등을 통해 다른 촉매 순환 메커니즘이 제안되었다.[15][16] 이 메커니즘들은 활성 부위의 전하를 일정하게 유지하여 근처 염기를 필요로 하지 않는다. 그러나 이 메커니즘들은 산소가 없을 때 카테콜을 첨가하면 화학량론적 양의 o-퀴논이 형성된다는 실험적 결과와는 일치하지 않는다.[16]
6. 경제 및 산업적 중요성
카테콜 산화효소는 과일과 채소가 숙성, 취급, 가공 과정에서 갈변하는 주된 원인이다.[17] 효소적 갈변은 과일 및 농산물의 영양 품질과 외관에 영향을 미치며, 과일 손실의 절반 이상이 효소적 갈변으로 인해 발생하는 것으로 추정된다.[6]
6. 1. 효소적 갈변과 품질 저하
페놀 기질이 해당 퀴논으로 산화되는 것은 과일과 채소가 숙성, 취급, 가공 과정에서 갈변하는 주된 원인이다.[17] 효소적 갈변은 과일 및 농산물의 영양 품질과 외관에 영향을 미쳐, 과일 손실의 절반 이상이 효소적 갈변으로 인해 발생하는 것으로 추정되며, 열대 과일이 이 반응에 특히 취약하다.[6] 영양소 손실은 산화에 의해 생성된 퀴논이 식물 단백질에서 유래된 필수 아미노산의 측쇄와 상호 작용하여 발생할 수 있는데, 특히 아미노산 측쇄의 티올 및 아민 작용기는 퀴논 결합 및 알킬화에 매우 취약하다.[18] 효소적 갈변에서 카테콜 산화효소의 핵심 역할로 인해 억제의 일반적인 대상이 되며, 카테콜 산화효소의 촉매 활성을 제거하기 위한 고온 처리(70-90 °C)와 같은 여러 억제 전략이 존재한다.[6] 널리 사용되는 전략은 구연산으로 pH를 낮추는 것으로, 카테콜 산화효소는 히스티딘 잔기가 촉매 구리 중심에 배위되기 때문에 pH 4-8 범위에서 더 촉매 활성이 높다. 구연산과 같은 산을 사용하여 이 최적 범위 미만으로 pH를 낮추면 히스티딘 잔기의 양성자화가 구리 중심과 배위하는 능력을 방해하기 때문에 효소가 활성 부위 구리에 결합하는 것이 감소한다.[19]6. 2. 억제 방법
페놀 기질이 퀴논으로 산화되는 것은 과일과 채소가 숙성, 취급, 가공 과정에서 갈변하는 주된 원인이다.[17] 효소적 갈변은 과일 및 농산물의 영양 품질과 외관에 영향을 미치는데, 과일 손실의 절반 이상이 효소적 갈변으로 인해 발생하는 것으로 추정되며, 열대 과일이 이 반응에 특히 취약하다.[6] 영양소 손실은 산화로 생성된 퀴논이 식물 단백질에서 유래된 필수 아미노산의 측쇄와 상호작용하여 발생할 수 있다. 특히 아미노산 측쇄의 티올 및 아민 작용기는 퀴논 결합 및 알킬화에 매우 취약하다.[18] 효소적 갈변에서 카테콜 산화효소의 핵심 역할 때문에 억제 대상이 된다. 카테콜 산화효소의 촉매 활성을 제거하기 위한 고온 처리(70~90°C)와 같은 여러 억제 전략이 존재하지만,[6] 널리 사용되는 전략은 구연산으로 pH를 낮추는 것이다. 카테콜 산화효소는 히스티딘 잔기가 촉매 구리 중심에 배위되기 때문에 pH 4~8 범위에서 더 촉매 활성이 높다. 구연산과 같은 산을 사용하여 이 최적 범위 미만으로 pH를 낮추면 히스티딘 잔기의 양성자화가 구리 중심과 배위하는 능력을 방해하기 때문에 효소가 활성 부위 구리에 결합하는 것이 감소한다.[19]7. 인공 효소
인공 효소 설계의 새로운 접근 방식은 아미노산 또는 펩타이드를 특징적인 분자 잔기로 사용하며, 이는 인공 효소 또는 효소 모방 분야를 크게 확장시켰다. Rob Liskamp 그룹의 최근 연구에 따르면, 스캐폴드된 히스티딘 잔기를 특정 금속 단백질 및 효소의 모방체로 사용할 수 있음이 밝혀졌다. 특히, type-3 구리 결합 부위를 포함하는 구리 단백질 (예: 헤모시아닌, 타이로시네이스) 및 카테콜 산화효소)의 구조적 모방이 입증되었다. 이는 스캐폴드된 히스티딘 잔기의 사용이 생물학적으로 관련된 종에 의한 효소 모방에 한 걸음 더 가까워졌다는 점에서 상당한 발전이다.[20]
7. 1. 히스티딘 잔기 활용
인공 효소를 설계하는 새로운 접근 방식은 아미노산 또는 펩타이드를 특징적인 분자 잔기로 사용하며, 이는 인공 효소 또는 효소 모방 분야를 크게 확장시켰다. Rob Liskamp 그룹의 최근 연구 결과에 따르면, 스캐폴드된 히스티딘 잔기는 특정 금속 단백질 및 효소의 모방체로 사용될 수 있다. type-3 구리 결합 부위를 포함하는 구리 단백질 (예: 헤모시아닌, 타이로시네이스, 카테콜 산화효소)의 구조적 모방이 입증되었다. 이는 스캐폴드된 히스티딘 잔기의 사용이 생물학적으로 관련된 종에 의한 효소 모방에 한 걸음 더 가까워졌다는 점에서 상당한 발전이다.[20]8. 관련 효소
- 락카아제
- 티로시나아제
참조
[1]
논문
The crystal structure of catechol oxidase: new insight into the function of type-3 copper proteins
2002-03
[2]
논문
Isolation and characterization of polyphenol oxidase from Indian tea leaf (Camellia sinensis)
1998
[3]
논문
Synthetic models of the active site of catechol oxidase: mechanistic studies
2006-09
[4]
논문
Catechol oxidase and phenoxazinone synthase: Biomimetic functional models and mechanistic studies
2016
[5]
논문
Isozymes of Ipomoea batatas catechol oxidase differ in catalase-like activity
2001-07
[6]
논문
Polyphenol Oxidase: Characteristics and Mechanisms of Browning Control
2008
[7]
논문
Comparative analysis of polyphenol oxidase from plant and fungal species
2006-01
[8]
논문
Import, targeting, and processing of a plant polyphenol oxidase
1994-08
[9]
논문
Polyphenol oxidases in plants and fungi: going places? A review
2006-11
[10]
논문
Proteolytic processing of polyphenol oxidase from plants and fungi
2008-12
[11]
논문
Catechol oxidase - structure and activity
https://zenodo.org/r[...]
1999-12
[12]
논문
Crystal structure of a plant catechol oxidase containing a dicopper center
1998-12
[13]
서적
Metal-carbon bonds in enzymes and cofactors
RSC Publishing
2009
[14]
논문
Cloning, sequencing, purification, and crystal structure of Grenache (Vitis vinifera) polyphenol oxidase
2010-01
[15]
논문
The catalytic cycle of catechol oxidase
2004-07
[16]
논문
Theoretical study of the catalytic mechanism of catechol oxidase
2007-11
[17]
논문
The biochemistry and control of enzymatic browning
1995-06
[18]
논문
Modification of Proteins by Polyphenol Oxidase and Peroxidase and their Products
1984-09
[19]
논문
Physicochemical Properties and Function of Plant Polyphenol Oxidase: A Review
2003-11
[20]
논문
Scaffolded amino acids as a close structural mimic of type-3 copper binding sites
2007-12
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com


