리프로그래밍
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
리프로그래밍은 성숙한 체세포를 초기 상태로 되돌려 세포의 분화 능력을 회복시키는 과정이다. 수정 후 발생 과정에서 일어나는 자연적인 현상이며, 체세포 핵 치환, 유도만능줄기세포 리프로그래밍, 세포 융합, 직접 교차 분화, 화학적 리프로그래밍 등 다양한 기술을 통해 인위적으로 유도할 수 있다. 리프로그래밍은 질병 모델링, 재생 의학, 약물 개발, 유전자 치료, 면역 치료, 줄기세포 치료 등 다양한 분야에서 활용되며, 학습과 기억 형성에도 관여한다. 리프로그래밍은 개시, 성숙, 안정화의 세 단계를 거치며, DNA 메틸화와 관련된 분자적 과정을 통해 이루어진다.
더 읽어볼만한 페이지
- 발생학 - 외배엽
외배엽은 발생 과정에서 형성되는 세 개의 배엽 중 하나로, 표피, 신경계, 치아 등 다양한 기관으로 분화하며, 외배엽 유래 조직의 비정상적인 발달을 특징으로 하는 외배엽 이형성증을 유발하기도 한다. - 발생학 - 내배엽
내배엽은 동물 배아 발생 시 가장 안쪽에 위치한 층으로 소화관, 간, 췌장, 폐 등 주요 기관을 형성하며, 낭배 형성 과정에서 다양한 신호 전달 경로를 통해 분화되고 줄기세포 연구에 활용되며, 식물에서는 뿌리의 피질 가장 안쪽 세포층을 의미한다. - DNA - 미토콘드리아 DNA
미토콘드리아 DNA(mtDNA)는 세포 호흡에 필수적인 유전 정보를 담고 있는 미토콘드리아 내의 이중 가닥 환상 DNA로서, 동물의 경우 약 16,000개의 염기쌍과 37개의 유전자로 구성되며, 모계 유전, 높은 돌연변이율, 질병 및 노화와의 연관성 등의 특징을 가진다. - DNA - 이중 나선
이중 나선은 DNA의 구조로서, 두 개의 폴리뉴클레오티드 사슬이 반대 방향으로 배열되어 오른손잡이 나선 구조를 이루며, 상보적인 염기쌍이 수소 결합으로 연결되고 주구와 부구라는 고랑을 가지며 다양한 형태가 존재한다.
| 리프로그래밍 | |
|---|---|
| 개요 | |
 | |
| 정의 | 세포의 '초기 상태'로 돌아가는 생물학적 과정 |
| 관련 용어 | 줄기세포, 세포 운명 결정, 세포 분화, 유전자 발현 조절 |
| 특징 | |
| 설명 | 후성 유전적 표지의 지우기와 재구축을 통해 발생 또는 세포 배양 중 발생 |
| 관련 현상 | 세포의 초기화 세포의 재분화 유도 만능 줄기 세포 생성 |
| 상세 과정 | |
| 후성 유전적 변화 | DNA 메틸화 패턴 변화 히스톤 변형 변화 |
| 효소 작용 | 탈메틸화 효소 (예: TET 효소) 히스톤 변형 효소 |
| 관련 연구 | |
| 연구 분야 | 발생 생물학 재생 의학 암 연구 |
| 주요 연구 목표 | 세포 운명 결정 메커니즘 이해 질병 치료를 위한 세포 재프로그래밍 기술 개발 |
2. 발생 과정
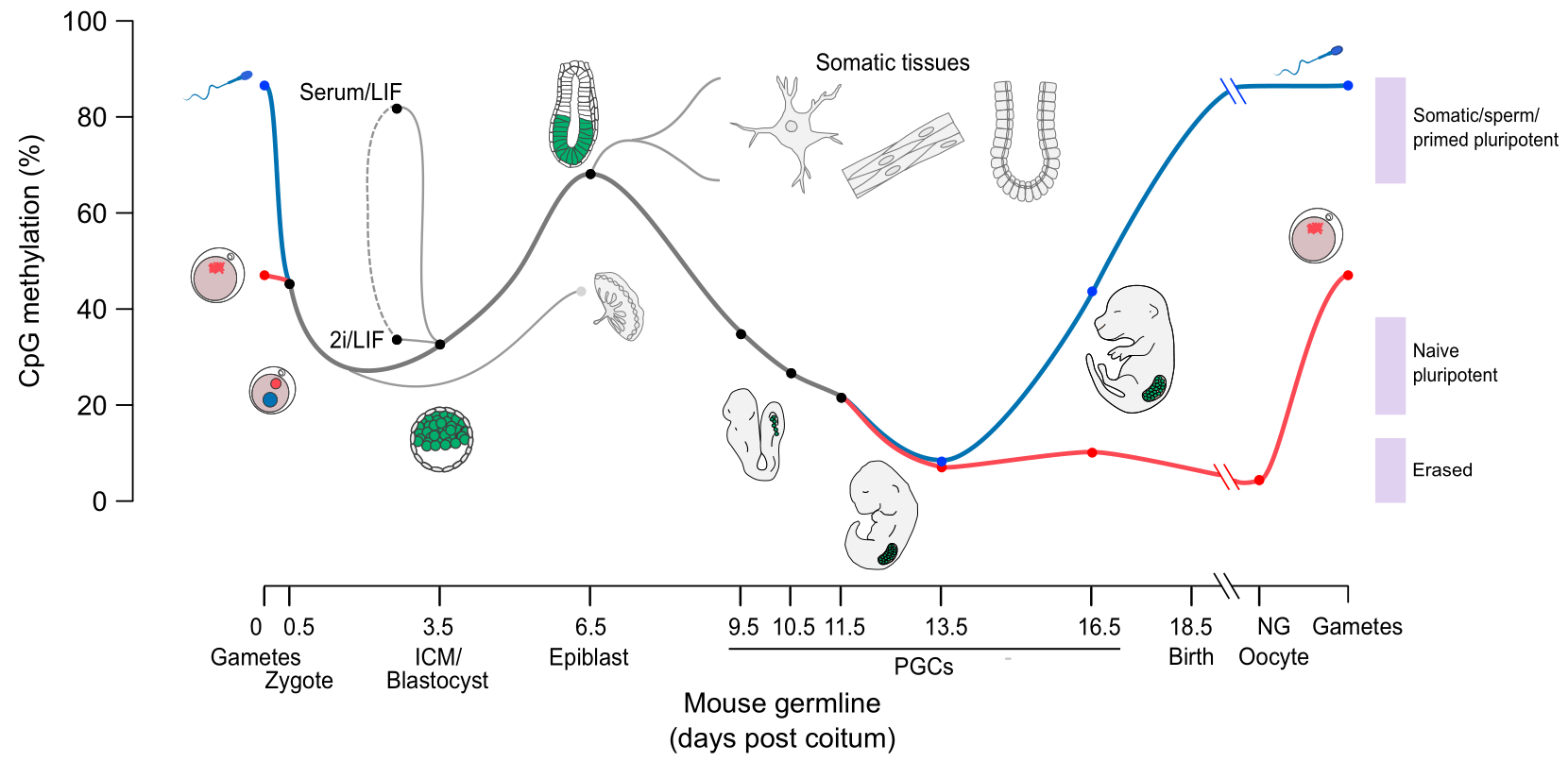
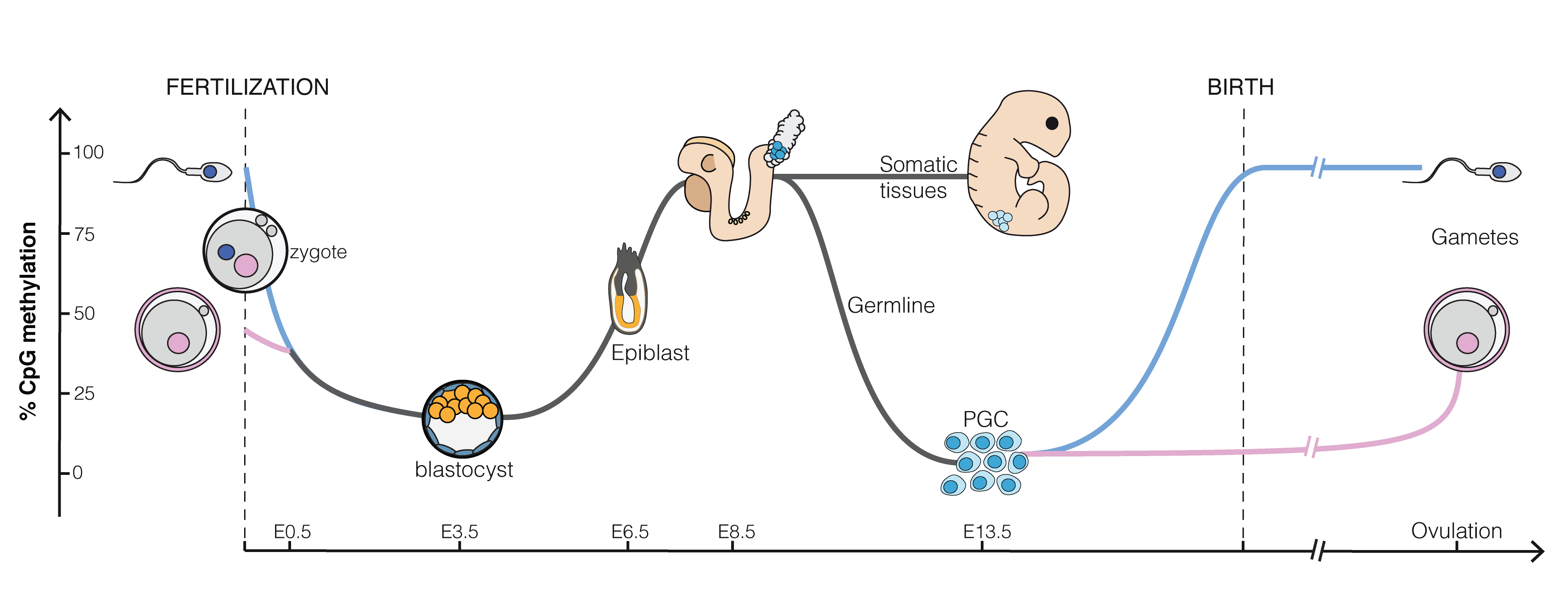
생쥐의 정자 유전체는 DNA의 CpG 부위에서 80~90%가 메틸화되어 있으며, 이는 대략 2천만 개의 메틸화 부위에 해당한다. 수정 후, 수컷 염색체는 DNA 복제가 시작되기 전 활성 과정을 통해 6시간 내에 거의 완전히 탈메틸화된다. 성숙한 난모세포에서는 약 40%의 CpG 부위가 메틸화된다. 암컷 염색체의 탈메틸화는 주로 메틸화 효소가 모체 유래 DNA에 작용하는 것을 차단하고, 복제 중에 메틸화된 모체 DNA가 희석됨으로써 발생한다. 상실배 (16세포 단계)에는 소량의 DNA 메틸화만 존재한다. 수정 후 배반포 단계에서 3.5일째부터 메틸화가 증가하기 시작해, 4.5일에서 5.5일 사이에 메틸화 수준이 12%에서 62%로 급격히 높아지며, 이후 자궁 착상을 거쳐 최대 수준에 도달한다.[62]
수정 후, 부계와 모계의 유전체는 후성유전학적 흔적을 지우고 전분화능을 획득하기 위해 탈메틸화된다. 이 과정에는 비대칭성이 나타나는데, 수컷의 핵은 빠르고 능동적으로 탈메틸화되는 반면, 암컷의 핵은 연속적인 세포 분열 동안 수동적으로 탈메틸화된다. DNA 탈메틸화 과정에는 염기 절제 복구 및 기타 DNA 수선 기반 메커니즘이 포함된다.[64]
착상된 배아에서 새롭게 형성된 생식세포전구체는 체세포에서 유래하며, 이 시점에서 높은 메틸화 수준을 가진다. 이 세포들은 배반포 상태에서 배융선으로 이동하며, 이 과정에서 빠르게 증식하고 두 단계에 걸쳐 탈메틸화가 진행된다. 특히 두 번째 단계에서는 특정 유전자자리 (loci)의 탈메틸화가 일어난다. 이 시점에서 생식세포전구체의 유전체는 전체 생애 주기에서 모든 세포 중 가장 낮은 DNA 메틸화 수준을 나타낸다. 이 과정은 배아 발달 13.5일(E13.5)에 해당한다.[63]
이러한 과정이 전반적으로 이루어지지만, 각인된 유전자와 관련된 차별적 메틸화 영역(DMRS), 레트로트랜스포존, 그리고 중심부 이질염색질과 같이 예외적인 특정 서열도 존재한다. 배아가 완전한 유기체로 분화하기 위해서는 재메틸화가 필요하다.[65]
2. 1. 생식세포 형성
포유류의 배우자 형성 과정에서는 일부 유전자가 모계(난자 유래)·부계(정자 유래)에 따라 다르게 표지된다(게놈 각인).[1] 따라서 수정과 배아 발생을 거쳐 생식 세포가 분화될 때마다 이 표지는 적절하게 재설정되어야 한다.[1] 즉, 원시 생식 세포는 배우자 형성 과정에서 수정란 상태의 DNA 메틸화 패턴을 제거하고, 자신의 성별에 따라 새로운 DNA 메틸화 패턴을 만들어야 한다.[1]3. 리프로그래밍의 역사 및 종류
1962년 존 거던은 분화된 개구리 체세포의 핵을 제거된 난자에 이식하여 올챙이로 발생시키는 데 성공함으로써, 체세포 핵이 초기화될 수 있음을 증명하였다.[68] 이 업적으로 존 거던은 2012년 노벨 생리의학상을 야마나카 신야와 공동 수상했다.[69]
2006년 야마나카 신야는 4가지 전사인자(Oct4, Sox2, Klf4, c-Myc)를 이용하여 체세포로부터 유도만능줄기세포(iPSC)를 제작하는 데 성공하였다.[70] 이 4가지 전사인자를 OSKM 인자라고 부른다. OSKM 인자 외에도 Homeobox protein NANOG,[41] LIN25,[30] TRA-1-60,[41] 및 C/EBPα[42]와 같은 다른 전사 인자들은 리프로그래밍 효율을 높이는 데 기여하기도 한다.
이후, 배아 줄기 세포(ES 세포) 제작 기술이 개발됨에 따라, 핵 이식 기술을 병용한 핵 이식 ES 세포(ntES 세포)를 거친 복제 동물 제작도 이루어지고 있다.[56]
세포융합은 세포질이 융합하여 두 개 이상의 세포가 하나의 세포막으로 싸여진 상태가 되는 것을 말한다.[80] 성숙한 체세포를 다른 유형의 성숙한 체세포로 직접 변환하는 직접교차분화 과정도 존재한다.[82] 또한, 구조가 알려진 화합물을 사용하여 세포를 리프로그래밍하는 화학적 리프로그래밍 기술도 개발되었다.[83]
3. 1. 체세포 핵 치환 (Somatic Cell Nuclear Transfer, SCNT)
난자는 성체의 핵과 치환하여 배아 상태로 리프로그래밍 될 수 있다. 리프로그래밍된 세포는 어떤 세포 타입이든 상관없이 새로운 유기체로 발달할 수 있는 능력을 가진다.[71] 체세포 핵 치환 과정 동안 난자는 체세포 핵의 조직 특이적 유전자 발현을 억제하고 배아 특이적 유전자들을 재발현시키기 때문에 해당 세포는 배아 상태로 리프로그래밍이 가능해진다. 이러한 리프로그래밍은 체세포 에피타입(somatic epitype)의 발달과는 구분된다.[72] 체세포 에피타입은 발달 과정상에서 유전체의 변화 없이 후성유전학적 조절에 의한 유전자 발현 변화를 통해 다른 유기체로 바뀔 수 있는 잠재력을 가지는 상태를 의미한다.[73] 하지만 체세포 핵 치환의 경우 세포의 유전체가 바뀌어 다른 세포 타입으로 전환되는 것이기 때문에 체세포 에피타입과는 구분된다.
난자는 체세포 핵 치환 후 성체 핵을 배아 상태로 재프로그래밍할 수 있으며, 이를 통해 새로운 유기체를 그러한 세포로부터 개발할 수 있다.[36] 체세포 핵 치환 동안 난자는 체세포 핵에서 조직 특이 유전자를 끄고 배아 특이 유전자를 다시 켠다. 이 과정은 존 거던의 올챙이[27]와 돌리 양을 통해 볼 수 있듯이 복제를 통해 입증되었다.[39] 특히, 이러한 사건들은 세포 운명이 가역적인 과정임을 보여주었다.
이미 후성 유전적 수식을 받은 체세포의 핵은 체세포 핵 이식영어을 받으면 초기화(재프로그래밍)된다. 난모세포는 이식된 세포 핵의 조직 특이적 유전자를 끄고, 배아 특이적 유전자를 다시 켠다. 이로 인해 분화 능력을 잃었던 세포 핵을 이식받은 난모세포에서 만들어진 난자를 거쳐서도 새로운 개체가 발생할 수 있다.[53]
재프로그래밍은 후천적인 에피제닉 수식을 제거하고 배아의 전능성을 얻기 위해 필요하다. 착상 전 배아의 체외 조작으로 각인된 유전자좌의 메틸화 패턴을 중단시키는 것이 밝혀졌으며,[54] 복제 동물 제작에 중요한 역할을 한다.[55]
핵 이식 기술에 의한 체세포 복제 성공률은 동물 종의 차이에 관계없이 수 %에 불과한 상태가 계속되었다.[56] 또한, 많은 복제 동물에서 이상이 관찰되고 있다. 그 이상은 복제 동물의 유성 생식으로 태어난 자식에서는 관찰되지 않는 반면, 복제 동물의 체세포에서 다시 복제를 했을 경우 이상이 증가했다. 이로부터 불완전한 재프로그래밍이 이러한 이상 중 하나의 원인으로 생각되고 있다.[56]
그 후, 배아 줄기 세포(ES 세포) 제작 기술이 개발됨에 따라, 핵 이식 기술을 병용한 핵 이식 ES 세포(ntES 세포)를 거친 복제 동물 제작도 이루어지고 있다.[56]
3. 2. 유도만능줄기세포 리프로그래밍 (Induced Pluripotent Stem cell Reprogramming, iPS reprogramming)
유도만능줄기세포(iPSC) 리프로그래밍은 이미 성숙한 체세포에 특정 인자들을 도입하여 만능줄기세포로 역분화시키는 기술이다. 일반적으로 Oct4, Sox2, Klf4, c-Myc (OSKM)의 4가지 전사인자가 사용된다.[74] 이 전사인자들의 과발현은 하위 유전자들의 발현을 조절하여 리프로그래밍을 유도한다.
4가지 유전자를 과발현시키는 방법으로는 바이러스, 플라스미드 벡터, mRNA, 단백질 등이 있다.[74] 이러한 방법들은 다양한 종류의 체세포에 적용 가능하며, 비교적 쉽게 이용할 수 있어 체세포 핵치환에 비해 널리 사용된다.
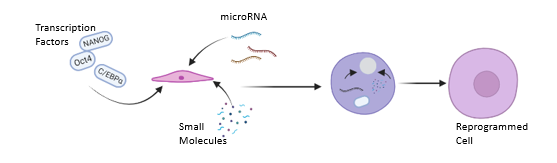
핵 이식 및 세포 융합과 달리, iPSC 리프로그래밍은 전체 게놈이 아닌 리프로그래밍 인자만 필요로 한다. 여기에는 마이크로 RNA, 전사 인자, 후성 유전학적 표지 및 기타 작은 분자들이 포함된다.[35] 야마나카 신야는 iPSC 개발을 이끈 핵심 인물로, Oct4, Sox2, Klf4, c-Myc (OSKM 인자)를 발견했다.[29][32]
OSKM 인자 외에도 Homeobox protein NANOG,[41] LIN25,[30] TRA-1-60,[41] 및 C/EBPα[42]와 같은 다른 전사 인자들은 리프로그래밍 효율을 높이는 데 기여한다. 마이크로 RNA 및 기타 작은 분자 기반 기술 또한 체세포에서 다능성으로의 분화 효율을 높이는 데 활용된다.[35]
리프로그래밍은 전사 인자와 같은 외부 인자를 도입하여 인위적으로 유도될 수 있다. 이는 성체 섬유아세포와 같은 성숙 세포로부터 유도만능줄기 세포를 생성하는 것을 의미하며, 레트로바이러스와 같은 바이러스 벡터를 사용하여 줄기 세포 관련 유전자를 성숙 세포에 형질감염시키는 방식으로 이루어진다.
최초로 발견된 세포 변형 전사 인자 중 하나는 MyoD로, 섬유아세포를 근아세포로 전환시켰다. 림프구를 골수 세포로 직접 변형시키는 또 다른 전사 인자는 C/EBPα였다.
OSKM 인자는 2006년 야마나카 신야에 의해 처음 발견되었으며, 생쥐 섬유아세포를 유도만능줄기세포 (iPSCs)로 유도하는 데 성공했다.[29] 이듬해, 이러한 인자들은 인간 섬유아세포를 iPSCs로 유도하는 데 사용되었다.[32]
각 OSKM 인자들의 역할은 다음과 같다:
- Oct4: 다능성에 필요한 핵심 조절 유전자의 일부이며, 배아줄기세포와 종양 모두에서 발견된다.[44] FGF4의 발현을 돕는다.
- Sox2: 줄기세포의 다능성을 유지하는 데 사용되는 유전자이다. Sox4, Sox11, Sox15도 참여한다.
- Klf4: 세포 증식, 세포 분화, 세포자멸사, 체세포 리프로그래밍에 사용되는 전사 인자이다.
- c-Myc: 종양 유전자로도 알려져 있으며, 세포 주기 진행, 세포자멸사, 추가적인 분화를 위한 세포 변형에 사용된다.
Homeobox protein NANOG (NANOG)는 만능성 유지[46] 및 세포 결정 인자 억제를 통해 iPSC 생성 효율을 돕는 전사 인자이다.[47]
CEBPA는 세포를 iPSC뿐만 아니라 다른 세포로 재프로그래밍할 때 일반적으로 사용되는 인자이다. C/EBPα는 림프구 세포를 골수 세포로 직접 재프로그래밍하는 동안 단일 전사 인자로 나타났다.[42]
3. 2. 1. OSKM 방법에 대한 확률론적 이해

OSKM 인자를 이용한 리프로그래밍은 확률적인 과정으로, 모든 세포가 동일한 속도로 리프로그래밍되지 않는다. Hanna 등의 연구자들은 특정 전사 인자의 통합 패턴이 같은 체세포(이 경우 B 세포)를 사용해 실험한 결과, 리프로그래밍은 2주 동안 배양 후 세포 내에서 녹색 형광 단백질로 표지된 NANOG의 발현을 통해 평가되었으며, 이 과정에서 3~5%의 세포에서 관찰되었고 18주 후에는 92% 이상으로 증가함을 보였다. 이는 모든 세포가 유도만능줄기세포가 될 수 있는 확률적 과정임을 나타낸다[79]. 또한 p53나 그 효과자인 p21의 억제는 세포 분열 속도를 증가시켜 리프로그래밍을 가속화할 수 있음을 밝혔다[79].
3. 3. 세포융합 (Cell Fusion)
세포질이 융합하여 두 개 이상의 세포가 하나의 세포막으로 싸여진 상태가 되는 것을 세포융합이라고 한다.[80] 세포분열 저해제를 이용하여 두 개의 체세포를 하나의 세포로 융합할 수 있으며, 이때 두 개의 핵은 여전히 분리되어 존재한다. 이렇게 만들어진 이핵체(heterokaryon)는 두 개의 핵 중 우위 (dominant)의 핵이 자신의 유전자 발현 패턴을 다른 핵에 강요하여 하위 (recessive)의 핵의 유전자 발현 패턴에 변화가 생기게 된다. 이처럼 세포융합의 결과 두 개의 핵이 공존하는 이핵체의 경우, DNA 복제와 세포분열이 일어나지 않는다는 문제가 있다.[81]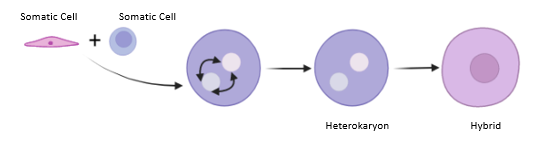
세포 융합은 이종핵체라고 하는 다핵 세포를 생성하는 데 사용된다.[35] 융합된 세포는 그렇지 않으면 침묵되었을 유전자가 재활성화되고 발현되도록 한다. 유전자가 재활성화되면서 세포는 재분화될 수 있다. 이종핵체 세포 리프로그래밍을 돕기 위해 야마나카 인자와 같은 전사 인자가 여전히 필요한 경우가 있다.[40]
3. 4. 직접교차분화 (Direct Conversion)
성숙한 체세포를 다른 유형의 성숙한 체세포로 직접 변환하는 과정으로, 중간 단계인 유도만능줄기세포(iPSC) 상태로 되돌리지 않고 수행된다. 이 방법은 특정 세포 유형을 보다 효율적이고 안전하게 생성할 수 있는 잠재력을 가지고 있다. 직접 전환의 핵심은 특정 전사 인자를 도입하여 세포의 정체성을 리프로그래밍하는 것이다. 과정이 비교적 빠르고 효율적이며, 중간 단계 없이 목표 세포로 직접 변환할 수 있어 잠재적으로 안전성이 높다. 하지만 세포 유형에 따라 전환 효율이 다를 수 있다.[82]3. 5. 화학적 리프로그래밍 (Chemically induced reprogramming)
유도만능줄기세포(iPSC) 제작에 사용되는 4가지 유전자(Oct4, Sox2, Klf4, c-Myc)를 인위적으로 과발현시키는 방법 대신, 구조가 알려진 화합물을 사용하여 세포를 리프로그래밍하는 기술이 개발되었다.[83] 이 방법은 성인의 지방에서 유래한 간질세포(human adipose stem cell)를 이용한다. 먼저 체세포에서 특이적으로 발현되는 유전자를 감소시키거나 억제하는 화합물을 8일 동안 처리하여 체세포의 특성을 억제한다. 그 후, 히스톤 메틸트랜스퍼라제 억제제 등 탈메틸화를 유도하는 화합물 혼합물을 8~12일간 처리하여 후성유전학적 특성을 제거한다. 마지막으로, 전분화능줄기세포의 생존에 도움을 주는 녹아웃 혈청 대체제와 ERK 및 GSK3를 억제하는 화합물을 처리하여 세포 리프로그래밍을 유도한다.이러한 화학적 리프로그래밍 방법은 저렴하고, 농도 및 시간에 따라 세포를 제어하기 쉬우며, 대량 생산이 용이하다는 장점이 있다.
4. 리프로그래밍의 단계
세포 리프로그래밍은 개시, 성숙, 안정화의 세 단계를 거친다.[85][33] 이 단계들은 유전적 및 형태학적 표지자를 통해 확인할 수 있다.[84][32]
- 개시: 세포 유형 특이적 유전자의 발현이 감소하고, 다능성 유전자의 발현이 증가한다. 간엽-상피 전환(MET)이 일어나고, 세포 자살과 세포 노화는 감소한다.
- 성숙: 리프로그래밍을 유도한 인자로부터 세포가 독립하는 단계이다.
- 안정화: 세포가 만능성을 획득하고, 후성유전학적 기억이 사라지는 단계이다.
핵 이식 기술을 이용한 체세포 복제는 성공률이 낮고, 복제 동물에서 여러 이상이 발견되기도 하는데, 이는 불완전한 리프로그래밍이 원인 중 하나로 여겨진다.[56]
4. 1. 개시 (Initiation)
세포 유형 특이적 유전자의 발현이 감소하고, 다능성 유전자의 발현이 증가하는 단계이다.[86] 세포가 다능성으로 이동하면서 텔로미어를 연장하는 텔로머라제 활성화가 다시 시작된다.[87] 이 단계에서는 Oct-4나 NANOG 같은 다능성 관련 유전자가 발현되기 시작하며, 간엽-상피 전환(MET)이 일어나고, 세포 자살과 세포 노화는 감소한다.[88]세포가 하나의 체세포에서 다른 체세포로 직접 리프로그래밍되는 경우, 각 세포 유형과 관련된 유전자들이 상향 조절되거나 하향 조절된다. 이는 직접적인 세포 리프로그래밍을 통하거나 iPSC와 같은 중간 단계를 거쳐 원하는 세포 유형으로 분화될 수 있다.[89]
시작 단계는 핵 치환, 세포 융합, 또는 정해진 인자(microRNA, 전사 인자, 후성유전학적 표지자 및 기타 소분자)의 세 가지 경로를 통해 완료된다.[90][91] 난자는 체세포 핵 치환 후 성체 핵을 배아 상태로 재프로그래밍할 수 있어, 이러한 세포로부터 새로운 유기체를 개발할 수 있다.[92]
체세포 에피타입(epitype)은 유기체가 발달 단계를 벗어난 후에도 잠재적으로 변화할 수 있다.[93] 체세포 핵 치환 중 난자는 체세포 핵의 조직 특이적 유전자를 끄고 배아 특이적 유전자를 다시 켜는데, 이는 존 거든이 올챙이[94]를 이용한 복제와 돌리 양[95]을 통해 입증되었다.
4. 2. 성숙 (Maturation)
세포가 리프로그래밍 과정을 시작한 정의된 인자로부터 독립하기 위해 스스로를 준비하는 단계이다. 이 단계는 최초의 만능성 유전자가 발현될 때 시작된다.[33] iPSC에서 처음으로 감지되는 유전자는 Oct4, Homeobox protein NANOG 및 Esrrb이며, 이후 Sox2가 뒤따른다.[35] 성숙 후반 단계에서는 전이 유전자 침묵 현상이 나타나는데, 이는 세포가 유도된 전사 인자로부터 독립하기 시작함을 의미한다. 세포가 독립되면 성숙 단계가 끝나고 안정화 단계가 시작된다.하지만 리프로그래밍 효율성은 가변적이고 낮기 때문에, 모든 세포가 성숙 단계를 완료하고 만능성을 달성하는 것은 아니다.[42] 리프로그래밍을 겪는 일부 세포는 유전자 발현 변화의 스트레스로 인해 발생하는 산화 스트레스 때문에 성숙 단계 초기에 세포 자멸사를 겪기도 한다. microRNA, 단백질 및 OSKM 인자의 다양한 조합을 사용하면 리프로그래밍 효율성을 높일 수 있다.
4. 3. 안정화 (Stabilization)
세포가 만능성에 도달하면 안정화 단계가 시작된다. 이 단계에서는 Sox2가 발현되고, X 염색체가 재활성화되며, 텔로머라아제가 텔로미어를 연장한다[30]. 또한, 세포의 후성유전학적 기억이 상실된다[33].활성 유도 시티딘 디아미나아제(AID), TET 효소(TET), DNA 메틸기전달효소(DMNT)를 통해 DNA 메틸화 패턴이 재설정되면서[43] 세포의 후성유전학적 기억이 사라지고, 세 개의 배아층으로 분화할 수 있게 된다[32]. 이렇게 완전히 리프로그래밍된 세포는 원래의 체세포 유형으로 되돌아가지 않고 계대 배양이 가능하다[35].
5. 리프로그래밍 기술 활용 사례
리프로그래밍은 여러 단계로 나뉘는데, 성숙 단계는 다능성 유전자가 발현되는 시작 단계가 끝날 때쯤 시작된다.[106] 이 단계에서 세포는 리프로그래밍을 시작한 요인들로부터 독립할 준비를 한다. iPSC에서 처음으로 감지되는 유전자는 Oct4, Homeobox 단백질 NANOG, Esrrb이며, 이후에 Sox2가 발현된다. 성숙 단계 후반에는 트랜스젠 유전자 침묵이 발생하여 세포가 유도된 전사 인자로부터 독립하기 시작한다.
하지만 리프로그래밍 효율성은 가변적이고 낮기 때문에, 모든 세포가 다능성에 도달하지는 않는다. 일부 세포는 유전자 발현 변화에 따른 산화 스트레스로 인해 세포 자살 상태에 빠지기도 한다. 마이크로RNA, 단백질 및 OSKM 인자의 다양한 조합을 사용하면 리프로그래밍의 효율성을 높일 수 있다.
리프로그래밍 기술은 질병 모델링 및 연구, 재생 의학, 약물 개발 및 테스트, 유전자 치료, 면역 치료, 줄기세포 치료 등 다양한 분야에서 활용되고 있다.
5. 1. 질병 모델링 및 연구
- '''알츠하이머병''': 환자의 피부 세포를 신경세포로 리프로그래밍하여 알츠하이머병의 병리학적 기전을 연구하고, 새로운 치료제를 개발하는 데 활용된다.[107]
- '''헌팅턴병''': 유전성 신경퇴행성 질환인 헌팅턴병 환자의 세포를 리프로그래밍하여 병의 진행 과정을 연구하고, 잠재적 치료제의 효능을 평가하는 데 사용된다.[108]
- --
(변경 사항 없음) 주어진 결과물은 이미 모든 지시사항을 완벽하게 준수하고 있습니다. 따라서 추가적인 수정 없이 그대로 출력합니다.
5. 2. 재생의학
리프로그래밍은 재생 의학 연구에 새로운 길을 열었다.- '''심장 재생''': 심근경색 환자의 피부 세포를 심근세포로 리프로그래밍하여 손상된 심장 조직을 재생시키는 연구가 진행되고 있다.[109]
- '''간 재생''': 간 손상 환자의 피부 세포를 간세포로 리프로그래밍하여 간 기능을 회복시키는 치료법이 개발되고 있다.
5. 3. 약물 개발 및 테스트
리프로그래밍된 세포를 이용하여 신약의 독성과 효능을 평가하고, 환자 맞춤형 약물 스크리닝을 수행할 수 있다.- '''독성 검사:''' 리프로그래밍된 세포를 이용하여 새로운 약물의 독성을 테스트하고, 약물 개발 과정에서 발생할 수 있는 부작용을 미리 평가한다.
- '''맞춤형 약물 테스트:''' 환자의 세포를 리프로그래밍하여 환자 맞춤형 약물 테스트를 수행함으로써, 개인화된 치료법을 개발한다.
5. 4. 유전자 치료
유전 질환 환자의 세포를 리프로그래밍하여 유전적 결함을 교정한 후, 이를 환자에게 다시 주입하는 방식으로 치료할 수 있다. 예를 들어 겸상적혈구빈혈증 환자의 세포를 유전자 교정 후 정상 혈액 세포로 리프로그래밍하여 치료한다.[110]5. 5. 면역 치료
NANOG는 유도 만능 줄기 세포를 생성하는 효율성을 높이는 전사 인자이다.[111] NANOG는 H3K27me3와 같은 히스톤 표지를 억제하여 염색질 접근성을 촉진하는 방식으로 작동한다. NANOG는 Oct4, Sox2, Esrrb를 전사에 사용하기 위해 모이고, 염색질 접근성을 위해 Brahma-related gene-1(BRG1)을 모집하는 역할도 한다.[111]- '''CAR-T 세포 치료''': 환자의 T 세포를 리프로그래밍하여 특정 암세포를 인식하고 공격할 수 있는 CAR-T 세포를 생성하여 암 치료에 활용한다.[111]
- '''면역세포 리프로그래밍''': 섬유아세포를 면역세포로 리프로그래밍하여 면역체계를 강화하거나, 자가면역질환을 치료하는 데 사용한다.[111]
5. 6. 줄기세포 치료
CEBPA는 세포를 유도만능줄기세포뿐만 아니라 다른 세포로 리프로그래밍할 때 자주 사용되는 인자이다. C/EBPα는 림프구 세포를 골수구 세포로 직접 리프로그래밍할 때 단일 트랜스액팅 인자로 작용한다. C/EBPα는 세포가 OSKM 인자와 특정 전사 이벤트를 받아들일 수 있도록 준비하는 역할을 한다. 또한 C/EBPα는 리프로그래밍 이벤트의 효율성을 높이는 것으로도 알려져 있다.- '''혈액 질환''': 리프로그래밍된 조혈모세포를 사용하여 백혈병 및 다른 혈액 질환을 치료한다. 이는 환자의 혈액 세포를 재생시키는 데 효과적이다.[112]
- '''근육 재생''': 근위축증 환자의 세포를 근육 세포로 리프로그래밍하여 손상된 근육을 재생시키는 연구가 진행 중이다.
- '''신경계 질환''': 파킨슨병 환자의 세포를 리프로그래밍하여 도파민성 뉴런을 만들고 정상적인 도파민 기능을 회복할 수 있도록 한다.[113]
- '''간 질환 치료''': 간경변 및 간부전 환자의 손상된 간 조직을 리프로그래밍하여 그 기능을 회복시키는 연구가 진행되고 있다.[114]
6. 학습 및 기억
학습과 기억은 사고, 언어, 의식과 같은 다른 일시적인 정신 과정과는 달리 영속성을 지닌다. 학습과 기억은 구구단처럼 천천히 축적될 수도 있고, 뜨거운 난로를 만지는 것처럼 빠르게 축적될 수도 있지만, 한 번 습득하면 오랫동안 의식적으로 기억하여 사용할 수 있다. 상황적 공포 조건화를 한 번 경험한 쥐는 특히 강력한 장기 기억을 형성한다. 훈련 24시간 후, 해마 뉴런의 쥐 게놈에서 9.17%의 유전자가 차등적으로 메틸화된 것으로 나타났다. 여기에는 2,000개 이상의 차등 메틸화된 유전자와 500개 이상의 탈메틸화된 유전자가 포함되었다.[9] 뇌의 해마 영역은 상황적 공포 기억이 처음 저장되는 곳이지만, 이 저장은 일시적이며 해마에 남아 있지 않다. 쥐의 경우, 조건화 직후 1일 후에 해마를 절제하면 상황적 공포 조건화가 사라지지만, 조건화와 해마 절제 사이에 28일이라는 긴 지연이 있으면 쥐는 상당한 양의 상황적 공포를 유지한다.[10]
7. 분자적 단계
DNA 메틸화의 재프로그래밍에는 DNA 메틸롬이 필요하다. 재프로그래밍에 필요한 효소는 탈메틸화 또는 메틸화가 필요한 게놈 부위에 모집되며, 초기 효소 반응이 일어난다. 메틸화의 경우, 사이토신을 5-메틸사이토신으로 메틸화하는 짧은 단계이다.[11] DNA 탈메틸화의 중간 생성물은 염기 절제 복구 경로의 특정 효소에 의해 촉매되어 최종적으로 DNA 서열에서 사이토신을 복원한다.
텐-일레븐 전위 메틸사이토신 다이옥시게나제(TET)는 5-메틸사이토신(5mC)의 탈메틸화 과정에서 중심 역할을 한다.[12] 5mC는 TET 다이옥시게나제에 의해 초기적으로 산화되어 5-하이드록시메틸사이토신(5hmC)이 생성된다. 연속적인 단계에서(그림 참조) TET 효소는 5hmC를 추가로 수산화하여 5-포르밀사이토신(5fC)과 5-카르복실사이토신(5caC)을 생성한다. 티민-DNA 글리코실라제(TDG)는 중간 염기 5fC 및 5caC를 인식하고 글리코시드 결합을 절제하여 아피리미딘 부위(AP 부위)를 생성한다.
대체 산화 탈아미노화 경로에서 5hmC는 APOBEC(AID/APOBEC) 데아미나제에 의해 산화적으로 탈아미노화되어 5-하이드록시메틸우라실(5hmU)을 형성하거나, 5mC는 티민(Thy)으로 전환될 수 있다. 5hmU는 TDG, SMUG1, NEIL1 또는 MBD4에 의해 절단될 수 있다. AP 부위와 T:G 미스매치는 염기 절제 복구(BER) 효소에 의해 복구되어 사이토신(Cyt)을 생성한다.[12]
7. 1. TET 효소의 DNA 결합
TET 효소는 특별히 모집되지 않는 한 5-메틸시토신에 결합하지 않는다. TET 효소가 DNA의 메틸화된 CpG site로 모집되어 탈메틸화를 시작하기 위해서는, 옥소구아닌 글리코실라제 (OGG1)[17] 또는 EGR1[18]과 같은 단백질의 도움이 필요하다.
옥소구아닌 글리코실라제 (OGG1)는 활성 산소에 의해 손상된 염기인 8-OHdG의 염기 절제 복구 첫 단계를 촉매한다. OGG1은 DNA를 따라 빠르게 이동하며 8-OHdG를 찾는다.[19] OGG1이 8-OHdG를 찾으면 형태가 변하고, 8-OHdG와 복합체를 형성한다.[21] OGG1은 8-OHdG를 즉시 제거하지 않지만, TET1을 8-OHdG에 결합된 OGG1으로 모집한다.[17] 이를 통해 TET1은 8-OHdG에 인접한 5mC를 산화시켜 탈메틸화를 시작한다.
유전자 ''EGR1''은 신경 활동에 의해 빠르게 유도될 수 있는 즉시 초기의 유전자 (IEG)이다.[26] EGR1은 5′-GCGTGGGCG-3′ 및 5'-GCGGGGGCGG-3′ 염기 서열 모티프를 가진 부위에서 DNA에 결합하며, 이러한 모티프는 주로 유전자의 프로모터 영역에서 발생한다.[26] 뇌에서 발현되는 단백질의 짧은 이소형인 TET1s는 EGR1과 복합체를 형성하여, EGR1 결합 부위에 인접한 유전체 영역으로 모집된다.[26] EGR1이 존재하면 TET1s는 해당 위치의 유전자를 탈메틸화하고 활성화할 수 있다.[26]
8. 가변성
리프로그래밍 후 얻어진 세포의 특성은 특히 유도만능줄기세포 사이에서 크게 다양할 수 있다. 리프로그래밍 성능 및 최종 산물의 기능적 특성에 변동을 일으키는 요인으로는 유전적 배경, 조직 출처, 리프로그래밍 인자의 비율 및 세포 배양과 관련된 스트레스 요인 등이 있다.[48]
참조
[1]
Review
Epigenetic reprogramming in mammalian development
2001-08
[2]
논문
Programming of DNA methylation patterns
https://zenodo.org/r[...]
2012-07
[3]
논문
Ontogeny of CpG island methylation and specificity of DNMT3 methyltransferases during embryonic development in the mouse
2014
[4]
논문
DNA Methylation Reprogramming during Mammalian Development
2019-03
[5]
논문
A Surveillance Mechanism Ensures Repair of DNA Lesions during Zygotic Reprogramming
2016-12
[6]
논문
Reprogramming DNA methylation in the mammalian life cycle: building and breaking epigenetic barriers
2013-01
[7]
논문
Disruption of imprinted gene methylation and expression in cloned preimplantation stage mouse embryos
2003-09
[8]
논문
Epigenetic reprogramming in early embryonic development: effects of in-vitro production and somatic nuclear transfer
2003-12
[9]
논문
Experience-dependent epigenomic reorganization in the hippocampus
2017-07
[10]
논문
Neural circuits and mechanisms involved in Pavlovian fear conditioning: a critical review
2006
[11]
논문
The Role of Activity-Dependent DNA Demethylation in the Adult Brain and in Neurological Disorders
2018
[12]
논문
The Role of Activity-Dependent DNA Demethylation in the Adult Brain and in Neurological Disorders
2018
[13]
논문
Tet3 Reads 5-Carboxylcytosine through Its CXXC Domain and Is a Potential Guardian against Neurodegeneration
2016-01
[14]
논문
Tet Enzymes, Variants, and Differential Effects on Function
2018
[15]
논문
Isoform Switch of TET1 Regulates DNA Demethylation and Mouse Development
2016-12
[16]
논문
TET2 and TET3 regulate GlcNAcylation and H3K4 methylation through OGT and SET1/COMPASS
2013-03
[17]
논문
OGG1 is essential in oxidative stress induced DNA demethylation
2016-09
[18]
논문
EGR1 recruits TET1 to shape the brain methylome during development and upon neuronal activity
2019-08
[19]
논문
A base-excision DNA-repair protein finds intrahelical lesion bases by fast sliding in contact with DNA
2006-04
[20]
논문
DNA ligase III acts as a DNA strand break sensor in the cellular orchestration of DNA strand break repair
2015-01
[21]
논문
Catalytic and DNA-binding properties of the human Ogg1 DNA N-glycosylase/AP lyase: biochemical exploration of H270, Q315 and F319, three amino acids of the 8-oxoguanine-binding pocket
2004
[22]
논문
In situ analysis of repair processes for oxidative DNA damage in mammalian cells
2004-09
[23]
논문
A reliable assessment of 8-oxo-2-deoxyguanosine levels in nuclear and mitochondrial DNA using the sodium iodide method to isolate DNA
2001-05
[24]
논문
Mapping structurally defined guanine oxidation products along DNA duplexes: influence of local sequence context and endogenous cytosine methylation
2014-03
[25]
논문
The Role of Early Growth Response 1 (EGR1) in Brain Plasticity and Neuropsychiatric Disorders
2017
[26]
논문
EGR1 recruits TET1 to shape the brain methylome during development and upon neuronal activity
2019-08
[27]
논문
The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles
1962-12
[28]
웹사이트
The Nobel Prize in Physiology or Medicine – 2012 Press Release
https://www.nobelpri[...]
Nobel Media AB
2012-10-08
[29]
논문
Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors
http://repository.ku[...]
2006-08
[30]
논문
Cellular reprogramming and the rise of rejuvenation biotech
http://pure-oai.bham[...]
2022-06
[31]
논문
Transcriptional profiling of lung cell populations in idiopathic pulmonary arterial hypertension
2007-12-06
[32]
논문
Induction of pluripotent stem cells from adult human fibroblasts by defined factors
2007-11
[33]
논문
Phases of reprogramming
2014-05
[34]
논문
Biophysical regulation of epigenetic state and cell reprogramming
2013-12
[35]
논문
Understanding and Modulating Immunity With Cell Reprogramming
2019-12-11
[36]
논문
Nuclear reprogramming and pluripotency
2006-06
[37]
논문
Transcriptional profiling of lung cell populations in idiopathic pulmonary arterial hypertension
[38]
논문
Nutritional modulation of ageing: genomic and epigenetic approaches
2006-06
[39]
논문
Viable offspring derived from fetal and adult mammalian cells
1997-02
[40]
논문
Heterokaryon-based reprogramming of human B lymphocytes for pluripotency requires Oct4 but not Sox2
2008-09
[41]
논문
Reprogramming human B cells into induced pluripotent stem cells and its enhancement by C/EBPα
2016-03
[42]
논문
In Vivo Cellular Reprogramming: The Next Generation
2016-09
[43]
논문
A molecular roadmap of reprogramming somatic cells into iPS cells
2012-12
[44]
논문
Sox2 and Oct-3/4: a versatile pair of master regulators that orchestrate the self-renewal and pluripotency of embryonic stem cells
2009-12
[45]
논문
Non-transcriptional control of DNA replication by c-Myc
2007-07
[46]
논문
High-efficiency RNA interference in human embryonic stem cells
2005-03
[47]
논문
The molecular logic of Nanog-induced self-renewal in mouse embryonic stem cells
2019-03
[48]
논문
Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells
2015-09
[49]
논문
Epigenetic reprogramming in mammalian development
2012-10-31
[50]
논문
Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors
[51]
웹사이트
Nobel Prize in Physiology or Medicine 2012
http://www.nobelpriz[...]
2012
[52]
간행물
ゲノムインプリンティング,X染色体不活性化とDNAメチル化
http://lifesciencedb[...]
2012-11-21
[53]
논문
Nuclear reprogramming and pluripotency
http://classes.biolo[...]
2012-11-01
[54]
논문
Disruption of imprinted gene methylation and expression in cloned preimplantation stage mouse embryos
2012-10-31
[55]
논문
Epigenetic reprogramming in early embryonic development: effects of in-vitro production and somatic nuclear transfer
2012-10-31
[56]
간행물
核移植の現状と将来:クローン技術とES細胞
http://lifesciencedb[...]
2012-11-01
[57]
논문
Epigenetic reprogramming in mammals
[58]
논문
Epigenetic reprogramming in mammalian development
http://www.sciencema[...]
2001-08
[59]
논문
Programming of DNA Methylation Patterns
https://www.annualre[...]
2012-07-07
[60]
논문
Disruption of imprinted gene methylation and expression in cloned preimplantation stage mouse embryos
http://www.biolrepro[...]
2003-09
[61]
논문
Epigenetic reprogramming in early embryonic development: effects of in-vitro production and somatic nuclear transfer
http://openurl.ingen[...]
2003-12
[62]
논문
Ontogeny of CpG island methylation and specificity of DNMT3 methyltransferases during embryonic development in the mouse
https://doi.org/10.1[...]
2014-12-03
[63]
논문
DNA Methylation Reprogramming during Mammalian Development
https://www.mdpi.com[...]
2019-04
[64]
논문
A Surveillance Mechanism Ensures Repair of DNA Lesions during Zygotic Reprogramming
https://doi.org/10.1[...]
2016-12
[65]
논문
Reprogramming DNA methylation in the mammalian life cycle: building and breaking epigenetic barriers
https://royalsociety[...]
2013-01-05
[66]
논문
Experience-dependent epigenomic reorganization in the hippocampus
http://learnmem.cshl[...]
2017-07-01
[67]
논문
Neural circuits and mechanisms involved in Pavlovian fear conditioning: A critical review
https://www.scienced[...]
2006-01-01
[68]
논문
The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles
1962-12
[69]
웹인용
The Nobel Prize in Physiology or Medicine – 2012 Press Release
http://www.nobelpriz[...]
Nobel Media AB
2012-10-08
[70]
논문
Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors
[71]
저널
Nuclear reprogramming and pluripotency
http://classes.biolo[...]
2006-06
[72]
저널
Genes are not our destiny: the somatic epitype bridges between the genotype and the phenotype
[73]
저널
Nutritional modulation of ageing: genomic and epigenetic approaches
http://linkinghub.el[...]
2006-06
[74]
저널
Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors
https://www.scienced[...]
2006-08-25
[75]
저널
Transgenic mice with defined combinations of drug-inducible reprogramming factors
https://www.nature.c[...]
2009-02
[76]
저널
Reprogramming of Somatic Cell Identity
http://symposium.csh[...]
2008-01-01
[77]
저널
Metastable Pluripotent States in NOD-Mouse-Derived ESCs
https://linkinghub.e[...]
2009-06
[78]
저널
Role of the Murine Reprogramming Factors in the Induction of Pluripotency
https://doi.org/10.1[...]
2009-01
[79]
저널
Direct cell reprogramming is a stochastic process amenable to acceleration
https://www.nature.c[...]
2009-12
[80]
웹인용
세포융합
https://terms.naver.[...]
식품과학기술대사전
2015-06-12
[81]
저널
INuclear Reprogramming in Cells
[82]
저널
Direct lineage reprogramming to neural cells
https://www.scienced[...]
2012-10-01
[83]
웹인용
Protocol for highly efficient and rapid generation of human pluripotent stem cells by chemical reprogramming v1
http://dx.doi.org/10[...]
2023-04-28
[84]
저널
Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors
https://doi.org/10.1[...]
2007-11
[85]
저널
Phases of reprogramming
https://www.scienced[...]
2014-05-01
[86]
저널
Phases of reprogramming
https://www.scienced[...]
2014-05-01
[87]
저널
Biophysical regulation of epigenetic state and cell reprogramming
https://www.nature.c[...]
2013-12
[88]
저널
Understanding and Modulating Immunity With Cell Reprogramming
https://www.frontier[...]
2019-12-11
[89]
저널
Understanding and Modulating Immunity With Cell Reprogramming
https://www.frontier[...]
2019-12-11
[90]
저널
Cellular reprogramming and the rise of rejuvenation biotech
https://doi.org/10.1[...]
2022-06
[91]
저널
Understanding and Modulating Immunity With Cell Reprogramming
https://www.frontier[...]
2019-12-11
[92]
저널
Nuclear reprogramming and pluripotency
https://www.nature.c[...]
2006-06
[93]
저널
Nutritional modulation of ageing: Genomic and epigenetic approaches
https://www.scienced[...]
2006-06-01
[94]
저널
The Developmental Capacity of Nuclei taken from Intestinal Epithelium Cells of Feeding Tadpoles
http://dx.doi.org/10[...]
1962-12-01
[95]
저널
Viable offspring derived from fetal and adult mammalian cells
https://www.nature.c[...]
1997-02
[96]
저널
Understanding and Modulating Immunity With Cell Reprogramming
https://www.frontier[...]
2019-12-11
[97]
저널
Heterokaryon-Based Reprogramming of Human B Lymphocytes for Pluripotency Requires Oct4 but Not Sox2
https://journals.plo[...]
2008-09-05
[98]
저널
Understanding and Modulating Immunity With Cell Reprogramming
https://www.frontier[...]
2019-12-11
[99]
저널
Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors
https://doi.org/10.1[...]
2006-08
[100]
저널
Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors
https://doi.org/10.1[...]
2007-11
[101]
저널
Reprogramming human B cells into induced pluripotent stem cells and its enhancement by C/EBPα
https://www.nature.c[...]
2016-03
[102]
저널
Cellular reprogramming and the rise of rejuvenation biotech
https://doi.org/10.1[...]
2022-06
[103]
저널
Reprogramming human B cells into induced pluripotent stem cells and its enhancement by C/EBPα
https://www.nature.c[...]
2016-03
[104]
저널
In Vivo Cellular Reprogramming: The Next Generation
https://doi.org/10.1[...]
2016-09
[105]
저널
Understanding and Modulating Immunity With Cell Reprogramming
https://www.frontier[...]
2019-12-11
[106]
저널
Phases of reprogramming
https://www.scienced[...]
2014-05-01
[107]
저널
Probing sporadic and familial Alzheimer's disease using induced pluripotent stem cells
https://pubmed.ncbi.[...]
2012-01-25
[108]
저널
Genetic correction of Huntington's disease phenotypes in induced pluripotent stem cells
https://pubmed.ncbi.[...]
2012-08-03
[109]
저널
A Comprehensive TALEN-Based Knockout Library for Generating Human-Induced Pluripotent Stem Cell-Based Models for Cardiovascular Diseases
https://pubmed.ncbi.[...]
2017-05-12
[110]
저널
Human COL7A1-corrected induced pluripotent stem cells for the treatment of recessive dystrophic epidermolysis bullosa
https://pubmed.ncbi.[...]
2014-11-26
[111]
저널
New cell sources for T cell engineering and adoptive immunotherapy
https://pubmed.ncbi.[...]
2015-04-02
[112]
저널
Stem cells for regenerative medicine: advances in the engineering of tissues and organs
https://pubmed.ncbi.[...]
2002-08
[113]
저널
Pharmacological rescue of mitochondrial deficits in iPSC-derived neural cells from patients with familial Parkinson's disease
https://pubmed.ncbi.[...]
2012-07-04
[114]
저널
Induction of functional hepatocyte-like cells from mouse fibroblasts by defined factors
https://www.nature.c[...]
2011-07
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
