세포핵
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
세포핵은 진핵세포의 핵심적인 구성 요소로, 유전 물질인 DNA를 포함하고 있으며, 유전자 발현 조절 및 DNA 복제를 수행한다. 1719년 안톤 판 레이우엔훅에 의해 처음 관찰되었으며, 19세기 초 로버트 브라운에 의해 "nucleus"로 명명되었다. 핵은 핵막, 핵질, 핵소체, 크로마틴 등으로 구성되어 있으며, 핵막은 핵공을 통해 물질 수송을 조절한다. 핵 내에는 DNA가 크로마틴 형태로 존재하며, 유크로마틴과 헤테로크로마틴으로 구분된다. 세포 분열 시 핵막은 분해되고 염색체 분리가 일어난 후 재형성된다. 핵의 기능은 세포 구획화, DNA 복제, 유전자 발현, pre-mRNA 가공, 핵 수송 등을 포함한다. 대부분의 진핵세포는 하나의 핵을 가지지만, 일부 세포는 핵이 없거나 여러 개의 핵을 가질 수 있다. 세포핵의 기원에 대해서는 공생 모델, 바이러스 진핵생물 발생, 외막 가설 등 다양한 이론이 제시되어 있다.
더 읽어볼만한 페이지
- 세포핵 - 염색체
염색체는 유전자를 포함하는 DNA 가닥으로, 진핵생물에서는 단백질과 결합해 염색질을 형성하고 세포 분열 시 응축된 막대 모양을 나타내며, 원핵생물은 진핵생물보다 단순한 구조를 가지고 종에 따라 수와 구조가 다양하며, 이상이 생기면 유전 질환을 유발할 수 있어 유전 연구에 중요한 역할을 한다. - 세포핵 - 핵공
핵공은 진핵세포 핵막에 있는 단백질 복합체로, 누클레오포린 단백질로 구성되어 핵과 세포질 간 물질 수송을 조절하며, 작은 분자는 수동 확산, 큰 분자는 수송 단백질의 도움을 받아 이동하고, 세포 주기 동안 수와 해체 및 재조립이 조절된다. - 세포소기관 - 소포 (세포)
소포는 막으로 둘러싸인 작은 주머니 모양의 구조물로, 세포 내 물질 수송, 소화, 분비, 세포간 신호 전달, 세포 외부 물질 소화 및 배출 등 다양한 기능을 수행하며, 특히 세포외소포체는 질병과의 연관성으로 주목받고 있고, 클라트린, COPI, COPII, SNARE 단백질 등이 소포 형성 및 수송에 관여한다. - 세포소기관 - 세포막
세포막은 세포질을 둘러싸고 세포 내외부 환경을 구분하는 선택적 투과성 막으로, 인지질 이중층과 단백질, 탄수화물로 구성되어 물질 수송, 세포 형태 유지, 세포 간 신호 전달, 세포 접합 등의 기능을 수행하며, 유동 모자이크 모델로 설명된다. - 글로벌세계대백과를 인용한 문서/{{{분류 - 공 (악기)
공은 금속으로 제작된 타악기로, 다양한 문화권에서 의식, 신호, 음악 연주 등에 사용되며, 형태와 용도에 따라 여러 종류로 나뉜다. - 글로벌세계대백과를 인용한 문서/{{{분류 - 국무회의
국무회의는 대한민국 대통령을 의장으로, 예산, 법률안, 외교, 군사 등 국정 현안을 심의하는 중요한 기관이며, 대통령, 국무총리, 국무위원으로 구성되고, 정례회의는 매주 1회, 임시회의는 필요에 따라 소집된다.
| 세포핵 | |
|---|---|
| 세포핵 | |
 | |
| 라틴어 | Nucleus |
| 세부 정보 | |
| 발견 시기 | 1831년 |
| 발견자 | 로버트 브라운 |
| 위치 | 진핵세포 |
| 특징 | |
| 기능 | 세포질 내에서 유전 물질을 보존하고, 세포의 활동을 조절한다. |
| 구조 | 핵막 핵공 핵형질 염색질 인 |
2. 역사
세포핵은 가장 먼저 발견된 세포 소기관 중 하나였다. 가장 오래된 그림은 1632년부터 1723년까지 활동한 초기 현미경 관찰자인 안톤 판 레이우엔훅이 그린 것으로, 그는 연어의 적혈구에서 "강"(lumen)이라고 하는 핵을 관찰했다.[97] 포유류의 적혈구와 달리 다른 척추동물의 적혈구에는 여전히 핵이 있다.[98]
thumb이 부착된 바깥쪽 핵막, 핵공, DNA(크로마틴 형태로 복합체화), 핵소체를 보여주는 핵의 그림.]]
1804년 프란츠 바우어가 핵을 기술하였고, 1831년에는 스코틀랜드의 식물학자 로버트 브라운이 런던 린네 학회 강연에서 더 자세히 묘사했다. 브라운은 현미경으로 난초를 연구하던 중 꽃의 바깥층 세포에서 "고리" 또는 "핵"(nucleus)이라고 부르는 불투명한 영역을 관찰했다.[100] 그는 핵의 기능에 대해서는 구체적으로 언급하지 않았다.
1838년 마티아스 슐라이덴은 핵이 세포 생성에 중요한 역할을 한다고 제안하며 "세포모체"(cytoblast)라는 이름을 도입했다. 그는 "세포모체" 주위에 새로운 세포가 조립된다고 믿었다. 그러나 프란츠 마이엔은 이 견해에 강하게 반대했는데, 그는 이미 세포가 분열을 통해 증식하는 것을 묘사했고, 많은 세포에 핵이 없을 것이라고 믿었다. 로베르트 레마크(1852)와 루돌프 피르호(1855)의 연구는 세포가 기존 세포의 분열로만 생성된다는 새로운 패러다임("Omnis cellula e cellulala")을 확립하면서 슐라이덴의 주장은 힘을 잃었다. 이로 인해 핵의 기능은 여전히 불분명했다.[101]
1877년과 1878년 사이에 오스카 헤르트비히는 성게 난자의 수정에 대한 여러 연구를 발표하여 정자의 핵이 난자에 들어가 핵과 융합된다는 것을 보여주었다. 이것은 개체가 단일 핵을 가진 세포에서 발달한다는 것을 처음으로 제안한 것이었다. 이는 종의 완전한 계통 발생이 배아 발달 중에 반복되며, 원시 원형질(Urschleimde)의 구조 없는 덩어리인 "모네룰라"로부터 첫 번째 핵을 가진 세포가 생성된다는 에른스트 헤켈의 이론과 모순되었다. 그러나 헤르트비히는 양서류와 연체동물을 포함한 다른 동물 그룹에서도 자신의 관찰을 확인했다. 에두아르트 스트라스부르거는 1884년 식물에 대해 동일한 결과를 냈다. 이를 통해 핵이 유전에서 중요한 역할을 한다는 것이 점차 밝혀지게 되었다. 1873년 아우구스트 바이스만은 유전에 대해 모계 및 부계 생식 세포의 역할이 동일하다고 예측했다. 유전 정보 전달자로서 핵의 기능은 세포 분열이 발견되고 20세기 초 멘델 유전 법칙이 재발견된 후에야 명확해졌으며, 염색체 유전설이 발전하면서 더욱 확실해졌다.[12]
3. 구조
핵은 세포의 거의 모든 DNA를 포함하며, 핵 기질이라고 하는 섬유성 중간 섬유 네트워크와 핵 외피라고 하는 이중 막에 싸여 있다. 핵 외피는 핵질이라고 하는 핵 내부의 액체를 세포의 나머지 부분과 분리한다. 핵의 크기는 세포의 크기와 관련이 있으며, 진핵 세포에서 핵은 일반적으로 세포 부피의 약 10%를 차지한다.[9] 핵은 동물 세포에서 가장 큰 세포 소기관이다. 사람 세포에서 핵의 직경은 약 6 마이크로미터 (μm)이다.[9]
일반적으로 세포에는 핵이 1개 있으며, 동물 세포에서 가장 큰 세포 소기관이다.[107] 포유류 세포에서 핵의 직경은 약 6 µm이며, 세포 전체 부피의 약 10%를 차지한다.[108] 핵 내부의 점성 액체는 핵질이라고 하며, 그 조성은 핵 밖의 세포질 기질과 유사하다.[109]
세포 분열 시 핵 내의 DNA는 응축되어 염색체를 형성하고, 세포 분열 후 2개의 세포로 나뉜다. 이때 핵의 표면은 이중 핵막으로 둘러싸인다. 그 후, 각각의 세포에서 다시 핵이 형성되고 염색체가 소실되며 DNA는 핵 내에 퍼진다.
핵 내에는 실처럼 이어진 DNA 분자가 결합 단백질과 복합체를 구성하면서 흩어져 있는데, 이를 '''크로마틴''' 또는 '''염색질'''이라고 한다. 염색질은 크게 2가지 종류로 나뉜다.
핵소체는 핵 내에서 발견되는 가장 크고 밀도가 높게 염색되는 구조물이다. 핵소체는 rDNA의 직렬 반복 주변에 형성되며, 이는 리보솜 RNA (rRNA)를 코딩하는 DNA이다. 핵소체의 주요 역할은 rRNA를 합성하고 리보솜을 조립하는 것이다.
핵소체 외에도 카할체, 젬, PML체, 파라스페클, 핵 스펙클 등 다양한 핵 내 구조체가 존재한다. 이러한 구조체들은 RNA 처리, 유전자 발현 조절 등 다양한 기능을 수행한다.
| 소기관 이름 | 소기관 지름 (μm) |
|---|---|
| 카할체 | 0.2–[38] |
| 클라스트솜 | 0.2–0.5μm[52] |
| PIKA | 5μm[39] |
| PML체 | 0.2–[40] |
| 파라스페클 | 0.5–[41] |
| 스펙클 | 20–25nm[39] |
3. 1. 핵막과 핵공
핵막은 내부 핵막과 외부 핵막의 두 세포막으로 구성되며, 핵공에 의해 뚫려 있다.[9] 이 막들은 함께 세포의 유전 물질을 나머지 세포 내용물로부터 분리하고, 핵이 나머지 세포와는 다른 환경을 유지하도록 한다. 핵 주변에 밀접하게 위치함에도 불구하고, 두 막은 모양과 내용물에서 실질적으로 다르다. 내부 막은 핵 내용을 둘러싸고 그 경계를 정의한다. 내부 막에 내장된 다양한 단백질은 핵에 구조를 부여하는 중간 필라멘트에 결합한다.[9] 외부 막은 내부 막을 둘러싸고, 인접한 소포체 막과 연결되어 있다.[9] 소포체 막의 일부로서, 외부 핵막에는 막을 가로질러 단백질을 활발하게 번역하는 리보솜이 박혀 있다.[9] 두 막 사이의 공간은 주변핵 공간이라고 불리며, 소포체 강과 연결되어 있다.[9]포유류 핵막에는 3000개에서 4000개 사이의 핵공 복합체(NPC)가 핵막을 관통하고 있다.[9] 각 NPC는 내부 및 외부 막이 융합되는 위치에 8중 대칭 고리 모양 구조를 포함한다.[10] NPC의 수는 세포 유형에 따라 상당히 다를 수 있는데, 작은 신경교 세포는 약 수백 개만 가지고 있으며, 큰 푸르키네 세포는 약 20,000개를 가지고 있다.[9] NPC는 핵질과 세포질 사이의 분자에 대한 선택적 수송을 제공한다.[11] 핵공 복합체는 약 30가지의 서로 다른 단백질로 구성되어 있으며, 이를 뉴클레오포린이라고 한다.[9] 핵공은 약 60–8000만 달톤의 분자량을 가지며, (효모)에서는 약 50개, (척추 동물)에서는 수백 개의 단백질로 구성된다.[12] 핵공의 총 직경은 100 nm이지만, 분자가 자유롭게 확산되는 틈은 핵공 중심에 있는 조절 시스템 때문에 약 9 nm에 불과하다. 이 크기는 작은 수용성 분자의 통과를 선택적으로 허용하는 반면, 핵산 및 더 큰 단백질과 같은 더 큰 분자가 부적절하게 핵에 들어가거나 나가는 것을 방지한다. 이러한 큰 분자는 대신 핵으로 능동적으로 수송되어야 한다. 고리에는 핵질로 뻗어 있는 '핵 바구니'라는 구조와 세포질로 뻗어 있는 일련의 필라멘트 확장이 부착되어 있다. 두 구조 모두 핵 수송 단백질과의 결합을 매개한다.[13]
대부분의 단백질, 리보솜 소단위체 및 일부 RNA는 캐리오페린으로 알려진 수송 인자군에 의해 매개되는 과정을 통해 핵공 복합체를 통과하여 수송된다. 핵으로 이동을 매개하는 캐리오페린은 임포틴이라고도 하며, 핵 밖으로 이동을 매개하는 캐리오페린은 엑스포틴이라고 한다. 대부분의 캐리오페린은 화물과 직접 상호 작용하지만, 일부는 신호 전달 어댑터 단백질을 사용한다.[14] 스테로이드 호르몬인 코르티솔과 알도스테론, 그리고 세포 간 세포 신호 전달에 관련된 다른 작은 지용성 분자는 세포막을 통해 세포질로 확산될 수 있으며, 여기서 핵으로 수송되는 핵 수용체 단백질에 결합한다. 이들은 리간드에 결합되면 전사 인자 역할을 한다. 리간드가 없는 경우, 많은 이러한 수용체는 유전자 발현을 억제하는 히스톤 탈아세틸화 효소로 기능한다.[13]
3. 2. 핵 라미나
동물 세포에는 두 개의 중간 섬유 네트워크가 존재하며, 핵에 기계적 지지력을 제공한다. 핵 라미나는 핵막 안쪽에 정돈된 그물 구조를 형성하고, 덜 정돈된 지지 구조는 핵막의 세포질 쪽에 제공된다. 이 두 시스템은 모두 핵막을 구조적으로 지지하고 염색체와 핵공의 고정 부위 역할을 한다.[15]핵 라미나는 대부분 라민 단백질로 구성된다. 모든 단백질과 마찬가지로 라민은 세포질에서 합성된 후 핵 내부로 수송되어 기존의 핵 라미나 네트워크에 통합되기 전에 조립된다.[16][17] 에머린과 네스프린과 같이 막의 세포질 쪽에서 발견되는 라민은 세포 골격에 결합하여 구조적 지지력을 제공한다. 라민은 핵질 내에서도 발견되며, 형광 현미경으로 관찰 가능한 ''핵질 베일''로 알려진 또 다른 규칙적인 구조를 형성한다.[18][19] 베일의 실제 기능은 불분명하지만, 핵소체에서는 제외되고 세포 주기의 간기 동안 존재한다.[20] LEM3과 같이 베일을 구성하는 라민 구조는 크로마틴과 결합하며, 그 구조를 파괴하면 단백질 코딩 유전자의 전사가 억제된다.[21]
다른 중간 섬유의 구성 요소와 마찬가지로, 라민 단량체는 두 개의 단량체가 서로 꼬여 나선형 도메인을 포함하여 단백질 이합체 구조인 코일 코일을 형성하는 데 사용된다. 이 두 개의 이합체 구조는 서로 나란히 역평행 배열로 결합하여 ''원섬유''라고 하는 사합체 단백질을 형성한다. 이 원섬유 8개는 측면 배열을 형성하여 꼬여서 밧줄 모양의 ''섬유''를 형성한다. 이 섬유는 역동적인 방식으로 조립되거나 분해될 수 있으며, 이는 섬유의 길이 변화가 섬유 추가 및 제거의 경쟁 속도에 달려 있음을 의미한다.[15]
섬유 조립에 결함이 있는 라민 유전자의 돌연변이는 ''라미노병''으로 알려진 희귀한 유전 질환 집단을 유발한다. 가장 주목할 만한 라미노병은 조로증으로 알려진 질환군으로, 이 질환을 가진 사람들에게 조기 노화의 징후가 나타난다. 관련된 생화학적 변화가 노화된 표현형을 유발하는 정확한 메커니즘은 잘 알려져 있지 않다.[22]
3. 3. 핵소체 (인)
핵소체는 핵 내에서 발견되는, 막이 없는 구조체인 핵 내 소체 중에서 가장 크고 밀도가 높게 염색되는 구조물이다. 핵소체는 rDNA의 직렬 반복 주변에 형성되며, 이는 리보솜 RNA (rRNA)를 코딩하는 DNA이다. 이 영역은 핵소체 형성 부위 (NOR)라고 불린다. 핵소체의 주요 역할은 rRNA를 합성하고 리보솜을 조립하는 것이다. 핵소체의 구조적 응집력은 그 활동에 달려 있으며, 핵소체 내에서 리보솜 조립은 핵소체 구성 요소의 일시적인 결합을 초래하여 추가적인 리보솜 조립, 따라서 추가적인 결합을 촉진한다. 이러한 모델은 rDNA의 비활성화가 핵소체 구조물의 혼합을 초래한다는 관찰에 의해 뒷받침된다.[23]
리보솜 조립의 첫 번째 단계에서, RNA 중합 효소 I이라고 불리는 단백질이 rDNA를 전사하여 큰 pre-rRNA 전구체를 형성한다. 이는 두 개의 큰 rRNA 소단위체 – 5.8S, 28S, 그리고 하나의 작은 rRNA 소단위체 18S로 절단된다.[9][24] rRNA의 전사, 전사 후 처리 및 조립은 작은 핵소체 RNA (snoRNA) 분자의 도움을 받아 핵소체에서 일어나며, 그 중 일부는 리보솜 기능과 관련된 유전자를 암호화하는 전령 RNA에서 스플라이싱된 인트론에서 유래한다. 조립된 리보솜 소단위체는 핵공을 통과하는 가장 큰 구조물이다.[13]
전자 현미경으로 관찰하면 핵소체는 세 가지 구별되는 영역으로 구성되어 있는 것을 볼 수 있다. 가장 안쪽의 ''섬유 중심''(FC)은 ''밀집 섬유 성분''(DFC)으로 둘러싸여 있으며 (여기에는 피브릴라린 및 누클레올린이 포함됨), 이 DFC는 다시 ''과립 성분''(GC)으로 경계를 이룬다 (여기에는 단백질 누클레오포스민이 포함됨). rDNA의 전사는 FC 내부 또는 FC-DFC 경계에서 일어나며, 따라서 세포 내에서 rDNA 전사가 증가하면 더 많은 FC가 감지된다. rRNA의 절단 및 변형 대부분은 DFC에서 일어나고, 리보솜 소단위체에 단백질을 조립하는 후속 단계는 GC에서 일어난다.[24]
3. 4. 기타 핵 내 구조체
핵소체 외에도 카할체, 젬, PML체, 파라스페클, 핵 스펙클 등 다양한 핵 내 구조체가 존재한다. 이러한 구조체들은 RNA 처리, 유전자 발현 조절 등 다양한 기능을 수행하는 것으로 알려져 있다.- 카할체 (Cajal body): 세포 유형과 종에 따라 1개에서 10개 사이로 존재하며, 직경은 0.2μm–이다.[38] 엉킨 실타래 모양을 하고 있으며, 단백질 코일린이 밀집 분포한다.[39][35] snoRNA 및 snRNA 성숙, 히스톤 mRNA 변형 등 RNA 처리와 관련된 역할을 한다.[38]
- 젬 (Gem): 카할체와 크기, 모양이 유사하여 현미경으로 구별하기 어렵다.[35] snRNP는 포함하지 않지만, snRNP 생합성에 관여하는 SMN 단백질을 포함한다.[36] 카할체와 젬은 동일 구조의 다른 발현일 수 있다는 주장도 있다.[35]
- PML체 (Promyelocytic leukemia body): 핵질 전체에 흩어져 있는 구형 구조물로, 크기는 0.1μm~이다.[40] 핵 도메인 10 (ND10), 크레머 소체, PML 종양 유전자 도메인 등으로도 불린다.[45] PML 단백질이 주요 구성 요소이며, DNA 복제, 전사, 후성 유전적 조절 등 다양한 핵 기능 조절에 관여한다.[133]
- 파라스페클 (Paraspeckle): 세포핵의 염색질 사이 공간에 있는 불규칙한 모양의 구획으로, 핵당 10~30개가 존재한다.[47][48] 핵 단백질과 RNA를 격리하여 유전자 발현 조절에 관여하는 분자 스펀지 역할을 하는 것으로 보인다.[50]
- 핵 스펙클 (Nuclear speckle): 포유류 세포 핵질의 염색질 사이 영역에 위치하며, pre-mRNA 스플라이싱 인자가 풍부하다.[25] 불규칙한 점상 구조로 크기와 모양이 다양하며, 염색질간 과립 덩어리로 보인다. 유전자 발현 조절, 스플라이싱 snRNP, 프리-mRNA 스플라이싱에 필요한 단백질 조직화에 관여한다.[27]
- PIKA 도메인: 1991년 현미경 연구에서 처음 기술되었다. 그 기능은 불분명하지만, 활성적인 DNA 복제, 전사 또는 RNA 처리에 관여하지 않는 것으로 여겨졌다.[43] 작은 핵 RNA(snRNA)의 전사를 촉진하는 전사 인자 PTF의 고밀도 국소화에 의해 정의되는 개별 도메인과 연관되어 있는 것으로 밝혀졌다.[44]
- 클라스트솜 (Clastosome): 프로테아좀에 의한 단백질 분해가 일어나는 장소로 추정된다. 두꺼운 링 모양을 띠는 작은 핵 소체(0.2μm–0.5μm)이다.[52]
| 소기관 이름 | 소기관 지름 (μm) |
|---|---|
| 카할체 | 0.2μm–[38] |
| 클라스트솜 | 0.2μm–0.5μm[52] |
| PIKA | 5μm[39] |
| PML체 | 0.2μm–[40] |
| 파라스페클 | 0.5μm–[41] |
| 스펙클 | 20nm–25nm[39] |
4. 기능
세포핵은 유전자 발현 조절과 DNA 복제를 매개하는 중요한 기능을 수행한다.[12] 세포핵 내에서는 유전자 전사가 일어나는데, 이는 세포질의 번역 장소와 분리되어 원핵생물에서는 불가능한 수준의 정교한 유전자 조절을 가능하게 한다.
핵은 세포 주기 동안 DNA 복제를 조절하며, 핵은 mRNA가 세포질로 이동하기 전에 가공되는 장소이기도 하다. 이러한 가공 과정에는 5' 캡핑, 3' 폴리아데닐화, RNA 스플라이싱이 포함되며, 이는 mRNA가 제대로 기능하는 단백질로 번역되도록 하는 데 필수적이다.[12] 특히 RNA 스플라이싱 과정에서 스플라이소좀은 인트론을 제거하고 엑손을 연결하여 성숙한 mRNA를 만든다. 얼터너티브 스플라이싱을 통해 하나의 유전자로부터 다양한 단백질이 생성될 수 있다.[62]
4. 1. 세포 구획화
핵막은 세포질과 핵을 분리하여 유전자 발현을 조절한다. 세포는 특정 단백질의 핵 내 이동을 조절하여 유전자 발현을 제어한다. 예를 들어, 헥소키나아제는 당분해 과정에서 중요한 효소인데, 과당-6-인산 농도가 높아지면 조절 단백질에 의해 핵으로 이동하여 당분해 관련 유전자 발현을 억제한다.[156][157]염증 반응에 관여하는 NF-κB는 평소 세포질에 존재하지만, TNF-α와 같은 신호 분자에 의해 활성화되면 핵 국소화 신호를 통해 핵으로 이동하여 특정 유전자의 전사를 촉진한다.[108]
핵은 스플라이싱되지 않은 mRNA가 번역되는 것을 막는다.[158] 진핵생물 mRNA는 인트론을 포함하는데, 이 부분은 핵 내에서 스플라이싱되어 제거되어야 정상적인 단백질이 만들어진다. 핵이 없다면 리보솜이 스플라이싱되지 않은 mRNA를 번역하여 비정상적인 단백질을 생성할 수 있다.
4. 2. DNA 복제
세포핵의 주요 기능은 유전자 발현을 제어하고 세포 주기 동안 DNA 복제를 매개하는 것이다.[12] 복제는 세포핵 내에서 국소적으로 일어나는 것으로 밝혀졌다. 세포 주기의 간기 중 S기에서 복제가 일어난다. 정체된 DNA를 따라 복제 분기점이 이동한다는 전통적인 관점과는 달리, 복제 분기점이 일부 고정된 '공장' 영역으로 집중된다는 개념인 ''복제 공장''이 등장했는데, 이는 템플릿 DNA 가닥이 컨베이어 벨트처럼 이를 통과한다는 것을 의미한다.[59]4. 3. 유전자 발현
세포핵은 유전자 전사가 일어나는 장소이며, 이는 세포질 내 번역 장소와 분리되어 원핵생물에게는 불가능한 수준의 유전자 조절을 가능하게 한다.[12]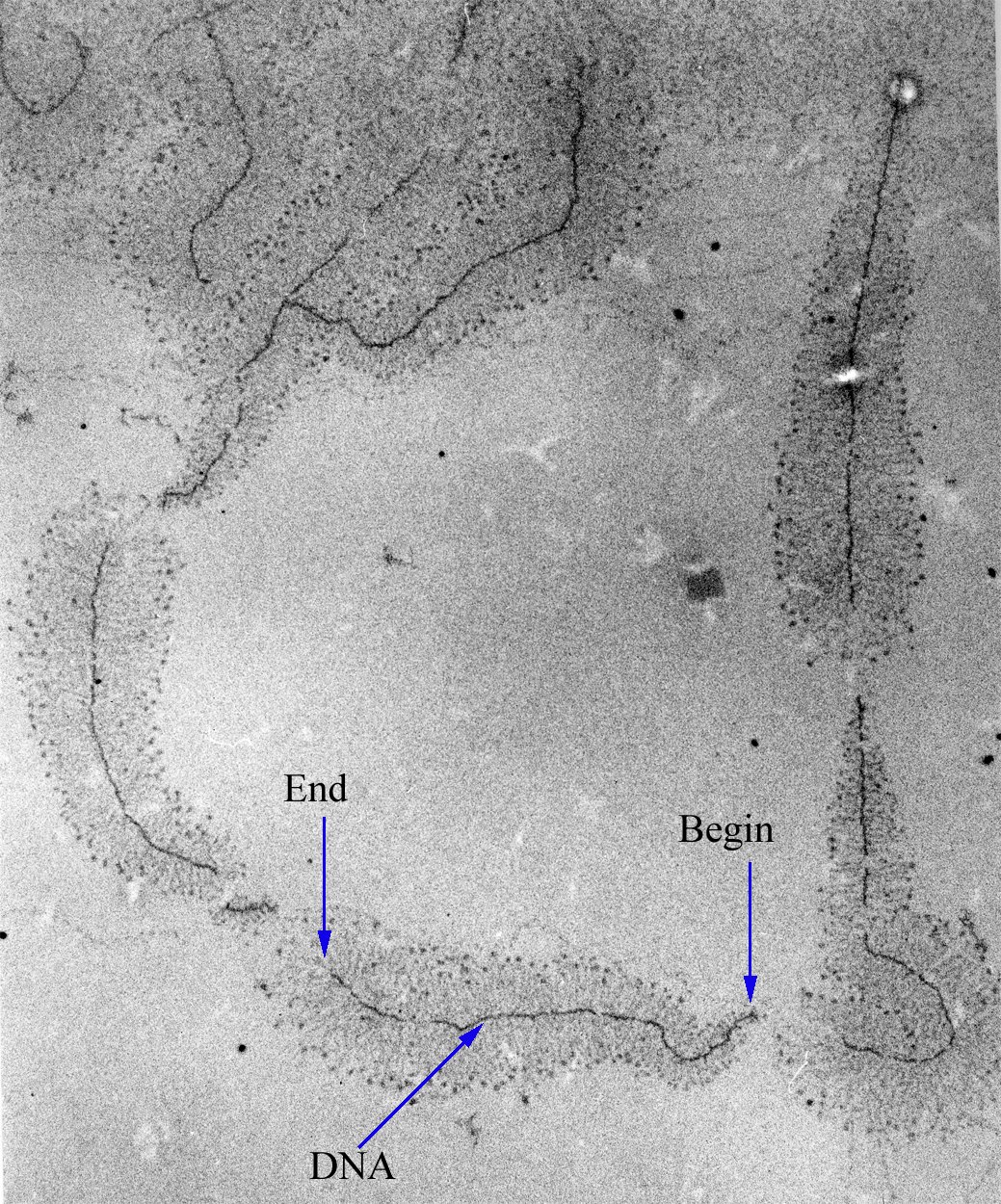
유전자 발현은 먼저 DNA를 주형으로 사용하여 RNA를 생성하는 전사를 포함한다. 단백질을 암호화하는 유전자의 경우, 이 과정에서 생성된 RNA는 메신저 RNA(mRNA)이며, 이는 단백질을 형성하기 위해 리보솜에 의해 번역되어야 한다. 리보솜은 핵 외부에 위치하므로 생성된 mRNA는 핵 밖으로 수송되어야 한다.[60]
핵은 전사가 일어나는 장소이므로 전사를 직접 매개하거나 과정을 조절하는 다양한 단백질도 포함하고 있다. 이러한 단백질에는 접근성을 용이하게 하기 위해 이중 가닥 DNA 분자를 푸는 헬리케이스, 성장하는 RNA 분자를 합성하기 위해 DNA 프로모터에 결합하는 RNA 중합 효소, DNA의 초나선의 양을 변경하여 감고 푸는 데 도움을 주는 토포이소머라제뿐만 아니라 발현을 조절하는 다양한 전사 인자가 포함된다.[61]
4. 4. pre-mRNA 가공
새로 합성된 mRNA 분자는 1차 전사체 또는 pre-mRNA로 알려져 있다. 이들은 세포질로 수송되기 전에 핵 내에서 전사 후 변형을 거치며, 이러한 변형을 거치지 않고 세포질로 이동한 mRNA는 단백질로 번역되기보다 분해된다. 이루어지는 변형은 5' 캡핑, 3' 폴리아데닐화, 그리고 RNA 스플라이싱이다.[12] 핵 내에서 pre-mRNA는 여러 단백질과 상호작용한다. 5' 캡 부착은 전사와 동시에 일어나며, 전사 후 변형의 첫 번째 단계이다. 3'의 폴리(A) 꼬리는 전사가 완료된 후에 부착된다.[12]RNA 스플라이싱은 스플라이소좀이라고 불리는 복합체에 의해 수행되며, 인트론, 즉 단백질을 코드하지 않는 영역이 pre-mRNA에서 제거되고, 남은 엑손이 하나의 연속적인 RNA 분자로 재형성된다. 이 과정은 일반적으로 5' 캡핑과 3' 폴리아데닐화 후에 일어나지만, 다수의 엑손으로 구성된 전사체의 경우에는 전사가 완료되기 전에 시작될 수 있다.[13] 항체를 코딩하는 것을 포함하여, 많은 pre-mRNA가 여러 방식으로 스플라이싱되어, 다른 단백질 서열을 코딩하는 성숙 RNA가 만들어진다. 이 과정은 얼터너티브 스플라이싱으로 알려져 있으며, 제한된 양의 DNA로부터 다양한 단백질을 만들어내는 것이 가능하게 된다.[62]
5. 핵 수송
핵막을 통과하는 핵공 복합체(NPC)는 핵과 세포질 사이의 분자 수송을 선택적으로 조절한다.[11] 핵공 복합체는 약 30가지의 뉴클레오포린이라는 단백질로 구성되어 있다.[9] 핵공은 분자량 약 60–8000만 달톤이며, 수십~수백 개의 단백질로 구성된다.[12]
핵공의 총 직경은 100 nm이지만, 분자가 자유롭게 확산되는 틈은 약 9 nm에 불과하여 핵산이나 큰 단백질과 같은 큰 분자는 핵을 드나들 때 능동 수송이 필요하다. 핵공에는 핵질로 뻗어 있는 ''핵 바구니''와 세포질로 뻗어 있는 필라멘트가 부착되어 핵 수송 단백질과의 결합을 돕는다.[13]
대부분의 단백질, 리보솜 소단위체, 일부 RNA는 캐리오페린이라는 수송 인자를 통해 핵공 복합체를 통과한다. 핵으로 이동하는 캐리오페린은 임포틴, 핵 밖으로 이동하는 캐리오페린은 엑스포틴이라고 한다.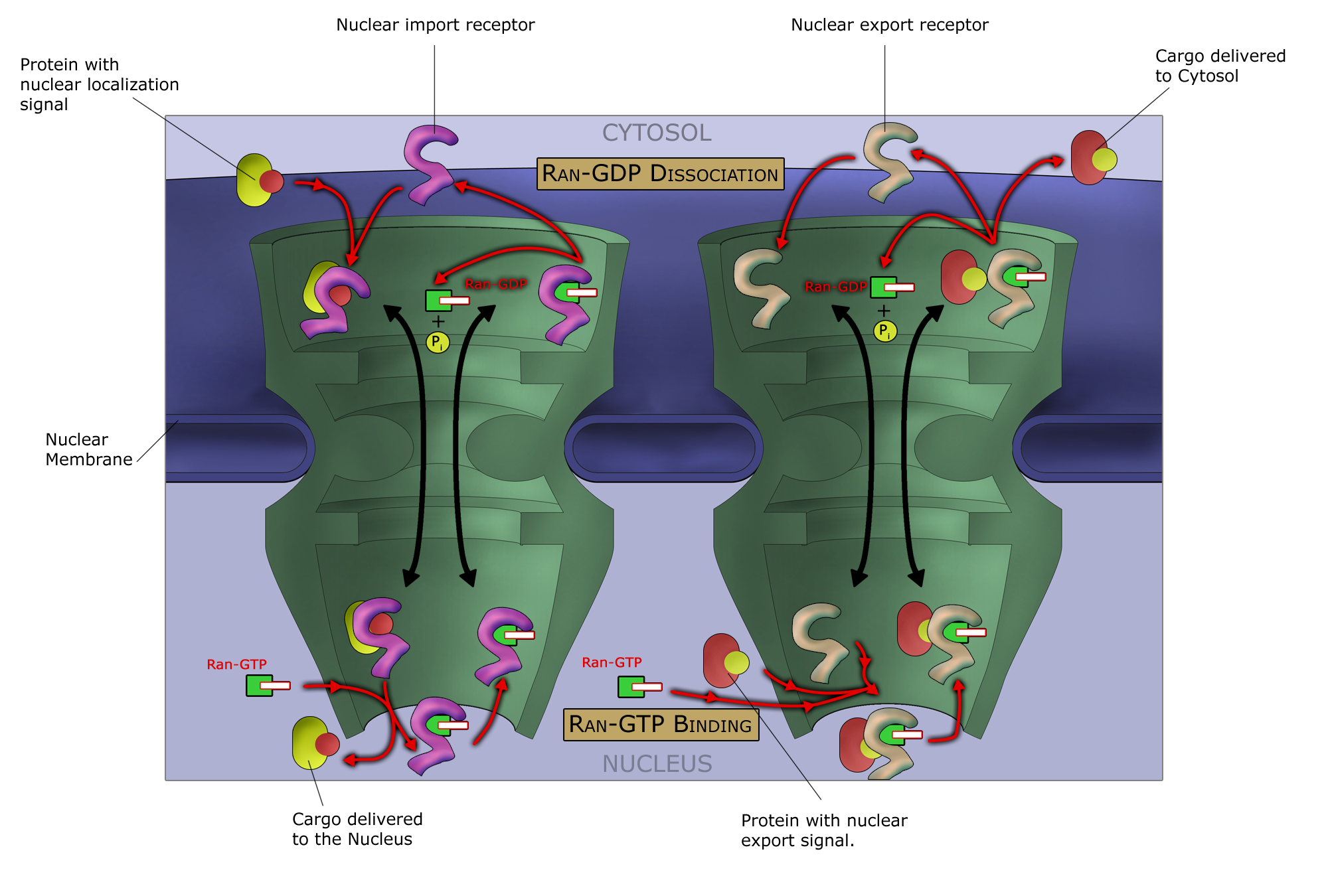
RNA, 단백질과 같은 거대 분자는 핵으로 들어가기 위해 임포틴과 결합해야 하고, 핵에서 나가기 위해서는 엑스포틴과 결합해야 한다. "화물" 단백질에는 핵 국소화 신호라는 아미노산 서열이 있어 임포틴과 결합하고, 핵에서 세포질로 수송되는 단백질에는 핵 수출 신호가 있어 엑스포틴과 결합한다. 임포틴과 엑스포틴의 수송 능력은 GTPase에 의해 조절되며, 핵 수송의 핵심 GTPase는 Ran이다. Ran은 핵 또는 세포질에 있는지에 따라 GTP 또는 GDP(구아노신 이인산)에 결합한다. 임포틴은 화물에서 분리되기 위해 RanGTP가 필요하고, 엑스포틴은 화물에 결합하기 위해 RanGTP가 필요하다.[14]
핵 내 수송은 임포틴이 세포질에서 화물에 결합하여 핵공을 통해 핵으로 운반하는 것에 의존한다. 핵 내부에서 RanGTP는 화물을 임포틴에서 분리하여 임포틴이 핵을 빠져나가 재사용될 수 있도록 한다. 핵 수출도 유사하게 엑스포틴이 RanGTP에 의해 촉진되는 과정에서 핵 내부에서 화물에 결합하고, 핵공을 통해 빠져나가 세포질에서 화물과 분리된다.[64]
성숙한 mRNA와 tRNA는 전사 후 수정이 완료되면 세포질로 이동해야 하는데, 이때 특수 수출 단백질이 관여한다. 불완전하게 수정된 RNA는 세포에 부정적인 결과를 초래할 수 있으므로, 세포질에 도착하면 번역 대신 분해된다.[13]
6. 핵의 조립 및 분해
세포 분열 과정에서 핵막은 분해되었다가 다시 조립된다. 대부분의 세포에서 핵막의 해체는 세포 분열 전기 말기에 일어난다. 그러나 핵 해체는 세포 분열의 보편적인 특징은 아니며, 일부 단세포생물 진핵생물 (효모 등)에서는 이른바 "폐쇄형 유사분열"이 일어나며, 핵막은 유지된다. 폐쇄형 유사분열에서는 딸 염색체가 핵의 양극으로 이동한 후 두 개로 분할된다. 반면 고등 진핵생물 세포에서는 일반적으로 "개방형 유사분열"이 일어나며, 핵막의 붕괴가 특징이다. 딸 염색체는 방추사의 양극으로 이동하고, 새로운 핵이 그 주변에서 재조립된다.[12]
세포 주기의 특정 시점에서 세포는 두 개로 분열되는데, 이때 새로운 딸세포 각각이 유전자의 완전한 세트를 가지도록 염색체를 복제하고 분리해야 한다. 이는 복제된 염색체 (자매 염색 분체)가 미세 소관을 통해 다른 중심체와 결합되도록 함으로써 수행된다. 그 후 자매 염색 분체는 세포의 별도 위치로 분리된다. 많은 세포에서 중심체는 핵 외부, 세포질에 위치하며, 핵막이 존재하면 미세 소관이 염색 분체에 결합할 수 없다.[65] 따라서 세포 주기 초기의 단계인 전기부터 전 중기 무렵까지 핵막은 분해된다.[18] 마찬가지로 같은 시기에 핵 라민도 분해되는데, 이는 CDC2와 같은 단백질 키나아제에 의한 라민의 인산화로 조절된다.[66] 세포 주기의 종료를 향해 핵막은 재형성되고, 거의 같은 시기에 핵 라민도 라민의 탈인산화에 의해 재조립된다.[66]
와편모조류에서는 핵막이 유지되며, 중심체는 세포질에 위치하고 있다. 미세 소관의 중심체 영역은 핵막에 포함되어 염색체와 접촉한다 (closed mitosis with extranuclear spindle). 다른 많은 원생생물(섬모충 및 포자충 등)과 균류는 중심체가 핵 내에 있기 때문에 세포 분열 중에도 핵막은 해체되지 않는다.[67]
세포 자멸사는 세포의 구조적 요소가 파괴되는 제어된 과정이며, 세포사가 유도된다. 세포 자멸사와 관련된 변화는 직접적으로 핵과 그 내용물에 영향을 미치며, 염색질은 농축되고, 핵막 및 핵 라민은 해체된다. 라민 네트워크의 파괴는 카스파제라고 불리는 세포 자멸사를 진행시키는 특별한 프로테아제에 의해 조절되며, 라민이 절단됨으로써 핵의 구조적 완전성이 파괴된다. 세포 자멸사의 초기 활성 분석에서 라민의 절단은 카스파제 활성의 실험적 지표로 사용되기도 한다.[18] 카스파제에 의해 절단되지 않는 변이형 라민을 발현하는 세포는 세포 자멸사와 관련된 핵의 변화가 나타나지 않으며, 라민이 세포 자멸사에 의한 핵의 분해를 시작하는 역할을 담당하고 있다는 것을 시사한다.[18] 라민의 중합 억제는 세포 자멸사의 유도 인자가 된다.[68]
핵막은 DNA 바이러스 및 RNA 바이러스가 핵으로 침투하는 것을 방지하는 장벽으로 기능한다. 몇몇 바이러스는 자신의 복제 및 조립을 위해 핵 내 단백질에 접근해야 한다. 헤르페스 바이러스와 같은 DNA 바이러스는 핵 내에서 복제 및 조립을 수행하고, 핵의 내막으로부터의 출아에 의해 외부로 나간다. 이 과정은 내막의 핵 측 라민의 분해를 동반한다.[18]
7. 세포당 핵의 수
대부분의 진핵 세포는 하나의 핵을 가지지만, 일부 세포는 핵이 없거나(무핵 세포) 여러 개의 핵을 가진다(다핵 세포).[70]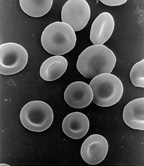
무핵 세포는 핵이 없어 딸세포를 생성하기 위해 분열할 수 없다. 대표적인 무핵 세포는 포유류의 적혈구로, 미토콘드리아 등 다른 세포 소기관도 없어 주로 산소 운반체 역할을 한다. 적혈구는 골수에서 적혈구 생성을 통해 성숙하며, 이 과정에서 핵, 세포 소기관, 리보솜을 잃는다. 핵은 적아구에서 망상적혈구로 분화하는 과정에서 배출된다.[71] 돌연변이 유발 물질은 일부 미성숙 "미세핵" 적혈구를 혈류로 방출시킨다.[72][73] 무핵 세포는 비정상적인 세포 분열로 인해 발생할 수도 있다. 꽃 식물에서는 사관에서 이러한 무핵세포가 발견된다.[74]
다핵 세포는 여러 개의 핵을 포함한다. 대부분의 극사류 원생동물[75]과 균근에 속하는 일부 균류[76]는 자연적으로 다핵 세포를 가진다. ''지아르디아''속 장내 기생충은 세포당 두 개의 핵을 가진다.[77] 섬모충은 단일 세포 내에 체세포 대핵과 생식계열 소핵의 두 종류 핵을 가진다.[78] 인간의 경우, 골격근 세포(근세포, 합포체)는 발달 과정에서 다핵화된다. 세포 주변부에 핵이 배열되어 근원섬유에 최대한의 세포 내 공간을 제공한다.[13] 인간의 다른 다핵 세포로는 파골 세포 (뼈 세포의 일종)가 있다. 단핵구와 대식세포의 융합으로 발생하는 거대 다핵 세포는 염증[79] 및 종양 형성[80]과 관련되기도 한다.
많은 수의 와편모조류는 두 개의 핵을 가지는데, 이 핵에는 와편모조류 유래 DNA와 공생 규조류 유래 DNA의 두 가지 뚜렷한 DNA 계통이 포함되어 있다.[81]
; 주요 다핵 세포
- 골격근의 근세포: 근육의 장축 방향으로 뻗어 있는 매우 큰 세포로, 하나의 세포를 근섬유라고도 부른다. 근육 분화 과정에서 다수의 근아세포가 세포 융합을 통해 만들어진다. 긴 근육의 처음부터 끝까지 강한 힘을 내기 위해, 세포 내에 규칙적으로 배열된 근원섬유(액틴과 미오신)에 의해 발생한 장력을 효율적으로 근육 전체의 힘으로 만들기 위해 도움이 된다고 생각된다.[107]
- 태반의 융모막 융모의 융합영양막 세포: 태반에 있으며, 태아의 혈액과 모체의 혈액이 섞이지 않도록 하는 "태반 관문"을 구성한다. 태아의 혈관이 지나는 융모막 융모의 바깥쪽을 덮고, 그 바깥쪽의 모체 혈액과의 사이에서 물질이 자유롭게 이동할 수 없도록 한다. 세포성 영양막이 세포 융합하여 형성된다.
- 골수 조혈 세포의 거핵구: 혈소판의 근원이 되는 세포로 골수에 존재하며 주변 세포보다 훨씬 크다.
- 뼈 속의 파골세포: 뼈를 녹여 재구성에 관여한다.
8. 진화
세포핵은 진핵세포를 정의하는 주요 특징으로, 그 기원에 대해 많은 추측이 있어왔다. 세포핵의 존재를 설명하기 위해 제안된 주요 가설은 4가지가 있지만, 널리 지지받는 가설은 아직 없다.[82][83][84]
- 공생 모델: 고세균과 세균 사이의 공생 관계에서 핵이 유래되었다는 가설이다. 고세균과 세균은 세포핵이 없다.[85] 이 가설은 미토콘드리아와 엽록체의 기원에 대한 정설과 유사한데, 이들은 원시 진핵생물과 호기성 세균의 공생 관계에서 발달한 것으로 여겨진다.[86] 핵의 고세균 기원은 고세균과 진핵생물이 히스톤 등 특정 단백질의 유사한 유전자를 가진다는 점, 점액세균이 운동성이 있고 다세포 복합체를 형성하며 진핵생물과 유사한 키나아제와 G 단백질을 가진다는 점에서 지지받는다.[89] 핵막은 미토콘드리아 기원 이후 고세균 숙주에서 새로운 막 시스템으로 나타났으며,[87] 원시 미토콘드리아에서 생성된 손상적인 활성 산소로부터 유전체를 보호하는 역할을 했을 수 있다.[88]
- 바이러스 진핵생물 발생 가설: 막으로 둘러싸인 핵이 바이러스 감염에서 비롯되었다는 가설이다. 이 가설은 진핵생물과 바이러스가 선형 DNA 가닥, mRNA 캡핑, 단백질에 대한 강한 결합(히스톤을 바이러스 외피에 비유) 등에서 유사성을 보인다는 점에 기반한다.[92] 핵이 포식작용과 함께 진화하여 초기 세포 "포식자"를 형성했다는 주장과[92] 진핵생물이 두창바이러스에 감염된 초기 고세균에서 기원했다는 주장이 있다.[93][94] 성의 진화 문제도 이 가설과 관련이 있을 수 있다고 제안되었다.[95]
- 외막 가설: 핵이 단일 조상 세포에서 기원했으며, 이 세포가 두 번째 외부 세포막을 진화시켜 핵막이 형성되었다는 가설이다. 내부 막은 원래 세포를 둘러싸고 있었으며, 이후 리보솜 서브유닛과 같은 내부 합성 세포 구성 요소의 통과를 위해 정교한 기공 구조로 진화했다.[96]
- 기타 가설: 원시 진핵세포가 공생 단계를 거치지 않고 세균에서 진화했다는 모델은 원시 기공 및 기타 구획화된 막 구조를 가진 핵 구조를 가진 현대 플랑크토마이세테스 세균의 존재에 기반한다.[90] 크로노사이트와 같은 진핵생물 유사 세포가 먼저 진화하여 포식작용을 통해 고세균과 세균을 포획하여 핵과 진핵세포를 생성한다는 주장도 있다.[91]
참조
[1]
간행물
Chromatin dynamics at DNA replication, transcription and repair
2004-06
[2]
간행물
The end adjusts the means: heterochromatin remodelling during terminal cell differentiation
[3]
간행물
Specific staining of human chromosomes in Chinese hamster x man hybrid cell lines demonstrates interphase chromosome territories
https://epub.ub.uni-[...]
1985-12
[4]
간행물
Structure and function in the nucleus
http://azolla.fc.ul.[...]
1998-04
[5]
간행물
Active and inactive genes localize preferentially in the periphery of chromosome territories
http://intl.jcb.org/[...]
1996-12
[6]
간행물
The relation of immunoglobulin class, pattern of anti-nuclear antibody, and complement-fixing antibodies to DNA in sera from patients with systemic lupus erythematosus
1967-11
[7]
간행물
Frequency of anti-nuclear antibodies in multiple sclerosis
1995-02
[8]
간행물
A systematic genomic screen implicates nucleocytoplasmic transport and membrane growth in nuclear size control
2017-05
[9]
서적
Molecular Biology of the Cell
Garland Science
2015
[10]
간행물
Yeast nucleoporins involved in passive nuclear envelope permeability
2000-05
[11]
서적
Essential cell biology
2019
[12]
서적
Molecular Cell Biology
W.H. Freeman
2016
[13]
서적
Molecular Cell Biology
https://archive.org/[...]
WH Freeman
[14]
간행물
Mechanisms of receptor-mediated nuclear import and nuclear export
2005-03
[15]
서적
Molecular Biology of the Cell
Garland Science
[16]
간행물
Nuclear lamins: their structure, assembly, and interactions
[17]
간행물
Pathway of incorporation of microinjected lamin A into the nuclear envelope
1992-11
[18]
간행물
Nuclear lamins: building blocks of nuclear architecture
2002-03
[19]
간행물
Dynamics of nuclear lamina assembly and disassembly
https://books.google[...]
2004
[20]
간행물
Nuclear lamins A and B1: different pathways of assembly during nuclear envelope formation in living cells
2000-12
[21]
간행물
Alteration of nuclear lamin organization inhibits RNA polymerase II-dependent transcription
2002-02
[22]
간행물
Aging and nuclear organization: lamins and progeria
https://zenodo.org/r[...]
2004-06
[23]
간행물
Nucleolus: from structure to dynamics
https://hal.archives[...]
2006-01
[24]
간행물
Nuclear substructure and dynamics
2003-10
[25]
간행물
Nuclear speckles
2011-02
[26]
간행물
p53 mediates target gene association with nuclear speckles for amplified RNA expression
2021-03
[27]
간행물
Nuclear speckles: a model for nuclear organelles
2003-08
[28]
간행물
Differential dynamics of splicing factor SC35 during the cell cycle
http://www.ias.ac.in[...]
2008-09
[29]
간행물
Differential dynamics of splicing factor SC35 during the cell cycle
2008-09
[30]
간행물
Subnuclear organelles: new insights into form and function
2006-01
[31]
웹사이트
Cellular component Nucleus speckle
https://www.uniprot.[...]
UniProt: UniProtKB
2013-08-30
[32]
간행물
Assembly of the nuclear transcription and processing machinery: Cajal bodies (coiled bodies) and transcriptosomes
1999-12
[33]
간행물
Non-coding RNAs: lessons from the small nuclear and small nucleolar RNAs
2007-03
[34]
간행물
Genome organization around nuclear speckles drives mRNA splicing efficiency.
2024-05
[35]
간행물
Coiled bodies and gems: Janus or gemini?
1998-08
[36]
논문
Of coiled bodies, gems, and salmon
1998-08
[37]
논문
Targeting SMN to Cajal bodies and nuclear gems during neuritogenesis
2004-06
[38]
논문
Cajal bodies: a long history of discovery
[39]
서적
Cell Biology
https://archive.org/[...]
Saunders
[40]
논문
Functional architecture in the cell nucleus
2001-06
[41]
논문
Paraspeckles: nuclear bodies built on long noncoding RNA
2009-09
[42]
논문
Nemaline myopathy with intranuclear rods--intranuclear rod myopathy
1997-01
[43]
논문
Compartmentalization within the nucleus: discovery of a novel subnuclear region
1991-11
[44]
논문
Regional and temporal specialization in the nucleus: a transcriptionally-active nuclear domain rich in PTF, Oct1 and PIKA antigens associates with specific chromosomes early in the cell cycle
1998-03
[45]
논문
Nuclear bodies and compartments: functional roles and cellular signalling in health and disease
2004-10
[46]
논문
PML nuclear bodies
2010-05
[47]
논문
Paraspeckles
2010-07
[48]
웹사이트
Nuclear Compartments: Paraspeckles
http://npd.hgu.mrc.a[...]
Nuclear Protein Database
2007-03-06
[49]
논문
P54nrb forms a heterodimer with PSP1 that localizes to paraspeckles in an RNA-dependent manner
2005-11
[50]
논문
Molecular dissection of nuclear paraspeckles: towards understanding the emerging world of the RNP milieu
2018-10
[51]
논문
Nuclear paraspeckles function in mediating gene regulatory and apoptotic pathways
2019-12
[52]
논문
Clastosome: a subtype of nuclear body enriched in 19S and 20S proteasomes, ubiquitin, and protein substrates of proteasome
2002-08
[53]
논문
LPS-induced down-regulation of signal regulatory protein {alpha} contributes to innate immune activation in macrophages
2007-10
[54]
논문
Orphan nuclear bodies
2010-09
[55]
논문
Stress induced nuclear granules form in response to accumulation of misfolded proteins in Caenorhabditis elegans
2017-04
[56]
서적
Lehninger principles of biochemistry
https://archive.org/[...]
Worth Publishers
[57]
논문
Glucose sensing through the Hxk2-dependent signalling pathway
2005-02
[58]
논문
Transport between the cell nucleus and the cytoplasm
[59]
논문
Replication factories
1994-02
[60]
서적
Protein Synthesis and Ribosome Structure: Translating the Genome
Wiley-VCH
[61]
서적
Genome Structure and Function: From Chromosomes Characterization to Genes Technology
Springer
[62]
논문
Mechanisms of alternative pre-messenger RNA splicing
https://cloudfront.e[...]
[63]
서적
Molecular Biology of the Gene
Peason Benjamin Cummings; CSHL Press.
[64]
논문
The RanGTP Pathway: From Nucleo-Cytoplasmic Transport to Spindle Assembly and Beyond
2015
[65]
논문
Cell biology: ripping up the nuclear envelope
https://zenodo.org/r[...]
2002-03
[66]
논문
Phosphorylation of transcription factors and control of the cell cycle
[67]
논문
The cell biology of open and closed mitosis
2013
[68]
논문
Mistargeting of B-type lamins at the end of mitosis: implications on cell survival and regulation of lamins A/C expression
2001-04
[69]
논문
IgG deposits can be detected in cell nuclei of patients with both lupus erythematosus and malignancy
2007-11
[70]
서적
Normal cell morphology in canine and feline cytology: an identification guide
John Wiley & Sons
2017
[71]
논문
Comparative study of nuclear expulsion from the late erythroblast and cytokinesis
1970-06-01
[72]
논문
Enumeration of micronucleated reticulocytes in rat peripheral blood: a flow cytometric study
2000-02-01
[73]
논문
Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry
[74]
논문
The angiosperm phloem sieve tube system: a role in mediating traits important to modern agriculture
2014-04-01
[75]
논문
Phylogenetic relationships between the Acantharea and the Polycystinea: a molecular perspective on Haeckel's Radiolaria
1997-10-01
[76]
논문
The number of nuclei in basidiospores of 63 species of ectomycorrhizal Homobasidiomycetes
[77]
논문
The biology of Giardia spp
1991-12-01
[78]
논문
Transposon Domestication versus Mutualism in Ciliate Genome Rearrangements
2013-08-01
[79]
논문
Interleukin 4 induces cultured monocytes/macrophages to form giant multinucleated cells
1988-02-01
[80]
논문
Human giant cell tumors of bone identification and characterization of cell types
1987-02-01
[81]
논문
Tertiary endosymbiosis in two dinotoms has generated little change in the mitochondrial genomes of their dinoflagellate hosts and diatom endosymbionts
[82]
논문
Evolutionary biology. The birth of the nucleus
2004-08-01
[83]
논문
Evolution of the nucleus
2014-06-01
[84]
논문
Open Questions on the Origin of Eukaryotes
2015-11-01
[85]
서적
Encyclopedia of Earth
National Council for Science and the Environment
2010-01-01
[86]
서적
Symbiosis in Cell Evolution
https://archive.org/[...]
W. H. Freeman and Company
[87]
논문
Archaebacteria (Archaea) and the origin of the eukaryotic nucleus
null
2005-12-01
[88]
간행물
Sexual Communication in Archaea, the Precursor to Eukaryotic Meiosis
Springer, Cham
2017-01-01
[89]
논문
Selective forces for the origin of the eukaryotic nucleus
2006-05-01
[90]
논문
Intracellular compartmentation in planctomycetes
[91]
논문
The origin of the eukaryotic cell: a genomic investigation
2002-02-01
[92]
논문
Viral eukaryogenesis: was the ancestor of the nucleus a complex DNA virus?
2001-09-01
[93]
논문
Poxviruses and the origin of the eukaryotic nucleus
2001-05-01
[94]
논문
A hypothesis for DNA viruses as the origin of eukaryotic replication proteins
2000-08-01
[95]
논문
Sex and the eukaryotic cell cycle is consistent with a viral ancestry for the eukaryotic nucleus
2006-11-01
[96]
논문
The origin of the eukaryotic cell based on conservation of existing interfaces
[97]
서적
Opera Omnia, seu Arcana Naturae ope exactissimorum Microscopiorum detecta, experimentis variis comprobata, Epistolis ad varios illustres viros J. Arnold et Delphis, A. Beman, Lugdinum Batavorum
Verlag Harri Deutsch
2009-01-01
[98]
논문
The cytomorphic system of anucleate non-mammalian erythrocytes
[99]
서적
The Birth of the Cell
https://archive.org/[...]
Yale University Press
[100]
논문
On the Organs and Mode of Fecundation of Orchidex and Asclepiadea
[101]
서적
Von der Zellenlehre zur Chromosomentheorie
Springer Verlag
[102]
간행물
Opera Omnia, seu Arcana Naturae ope exactissimorum Microscopiorum detecta, experimentis variis comprobata, Epistolis ad varios illustres viros
Verlag Harri Deutsch
2009-01-01
[103]
논문
The nucleus introduced
https://www.ncbi.nlm[...]
2011-05-01
[104]
서적
The Birth of the Cell
Yale University Press
[105]
논문
On the Organs and Mode of Fecundation of Orchidex and Asclepiadea
[106]
서적
Von der Zellenlehre zur Chromosomentheorie
http://www.t-cremer.[...]
Springer Verlag
[107]
서적
Molecular Cell Biology
WH Freeman
[108]
서적
Molecular Biology of the Cell, Chapter 4, pages 191–234
Garland Science
[109]
논문
Properties and metabolism of the aqueous cytoplasm and its boundaries
http://ajpregu.physi[...]
1984-02
[110]
논문
Nuclear envelope permeability
[111]
서적
Human Physiology
Saunders College Publishing
[112]
논문
Yeast nucleoporins involved in passive nuclear envelope permeability
[113]
논문
Mechanisms of receptor-mediated nuclear import and nuclear export
[114]
논문
Nuclear lamins: their structure, assembly, and interactions
[115]
논문
Pathway of incorporation of microinjected lamin A into the nuclear envelope
[116]
논문
The LINC complex and human disease
http://www.biochemso[...]
2011-12-01
[117]
논문
Nuclear lamins: building blocks of nuclear architecture
http://www.genesdev.[...]
[118]
논문
Nuclear Lamins A and B1: Different Pathways of Assembly during Nuclear Envelope Formation in Living Cells
[119]
논문
Alteration of nuclear lamin organization inhibits RNA polymerase II–dependent transcription
[120]
논문
Aging and nuclear organization: lamins and progeria
[121]
논문
Chromatin dynamics at DNA replication, transcription and repair
[122]
논문
The end adjusts the means: heterochromatin remodelling during terminal cell differentiation
[123]
논문
Specific staining of human chromosomes in Chinese hamster x man hybrid cell lines demonstrates interphase chromosome territories
http://www.springerl[...]
Springer Berlin / Heidelberg
1985-12
[124]
논문
Structure and Function in the Nucleus
1998-04-24
[125]
논문
Active and inactive genes localize preferentially in the periphery of chromosome territories
http://intl.jcb.org/[...]
The Rockefeller University Press
[126]
논문
The Relation of Immunoglobulin Class, Pattern of Antinuclear Antibody, and Complement-Fixing Antibodies to DNA in Sera from Patients with Systemic Lupus Erythematosus
[127]
논문
Frequency of anti-nuclear antibodies in multiple sclerosis
[128]
논문
Nucleolus: from structure to dynamics
https://hal.archives[...]
[129]
논문
Nuclear substructure and dynamics
2003-10
[130]
논문
Cajal bodies: a long history of discovery
[131]
논문
Clastosome: A Subtype of Nuclear Body Enriched in 19S and 20S Proteasomes, Ubiquitin, and Protein Substrates of Proteasome
http://www.molbiolce[...]
2002-08-01
[132]
서적
Cell Biology
Saunders
[133]
논문
Functional architecture in the cell nucleus
[134]
논문
Paraspeckles: nuclear bodies built on long noncoding RNA
[135]
논문
Nemaline myopathy with intranuclear rods—intranuclear rod myopathy
1997-01
[136]
논문
Coiled Bodies and Gems: Janus or Gemini?
[137]
논문
Of Coiled Bodies, Gems, and Salmon
[138]
논문
Targeting SMN to Cajal bodies and nuclear gems during neuritogenesis.
2004-06
[139]
논문
Compartmentalization within the nucleus: discovery of a novel subnuclear region.
[140]
논문
Regional and temporal specialization in the nucleus: a transcriptionally active nuclear domain rich in PTF, Oct1 and PIKA antigens associates with specific chromosomes early in the cell cycle
[141]
논문
PML Nuclear Bodies
[142]
논문
Nuclear speckles: a model for nuclear organelles
2003-08
[143]
논문
Differential dynamics of splicing factor SC35 during the cell cycle
http://www.ias.ac.in[...]
2008-09
[144]
논문
Differential dynamics of splicing factor SC35 during the cell cycle
[145]
논문
Nuclear speckles: a model for nuclear organelles
2003-08
[146]
논문
Subnuclear organelles: new insights into form and function
2006-01
[147]
웹사이트
Cellular component Nucleus speckle
https://www.uniprot.[...]
2013-08-30
[148]
논문
Assembly of the Nuclear Transcription and Processing Machinery: Cajal Bodies (Coiled Bodies) and Transcriptosomes
1999-12
[149]
논문
Non-coding RNAs: lessons from the small nuclear and small nucleolar RNAs
http://www.nature.co[...]
2013-08-09
[150]
논문
Paraspeckles: A Novel Nuclear Domain
[151]
웹사이트
Nuclear Compartments: Paraspeckles
http://npd.hgu.mrc.a[...]
Nuclear Protein Database
2007-03-06
[152]
논문
P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner
http://www.molbiolce[...]
[153]
논문
LPS-induced down-regulation of signal regulatory protein α contributes to innate immune activation in macrophages
2007-10-29
[154]
논문
Orphan Nuclear Bodies
2010-09
[155]
논문
Stress induced nuclear granules form in response to accumulation of misfolded proteins in Caenorhabditis elegans
2017-04-19
[156]
서적
Lehninger principles of biochemistry
Worth Publishers
[157]
논문
Glucose sensing through the Hxk2-dependent signalling pathway.
[158]
논문
Transport between the cell nucleus and the cytoplasm
[159]
서적
Protein Synthesis and Ribosome Structure: Translating the Genome
Wiley-VCH
[160]
서적
Genome Structure and Function: From Chromosomes Characterization to Genes Technology
Springer
[161]
서적
Molecular Biology of the Gene
Peason Benjamin Cummings; CSHL Press.
[162]
논문
Cell biology: Ripping up the nuclear envelope
2002-03-07
[163]
논문
Phosphorylation of transcription factors and control of the cell cycle
[164]
논문
Mistargeting of B-type lamins at the end of mitosis: implications on cell survival and regulation of lamins A/C expression
[165]
간행물
IgG deposits can be detected in cell nuclei of patients with both lupus erythematosus and malignancy.
Clin Rheumatol
2007-11-01
[166]
논문
Phylogenetic relationships between the Acantharea and the Polycystinea: A molecular perspective on Haeckel's Radiolaria
[167]
논문
The number of nuclei in basidiospores of 63 species of ectomycorrhizal Homobasidiomycetes
[168]
논문
The biology of Giardia spp
http://mmbr.asm.org/[...]
1991-12
[169]
논문
Interleukin 4 induces cultured monocytes/macrophages to form giant multinucleated cells
[170]
논문
Human giant cell tumors of bone identification and characterization of cell types
[171]
논문
Tertiary endosymbiosis in two dinotoms has generated little change in the mitochondrial genomes of their dinoflagellate hosts and diatom endosymbionts
[172]
논문
Comparative study of nuclear expulsion from the late erythroblast and cytokinesis
1970-06
[173]
논문
Enumeration of micronucleated reticulocytes in rat peripheral blood: a flow cytometric study
[174]
논문
Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry
[175]
논문
Evolutionary biology. The birth of the nucleus
[176]
웹사이트
'Archaea'
http://www.eoearth.o[...]
National Council for Science and the Environment, Washington DC.
2011-05-11
[177]
서적
Symbiosis in Cell Evolution
W. H. Freeman and Company
[178]
논문
Selective forces for the origin of the eukaryotic nucleus
[179]
논문
Intracellular compartmentation in planctomycetes
[180]
논문
The origin of the eukaryotic cell: a genomic investigation
[181]
논문
Viral eukaryogenesis: was the ancestor of the nucleus a complex DNA virus?
2001-09
[182]
논문
Poxviruses and the origin of the eukaryotic nucleus
[183]
논문
A hypothesis for DNA viruses as the origin of eukaryotic replication proteins
[184]
논문
Sex and the eukaryotic cell cycle is consistent with a viral ancestry for the eukaryotic nucleus
2006-11
[185]
논문
The origin of the eukaryotic cell based on conservation of existing interfaces
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com