엽록체
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
엽록체는 엽록소를 포함하여 녹색을 띠는 세포 소기관으로, 빛 에너지를 이용하여 포도당을 합성하는 광합성을 수행한다. 세포 내 공생설에 따르면 엽록체는 미토콘드리아와 함께 세포내 공생체이며, 독자적인 DNA와 리보솜을 가지고 있다. 엽록체는 틸라코이드, 그라나, 스트로마를 포함하는 내부 구조를 가지며, 분열을 통해 증식한다. 엽록체는 식물, 조류 등 다양한 생물에서 발견되며, 광합성 외에도 질소 대사, 아미노산 합성 등 다양한 생명 활동에 기여한다. 엽록체는 시아노박테리아가 진핵생물 세포 내로 공생하면서 유래한 것으로 추정되며, 2차 및 3차 공생을 통해 여러 생물에서 다양한 형태와 구조를 갖게 되었다. 엽록체는 1차, 2차, 3차 엽록체 계통으로 분류되며, 각 계통은 고유한 특성을 나타낸다. 또한 엽록체는 광합성, 질소 대사, 아미노산 합성, 기타 화학 물질 생성 등 다양한 기능을 수행하며, 엽록체 DNA를 통해 유전된다.
더 읽어볼만한 페이지
- 세포소기관 - 소포 (세포)
소포는 막으로 둘러싸인 작은 주머니 모양의 구조물로, 세포 내 물질 수송, 소화, 분비, 세포간 신호 전달, 세포 외부 물질 소화 및 배출 등 다양한 기능을 수행하며, 특히 세포외소포체는 질병과의 연관성으로 주목받고 있고, 클라트린, COPI, COPII, SNARE 단백질 등이 소포 형성 및 수송에 관여한다. - 세포소기관 - 세포막
세포막은 세포질을 둘러싸고 세포 내외부 환경을 구분하는 선택적 투과성 막으로, 인지질 이중층과 단백질, 탄수화물로 구성되어 물질 수송, 세포 형태 유지, 세포 간 신호 전달, 세포 접합 등의 기능을 수행하며, 유동 모자이크 모델로 설명된다. - 광합성 - 멜빈 캘빈
멜빈 캘빈은 광합성 과정의 탄소 고정 경로를 밝혀 1961년 노벨 화학상을 수상한 미국의 화학자로, 캘빈 순환을 규명하고 화학 생역학 연구소 설립, NASA 협력 등을 통해 과학 발전에 기여했다. - 광합성 - 명반응
명반응은 엽록체 틸라코이드 막에서 광계 II와 I을 통해 빛 에너지를 이용하여 ATP와 NADPH를 합성하고 물을 광분해하여 산소를 발생시키는 광합성의 첫 번째 단계이다.
| 엽록체 | |
|---|---|
| 개요 | |
![일반적인 고등 식물 엽록체의 구조. 녹색의 [[엽록소]]는 원반 모양의 [[틸라코이드]]가 쌓여 있는 곳에 들어 있다.](https://cdn.onul.works/wiki/noimage.png) | |
| 정의 | 광합성을 수행하는 세포 소기관 |
| 위치 | 식물, 조류 세포 내 |
| 구조 | |
| 외막 | 엽록체를 둘러싸는 바깥쪽 막 |
| 내막 | 엽록체를 둘러싸는 안쪽 막 |
| 스트로마 | 엽록체 내의 액체 공간 |
| 틸라코이드 | 스트로마 내부에 존재하는 납작한 주머니 모양의 구조 |
| 그라나 | 틸라코이드가 쌓여서 형성된 구조 |
| 틸라코이드 막 | 틸라코이드를 둘러싸는 막 |
| 틸라코이드 내강 | 틸라코이드 막으로 둘러싸인 공간 |
| 기능 | |
| 광합성 | 빛 에너지를 사용하여 이산화탄소와 물로부터 포도당을 합성하는 과정 |
| 탄소 고정 | 이산화탄소를 유기 분자로 전환하는 과정 |
| 산소 발생 | 광합성 과정에서 부산물로 산소를 생성하는 과정 |
| 기타 정보 | |
| 관련 용어 | 엽록소 카로티노이드 광계 ATP 합성 효소 캘빈 회로 |
2. 일반적 특징
엽록체는 엽록소(클로로필)를 다량 함유하여 뚜렷한 녹색을 띠므로, 현미경 관찰 시 쉽게 식별할 수 있다.[193] 일반적으로 노란색의 카로테노이드도 포함하지만, 엽록소 함량이 높아 녹색으로 보인다.[193] 그러나 갈조류는 푸코잔틴을 추가로 가져 갈색을 띠고, 홍조류는 피코빌린 색소 때문에 붉은색으로 보인다.[193]
엽록체는 빛에너지를 이용하여 포도당 등 유기물을 합성하는 광합성이 일어나는 세포 소기관이다. 종자식물에서는 주로 잎 세포에 풍부하지만, 줄기, 미성숙한 열매 등 다른 기관의 세포에서도 발견된다.[194]
세포내 공생설에 따르면, 엽록체는 미토콘드리아와 더불어 세포 내 공생을 통해 기원한 대표적인 소기관이다. 과거 진핵생물 세포가 광합성을 하는 원핵생물인 남조균류(시아노박테리아)와 유사한 생물을 받아들여 공생 관계를 형성하면서 엽록체로 분화되었다는 것이 정설이다(1차 공생). 그 증거로 엽록체는 핵과는 별개인 독자적인 원형 DNA(엽록체 DNA, cpDNA)와 리보솜을 가지며, 스스로 일부 단백질을 합성하고 복제할 수 있다. 엽록체의 이중막 구조 역시 공생의 증거로 제시되는데, 안쪽 막은 남조균류의 세포막, 바깥쪽 막은 숙주 진핵생물의 식세포 작용 유래 막에서 기원했을 것으로 추정되나[195], 확증은 없다.[195]
엽록체 내부는 스트로마라는 기질로 채워져 있으며, 이곳에는 엽록체 DNA, 리보솜, 광합성의 암반응(캘빈 회로) 관련 효소들이 존재한다. 스트로마 안에는 틸라코이드라는 납작한 막 주머니들이 복잡하게 배열되어 있다. 틸라코이드가 동전처럼 겹겹이 쌓인 구조를 그라나(단수형: 그라눔)라고 부른다. 틸라코이드 막에는 엽록소, 카로테노이드 같은 광합성 색소와 명반응 관련 단백질 복합체들이 있어 빛 에너지를 화학 에너지로 전환한다.
엽록체는 세포 분열과 독립적으로 스스로 분열하여 증식한다. 빛이 없는 조건에서는 엽록소를 합성하지 않아 백색체 상태로 존재하다가, 빛을 받으면 엽록소를 합성하여 녹색의 엽록체로 발달한다. 관다발 식물의 비광합성 세포(예: 뿌리 세포)에는 엽록체 대신 다른 색소체가 존재한다. 여기에는 녹말을 저장하는 녹말체(아밀로플라스트), 카로테노이드 색소를 저장하는 잡색체(크로모플라스트), 색소가 없는 백색체(류코플라스트) 등이 있다. 이들 모든 색소체는 엽록체와 마찬가지로 이중막 구조와 엽록체 DNA를 가진다.
엽록체의 형태, 크기, 세포당 개수는 생물 분류군에 따라 매우 다양하며, 특히 조류에서 높은 다양성을 보인다.
- 일부 단세포 조류는 세포당 1개의 구형 엽록체를 갖는다.[193]
- 다세포 조류에서는 컵 모양, 별 모양, 나선형(실이끼 등), 판상 등 다양한 형태의 큰 엽록체가 세포당 1개 또는 수 개 존재한다.[193]
- 육상 식물에서는 일반적으로 지름 5µm~10µm, 두께 2µm~3µm 정도의 볼록 렌즈 모양 또는 원반형 엽록체가 세포 하나당 수십 개에서 수백 개 포함된다.[193] 이들은 주로 세포 중앙의 큰 액포 때문에 세포벽 근처에 분포하며, 원형질 유동에 의해 이동한다.
조류의 엽록체는 고등 식물과 다른 특징을 보이기도 한다.
- 피레노이드: 많은 조류 엽록체 내 단백질성 구조로, 광합성 산물의 저장 물질 전환 및 저장에 관여하는 것으로 추정된다.
- 다중막 구조: 유글레나, 와편모충류, 클로라라크니온 조류 등 일부 조류는 삼중 또는 사중막 엽록체를 갖는다. 이는 1차 공생으로 엽록체를 얻은 진핵 조류를 다른 비광합성 진핵생물이 다시 세포 내 공생으로 받아들인 결과(2차 공생)로 해석된다.[197] 가장 바깥 막은 숙주 세포의 식포막 유래로 추정된다.[196]
- 누클레오모프: 클로라라크니온 조류[196]나 크립토조류 등에서 발견되는 퇴화한 핵 유사 구조물이다. 엽록체 막 사이에 존재하며, 2차 공생 과정에서 흡수된 진핵 조류의 핵 흔적으로 여겨진다.[197] 클로라라크니온 조류는 녹조류를 받아들인 것으로 밝혀졌다.[196]
3. 형태
엽록체는 광합성을 수행하는 세포 소기관으로, 색소체의 일종이다. 내부에 클로로필(엽록소)과 카로테노이드 등의 광합성 색소를 포함하고 있어 일반적으로 녹색으로 보인다.[193] 그러나 갈조류나 홍조류 등 일부 생물에서는 다른 색소의 영향으로 갈색이나 붉은색을 띠기도 한다.[193]
육상 식물의 엽록체는 대부분 지름 5µm에서 10µm, 두께 2µm에서 3µm 정도의 볼록 렌즈 모양 또는 원반상이다.[193][95][61] 반면, 조류에서는 해캄의 나선형 엽록체처럼[98][193] 컵 모양, 별 모양 등 매우 다양한 형태가 나타난다.[193] 엽록체의 구체적인 구조와 막 구성은 하위 문단에서 자세히 설명한다.
3. 1. 외부
엽록체의 형태는 분류군에 따라 다양하며, 일반적으로 조류에서 다양성이 높다.[193] 종자 식물 등 고등 식물의 엽록체는 대부분 지름 5µm~10µm, 두께 2µm~3µm 정도의 볼록 렌즈 모양 또는 원반상이다.[193][95][61] 현미경으로 보면 세포 중앙부의 액포 때문에 세포 바깥쪽에 배열된 것처럼 보이며,[193] 원형질 유동에 의해 이동하는 것을 관찰할 수 있다.[193]엽록체는 클로로필(엽록소)과 카로테노이드 같은 광합성 색소를 포함하여 일반적으로 녹색을 띤다.[193] 그러나 갈조류의 엽록체는 푸코잔틴을 추가로 가져 갈색으로 보이고, 홍조류는 피코빌린 색소를 가져 붉은색으로 보인다.[193]
조류에서는 엽록체의 형태가 훨씬 다양하다. 예를 들어, 해캄(Spirogyra)은 리본 모양의 엽록체가 원통형 세포 내부에 나선형으로 배열되어 있고,[98][193] ''Oedogonium''은 그물 모양,[96] ''Chlamydomonas''는 컵 모양,[97] ''Sirogonium''은 약간 꼬인 띠 모양의 엽록체를 가진다.[99] 또한 ''Zygnema''에서는 별 모양,[100][193] Desmidiales에서는 세포 절반의 형태를 따르는[101] 등 다양한 형태가 존재한다. 일부 ''Chlorella'' 종처럼 컵 모양 엽록체가 세포의 대부분을 차지하는 경우도 있다.[103]
모든 엽록체는 최소한 세 개의 막 시스템을 가지는데, 이는 바깥쪽 엽록체 막, 안쪽 엽록체 막, 그리고 틸라코이드 시스템이다. 엽록체를 둘러싸는 가장 바깥쪽의 두 세포막(외막과 내막)은 조상 시아노박테리아의 그람 음성 세포벽 막에 해당하며,[24][105][106] 숙주 세포의 식포막에서 유래한 것이 아니다.[24] 이 이중 막 구조는 엽록체가 공생을 통해 기원했다는 증거로 자주 언급된다.
조류 중 일부는 2차 공생이나 3차 공생의 결과로 삼중 혹은 사중의 막으로 둘러싸인 엽록체를 가지기도 한다.[25] 예를 들어 클로라라크니온 조류의 엽록체는 사중 막 구조이며, 이는 녹조류를 세포 내에 받아들여 형성된 것으로 여겨진다.[196][197]
바깥쪽 엽록체 막은 이온과 같은 작은 분자들이 쉽게 통과할 수 있는 반투과성 막이다.[109] 하지만 더 큰 단백질은 통과하지 못하며, 세포 세포질에서 합성된 엽록체 단백질은 TOC 복합체라는 수송체를 통해 막을 통과해야 한다.[89] 때때로 엽록체 외막은 세포질 쪽으로 돌출하여 스트로마를 포함하는 관 모양 구조인 스트로물을 형성하기도 한다.[110] 스트로물은 엽록체의 표면적을 늘려 막 수송을 효율적으로 만들거나 다른 세포 소기관과의 상호작용에 관여하는 것으로 추정된다.[112][114]
3. 2. 내부
1. 외막(Outer membrane)2. 막 사이 공간(Intermembrane space)
3. 내막(Inner membrane)
4. 스트로마(Stroma)
5. 틸라코이드 내강(Thylakoid Lumen)
6. 틸라코이드 막(Thylakoid membrane)
7. 그라나(Granum)
8. 틸라코이드(Thylakoid)
9. 녹말 과립(Starch granule)
10. 리보솜(Ribosome)
11. 엽록체 DNA(Plastidial DNA)
12. 플라스토글로불(Plastoglobule)]]
미토콘드리아와 유사하게 엽록체도 여러 막 구조로 둘러싸여 있다. 모든 엽록체는 최소한 세 개의 막 시스템을 가지고 있는데, 가장 바깥쪽부터 엽록체 외막(outer chloroplast membrane), 엽록체 내막(inner chloroplast membrane), 그리고 그 안에 틸라코이드 시스템(thylakoid system)이 있다.[104] 이 두 개의 외막과 내막은 엽록체의 조상으로 여겨지는 시아노박테리아의 그람 음성 세포벽에서 유래한 것으로 생각된다.[24][105][106] 흔히 엽록체의 이중 막이 공생 과정에서 숙주 세포막이 시아노박테리아를 감싸면서 형성되었다고 오해하지만, 실제로는 두 막 모두 시아노박테리아 자체의 막과 상동 관계에 있다.[24] 외막과 내막 사이에는 막 사이 공간(intermembrane space)이 존재한다. 이차 공생 등으로 만들어진 엽록체는 이 세 막 바깥에 추가적인 막을 더 가질 수도 있다.[25]
엽록체 내막 안쪽 공간은 스트로마(stroma)라는 단백질이 풍부하고,[107] 알칼리성이며,[108] 수성 액체로 채워져 있으며, 이는 원래 시아노박테리아의 세포질에 해당한다.[107] 스트로마는 엽록체 부피의 상당 부분을 차지하며, 틸라코이드 시스템이 이 안에 떠 있다. 스트로마 안에는 고유한 엽록체 DNA(cpDNA)를 가진 핵양체, 엽록체 리보솜, 플라스토글로불리(plastoglobuli), 녹말 과립 및 다양한 단백질들이 존재한다. CO2를 고정하여 유기물을 합성하는 캘빈 회로가 바로 이 스트로마에서 일어난다.
엽록체 DNA(cpDNA)는 다양한 단백질과 결합하여 세포핵의 염색질과 유사한 구조를 이룬다. 그러나 진핵생물의 히스톤이나 세균의 DNA 결합 단백질(HU, DPS 등)은 녹색 식물 엽록체에는 없으며, 대신 아황산 환원 효소(sulfite reductase)가 DNA 결합 단백질 역할을 하는 것으로 알려져 있다. 엽록체 DNA 역시 세포핵 DNA처럼 복제, 전사, 번역 과정을 거쳐 유전 정보를 발현한다.
엽록체는 자체 리보솜을 가지고 있어 필요한 단백질의 일부를 스스로 합성한다. 엽록체 리보솜(70S)은 세균의 리보솜과 유사하지만,[14] 크기는 세포질 리보솜(80S)의 약 2/3(지름 약 17 nm 대 25 nm) 정도로 약간 작고,[115] 엽록체 고유의 특징을 가지며 세균보다 더 복잡한 번역 과정을 수행한다.[118][119] 엽록체 리보솜은 엽록체 DNA에서 전사된 mRNA 정보를 이용해 단백질을 만든다. 흥미롭게도 일부 녹조류나 유글레나 엽록체의 리보솜 작은 소단위체(small subunit) rRNA에는 대부분의 엽록체나 원핵생물에서 번역 개시에 중요한 역할을 하는 샤인-달가노 서열 인식 부위가 없다.[120][121][122] 또한 고등 식물에서는 세균의 23S rRNA 3' 말단과 상동성을 가지는 추가적인 4.5S rRNA가 발견된다.[119]
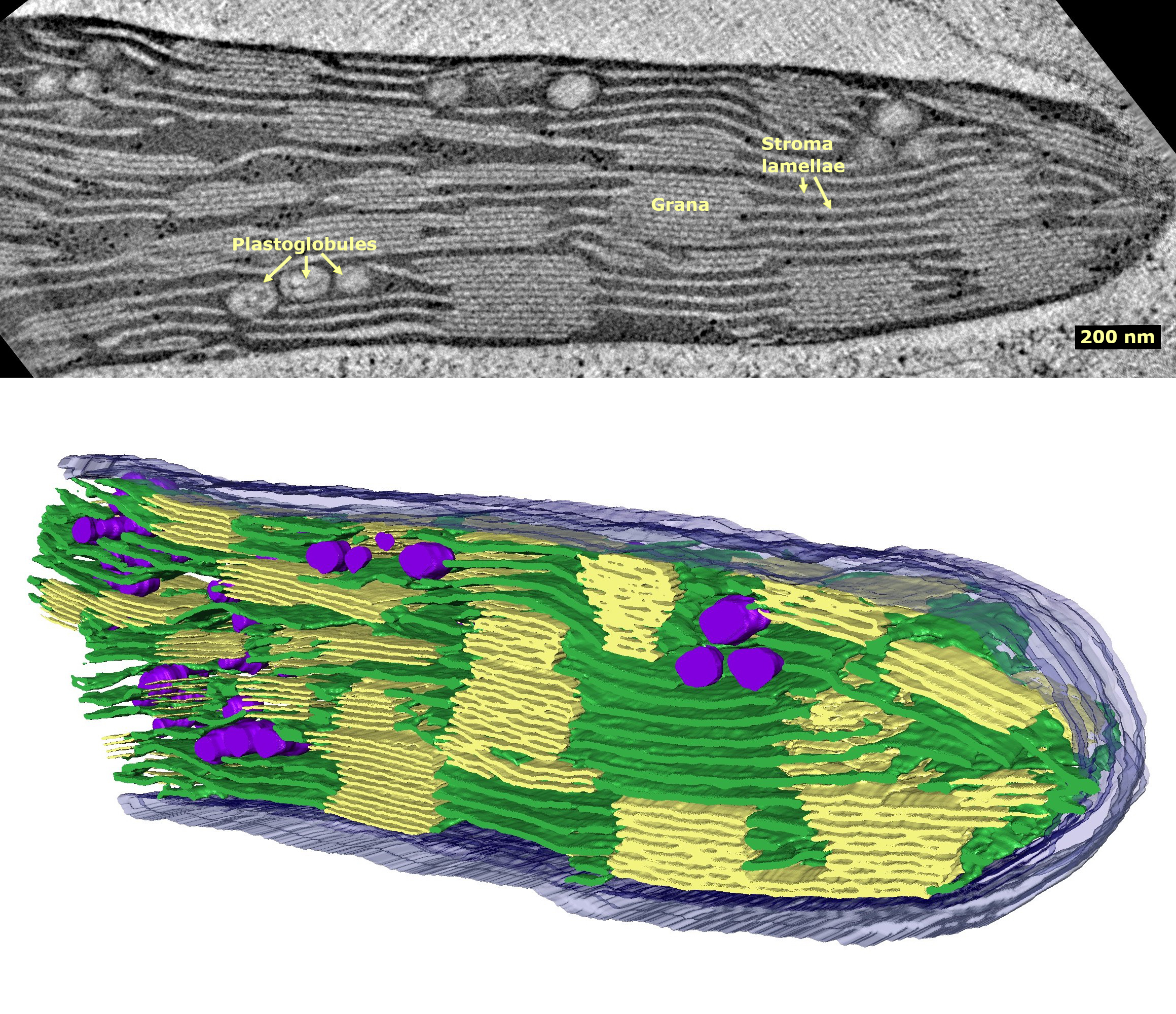
스트로마 내부에는 틸라코이드(thylakoid) 시스템이라는 막 구조물이 존재한다. 틸라코이드는 그리스어 'thylakos'(주머니)에서 유래한 이름처럼[133], 납작한 주머니 모양의 막 구조물들이 서로 연결되어 복잡한 네트워크를 이룬다.[132] 이 틸라코이드 막 위에 엽록소(클로로필)를 비롯한 광합성 색소들과 광합성의 명반응에 관여하는 다양한 단백질 복합체 및 효소들이 위치한다.[9] 따라서 명반응은 바로 이 틸라코이드 막에서 일어난다. 틸라코이드 내부의 빈 공간을 내강(lumen)이라고 부른다. 엽록체의 엽록소는 주로 가시광선 중 청색광과 적색광을 흡수하고 녹색광은 반사하거나 투과시키기 때문에 우리 눈에 녹색으로 보인다. 잎의 노화나 환경 스트레스(가뭄, 저온 등) 조건에서는 엽록소가 파괴되면서 원래 가려져 있던 카로티노이드나 크산토필 같은 보조 색소들의 색(노란색, 주황색 등)이 드러나 단풍이 들게 된다.
대부분의 관다발 식물 엽록체에서는 원반형의 틸라코이드들이 동전처럼 차곡차곡 쌓여 있는 구조를 만드는데, 이를 그라나(granum, 복수 grana)라고 한다.[136] 여러 개의 그라나들은 스트로마 라멜라(stroma lamella) 또는 단순히 라멜라(lamella)라고 불리는 막 구조를 통해 서로 연결되어 있다. 하지만 특정 C4 식물[147]이나 일부 조류의 엽록체에서는 그라나 구조 없이 틸라코이드들이 스트로마 내에 자유롭게 흩어져 있기도 한다.[102]
엽록체의 막 구조는 종종 미토콘드리아와 비교되지만, 기능적으로는 차이가 있다. 미토콘드리아의 내막은 전자전달계를 통해 양성자를 펌핑하고 산화적 인산화를 수행하여 ATP를 생산하는 핵심 장소이다. 엽록체에서 이와 유사한 기능을 하는 곳은 틸라코이드 막이다. 다만, 틸라코이드 막에서의 양성자(H+) 이동 방향은 미토콘드리아와 반대이다.[107][108] 한편, 엽록체 내막은 미토콘드리아 내막과 달리 ATP 합성에 직접 관여하지 않고, 대신 엽록체 안팎으로의 물질 출입을 조절하고 일부 지질이나 색소 등을 합성하는 역할을 한다.[107]
조류 엽록체의 내부 구조는 식물보다 더 다양하다. 많은 조류 엽록체에는 피레노이드(pyrenoid)라는 뚜렷한 단백질성 구조가 1개 또는 여러 개 존재한다. 피레노이드는 광합성 산물을 저장 물질로 전환하는 데 관여하는 것으로 생각되며, 예를 들어 녹조류에서는 녹말 합성이 일어나는 장소이다. 또한, 일부 조류(예: 클로라라크니온 조류)의 엽록체는 삼중 또는 사중 막으로 둘러싸여 있고, 막 사이 공간에 누클레오모프(nucleomorph)라는 퇴화된 세포핵 구조를 가지기도 한다. 이는 진핵생물이 다른 광합성 진핵생물을 세포 내로 받아들여 공생하는 이차 또는 삼차 공생의 결과로 해석된다.[196][197]
4. 기능
엽록체는 식물 세포의 대사 과정에서 매우 중요한 역할을 수행한다. 가장 잘 알려진 주요 기능은 광합성을 통해 빛 에너지를 화학 에너지로 변환하여 당 형태의 양분을 만드는 것이다. 광합성에는 물(H₂O)과 이산화 탄소(CO₂)가 원료로 사용되며, 빛 에너지를 이용하여 당과 산소(O₂)가 생성된다.
광합성은 크게 두 단계로 나뉜다.[158][155]
- '''명반응''': 빛 에너지를 직접 이용하는 단계이다. 엽록체 내 틸라코이드 막에서 일어나며, 물(H₂O)을 분해하여 산소(O₂)를 방출하고, 화학 에너지 저장 물질인 아데노신 삼인산(ATP)과 환원형 NADPH를 생성한다. 엽록체는 태양 빛 에너지를 흡수하여 엽록소의 전자를 들뜬 상태로 만들고, 이 전자가 다시 안정된 상태로 돌아가면서 방출하는 에너지를 이용하여 ATP와 NADPH를 만든다. 흡수된 빛 에너지 중 ATP와 NADPH 생성에 사용되지 않은 일부는 열에너지로 방출되기도 한다.
- '''암반응'''(캘빈 회로): 빛이 직접 필요하지 않은 단계이다. 엽록체의 스트로마에서 일어나며, 명반응에서 만들어진 ATP와 NADPH를 이용하여 이산화 탄소(CO₂)로부터 당과 같은 유기물을 합성한다.
광합성 외에도 엽록체는 식물 세포 대사의 중요한 중심으로서 다양한 기능을 수행한다. 여기에는 질소 대사, 아미노산 합성, 지질 합성, 색소 합성 등이 포함된다.
또한 엽록체는 세포핵의 DNA와는 별개로 독자적인 게놈 DNA와 리보솜을 가지고 있다. 이는 세포내 공생설에 따라, 과거 진핵생물의 조상이 광합성을 하는 원핵생물(현재의 남세균과 유사)을 세포 내로 받아들여 공생 관계를 형성한 결과로 여겨진다. 이 독자적인 유전 물질과 단백질 합성 기구를 통해 엽록체는 자신의 기능에 필요한 일부 단백질을 스스로 합성할 수 있다.
5. 색소체의 기원
엽록체의 기원은 세포내 공생설로 설명되며, 미토콘드리아와 함께 세포 내 공생을 통해 형성된 대표적인 세포 소기관으로 여겨진다. 현재 가장 유력한 가설은 산소 발생 광합성 세균인 시아노박테리아의 일종이 초기 진핵생물 세포 내로 들어가 공생 관계를 형성하면서 엽록체로 분화했다는 것이다. 이러한 생각은 1883년 안드레아스 프란츠 빌헬름 쉬페르가 엽록체와 시아노박테리아의 형태적 유사성을 관찰한 후, 1905년 러시아 생물학자 콘스탄틴 메레슈코프스키에 의해 처음으로 제안되었다.[11][3] 엽록체는 식물, 조류[12] 및 일부 아메바 종인 ''Paulinella''에서 발견된다.[13]
엽록체는 여러 측면에서 시아노박테리아와 유사한 특징을 보인다.
- 유전 물질: 독자적인 원형 DNA(엽록체 DNA, cpDNA)와 리보솜을 가지고 있어, 일부 단백질을 스스로 합성할 수 있다. 엽록체 DNA는 히스톤 없이 핵양체(nucleoid)를 형성하며, 특정 DNA 결합 단백질(예: 아황산 환원 효소)과 함께 존재한다.
- 막 구조: 미토콘드리아와 마찬가지로 외막과 내막의 이중막 구조를 가진다. 모든 색소체는 이 이중막 구조와 엽록체 DNA를 공유한다.
- 내부 구조: 엽록체 내부에는 광합성 반응이 일어나는 틸라코이드라는 막 구조가 있으며, 이는 시아노박테리아 내부의 광합성 막 구조와 유사하다.[9] 틸라코이드 막에는 엽록소 a를 포함한 광합성 색소가 존재한다.[102][10]
하지만 이러한 유사성에도 불구하고, 현존하는 특정 시아노박테리아나 그 근연종으로부터 엽록체가 직접 유래했다는 명확한 계통학적 증거는 아직 부족하다. 예를 들어, 엽록체의 광계1과 광계2는 각각 광합성 세균인 헬리오박테리아(Heliobacteria)와 클로로플렉서스(Chloroflexus)의 광계와 계통적으로 관련이 있을 것으로 추정되지만, 구성 단백질의 기능과 구조 면에서 상당한 차이를 보인다. 또한, 광합성 외 다른 엽록체 기능들의 기원에 대해서는 아직 불분명한 점이 많다.
엽록체는 독자적인 DNA를 가지고 있지만, 세포 내에서 완전히 독립적으로 기능하지는 못한다. 엽록체 기능에 필요한 단백질 중 상당수는 세포핵의 유전자 정보로부터 만들어져 엽록체 내부로 운반되어야 한다. 이러한 유전 정보의 이동과 소실 과정을 거치면서 엽록체의 게놈(genome)은 조상으로 여겨지는 시아노박테리아보다 훨씬 단순해졌으며, 이 때문에 엽록체만을 세포 밖에서 독립적으로 배양하는 것은 거의 불가능하다. 다만, 낭설목(Sacoglossa) 바다 달팽이 중 일부는 섭취한 해조류의 엽록체를 자신의 세포 내에 유지하며 광합성 산물을 얻는 예외적인 경우가 알려져 있다.[198]
엽록체의 기원은 한 번의 공생 사건으로 끝나지 않았을 수 있다. 부등편모조류(heterokonts), 유글레나류(Euglenozoa), 케르코조아(Cercozoa)와 같은 일부 원생생물의 엽록체는 3겹 또는 4겹의 막으로 둘러싸여 있다. 이는 이미 엽록체를 가지고 있는 진핵생물이 다른 진핵생물에게 통째로 잡아먹혀 다시 공생 관계를 형성하는 2차 세포내 공생이 일어났음을 시사한다. 예를 들어, 클로라라크니온 조류의 엽록체는 4중 막 구조를 가지는데, 가장 안쪽의 2겹 막이 원래 엽록체(녹조류 유래로 추정)이고, 세 번째 막은 공생한 녹조류의 세포막, 가장 바깥 막은 숙주 진핵생물의 식포막에서 유래한 것으로 해석된다. 이때 두 번째와 세 번째 막 사이에는 공생한 진핵생물의 핵이 퇴화된 흔적인 누클레오모프(nucleomorph)가 발견되기도 한다.[196][197] 이러한 2차 공생체가 다시 다른 진핵생물과 공생할 경우 3차 세포내 공생도 가능할 것으로 여겨진다.
엽록체는 식물과 조류의 종류에 따라 다양한 형태와 색소 구성을 보인다. 예를 들어, 홍조류의 엽록체(홍색체, rhodoplast)는 피코빌린 색소(피코에리트린 등)를 다량 함유하여 붉은색을 띠며[193][33], 녹조류와 육상 식물의 엽록체는 엽록소 a와 엽록소 b를 주로 가져 녹색을 띤다.[193] 조류의 엽록체에는 종종 피레노이드라는 단백질성 구조가 발견되는데, 이는 광합성 산물의 저장 및 전환에 관여하는 것으로 여겨진다.
6. 엽록체의 발견과 어원
엽록체("Chlorophyllkörnen", 엽록소 과립)에 대한 최초의 정확한 설명은 1837년 휴고 폰 몰이 녹색 식물 세포 내의 개별적인 구조물로 제시한 것이다.[2] 1883년, 안드레아스 프란츠 빌헬름 쉬퍼는 이 구조물들을 "엽록체"(''Chloroplastiden'')라고 명명했다.[3] 1884년, 에두아르트 스트라스부르거는 "엽록체"(''Chloroplasten'')라는 용어를 채택했다.[4][5][6]
단어 "엽록체"는 그리스어로 녹색을 의미하는 ''chloros''(χλωρός)와 "형성하는 것"을 의미하는 ''plastes''(πλάστης)에서 유래했다.[7]
7. 엽록체의 내공생 기원
엽록체는 광합성을 하는 진핵세포 내에 존재하는 세포 소기관 중 하나로, 색소체의 일종이다. 세포내 공생설에 따르면 엽록체는 미토콘드리아와 마찬가지로 세포 내 공생을 통해 기원했으며, 구체적으로 산소 발생 광합성을 하는 세균인 시아노박테리아가 과거 진핵생물 세포 안으로 들어가 공생 관계를 형성하면서 진화했다는 것이 정설이다.[8] 이 기원설은 1883년 안드레아스 프란츠 빌헬름 쉬페르의 관찰과 1905년 콘스탄틴 메레슈코프스키의 제안으로 구체화되었다.[11][3]
대부분의 식물과 조류[12]에서 발견되는 엽록체는 약 20억 년 전 단 한 번의 1차 내공생 사건에서 유래하여 공통 조상을 공유하는 것으로 여겨진다. 이후, 1차 내공생으로 엽록체를 얻은 진핵생물이 다른 진핵생물에게 다시 포획되는 2차 및 3차 내공생 과정을 통해 엽록체가 다른 생물 계통으로 확산되기도 했다. 모든 진핵생물이 미토콘드리아를 가지는 반면 엽록체는 일부만 가지므로, 엽록체의 내공생은 미토콘드리아 이후에 일어난 사건으로 추정된다.[14]
하지만 모든 엽록체가 이 공통된 경로를 따르는 것은 아니다. 아메바의 일종인 ''Paulinella'' 속(''P. chromatophora'', ''P. micropora'', ''P. longichromatophora'')은 다른 엽록체들과는 독립적으로, 비교적 최근인 약 9천만~1억 4천만 년 전에 ''Synechococcus'' 속의 시아노박테리아를 세포 내로 받아들여 '색소체'라고 불리는 독자적인 엽록체를 진화시켰다.[13][22][21][24] 이 ''Paulinella''의 색소체는 다른 엽록체에 비해 게놈 크기가 훨씬 크고 숙주 핵으로의 유전자 이전도 적게 일어났다는 특징을 보여[17][39], 초기 엽록체의 진화 과정을 연구하는 데 중요한 모델이 된다.[17]
엽록체는 독자적인 DNA와 리보솜을 가지지만[193], 오랜 공생 과정에서 많은 유전자를 숙주 세포의 핵으로 넘겨주었기 때문에 현재는 세포 없이는 독립적으로 생존하거나 증식할 수 없다. 다만, 낭설목(囊舌目, Sacoglossa)[198]의 일부 바다 달팽이처럼 해조류의 엽록체를 자신의 세포에 포획하여 광합성을 하는 예외적인 경우도 알려져 있다.
7. 1. 1차 내공생
엽록체는 광합성을 하는 진핵세포 내에 존재하는 세포 소기관의 한 종류로, 시아노박테리아로부터 세포 내 공생 과정을 통해 진화한 것으로 여겨진다.[8] 시아노박테리아는 산소 발생 광합성을 수행하는 세균의 일종으로, 엽록체와 마찬가지로 내부에 틸라코이드라는 막 구조를 가지고 있다.[9] 이 틸라코이드 막에는 엽록소 ''a''를 비롯한 광합성 색소가 포함되어 있다.[102][10]엽록체의 기원에 대한 이러한 생각은 1883년 안드레아스 프란츠 빌헬름 쉬페르가 엽록체가 시아노박테리아와 매우 유사하다는 점을 관찰하면서 시작되었고, 1905년 러시아 생물학자 콘스탄틴 메레슈코프스키에 의해 구체적으로 제안되었다.[11][3] 엽록체는 미토콘드리아와 마찬가지로 자체적인 DNA와 이중막(외막, 내막) 구조를 가지며, 이는 과거 독립적인 생물이었음을 시사하는 강력한 증거이다. 엽록체의 내막은 광합성에 관련된 단백질들로 구성되어 있는데, 이는 시아노박테리아의 세포막과 기능적으로 유사하다. 이러한 공통점 때문에, 미토콘드리아가 호기성 세균이 세포 내로 들어와 공생하면서 기원한 것처럼, 엽록체 역시 시아노박테리아가 다른 진핵생물 세포 내로 들어가 공생 관계를 형성(1차 내공생)하면서 만들어졌다고 본다.[14]
이 1차 내공생 사건을 통해 식물과 조류[12] 등 오늘날 우리가 아는 광합성 진핵생물의 조상이 탄생했다. 특히 녹조류와 육상 식물을 포함하는 엽록체류(Viridiplantae)는 1차 내공생의 대표적인 결과이다.[34] 엽록체류의 엽록체는 글라우코조류나 홍조류의 엽록체와 달리 피코빌리소체를 잃고 엽록소 ''b''를 가지게 되었으며, 이중 막 사이의 펩티도글리칸 벽이 사라졌다.[102] 또한, 광합성 산물인 녹말을 엽록체 내부에 저장하는 특징을 보인다.[102][43][34]
오랜 공생 과정에서 엽록체는 자신의 유전자 중 상당수를 숙주 세포의 핵으로 넘겨주었다. 이 때문에 엽록체는 조상인 시아노박테리아보다 훨씬 작은 게놈을 가지게 되었고, 생존에 필요한 단백질 중 일부를 핵의 유전자 정보에 의존하여 만들어야 한다. 따라서 엽록체는 세포 밖에서 독립적으로 생존하거나 배양될 수 없다.
7. 2. 2차 및 3차 내공생
엽록체는 일반적으로 시아노박테리아가 진핵생물 세포 내로 들어와 공생하면서 생긴 것으로 알려져 있지만(1차 세포내 공생), 모든 엽록체가 이런 방식으로 만들어진 것은 아니다. 많은 생물들은 이미 1차 공생을 통해 엽록체를 가진 홍조류나 녹조류를 다시 삼키는 방식으로 엽록체를 얻었는데, 이를 2차 세포내 공생이라고 한다. 이렇게 얻어진 엽록체는 2차 색소체라고 불린다.[107]2차 세포내 공생의 결과, 2차 엽록체는 원래 엽록체의 두 막(시아노박테리아 유래) 외에 추가적인 막을 가지게 된다.[24] 보통 삼켜진 조류의 세포막과 삼킨 숙주 세포의 식세포성 액포 막이 더해져 총 3개 또는 4개의 막으로 둘러싸인다.[24][25] 이 과정에서 삼켜진 진핵생물의 세포핵에 있던 유전자 중 상당수는 2차 숙주의 핵으로 옮겨간다.[24] 하지만 은편모조류나 녹색유병식물 같은 일부 생물에서는 삼켜진 진핵생물의 핵이 완전히 사라지지 않고 축소된 형태로 남아있는데, 이를 핵형질체라고 하며 엽록체의 두 번째 막과 세 번째 막 사이에 위치한다.[24][102][76]
현재까지 알려진 모든 2차 엽록체는 녹조류나 홍조류로부터 유래했다. 글라우코식물에서 유래한 2차 엽록체는 발견되지 않았는데, 이는 글라우코식물이 자연계에서 상대적으로 드물어 다른 진핵생물에게 섭취될 기회가 적었기 때문일 것으로 추정된다.[24]

더 나아가, 2차 색소체를 가진 생물을 또 다른 진핵생물이 삼키는 경우도 있는데, 이를 3차 세포내 공생이라고 한다. 이렇게 얻어진 엽록체는 3차 색소체라고 불린다. 예를 들어, 일부 와편모조류(예: ''Karlodinium'', ''Karenia'')는 이런 방식으로 엽록체를 획득했다.[107]
원생생물 중 일부(부등편모조류, 유글레나류, 유각변형충류)에서 발견되는 3겹 또는 4겹의 막을 가진 엽록체는 이러한 2차 또는 3차 세포내 공생의 결과로 여겨진다.
8. 1차 엽록체 계통
엽록체는 광합성을 하는 진핵생물 세포 내에 존재하는 소기관 중 하나로, 시아노박테리아로부터 세포내 공생 과정을 통해 유래했다.[8] 이렇게 최초의 공생 사건으로 생겨난 엽록체를 1차 엽록체라고 한다. 모든 1차 엽록체는 다음 4가지 주요 계통 중 하나에 속한다.
남조식물, 홍조식물, 녹색식물 계통은 단일한 1차 공생 사건에서 유래한 것으로 여겨진다.[24] 반면, ''Paulinella chromatophora'' 계통의 엽록체(종종 '''색소체'''라고도 불림[22])는 다른 세 계통과는 별개로, 비교적 최근(약 9천만~1억 4천만 년 전[21][24])에 독립적인 공생 사건을 통해 ''Synechococcus'' 속 시아노박테리아를 획득하여 형성되었다.
각 계통의 1차 엽록체는 고유한 특징을 가지며 진화해왔으며, 이들의 구조와 기능, 진화 과정은 생물 다양성을 이해하는 데 중요한 단서를 제공한다.
8. 1. 남조식물 엽록체
글라우코식물의 엽록체는 현재까지 약 25종만이 기술되어 있어, 3개의 주요 엽록체 계통 중 가장 작은 그룹이다.[27] 글라우코식물은 홍조류와 녹조류의 엽록체 계통이 분기되기 전에 가장 먼저 분기된 것으로 여겨진다.[28] 이러한 이유로 글라우코식물의 엽록체는 때때로 시아노박테리아와 홍색 및 녹색 엽록체의 중간 단계로 간주되기도 한다.[29]이러한 초기 분기 가설은 계통 발생 연구뿐만 아니라, 글라우코식물 엽록체와 시아노박테리아에는 존재하지만 홍색 및 녹색 엽록체에는 없는 여러 물리적 특징들에 의해 뒷받침된다. 첫째, 글라우코식물 엽록체는 시아노박테리아를 포함한 세균에서만 발견되는 세포벽 유형인 펩티도글리칸 벽을 가지고 있다.[30] 둘째, 글라우코식물 엽록체는 동심원 형태로 배열된, 서로 겹쳐지지 않은 틸라코이드 막 구조를 가진다. 이 틸라코이드는 탄소 고정을 담당하는 효소인 RuBisCO를 포함하는 정이십면체 구조의 카르복시솜을 둘러싸고 있다. 셋째, 엽록체에서 광합성을 통해 생성된 녹말은 엽록체 외부에서 저장된다.[31] 또한, 시아노박테리아와 마찬가지로 글라우코식물과 홍조류의 틸라코이드 표면에는 피코빌리솜이라고 불리는 빛 수집 구조가 덮여 있다.
8. 2. 홍조식물 (적색 엽록체)
홍조류는 크고 다양한 생물 계통이다.[24] 홍조류의 엽록체는 '붉은 엽록체'라는 의미를 가진 '''홍색체'''(rhodoplasts|la)라고도 불린다.[107][32]홍색체는 막 사이 공간이 있는 이중 막 구조를 가지며,[102] 피코빌린 색소를 함유하고 있다. 특히, 피코빌리솜이라는 빛 수집 구조가 틸라코이드 막 표면에 배열되어 있어 틸라코이드가 서로 겹쳐 쌓이는 것을 방지한다.[102] 일부 홍조류의 홍색체에는 피레노이드가 존재하기도 한다.[107]
홍색체의 주요 광합성 색소는 클로로필 a와 피코빌린이다.[43] 피코빌린 중 하나인 피코에리트린은 많은 홍조류가 특유의 붉은색을 나타내게 하는 핵심 색소이다.[33] 이 붉은색 피코에리트린은 홍조류가 햇빛이 적게 도달하는 깊은 바닷속 환경에서도 효율적으로 빛 에너지를 흡수하여 광합성을 수행할 수 있도록 돕는 중요한 적응 기작으로 이해된다.[107] 이 때문에 상대적으로 얕은 수심에 서식하는 일부 홍조류는 홍색체 내 피코에리트린 함량이 적어 녹색에 가까운 색을 띠기도 한다.[33]
홍색체는 광합성 결과물로 플로리데아 전분이라는 독특한 형태의 전분을 합성하며,[107] 이 전분은 홍색체 외부의 세포질 내에 과립 형태로 저장된다.[102]
체제가 단순한 단세포 홍조류는 보통 세포 하나당 1개의 구형 엽록체(홍색체)를 가지지만,[193] 다세포 홍조류의 경우, 세포 내에 컵 모양, 성상, 나선형, 판상 등 다양한 형태의 큰 엽록체를 1개 또는 여러 개 포함하는 경우가 많다.[193]
8. 3. 녹색식물 (녹색 엽록체)
색소체의 일종인 엽록체는 노란색의 카로테노이드와 다량의 클로로필을 포함하고 있어 일반적으로 녹색으로 보인다.[193] 녹조류와 육상 식물을 포함하는 녹색식물 계통의 엽록체가 대표적이다.체제가 단순한 조류에서는 세포 하나당 1개의 구형 엽록체를 포함하는 경우가 많다.[193] 다세포 녹조류 등이 되면 컵 모양, 성상, 나선형, 판상 등 다양한 형태의 큰 엽록체를 1개 또는 수 개 정도 포함하게 된다.[193] 이것이 더 나아가 다세포 녹조류나 육상 식물이 되면 세포 하나당 일반적으로 10~수백 개 정도 포함하게 되며[193], 대부분 지름이 5um~10um 정도, 두께가 2um~3um 정도의 볼록 렌즈 모양이다.[193] 종자식물 등 일반적으로 엽록체는 식물의 잎에 존재하지만, 줄기, 가지, 꽃잎, 열매 등의 기관에서도 엽록체가 발달하는 경우가 있다.[194]
유글레나류는 흔히 볼 수 있는 편모를 가진 원생생물의 일종으로, 녹조류에서 유래된 엽록체를 가지고 있다.[24] 유글레나류는 Diaphoretickes 밖에서 클렙토플라스티를 수행하지 않고 엽록체를 가지는 유일한 그룹이다.[45][46] 유글레나류 엽록체는 세 개의 막을 가지고 있는데, 이는 제1차 공생체였던 녹조류의 막이 손실되고 두 개의 시아노박테리아 막과 제2차 숙주의 식세포막이 남은 것으로 생각된다.[24] 유글레나류 엽록체는 피레노이드를 가지고 있으며, 틸라코이드는 3개씩 겹쳐 쌓여 있다. 광합성을 통해 고정된 탄소는 유글레나류의 세포질 내 막으로 둘러싸인 과립에 들어 있는 파라밀론 형태로 저장된다.[102][43]
8. 4. Paulinella chromatophora
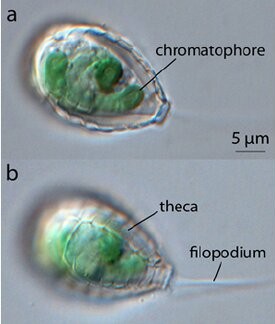
광합성을 하는 아메바인 ''Paulinella'' 속(P. chromatophora, P. micropora, 해양종인 P. longichromatophora)은 독립적으로 진화한 엽록체를 가지고 있으며, 이는 종종 '''색소체'''(chromatophore)라고 불린다.[22] 다른 모든 엽록체가 단일한 고대의 공생 사건에서 유래한 것과 달리, ''Paulinella''는 약 9천만 년에서 1억 4천만 년 전에 ''Synechococcus'' 속의 남세균을 독립적으로 획득하여 색소체를 형성했다.[21][24] 각 ''Paulinella'' 세포는 보통 소시지 모양의 색소체를 하나 또는 두 개 포함하고 있다.[17][39] 이 색소체는 1894년 독일의 생물학자 로버트 로터본(Robert Lauterborn)에 의해 처음으로 기술되었다.[40]
''Paulinella''의 색소체는 자유 생활을 하는 남세균 친척에 비해 유전적으로 상당히 축소되었고 기능도 제한적이다. 예를 들어, 색소체의 게놈 크기는 약 100만 염기쌍으로, 이는 약 300만 염기쌍인 ''Synechococcus'' 게놈의 3분의 1 크기에 해당하며 약 850개의 단백질만을 암호화한다.[17] 하지만 이는 일반적인 식물이나 조류의 엽록체 게놈 크기(약 15만 염기쌍)보다는 훨씬 크다. 또한, 색소체에서 숙주 세포의 핵으로 유전자가 이전된 정도도 다른 엽록체에 비해 훨씬 적다. ''Paulinella'' 핵 DNA의 약 0.3–0.8%만이 색소체에서 유래한 것으로 추정되는 반면, 식물의 경우에는 핵 DNA의 11–14%가 엽록체에서 유래한 것으로 여겨진다.[39] 다른 엽록체와 마찬가지로, ''Paulinella''는 특정 표적 서열을 이용하여 핵에서 만들어진 단백질 중 일부를 색소체로 보낸다.[41]
색소체는 일반적인 엽록체보다 훨씬 최근에 형성되었기 때문에, ''Paulinella chromatophora''는 엽록체가 숙주 세포와 공생 관계를 맺고 진화하는 초기 단계를 이해하는 데 중요한 모델 생물로 연구되고 있다.[17]
9. 2차 및 3차 엽록체 계통
1차 공생을 통해 엽록체를 얻은 진핵생물 외에도, 많은 생물들은 1차 엽록체를 가진 홍조류 또는 녹조류를 다시 삼키는 2차 공생 과정을 통해 엽록체를 획득했다. 이렇게 얻어진 엽록체를 2차 색소체라고 부른다.[107]
2차 공생의 결과, 엽록체는 원래 시아노박테리아에서 유래한 두 개의 막 외에 추가적인 막을 갖게 된다.[24] 일반적으로 삼켜진 조류의 세포막과 숙주 세포의 식세포성 액포에서 유래한 막이 더해져, 총 3개 또는 4개의 막으로 둘러싸인 엽록체가 형성된다.[24][25] 이 과정에서 삼켜진 진핵생물의 핵에 있던 유전자 대부분은 숙주 세포의 핵으로 이동한다.[24] 하지만 일부 그룹(예: 은편모조류, 클로라라크니오조류)의 경우, 삼켜진 진핵생물의 핵이 퇴화된 형태로 남아 엽록체의 두 번째와 세 번째 막 사이에 위치하는데, 이를 핵형질체(nucleomorph)라고 한다.[24][102][76]
현재까지 알려진 모든 2차 엽록체는 녹조류 또는 홍조류에서 유래했다. 글라우코식물에서 유래한 2차 엽록체는 발견되지 않았는데, 이는 글라우코식물이 자연계에서 상대적으로 드물어 다른 진핵생물에게 포식될 기회가 적었기 때문일 것으로 추정된다.[24] 녹조류에서 유래된 2차 엽록체는 여러 조류 그룹에서 발견되며,[42][43] 홍조류에서 유래한 2차 엽록체 역시 다양한 조류 그룹에서 나타난다.[43][44]
더 나아가, 2차 색소체를 가진 생물을 또 다른 진핵생물이 삼켜 엽록체를 얻는 3차 공생 현상도 관찰된다. 이렇게 얻어진 엽록체를 3차 색소체라고 부르며, 일부 와편모조류 등은 이러한 방식으로 엽록체를 획득했다.[107][43] 이는 엽록체가 여러 단계의 공생을 거쳐 다양한 진핵생물 계통으로 퍼져나갔음을 보여준다.
9. 1. 녹조류 유래 엽록체
녹조류의 엽록체는 다른 진핵생물과의 세포 내 공생을 통해 새로운 엽록체로 자리 잡기도 한다. 이는 기존의 엽록체를 가진 진핵생물(이 경우 녹조류)이 다른 엽록체가 없는 진핵생물에게 통째로 흡수되는 2차 세포 내 공생 과정을 통해 일어난다.[197] 이렇게 형성된 엽록체는 원래 엽록체의 이중 막 외에, 흡수된 녹조류의 세포막과 숙주 세포의 막이 추가되어 삼중 또는 사중의 막으로 둘러싸이는 경우가 많다.[196] 때로는 흡수된 녹조류의 핵이 퇴화한 흔적인 누클레오모프가 막 사이 공간에서 발견되기도 한다.[196][197]녹조류 엽록체의 특징 중 하나는 피레노이드라는 구조를 포함한다는 점이다. 피레노이드는 엽록체 내부에 존재하는 단백질성 구조로, 광합성 산물을 녹말과 같은 저장 물질로 전환하는 데 관여하는 것으로 여겨진다.[195] 녹조류에서는 녹말 합성이 이 피레노이드에서 이루어진다.[195]
9. 1. 1. 유글레나류
(내용 없음 - 제공된 원본 소스에 '유글레나류'에 대한 정보가 포함되어 있지 않습니다.)9. 1. 2. 클로라라크니오조류
클로라라크니온 조류(Chlorarachniophytes)는 녹조류에서 유래한 것으로 보이는 엽록체를 가진다.[196] 이 엽록체는 4중의 막으로 둘러싸여 있는데, 이는 세포 내 공생이 두 번 일어난 결과로 해석된다. 즉, 원래 엽록체를 가지지 않던 진핵생물이 엽록체를 가진 녹조류(진핵 조류)를 세포 안으로 받아들여 공생 관계를 형성한 것이다.[197]4중 막 구조는 다음과 같이 설명될 수 있다: 가장 안쪽의 2개 막은 원래 녹조류 엽록체의 막이고, 세 번째 막은 녹조류의 세포막, 가장 바깥쪽 막은 숙주 진핵생물의 식포 막에서 유래한 것으로 여겨진다.[196] 특히, 바깥쪽에서 두 번째와 세 번째 막 사이에는 누클레오모프(nucleomorph)라고 불리는, 핵과 유사한 구조가 발견된다. 이는 공생 과정에서 받아들여진 녹조류의 핵이 퇴화하여 남은 흔적으로 생각된다.[196][197]
9. 1. 3. 프라시노조류 유래 엽록체
주어진 원본 소스에는 '프라시노조류 유래 엽록체'에 대한 정보가 포함되어 있지 않습니다. 따라서 해당 섹션의 내용을 작성할 수 없습니다.9. 2. 홍조류 유래 엽록체
홍조류는 1차 공생을 통해 시아노박테리아로부터 엽록체를 얻은 진핵생물 그룹 중 하나이다. 많은 다른 생물들은 이렇게 1차 엽록체를 가진 홍조류를 다시 삼키는 2차 공생 과정을 통해 홍조류에서 유래한 엽록체를 얻었다.[107] 이러한 엽록체는 2차 색소체라고 불린다.[107]2차 공생의 결과, 엽록체는 원래의 두 막 외에 추가적인 막을 갖게 된다.[24] 일반적으로 포식된 홍조류의 세포막과 숙주 세포의 식세포성 액포 막이 더해져, 총 3개 또는 4개의 막으로 둘러싸인 엽록체가 형성된다.[24][25] 이 과정에서 포식된 홍조류의 유전자 대부분은 숙주 세포의 핵으로 이동하지만,[24] 일부 그룹에서는 포식된 홍조류의 핵이 축소된 형태로 남아 엽록체 막 사이에 위치하기도 하는데, 이를 핵형질체라고 한다.[24][102][76] 홍조류에서 유래한 2차 엽록체는 은편모조류를 포함한 다양한 조류 그룹에서 발견되며, 이들은 종종 색소체조류(Chromista) 등으로 분류된다.[49]
더 나아가, 2차 색소체를 가진 생물을 또 다른 진핵생물이 삼켜 엽록체를 얻는 3차 공생 현상도 관찰된다.[107] 이렇게 얻어진 엽록체를 3차 색소체라고 부르며, 이는 홍조류에서 기원한 엽록체가 여러 단계의 공생을 거쳐 전달될 수 있음을 보여준다. 예를 들어, 일부 와편모조류는 홍조류 유래 2차 엽록체를 가진 다른 조류를 섭취하여 3차 엽록체를 획득하기도 한다.[43]
9. 2. 1. 은편모조류
은편모조류(Cryptophytes|크립토조류eng)는 엽록체를 가진 조류의 한 그룹이다. 이들의 엽록체는 핵형체를 포함하고 있으며, 자체 유지를 위해 핵형체가 필요한 것으로 알려져 있다.[51]
일부 와편모조류 종, 예를 들어 ''Dinophysis'' 속의 생물들은 은편모조류로부터 엽록체를 얻어 일시적으로 사용하는 클렙토플라스트 현상을 보인다.[24][56][57] ''Dinophysis''는 은편모조류를 섭취한 뒤 엽록체만 분리하여 자신의 세포 내에서 활용한다. 이 엽록체는 피코빌린을 함유하는 특징을 가진다.[54]
''Dinophysis''가 은편모조류로부터 엽록체를 흡수할 때, 엽록체를 둘러싼 가장 바깥쪽 두 개의 세포막과 핵형체는 제거된다. 따라서 ''Dinophysis'' 세포 내에 남는 엽록체는 두 개의 막으로만 둘러싸여 있으며, 핵형체가 없다.[51] 핵형체가 없기 때문에 이 엽록체는 스스로 유지되지 못하고 수명이 며칠 정도로 짧을 수 있다.[56][57] 이 때문에 ''Dinophysis'' 종은 세포 배양만으로는 생존하기 어려울 수 있으며, 낡은 엽록체를 대체하기 위해 지속적으로 은편모조류를 섭취해야 할 필요가 있을 것으로 추정된다 (이것이 클렙토플라스트인지 여부는 아직 확실하지 않다).[51]
9. 2. 2. 갈조식물
갈조류는 홍조류에서 유래한 엽록체를 2차 공생을 통해 얻은 색소체조류의 일종이다. 갈조류의 엽록체는 일반적으로 4개의 막으로 둘러싸여 있으며, 특징적인 갈색 색소인 푸코산틴을 함유하고 있다.[51]흥미롭게도, 일부 와편모조류는 기존 엽록체를 잃고 갈조류를 세포 내로 받아들여 새로운 엽록체를 얻는 3차 공생 과정을 거쳤다. 이 과정에서 와편모조류 세포 내로 들어온 갈조류는 내공생체로서 존재하게 되는데, 시간이 지나면서 점차 축소된다. 이 축소 과정에서 갈조류의 핵을 비롯한 여러 세포 소기관들이 사라지고, 최종적으로는 원래의 엽록체(이중 막)와 그 주변에 하나 또는 두 개의 추가 막만이 남게 되는 경우가 많다.[43][54] 따라서 와편모조류 내에 존재하는 갈조류 유래 엽록체는 원래 갈조류 세포와는 다른 형태를 띠게 된다. 이 과정에서 갈조류 내공생체의 핵이 소실되므로, 핵형질체는 존재하지 않는다.
이처럼 갈조류는 자체적으로 광합성을 수행할 뿐만 아니라, 다른 진핵생물에게 엽록체를 제공하는 중간자 역할을 하기도 한다. 와편모조류에서 발견되는 푸코산틴 색소는 이들 엽록체가 갈조류로부터 유래했음을 보여주는 중요한 증거이다.[51]
9. 2. 3. 정단복합체충, 크로메리드 및 디노파이트
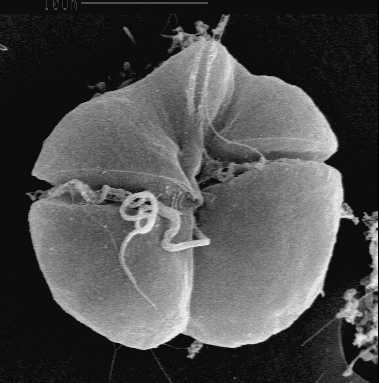
푸코산틴을 함유한 와편모조류 계통(''Karlodinium'' 및 ''Karenia'' 포함)[43]은 원래 가지고 있던 홍조류 유래의 엽록체를 잃고, 갈조류 내공생체에서 유래한 새로운 엽록체로 대체하였다. 이 엽록체는 3차 엽록체에 해당한다. ''Karlodinium''과 ''Karenia''는 아마도 다른 종속영양생물을 섭취하는 과정에서 이러한 엽록체를 얻었을 것으로 추정된다.[43] 갈조류 엽록체는 원래 4개의 막을 가지고 있으므로, 3차 내공생 과정에서 갈조류의 세포막과 와편모조류의 식포 막이 더해져 총 6개의 막을 가질 것으로 예상할 수 있다.[54] 그러나 실제로는 내공생체인 갈조류가 크게 축소되어 몇 개의 막과 핵이 제거되었고, 결국 원래의 이중 막을 가진 엽록체와 그 주변에 하나 또는 두 개의 추가 막만 남게 되었다.[43][54]
푸코산틴 함유 엽록체는 페리디닌이 없는 대신, 색소 푸코산틴(정확히는 19′-헥사노일옥시-푸코산틴 및/또는 19′-부타노일옥시-푸코산틴)을 가지고 있다는 특징이 있다. 푸코산틴은 갈조류 엽록체에서도 발견되는 색소로, 이 엽록체가 갈조류에서 유래했음을 보여주는 증거가 된다.[51]
일부 와편모조류, 예를 들어 ''크립토페리디니움''과 ''두린스키아''[43] 등은 규조류(이형혹편모조류)에서 유래한 엽록체를 가지고 있다.[24] 이 엽록체는 최대 5개의 막으로 둘러싸여 있다.[24] (이는 전체 규조류 내공생체를 엽록체로 간주하는지, 아니면 그 안에 있는 홍조류 유래 엽록체만 엽록체로 간주하는지에 따라 달라질 수 있다). 규조류 내공생체는 비교적 덜 축소되어, 여전히 원래의 미토콘드리아를 유지하고 있으며,[43] 소포체, 리보솜, 핵, 그리고 홍조류 유래 엽록체까지 가지고 있어 사실상 완전한 세포와 유사한 형태를 유지한다.[55] 이 모든 구조는 숙주 와편모조류의 소포체 내강 안에 존재한다.[43] 그러나 규조류 내공생체는 스스로 양분을 저장하지 못하며, 저장 다당류는 대신 와편모조류 숙주 세포질의 과립에서 발견된다.[102][55] 규조류 내공생체의 핵은 존재하지만, 게놈 축소의 징후가 없고 오히려 확장되었을 가능성도 있어 핵모양체라고 부르기는 어렵다.[43] 와편모조류는 최소 세 번 이상 독립적으로 규조류를 포획하여 공생 관계를 형성한 것으로 보인다.[43]
규조류 내공생체는 단일 막으로 둘러싸여 있으며,[51] 그 안에는 4개의 막을 가진 엽록체가 존재한다. 이 엽록체는 규조류 조상과 마찬가지로 삼중 틸라코이드와 피레노이드를 가지고 있다.[55]
이러한 와편모조류 중 일부에서는 규조류 내공생체의 엽록체 외에도, 원래 가지고 있던 3중막의 페리디닌 엽록체가 안점으로 변형되어 남아있는 경우도 있다.[24][43]
일부 혼합 영양 원생생물, 특히 특정 와편모조류(예: ''Dinophysis'')는 포획한 조류로부터 엽록체만 분리하여 일시적으로 사용하는 클렙토플라스티 현상을 보인다. 이렇게 얻은 엽록체, 즉 클렙토플라스트는 수명이 며칠 정도로 짧아 이후 새로운 엽록체로 교체해야 한다.[56][57]
''디노피시스속''의 종들은 피코빌린을 함유하는[54] 엽록체를 가지고 있는데, 이는 은편모조류에서 유래한 것이다.[24] 그러나 이 경우 은편모조류 전체가 공생하는 것이 아니라 엽록체만 흡수된 것으로 보이며, 이 과정에서 엽록체의 핵형체와 가장 바깥쪽 두 개의 막이 제거되어 최종적으로 두 개의 막으로 둘러싸인 엽록체만 남게 되었다. 은편모조류 엽록체는 자체 유지를 위해 핵형체가 필요한데, ''Dinophysis'' 종은 세포 배양만으로는 생존할 수 없다. 따라서 ''Dinophysis''의 엽록체는 클렙토플라스트일 가능성이 높으며(확실하지는 않음), 만약 그렇다면, 이 엽록체는 시간이 지나면 기능이 저하되므로 ''Dinophysis'' 종은 낡은 엽록체를 대체하기 위해 지속적으로 은편모조류를 섭취해야 할 것이다.[51]
9. 3. 3차 엽록체 (갈조식물 유래)
푸코산틴을 가진 와편모조류 계통(''Karlodinium'' 및 ''Karenia'' 포함)[43]은 원래 가지고 있던 홍조류 유래의 엽록체를 잃어버리고, 대신 갈조류 내공생체에서 유래한 새로운 엽록체를 받아들였다. 이렇게 형성된 엽록체를 3차 엽록체라고 부른다. ''Karlodinium''과 ''Karenia''는 아마도 다른 종속영양생물을 섭취하는 과정에서 이러한 엽록체를 얻었을 것으로 추정된다.[43]
원래 갈조류의 엽록체는 4개의 막으로 둘러싸여 있었다. 따라서 3차 내공생 과정에서 갈조류의 세포막과 와편모조류의 식포 막이 더해져 총 6개의 막을 가진 엽록체가 될 것으로 예상할 수 있다.[54] 하지만 실제로는 갈조류 내공생체가 매우 축소되어 핵과 일부 막이 사라지고, 원래 엽록체의 이중 막 주변에 추가로 한두 개의 막만 남게 되었다.[43][54]
이 3차 엽록체는 페리디닌 대신 푸코산틴(정확히는 19′-헥사노일옥시-푸코산틴 및/또는 19′-부타노일옥시-푸코산틴)이라는 색소를 가지고 있다는 특징이 있다. 푸코산틴은 갈조류 엽록체에서도 발견되는 색소이기 때문에, 이 엽록체가 갈조류에서 유래했다는 증거가 된다.[51]
9. 3. 1. "디노톰" 규조류 유래 디노파이트 엽록체
일부 와편모조류, 예를 들어 Kryptoperidinium|크립토페리디니움la과 Durinskia|두린스키아la는[43] 규조류(이형혹편모조류)에서 유래한 엽록체를 가지고 있다.[24] 이 엽록체는 최대 5개의 막으로 둘러싸여 있는데,[24] 이는 전체 규조류 내공생체(endosymbiont)를 엽록체로 간주할지, 아니면 그 안에 있는 원래의 적조류 유래 엽록체만을 엽록체로 간주할지에 따라 달라진다.규조류 내공생체는 비교적 덜 축소된 상태로 남아 있으며, 원래의 미토콘드리아뿐만 아니라[43] 소포체, 리보솜, 핵, 그리고 물론 적조류에서 유래한 엽록체까지 가지고 있어 사실상 완전한 세포와 유사하다.[55] 이 모든 구조는 숙주 와편모조류의 소포체 내강 안에 위치한다.[43] 하지만 규조류 내공생체는 스스로 영양분을 저장하지 못하며, 저장 다당류는 숙주인 와편모조류 세포질 내의 과립 형태로 발견된다.[102][55] 규조류 내공생체의 핵은 존재하지만, 게놈 축소의 뚜렷한 징후가 없고 오히려 확장되었을 가능성도 있어 핵모양체라고 부르기는 어렵다.[43] 이러한 형태의 공생은 와편모조류가 규조류를 최소 세 번 이상 포식하면서 발생한 것으로 보인다.[43]
규조류 내공생체 자체는 단일 막으로 둘러싸여 있으며,[51] 그 안에 4개의 막을 가진 엽록체가 존재한다. 이 엽록체는 규조류 조상의 엽록체처럼 삼중 틸라코이드와 피레노이드를 가지고 있다.[55]
이러한 속에 속하는 일부 와편모조류에서는 규조류 내공생체의 엽록체 외에도, 원래 가지고 있던 3중막의 페리디닌 엽록체가 안점으로 변형되어 여전히 존재하기도 한다.[24][43]
9. 4. 절취 색소체 (Kleptoplasty)
일부 혼합 영양 원생생물 집단에서는 포획한 조류로부터 엽록체를 분리하여 일시적으로 사용하는 현상이 나타난다. 이러한 과정을 절취 색소체 형성(Kleptoplasty)이라고 부른다.[56][57] 대표적인 예로는 특정 와편모조류 종류(예: ''Dinophysis'')가 있으며, 이들은 먹이로부터 얻은 엽록체를 활용한다.이렇게 얻어진 클렙토플라스트(절취 엽록체)는 일반적으로 수명이 며칠 정도로 짧기 때문에, 유기체는 새로운 엽록체를 얻기 위해 지속적으로 조류를 포획하여 엽록체를 교체해야 한다.[56][57]
절취 색소체 형성은 원생생물뿐만 아니라 일부 동물에서도 관찰된다. 예를 들어, 바다 달팽이의 일종인 낭설류 중 일부는 해조류의 세포 내용물을 섭취할 때 엽록체를 분해하지 않고 자신의 세포 안으로 가져온다. 이 엽록체는 동물 세포 내에서도 광합성을 계속 수행하여 동물이 필요로 하는 영양분을 공급하는 역할을 한다. 이는 엽록체가 원래의 세포(조류)에서 분리된 상태에서도 일정 기간 기능을 유지할 수 있음을 보여주는 흥미로운 사례이다.
9. 4. 1. 은편모조류 유래 디노파이트 엽록체
디노피시스속의 구성원들은 피코빌린을 함유하는[54] 엽록체를 가지고 있는데, 이는 은편모조류에서 유래한 것이다.[24] 그러나 이 과정에서 은편모조류 전체가 공생하는 것이 아니라, 오직 엽록체만이 흡수된 것으로 보인다. 이 과정에서 엽록체를 둘러싸던 막 중 핵형체와 가장 바깥쪽 두 개의 막이 제거되어, 최종적으로 두 개의 막으로 이루어진 엽록체만 남게 된다.[51]
은편모조류 엽록체는 자체적인 유지를 위해 핵형체를 필요로 한다. 실제로 세포 배양 환경에서는 ''Dinophysis'' 종이 생존할 수 없다는 점은 이들 엽록체가 클렙토플라스트일 가능성을 시사한다(확실하지는 않다). 만약 이것이 사실이라면, ''Dinophysis''의 엽록체는 시간이 지나면서 기능이 저하(마모)되며, 따라서 ''Dinophysis'' 종은 낡은 엽록체를 계속 대체하기 위해 끊임없이 은편모조류를 섭취해야 할 것이다.[51]
10. 엽록체 DNA
엽록체는 미토콘드리아와 마찬가지로 세포 핵과는 별개의 독자적인 게놈인 엽록체 DNA(cpDNA)를 가지고 있다. 이는 엽록체가 과거 독립적인 생물이었음을 시사하는 세포내 공생설의 강력한 증거 중 하나이다. cpDNA의 존재는 1959년에 생화학적으로 처음 확인되었고, 1962년에는 전자 현미경을 통해 그 모습이 관찰되었다. 이후 엽록체가 자체 리보솜을 가지고 단백질 합성을 수행한다는 사실이 밝혀지면서, 엽록체가 유전적으로 어느 정도 독립성을 가진다는 것이 명확해졌다.
cpDNA의 전체 염기서열은 1986년 담배에서 처음으로 완전히 해독되었다.[58] 이후 수많은 생물 종의 cpDNA 염기서열이 분석되었지만, 연구가 육상 식물이나 녹조류에 집중되는 경향이 있어[59] cpDNA의 다양성을 완전히 이해하기에는 한계가 있다.
대부분의 엽록체에서 cpDNA는 하나의 큰 원형(환형) DNA 분자 형태를 띠며,[59] 그 길이는 일반적으로 120,000~170,000 염기쌍 정도이다.[60][77][66][61] cpDNA는 특정 단백질과 결합하여 뉴클레오이드라는 구조를 형성하며 응축되어 있으며, 이는 cpDNA의 복제, 전사, 분배 단위로 기능한다.[62]
많은 cpDNA는 두 개의 긴 역반복(Inverted Repeat, IR) 서열을 가지고 있다. 이 역반복 서열은 서로 거의 동일하며, 긴 단일 복사 영역(Long Single Copy, LSC)과 짧은 단일 복사 영역(Short Single Copy, SSC)이라는 두 영역을 분리한다.[66]
엽록체는 원래 훨씬 더 많은 유전자를 가지고 있었을 것으로 추정되지만, 진화 과정에서 많은 유전자가 숙주 세포의 핵으로 이동하는 내부공생 유전자 전이 현상이 일어나면서 현재는 그 수가 크게 줄었다.
10. 1. DNA 복구 및 복제
주어진 원본 소스(`source`)에는 'DNA 복구 및 복제' 섹션 제목(`section-title`)에 해당하는 내용이 포함되어 있지 않습니다. 따라서 해당 섹션에 대한 위키텍스트를 작성할 수 없습니다.10. 2. 유전자 함량 및 단백질 합성
엽록체는 다른 공생 세포 소기관처럼 세포 핵과는 별개의 게놈을 가지고 있다. 엽록체 DNA(cpDNA)의 존재는 1959년에 생화학적으로 확인되었고, 1962년에 전자 현미경으로 확인되었다. 이후 엽록체가 자체 리보솜을 포함하고 단백질 합성을 수행한다는 사실이 밝혀지면서, 엽록체가 유전적으로 어느 정도 자율성을 가진다는 것이 드러났다. 엽록체 DNA는 1986년에 처음으로 염기서열이 완전히 분석되었으며,[58] 이후 다양한 종에서 염기서열 분석이 이루어졌으나, 특정 분류군에 편중된 경향이 있다.[59]대부분의 엽록체 게놈은 하나의 큰 원형 DNA 분자로 구성되며,[59] 길이는 일반적으로 120,000~170,000 염기쌍이다.[60][77][66][61] 세포 내에서는 다양한 선형 및 분지 형태도 존재하며,[59][63] 여러 개의 게놈 사본이 존재한다.[60][64] 엽록체 DNA는 뉴클레오이드라는 구조로 응축되어 있으며, 이는 진핵생물 핵의 히스톤과는 다른 단백질에 의해 이루어진다.[14][62]
많은 엽록체 게놈은 두 개의 역반복(Inverted Repeats, IR) 서열을 가지며, 이들은 긴 단일 복사 영역(LSC)과 짧은 단일 복사 영역(SSC)을 분리한다.[66] 역반복 서열은 협동 진화의 결과로 서로 매우 유사하며,[59] 게놈 안정화에 기여하는 것으로 보인다.[68]
엽록체의 조상인 시아노박테리아는 수천 개의 유전자를 가졌으나, 진화 과정에서 많은 유전자가 숙주 세포의 핵으로 이동하는 내부공생 유전자 전이가 일어나 현대 엽록체 게놈에는 약 100여 개의 유전자만 남아 있다.[61][76][77][60][78] 남아있는 유전자들은 주로 단백질 합성과 광합성 관련 기능을 암호화하며,[76] 일부는 인트론을 포함하기도 한다.[187] 엽록체 내 단백질의 대부분은 핵 유전자에 의해 암호화되어 세포질에서 합성된 후 엽록체로 운반되므로, 단백질 합성은 핵과 엽록체 간의 긴밀한 조절이 필요하다.[79][82][89]
10. 2. 1. 엽록체 게놈 축소 및 유전자 전이
엽록체의 조상으로 여겨지는 시아노박테리아는 3,000개 이상의 유전자를 포함하는 게놈을 가지고 있었지만, 현대 엽록체 게놈에는 약 100개의 유전자만이 남아 있다.[61][76][77] 이는 엽록체 게놈이 진화 과정에서 크게 축소되었음을 보여준다. 엽록체에 남아있는 유전자들은 주로 단백질 합성과 광합성 관련 기능을 암호화하며, 원핵생물처럼 오페론 구조로 배열되어 있다.[76] 다만, 원핵생물 DNA와 달리 엽록체 DNA는 인트론을 포함하기도 한다.[187]엽록체 게놈 축소의 주요 원인은 시간이 지남에 따라 많은 엽록체 유전자가 숙주 세포의 핵 게놈으로 이동했기 때문이다.[60][77][78] 이 과정을 내부공생 유전자 전이(endosymbiotic gene transfer, EGT)라고 부른다. 그 결과, 엽록체 게놈은 자유 생활 남세균의 게놈(종종 1500개 이상의 유전자 보유)에 비해 60~100개 유전자 수준으로 크게 줄어들었다.[79] 최근에는 게놈이 완전히 없는 색소체도 발견되어, 엽록체가 내부공생 유전자 전이 과정에서 게놈을 모두 잃을 수도 있음을 시사한다.[80]
육상 식물의 경우, 핵 DNA의 약 11~14%가 엽록체에서 유래된 것으로 추정되며,[39] 애기장대에서는 최대 18%까지 이르러 약 4,500개의 단백질 코딩 유전자에 해당한다.[81] 이러한 유전자 전이는 최근까지도 육상 식물에서 여러 차례 발생했다.[77] 결과적으로 엽록체 내에서 기능하는 약 3000개의 단백질 중 약 95%는 핵에 있는 유전자에 의해 암호화된다. 많은 엽록체 단백질 복합체는 엽록체 게놈과 핵 게놈에서 유래한 소단위체들로 구성되므로, 단백질 합성은 엽록체와 핵 사이의 긴밀한 조절 하에 이루어진다. 엽록체는 주로 핵의 통제를 받지만, 반대로 핵의 유전자 발현을 조절하는 신호(역행 신호 전달)를 보내기도 한다.[82]
내부공생 유전자 전이는 과거 엽록체의 흔적을 찾는 증거가 되기도 한다. 특정 생물에서 엽록체가 소실되었더라도, 핵 속에 남아있는 엽록체 유래 유전자들은 과거에 엽록체가 존재했음을 알려준다. 예를 들어, 현재 홍조류 유래 엽록체를 가진 규조류의 핵에는 다수의 녹조류 유전자가 발견되는데, 이는 규조류의 조상이 과거 한때 녹조류 유래 엽록체를 가졌다가 나중에 홍조류 엽록체로 대체했음을 시사한다.[44]
핵으로 옮겨진 엽록체 유전자 중 상당수는 원래 기능을 유지하며, 이 유전자들이 만드는 단백질은 세포질에서 합성된 후 다시 엽록체로 이동하여 제 기능을 수행한다. 하지만 핵으로 옮겨진 유전자의 단백질 산물 중 약 절반은 엽록체로 돌아가지 않고, 세포 분열, 단백질 라우팅, 질병 저항성 등 세포 내 다른 장소에서 새로운 기능을 수행하도록 전용되기도 한다. 일부 엽록체 유전자는 미토콘드리아 게놈으로 옮겨가기도 했는데, 대부분은 기능이 없는 유사 유전자가 되었지만, 소수의 tRNA 유전자는 미토콘드리아 내에서 여전히 기능한다.[79] 일부 단백질 산물은 세포 밖으로 나가는 분비 경로로 보내지기도 한다.[79]
10. 2. 2. 단백질 합성
엽록체에서 발견되는 약 3000개의 단백질 중 약 95%는 핵 유전자에 의해 암호화된다.[79] 엽록체의 많은 단백질 복합체는 엽록체 게놈과 숙주 핵 게놈 모두에서 유래한 소단위체로 구성된다. 따라서 단백질 합성은 엽록체와 핵 사이에서 조절되어야 한다. 엽록체는 주로 핵의 제어를 받지만, 핵에서 유전자 발현을 조절하는 신호(역행 신호 전달)를 보내기도 한다.[82]엽록체 내의 단백질 합성은 두 개의 RNA 중합 효소에 의존한다. 하나는 엽록체 DNA에 의해 암호화되고, 다른 하나는 세포 핵 기원이다. 이 두 RNA 중합 효소는 엽록체 게놈 내의 서로 다른 종류의 프로모터를 인식하고 결합할 수 있다.[87] 엽록체의 리보솜은 세균 리보솜과 유사하다.[88]
많은 엽록체 유전자가 핵으로 옮겨졌기 때문에, 원래 엽록체에서 번역되었을 많은 단백질이 이제 식물 세포의 세포질에서 합성된다. 이 단백질들은 엽록체로 다시 운반되어야 하며, 최소 두 개의 엽록체 막을 통과하여 수입된다.[89] 핵에서 암호화된 엽록체 단백질 대부분은 단백질 전구체의 N-말단에 추가된 ''절단성 수송 펩타이드''를 가지고 번역된다. 때로는 수송 서열이 단백질의 C-말단이나[91] 단백질의 기능적 부분 내에서 발견되기도 한다.[89]
엽록체 폴리펩타이드가 세포질의 리보솜에서 합성된 후, 특정 효소[92]는 전이 서열의 많은 단백질을 인산화한다.[89] 인산화는 많은 단백질이 폴리펩타이드에 결합하여 조기에 접히는 것을 막는 데 도움이 된다.[89] 이는 엽록체 단백질이 세포질에서 활성 형태를 띠고 잘못된 기능을 수행하는 것을 방지하기 위해 중요하다.[94][93] 동시에, 단백질은 엽록체에서 인식될 수 있도록 충분한 형태를 유지해야 한다.[94]
엽록체로 운반되는 단백질은 두 개의 단백질 복합체, 즉 TOC 복합체(바깥쪽 엽록체 막의 트랜스로콘)와 TIC 복합체(안쪽 엽록체 막의 트랜스로콘)를 통과해야 한다.[89] 엽록체 폴리펩타이드 사슬은 아마도 두 복합체를 동시에 통과하는 경우가 많지만, TIC 복합체는 엽록체 막간 공간에서 잘못 위치한 전구 단백질을 회수할 수도 있다.[89]
핵으로 옮겨진 엽록체 유전자의 단백질 생성물 중 약 절반은 엽록체로 다시 표적화되지 않는다. 많은 단백질이 세포 분열, 단백질 라우팅, 질병 저항성 참여 등 새로운 기능을 수행하도록 전용되었다. 소수의 엽록체 유전자는 미토콘드리아 게놈으로 이동했는데, 대부분 기능 없는 유사 유전자가 되었지만 일부 tRNA 유전자는 여전히 미토콘드리아에서 기능한다.[79] 일부 옮겨진 엽록체 DNA 단백질 생성물은 분비 경로로 보내지기도 한다.[79]
10. 3. 단백질 표적화 및 유입
내부공생 유전자 전이 과정을 통해 엽록체 게놈의 많은 유전자가 시간이 지남에 따라 숙주 세포의 핵으로 이동했다.[60][77][78] 그 결과, 원래 엽록체 내부에서 만들어졌어야 할 많은 단백질들이 이제 세포질의 리보솜에서 합성된다. 이렇게 세포질에서 만들어진 단백질들은 다시 엽록체로 정확히 운반되어야 하며, 이를 위해 최소 두 개의 엽록체 막을 통과하는 '수입' 과정을 거친다.[89]하지만 핵으로 옮겨진 엽록체 유전자로부터 만들어진 단백질 중 약 절반 정도는 원래의 목적지인 엽록체로 돌아가지 않는다. 대신 이 단백질들은 세포 분열, 단백질 라우팅, 심지어 질병 저항성과 같은 세포 내 다른 중요한 기능들을 수행하도록 전용되기도 한다.[79] 일부는 미토콘드리아로 가거나[79] 분비 경로로 향하기도 한다.[79]
세포 내에는 엽록체 외에도 미토콘드리아, 과산화소체 등 다양한 세포 소기관이 존재하기 때문에, 핵에서 만들어진 단백질이 엉뚱한 곳으로 잘못 배달되는 것을 막고 정확히 엽록체로 향하도록 유도하는 정교한 단백질 표적 시스템이 필수적이다.[89]
10. 3. 1. 수송 단백질 및 막 전좌체
엽록체에서 발견되는 약 3000개의 단백질 중 약 95%는 핵 유전자에 의해 암호화된다.[81] 원래 엽록체에서 번역되었을 많은 단백질이 이제는 식물 세포의 세포질에서 합성된다. 이 단백질은 다시 엽록체로 향해야 하며, 최소 두 개의 엽록체 막을 통과하여 수입되어야 한다.[89]핵에서 암호화된 엽록체 단백질은 대부분 단백질 전구체의 N-말단에 ''절단성 수송 펩타이드''가 추가된 형태로 번역된다. 때로는 수송 서열이 단백질의 C-말단[91] 또는 단백질의 기능적 부분 내에서 발견되기도 한다.[89]
엽록체 폴리펩타이드가 세포질의 리보솜에서 합성된 후, 엽록체 단백질에 특이적인 효소[92]는 전이 서열에서 많은(전부는 아닌) 단백질을 인산화하거나 인산기를 첨가한다.[89] 인산화는 여러 단백질이 폴리펩타이드에 결합하여 조기에 접히는 것을 방지하는 데 도움을 준다.[89] 이는 엽록체 단백질이 세포질과 같은 잘못된 장소에서 활성 형태를 띠고 기능을 수행하는 것을 방지하므로 중요하다.[94][93] 동시에 단백질은 엽록체에서 인식될 수 있도록 충분한 형태를 유지해야 한다.[94] 이 과정에 관여하는 단백질은 폴리펩타이드가 엽록체로 수입되는 것을 돕기도 한다.[89]
스트로마로 향하는 엽록체 단백질은 두 개의 단백질 복합체, 즉 '''TOC 복합체'''('''바깥''' 엽록체 막의 '''트'''랜스로콘)와 '''TIC 트랜스로콘'''('''''안쪽''' 엽록체 막의 트랜스로콘'')을 통과해야 한다.[89] 엽록체 폴리펩타이드 사슬은 아마도 두 복합체를 동시에 통과하는 경우가 많지만, TIC 복합체는 엽록체 막간 공간에서 경로를 이탈한 전구 단백질을 회수하는 역할도 수행할 수 있다.[89]
11. 구조
1. 외막(Outer membrane)
2. 막 사이 공간(Intermembrane space)
3. 내막(Inner membrane)
4. 스트로마(Stroma)
5. 틸라코이드 내강(Thylakoid Lumen)
6. 틸라코이드 막(Thylakoid membrane)
7. 그라나(Granum)
8. 틸라코이드(Thylakoid)
9. 녹말 과립(Starch granule)
10. 리보솜(Ribosome)
11. 엽록체 DNA(Plastidial DNA)
12. 플라스토글로불루스(Plastoglobulus)]]
엽록체는 엽록소라는 녹색 색소를 가지고 있어 광합성을 수행하는 세포 내 소기관이다. 이 때문에 세포를 관찰할 때 뚜렷한 녹색으로 쉽게 확인할 수 있다. 세포내 공생설에 따르면 엽록체는 독자적인 DNA와 리보솜을 가진다.
모든 엽록체는 기본적으로 세 개의 막 시스템으로 구성된다. 가장 바깥쪽의 외막(outer membrane)과 안쪽의 내막(inner membrane)으로 이루어진 이중막이 엽록체 전체를 감싸고 있으며, 그 안쪽에는 틸라코이드 시스템(thylakoid system)이라는 또 다른 막 구조가 존재한다. 외막과 내막 사이에는 막 사이 공간(intermembrane space)이 있다.
내막 안쪽의 공간은 스트로마(stroma)라고 불리는 액체 상태의 기질로 채워져 있다. 스트로마는 엽록체의 DNA, 리보솜, 다양한 효소 등을 포함하며, 광합성의 캘빈 회로가 일어나는 장소이다.
스트로마 내부에는 납작한 주머니 모양의 막 구조물인 틸라코이드(thylakoid)가 복잡하게 얽혀 있다. 틸라코이드 막에는 엽록소를 비롯한 광합성 색소와 빛 에너지를 화학 에너지로 전환하는 데 필요한 단백질 복합체들이 존재한다. 많은 식물에서 틸라코이드는 동전처럼 겹겹이 쌓여 그라나(granum, 복수형 grana)라는 구조를 형성하며, 각 그라나와 틸라코이드들은 서로 연결되어 있다. 틸라코이드 내부의 공간은 내강(lumen)이라고 한다.
종자 식물의 엽록체는 일반적으로 지름 5um~10um, 두께 2um~3um 정도의 약간 납작한 원반 또는 렌즈 모양이다[193]. 현미경으로 관찰하면 세포의 가장자리를 따라 배열된 모습을 흔히 볼 수 있는데, 이는 세포 중앙에 큰 액포가 자리 잡고 있기 때문이다. 원형질 유동에 의해 엽록체가 세포 내에서 이동하는 모습도 관찰할 수 있다.
반면, 조류에서는 엽록체의 형태가 매우 다양하게 나타난다. 예를 들어 해캄에서는 리본 모양의 엽록체가 세포 내에서 나선형으로 배열되어 있고, 이 외에도 별 모양, 판 모양 등 여러 가지 독특한 형태의 엽록체가 존재한다[193]. 일반적으로 체제가 단순한 조류는 세포 하나당 하나의 구형 엽록체를 가지기도 하며, 다세포 조류에서는 세포당 여러 개의 다양한 형태의 엽록체를 포함하기도 한다[193].
11. 1. 외부 엽록체 막
엽록체 외막은 작고 이온과 같은 작은 분자들이 쉽게 확산될 수 있는 반투과성 막이다.[109] 그러나 더 큰 단백질은 통과할 수 없다. 따라서 세포질에서 합성된 엽록체 폴리펩타이드는 TOC 복합체 (translocon on the outer chloroplast membrane)라는 특별한 통로를 통해 외막을 건너 수송되어야 한다.[89]때때로 엽록체 막은 세포질 쪽으로 길게 늘어나 관 모양의 스트로물(stromule)을 형성하기도 한다. 스트로물은 스트로마를 포함하며, 엽록체의 표면적을 넓혀 물질 수송을 돕는 역할을 할 수 있다.[110][111][112] 스트로물은 꽃잎의 색소체나 뿌리의 아밀로플라스트 같은 다른 색소체에서는 흔하지만, 엽록체에서는 상대적으로 드물게 관찰된다.[110][111]
11. 2. 막간 공간 및 펩티도글리칸 벽
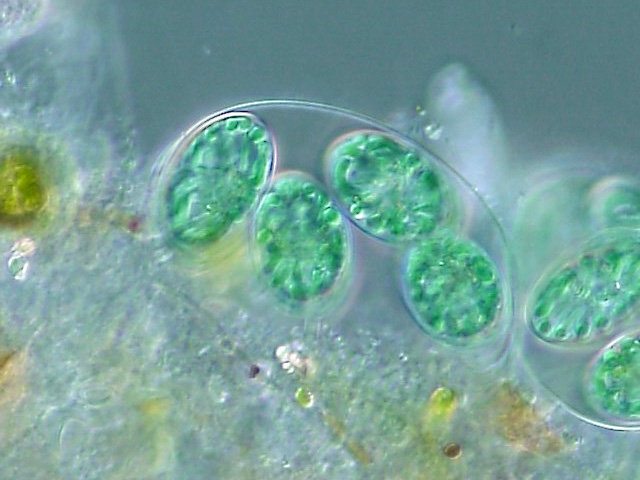
일반적으로 외부 및 내부 엽록체 막 사이에는 두께가 약 10nm~20nm인 얇은 내막 공간이 존재한다.[115]
남조식물 조류의 엽록체는 엽록체 막 사이에 펩티도글리칸 층을 가지고 있다. 이는 두 개의 세포막 사이에 위치한 시아노박테리아 조상의 펩티도글리칸 세포벽에 해당한다. 이러한 엽록체를 "무로플라스트"("mura"|"무라"la, "벽"을 의미함)라고 부른다. 다른 엽록체는 시아노박테리아 벽을 잃어 두 엽록체 외피 막 사이에 내막 공간을 남긴 것으로 추정되었지만,[107] 이후 이끼, 석송류 및 양치류에서도 펩티도글리칸 벽이 발견되었다.[116]
11. 3. 내부 엽록체 막
내부 엽록체 막은 스트로마에 접해 있으며,[107] 엽록체 안팎으로 물질 이동을 조절하는 중요한 역할을 한다. 외부 엽록체 막의 TOC 복합체를 통과한 폴리펩타이드는 내부 엽록체 막에 위치한 TIC 복합체(''내부 엽록체 막의 '''t'''랜스 로콘'')를 통과해야 엽록체 내부로 들어갈 수 있다.[89]물질 이동 조절 외에도, 내부 엽록체 막은 지방산, 지질, 카로티노이드와 같은 중요한 유기 분자들이 합성되는 장소이기도 하다.[107] 이는 미토콘드리아의 내막이 주로 산화적 인산화를 통한 아데노신 삼인산(ATP) 생성에 관여하는 것과는 다른 기능적 특징이며, 미토콘드리아에는 내부 엽록체 막과 같은 기능을 하는 막 구조가 없다.[107]
11. 3. 1. 주변 망상체
주어진 원본 소스에는 '주변 망상체'에 해당하는 내용이 포함되어 있지 않습니다.11. 4. 스트로마
내부 엽록체 막 안쪽과 틸라코이드 공간 바깥쪽을 채우는 액체 부분을 스트로마라고 한다.[107] 스트로마는 단백질이 풍부하며, 알칼리성을 띠는 수용액 상태이다.[108] 이는 세포내 공생설에 따라 시아노박테리아의 세포질에 해당하는 부분으로 여겨진다.[107]스트로마 내부에는 엽록체 DNA의 핵양체, 엽록체 리보솜, 플라스토글로불리, 녹말 과립, 그리고 광합성과 관련된 다양한 효소와 단백질들이 존재한다.[107] 특히, CO2를 G3P와 같은 유기물로 고정하는 캘빈 회로가 스트로마에서 일어난다.
엽록체는 독자적인 엽록체 DNA를 가지고 있으며, 이는 스트로마 내에서 핵양체 형태로 존재한다.[62] 진핵생물의 히스톤이나 세균의 HU, DPS와 같은 DNA 결합 단백질은 녹색 식물 엽록체에는 없으며, 대신 아황산 환원 효소가 DNA 결합 단백질로서 기능하는 것으로 알려져 있다.[14] 엽록체 DNA는 세포핵의 DNA처럼 복제, 전사, 번역 과정을 거친다.
11. 4. 1. 엽록체 리보솜
엽록체는 자체적으로 리보솜을 가지고 있으며, 이를 이용해 단백질의 일부를 합성한다. 엽록체 리보솜은 세포질에 있는 세포질 리보솜보다 크기가 작아서, 약 2/3 정도(약 17nm 대 25nm)이다.[115] 이 리보솜은 엽록체 DNA에서 전사된 mRNA 정보를 읽어 단백질로 번역하는 역할을 한다.엽록체 리보솜은 세균의 리보솜과 유사한 구조를 가지고 있지만,[14][88] 엽록체에서의 번역 과정은 세균보다 더 복잡하며, 엽록체 리보솜만이 가지는 고유한 특징들도 있다.[118][119] 예를 들어, 일부 녹조류나 유글레나 엽록체의 작은 소단위체 리보솜 RNA에는 샤인-달가노 서열 인식 부위가 없는데, 이 서열은 대부분의 엽록체나 원핵생물에서 번역을 시작하는 데 중요한 역할을 하는 것으로 알려져 있다.[120][121][122] 이러한 특징은 다른 색소체나 원핵생물에서도 드물게 발견된다.[120][123] 또한, 고등 식물의 엽록체에서는 23S rRNA의 3' 말단과 유사한 구조를 가진 4.5S rRNA가 추가로 발견되기도 한다.[119]
11. 4. 2. 플라스토글로불리
플라토글로불리(Plastoglobuli영어, '''단수''' ''plastoglobulus'')는 지름이 약 45nm~60nm인 구형의 지질과 단백질 덩어리이다.[107][124] 지질 단분자막으로 둘러싸여 있다.[124] 플라토글로불리는 모든 엽록체에서 발견되지만,[115] 엽록체가 산화 스트레스를 받거나,[124] 노화되어 노화 엽록체로 전환될 때 더 흔하게 나타나며 크기도 커진다.[107][124] 또한 에티오플라스트에서도 흔히 발견되지만, 에티오플라스트가 엽록체로 성숙해짐에 따라 그 수는 감소한다.[124]플라토글로불리는 지질 합성과 대사에 관여하는 구조 단백질과 효소를 모두 포함하고 있다. 플라스토퀴논, 비타민 E, 카로티노이드, 엽록소를 포함한 다양한 종류의 지질을 함유하고 있다.[124]
과거에는 플라토글로불리가 스트로마에 자유롭게 떠다니는 것으로 생각되었지만, 현재는 틸라코이드에 영구적으로 부착되어 있거나, 틸라코이드에 부착된 다른 플라토글로불리에 부착되어 있는 것으로 여겨진다. 이러한 구조를 통해 플라토글로불리는 틸라코이드 네트워크와 내용물을 교환할 수 있다.[124] 정상적인 녹색 엽록체에서는 대부분 단독으로 모엽록체에 직접 부착되어 있다. 오래되거나 스트레스를 받은 엽록체에서는 연결된 그룹이나 사슬 형태로 나타나는 경향이 있지만, 항상 틸라코이드에 고정되어 있다.[124]
플라토글로불리는 틸라코이드 막의 지질 이중층 사이에 거품처럼 나타나거나, 기존의 플라토글로불리에서 싹이 트면서 형성된다. 절대로 분리되어 스트로마로 떠다니지는 않는다.[124] 거의 모든 플라토글로불리는 틸라코이드 디스크 또는 시트의 곡선 가장자리에서 형성된다. 또한 그라나 틸라코이드보다 스트로마 틸라코이드에서 더 흔하게 나타난다.[124]
11. 4. 3. 녹말 과립
녹말 과립은 엽록체에서 매우 흔하게 발견되며, 일반적으로 엽록체 부피의 15%를 차지한다.[126] 아밀로플라스트와 같은 다른 색소체에서는 엽록체의 모양을 변형시킬 정도로 크게 발달하기도 한다.[115] 녹말 과립은 막으로 둘러싸여 있지 않고, 단순히 기질에 축적된 녹말 덩어리이다.[115]엽록체가 당류를 합성하는 낮 동안 녹말 과립이 나타나고 성장하며, 밤에는 세포 호흡의 연료로 사용되거나 체관부를 통해 다른 기관으로 운반될 당류를 공급하기 위해 소비된다.[125] 그러나 성숙한 엽록체에서는 녹말 과립이 완전히 사라지거나 새로 축적되는 경우는 드물다.[126]
녹말 과립의 조성과 위치는 엽록체 계통에 따라 다양하다. 예를 들어, 홍조류의 경우 녹말 과립은 엽록체 내부가 아닌 세포질에서 발견된다.[127] 또한, C4 식물의 엽육 조직에 있는 엽록체는 당류를 직접 합성하지 않기 때문에 녹말 과립을 가지지 않는다.[107]
11. 4. 4. RuBisCO
엽록체 기질에는 많은 단백질이 존재하지만, 가장 흔하고 중요한 것은 RuBisCO로, 이는 아마도 지구상에서 가장 풍부한 단백질일 것이다.[108] RuBisCO는 CO2를 당 분자로 고정하는 효소이다. C3 식물에서 RuBisCO는 모든 엽록체에 풍부하게 존재하지만, C4 식물에서는 유관속초 엽록체에 국한되어 있으며, 이곳에서 C4 식물의 캘빈 회로가 수행된다.[147]11. 5. 피레노이드
일부 뿔이끼류[128]와 조류의 엽록체에는 '''피레노이드'''(pyrenoid)라고 불리는 구조가 있다. 이 구조는 고등 식물에서는 발견되지 않는다.[129]피레노이드는 대체로 둥근 모양의 구조체로 굴절률이 높으며, 이를 포함하는 생물에서 녹말이 축적되는 장소이다. 전자 현미경으로 관찰 시 전자 투과성이 없는 기질로 구성되어 있고, 반구형 녹말판 두 개로 둘러싸여 있다. 피레노이드가 성숙함에 따라 녹말이 축적된다.[130] 조류의 경우, 엽록체(색소체) 안에 보통 1개에서 여러 개의 피레노이드가 존재하며, 단백질 성분으로 이루어져 있다. 광합성 산물을 저장 물질로 변환하는 과정에 관여하는 것으로 여겨지며, 특히 녹조류에서는 녹말 합성이 피레노이드에서 이루어진다.
탄소 농축 기작을 가진 조류에서는 효소 RuBisCO가 피레노이드에서 발견된다. CO2가 부족한 환경에서는 녹말이 피레노이드 주변에 축적되기도 한다.[129] 피레노이드는 기존 피레노이드가 분열하여 새로운 피레노이드를 형성하거나, "드 노보" (de novo) 방식으로 새로 생성될 수 있다.[130][131]
11. 6. 틸라코이드 시스템
엽록체 내부에는 틸라코이드(thylakoid)라는 막으로 이루어진 시스템이 존재한다. 틸라코이드는 광합성 과정 중 빛 에너지를 화학 에너지로 전환하는 명반응이 일어나는 핵심적인 장소이다. 이 막 구조는 납작한 주머니 모양을 하고 있으며, 내부에 빛 에너지를 흡수하는 엽록소를 비롯한 다양한 광합성 색소와 단백질 복합체를 포함하고 있다.틸라코이드 주머니들은 종종 동전처럼 겹겹이 쌓여 그라나(granum, 복수형 grana)라는 구조를 형성하며, 개별 틸라코이드 또는 그라나들은 서로 연결되어 엽록체 기질인 스트로마 내에서 복잡한 막 네트워크를 이룬다. 틸라코이드 막으로 둘러싸인 내부 공간은 내강(lumen)이라고 부른다. 이러한 틸라코이드 시스템의 구조는 빛 에너지를 효율적으로 포획하고 전달하여 광합성 반응이 원활하게 진행되도록 한다.
11. 6. 1. 틸라코이드 구조
Outer membrane:외막Intermembrane space:막 사이 공간
Inner membrane:내막
Stroma(matrix): 스트로마(기질)
Granum(pl. grana): 그라나
Thylakoid:틸라코이드
Lamella 라멜라
Lumen:틸라코이드 내강
Vesicle:소포]]
미토콘드리아와 유사하게 엽록체도 내막에서 생체 내 합성을 수행한다. 특히 종자 식물의 엽록체에서 내막은 실질적인 광합성이 일어나는 장소이며, 이 구조를 틸라코이드(Thylakoid)라고 부른다. 틸라코이드는 원반 모양이며, 여러 개가 겹겹이 쌓여 그라나(Granum, 복수형 Grana)를 형성한다. 틸라코이드 내부의 빈 공간은 내강(lumen)이라고 한다.
틸라코이드 막 위에는 엽록소와 함께 보조색소, 그리고 광합성에 관여하는 다양한 효소를 포함한 단백질들이 존재한다. 엽록체의 엽록소는 주로 가시광선 영역의 청색광과 적색광을 흡수하고 녹색광은 잘 흡수하지 않아 반사시키기 때문에 우리 눈에는 녹색으로 보인다. 세포의 수명이 다하거나 가뭄, 저온과 같은 좋지 않은 환경 조건에 처하면 엽록소가 파괴되는데, 이때 크산토필이나 카로테노이드 같은 보조색소들의 색깔이 드러나면서 잎이 노란색이나 주황색 등으로 알록달록하게 변한다. 조류(藻類)의 경우, 육상식물과는 달리 틸라코이드의 수에 따라 황금색, 갈색, 적색 등 다양한 색을 띠기도 한다.
C4 식물에서는 광합성 효율을 높이기 위해 특화된 틸라코이드 구조를 가진 엽록체가 발견된다. C4 식물은 광합성 과정 중 RuBisCO 효소가 이산화 탄소 대신 산소와 반응하여 에너지를 낭비하는 문제(광호흡)를 극복하기 위해, 명반응과 캘빈 회로를 서로 다른 세포에서 수행하도록 분화시켰다.[146]
- 중간엽 세포의 엽록체: 명반응에 특화되어 있다. 이곳의 엽록체는 일반적인 식물처럼 그라나(grana)를 이루는 틸라코이드 구조를 가지며, ATP와 NADPH를 생성하고 산소를 방출한다. 하지만 RuBisCO 효소는 거의 없다.[147] 생성된 이산화 탄소는 4탄소 화합물 형태로 유관속초 세포로 전달된다.[146]
- 유관속초 세포의 엽록체: 캘빈 회로에 특화되어 있다. 이곳의 엽록체는 명반응을 거의 수행하지 않아 산소 농도가 낮게 유지되므로 RuBisCO 효소의 비효율적인 반응을 최소화한다. 따라서 그라나 구조가 발달하지 않았고, 대신 스트로마에 개별적으로 떠다니는 틸라코이드들이 존재한다. 이 틸라코이드들은 순환적 전자 흐름을 통해 산소를 생성하지 않으면서 캘빈 회로에 필요한 ATP를 합성한다. 이를 위해 광계 II는 없고 광계 I만 가지고 있다.[147][146] 유관속초 세포의 엽록체는 설탕 합성이 주 역할이므로 녹말 과립을 많이 포함하는 경우가 많다.[147]
두 종류의 C4 식물 엽록체 모두 물질 수송을 위한 표면적을 늘리기 위해 엽록체 주변 망상체를 많이 가지고 있다.[147][117][148] 일반적으로 중간엽 세포의 엽록체가 유관속초 세포의 엽록체보다 주변 망상체를 약간 더 많이 가진다.[149]
11. 6. 2. 틸라코이드 구성
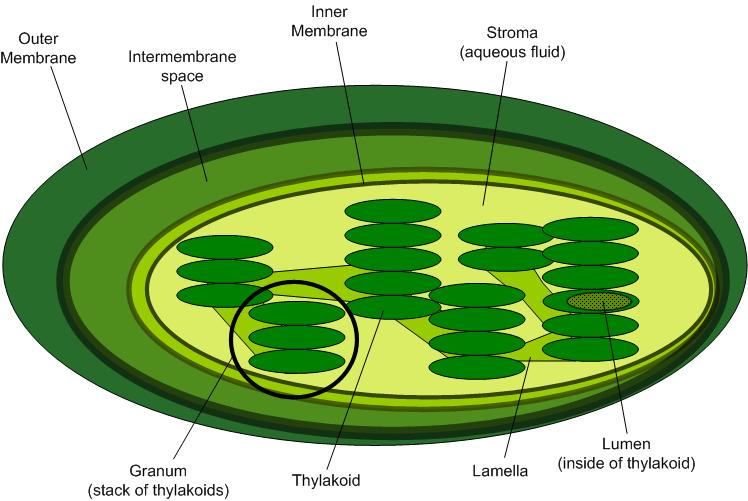
종자 식물의 엽록체 내막은 실질적인 광합성이 일어나는 틸라코이드라고 한다. 틸라코이드는 원반형이며, 이들이 겹겹이 쌓여 그라나(granum, 복수형 grana)를 형성한다. 틸라코이드 내부의 빈 공간은 내강(lumen)이라고 부른다.
틸라코이드 막 위에는 엽록소와 함께 보조색소, 광합성에 관여하는 효소를 포함한 단백질들이 존재한다. 이들은 광합성 과정에서 중요한 역할을 수행한다.
11. 7. 색소 및 엽록체 색상
엽록체가 색을 띠는 것은 내부에 다양한 광합성 색소가 존재하기 때문이다. 이 색소들은 틸라코이드 막에 위치하며[193] 빛 에너지를 흡수하고 전달한다. 가장 대표적인 색소는 엽록소(클로로필)로, 주로 가시광선의 청색과 적색 파장을 흡수하고 녹색 파장을 반사하여 엽록체가 녹색으로 보이게 한다[193]。엽록체에는 엽록소 외에도 다양한 보조 색소들이 함께 존재한다. 노란색 계열의 카로테노이드[193], 갈조류의 갈색을 나타내는 푸코잔틴[193], 홍조류의 붉은색을 나타내는 피코빌린[193] 등이 그 예이다. 이처럼 엽록체에 포함된 색소의 종류와 비율에 따라 식물이나 조류는 다양한 색을 띨 수 있다. 예를 들어, 환경 변화 시 엽록소가 분해되면 카로테노이드 등의 색이 드러나기도 하며, 조류는 종류에 따라 엽록소 외 다른 색소의 영향으로 갈색이나 붉은색을 띠기도 한다[193]。
11. 7. 1. 엽록소
엽록체는 엽록소를 가지고 있어 뚜렷한 녹색을 띤다[193]。 엽록소는 주로 가시광선의 청색과 적색 파장을 흡수하고 녹색 파장은 잘 흡수하지 않아 반사하기 때문에 우리 눈에 녹색으로 보인다. 이러한 엽록소를 비롯한 '''광합성 색소''' 덕분에 엽록체는 뚜렷한 색을 가지며, 살아있는 세포를 관찰할 때 가장 쉽게 확인할 수 있는 세포 소기관 중 하나이다.엽록체에는 엽록소 외에도 노란색 계열의 카로테노이드와 같은 보조 색소들이 존재한다[193]。 평소에는 다량의 엽록소 때문에 녹색이 두드러지지만, 세포의 수명이 다하거나 가뭄, 저온 등 환경 조건이 나빠지면 엽록소가 먼저 파괴된다. 이때 카로테노이드나 크산토필 같은 보조 색소들의 색이 드러나면서 잎이 노란색이나 붉은색 등으로 변하는 단풍 현상이 나타난다.
조류의 경우, 가지고 있는 광합성 색소의 종류가 다양하여 육상 식물과 다른 색을 띠기도 한다. 예를 들어, 갈조류의 엽록체는 엽록소 외에도 푸코잔틴을 다량 함유하여 갈색으로 보이며, 홍조류는 피코빌린 색소를 가지고 있어 붉은색으로 보인다[193]。
엽록소와 같은 광합성 색소와 광합성의 명반응에 관여하는 효소들은 엽록체 내부의 틸라코이드 막 위에 존재한다.
11. 7. 2. 카로티노이드
엽록체에는 주된 광합성 색소인 엽록소 외에도 보조적인 색소들이 존재한다. 그중 하나가 카로테노이드로, 이는 노란색 계열의 색을 띠는 색소체 그룹이다.[193] 일반적으로 엽록체는 다량의 엽록소 때문에 녹색으로 보이지만, 카로테노이드 역시 함께 포함하고 있다.[193]카로테노이드는 보조색소로서 기능한다. 식물 세포의 수명이 다하거나 가뭄, 저온과 같은 환경 조건이 좋지 않아지면 엽록소가 먼저 파괴된다. 이때 엽록소의 녹색에 가려져 있던 카로테노이드나 크산토필과 같은 다른 보조색소들의 색깔(주로 노란색이나 주황색 계열)이 드러나게 되어, 잎이 알록달록하게 물드는 현상을 관찰할 수 있다.
11. 7. 3. 피코빌린
엽록체는 일반적으로 클로로필을 다량 포함하고 있어 녹색으로 보이지만[193], 포함된 색소의 종류에 따라 다른 색을 띠기도 한다. 예를 들어 갈조류의 엽록체는 클로로필 외에도 푸코잔틴을 가지고 있어 갈색으로 보인다.[193] 이와 달리 홍조류는 피코빌린이라는 색소를 가지고 있어 엽록체가 붉은색으로 보인다.[193]12. C4 식물의 특화된 엽록체
엽록체는 광합성 과정에서 이산화 탄소를 당 분자로 고정하기 위해 RuBisCO라는 효소를 사용한다. 하지만 RuBisCO는 이산화 탄소와 산소를 잘 구별하지 못하여, 산소 농도가 높으면 실수로 당 대신 다른 물질에 산소를 결합시키는 반응(광호흡)을 일으킨다. 이 과정은 ATP 에너지를 소모하고 이산화 탄소를 방출하지만, 당은 생성하지 못한다. 광합성의 초기 단계인 명반응에서 산소가 생성되기 때문에, 캘빈 회로에서 RuBisCO를 사용하는 과정에 문제가 생길 수 있다.[146]
C4 식물은 명반응과 캘빈 회로를 공간적으로 분리하여 이 문제를 해결하는 방식을 진화시켰다. 빛 에너지를 ATP와 NADPH에 저장하는 명반응은 C4 식물 잎의 중간엽 세포에서 일어난다. 반면, RuBisCO를 사용하여 저장된 에너지를 당으로 전환하는 캘빈 회로는 잎맥을 둘러싼 유관속초 세포에서 진행된다.[146]
결과적으로 C4 식물의 중간엽 세포와 유관속초 세포의 엽록체는 각각 다른 광합성 단계에 특화되어 있다.
- 중간엽 세포 엽록체: 명반응에 특화되어 RuBisCO가 없다. ATP, NADPH, 그리고 산소를 만드는 데 필요한 정상적인 그라나와 틸라코이드를 가지고 있다.[147] 이 세포에서는 이산화 탄소를 4탄소 화합물에 고정하는데, 이 때문에 이 과정을 C4 광합성이라고 부른다. 생성된 4탄소 화합물은 유관속초 세포의 엽록체로 운반되어 이산화 탄소를 방출한 뒤 다시 중간엽 세포로 돌아온다.[146]
- 유관속초 세포 엽록체: 캘빈 회로에 특화되어 명반응을 수행하지 않는다. 따라서 산소가 축적되어 RuBisCO의 활성을 방해하는 것을 막을 수 있다.[146] 이 때문에 그라나 구조가 없지만, 스트로마에 자유롭게 떠 있는 틸라코이드를 가지고 순환적 전자 흐름을 수행한다. 이 과정은 산소를 생성하지 않으면서 캘빈 회로에 필요한 ATP를 광 구동 방식으로 합성한다. 유관속초 세포 엽록체는 광계 II가 없고 광계 I만 가지고 있는데, 이는 순환적 전자 흐름에 필요한 유일한 단백질 복합체이다.[147][146] 유관속초 엽록체의 주된 역할은 캘빈 회로를 통해 당을 만드는 것이므로, 많은 양의 녹말 과립을 포함하는 경우가 많다.[147]
두 종류의 엽록체 모두 엽록체 주변 망상체를 많이 가지고 있어[147] 물질 수송을 위한 표면적을 넓힌다.[117][148] 중간엽 엽록체가 유관속초 엽록체보다 주변 망상체를 약간 더 많이 가지고 있다.[149]
13. 기능 및 화학
엽록체는 클로로필(엽록소)과 같은 '''광합성 색소'''를 포함하고 있어 뚜렷한 녹색을 띠며, 살아있는 세포를 관찰할 때 가장 쉽게 확인할 수 있는 세포 소기관 중 하나이다.
관다발 식물 중 광합성을 하지 않는 세포에서는 엽록체 대신 다른 종류의 색소체가 발견된다. 예를 들어 녹말을 저장하는 아밀로플라스트, 색소를 함유한 크로모플라스트, 색소가 없는 백색체 등이 있다. 이들 색소체는 종류는 다르지만 모두 이중 막 구조를 가지며, 고유의 엽록체 DNA(cpDNA)를 가지고 있다는 공통점이 있다.
엽록체의 모양은 생물 분류군에 따라 매우 다양하며, 특히 조류에서 다양한 형태가 관찰된다. 실이끼에서는 리본 모양의 엽록체가 세포 내에서 나선형으로 배열되어 있고, 별말의 엽록체는 별 모양을 하고 있다. 판 모양의 엽록체를 가진 조류도 존재한다.
종자 식물의 엽록체는 대부분 지름 약 5µm 정도의 단순한 원반 모양이다. 세포 내에서는 주로 가장자리에 배열되어 있는 것을 볼 수 있는데, 이는 세포 중앙 부분을 큰 액포가 차지하고 있기 때문이다. 엽록체는 원형질 유동에 따라 세포 내에서 이동하기도 한다.
구조적으로 종자 식물의 엽록체는 바깥쪽을 이중 막이 감싸고 있으며, 그 안쪽의 기질 부분을 스트로마라고 한다. 스트로마 내에는 틸라코이드라고 불리는 납작한 막 주머니 구조가 많이 존재한다. 틸라코이드가 여러 겹 쌓여 동전 더미 같은 구조를 이루는데, 이를 그라나(복수형: 그라눔)라고 한다.
스트로마에는 엽록체 고유의 DNA(엽록체 DNA, cpDNA)와 리보솜이 있어 자체적으로 일부 단백질을 합성할 수 있다. 틸라코이드 막에는 광합성 색소와 광합성의 명반응에 관여하는 효소들이 위치한다.
13. 1. 공변 세포 엽록체
대부분의 표피 세포와 달리 식물 기공의 공변 세포는 비교적 잘 발달된 엽록체를 포함하고 있다.[150] 그러나 정확히 어떤 기능을 하는지는 논란의 여지가 있다.[151]엽록체는 식물 세포의 거의 모든 아미노산을 기질에서 자체적으로 생성하며,[178] 황 함유 아미노산인 시스테인과 메티오닌은 제외한다.[165][166] 시스테인은 엽록체(전색체)에서도 만들어지지만, 세포질과 미토콘드리아에서도 합성되는데, 이는 막을 통과하여 필요한 곳으로 이동하는 데 어려움이 있기 때문일 것이다.[166] 엽록체는 메티오닌의 전구체를 만드는 것으로 알려져 있지만, 엽록체에서 이 경로의 마지막 단계가 수행되는지, 아니면 세포질에서 발생하는지는 불분명하다.[167]
13. 2. 식물 선천 면역
식물은 동물과 달리 특화된 면역 세포가 없으며, 모든 식물 세포가 식물 선천 면역 면역 반응에 참여한다. 엽록체는 세포 핵, 세포막, 소포체와 함께[152] 병원체 방어에서 핵심적인 역할을 수행한다. 이러한 중요성 때문에 병원체는 종종 엽록체를 공격 대상으로 삼는다.[152]식물은 크게 두 가지 주요 면역 반응을 보인다. 첫째는 감염된 세포가 스스로를 주변과 격리하고 프로그램된 세포사를 통해 제거되는 과민 반응(HR, Hypersensitive Response)이며, 둘째는 감염된 세포가 식물의 다른 부위에 병원체의 존재를 알리는 신호를 보내 전체적인 방어 태세를 갖추게 하는 전신 획득 저항성(SAR, Systemic Acquired Resistance)이다.
엽록체는 이 두 가지 반응을 모두 조절하는 데 중요한 역할을 한다. 엽록체는 의도적으로 자신의 광합성 시스템을 손상시켜 활성 산소(ROS, Reactive Oxygen Species)를 생성한다. 높은 농도의 활성 산소는 과민 반응을 유발하며, 세포 내 병원체를 직접 죽이는 효과도 있다. 반면, 낮은 농도의 활성 산소는 전신 획득 저항성을 유도하여 식물 전체적으로 방어 관련 분자의 생산을 촉진한다.[152]
일부 식물에서는 감염이 발생하면 엽록체가 감염 부위나 세포 핵 쪽으로 이동하는 것이 관찰되기도 한다.[152]
또한 엽록체는 세포 내 센서로서 기능할 수 있다. 병원체 감염 등으로 인한 세포 스트레스를 감지하면, 방어 신호로 작용하는 살리실산, 자스몬산, 일산화 질소, 활성 산소와 같은 분자들을 생산하기 시작한다. 활성 산소는 매우 불안정하여 엽록체 밖으로 직접 이동하기보다는, 다른 2차 전달자 분자를 통해 신호를 전달할 가능성이 높다. 이러한 신호 분자들은 엽록체에서 핵으로 신호를 보내 유전자 발현을 조절하는 역행 신호 전달 과정을 개시한다.[152]
방어 신호 전달 외에도, 엽록체는 과산화소체와 협력하여[153] 중요한 방어 분자인 자스몬산염 합성에 기여한다. 엽록체는 식물 세포 내 모든 지방산을 합성하는데[152][154], 이 중 리놀레산이 자스몬산염의 전구체로 사용된다.[152]
13. 3. 광합성
엽록체의 주요 기능 중 하나는 광합성 과정에서 빛 에너지를 화학 에너지로 변환하여 당 형태의 식량을 생산하는 것이다.[158][155] 물(H₂O)과 이산화 탄소(CO₂)는 광합성에 사용되며, 빛 에너지를 이용하여 당과 산소(O₂)가 생성된다.[158][155]광합성은 크게 두 단계로 나뉜다. 첫 번째 단계는 명반응으로, 물이 분해되어 산소가 생성되고 빛 에너지가 ATP와 NADPH 형태의 화학 에너지로 전환된다.[158][155] 두 번째 단계는 암반응(캘빈 회로)으로, 명반응에서 생성된 ATP와 NADPH를 사용하여 이산화 탄소로부터 당 분자를 합성한다.[158][155] 이 두 단계는 에너지 전달체인 ATP와 NADPH에 의해 서로 연결된다.[158][155]
13. 3. 1. 명반응
광합성은 크게 두 단계로 나뉘며, 첫 번째 단계인 명반응은 엽록체 내 틸라코이드 막에서 진행된다.[158][155] 이 틸라코이드 막에는 광합성 색소와 명반응에 관련된 효소들이 위치하고 있다.명반응 과정에서는 빛에너지를 흡수하여 물(H₂O) 분자를 분해하고 산소(O₂)를 방출한다.[158][155] 흡수된 빛에너지는 화학 에너지로 전환되어, 에너지 전달 물질인 ATP와 NADPH(NADP+의 환원된 형태)에 저장된다. 이렇게 생성된 ATP와 NADPH는 광합성의 다음 단계인 암반응(캘빈 회로)으로 전달되어 당을 합성하는 데 사용된다.[158][155]
13. 3. 2. 암반응

캘빈 회로는 "암반응"이라고도 불리며, 일련의 생화학 반응을 통해 CO2를 G3P라는 당 분자로 고정시키는 과정이다. 이 과정에서는 광합성의 명반응 단계에서 생성된 ATP와 NADPH의 에너지와 전자가 사용된다. 캘빈 회로는 엽록체의 기질(스트로마)에서 일어난다.[146]
"암반응"이라는 이름이 붙었지만, 실제로는 빛이 있을 때 진행되는 경우가 많다. 이는 암반응이 명반응의 산물(ATP와 NADPH)에 의존하기 때문이다.[9]
13. 4. pH
틸라코이드 막을 가로지르는 수소 이온(H+) 기울기 때문에 틸라코이드 내부의 pH는 약 4로 산성을 띠는 반면, 스트로마는 약 8로 약간 염기성을 띤다.[162][163] 캘빈 회로가 가장 효율적으로 작동하는 스트로마의 최적 pH는 8.1이며, pH가 7.3 이하로 떨어지면 반응이 거의 멈춘다.[164]빛이 존재할 때 틸라코이드 내부(루멘)의 pH는 최대 1.5 pH 단위까지 떨어질 수 있으며, 스트로마의 pH는 거의 1 pH 단위까지 상승할 수 있다.[164] 이러한 pH 변화는 광합성 과정에서 중요한 역할을 한다.
물에 녹은 이산화 탄소(CO2)는 탄산을 형성하여 분리된 엽록체의 pH를 변화시키고 광합성을 방해할 수 있지만, 살아있는 식물 세포 내의 엽록체는 이러한 영향에서 비교적 자유롭다.[163] 또한 엽록체는 잘 알려지지 않은 빛을 이용한 수송 시스템을 통해 칼륨(K+) 이온과 수소 이온(H+)을 세포 안팎으로 이동시키는 기능도 가지고 있다.[163]
13. 5. 아미노산 합성
엽록체는 식물 세포에서 필요한 거의 모든 아미노산을 기질에서 스스로 만들어 낸다.[178] 하지만 황 함유 아미노산인 시스테인과 메티오닌은 예외이다.[165][166] 시스테인의 경우, 엽록체(전색체)에서도 만들어지지만 세포질과 미토콘드리아에서도 합성된다. 이는 시스테인이 막을 통과하여 필요한 곳으로 이동하기 어렵기 때문일 수 있다.[166] 엽록체는 메티오닌의 전구체를 만드는 것으로 알려져 있으나, 메티오닌 합성의 마지막 단계가 엽록체에서 일어나는지, 아니면 세포질에서 일어나는지는 아직 명확하지 않다.[167]13. 6. 기타 질소 화합물
엽록체는 세포의 모든 퓨린과 피리미딘—DNA와 RNA에서 발견되는 질소 염기—을 생성한다.[178] 또한 아질산염(NO2−)을 암모니아(NH3)로 전환하여 식물에 질소를 공급하고, 이를 통해 아미노산과 뉴클레오타이드를 생성하게 한다.[178]13. 7. 기타 화학 제품
엽록체는 식물에서 다양하고 복잡한 지질 합성이 일어나는 중요한 장소이다.[168][169] 대부분의 지질을 만드는 데 필요한 탄소는 아세틸-CoA에서 오며, 이는 피루브산이 분해되면서 만들어진다.[168] 피루브산은 세포의 세포질에서 당분해 과정을 통해 만들어진 후, 막을 통해 수동적으로 엽록체 안으로 들어온다.[170] 또한, 피루브산은 세포질에서 만들어진 포스포엔올피루브산으로부터 엽록체 내에서 직접 생성될 수도 있다.[168] 하지만 세포질에 있는 아세테이트는 엽록체 내 지질 합성에 직접 사용될 수 없다.[171] 엽록체에서 주로 만들어지는 지방산은 탄소 원자가 16개 또는 18개이며, 0개에서 3개 사이의 시스 이중 결합을 가진다.[172]아세틸-CoA로부터 지방산을 만드는 과정에는 주로 두 가지 효소가 필요하다. 첫 번째는 아세틸-CoA 카복실라제로, 지방산 합성의 첫 단계와 길이를 늘리는 연장 단계 모두에 필요한 말로닐-CoA를 만든다. 두 번째는 지방산 합성 효소(FAS)인데, 이는 여러 효소와 보조 인자들이 모인 큰 복합체로, 아실 사슬이 만들어지는 동안 이를 유지하는 아실 운반 단백질(ACP)을 포함한다. 지방산 합성은 말로닐-ACP와 아세틸-CoA가 결합하여 케토부티릴-ACP를 생성하는 것으로 시작된다. 이후 NADPH를 사용하는 두 번의 환원 과정과 한 번의 탈수 과정을 거쳐 부티릴-ACP를 생성한다. 지방산의 길이는 말로닐-ACP 축합, 환원 및 탈수의 반복되는 사이클을 통해 연장된다.[168]
다른 지질은 메틸-에리트리톨 인산(MEP) 경로에서 유래하며, 지베렐린, 스테롤, 앱시스산, 피톨, 그리고 다양한 2차 대사 산물로 구성된다.[168]
14. 위치
엽록체는 식물 세포나 조류 세포 내에 존재하며, 세포 분열 시 함께 분열하여 딸세포로 전달된다. 엽록체의 구체적인 분포와 세포 내에서의 위치 이동은 빛 조건 등 환경 요인에 따라 달라진다. 자세한 내용은 하위 문단을 참고한다.
14. 1. 식물 내 분포
다세포 식물의 모든 세포가 엽록체를 포함하는 것은 아니다. 식물의 녹색 부분은 모두 엽록소에서 색이 나오기 때문에 엽록체를 포함한다.[9] 엽록체를 포함하는 식물 세포는 주로 유조직 세포이며, 후각 조직에서도 발견될 수 있다.[173] 이러한 세포를 엽육세포라고 하며, 육상 식물의 전형적인 엽육세포 하나에는 약 10개에서 100개의 엽록체가 들어있다.대부분의 식물에서 엽록체는 잎에 집중되어 있으며, 잎 조직 1제곱 밀리미터당 50만 개가 존재할 수 있다.[9] 잎 내부에서는 주로 중간 세포 층과 기공의 공변 세포에서 발견된다. 책상 조직 세포는 세포당 30~70개, 공변 세포는 약 8~15개의 엽록체를 가지며 엽록소 함량도 더 적다. 특히 C4 식물의 경우, 잎의 유관속초 세포에서도 엽록체가 발견되어 캘빈 회로를 수행한다. 잎의 표피에서는 엽록체가 거의 발견되지 않는다.[150] 그러나 선인장처럼 줄기에서 엽록체가 발견되거나[174], 가지, 꽃잎, 열매 등 다른 기관에서 발달하는 경우도 있다.[194]
관다발 식물의 경우, 광합성을 하지 않는 세포에서는 엽록체 대신 색소체(아밀로플라스트, 크로모플라스트, 백색체 등) 형태로 존재한다. 모든 색소체는 이중 막 구조와 자체 DNA를 가진다는 공통점이 있다.
종자 식물 엽록체의 크기는 일반적으로 직경 5μm 정도이다. 현미경 관찰 시, 세포 중앙의 큰 액포 때문에 세포 가장자리에 배열된 모습이 흔히 보이며, 원형질 유동에 따라 움직이는 것을 관찰할 수 있다.
14. 2. 세포 내 위치
잎의 중간엽 세포는 엽록체를 많이 가지고 있다. 기공을 둘러싼 공변세포 역시 엽록체를 포함하지만, 중간엽 세포보다는 그 수가 훨씬 적다.엽록체는 빛의 세기에 따라 세포 내에서 위치를 바꾼다. 강한 직사광선 아래에서는 빛에 의한 손상을 최소화하기 위해 세포의 옆면 벽(사벽 세포벽)을 따라 쌓이는 형태로 배열된다. 반면, 빛이 약한 어두운 환경에서는 빛을 최대한 많이 흡수하기 위해 세포의 윗면과 아랫면 벽(주벽)을 따라 넓게 퍼진다.
14. 2. 1. 엽록체 이동
식물과 조류 세포의 엽록체는 가용 광원에 가장 적합하도록 스스로를 정렬할 수 있다. 저조도 조건에서는 빛을 흡수하는 표면적을 최대화하기 위해 얇게 펼쳐진다. 반면, 강한 빛 아래에서는 식물 세포의 세포벽을 따라 수직 열로 정렬하거나 옆으로 돌아서 빛이 가장자리로만 닿도록 하여 은신처를 찾는다. 이렇게 하면 과도한 빛 노출을 줄이고 광산화 손상으로부터 엽록체를 보호할 수 있다.[175] 엽록체가 서로 뒤에 숨거나 펼쳐지는 방식으로 빛 노출을 조절하는 능력은 육상 식물이 몇 개의 큰 엽록체 대신 여러 개의 작은 엽록체를 가지도록 진화한 이유 중 하나일 수 있다.[184]엽록체 이동은 식물에서 발견되는 가장 정교하게 조절되는 자극-반응 시스템 중 하나로 여겨진다.[176] 미토콘드리아 역시 엽록체가 이동할 때 함께 움직이는 것이 관찰되었다.[177]
고등 식물에서 엽록체 이동은 주로 포토트로핀이라는 청색광 광수용체 단백질에 의해 제어된다. 이 단백질은 식물의 굴광성에도 관여한다. 일부 조류, 이끼, 양치식물, 속씨식물에서는 청색광뿐만 아니라 적색광도 엽록체 이동에 영향을 미친다.[175] 그러나 매우 긴 파장의 적색광은 이동을 촉진하기보다는 억제하는 경향이 있다. 일반적으로 청색광은 엽록체가 강한 빛을 피해 숨도록 유도하는 반면, 적색광은 빛 흡수를 최대화하기 위해 엽록체를 펼쳐지게 한다.[177]
수생 속씨식물인 ''거대한 가래''(Vallisneria gigantea) 연구에 따르면, 엽록체는 빛에 노출된 지 5분 이내에 움직이기 시작할 수 있지만, 처음에는 명확한 방향성을 보이지 않는다. 엽록체는 미세 필라멘트라는 세포 내 구조물을 따라 이동하며, 이동 후에는 미세 필라멘트 망이 엽록체를 둘러싸는 벌집 모양 구조를 형성한다. 이는 미세 필라멘트가 엽록체를 제자리에 고정하는 데 기여할 수 있음을 시사한다.[176][177]
최근 엽록체는 유전자 변형 작물(GMO) 개발 분야에서 주목받고 있다. 대부분의 속씨식물에서 엽록체는 모계를 통해서만 유전되고 부계(꽃가루)를 통해 유전되지 않는다. 따라서 엽록체 내에 도입된 전이 유전자는 꽃가루를 통해 다른 식물로 퍼져나갈 가능성이 매우 낮다. 이러한 특성 때문에 플라스티드 형질전환 기술은 유전자가 외부로 유출될 위험이 낮은, 즉 생물학적 제한이 강화된 유전자 변형 식물을 만드는 데 유용하게 활용될 수 있으며, 이는 환경적 위험을 현저히 낮추는 장점이 있다. 이 생물학적 제한 전략은 유전자 변형 작물과 일반 작물 및 파생 식품 및 사료의 공존을 확립하는 데 적합한 방법으로 평가된다. 이 메커니즘의 완전한 신뢰성은 모든 작물 종에 대해 검증된 것은 아니지만, 담배 식물을 대상으로 한 최근 연구 결과는 100만분의 3이라는 매우 낮은 수준의 형질전환 엽록체 유전자 유출 실패율을 보여주어 그 가능성을 시사했다.[192]
15. 분화, 복제 및 유전
엽록체는 식물 세포의 색소체 중 하나로, 광합성을 수행하는 중요한 소기관이다. 세포내 공생설에 따르면 독자적인 DNA와 리보솜을 가지고 있다. 식물의 모든 엽록체는 접합자[178] 또는 수정된 난자에 있는 미분화된 전색소체로부터 분화된다. 전색소체는 특정 조건 하에서 엽록체 또는 다른 종류의 색소체로 발달하며, 이들 색소체 간에는 상호 전환이 가능하다.[178] 엽록체는 세포 분열과 별개로 독자적으로 분열하여 증식하며,[180][181] 대부분 한쪽 부모로부터 유전되는 단성 유전 방식으로 다음 세대에 전달된다.[190][191][192] 엽록체의 분화, 복제(분열), 유전에 대한 더 자세한 내용은 각각의 하위 섹션에서 다룬다.
15. 1. 색소체 상호 전환
엽록체는 식물 세포 소기관의 한 종류인 '''색소체'''이다. 식물의 모든 색소체는 접합자나 수정된 난자에서 발견되는 미분화된 전색소체에서 유래한다.[178] 전색소체는 주로 성숙한 식물의 정단 분열 조직에서 발견된다. 뿌리 끝 분열 조직의 전색소체는 일반적으로 엽록체로 발달하지 않고[179], 대신 전분을 저장하는 전분체로 발달하는 경우가 많다.[178]줄기의 정단 분열 조직에 있는 전색소체는 빛에 노출되면 잎이 성숙하면서 광합성을 하는 잎 조직에서 점차 엽록체로 발달할 수 있다.[12] 이 과정에서 내부 색소체 막이 안으로 접혀 들어가 스트로마로 돌출되는 막 구조를 형성하고, 이 막 구조가 접혀 틸라코이드와 그라나가 된다.[180]
만약 피자식물의 줄기가 빛에 노출되지 않으면, 전색소체는 엽록체가 되기 전에 에티오플라스트라는 중간 단계로 발달할 수 있다. 에티오플라스트는 클로로필이 없고, 스트로마 내부에 전층체라고 불리는 관 모양 격자 구조를 가진다. 클로로필은 없지만 노란색 클로로필 전구체를 가지고 있다.[12] 에티오플라스트가 빛에 노출되면 몇 분 안에 전층체가 틸라코이드 구조로 재배열되기 시작하고 클로로필 합성이 시작된다. 에티오플라스트가 엽록체로 완전히 전환되는 데는 몇 시간이 걸린다.[180] 겉씨식물은 엽록체를 형성하는 데 빛이 필요하지 않다.[180]
하지만 빛이 있다고 해서 전색소체가 반드시 엽록체로 발달하는 것은 아니다. 전색소체가 어떤 종류의 색소체로 분화할지는 주로 세포 핵의 유전 정보에 의해 결정되며[12], 이는 해당 세포의 종류에 따라 달라진다.[178] 그림에서 볼 수 있듯이, 엽록체를 포함한 다양한 색소체들은 특정 조건 하에서 서로 전환될 수 있다.
15. 2. 분열
대부분의 광합성 세포 내 엽록체는 전엽록체 또는 에티오플라스트로부터 직접 발달하지 않는다. 실제로 전형적인 분열 조직 식물 세포는 단지 7~20개의 전엽록체를 포함한다. 이러한 전엽록체는 엽록체로 분화되며, 이는 성숙한 광합성 식물 세포에서 발견되는 30~70개의 엽록체를 생성하기 위해 분열된다. 세포가 세포 분열을 하면 엽록체 분열은 두 개의 딸 세포 사이를 분할하기 위한 추가 엽록체를 제공한다.[181]단세포 조류에서 엽록체 분열은 새로운 엽록체가 형성되는 유일한 방법이다. 전엽록체 분화는 없으며, 조류 세포가 분열하면 그 엽록체가 함께 분열하고, 각 딸 세포는 성숙한 엽록체를 받는다.[180]
세포 내 거의 모든 엽록체가 분열하며, 빠르게 분열하는 소수의 엽록체만 있는 것은 아니다.[182] 엽록체는 특정 S기를 갖지 않으며, DNA 복제는 숙주 세포의 DNA 복제와 동기화되거나 제한되지 않는다.[183] 엽록체 분열에 대해 알려진 대부분의 정보는 ''애기장대''와 홍조류 ''Cyanidioschyzon merolæ''와 같은 생물을 연구한 결과이다.[184]
분열 과정은 단백질 FtsZ1과 FtsZ2가 필라멘트로 조립되고 단백질 ARC6의 도움을 받아 엽록체의 스트로마 내에 Z-ring이라고 하는 구조를 형성하면서 시작된다.[184][185] Min 시스템은 Z-ring의 위치를 관리하여 엽록체가 거의 균등하게 절단되도록 보장한다. 단백질 MinD는 FtsZ가 연결되어 필라멘트를 형성하는 것을 방지한다. 또 다른 단백질 ARC3도 관련될 수 있지만, 아직 잘 알려져 있지 않다. 이러한 단백질은 엽록체의 극에서 활성화되어 그곳에서 Z-ring 형성을 방지하지만, 엽록체의 중심 근처에서는 MinE가 이를 억제하여 Z-ring이 형성되도록 한다.[184]
다음으로 두 개의 플라스티드 분열 고리(PD 고리)가 형성된다. 내측 플라스티드 분열 고리는 엽록체의 내막 안쪽에 위치하며 먼저 형성된다.[184] 외측 플라스티드 분열 고리는 외측 엽록체 막을 감싸고 있다. 이 고리는 폭이 약 5nm인 필라멘트로 구성되며,[184] 6.4nm 간격으로 배열되어 엽록체를 조인다. 이것이 엽록체 수축이 시작될 때이다.[185] ''Cyanidioschyzon merolæ''와 같은 몇몇 종에서 엽록체는 엽록체의 막간 공간에 위치한 세 번째 플라스티드 분열 고리를 가지고 있다.[184][185]
수축 단계 후반에, 다이나민 단백질이 외측 플라스티드 분열 고리 주변에 조립되어,[185] 엽록체를 조이는 힘을 제공한다.[184] 한편, Z-ring과 내측 플라스티드 분열 고리는 분해된다.[185] 이 단계 동안, 스트로마 내에서 떠다니는 많은 엽록체 DNA 플라스미드는 분할되어 두 개의 형성 중인 딸 엽록체로 분배된다.[186]
나중에, 다이나민은 외측 플라스티드 분열 고리 아래로 이동하여 엽록체의 외막과 직접 접촉하여,[185] 엽록체를 두 개의 딸 엽록체로 절단한다.[184] 외측 플라스티드 분열 고리의 잔여물은 두 개의 딸 엽록체 사이에 떠 있으며, 다이나민 고리의 잔여물은 딸 엽록체 중 하나에 부착되어 있다.[185]
엽록체 분열에 관여하는 5~6개의 고리 중 외측 플라스티드 분열 고리만 수축 및 분열 단계 전체에 존재한다. Z-ring이 먼저 형성되지만, 수축은 외측 플라스티드 분열 고리가 형성될 때까지 시작되지 않는다.[185]
15. 2. 1. 조절
조류 중 단일 엽록체를 가진 종의 경우, 세포 분열 시 각 딸 세포가 엽록체를 하나씩 물려받도록 엽록체 분열을 정교하게 조절하는 것이 매우 중요하다. 이는 엽록체를 세포 내에서 새로 만들 수 없기 때문이다.[187][184] 반면, 식물처럼 세포 하나에 여러 개의 엽록체를 가진 생물에서는 이러한 조절이 상대적으로 덜 엄격하며 덜 중요하다. 엽록체 분열과 세포 분열이 어느 정도 연관되어 있을 것으로 추정되지만, 그 구체적인 메커니즘은 아직 명확히 밝혀지지 않았다.[184]빛은 엽록체 분열에 필수적인 요소로 밝혀졌다. 엽록체는 품질이 좋지 않은 녹색광 아래에서도 성장하고 분열 과정의 일부인 수축 단계를 진행할 수는 있지만, 분열을 완전히 마치지는 못하고 속도가 느려진다. 분열을 완료하기 위해서는 밝은 백색광에 노출되어야 한다. 실제로 녹색광 아래에서 자란 시금치 잎에서는 분열 중인 아령 모양의 큰 엽록체가 많이 관찰되었다. 이 잎들을 백색광에 노출시키면 엽록체 분열이 촉진되어 아령 모양 엽록체의 수가 줄어드는 것을 확인할 수 있다.[182][186]
15. 3. 엽록체 유전
미토콘드리아와 마찬가지로 엽록체는 대개 한쪽 부모로부터 유전된다. 이를 단성 유전이라고 한다. 반면, 양쪽 부모 식물로부터 엽록체 유전자가 유전되는 양친 엽록체 유전 현상은 일부 속씨식물에서 매우 낮은 수준으로 발생한다.[191]식물은 다양한 기작을 통해 양친 엽록체 DNA 유전을 막는다. 여기에는 배우자 또는 접합자 내 엽록체나 그 유전자를 선택적으로 파괴하는 방법, 또는 한쪽 부모의 엽록체가 배아에서 제외되는 방법 등이 있다. 부모 엽록체는 정렬되어 각 자손에게 한 종류만 전달될 수 있다.[188]
식물의 종류에 따라 엽록체 유전 방식이 다르다. 겉씨식물인 소나무와 같은 식물은 대부분 아버지 쪽, 즉 부계로 엽록체를 전달한다.[189] 반면, 속씨식물은 대부분 어머니 쪽, 즉 모계로 엽록체를 유전한다.[190][192] 과거에는 속씨식물이 엽록체를 모계로만 유전한다고 생각했지만, 현재는 속씨식물에서 부계로 엽록체를 유전하는 많은 사례가 보고되었다.[191]
엽록체를 모계로 전달하는 속씨식물은 부계 유전을 막기 위한 다양한 방법을 가지고 있다. 대부분의 경우, 엽록체를 포함하지 않는 정자를 생산한다. 또한 배아 내 엽록체 복제 속도를 조절하는 등 다른 여러 기작들도 부계 유전을 막는 데 기여한다.[191]
흥미롭게도, 속씨식물 중에서 부계 엽록체 유전은 같은 종의 부모 사이에서 태어난 자손보다 잡종에서 더 자주 관찰된다. 이는 서로 다른 종의 유전자가 섞이면서 부계 유전을 막는 기존의 기작이 제대로 작동하지 않을 수 있음을 시사한다.[191]
15. 3. 1. 형질전환 엽록체 식물
최근 엽록체는 유전자 변형 작물 개발자들에게 주목받고 있다. 대부분의 속씨식물에서 엽록체는 부계로부터 유전되지 않기 때문에, 플라스티드 안에 있는 전이 유전자가 꽃가루를 통해 퍼져나갈 수 없다. 이러한 특징 덕분에 플라스티드 형질전환은 유전자 변형 식물을 생물학적으로 안전하게 만들고 재배하는 데 유용한 기술로 여겨지며, 환경에 미치는 위험을 크게 줄일 수 있다. 따라서 이 생물학적 제한 방법은 유전자 변형 작물과 일반 작물의 공존을 이루는 데 적합하다. 이 기술의 신뢰성이 모든 관련 작물 종에서 확인된 것은 아니지만, 최근 담배 식물을 대상으로 한 연구 결과는 긍정적이다. 해당 연구에서는 형질전환된 엽록체 식물의 제한 실패율이 100만분의 3에 불과한 것으로 나타났다.[192]참조
[1]
웹사이트
Bacteria
https://basicbiology[...]
2016-03-18
[2]
논문
Ueber die Vermehrung der Pflanzen-Zellen durch Teilung
https://www.biodiver[...]
1835
[3]
간행물
Über die Entwicklung der Chlorophyllkörner und Farbkörper
http://publikationen[...]
[4]
서적
Das botanische Praktikum
https://archive.org/[...]
Gustav Fischer
1884
[5]
서적
The structure and function of plastids
Springer
2006
[6]
서적
Chloroplasts
https://books.google[...]
Plenum
1984
[7]
간행물
chloroplast
http://www.etymonlin[...]
[8]
간행물
An Expanded Ribosomal Phylogeny of Cyanobacteria Supports a Deep Placement of Plastids
2019
[9]
서적
Biology
Benjamin Cummings (Pearson)
[10]
간행물
The structure of cyanobacterial phycobilisomes: A model
[11]
간행물
Über Natur und Ursprung der Chromatophoren im Pflanzenreiche
https://archive.org/[...]
[12]
서적
Molecular biology of the cell
https://www.ncbi.nlm[...]
Garland
[13]
간행물
Paulinella, a model for understanding plastid primary endosymbiosis
2020-08
[14]
서적
Biology
Benjamin Cummings (Pearson)
[15]
간행물
Early photosynthetic eukaryotes inhabited low-salinity habitats
2017-09
[16]
간행물
Dating the cyanobacterial ancestor of the chloroplast
https://academic.oup[...]
2010-03-04
[17]
간행물
Evolving a photosynthetic organelle
2012-04
[18]
간행물
An Early-Branching Freshwater Cyanobacterium at the Origin of Plastids
2017-02
[19]
간행물
Endosymbiosis: Did Plastids Evolve from a Freshwater Cyanobacterium?
2017-02
[20]
간행물
Symbiosis in eukaryotic evolution
2017-12
[21]
간행물
Paulinella chromatophora
https://linkinghub.e[...]
2021-09-13
[22]
문서
Not to be confused with [[chromatophore]]—the pigmented cells in some animals—or [[Chromatophore (bacteria)|chromatophore]]—the membrane associated vesicle in some bacteria.
[23]
간행물
The puzzle of plastid evolution
2009-01
[24]
간행물
Diversity and evolutionary history of plastids and their hosts
2004-10
[25]
간행물
Protein import pathways in 'complex' chloroplasts derived from secondary endosymbiosis involving a red algal ancestor
2005-02
[26]
간행물
Evolution: Red Algal Genome Affirms a Common Origin of All Plastids
2004
[27]
간행물
How many species of algae are there? A reprise. Four kingdoms, 14 phyla, 63 classes and still growing
2024-01-02
[28]
간행물
The Puzzle of Plastid Evolution
https://linkinghub.e[...]
2009-01-27
[29]
간행물
Mechanism of Plastid Division: From a Bacterium to an Organelle
2011-03-01
[30]
문서
For this reason, glaucophyte chloroplasts are also known as 'muroplasts' from the Latin ''muro'' meaning wall.
[31]
서적
The Structure and Function of Plastids
http://link.springer[...]
Springer Netherlands
2006
[32]
웹사이트
rhodo-
http://www.thefreedi[...]
Farlex
2013-06-07
[33]
서적
Biology
Benjamin Cummings (Pearson)
[34]
간행물
Green algae and the origin of land plants
2004-10
[35]
간행물
Genes for the peptidoglycan synthesis pathway are essential for chloroplast division in moss
2006-04
[36]
논문
How Do algae concentrate CO2 to increase the efficiency of photosynthetic carbon fixation?
1999-01
[37]
논문
The non-photosynthetic, pathogenic green alga Helicosporidium sp. has retained a modified, functional plastid genome
2004-04
[38]
논문
Phylogeny of the non-photosynthetic green micro-algal genus Prototheca (Trebouxiophyceae, Chlorophyta) and related taxa inferred from SSU and LSU ribosomal DNA partial sequence data
https://academic.oup[...]
2003-06-01
[39]
논문
Endosymbiotic gene transfer and transcriptional regulation of transferred genes in Paulinella chromatophora
2011-01
[40]
논문
Evolution: Protein Import in a Nascent Photosynthetic Organelle
https://linkinghub.e[...]
2017-09-25
[41]
논문
Massive Protein Import into the Early-Evolutionary-Stage Photosynthetic Organelle of the Amoeba Paulinella chromatophora
https://linkinghub.e[...]
2017-09-25
[42]
논문
The complete chloroplast genome of the chlorarachniophyte Bigelowiella natans: evidence for independent origins of chlorarachniophyte and euglenid secondary endosymbionts
2007-01
[43]
논문
The endosymbiotic origin, diversification and fate of plastids
2010-03
[44]
논문
Genomic footprints of a cryptic plastid endosymbiosis in diatoms
https://epic.awi.de/[...]
2009-06
[45]
논문
The New Tree of Eukaryotes
https://linkinghub.e[...]
2020-01-01
[46]
논문
Genomic Insights into Plastid Evolution
https://academic.oup[...]
2020-05-20
[47]
간행물
Origins and early evolution of photosynthetic eukaryotes
https://tel.archives[...]
Université Paris-Saclay
2018-03-05
[48]
논문
Did some red alga-derived plastids evolve via kleptoplastidy? A hypothesis
2018-02
[49]
논문
Major transitions in dinoflagellate evolution unveiled by phylotranscriptomics
2017-01
[50]
논문
Photosynthesis in Chromera velia represents a simple system with high efficiency
2012-10-10
[51]
논문
Dinoflagellates: a remarkable evolutionary experiment
2004-10
[52]
논문
Do red and green make brown?: perspectives on plastid acquisitions within chromalveolates
2011-07
[53]
논문
Characterization of Peridinin-Chlorophyll α-Proteins from the Marine Dinoflagellate Ceratium furca
[54]
논문
Phylogenetic analyses indicate that the 19'Hexanoyloxy-fucoxanthin-containing dinoflagellates have tertiary plastids of haptophyte origin
2000-05
[55]
논문
Dinophyte chloroplasts and phylogeny – A review
[56]
논문
Role of chloroplast retention in a marine dinoflagellate
[57]
논문
Integration of plastids with their hosts: Lessons learned from dinoflagellates
2015-08
[58]
웹사이트
Chloroplasts and Other Plastids
http://www.biologie.[...]
University of Hamburg
2012-12-27
[59]
서적
The Chloroplast: Interactions with the Environment
https://books.google[...]
Springer
[60]
서적
Bioscience—Explained
http://www.bioscienc[...]
BIOSCIENCE EXPLAINED
[61]
웹사이트
Cell Biology by the Numbers: How large are chloroplasts?
http://book.bionumbe[...]
2017-02-07
[62]
서적
An introduction to plant cell development
https://books.google[...]
Cambridge university press
[63]
논문
Chloroplast genomes of photosynthetic eukaryotes
https://onlinelibrar[...]
2011-04-28
[64]
서적
Plant Biochemistry
https://archive.org/[...]
Academic Press
[65]
논문
Detection and localization of a chloroplast-encoded HU-like protein that organizes chloroplast nucleoids
2002-07
[66]
논문
Comparison of whole chloroplast genome sequences to choose noncoding regions for phylogenetic studies in angiosperms: the tortoise and the hare III
2007-03
[67]
논문
Inverted repeats in chloroplast DNA from higher plants
1979-01
[68]
논문
Chloroplast DNA rearrangements are more frequent when a large inverted repeat sequence is lost
1982-06
[69]
논문
MSH1 maintains organelle genome stability and genetically interacts with RECA and RECG in the moss Physcomitrella patens
2017-08
[70]
논문
RecA maintains the integrity of chloroplast DNA molecules in Arabidopsis
2010-06
[71]
논문
A comparative approach to elucidate chloroplast genome replication
2009-05
[72]
논문
DNA replication in chloroplasts
https://aquila.usm.e[...]
1993
[73]
논문
Circular chloroplast chromosomes: the grand illusion
2004-07
[74]
웹사이트
Effect of chemical mutagens on nucleotide sequence
http://www.biocyclop[...]
2015-10-24
[75]
논문
Circular and branched circular concatenates as possible intermediates in bacteriophage T4 DNA replication
1973-07
[76]
논문
Chloroplast origin and integration
2001-01
[77]
논문
Rates and patterns of chloroplast DNA evolution
1994-07
[78]
논문
Direct measurement of the transfer rate of chloroplast DNA into the nucleus
2003-03
[79]
논문
Evolutionary analysis of Arabidopsis, cyanobacterial, and chloroplast genomes reveals plastid phylogeny and thousands of cyanobacterial genes in the nucleus
2002-09
[80]
논문
A plastid without a genome: evidence from the nonphotosynthetic green algal genus Polytomella
2014-04
[81]
논문
Algal genomics: exploring the imprint of endosymbiosis
2006-12
[82]
논문
Signals from chloroplasts converge to regulate nuclear gene expression
2007-05
[82]
간행물
Communicating with chloroplasts
https://www.the-scie[...]
2009-04-01
[83]
논문
Embryophyte stress signaling evolved in the algal progenitors of land plants
2018-04-10
[84]
논문
The Chara Genome: Secondary Complexity and Implications for Plant Terrestrialization
2018-07
[85]
논문
Evolution of chloroplast retrograde signaling facilitates green plant adaptation to land
2019-03-12
[86]
논문
Environmental gradients reveal stress hubs pre-dating plant terrestrialization
2023-08-28
[87]
논문
Mitochondrial and chloroplast phage-type RNA polymerases in Arabidopsis
1997-08
[88]
논문
Chloroplast ribosomes and protein synthesis
1994-12
[89]
논문
Protein import into chloroplasts
http://nbn-resolving[...]
2004-03
[90]
서적
Biology
Benjamin Cummings (Pearson)
[91]
논문
A transit peptide-like sorting signal at the C terminus directs the Bienertia sinuspersici preprotein receptor Toc159 to the chloroplast outer membrane
2012-04
[92]
논문
Phosphorylation of the transit sequence of chloroplast precursor proteins
1996-03
[93]
논문
Toc, Tic, and chloroplast protein import
2001-12
[94]
논문
14-3-3 proteins form a guidance complex with chloroplast precursor proteins in plants
2000-01
[95]
서적
The Structure and Function of Plastids
https://books.google[...]
Springer
[96]
웹사이트
Oedogonium Link ex Hirn, 1900: 17
http://www.algaebase[...]
algaeBASE
2013-05-19
[97]
웹사이트
Chlamydomonas Ehrenberg, 1833: 288
http://www.algaebase[...]
algaeBASE
2013-05-19
[98]
웹사이트
Spirogyra Link, 1820: 5
http://www.algaebase[...]
algaeBASE
2013-05-19
[99]
웹사이트
Sirogonium Kützing, 1843: 278
http://www.algaebase[...]
algaeBASE
2013-05-19
[100]
웹사이트
Zygnema C.Agardh, 1817: xxxii, 98
http://www.algaebase[...]
algaeBASE
2013-05-19
[101]
웹사이트
Micrasterias C.Agardh ex Ralfs, 1848: 68
http://www.algaebase[...]
algaeBASE
2013-05-19
[102]
서적
The Chloroplast
[103]
서적
The freshwater algal flora of the British Isles: an identification guide to freshwater and terrestrial algae
https://books.google[...]
Cambridge University Press
[104]
논문
Mechanism of proton permeation through chloroplast lipid membranes
1996-10
[105]
논문
Molecular aspects of plastid envelope biochemistry
1991-08
[106]
Encyclopedia
Chloroplast
http://www.daviddarl[...]
2012-12-27
[107]
서적
The structure and function of plastids
http://www.uwosh.edu[...]
Springer
2013-05-21
[108]
서적
Biology
Benjamin Cummings (Pearson)
[109]
간행물
Polypeptide composition of envelopes of spinach chloroplasts: two major proteins occupy 90% of outer envelope membranes
1998-05
[110]
간행물
Plastid tubules of higher plants are tissue-specific and developmentally regulated
http://jcs.biologist[...]
2000-01
[111]
간행물
Stromules: mobile protrusions and interconnections between plastids
[112]
간행물
Plastid stromule branching coincides with contiguous endoplasmic reticulum dynamics
2011-04
[113]
간행물
Differential coloring reveals that plastids do not form networks for exchanging macromolecules
2012-04
[114]
간행물
Chloroplasts extend stromules independently and in response to internal redox signals
2015-08
[115]
서적
An introduction to plant cell development
https://books.google[...]
Cambridge university press
[116]
간행물
Plant peptidoglycan precursor biosynthesis: Conservation between moss chloroplasts and Gram-negative bacteria
https://academic.oup[...]
[117]
간행물
The occurrence of a peripheral reticulum in plastids of the gymnosperm Welwitschia mirabilis
1994-07-05
[118]
간행물
Structure of the chloroplast ribosome: novel domains for translation regulation
2007-08
[119]
간행물
The complete structure of the chloroplast 70S ribosome in complex with translation factor pY.
2017-02-15
[120]
간행물
Alterations in rRNA-mRNA interaction during plastid evolution
2014-07
[121]
간행물
Functional Shine-Dalgarno-like sequences for translational initiation of chloroplast mRNAs
2004-01
[122]
간행물
Correlations between Shine-Dalgarno sequences and gene features such as predicted expression levels and operon structures
2002-10
[123]
간행물
Large variations in bacterial ribosomal RNA genes
2012-10
[124]
간행물
Plastoglobules are lipoprotein subcompartments of the chloroplast that are permanently coupled to thylakoid membranes and contain biosynthetic enzymes
2006-07
[125]
간행물
Starch breakdown: Recent discoveries suggest distinct pathways and novel mechanisms
[126]
간행물
Control of starch granule numbers in Arabidopsis chloroplasts
2012-02
[127]
서적
The molecular biology of chloroplasts and mitochondria in Chlamydomonas
https://books.google[...]
Kluwer Acad. Publ.
[128]
간행물
Variability of the pyrenoid-based CO2 concentrating mechanism in hornworts (Anthocerotophyta)
[129]
간행물
Identification of a novel gene, CIA6, required for normal pyrenoid formation in Chlamydomonas reinhardtii
2011-06
[130]
간행물
The development and structure of pyrenoids in Bulbochaete hiloensis
1970-01
[131]
간행물
Structure and Function of the Algal Pyrenoid
http://www.botany.ut[...]
2012-12-31
[132]
간행물
The chloroplast import receptor Toc90 partially restores the accumulation of Toc159 client proteins in the Arabidopsis thaliana ppi2 mutant
http://doc.rero.ch/r[...]
2011-03
[133]
웹사이트
thylakoid
http://www.merriam-w[...]
Merriam-Webster
2013-05-19
[134]
간행물
The three-dimensional arrangement of intergranal lamellae in chloroplasts
[135]
간행물
Three-dimensional organization of higher-plant chloroplast thylakoid membranes revealed by electron tomography
[136]
간행물
The three-dimensional network of the thylakoid membranes in plants: quasihelical model of the granum-stroma assembly
2008-10
[137]
간행물
Three-dimensional architecture of grana and stroma thylakoids of higher plants as determined by electron tomography
2011-04
[138]
간행물
Fundamental helical geometry consolidates the plant photosynthetic membrane
[139]
웹사이트
Chloroplast in a plant cell
https://www.sciencep[...]
TUMEGGY / SCIENCE PHOTO LIBRARY
2020-08-19
[140]
서적
Biology
Benjamin Cummings (Pearson)
[141]
웹사이트
Australian scientists discover first new chlorophyll in 60 years
http://www.usyd.edu.[...]
University of Sydney
2010-08-20
[142]
간행물
Carotenoids in algae: distributions, biosyntheses and functions
2011-06-15
[143]
웹사이트
Why Do Leaves Change Color in Fall?
http://www.thedailyg[...]
2013-05-21
[144]
간행물
The origin of plastids
2008-08
[145]
웹사이트
Introduction to the Rhodophyta
http://www.ucmp.berk[...]
University of California Museum of Paleontology
2013-05-20
[146]
서적
Biology
Benjamin Cummings (Pearson)
[147]
서적
Plant cell biology: structure and function
https://archive.org/[...]
Jones and Bartlett Publishers
[148]
서적
The Structure and Function of Plastids
https://books.google[...]
Springer
[149]
간행물
Ultrastructure of Chloroplast Membranes in Leaves of Maize and Ryegrass as Revealed by Selective Staining Methods
1988-03
[150]
문서
Lawson T. and J. I. L. Morison. Essay 10.1 Guard Cell Photosynthesis. Plant Physiology and Development, Sixth Edition
http://6e.plantphys.[...]
[151]
간행물
The guard cell chloroplast: A perspective for the twenty-first century
[152]
간행물
All hands on deck—the role of chloroplasts, endoplasmic reticulum, and the nucleus in driving plant innate immunity
2010-11
[153]
간행물
Jasmonate signaling: a conserved mechanism of hormone sensing
2008-08
[154]
간행물
Fatty acid export from the chloroplast. Molecular characterization of a major plastidial acyl-coenzyme A synthetase from Arabidopsis
2002-08
[155]
서적
Biology: Exploring Life
http://www.phschool.[...]
Pearson Prentice Hall
[156]
간행물
ATP formation caused by acid-base transition of spinach chloroplasts
1966-01
[157]
서적
Biochemistry
https://archive.org/[...]
W. H. Freeman
[158]
서적
Biology—Concepts and Connections
Pearson
[159]
서적
Biochemistry
https://archive.org/[...]
W. H. Freeman
[160]
간행물
Effect of Flooding on Starch Accumulation in Chloroplasts of Sunflower (Helianthus annuus L.)
1983-09
[161]
간행물
Starch Accumulation and Photosynthetic Activity in Primary Leaves of Bean (''Phaseolus vulgaris'' L.)
[162]
서적
Biochemistry.
https://www.ncbi.nlm[...]
W H Freeman
2012-10-30
[163]
간행물
Stimulation by Light of Rapid pH Regulation in the Chloroplast Stroma in Vivo as Indicated by CO2 Solubilization in Leaves
1995-07
[164]
간행물
The role of pH in the regulation of carbon fixation in the chloroplast stroma. Studies on CO2 fixation in the light and dark
1975-08
[165]
간행물
Integral membrane proteins of the chloroplast envelope: identification and subcellular localization of new transporters
2002-08
[166]
간행물
Subcellular Distribution of O-Acetylserine(thiol)lyase in Cauliflower (Brassica oleracea L.) Inflorescence
1992-03
[167]
간행물
The specific features of methionine biosynthesis and metabolism in plants
1998-06
[168]
문서
Buchanan BB, Gruissem W, Jones RL (Eds.). 2015. Biochemistry & Molecular Biology of Plants. Wiley Blackwell.
[169]
간행물
Chloroplast proteomics highlights the subcellular compartmentation of lipid metabolism
2010-04
[170]
간행물
The uptake of 2-oxoglutarate and pyruvate by isolated pea chloroplasts
[171]
문서
Bao X, Focke M, Pollard M, Ohlrogge J. 2000. Understanding in vivo carbon precursor supply for fatty acid synthesis in leaf tissue. Plant Journal 22, 39–50.
[172]
간행물
Lipid Biosynthesis
[173]
서적
Handbook of plant science
https://books.google[...]
Wiley
[174]
서적
Biology
Benjamin Cummings (Pearson)
[175]
간행물
The mitogenic activity of lipopolysaccharide for spleen cells from germfree, conventional, and gnotobiotic rats
[176]
논문
Microfilaments Anchor Chloroplasts along the Outer Periclinal Wall in Vallisneria Epidermal Cells through Cooperation of PFR and Photosynthesis
[177]
논문
Actin-based photo-orientation movement of chloroplasts in plant cells
2003-06
[178]
서적
An introduction to plant cell development
https://books.google[...]
Cambridge university press
[179]
서적
Plant cell biology: structure and function
https://archive.org/[...]
Jones and Bartlett Publishers
[180]
서적
An introduction to plant cell development
https://books.google[...]
Cambridge university press
[181]
서적
An introduction to plant cell development
https://books.google[...]
Cambridge university press
[182]
논문
Chloroplast Replication and Chloroplast DNA Synthesis in Spinach Leaves
[183]
논문
DNA replication in chloroplasts
http://jcs.biologist[...]
1993-01-01
[184]
논문
Chloroplast division
2007-05
[185]
논문
A plant-specific dynamin-related protein forms a ring at the chloroplast division site
2003-03
[186]
논문
Effect of light on the chloroplast division cycle and DNA synthesis in cultured leaf discs of spinach
1989-04
[187]
서적
Molecular biology of the cell
https://www.ncbi.nlm[...]
Garland
[188]
논문
Uniparental inheritance of mitochondrial and chloroplast genes: mechanisms and evolution
1995-12
[189]
논문
Polymorphic simple sequence repeat regions in chloroplast genomes: applications to the population genetics of pines
1995-08
[190]
논문
High-frequency gene transfer from the chloroplast genome to the nucleus
2003-07
[191]
논문
Paternal, maternal, and biparental inheritance of the chloroplast genome in Passiflora (Passifloraceae): implications for phylogenetic studies
2007-01
[192]
논문
Determining the transgene containment level provided by chloroplast transformation
2007-04
[193]
서적
岩波生物学辞典第4版
岩波書店
[194]
웹사이트
葉がなければ根で光合成?
https://www.c.u-toky[...]
東京大学
2020-08-25
[195]
간행물
千原編
[196]
간행물
千原編
[197]
간행물
千原編
[198]
문서
연체동물문 후새아강, 군소와 유사하게 생김
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com