유리기
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
유리기(radical)는 짝을 이루지 않은 전자를 가진 원자, 분자 또는 이온을 의미하며, 화학 반응성이 매우 높다. 1900년 모제스 곰버그에 의해 최초로 유기 라디칼이 발견된 이후, 다양한 유기 합성 반응에 활용된다. 유기 라디칼은 전기 음성도, 비편재화, 입체 장애 등에 의해 안정화될 수 있으며, 균일 분해, 환원 반응 등을 통해 생성된다. 유리기 반응은 연소, 중합, 생화학 반응 등 다양한 분야에서 중요한 역할을 하며, 고분자 화학, 유기 합성, 생화학, 환경 화학 등 다양한 분야에서 응용된다. 특히 생체 내에서는 세포 사멸, 신호 전달, 질병 발생 등과 관련이 있으며, 활성 산소 종(ROS)과 같은 유해한 라디칼로부터 세포를 보호하기 위한 항산화 시스템이 존재한다.
더 읽어볼만한 페이지
- 유리기 - 오존화물
오존화물은 굽은 형태의 O₃⁻ 음이온을 포함하는 이온 화합물로, 알칼리 금속 또는 알칼리 토금속과 오존의 반응 등으로 생성되며, 화학적 산소 발생기나 일중항 산소 생성 중간체로 연구되지만, 분자 오존화물은 불안정하여 트리옥솔란으로 전환되거나 물과 반응하여 분해된다. - 유리기 - 초과산화물
초과산화물은 분자 산소에 전자가 추가되어 생성된 음이온(O2-)으로, 알칼리 금속 및 알칼리 토금속과 염을 형성하며, 화학적 산소 발생기나 소방관 산소통에 사용되거나 생체 내에서 활성 산소종으로 작용하지만 초과산화물 불균등화 효소에 의해 조절된다. - 생물학적 과정 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다. - 생물학적 과정 - 혈관신생
혈관신생은 기존 혈관에서 새로운 혈관이 생성되는 생리적 과정으로, 상처 치유, 종양 성장 등 다양한 생리적 현상과 질병에 관여하며, 의학적으로는 혈관 형성 촉진 또는 억제를 위한 치료 표적으로 활용된다. - 노쇠 - 죽음
죽음은 생명 활동의 영구적 종식으로 의학, 법, 사회, 종교, 심리, 생물학 등 다양한 관점에서 해석되며, 전통적인 심폐사 외에 뇌사도 죽음으로 인정되고, 개발도상국은 전염병, 선진국은 노화 관련 질병이 주요 사망 원인이며, 문화와 종교에 따라 다양한 이해와 관습이 존재하고, 수명 연장, 냉동 보존술, 존엄사, 안락사 등에 대한 논의가 이루어지고 있다. - 노쇠 - 미토콘드리아 DNA
미토콘드리아 DNA(mtDNA)는 세포 호흡에 필수적인 유전 정보를 담고 있는 미토콘드리아 내의 이중 가닥 환상 DNA로서, 동물의 경우 약 16,000개의 염기쌍과 37개의 유전자로 구성되며, 모계 유전, 높은 돌연변이율, 질병 및 노화와의 연관성 등의 특징을 가진다.
| 유리기 | |
|---|---|
| 일반 정보 | |
| 정의 | 홀수 개의 전자를 가지는 분자, 이온 또는 원자이다. |
| 특징 | 매우 반응성이 높다. 짧은 수명을 가진다. |
| 구조 및 반응성 | |
| 전자 구조 | 비어있는 원자가 껍질이 있다. 스핀 쌍을 이루지 않은 전자를 가진다. |
| 반응성 | 다른 분자로부터 전자를 빼앗으려고 한다. 사슬 반응을 일으킬 수 있다. |
| 생성 | |
| 방법 | 공유 결합의 균등 분해 단일 전자 전달 반응 방사선 조사 열 분해 |
| 종류 | |
| 탄소 중심 라디칼 | 메틸 라디칼(CH3•), 에틸 라디칼(CH3CH2•) 등이 있다. |
| 산소 중심 라디칼 | 하이드록실 라디칼(•OH), 퍼옥실 라디칼(ROO•) 등이 있다. |
| 질소 중심 라디칼 | 아미노 라디칼(•NH2) 등이 있다. |
| 황 중심 라디칼 | 티일 라디칼(RS•) 등이 있다. |
| 기타 | 수소 라디칼(H•), 할로젠 라디칼(Cl•, Br•) 등이 있다. |
| 중요성 | |
| 화학 반응 | 중합 반응, 연소 반응, 할로젠화 반응 등에 관여한다. |
| 생물학적 역할 | 면역 반응 신호 전달 세포 손상 (산화 스트레스) |
| 산업적 응용 | 중합 반응 촉매 화학 물질 합성 |
| 안정화 | |
| 방법 | 항산화제 첨가 라디칼 소거제 사용 |
| 관련 용어 | |
| 항산화제 | 라디칼 반응을 억제하는 물질 |
| 산화 스트레스 | 라디칼에 의한 세포 손상 |
| 주의사항 | |
| 반응성 | 매우 불안정하고 반응성이 높으므로 취급에 주의해야 한다. |
2. 역사

1900년 미시건 대학교의 모세스 곰버그가 트리페닐메틸 라디칼 구조를 최초로 정의하는 연구를 발표한 후, 유기 합성 반응에 라디칼이 많이 쓰이게 되었다.
20세기 후반까지 화학에서 "라디칼"이라는 단어는 메틸기나 카르복실기처럼 더 큰 분자의 일부이든, 독립적인 분자이든 관계없이 연결된 모든 원자 그룹을 나타냈다. 그러나 최근에는 더 큰 분자의 일부를 작용기 또는 치환기라고 부르며, "라디칼"은 "자유" 라디칼, 즉 유리기를 의미하게 되었다.
2. 1. 라디칼 이론과 용어의 변천
19세기 초, '라디칼'이라는 용어는 루이 베르나르 귀통 드 모르보에 의해 처음 도입되었고, 앙투안 라부아지에가 그의 저서 화학 원론(Traité Élémentaire de Chimie)에서 사용하면서 널리 알려지게 되었다. 당시 라디칼은 특정 산의 기본이 되는 뿌리(라틴어 "radix")로 여겨졌으며, 유기 화합물의 구성 요소, 즉 오늘날의 치환기에 해당하는 용어로 사용되었다.[25][26] 예를 들어, 메틸 알코올은 메틸 "라디칼"과 히드록실 "라디칼"로 구성된 것으로 묘사되었다.1865년, 케쿨레가 벤젠의 구조를 제안하면서 라디칼이라는 단어는 새로운 국면을 맞이했다. 1900년, 미국의 화학자 모제스 곰버그가 최초로 안정한 유기 라디칼인 트리페닐메틸 라디칼을 발견하면서, '라디칼'은 단순히 분자의 부분 구조를 나타내는 용어에서 벗어나, 홀전자를 가진 반응성이 큰 분자종을 의미하는 용어로 확장되었다.
1910년, G.N. 루이스가 원자가 전자 이론을 발표하면서 라디칼이 공유 결합과 관련이 있다는 것이 밝혀졌다. 1933년, 모리스 S. 카라쉬와 프랭크 메이오는 자유 라디칼이 브롬화 수소의 알릴 브로마이드에 대한 마르코프니코프 부가 반응 반대의 원인임을 제안했다.[25][26]
20세기 후반, 게르하르트 헤르츠베르크는 분광법을 이용하여 라디칼의 전자 상태를 연구하고, 라디칼의 정의를 "반응성이 높고 수명이 짧은 중간 화학종"으로 더욱 확장했다. 헤르츠베르크의 정의는 짝을 이루지 않은 전자를 갖지 않는 화학적으로 불안정한 분자(예: C2, C3, CH2)까지 포함하는 더 넓은 개념이다.[27][28]
오늘날에는 '라디칼'이라고 하면 일반적으로 홀전자를 가진 유리기(free radical)를 의미한다.
3. 라디칼의 형성
라디칼은 스핀 짝지어진 분자로부터 형성되거나 다른 라디칼로부터 형성된다. 라디칼은 약한 결합의 균일 분해나 전자 이동(환원)을 통해 스핀 짝지어진 분자로부터 형성된다. 또한, 치환, 첨가 반응, 제거 반응을 통해 다른 라디칼로부터 형성될 수 있다.
3. 1. 균일 분해
균일 분해는 공유 결합이 끊어져 짝을 이루지 않은 전자를 가진 두 개의 새로운 라디칼이 생성되는 반응이다. 각 조각은 결합에 있던 전자 중 하나를 갖게 된다.[9] 화학 결합을 끊는 데에는 에너지가 필요하므로, 균일 분해는 열이나 빛을 가했을 때 일어난다. 결합 해리 에너지는 균일 분해와 관련이 있으며, 특정 화합물의 안정성에 따라 달라진다. 일부 약한 결합은 비교적 낮은 온도에서도 균일 분해가 될 수 있다.
일부 균일 분해 반응은 다른 라디칼 반응의 개시제로 작용하기 때문에 특히 중요하다. 예를 들어 할로젠의 균일 분해는 빛 아래에서 일어나 라디칼 할로젠화 반응을 일으킨다.
또 다른 주목할 만한 반응은 디벤조일 과산화물의 균일 분해인데, 이 반응은 두 개의 벤조일옥시 라디칼을 생성하며 많은 라디칼 반응의 개시제로 작용한다.[3]

3. 2. 환원
전형적으로 라디칼은 1전자 환원을 통해 형성된다. 일반적으로 1전자 환원된 유기 화합물은 불안정하다. 전하가 분산될 수 있을 때 라디칼 음이온에 안정성이 부여된다. 예로는 알칼리 금속 나프탈라이드, 안트라센, 케틸이 있다.[4][5]
3. 3. 다른 라디칼로부터의 생성
라디칼은 치환, 첨가 반응, 제거 반응을 통해 다른 라디칼로부터 형성된다.[1]첨가 반응에서 라디칼은 불포화 결합(이중 결합 또는 삼중 결합)에 첨가되어 새로운 라디칼을 생성한다.[1] 라디칼 제거 반응은 라디칼 첨가 반응의 역반응으로 볼 수 있다.[1] 라디칼 제거 반응에서 불안정한 라디칼 화합물은 스핀 짝지어진 분자와 새로운 라디칼 화합물로 분해된다.[1]
4. 라디칼의 안정성
라디칼의 안정성은 반응성과 수명에 큰 영향을 미친다. 유기 라디칼의 경우, 생성과 반응성은 열역학적 안정성과 운동적 안정성(지속성)에 모두 의존하는데, 이 두 가지 유형의 안정성이 항상 서로 상관관계가 있는 것은 아니다. 예를 들어 벤질 라디칼은 공명 비편재화로 열역학적으로 안정화되지만, 수명이 매우 짧아 운동적으로 일시적이다.[7] 유기 라디칼은 전기 음성도, 비편재화 및 입체 장애에 따라 안정화될 수 있다.[7]
무기 라디칼의 경우, 일산화 질소(NO)는 분리 가능한 무기 라디칼의 잘 알려진 예이다.[10][11] 프레미 염(니트로소디설폰산 칼륨, (KSO3)2NO)도 이와 관련된 예이다. π 공명 안정화가 제한적임에도 불구하고 많은 티아질 라디칼이 알려져 있다.
4. 1. 유기 라디칼의 안정성
유기 라디칼의 생성과 반응성은 열역학적 안정성과 운동적 안정성(지속성이라고도 함)에 모두 의존한다. 이 두 가지 유형의 안정성이 항상 서로 상관관계가 있는 것은 아니다. 예를 들어 벤질 라디칼은 공명 비편재화로 열역학적으로 안정화되지만, 수명이 매우 짧아 운동적으로 일시적이다.[7] 유기 라디칼은 전기 음성도, 비편재화 및 입체 장애에 따라 안정화될 수 있다.[7] 2,2,6,6-테트라메틸피페리디닐옥실 화합물은 이 세 가지 요소를 모두 결합하여 안정성을 확보한 대표적인 예시이다.- 전기 음성도: 유기 라디칼은 전자가 부족하기 때문에 홀전자가 있는 원자의 전기 음성도가 클수록 라디칼은 덜 안정하다.[8] 예를 들어 탄소, 질소, 산소 중 탄소가 가장 안정하고 산소가 가장 불안정하다. 또한, 서로 다른 혼성화를 갖는 탄소 원자의 안정성에도 영향을 미치는데, 높은 s-성질은 탄소 원자의 더 높은 전기 음성도와 관련이 있으며, 전기 음성도가 클수록 라디칼은 덜 안정하다.[8] sp-혼성화 탄소(50% s-성질)는 sp3-혼성화 탄소(25% s-성질)에 비해 가장 불안정한 라디칼을 형성하며, sp3-혼성화 탄소가 가장 안정적인 라디칼을 형성한다.
- 비편재화: 홀전자가 분자 전체에 걸쳐 비편재화될수록 라디칼은 안정하다. 비편재화는 하나 이상의 공명 구조를 형성하는 능력으로, 전자 부족 현상을 여러 원자에 분산시켜 불안정성을 최소화한다. 비편재화는 일반적으로 하이드록실기(−OH), 에테르(−OR), 인접한 알켄, 아민(−NH2 또는 −NR)과 같은 전자 공여성 작용기 또는 C=O 또는 C≡N과 같은 전자 인출성 작용기가 존재할 때 발생한다.[9]


전자 공여성 작용기는 짝을 이루지 않은 전자의 에너지를 증가시키지만, 새로운 결합 궤도를 형성하는 고립 전자쌍의 에너지 감소가 더 커서 분자의 순 에너지를 감소시킨다. 전자 인출성 작용기는 비어있는 π* 궤도와 상호작용하여 더 낮은 에너지의 새로운 SOMO를 형성하여 유리기 종의 에너지를 낮추고 안정성을 높인다.
초공액에 의해서도 안정화가 가능하다. 유리기 화학에서 유리기는 인접한 알킬기와의 초공액에 의해 안정화된다. 시그마(σ) C−H 결합이 부분적으로 비어있는 유리기 궤도로 기증되어 3차, 2차 및 1차 탄소에 있는 유리기의 안정성을 구별하는 데 도움이 된다. 3차 탄소 유리기는 세 개의 σ C−H 결합을 기증하고, 2차 유리기는 두 개, 1차 유리기는 하나만 기증한다. 따라서 3차 유리기가 가장 안정하고 1차 유리기가 가장 불안정하다.

- 입체 장애: 홀전자 주위에 큰 치환기가 존재하면 라디칼의 반응성이 감소하여 안정성이 증가한다.

예를 들어, TEMPO는 추가적인 메틸 그룹으로 인해 입체 장애가 너무 커서 반응하기 어렵기 때문에 라디칼 형태로 상업적으로 판매될 수 있을 만큼 안정적이다.[9] 하지만, ''N''-하이드록시피페리딘은 반응하는 분자의 경로를 방해할 네 개의 메틸 그룹이 없으므로 구조가 불안정하다.[9]
많은 유기 라디칼의 안정성은 H•의 공여체로서 기능하는 능력으로 나타난다. 이러한 특성은 수소와의 약화된 결합(일반적으로 O−H, 때로는 N−H 또는 C−H)을 반영한다. 이러한 거동은 이러한 H• 공여체가 생물학 및 상업에서 항산화제 역할을 하기 때문에 중요하다. 예시로 α-토코페롤(비타민 E)이 있다. 토코페롤 라디칼 자체는 분리할 만큼 충분히 안정하지 않지만, 모 분자는 매우 효과적인 수소 원자 공여체이다. C−H 결합은 트리페닐메틸(트리틸) 유도체에서 약화된다.
4. 2. 무기 라디칼의 안정성
일산화 질소(NO)는 분리 가능한 무기 라디칼의 잘 알려진 예이다.[10][11] 프레미 염(니트로소디설폰산 칼륨, (KSO3)2NO)도 이와 관련된 예이다. π 공명 안정화가 제한적임에도 불구하고 많은 티아질 라디칼이 알려져 있다.5. 라디칼 반응
라디칼은 반응성이 매우 커서 다양한 화학 반응에 참여한다. 라디칼에 전자를 하나 빼앗긴 분자는 다른 분자로부터 전자를 빼앗아 새로운 라디칼을 형성하며, 이러한 반응은 연쇄적으로 일어난다. 라디칼끼리 반응하여 공유 결합을 생성하면 반응이 종결된다. 이러한 반응을 '''라디칼 반응''' 또는 '''라디칼 연쇄 반응'''이라고 한다. 연소는 가장 잘 알려진 라디칼 반응 중 하나이며, 할로젠 분자가 탄화수소와 반응하여 할로젠화 알킬을 생성하는 반응, 과산화 벤조일이나 아조비스이소부티로니트릴을 개시제로 하는 라디칼 중합도 이에 해당한다. 오존층 파괴의 원인이 되는 것은 염소 원자의 라디칼이다.[9]
5. 1. 라디칼 연쇄 반응
염소 가스는 자외선에 의해 원자 염소 유리기(라디칼)로 만들어진다. 화학식에서 유리기는 원자기호 옆에 점으로 표현된다.:

균일 분해는 공유 결합을 끊어 스핀 짝지어진 분자에서 두 개의 새로운 라디칼을 생성하며, 각 단편에 결합의 전자 중 하나를 남긴다.[9] 화학 결합을 끊는 데 에너지가 필요하기 때문에, 균일 분해는 열이나 빛을 가하면 발생한다. 결합 해리 에너지는 균일 분해와 관련되어 있으며, 주어진 화합물의 안정성에 따라 달라지며, 일부 약한 결합은 비교적 낮은 온도에서 균일 분해될 수 있다.
라디칼을 포함하는 연쇄 반응은 일반적으로 세 가지 과정으로 나눌 수 있다.
- '''개시''' 반응은 라디칼의 수를 순증가시키는 반응이다. 안정적인 종으로부터 라디칼이 형성되거나, 라디칼이 안정적인 종과 반응하여 더 많은 라디칼을 형성하는 반응을 포함할 수 있다.
- '''전파''' 반응은 라디칼을 포함하는 반응으로, 라디칼의 총 개수가 동일하게 유지된다.
- '''종결''' 반응은 라디칼의 순 감소를 초래하는 반응이다. 일반적으로 두 개의 라디칼이 결합하여 더 안정적인 종을 형성한다. 예를 들어 다음과 같다.
- :2 Cl• → Cl2
라디칼에 1개의 전자를 빼앗긴 분자가 다른 분자로부터 전자를 빼앗으면, 그 분자가 더 나아가 라디칼을 형성하기 때문에 반응은 연쇄적으로 진행된다. 반응은 라디칼끼리 반응하여 공유 결합을 생성할 때까지 계속된다. 이러한 반응을 '''라디칼 반응''' 또는 '''라디칼 연쇄 반응'''이라고 한다. 연소는 가장 잘 알려진 라디칼 반응 중 하나이며, 할로젠 분자가 탄화수소와 반응하여 할로젠화 알킬을 생성하는 것도 라디칼 반응이다.
5. 2. 주요 라디칼 반응

연소는 친숙한 라디칼 반응이다. 산소 분자는 •O–O•로 나타낼 수 있는 안정적인 이중 라디칼이며, 전자의 스핀이 평행하여 안정적이다. 산소의 바닥 상태는 반응성이 없는 스핀 비쌍(unpaired) 삼중항 이중 라디칼이지만, 반응성이 매우 높은 스핀 쌍(paired) 일중항 상태도 존재한다. 연소가 발생하려면 이들 사이의 에너지 장벽을 극복해야 하며, 이는 열에 의해 가능하므로 높은 온도가 필요하다. 삼중항-일중항 전이는 "금지된" 전이로, 반응에 추가적인 장벽을 만든다. 분자 산소는 철이나 구리와 같은 촉매 중원자가 없으면 실온에서 비교적 비활성 상태이다.
연소는 일중항 라디칼이 시작하는 다양한 라디칼 연쇄 반응으로 구성된다. 물질의 가연성은 시작 및 전파 반응으로 이어져 물질의 연소가 일어나기 전 얻어야 하는 라디칼 농도에 크게 의존한다. 가연성 물질이 소모되면 종결 반응이 지배하여 불꽃이 꺼진다. 테트라에틸 납은 납 자체가 가솔린-공기 혼합물에서 라디칼을 비활성화하여 한때 가솔린에 첨가되었는데, 이는 연소가 통제되지 않거나 연소되지 않은 잔류물(노킹 현상) 또는 조기 점화(조기 점화)를 방지한다.
탄화수소가 연소되면 많은 수의 다른 산소 라디칼이 관여한다. 처음에는 과산화수소 라디칼(HOO•)이 형성되고, 이들은 더 반응하여 유기 과산화물을 생성하며, 이 과산화물은 하이드록실 라디칼(HO•)로 분해된다.
라디칼에서 전자를 빼앗긴 분자가 다른 분자에서 전자를 빼앗으면, 그 분자가 라디칼을 형성하므로 반응은 연쇄적으로 진행된다. 라디칼끼리 반응하여 공유 결합을 생성할 때까지 반응이 계속되는데, 이러한 반응을 '''라디칼 반응''' 또는 '''라디칼 연쇄 반응'''이라고 한다.
라디칼이 관여하는 대표적인 화학 반응은 다음과 같다.
6. 라디칼의 응용
라디칼 반응은 여러 분야에서 활용된다.
고분자 화학에서 라디칼 연쇄 반응은 폴리(메틸 메타크릴레이트)(PMMA)와 같은 중합체를 만드는 데 사용된다. 리빙 중합과 같은 새로운 라디칼 중합 방법도 개발되었다.[1] 흔히 발견되는 라디칼인 산소(O2)는 건성유와 알키드 페인트가 굳는 데 중요한 역할을 한다.[1]
생화학에서 라디칼은 세포 신호 전달 과정에 관여하며, 이를 산화 환원 신호 전달이라고 한다.[15] 리놀레산이나 아라키돈산과 같은 물질에 대한 라디칼 공격은 다양한 신호 전달 물질을 생성한다.[16] 라디칼은 파킨슨병, 알츠하이머병 등 다양한 질병과 관련이 있으며,[17] 노화 과정에도 영향을 미친다. 신체는 슈퍼옥사이드 디스뮤타제, 카탈라아제와 같은 효소와 비타민 A, 비타민 C, 비타민 E 등의 항산화제를 통해 라디칼로 인한 손상을 막는다.[18]
환경 화학에서 라디칼은 광화학 스모그 생성에 중요한 역할을 한다. 이산화질소의 광분해로 생성되는 산소 원자는 일산화 질소와 반응하여 오존을 생성한다. 상층 대기에서는 염화플루오린화탄소(CFCs)가 자외선에 의해 분해되어 염소 라디칼(Cl•)을 생성하며, 이는 오존층 파괴를 촉진한다.
6. 1. 고분자 화학
라디칼 연쇄 반응의 기초가 되는 중합 반응은 라디칼이 알켄에 부가되어 새로운 라디칼을 생성하는 과정을 포함한다. 중합 기술은 개시 라디칼이 도입되는 방법에 따라 달라진다. 예를 들어 메틸 메타크릴레이트(MMA)는 반복적인 라디칼 부가 단계를 통해 폴리(메틸 메타크릴레이트)(PMMA, 플렉시글라스 또는 퍼스펙스)를 생성하기 위해 중합될 수 있다.[1]
새로운 라디칼 중합 방법으로는 리빙 중합이 알려져 있으며, 가역적 부가-분절 연쇄 이동 (RAFT) 및 원자 전달 라디칼 중합 (ATRP)과 같은 변형이 있다.[1]
흔한 라디칼인 O2는 많은 유기 화합물과 반응하여 과산화수소 라디칼과 함께 라디칼을 생성한다. 건성유와 알키드 페인트는 대기 중의 산소에 의해 시작된 라디칼 가교 반응으로 인해 경화된다.[1]
6. 2. 생화학
라디칼은 생물학에서 중요한 역할을 한다. 이 중 많은 라디칼은 과립구 및 대식세포와 같은 탐식 세포에 의한 세균의 세포 내 사멸과 같이 생명에 필수적이다. 라디칼은 신호 전달 과정에 관여하며,[15] 이를 산화 환원 신호 전달이라고 한다. 예를 들어, 리놀레산에 대한 라디칼 공격은 일련의 13-하이드록시옥타데카디에노산 및 9-하이드록시옥타데카디에노산을 생성하며, 이는 국소 조직 염증 및/또는 치유 반응, 통증 인식, 악성 세포 증식을 조절하는 역할을 할 수 있다. 아라키돈산과 도코사헥사엔산에 대한 라디칼 공격은 유사하지만 더 광범위한 신호 전달 생성물을 생성한다.[16]라디칼은 파킨슨병, 노인성 및 약물 유발 난청, 정신 분열증, 알츠하이머병에도 관여할 수 있다.[17] 전형적인 자유 라디칼 증후군인 철분 저장 질환인 혈색소침착증은 일반적으로 운동 장애, 정신병, 피부 색소 침착 멜라닌 이상, 난청, 관절염 및 당뇨병을 포함하는 자유 라디칼 관련 증상의 집합과 관련이 있다. 노화의 자유 라디칼 이론은 라디칼이 노화 과정 자체의 근본 원인이라고 제안한다. 마찬가지로, 미토호르메시스 과정은 라디칼에 대한 반복적인 노출이 수명을 연장할 수 있음을 시사한다.
라디칼은 생명에 필수적이므로 신체는 라디칼에 의한 손상을 최소화하고 발생한 손상을 복구하기 위한 여러 메커니즘을 가지고 있으며, 여기에는 효소 슈퍼옥사이드 디스뮤타제, 카탈라아제, 글루타티온 과산화효소 및 글루타티온 환원효소가 있다. 또한, 항산화제는 이러한 방어 메커니즘에서 핵심적인 역할을 한다. 이는 종종 세 가지 비타민인 비타민 A, 비타민 C, 비타민 E 및 폴리페놀 항산화제이다. 또한, 빌리루빈과 요산이 특정 라디칼을 중화하는 데 도움이 되는 항산화제 역할을 할 수 있음을 나타내는 좋은 증거가 있다. 빌리루빈은 적혈구 내용물의 분해로부터 생성되는 반면, 요산은 퓨린의 분해 산물이다. 그러나 빌리루빈이 너무 많으면 황달이 발생하여 결국 중추 신경계에 손상을 줄 수 있으며, 요산이 너무 많으면 통풍이 발생한다.[18]
6. 3. 환경 화학
하부 대기에서 가장 흔한 라디칼은 분자 산소이다. 소스 분자의 광분해는 다른 라디칼을 생성한다. 하부 대기에서 중요한 라디칼은 이산화질소가 산소 원자와 일산화 질소로 광분해되면서 생성되며, 이는 광화학 스모그 형성에 중요한 역할을 한다. 또한 오존이 들뜬 산소 원자 O(1D)를 생성하도록 광분해되면서 생성된다.:
:
:
:
상부 대기에서, 일반적으로 반응성이 없는 염화플루오린화탄소(CFCs)의 태양 자외선에 의한 광분해는 중요한 라디칼의 원천이다. 이러한 반응은 염소 라디칼(Cl•)을 생성하며, 이는 오존을 O2로 전환하는 것을 촉매하여 오존층 파괴를 촉진한다.
:
:
:
:
:
이러한 반응은 특히 염소 라디칼이 또 다른 반응 연쇄에 참여할 수 있기 때문에 오존층의 고갈을 유발한다. 그 결과 냉매로서 염화플루오린화탄소의 사용이 제한되었다.
7. 생체 내 라디칼
라디칼은 과립구 및 대식세포와 같은 탐식 세포에 의한 세균의 세포 내 사멸과 같이 생명에 필수적인 역할을 한다. 라디칼은 산화 환원 신호 전달 과정에 관여한다.[15] 예를 들어, 리놀레산에 대한 라디칼 공격은 13-하이드록시옥타데카디에노산 및 9-하이드록시옥타데카디에노산을 생성하며, 국소 조직 염증 및/또는 치유 반응, 통증 인식, 악성 세포 증식을 조절하는 역할을 할 수 있다. 아라키돈산과 도코사헥사엔산에 대한 라디칼 공격은 유사하지만 더 광범위한 신호 전달 생성물을 생성한다.[16]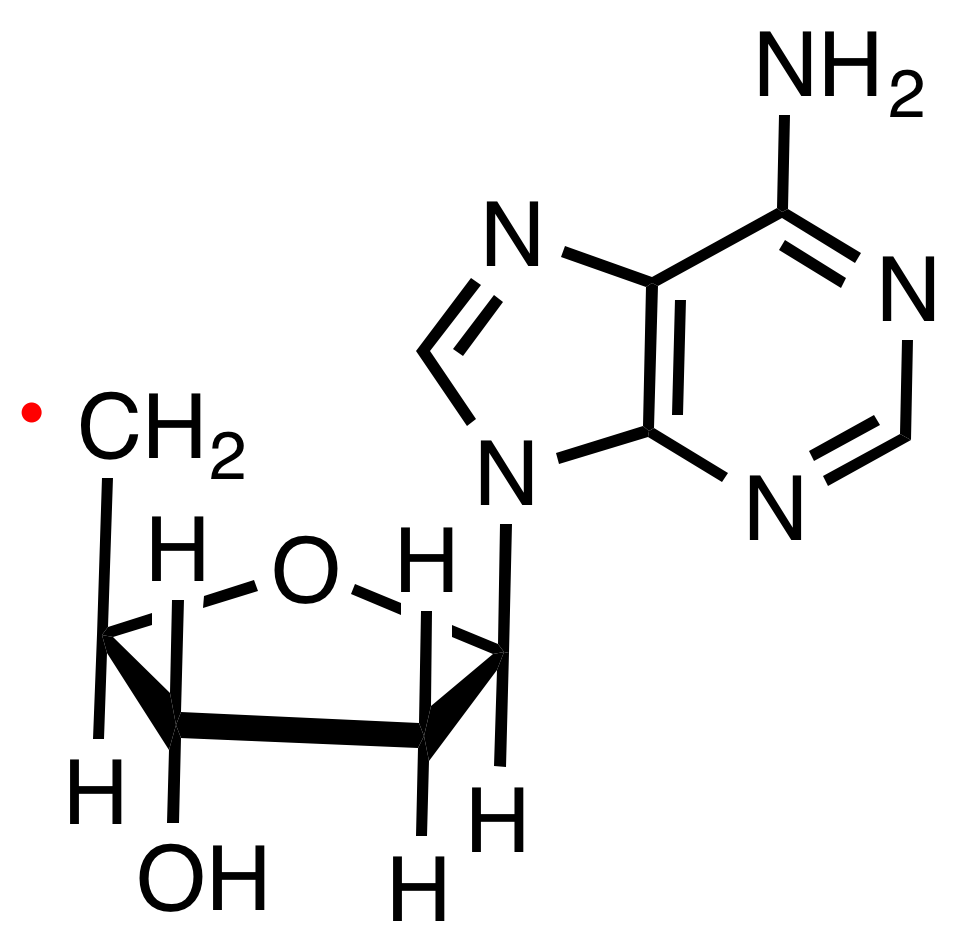
thumb의 근사 구조]]
라디칼은 파킨슨병, 노인성 및 약물 유발 난청, 정신 분열증, 알츠하이머병과 같은 질병에도 관여할 수 있다.[17] 혈색소침착증은 운동 장애, 정신병, 피부 색소 침착 멜라닌 이상, 난청, 관절염 및 당뇨병을 포함하는 자유 라디칼 관련 증상의 집합과 관련이 있다. 노화의 자유 라디칼 이론은 라디칼이 노화 과정 자체의 근본 원인이라고 제안하며, 미토호르메시스 과정은 라디칼에 대한 반복적인 노출이 수명을 연장할 수 있음을 시사한다.
신체는 라디칼에 의한 손상을 최소화하고 발생한 손상을 복구하기 위해 슈퍼옥사이드 디스뮤타제, 카탈라아제, 글루타티온 과산화효소, 글루타티온 환원효소 등의 효소와 비타민 A, 비타민 C, 비타민 E, 폴리페놀 항산화제 등의 항산화제를 사용한다.[18] 빌리루빈과 요산도 특정 라디칼을 중화하는 항산화제 역할을 할 수 있다. 빌리루빈은 적혈구 분해 산물이고, 요산은 퓨린의 분해 산물이다. 그러나 빌리루빈 과다는 황달로 중추 신경계에 손상을 줄 수 있고, 요산 과다는 통풍을 유발한다.[18]
7. 1. 활성 산소 (ROS)
활성산소 (ROS)는 과산화물, 과산화 수소, 수산화 라디칼 등을 포함하는, 세포 손상과 관련된 물질군이다.[19] ROS는 산소의 정상적인 대사 과정에서 자연적으로 생성되며, 세포 신호 전달에 중요한 역할을 한다.과산화물과 수산화 라디칼은 대표적인 산소 중심 라디칼이다. 이들은 환원 조건에서 분자 산소로부터 유래한다. 그러나 반응성이 높아 원치 않는 부반응을 일으켜 세포를 손상시킬 수 있다. 과도한 양의 ROS는 세포 손상 및 사망을 초래하며, 암, 뇌졸중, 심근 경색, 당뇨병 등 다양한 질병의 원인이 된다.[19] DNA와 라디칼의 반응은 돌연변이를 유발하여 세포 주기에 악영향을 미치고, 암을 유발할 수 있다고 알려져 있다.[20] 죽상 경화증과 같은 노화 증상도 콜레스테롤의 라디칼 유도 산화, 즉 7-케토콜레스테롤 때문에 발생한다.[21] 알코올에 의한 간 손상 역시 라디칼이 관여하며, 이는 알코올 자체보다 더 큰 영향을 미칠 수 있다. 담배 연기 속 라디칼은 폐에서 알파 1-안티트립신을 불활성화시켜 폐기종을 유발한다.
옥시벤존은 햇빛 아래에서 라디칼을 생성하여 세포 손상을 유발할 수 있다. 이는 이산화 티타늄, 옥틸 메톡시신나메이트 등 자외선 차단제에 흔히 사용되는 다른 성분과 결합될 때만 나타난다.[22]
ROS는 불포화 지방산인 리놀레산을 공격하여 13-하이드록시옥타데카디에노산 및 9-하이드록시옥타데카디에노산을 생성한다. 이들은 조직 손상에 대한 반응을 유도하는 신호 분자 역할을 한다. ROS는 아라키돈산, 도코사헥사엔산 등 다른 불포화 지방산도 공격하여 유사한 신호 분자를 생성한다.[23]
활성 산소는 단일 산소()와 관련된 제어된 반응에도 사용된다. 이는 천연 삼중항 산소()와 광감각제의 삼중항 여기 상태에서 덱스터 에너지 전달 (삼중항-삼중항 소멸)을 통한 II형 광산소화 반응으로 알려져 있다. 단일 산소를 이용한 대표적인 화학 변환에는 셀룰로오스 바이오 폐기물을 폴리메틴 염료로 전환하는 것이 있다.[24]
7. 2. 생리적 역할
라디칼은 세포 신호 전달, 면역 반응 등 생리적 과정에서 중요한 역할을 한다. 적절한 수준의 라디칼은 세포 기능 유지에 필수적이다.[15] 라디칼은 산화 환원 신호 전달 과정에 관여한다.[15] 예를 들어, 리놀레산에 대한 라디칼 공격은 13-하이드록시옥타데카디에노산 및 9-하이드록시옥타데카디에노산을 생성하며, 이들은 국소 조직 염증, 치유 반응, 통증 인식, 악성 세포 증식 등을 조절한다.[16] 아라키돈산과 도코사헥사엔산에 대한 라디칼 공격도 유사하지만 더 광범위한 신호 전달 생성물을 만든다.[16]라디칼은 파킨슨병, 노인성 및 약물 유발 난청, 정신 분열증, 알츠하이머병 등에도 관여할 수 있다.[17] 철분 저장 질환인 혈색소침착증은 운동 장애, 정신병, 피부 색소 침착 멜라닌 이상, 난청, 관절염, 당뇨병 등 라디칼 관련 증상과 관련이 있다.[17] 노화의 자유 라디칼 이론은 라디칼이 노화 과정의 근본 원인이라고 제안하며, 미토호르메시스 과정은 라디칼에 대한 반복적인 노출이 수명을 연장할 수 있음을 시사한다.
신체는 라디칼에 의한 손상을 최소화하고 복구하기 위해 슈퍼옥사이드 디스뮤타제, 카탈라아제, 글루타티온 과산화효소, 글루타티온 환원효소 등의 효소와 비타민 A, 비타민 C, 비타민 E, 폴리페놀 항산화제 등의 항산화제를 사용한다.[18] 빌리루빈과 요산도 특정 라디칼을 중화하는 항산화제 역할을 할 수 있다. 빌리루빈은 적혈구 분해 산물이고, 요산은 퓨린의 분해 산물이다. 그러나 빌리루빈 과다는 황달로 중추 신경계에 손상을 줄 수 있고, 요산 과다는 통풍을 유발한다.[18]
과산화물, 과산화 수소, 수산화 라디칼과 같은 활성산소 (ROS)는 세포 손상과 관련이 있다. 이들은 산소의 정상적인 대사의 부산물로 형성되며 세포 신호 전달에 중요한 역할을 한다. 과산화물과 수산화 라디칼은 환원 조건에서 분자 산소에서 유래한다. 그러나 이들은 반응성이 커서 세포 손상을 일으키는 부반응에 참여할 수 있다. 과도한 양은 암, 뇌졸중, 심근 경색, 당뇨병 등 많은 질병의 원인이 되는 세포 손상 및 사망으로 이어질 수 있다.[19] 많은 암은 라디칼과 DNA 반응으로 발생하며, 돌연변이를 유발하여 세포 주기에 부정적인 영향을 미치고 악성 종양으로 이어질 수 있다고 생각된다.[20] 죽상 경화증 같은 노화 증상은 콜레스테롤의 라디칼 유도 산화에 의한 7-케토콜레스테롤 때문이다.[21] 라디칼은 알코올로 인한 간 손상, 담배 연기로 인한 폐의 알파 1-안티트립신 불활성화 및 폐기종 발병에도 기여한다.
옥시벤존은 햇빛에서 라디칼을 형성하여 세포 손상과 관련될 수 있다. 이는 이산화 티타늄, 옥틸 메톡시신나메이트 등 자외선 차단제 성분과 결합될 때만 발생한다.[22]
ROS는 불포화 지방산인 리놀레산을 공격하여 13-하이드록시옥타데카디에노산 및 9-하이드록시옥타데카디에노산 생성물을 형성하며, 이들은 조직 손상에 대응하는 반응을 유발하는 신호 분자 역할을 한다. ROS는 아라키돈산, 도코사헥사엔산 등 다른 불포화 지방산을 공격하여 유사한 신호 생성물을 만든다.[23]
활성 산소 종은 단일 산소()와 관련된 제어된 반응에도 사용되며, 이는 천연 삼중항 산소()와 광감각제의 삼중항 여기 상태로부터의 덱스터 에너지 전달(삼중항-삼중항 소멸)에 따른 II형 광산소화 반응으로 알려져 있다. 이 단일 산소 종을 사용한 전형적인 화학적 변환에는 셀룰로오스 바이오 폐기물을 새로운 폴리메틴 염료로 변환하는 것이 포함된다.[24]
참조
[1]
간행물
radical (free radical)
http://goldbook.iupa[...]
2017-03-02
[2]
논문
Superoxide Ion: Generation and Chemical Implications
[3]
웹사이트
Diacyl Peroxides
https://polymerdatab[...]
2020-12-08
[4]
논문
Catalytic Chain Transfer in Free-Radical Polymerizations
2001
[5]
논문
Photoinitiators for free-radical-initiated photoimaging systems
1993
[6]
논문
Radical Chain Polymerization
Springer
2013
[7]
논문
Persistent carbon-centered radicals
[8]
서적
Organic Chemistry of Stable Free Radicals
London: Academic Press
[9]
서적
Organic chemistry
https://www.worldcat[...]
Oxford University Press
2012
[10]
서적
Progress in Inorganic Chemistry
2011-03-31
[11]
서적
The Chemistry of Dithiadiazolylium and Dithiadiazolyl Rings**Dedicated to Dr. Z. V. Hauptman, in appreciation of his important contribution to sulfur-nitrogen and carbon-sulfur-nitrogen chemistry
[12]
문서
paramagnetism
[13]
논문
Timing is Critical: Effect of Spin Changes on the Diastereoselectivity in Mn(Salen)-Catalyzed Epoxidation
1999
[14]
논문
Radical S-Adenosylmethionine Enzymes
[15]
논문
Nitric oxide and peroxynitrite in health and disease
[16]
논문
Lipid peroxidation: pathophysiological and pharmacological implications in the eye
[17]
논문
Neuroinflammatory processes are important in neurodegenerative diseases: An hypothesis to explain the increased formation of reactive oxygen and nitrogen species as major factors involved in neurodegenerative disease development
[18]
서적
Toxicology of the Human Environment – the critical role of free radicals
Taylor and Francis
[19]
논문
Chemopreventive effect of Padina boergesenii extracts on ferric nitrilotriacetate (Fe-NTA)-induced oxidative damage in Wistar rats
[20]
논문
Neuroprotecin D1: A docosahexanoic acid-derived docosatriene protects human retinal pigment epithelial cells from oxidative stress
[21]
논문
7-Ketocholesterol
[22]
논문
An in vitro systematic spectroscopic examination of the photostabilities of a random set of commercial sunscreen lotions and their chemical UVB/UVA active agents
[23]
논문
Lipid peroxidation: pathophysiological and pharmacological implications in the eye
[24]
논문
Synthesis and characterization of polymethine dyes carrying thiobarbituric and carboxylic acid moieties
https://hal.archives[...]
2022-05-16
[25]
논문
The Peroxide Effect in the Addition of Reagents to Unsaturated Compounds. I. The Addition of Hydrogen Bromide to Allyl Bromide
[26]
논문
Radicals: Reactive Intermediates with Translational Potential
[27]
서적
The spectra and structures of simple free radicals
[28]
웹사이트
28th International Symposium on Free Radicals
http://www.free-radi[...]
2007-07-16
[29]
웹사이트
IUPAC Gold Book - radical (free radical)
http://goldbook.iupa[...]
[30]
웹사이트
GLOSSARY OF CLASS NAMES OF ORGANIC COMPOUNDS AND REACTIVE INTERMEDIATES BASED ON STRUCTURE (IUPAC Recommendations 1994)
http://www.chem.qmul[...]
[31]
서적
The spectra and structures of simple free radicals
[32]
웹사이트
28th International Symposium on Free Radicals
http://www.free-radi[...]
2007-04-18
[33]
서적
専門医がやさしく教える活性酸素
[34]
서적
환경친화적인 이온성 액체를 사용한 라디칼 반응에 관한 연구
연세대학교
2007-01-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
