유전자 중복
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
유전자 중복은 유전체 내에서 유전자의 사본이 추가로 생성되는 현상으로, 다양한 메커니즘을 통해 발생하며 진화와 질병에 중요한 영향을 미친다. 불균등 교차, 복제 오류, 레트로트랜스포지션, 이수성, 배수성 등이 유전자 중복을 유발하며, 유전자 중복은 신기능 획득, 부분기능화, 유전자 소실 등 다양한 진화적 결과를 초래한다. 유전자 중복은 샤르코-마리-투스병과 같은 유전성 질환과 암 발생의 원인이 되기도 하며, 유전체 마이크로어레이 및 차세대 염기서열 분석 기술을 통해 연구된다. 유전자 중복으로 생성된 유전자는 오소로그와 파라로그로 구분되며, 파라로그는 서로 다른 기능이나 단백질 구조를 가질 수 있다.
더 읽어볼만한 페이지
- 분자 진화 - 중립 진화 이론
중립 진화 이론은 자연 선택 외에 중립적인 돌연변이와 유전적 부동이 생물 진화의 주요 원동력이라고 주장하며, 유전자 다형성, 분자 시계 등을 설명하고 자연 선택과 병립 가능하다. - 분자 진화 - 돌연변이설
돌연변이설은 초기 유전학자들이 종의 기원과 분화가 점진적인 변화가 아닌 돌연변이로 일어날 수 있다고 주장한 이론으로, 자연 선택의 중요성을 축소한다는 비판과 증거 부족으로 쇠퇴했으나 현대 진화생물학에서 재평가되고 있다. - 돌연변이 - 조로증
조로증은 DNA 복구 과정 결함으로 아동기 또는 청소년기에 노화 징후를 보이는 희귀 유전 질환으로, RecQ 헬리카제, NER 단백질, 라민 등 DNA 복구 단백질 유전자 돌연변이가 주요 원인이며, 베르너 증후군, 블룸 증후군, 로스문드-톰슨 증후군, 콕케인 증후군, 색소피부건조증, 허친슨-길포드 프로제리아 증후군 등이 대표적이다. - 돌연변이 - 돌연변이원
돌연변이원은 DNA에 변화를 일으켜 유전독성을 유발하는 물질 또는 방사선으로, 에임스 검사로 검출이 가능하며 암을 비롯한 질병을 유발할 수 있고, 물리적, 화학적, 생물학적 요인 등 다양한 종류가 존재하여 위험성을 줄이기 위한 연구가 진행 중이다. - 유전 정보 수정 - 형질전환
형질전환은 세균, 효모, 식물, 동물 등 생명체에 외부 DNA를 도입하여 유전적 형질을 변화시키는 기술이며, 자연적 또는 인공적으로 발생하며 유전자 조작에 활용된다. - 유전 정보 수정 - 염색체 전좌
염색체 전좌는 염색체 일부 또는 전체가 다른 염색체로 이동하는 구조 변화로, 유전 정보 변화를 초래하여 다양한 질병을 유발하며, 상호 전좌, 비상호 전좌, 로버트슨 전좌 등으로 분류되고, 가족력이 있는 경우 유전자 검사가 중요하다.
| 유전자 중복 | |
|---|---|
| 기본 정보 | |
| 다른 이름 | 유전자 증폭 |
| 정의 | 유전자 서열이 게놈 내에서 복제되는 현상 |
| 참고 문헌 | |
| 참고 문헌 | Zhang J. Evolution by gene duplication: an update. Trends in Ecology & Evolution. 2003 Jun;18(6):292–8. https://doi.org/10.1016/S0169-5347(03)00033-8 http://www.medterms.com/script/main/art.asp?articlekey=3562 (https://web.archive.org/web/20140306214736/http://www.medterms.com/script/main/art.asp?articlekey=3562) |
2. 유전자 중복의 메커니즘
유전자 중복은 진화의 주요 원인 중 하나로 여겨진다.[49] 일본계 미국인 생물학자 스스무 오노는 1970년에 《유전자 중복에 의한 진화》를 출간하여 종분화의 가장 큰 원인이 유전자 중복이라고 주장했다.[50][51] 효모의 유전체는 1억 년 전 무렵 유전자 중복을 겪은 것으로 추정된다.[52] 밀과 같은 식물에서는 동일한 유전체가 6배수로 존재하는 등 배수체 형성이 흔하게 나타난다.
유전자 중복은 다음과 같은 메커니즘으로 발생한다.
- '''불균등 교차''': 감수 분열 과정에서 상동 염색체가 잘못 정렬되어 발생한다.
- '''복제 오류''': DNA 복제 과정 중 DNA 중합효소의 오류로 발생한다.
- '''레트로트랜스포지션''': 레트로트랜스포존에 의해 mRNA가 DNA로 역전사되어 게놈에 삽입되면서 발생한다.
- '''이수성''': 염색체 비분리 현상으로 인해 염색체 수가 비정상적으로 변하면서 발생한다.
- '''배수성''': 감수 분열 과정에서 비분리가 일어나 전체 게놈이 복제되면서 발생한다.
중복된 유전자 중 하나는 선택 압력에서 해방되어, 돌연변이를 통해 기능을 잃거나 변화시켜도 다른 유전자가 정상 기능을 유지하여 생존에 영향을 주지 않으므로, 단일 유전자보다 빠르게 변이가 축적될 수 있다. 이러한 이유로 중복 유전자는 진화의 주요 역할을 담당한다고 여겨지며, 오노는 저서 "Evolution by gene duplication" (1970년)에서 이를 주장했다.[46]
2. 1. 불균등 교차 (Ectopic recombination)
유전자 중복은 감수 분열 동안 정렬이 잘못된 상동 염색체 간에 발생하는 불균등 교차라는 사건으로 인해 일어난다. 이러한 현상이 일어날 가능성은 두 염색체 간에 반복 요소가 공유되는 정도에 따라 달라진다. 이러한 재조합의 결과물은 교환 부위에 중복이 생기고 상호적인 결실이 일어나는 것이다. 이소성 재조합은 일반적으로 중복된 절단점에서의 서열 유사성에 의해 매개되며, 이는 직접 반복을 형성한다. 전이성 요소와 같은 반복적인 유전 요소는 재조합을 촉진할 수 있는 반복 DNA의 한 가지 원천이 되며, 식물과 포유류의 중복 절단점에서 자주 발견된다.[2]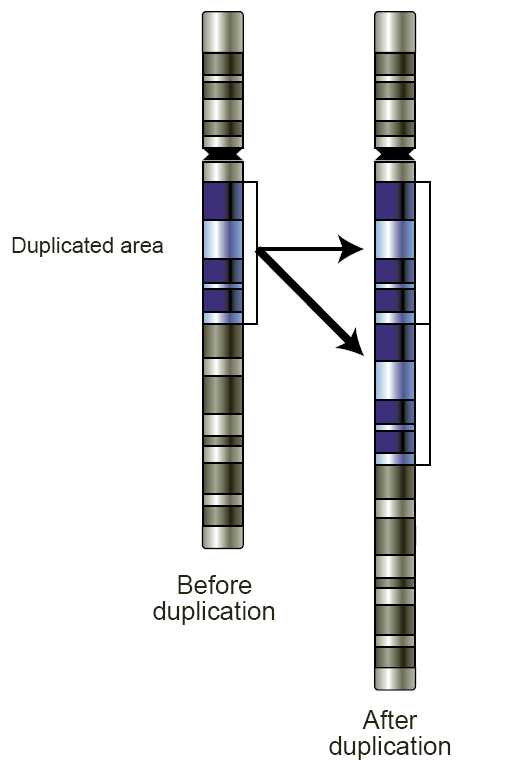
2. 2. 복제 오류 (Replication slippage)
복제 오류는 DNA 복제 과정에서 발생하는 오류로, 짧은 유전 서열의 중복을 생성할 수 있다. 복제 과정 동안 DNA 중합효소는 DNA 복제를 시작하는데, 이 과정 중 어느 시점에서 중합효소가 DNA에서 떨어져 나가 복제가 중단된다. 이후 중합효소가 DNA 가닥에 다시 결합할 때, 복제 가닥을 잘못된 위치에 정렬하여 우연히 동일한 부분을 두 번 이상 복사하게 된다. 복제 오류는 반복 서열에 의해 촉진되는 경우가 많지만, 몇 개의 염기만 유사해도 발생할 수 있다.2. 3. 레트로트랜스포지션 (Retrotransposition)
레트로트랜스포존은 주로 L1이며, 때때로 세포 mRNA에 작용할 수 있다. 전사체는 DNA로 역전사되어 게놈의 임의의 위치에 삽입되어 레트로유전자를 생성한다.[3] 생성된 서열은 대개 인트론이 없고, 게놈에 통합되는 poly(A) 서열을 포함하는 경우가 많다.[3] 많은 레트로유전자는 부모 유전자 서열과 비교하여 유전자 조절의 변화를 보이며, 이는 때때로 새로운 기능을 초래한다.[3] 레트로유전자는 다른 염색체 사이를 이동하여 염색체 진화를 형성할 수 있다.[3]2. 4. 이수성 (Aneuploidy)
이수성은 단일 염색체에서 비분리가 발생하여 염색체의 수가 비정상적으로 될 때 발생한다. 이수성은 종종 해로우며 포유류에서는 종종 자연 유산(유산)으로 이어진다. 일부 이수성 개체는 생존 가능하며, 예를 들어 인간의 다운 증후군을 유발하는 21번 삼염색체가 있다. 이수성은 종종 유전자 용량을 유기체에 해로운 방식으로 변경하므로, 집단 전체로 퍼질 가능성은 낮다.2. 5. 배수성 (Polyploidy)
배수성 또는 ''전체 게놈 중복''은 감수 분열 과정에서 비분리의 결과로, 전체 게놈의 추가적인 복제본이 생성되는 현상이다. 배수성은 식물에서 흔하며, 동물에서도 발생했으며, 척추동물 계통에서 2번의 전체 게놈 중복(2R 가설)을 거쳐 인간에 이르렀다.[4] 또한, 반자낭균 효모에서도 약 1억 년 전에 발생했다.[5][6]전체 게놈 중복 이후에는 비교적 짧은 기간 동안 게놈 불안정, 광범위한 유전자 손실, 높은 수준의 뉴클레오티드 치환 및 조절 네트워크 재배선이 일어난다.[7][8] 또한, 유전자 용량 효과가 중요한 역할을 한다.[9] 따라서, 대부분의 중복 유전자는 짧은 기간 내에 소실되지만, 상당 부분의 중복 유전자는 생존한다.[10] 흥미롭게도 조절에 관여하는 유전자가 우선적으로 유지된다.[11][12] 게다가, 특히 Hox 유전자와 같은 조절 유전자의 유지는 적응적 혁신을 이끌었다.
중복 유전자의 전사 수준에서 빠른 진화와 기능적 분화가 관찰되었으며, 이는 일반적으로 짧은 전사 인자 결합 모티프의 점 돌연변이에 의해 발생한다.[13][14] 또한, 빠르게 진화하는 본질적으로 무질서한 영역 내에 포함된 단백질 인산화 모티프의 빠른 진화는 중복 유전자의 생존 및 빠른 적응/신생 기능화를 위한 또 다른 기여 요인이다.[15] 따라서, 유전자 조절(적어도 번역 후 수준에서)과 게놈 진화 사이에는 연관성이 있는 것으로 보인다.[15]
배수성은 또한 종 분화의 잘 알려진 원인이며, 부모 종과 다른 수의 염색체를 가진 자손은 종종 비배수성 유기체와 교배할 수 없다. 전체 게놈 중복은 개별 유전자의 상대적 용량이 동일해야 하므로, 이수성과 비교하여 덜 해로운 것으로 여겨진다.
3. 유전자 중복의 진화적 의의
유전자 중복은 진화에 중요한 역할을 한다고 여겨지며, 과학계에서는 100년 이상 이러한 견해를 유지해 왔다.[25] 오노 스스무는 그의 저서 《유전자 중복에 의한 진화》(1970)에서 이 이론을 체계적으로 제시하였다.[26] 오노는 유전자 중복이 보편적 공통 조상이 출현한 이후 가장 중요한 진화의 동력이라고 주장했다.[27]
주요한 게놈 중복 사건은 매우 흔하게 일어날 수 있다. 예를 들어, 효모의 유전체는 약 1억 년 전에 중복을 겪었다고 알려져 있다.[28] 식물은 게놈 중복이 가장 많이 일어나는 생물군이다. 밀은 6배체(일종의 다배체)로, 게놈이 6개의 사본으로 이루어져 있다.
이러한 유전자 중복은 신기능 획득, 부분기능화를 거쳐 새로운 유전적 기능을 만들어내거나, 또는 유전자 소실을 겪을 수도 있다.
3. 1. 유전자 중복의 빈도
유전자 중복은 진화를 일으키는 원인 가운데 하나로 지목되고 있다.[49] 일본계 미국인 생물학자인 오노 스스무는 1970년 이와 관련하여 《유전자 중복에 의한 진화》를 출간한 바 있다.[50] 오노는 공통 조상에서 종분화가 이루어지는 가장 큰 원인이 유전자 중복이라고 하였다.[51] 배수체의 형성 기제는 아직 정확히 밝혀지지 않고 있으나 효모의 유전체는 1억년 전 무렵 유전자 중복을 일으킨 것으로 추정되고 있다.[52]식물에서 배수체의 형성은 매우 일반적인 현상으로 밀의 경우 동일한 유전체가 6배수로 존재한다.
게놈 비교를 통해 유전자 중복이 조사된 대부분의 종에서 흔하게 발생한다는 것을 알 수 있다. 이는 인간[16][17] 또는 초파리[18]의 게놈에서 가변적인 복제 수(복제 수 변이)로 나타난다. 그러나 이러한 중복이 발생하는 속도를 측정하는 것은 어려웠다. 최근 연구에서 이러한 추정치가 처음으로 확보된 다세포 진핵생물인 ''C. elegans''에서 유전자 중복의 전체 게놈 규모의 속도를 처음으로 직접 추정했다. ''C. elegans''의 유전자 중복 속도는 10−7 중복/유전자/세대 정도인데, 즉 1000만 마리의 벌레 집단에서 한 세대마다 유전자 중복이 한 번 발생한다는 의미이다. 이 속도는 이 종의 뉴클레오티드 부위당 자발적인 점 돌연변이율보다 두 자릿수나 더 높다.[19] 이전의 (간접적인) 연구에서는 세균, ''Drosophila'', 인간에서 10−3 ~ 10−7/유전자/세대의 국소 유전자 중복 속도를 보고했다.[20][21][22]
중복된 유전자 중 하나는 선택 압력에서 해방된다. 이는 동일한 기능을 가진 두 개의 유전자가 존재하는 경우, 한쪽이 돌연변이를 일으켜 그 기능을 잃어도 (혹은 변화시켜도), 다른 한쪽이 정상적으로 기능하면 생물의 생존에 지장이 없기 때문이다. 따라서 중복된 유전자에서는 단일 유전자보다 훨씬 빠르게, 경대에 따른 변이가 축적된다. 그렇기 때문에, 중복 유전자는 진화의 주요 역할을 담당한다고 생각되며, 100년 이상 전부터 학계에서 지지받아 왔다.[45] 오노 스스무는 가장 유명한 제창자 중 한 명이며, 저서 "Evolution by gene duplication" (1970년)을 저술한 인물이기도 하다.[46] 중복 유전자는 공통 조상의 출현 이래, 가장 중요한 진화의 원동력이었다고 주장하는 사람도 있다.
3. 2. 신기능 획득 (Neofunctionalization)
유전자 중복은 진화적 혁신으로 이어질 수 있는 유전적 참신함의 필수적인 원천이다. 중복은 유전적 중복성을 생성하며, 두 번째 유전자 사본은 종종 선택적 압력으로부터 자유롭다. 즉, 유전자 돌연변이는 숙주 유기체에 유해한 영향을 미치지 않는다. 유전자의 한 사본이 원래 기능에 영향을 미치는 돌연변이를 경험하면, 두 번째 사본이 '예비 부품' 역할을 하여 계속해서 올바르게 기능할 수 있다.[23] 따라서 중복된 유전자는 기능적인 단일 사본 유전자보다 유기체의 세대를 거쳐 돌연변이를 더 빠르게 축적하며, 두 사본 중 하나가 새롭고 다른 기능을 개발하는 것이 가능하다. 그러한 신규 기능화의 몇 가지 예는 빙어과의 중복된 소화 유전자의 돌연변이가 부동액 유전자로 변하고, 새로운 뱀 독 유전자를 생성하는 중복, 그리고 돼지에서 1 베타-히드록시테스토스테론의 합성이 있다.[24]유전자 중복은 진화에 중요한 역할을 하는 것으로 여겨지며, 이 입장은 과학계 구성원들이 100년 이상 유지해왔다.[25] 오노 스스무는 그의 고전적인 저서 ''유전자 중복에 의한 진화''(1970)에서 이 이론의 가장 유명한 개발자 중 한 명이었다.[26] 오노는 유전자 중복이 보편적 공통 조상의 출현 이후 가장 중요한 진화적 힘이라고 주장했다.[27]
3. 3. 부분기능화 (Subfunctionalization)
중복된 유전자는 퇴행성 돌연변이를 축적할 수 있다. 단, 다른 사본에 의해 결함이 보완되는 경우에 한한다. 이는 중립적인 "부분기능화"(건설적 중립 진화) 또는 DDC(복제-퇴화-보완) 모델로 이어진다.[29][30] 원본 유전자의 기능은 두 사본에 분산된다. 두 유전자 모두 중요한 비중복 기능을 수행하므로 어느 유전자도 손실될 수 없지만, 궁극적으로 새로운 기능을 달성할 수 없다.부분기능화는 돌연변이가 유해하거나 유익한 영향 없이 축적되는 중립적 과정을 통해 발생할 수 있다. 그러나 어떤 경우에는 명확한 적응적 이점을 가지고 부분기능화가 발생할 수 있다. 만약 조상 유전자가 다면발현적이고 두 가지 기능을 수행한다면, 종종 이 두 기능 중 어느 것도 다른 기능에 영향을 주지 않고는 변경될 수 없다. 이러한 방식으로, 조상 기능을 두 개의 별도 유전자로 분할하면 하위 기능의 적응적 전문화를 허용하여 적응적 이점을 제공할 수 있다.[31]
3. 4. 유전자 소실 (Gene Loss)
중복된 유전자 가운데 하나는 선택 압력에서 해방된다. 이는 동일한 기능을 가진 두 개의 유전자가 존재하는 경우, 한쪽이 돌연변이를 일으켜 그 기능을 잃어도 (혹은 변화시켜도), 다른 한쪽이 정상적으로 기능하면 생물의 생존에 지장이 없기 때문이다. 따라서 중복된 유전자에서는 단일 유전자보다 훨씬 빠르게, 경대에 따른 변이가 축적된다. 그렇기 때문에, 중복 유전자는 진화의 주요 역할을 담당한다고 생각되며, 100년 이상 전부터 학계에서 지지받아 왔다[45]. 오노 모토는 가장 유명한 제창자 가운데 한 명이며, 저서 "Evolution by gene duplication" (1970년)을 저술한 인물이기도 하다[46]. 중복 유전자는 공통 조상의 출현 이래, 가장 중요한 진화의 원동력이었다고 주장하는 사람도 있다.종종 그 결과로 나타나는 유전체 변이는 레트 유사 증후군이나 펠리제우스-메르츠바허병과 같은 유전자 용량 의존적 신경 질환을 유발한다.[32] 이러한 해로운 돌연변이는 개체군에서 사라질 가능성이 높으며, 보존되거나 새로운 기능을 개발하지 못할 것이다. 그러나 많은 중복은 실제로 해롭거나 유익하지 않으며, 이러한 중립적인 서열은 유전적 부동을 통해 무작위적인 변동을 겪으며 개체군에서 사라지거나 확산될 수 있다.
4. 유전자 중복과 질병
유전자 중복은 유전성 질환의 원인이 되기도 한다. 사람에게서 나타나는 샤르코 마리 투스 질환은 염색체의 특정 구간에서 일어나는 유전자 중복이 원인이다. 이 외에도 레트 유사 증후군이나 펠리제우스-메르츠바허병과 같은 유전자 용량 의존적 신경 질환을 유발하기도 한다.[32] 이러한 해로운 돌연변이는 개체군에서 사라질 가능성이 높으며, 보존되거나 새로운 기능을 개발하지 못할 것이다. 그러나 많은 중복은 실제로 해롭거나 유익하지 않으며, 이러한 중립적인 서열은 유전적 부동을 통해 무작위적인 변동을 겪으며 개체군에서 사라지거나 확산될 수 있다.
4. 1. 샤르코-마리-투스병 (Charcot-Marie-Tooth disease)
사람에게서 나타나는 샤르코 마리 투스 질환은 염색체의 특정 구간에서 일어나는 유전자 중복이 원인이다. 손과 발의 말초신경 발달에 관여하는 유전자가 돌연변이로 인해 중복되어 샴페인 병을 거꾸로 세운 것과 같은 모습의 기형을 유발한다. 발생된 샤르코 마리 투스 질환은 멘델의 유전법칙에 따라 유전되며 유형에 따라 상염색체 우성 또는 열성을 보인다.[53] 샤르코 마리 투스 질환은 중요 신경 질환의 하나이며 100,000명당 발병률은 36명이다.[54]4. 2. 암 (Cancer)
암 유전자의 중복은 여러 유형의 암의 흔한 원인이다. 유전자 중복은 체세포에서 발생하며 암세포 자체의 유전체에만 영향을 미치고, 전체 유기체나 후손에게는 영향을 미치지 않는다. 최근 TCGA 코호트에서 운전자 사건을 환자 수준에서 분류 및 정량화한 결과, 종양당 평균 12개의 운전자 사건이 발생하며 그중 1.5개는 암 유전자의 증폭으로 나타났다.[38]| 암 유형 | 관련 유전자 증폭 | 암 유형에서 증폭 빈도(%) |
|---|---|---|
| 유방암 | MYC | 20%[39] |
| ERBB2 (HER2) | 20%[39] | |
| CCND1 (사이클린 D1) | 15–20%[39] | |
| FGFR1 | 12%[39] | |
| FGFR2 | 12%[39] | |
| 자궁경부암 | MYC | 25–50%[39] |
| ERBB2 | 20%[39] | |
| 대장암 | HRAS | 30%[39] |
| KRAS | 20%[39] | |
| MYB | 15–20%[39] | |
| 식도암 | MYC | 40%[39] |
| CCND1 | 25%[39] | |
| MDM2 | 13%[39] | |
| 위암 | CCNE (사이클린 E) | 15%[39] |
| KRAS | 10%[39] | |
| MET | 10%[39] | |
| 교모세포종 | ERBB1 (EGFR) | 33–50%[39] |
| CDK4 | 15%[39] | |
| 두경부암 | CCND1 | 50%[39] |
| ERBB1 | 10%[39] | |
| MYC | 7–10%[39] | |
| 간세포암 | CCND1 | 13%[39] |
| 신경모세포종 | MYCN | 20–25%[39] |
| 난소암 | MYC | 20–30%[39] |
| ERBB2 | 15–30%[39] | |
| AKT2 | 12%[39] | |
| 육종 | MDM2 | 10–30%[39] |
| CDK4 | 10%[39] | |
| 소세포폐암 | MYC | 15–20%[39] |
전체 유전체 중복 또한 암에서 빈번하게 나타나며, 가장 흔한 암 유형의 종양에서 30%에서 36%까지 발견된다.[40][41] 발암 과정에서의 정확한 역할은 불분명하지만, 어떤 경우에는 염색질 분리가 손실되어 염색질 구조 변화를 일으키고, 이는 다시 발암성 후성 유전적 및 전사적 변형으로 이어진다.[42]
5. 유전자 중복 연구 방법
유전자 중복을 연구하는 방법에는 여러 가지가 있다. 유사 유전자는 모든 주석 처리된 유전자 모델을 서로 비교하여 단일 게놈에서 식별할 수 있다. 이러한 비교는 고대 중복을 식별하기 위해 번역된 아미노산 서열(예: BLASTp, tBLASTx) 또는 더 최근 중복을 식별하기 위해 DNA 뉴클레오티드 서열(예: BLASTn, megablast)에서 수행할 수 있다. 유전자 중복을 식별하기 위한 대부분의 연구에서는 상호 최적 정합 또는 퍼지 상호 최적 정합이 필요하며, 여기서 각 유사 유전자는 서열 비교에서 다른 유전자의 단일 최적 정합이어야 한다.[33]
생물학적 연구에서 유사 유전자와 정상 유전자를 구별하는 것은 중요하다. 인간 유전자의 기능에 대한 실험은 인간 유전자에 대한 상동 유전자가 해당 종의 게놈에서 발견될 수 있다면 다른 종에서 수행될 수 있지만, 상동 유전자가 정상 유전자인 경우에만 가능하다. 만약 그들이 유사 유전자이고 유전자 중복 사건의 결과라면, 그들의 기능은 너무 다를 가능성이 높다. 유전자 집단을 구성하는 중복 유전자의 하나 이상의 사본은 서열에서 그들 간에 상당한 변이를 일으키는 전이 인자의 삽입에 의해 영향을 받을 수 있으며, 결국 분기 진화의 원인이 될 수 있다. 이것은 또한 서열의 유사성이 적거나 없기 때문에 유전자 중복의 상동 유전자 간의 유전자 전환의 기회와 속도를 렌더링할 수 있다.
대부분의 유전자 중복은 저 복제 반복 (LCR)으로 존재하며, 전이 인자와 같은 매우 반복적인 서열은 아니다. 그들은 주로 염색체의 중절부위, 말단소립 및 간질 영역에서 발견된다. 많은 LCR은 크기(>1Kb), 유사성 및 방향성으로 인해 중복 및 삭제에 매우 취약하다.
5. 1. 유전체 마이크로어레이 (Genomic microarray)
array 비교 유전체 혼성화(array CGH)라고도 불리는 유전체 마이크로어레이 기술은 유전체 DNA 샘플에서 마이크로중복과 같은 염색체 이상을 고속으로 감지하는 데 사용된다.[34][35] 특히, DNA 마이크로어레이 기술은 여러 치료법 또는 실험 조건에서 수천 개의 유전자의 유전자 발현 수준을 동시에 모니터링하여 유전자 중복 또는 종 분화 이후 유전자 조절에 대한 진화 연구를 크게 용이하게 한다.[34][35]5. 2. 차세대 염기서열 분석 (Next generation sequencing)
유전학이나 유전공학에서는 연구를 위해 인공적으로 유전자 중복을 이용한다. 중합효소 연쇄반응을 이용한 유전자 증폭은 겔 전기 영동법과 더불어 가장 일반적인 실험 방법 가운데 하나가 되었다. 제한효소를 이용하여 DNA를 분리한 뒤 이를 중복 복제하는 중합효소 연쇄반응의 도입은 유전자 연구의 시간을 획기적으로 단축시켰다.[55] 이를 이용한 DNA 지문 검사는 범죄 수사에도 이용된다. 캐리 멀리스는 1983년 중합효소 연쇄반응을 발견하였고, 이 공로로 1993년 노벨 화학상을 수상하였다.[55]유전자 중복은 차세대 염기 서열 분석 플랫폼을 사용하여 식별할 수도 있다. 유전체 재시퀀싱 데이터에서 중복을 식별하는 가장 간단한 방법은 쌍으로 이루어진 염기 서열 분석 리드를 사용하는 것이다. 연속적인 중복은 비정상적인 방향으로 매핑되는 염기 서열 분석 리드 쌍에 의해 나타난다. 시퀀스 커버리지 증가와 비정상적인 매핑 방향의 조합을 통해 유전체 시퀀싱 데이터에서 중복을 식별할 수 있다.
6. 유전자 중복과 유전자 증폭
유전학이나 유전공학에서는 연구를 위해 인공적으로 유전자 중복을 이용한다. 중합효소 연쇄반응을 이용한 유전자 증폭은 겔 전기 영동법과 더불어 가장 일반적인 실험 방법 가운데 하나가 되었다. 제한효소를 이용하여 DNA를 분리한 뒤 이를 중복 복제하는 중합효소 연쇄반응의 도입은 유전자 연구의 시간을 획기적으로 단축시켰다. 이를 이용한 DNA 지문 검사는 범죄 수사에도 이용된다. 중합효소 연쇄반응은 1983년 캐리 멀리스가 발견하였으며, 멀리스는 이 공로로 1993년 노벨 화학상을 수상하였다.[55]
분자 유전학의 관점에서, 유전자 증폭은 유전자가 과발현될 수 있는 여러 가지 방법 중 하나이다. 유전자 증폭은 효소를 사용하여 짧은 가닥의 DNA를 ''생체 외''에서 증폭하는 중합효소 연쇄 반응 기술과 같이 인위적으로 발생할 수 있으며, 위에서 설명한 것처럼 자연적으로 발생할 수도 있다. 자연적인 중복의 경우, 지속적인 진화적 변화에 필요할 생식 계열 세포가 아닌 체세포에서 발생할 수 있다.
7. 오소로그와 파라로그
동일한 유전자, 즉 호몰로그(같은 조상 유전자에서 유래한 유전자)는 발생 방식의 차이에 따라 오소로그와 파라로그로 나뉜다. 종 분화로 생긴 두 유전자는 오소로그라고 불린다. 이에 반해, 유전자 중복에 의해 생긴 두 유전자는 파라로그라고 불린다. 파라로그는 유전자로서 발현되는 신체 부위나 발현 시기, 또는 기능이나 단백질 구조가 다른 단백질을 코딩하는 경우가 많다.
이러한 오소로그와 파라로그를 구별하는 것은 연구상 중요하지만, 종종 어렵다. 예를 들어 인간 유전자 연구는 다른 동물에서 상동 유전자가 발견되면 그것을 이용하여 수행되는 경우가 많은데, 이는 해당 유전자가 인간 유전자의 오소로그인 경우에만 가능하다. 만약 유전자 중복의 결과로 생긴 파라로그라면, 그 기능이 다를 가능성이 높다.
참조
[1]
간행물
Evolution by gene duplication: an update
http://www.umich.edu[...]
[2]
웹사이트
Definition of Gene duplication
http://www.medterms.[...]
MedicineNet
2012-03-19
[3]
간행물
Retrogene Duplication and Expression Patterns Shaped by the Evolution of Sex Chromosomes in Malaria Mosquitoes
2022-05-28
[4]
간행물
Two rounds of whole genome duplication in the ancestral vertebrate
2005-10
[5]
간행물
Molecular evidence for an ancient duplication of the entire yeast genome
1997-06-12
[6]
간행물
Proof and evolutionary analysis of ancient genome duplication in the yeast Saccharomyces cerevisiae
https://pubmed.ncbi.[...]
2004-04-08
[7]
간행물
The evolutionary consequences of polyploidy
2007-11-02
[8]
간행물
Functional partitioning of yeast co-expression networks after genome duplication
2006-04
[9]
간행물
Dosage sensitivity and the evolution of gene families in yeast
https://pubmed.ncbi.[...]
2003-07-10
[10]
간행물
The evolutionary fate and consequences of duplicate genes
https://pubmed.ncbi.[...]
2000-11-10
[11]
간행물
Gene-balanced duplications, like tetraploidy, provide predictable drive to increase morphological complexity
2006-07
[12]
간행물
Do disparate mechanisms of duplication add similar genes to the genome?
https://pubmed.ncbi.[...]
2005-10
[13]
간행물
Nonrandom divergence of gene expression following gene and genome duplications in the flowering plant Arabidopsis thaliana
2006
[14]
간행물
Expression divergence between duplicate genes
https://pubmed.ncbi.[...]
2005-11
[15]
간행물
Posttranslational regulation impacts the fate of duplicated genes
2010-02-16
[16]
간행물
Large-scale copy number polymorphism in the human genome
2004-07
[17]
간행물
Detection of large-scale variation in the human genome
2004-09
[18]
간행물
Natural selection shapes genome-wide patterns of copy-number polymorphism in Drosophila melanogaster
2008-06
[19]
간행물
High spontaneous rate of gene duplication in Caenorhabditis elegans
2011-02
[20]
간행물
Spontaneous tandem genetic duplications in Salmonella typhimurium arise by unequal recombination between rRNA (rrn) cistrons
1981-05
[21]
간행물
Molecular spectrum of spontaneous de novo mutations in male and female germline cells of Drosophila melanogaster
2009-03
[22]
간행물
Germline rates of de novo meiotic deletions and duplications causing several genomic disorders
2008-01
[23]
간행물
Inventing an arsenal: adaptive evolution and neofunctionalization of snake venom phospholipase A2 genes
2007-01
[24]
간행물
Turning a hobby into a job: how duplicated genes find new functions
2008-12
[25]
간행물
Duplication and divergence: the evolution of new genes and old ideas
[26]
서적
Evolution by gene duplication
Springer Science+Business Media
[27]
서적
Sex Chromosomes and Sex-linked Genes
https://archive.org/[...]
Springer-Verlag
[28]
간행물
Proof and evolutionary analysis of ancient genome duplication in the yeast Saccharomyces cerevisiae
2004-04
[29]
간행물
Preservation of duplicate genes by complementary, degenerative mutations
1999-04
[30]
간행물
On the possibility of constructive neutral evolution
1999-08
[31]
간행물
Escape from adaptive conflict after duplication in an anthocyanin pathway gene
2008-08
[32]
간행물
Genomic rearrangements and gene copy-number alterations as a cause of nervous system disorders
2006-10
[33]
간행물
Gene family evolution across 12 Drosophila genomes
2007-11
[34]
간행물
The use of genomic microarrays to study chromosomal abnormalities in mental retardation
[35]
간행물
Rapid evolution of expression and regulatory divergences after yeast gene duplication
2005-01
[36]
웹사이트
ISCN Symbols and Abbreviated Terms
https://www.coriell.[...]
2022-10-27
[37]
웹사이트
HARCOT-MARIE-TOOTH DISEASE, DEMYELINATING, TYPE 1A; CMT1A
https://omim.org/ent[...]
[38]
논문
Comprehensive patient-level classification and quantification of driver events in TCGA PanCanAtlas cohorts
2022-01-14
[39]
서적
The genetic basis of human cancer
https://books.google[...]
McGraw-Hill
[40]
논문
Genome doubling shapes the evolution and prognosis of advanced cancers
2018
[41]
논문
Whole-genome doubling confers unique genetic vulnerabilities on tumour cells
2021
[42]
논문
Whole-genome doubling drives oncogenic loss of chromatin segregation
2023-03-15
[43]
논문
Evolution by gene duplication: an update.
2003
[44]
논문
"Proof and evolutionary analysis of ancient genome duplication in the yeast Saccharomyces cerevisiae"
2004
[45]
논문
"Duplication and Divergence: The Evolution of New Genes and Old Ideas"
2004
[46]
서적
Evolution by gene duplication
Springer-Verlag
[47]
논문
Evolution by gene duplication: an update
2003
[48]
웹인용
Definition of Gene duplication
http://www.medterms.[...]
2014-03-06
[49]
논문
Duplication and divergence: the evolution of new genes and old ideas
2004
[50]
서적
Evolution by gene duplication
Springer-Verlag
1970
[51]
서적
Sex Chromosomes and Sex-linked Genes
Springer-Verlag
1967
[52]
논문
"Proof and evolutionary analysis of ancient genome duplication in the yeast Saccharomyces cerevisiae"
2004-04
[53]
간행물
한국인에서 Charcot-Marie-Tooth 1A 질환의 분자유전학적 분석
http://bbs.neuro.or.[...]
1999
[54]
논문
"Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A"
http://brain.oxfordj[...]
2000
[55]
서적
즐거운 생물학
살림
2009
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
