핵인자 카파비
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
핵인자 카파비(NF-κB)는 B 세포의 면역글로불린 유전자 인핸서에서 처음 발견된 전사 인자이다. NF-κB는 Rel 상동성 도메인(RHD)을 공유하는 단백질들의 패밀리로, 면역 반응, 세포 생존, 세포 증식, 신경계 기능 등 다양한 생물학적 과정에 관여한다. NF-κB는 고전적 경로와 비고전적 경로를 통해 활성화되며, IκB 억제제에 의해 조절된다. NF-κB의 비정상적인 활성화는 암, 염증성 질환, 정신 질환 등 다양한 질병과 관련이 있으며, 억제제 개발을 통해 치료적 접근이 시도되고 있다.
더 읽어볼만한 페이지
- 노화 관련 단백질 - 텔로머레이스
텔로머레이스는 진핵세포 염색체 말단의 텔로미어 DNA 반복 서열을 연장하는 역전사 효소로, 세포 분열 시 텔로미어 단축을 막아 세포 수명 유지에 중요한 역할을 하며, RNA 구성 요소(TERC)와 역전사 효소(TERT) 복합체로 구성되어 세포 노화, 암, 유전 질환 연구와 관련이 있고, 텔로미어와 텔로머레이스 기능 연구로 엘리자베스 블랙번, 캐럴 W. 그리더, 잭 W. 쇼스택이 2009년 노벨 생리학·의학상을 수상했다. - 노화 관련 단백질 - IGF-1
IGF-1은 성장 호르몬에 의해 간에서 생성되는 폴리펩타이드 호르몬으로, 성장, 대사, 단백질 번역 등 동화 작용에 관여하며, GH-IGF-1 축을 통해 근력 유지, 골격 발달, 뇌 발달 등에 기여하지만, 비정상적인 수치는 질환과 관련될 수 있고 스포츠계에서는 금지 약물로 지정되어 있다. - 탐닉 - 인지 행동 치료
인지 행동 치료(CBT)는 생각과 행동 변화를 통해 정신 건강 문제를 치료하는 심리 치료법으로, 다양한 정신적, 신체적 문제에 적용되며, 최근에는 마음챙김을 강조하는 제3세대 CBT가 주목받지만, 효과에 대한 논쟁과 비판도 존재한다. - 탐닉 - 집행 기능
집행 기능은 계획, 의사결정, 작업 기억, 주의 조절, 인지적 유연성 등 고차원 인지 과정을 통합하고 조절하는 능력으로, 전전두엽 피질을 비롯한 뇌 영역이 관여하며, 상황 적응, 오류 수정, 습관 억제 등에 중요한 역할을 하고, 유아기부터 청소년기를 거쳐 20대 후반에서 30대 초반까지 발달하며, 다양한 모델과 평가 방법이 존재하고, 특정 질병 및 장애와 관련되기도 하며, 이중언어 사용이 긍정적 영향을 주기도 한다. - 세포예정사 - 사이토크롬 c
사이토크롬 c는 진핵생물의 미토콘드리아 내막에 존재하는 전자 전달계 구성 요소이자 세포자멸사 관여 단백질로서, 작은 크기와 보존된 서열 덕분에 분자 계통학 연구에 활용되며 항산화 효소 및 저준위 레이저 치료에서의 역할 등 다양한 응용 가능성이 제시된다. - 세포예정사 - 오토파지
오토파지는 세포 내 구성 성분을 분해 및 재활용하여 항상성을 유지하고, 영양 결핍 시 에너지와 물질을 공급하는 과정으로, 거대 자가포식, 미세 자가포식, 샤페론 매개 자가포식의 세 유형으로 나뉘며, 오스미 요시노리의 노벨상 수상 이후 질병 치료 표적으로 연구가 활발하다.
| 핵인자 카파비 | |
|---|---|
| 기본 정보 | |
 | |
| 유형 | 단백질 복합체 |
| 기능 | 전사 인자 |
| 하위 단위 | NFKB1 RELA RELB NFKB2 NFKBIA NFKBIB NFKBIE NFKBIZ TNFAIP3 |
| 상세 정보 | |
| 참여 경로 | 세포 신호 전달 면역 반응 세포 사멸 세포 성장 |
| 유전자 | |
| 관련 유전자 | NFKB1 RELA RELB NFKB2 NFKBIA NFKBIB NFKBIE NFKBIZ TNFAIP3 |
| 추가 정보 | |
| 관련 질병 | 암 자가면역 질환 신경퇴행성 질환 |
2. NF-κB의 발견과 구조
NF-κB 패밀리 구성원은 레트로바이러스 온코진 v-Rel과 구조적 상동성을 공유한다.[3]
포유류의 NF-κB 패밀리에는 다섯 가지 단백질이 있다:[22]
| 종류 | 단백질 | 별칭 | 유전자 |
|---|---|---|---|
| I | NF-κB1 | p105 → p50 | NFKB1 |
| NF-κB2 | p100 → p52 | NFKB2 | |
| II | RelA | p65 | RELA |
| RelB | RELB | ||
| c-Rel | REL |
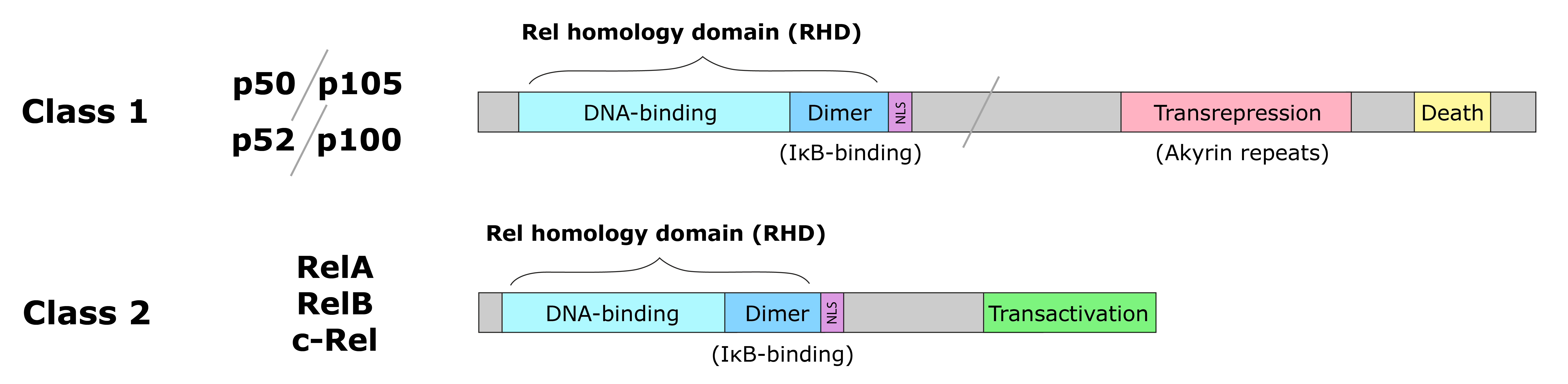
NF-κB/Rel 단백질은 I형과 II형으로 나뉜다. I형(NF-κB1, NF-κB2)은 C-말단에 앵커린 반복을 포함하여 억제 활성을 가지며, II형(RelA, RelB, c-Rel)은 C-말단에 전사 활성화 기능을 가진다.
2. 1. 발견
NF-κB는 1986년 노벨상 수상자 데이비드 볼티모어의 연구실에서 란잔 센에 의해 B 세포의 면역글로불린 경쇄 인핸서 내 11쌍 염기 서열과의 상호작용을 통해 발견되었다.[14] 이후 알렉산더 폴토락과 브루노 르메트르의 쥐와 초파리 연구를 통해 톨 유사 수용체가 NF-κB 신호 전달의 보편적으로 보존된 활성제임이 밝혀졌다.[15][16][17] 이러한 연구들은 브루스 뷰틀러와 쥘 아 호프만에게 노벨상을 수여하는 데 기여했으며, 이들은 해당 연구의 주요 연구자들이었다.[15][16][17]2. 2. 구조
NF-κB 계열의 모든 단백질은 N-말단에 Rel 상동성 도메인 (RHD)을 공유한다. RelA, RelB, c-Rel을 포함하는 NF-κB 단백질의 하위 그룹은 C-말단에 전사 활성화 도메인을 가지고 있다. 반면, NF-κB1과 NF-κB2 단백질은 각각 성숙한 p50 및 p52 서브유닛을 생성하기 위해 처리되는 큰 전구체인 p105 및 p100으로 합성된다. p105 및 p100의 처리는 유비퀴틴/프로테아좀 경로에 의해 매개되며, 앵커린 반복을 포함하는 C-말단 영역의 선택적 분해를 포함한다. p100으로부터 p52의 생성은 엄격하게 조절되는 과정인 반면, p50은 p105의 구성적 처리를 통해 생성된다.[18][19] p50 및 p52 단백질은 전사를 활성화하는 고유한 능력이 없으며, 따라서 호모이량체로 κB 요소에 결합할 때 전사 억제제 역할을 하는 것으로 제안되었다.[20][21]포유류에서 NF-κB 패밀리(Rel 패밀리)에 속하는 분자는 5종류가 알려져 있다. 이들 분자가 호모 또는 헤테로 이량체를 형성한 것이 전사 인자로 기능한다. NF-κB 패밀리에 속하는 분자는 아미노기 측 말단에 약 300아미노산잔기로 구성된 Rel 상동성 도메인 (RHD)을 가지고 있으며, 이 구조가 DNA와의 결합이나 핵 내 이동, 이량체의 형성에 기여하고 있다.
NF-κB는 구조적으로 클래스 I과 클래스 II의 두 가지로 분류된다. 어느 쪽도 아미노기 쪽에 DNA 결합 도메인(DBD)을 가지고 있으며, 이량체의 형성이나 IκB(후술)와의 결합에 관여하고 있다.
| 클래스 | 구성원 | 설명 |
|---|---|---|
| 클래스 I | NF-κB1 (p105/p50), NF-κB2 (p100/p52) | 각각 전구체인 p105 및 p100으로 생성되며, 프로테아좀에 의한 제한적 분해를 거쳐 성숙체인 p50 및 p52가 된다. 둘 다 전사 활성화에 관여하는 도메인을 결손하고 있으며, p50과 p52가 이합체를 형성할 경우에는 활성화된 유전자의 전사를 억제하는 기능을 갖게 된다. 전사 활성화능을 나타내기 위해서는 클래스 II의 분자와 이종 이합체를 형성할 필요가 있다.[126] 카르복실기 측에는 단백질 상호 작용에 관여하는 앙키린 반복 서열이 존재하며, 전사 억제 작용에 관여한다. |
| 클래스 II | RelA(p65), RelB, c-Rel | 카르복실기 측에 전사 활성화 작용에 관여하는 도메인이 존재한다.[127] c-Rel도 클래스 II에 분류되는 분자이다. |
포유류의 NF-κB 패밀리에는 다음 다섯 가지 단백질이 있다:[22]
이들 분자는 인터루킨 (IL-1, IL-6, IL-8 등)이나 유도형 일산화 질소 합성 효소 (iNOS), 부착 분자 (ICAM, VCAM), 시클로옥시게나제 2 (COX-2) 등의 분자 발현 항진에 관여한다.[128]
3. NF-κB 단백질 구성원
종류 단백질 별칭 유전자 I NF-κB1 p105 → p50 NFKB1 NF-κB2 p100 → p52 NFKB2 II RelA p65 RELA RelB RELB c-Rel REL
NF-κB/Rel 단백질은 두 가지 종류로 나눌 수 있으며, 이들은 일반적인 구조적 특징을 공유한다.[1]
두 종류 모두 N-말단에 DNA 결합 도메인(DBD)을 가지며, 이량체 형성 및 IκBα와의 결합에 관여한다.
4. NF-κB의 활성화 경로
NF-κB는 세포 반응을 조절하는 데 매우 중요한 전사 인자이다. 평소 세포 내에 비활성 상태로 존재하다가, 특정 자극에 의해 빠르게 활성화되는 특징을 가지며, 세포에 유해한 자극에 대한 첫 번째 방어선 역할을 수행한다. NF-κB를 활성화시키는 요인으로는 활성 산소종(ROS), TNFα, 인터루킨 1-베타(IL-1β), 세균 리포다당류(LPS), 이소프로테레놀, 코카인, 엔도텔린-1, 이온화 방사선 등이 있다.[26]
종양 괴사 인자의 세포 독성(세포자멸사) 억제 기능은 항산화 효소 유도 및 c-Jun N-말단 키나아제(JNK)의 지속적인 억제를 통해 이루어진다.[27]
NF-κB의 수용체 활성화제(RANK)는 TNFR의 일종으로, NF-κB의 주요 활성제이다. 오스테오프로테게린(OPG)은 RANK 리간드(RANKL)의 미끼 수용체 동족체로, RANKL에 결합하여 RANK를 억제함으로써 NF-κB 활성 조절에 밀접하게 관여한다.[28]
다양한 세균 생성물과 세포 표면 수용체 자극은 NF-κB 활성화 및 유전자 발현의 빠른 변화를 유도한다.[3] 톨 유사 수용체(TLR)가 특정 패턴 인식 분자로 작용하며, TLR 자극이 NF-κB 활성화를 유도한다는 사실이 밝혀지면서, 다양한 병원체가 NF-κB를 활성화하는 기작에 대한 이해가 높아졌다. TLR4는 그람 음성 세균의 LPS 성분에 대한 수용체로 확인되었다.[29] TLR은 선천성 및 적응 면역 반응의 핵심 조절자이다.[30]
RelA, RelB, c-Rel과 달리 p50 및 p52 NF-κB 서브유닛은 C 말단에 전사 활성 도메인이 없다. 그러나 p50 및 p52는 NF-κB 기능 특이성 조절에 중요한 역할을 한다. p50 및 p52의 동종이량체는 κB 부위 전사를 억제하지만, RelA, RelB 또는 c-Rel과의 이종이량체 형성을 통해 표적 유전자 전사 활성화에 참여한다.[31] p50 및 p52 동종이량체는 핵 단백질 Bcl-3에 결합하여 전사 활성제 역할을 수행할 수도 있다.[32][33][34]
4. 1. 고전적 경로 (Canonical Pathway)
비자극 세포에서 NF-κB 이량체는 IκB(κB 억제제)라고 불리는 억제제 단백질에 의해 세포질 내에 격리된다.[35] IκB는 앵커린 반복 서열을 가지는 단백질로, 이 서열을 통해 NF-κB 단백질의 핵 국소화 신호(NLS)를 가려 세포질 내에 비활성 상태로 가둔다.[35]IκB는 N-말단 조절 도메인, 6개 이상의 앵커린 반복, C-말단 근처의 PEST 도메인을 갖는 단백질 군이다. IκB 계열에는 IκBα, IκBβ, IκBε, Bcl-3 등이 있지만, 가장 잘 연구되었고 주요한 IκB 단백질은 IκBα이다.[36]
NF-κB의 활성화는 신호에 의해 유도되는 IκB 단백질의 분해로부터 시작된다. 이는 주로 IκB 키나아제(IKK)라는 키나아제의 활성화를 통해 일어난다. IKK는 촉매 IKKα 및 IKKβ 소단위체의 이량체와 NEMO(NF-κB 필수 조절자) 또는 IKKγ로 불리는 조절 단백질로 구성된다. 세포 외부로부터 오는 신호에 의해 활성화되면, IκB 키나아제는 IκB 조절 도메인에 위치한 두 개의 세린 잔기를 인산화한다. 예를 들어, 인간 IκBα의 경우 세린 32 및 36번이 인산화되면, IκB 단백질은 유비퀴틴화라는 과정을 거쳐 프로테아좀에 의해 분해된다.[129]
IκB가 분해되면 NF-κB 복합체는 핵으로 들어가 NF-κB 결합 부위가 있는 특정 유전자의 발현을 촉진한다. NF-κB에 의한 이러한 유전자의 활성화는 염증, 면역 반응, 세포 생존 반응, 세포 증식 등 생리학적 반응으로 이어진다. NF-κB의 핵 내 전위는 면역세포화학적으로 검출할 수 있으며, 레이저 주사 세포 계측법으로 측정할 수 있다.[39]
NF-κB는 자체 억제제인 IκBα의 발현을 촉진한다. 새로 합성된 IκBα는 다시 NF-κB를 억제하여 자가 피드백 루프를 형성하고, 이는 NF-κB 활성의 진동 수준을 초래한다.[40]
다양한 세포 외부 자극이 IKK 복합체를 활성화시킬 수 있다. 예를 들어, TNFα, IL-1β, 세균 LPS 등이 IKK를 활성화시켜 IκBα의 분해를 유도한다.[26] IκBα로부터 분리된 NF-κB (주로 p50-RelA 이형체)는 핵으로 이동하여 DNA의 κB motif에 결합, 표적 유전자의 전사를 활성화한다.
몇몇 세균 생성물과 다양한 세포 표면의 수용체 자극은 NF-κB 활성 및 유전자 발현의 비교적 빠른 변화를 유도한다.[3] 톨 유사 수용체(TLR) 자극이 NF-κB의 활성화로 이어진다는 발견은 다양한 병원체가 NF-κB를 활성화하는 방법에 대한 이해를 높였다. 예를 들어, TLR4는 그람 음성 세균의 LPS 성분에 대한 수용체로 확인되었다.[29]
4. 2. 비고전적 경로 (Non-canonical Pathway)
NF-κB 유도 키나아제(NIK)는 특정 세포 분화 또는 발달 자극(예: 림포톡신 β 수용체(LTβR), B 세포 활성화 인자(BAFF), RANKL)에 의해 활성화된다.[46] NIK는 IKKα를 통해 NF-κB2 전구 단백질 p100을 인산화하고, p100은 부분적으로 분해되어 성숙한 p52 서브유닛을 생성한다.[46] 생성된 p52는 RelB와 이량체를 형성하여 핵으로 이동, DNA에 결합하여 특정 유전자의 전사를 활성화한다.[46]비고전적 경로는 림프 조직 형성과 림프구 이동을 조절하는 항상성 림포카인 발현에 중요한 역할을 한다.[46]
최근 연구에 따르면, 비정규 NF-κB 경로는 림프 조직 형성 외에도 정규 NF-κB 신호 전달을 조절하여 미생물 병원체에 대한 염증 면역 반응을 강화한다. p100/''Nfkb2''는 두 NF-κB 경로 간의 상호 작용을 매개하며, ''Nfkb2'' 매개 상호 작용은 쥐를 장내 병원체로부터 보호하는 것으로 밝혀졌다.[49][50]
4. 3. NF-κB 활성화 조절
비자극 세포에서 NF-κB 이량체는 IκB (κB 억제제)라고 불리는 억제제에 의해 세포질 내에 격리된다. IκB는 앵커린 반복을 포함하는 단백질로, 이 반복 서열을 통해 NF-κB 단백질의 핵 국소화 신호 (NLS)를 가리고 세포질 내에서 비활성 상태로 격리한다.[35]'''IκB'''는 N-말단 조절 도메인, 6개 이상의 앵커린 반복, C-말단 근처의 PEST 도메인을 갖는 단백질 군이다. IκB 계열은 IκBα, IκBβ, IκBε, Bcl-3로 구성되지만, 가장 잘 연구되었고 주요한 IκB 단백질은 IκBα이다. [36][37]
NF-κB의 활성화는 신호 유도 IκB 단백질의 분해로 시작된다. 이는 주로 IκB 키나아제 (IKK)라고 불리는 키나아제의 활성화를 통해 일어난다. IKK는 촉매 IKKα 및 IKKβ 소단위체의 이량체와 NEMO (NF-κB 필수 조절자) 또는 IKKγ로 불리는 "마스터" 조절 단백질로 구성된다. 일반적으로 세포 외부에서 오는 신호에 의해 활성화되면, IκB 키나아제는 IκB 조절 도메인에 위치한 두 개의 세린 잔기를 인산화한다. 이 세린(예: 인간 IκBα의 세린 32 및 36)이 인산화되면, IκB 단백질은 유비퀴틴화 과정을 거쳐, 프로테아좀에 의해 분해된다.
IκB가 분해되면 NF-κB 복합체는 핵으로 들어가 특정 유전자의 발현을 '켜는' 역할을 한다. NF-κB에 의한 이러한 유전자의 활성화는 염증, 면역 반응, 세포 생존 반응, 세포 증식 등 생리학적 반응으로 이어진다. NF-κB는 자체 억제제인 IκBα의 발현을 켜서 자가 피드백 루프를 형성하여 NF-κB 활성의 진동 수준을 초래한다.[40]
페스트균의 원인균인 ''Yersinia pestis''에서 분비되는 YopP는 IκB의 유비퀴틴화를 막아 NF-κB 경로를 억제하여 감염된 인간의 면역 반응을 차단한다.[42]
NF-κB 활성의 억제제 중 하나인 IFRD1은 p65 서브유닛의 리신 310에서 HDAC 매개 탈아세틸화를 강화하여 NF-κB p65의 활성을 억제한다.[43][44]
NAD+ 의존적 단백질 탈아세틸화 효소인 SIRT1은 NF-κB의 RelA/p65 서브유닛의 리신 310을 탈아세틸화하여 NF-κB 유전자 발현을 억제한다.[45]
5. NF-κB의 생물학적 기능
NF-κB는 포유류뿐만 아니라 자포동물(말미잘, 산호, 히드라 등), 해면동물, 곤충(나방, 모기, 초파리) 등 다양한 생물에서 발견된다.[23] 이집트숲모기, 감비아얼룩날개모기, 초파리의 유전자 서열 분석을 통해 NF-κB의 진화 연구가 이루어졌다. 곤충에서 NF-κB 활성화는 톨 경로 및 Imd (면역 결핍) 경로에 의해 유발된다.[24]
NF-κB는 "신속하게 작용하는" 주요 전사 인자로, 세포에 유해한 자극에 대한 첫 번째 반응자 역할을 한다. 활성 산소종(ROS), TNFα, IL-1β, 세균 LPS, 이소프로테레놀, 코카인, 엔도텔린-1, 이온화 방사선 등 다양한 요인이 NF-κB 활성을 유도한다.[26]
종양 괴사 인자의 세포 독성(세포자멸사) 억제는 항산화 효소 유도 및 c-Jun N-말단 키나아제(JNK) 억제 때문이다.[27] 오스테오프로테게린(OPG)은 RANKL의 미끼 수용체 동족체로, RANKL에 결합하여 RANK를 억제하여 NF-κB 활성을 조절한다.[28]
톨 유사 수용체(TLR) 자극은 NF-κB 활성화를 유도한다. TLR4는 그람 음성 세균의 LPS 성분 수용체로 확인되었다.[29] TLR은 선천성 및 적응 면역 반응의 핵심 조절자이다.[30]
p50 및 p52 NF-κB 서브유닛은 전사 활성 도메인이 없지만, NF-κB 기능 특이성을 조절한다. p50 및 p52 동종이량체는 κB 부위 전사를 억제하지만, RelA, RelB 또는 c-Rel과 이종이량체를 형성하여 표적 유전자 전사를 활성화한다.[31] p50 및 p52 동종이량체는 핵 단백질 Bcl-3에 결합하여 전사 활성제 역할을 할 수 있다.[32][33][34]
림포톡신 β 수용체(LTβR), B 세포 활성화 인자(BAFF) 또는 RANKL과 같은 특정 자극은 비정규 NF-κB 경로를 활성화하여 핵에서 NF-κB/RelB:p52 이량체를 유도한다. RelB:p52는 림프 조직 형성과 림프구 이동을 지시하는 항상성 림포카인 발현을 조절한다.[46] 비정규 NF-κB 경로는 림프 조직 형성 외에도 정규 NF-κB 신호 전달을 조절하여 염증 면역 반응을 강화한다. p100/''Nfkb2''는 두 NF-κB 경로 간의 상호 작용을 매개하며, ''Nfkb2'' 매개 상호 작용은 쥐를 장내 병원체로부터 보호한다.[49][50] 다발성 골수종에서 p100/''Nfkb2''의 돌연변이 비활성화는 TNF가 오래 지속되는 RelB 활성을 유도하여 골수종 세포에 화학 요법 약물 내성을 부여한다.[51]
5. 1. 면역 반응
NF-κB는 선천 면역과 적응 면역 반응 모두에 관여하는 유전자를 조절하는 주요 전사 인자이다.[52] T 세포 수용체 또는 B 세포 수용체가 활성화되면, NF-κB는 각기 다른 신호 전달 구성 요소를 통해 활성화된다. T 세포 수용체에 리간드가 결합하면 단백질 키나아제 Lck가 동원되어 CD3 세포질 꼬리의 ITAM을 인산화한다. 그 후 ZAP70이 인산화된 ITAM에 동원되어 LAT와 PLC-γ의 동원을 돕고, 이는 PKC의 활성화를 유발한다. 일련의 인산화 과정을 거쳐 키나아제 복합체가 활성화되고, NF-κB는 핵으로 들어가 T 세포 발달, 성숙 및 증식에 관여하는 유전자를 상향 조절할 수 있다.[53]5. 2. 신경계
NF-κB는 세포 생존을 매개하는 역할 외에도, 마크 맷슨 등의 연구에 따르면 신경계에서 가소성, 학습 및 기억과 같은 다양한 기능을 수행한다.[54] 신경계에서 NF-κB는 성장 인자(BDNF, NGF) 및 글루탐산과 같은 시냅스 전달에 의해 활성화될 수 있다.[9]최근 신경계에서 NF-κB의 역할에 대한 관심이 높아지고 있다. NF-κB는 게,[11][12] 초파리,[55] 그리고 쥐를 포함한 여러 유기체에서 학습과 기억에 중요하다.[9][10] NF-κB는 부분적으로 시냅스 가소성,[8][61] 시냅스 기능,[55][56][57] 수상돌기[58]와 수상돌기 가시[57]의 성장을 조절함으로써 학습과 기억을 조절할 수 있다.
NF-κB 결합 부위를 가진 유전자는 학습 후에 발현이 증가하는 것으로 나타났으며,[10] 이는 신경계에서 NF-κB의 전사 표적이 가소성에 중요하다는 것을 시사한다. 가소성과 학습에 중요할 수 있는 많은 NF-κB 표적 유전자에는 성장 인자(BDNF, NGF),[59] 사이토카인(TNF-alpha, TNFR),[60] 키나제(PKAc)가 포함된다.[61]
5. 3. 기타 기능
NF-κB는 세포 반응 조절에 핵심적인 역할을 수행하는 전사 인자이다. NF-κB는 세포 내에서 비활성 상태로 존재하다가 활성화되면 새로운 단백질 합성을 필요로 하지 않고 신속하게 작용하기 때문에, 세포에 유해한 자극에 대한 초기 반응자 역할을 수행할 수 있다.[26] NF-κB 활성을 유도하는 요인은 매우 다양하며, 활성 산소종(ROS), TNFα, IL-1β, 세균 LPS, 이소프로테레놀, 코카인, 엔도텔린-1, 이온화 방사선 등이 있다.[26]NF-κB의 종양 괴사 인자 세포 독성(세포자멸사) 억제는 항산화 효소 유도 및 c-Jun N-말단 키나아제 (JNK)의 지속적인 억제 때문이다.[27] 오스테오프로테게린(OPG)은 RANKL의 미끼 수용체 동족체로, RANKL에 결합하여 RANK를 억제하므로 NF-κB 활성 조절에 밀접하게 관여한다.[28]
톨 유사 수용체 (TLR) 자극이 NF-κB 활성화로 이어진다는 발견은 다양한 병원체가 NF-κB를 활성화하는 방식에 대한 이해를 높였다. 예를 들어, TLR4는 그람 음성 세균의 LPS 성분에 대한 수용체로 확인되었다.[29] TLR은 선천성 및 적응 면역 반응의 핵심 조절자이다.[30]
p50 및 p52 NF-κB 서브유닛은 C 말단에 전사 활성 도메인이 없지만, NF-κB 기능의 특이성을 조절하는 데 중요한 역할을 한다. p50 및 p52의 동종이량체는 κB 부위 전사를 억제하지만, p50과 p52는 RelA, RelB 또는 c-Rel과 이종이량체를 형성하여 표적 유전자 전사 활성화에 참여한다.[31] p50 및 p52 동종이량체는 핵 단백질 Bcl-3에 결합하며, 이 복합체는 전사 활성제 역할을 할 수 있다.[32][33][34]
림포톡신 β 수용체(LTβR), B 세포 활성화 인자(BAFF) 또는 RANKL과 같은 특정 세포 분화 또는 발달 자극은 비정규 NF-κB 경로를 활성화하여 핵에서 NF-κB/RelB:p52 이량체를 유도한다. RelB:p52는 림프 조직 형성 및 림프구 이동을 지시하는 항상성 림포카인의 발현을 조절한다.[46]
NF-κB는 선천 면역과 적응 면역 반응 모두에 관여하는 유전자를 조절하는 주요 전사 인자이다.[52] T 세포 수용체 또는 B 세포 수용체가 활성화되면, NF-κB는 각기 다른 신호 전달 구성 요소를 통해 활성화된다. T 세포 수용체에 리간드가 결합하면, 일련의 과정을 거쳐 NF-κB는 핵으로 들어가 T 세포 발달, 성숙 및 증식에 관여하는 유전자를 상향 조절할 수 있다.[53]
세포 생존 외에도, NF-κB는 신경계에서 가소성, 학습 및 기억과 같은 다양한 기능을 수행한다.[54] 신경계의 NF-κB는 성장 인자(BDNF, NGF) 및 글루탐산과 같은 시냅스 전달에 의해 활성화될 수 있다.[9]
최근 연구에 따르면 NF-κB는 게,[11][12] 초파리,[55] 쥐를 포함한 여러 유기체에서 학습과 기억에 중요하다.[9][10] NF-κB는 시냅스 가소성,[8][61] 시냅스 기능,[55][56][57] 수상돌기[58]와 수상돌기 가시[57]의 성장을 조절함으로써 학습과 기억을 조절할 수 있다.
NF-κB는 염증성 장 질환, 관절염, 패혈증, 위염, 천식, 죽상경화증[78] 등 많은 염증성 질환에서 만성적으로 활성화되어 있다.
6. NF-κB 관련 질환
NF-κB는 세포 반응을 조절하는 데 매우 중요한 역할을 하는 전사 인자이다. NF-κB는 평소 세포 내에 비활성 상태로 존재하다가, 세포에 유해한 자극이 가해지면 빠르게 활성화되어 다양한 유전자의 발현을 조절한다. NF-κB를 활성화시키는 요인으로는 활성 산소종(ROS), TNFα, IL-1β, 세균 LPS, 이소프로테레놀, 코카인, 엔도텔린-1, 이온화 방사선 등이 있다.[26]
종양 괴사 인자의 세포 독성(세포자멸사) 억제는 항산화 효소 유도 및 c-Jun N-말단 키나아제(JNK)의 지속적인 억제 때문이다.[27] NF-κB의 수용체 활성화제(RANK)는 TNFR의 일종으로, NF-κB의 주요 활성제이다. 오스테오프로테게린(OPG)은 RANK 리간드(RANKL)의 미끼 수용체 동족체로, RANKL에 결합하여 RANK를 억제하므로 NF-κB 활성 조절에 밀접하게 관여한다.[28]
톨 유사 수용체(TLR)는 세균 생성물과 다양한 세포 표면 수용체 자극을 인식하여 NF-κB 활성화 및 유전자 발현의 빠른 변화를 유도한다.[3] TLR은 선천성 및 적응 면역 반응의 핵심 조절자이며,[30] 예를 들어 TLR4는 그람 음성 세균의 LPS 성분에 대한 수용체로 확인되었다.[29]
RelA, RelB, c-Rel과 달리 p50 및 p52 NF-κB 서브유닛은 C 말단 절반에 전사 활성 도메인이 없다. 그러나 p50 및 p52는 NF-κB 기능의 특이성을 조절하는 데 중요한 역할을 한다. p50 및 p52의 동종이량체는 κB 부위 전사의 억제제이지만, RelA, RelB 또는 c-Rel과 이종이량체를 형성하여 표적 유전자 전사 활성화에 참여한다.[31] 또한 p50 및 p52 동종이량체는 핵 단백질 Bcl-3에 결합하며, 이 복합체는 전사 활성제 역할을 할 수 있다.[32][33][34]
NF-κB는 염증성 장 질환, 관절염, 패혈증, 위염, 천식, 죽상경화증[78] 등 많은 염증성 질환에서 만성적으로 활성화되어 있다. 오스테오프로테게린(OPG)과 같은 일부 NF-κB 활성화 인자의 증가는 심혈관 질환으로 인한 사망률 증가와 관련이 있으며,[79][80] NF-κB 증가는 조현병과도 관련이 있다.[81] 최근에는 NF-κB 활성화가 골격근의 담배 연기 이화 작용 효과와 근감소증의 가능한 분자 메커니즘으로 제시되었다.[82]
IKBKG 유전자 결함으로 인해 발생하는 희귀 유전 질환인 NEMO 결핍 증후군은 NF-κB 활성화에 이상을 초래한다.[90] NF-κB는 비만과 노화가 진행됨에 따라 발현이 증가하여[91] 항염증, 자가 자가포식, 항-인슐린 저항성 단백질인 시르투인 1의 수치를 감소시킨다. NF-κB는 마이크로RNA miR-34a의 수치를 증가시키고, 이는 니코틴아미드 아데닌 다이뉴클레오티드(NAD)의 프로모터 부위에 결합하여 NAD 합성을 억제하여[92] 시르투인 1의 수치를 낮춘다.
NF-κB와 인터루킨 1 알파는 세포 노화가 일어나는 세포에서 양성 피드백 루프를 통해 서로 유도하여 노화 관련 분비 표현형(SASP) 인자를 생성하게 한다.[93] NF-κB와 NAD 분해 효소인 CD38 또한 서로를 유도한다.[94] NF-κB는 손상에 대한 세포 반응의 핵심 요소이며,[95] 정상적이거나 가속화된 노화를 겪는 다양한 세포 유형에서 활성화된다.[15] NF-κB 활성을 유전자적 또는 약리학적으로 억제하면 여러 노화 관련 증상과 병리의 발병을 지연시킬 수 있다.[15]
NF-κB는 자극에 대한 중독의 발달과 유지를 용이하게 하는 ΔFosB의 유도 전사 표적 중 하나이다.[96][97][98] 꼬리핵에서 NF-κB 유도는 이동성 증가와 관련이 있는 반면, 측좌핵에서 NF-κB 유도는 보상 민감화를 통해 약물의 긍정적 강화 효과를 향상시킨다.[97]
| 표적 유전자 | 표적 유전자 발현 | 신경 효과 | 행동 효과 |
|---|---|---|---|
| c-Fos | ↓ | 만성적인 ΔFosB 유도를 가능하게 하는 분자 스위치 | – |
| 디노르핀 | ↓ | κ-오피오이드 수용체 피드백 루프의 하향 조절 | 약물 혐오 감소 |
| NF-κB | ↑ | 측좌핵 수지상 과정 확장 측좌핵 및 꼬리핵에서의 NF-κB 염증 반응 | 약물 보상 증가 정형 행동 |
| GluR2 | ↑ | 글루탐산염에 대한 민감성 감소 | 약물 보상 증가 |
| Cdk5 | ↑ | GluR1 시냅스 단백질 인산화 측좌핵 수지상 과정 확장 | 약물 보상 감소 (결과) |
6. 1. 암
NF-κB는 진핵 세포에서 세포 증식과 생존을 제어하는 유전자의 조절 인자로 널리 사용된다. 다양한 유형의 인간 종양에서 NF-κB가 비정상적으로 활성화(구성적 활성화)된다.[68] 활성 NF-κB는 세포가 증식하도록 유지하고, 세포자멸사를 통해 죽게 만들 조건으로부터 세포를 보호하는 유전자 발현을 활성화한다.[68] 암에서 NF-κB 신호를 제어하는 단백질은 돌연변이가 발생하거나 비정상적으로 발현되어 악성 세포와 나머지 유기체 간의 결함 있는 조정을 초래한다. 이는 전이뿐만 아니라 면역 체계에 의한 종양의 비효율적인 제거에서도 분명하게 나타난다.[68]정상 세포는 속한 조직에서 제거되거나, 유전체가 조직 기능과 조화를 이루어 작동할 수 없을 때 죽는다. 이러한 현상은 NF-κB의 피드백 조절에 의존하며, 암에서는 실패한다.[69]
NF-κB의 결함은 세포자멸사에 대한 감수성을 증가시켜 세포 사멸을 증가시킨다. 이는 NF-κB가 TRAF1, TRAF2와 같은 항세포자멸사 유전자를 조절하여 대부분의 세포자멸사 과정의 중심인 카스파제 효소군의 활성을 무효화하기 때문이다.[70]
종양 세포에서 NF-κB 활성은 증가하는데, 비인두암의 41%,[71] 대장암, 전립선암, 췌장암에서 그러하다. 이는 NF-κB 전사 인자 자체를 암호화하는 유전자의 돌연변이나 NF-κB 활성을 제어하는 유전자(IκB 유전자 등)의 돌연변이 때문이다. 일부 종양 세포는 NF-κB가 활성화되도록 하는 인자를 분비하기도 한다.[72][73] NF-κB를 차단하면 종양 세포가 증식을 멈추거나, 죽거나, 항종양제의 작용에 더 민감해질 수 있다.[74][75] 따라서 NF-κB는 항암 치료의 표적으로서 제약 회사에서 많은 연구가 진행되고 있다.[76]
그러나 NF-κB가 종양 발생의 중요한 촉진 인자임을 확인하여 NF-κB 활성 억제를 기반으로 하는 항종양 치료법 개발에 대한 근거를 제시했지만, NF-κB 활성이 세포자멸사 및 노화에 대한 종양 세포의 민감성을 향상시킨다는 데이터도 있으므로 암 치료에서 항NF-κB 활성을 광범위한 치료 전략으로 고려할 때는 주의해야 한다. 표준 NF-κB는 Fas 전사 활성제이고 대체 NF-κB는 Fas 전사 억제제인 것으로 나타났다.[77] 따라서 NF-κB는 암세포에서 Fas 매개 세포자멸사를 촉진하므로, NF-κB 억제는 Fas 매개 세포자멸사를 억제하여 숙주 면역 세포 매개 종양 억제를 손상시킬 수 있다.
NF-κB의 비정상적인 활성화는 많은 암에서 빈번하게 관찰되며, NF-κB 억제는 암세포 증식을 제한한다. NF-κB는 염증 반응의 핵심적인 요소이므로, NF-κB 신호 전달을 억제하는 방법은 암 및 염증성 질환에 대한 잠재적인 치료적 응용 가능성을 가지고 있다.[109][110]
정상 및 비정상 NF-κB 경로 모두 NF-κB 신호 전달이 발생하려면 조절 경로 구성 요소의 단백질 분해 효소 분해가 필요하다. 프로테아좀 억제제인 보르테조밉은 이러한 활동을 광범위하게 차단하며 NF-κB에 의해 유발되는 외투 세포 림프종과 다발성 골수종 치료제로 승인되었다.[111][112]
NF-κB 핵 전위 활성화가 산화 스트레스 증가와 분리될 수 있다는 발견[113]은 NF-κB 억제를 목표로 하는 전략 개발에 유망한 길을 제시한다.
약물 데노수맙은 RANKL을 억제하여 많은 환자 하위 그룹에서 골밀도를 높이고 골절률을 감소시킨다. RANKL은 수용체 RANK를 통해 작용하며, RANK는 다시 NF-κB를 촉진한다.[114] RANKL은 일반적으로 단핵구로부터 파골세포의 분화를 가능하게 함으로써 작용한다.
디설피람, 올메사탄, 디티오카바메이트는 NF-κB 신호 전달 연쇄 반응을 억제할 수 있다.[115] (-)-DHMEQ, PBS-1086, IT-603, IT-901과 같은 화합물을 사용한 직접적인 NF-κB 억제제 개발 노력이 나타났다.[116][117][118] (-)-DHMEQ와 PBS-1086은 NF-κB에 비가역적으로 결합하는 반면, IT-603과 IT-901은 가역적으로 결합한다. DHMEQ는 p65의 Cys 38에 공유 결합한다.[119]
아나타빈의 항염증 효과는 NF-κB 활성 조절의 결과라고 주장된다.[120] 그러나 그 효능을 주장하는 연구에서는 밀리몰 범위(세포 외 칼륨 농도와 유사)의 비정상적으로 높은 용량을 사용하는데, 이는 인간에게서 달성될 가능성이 낮다.
BAY 11-7082는 NF-κB 신호 전달 연쇄 반응을 억제할 수 있는 약물로 확인되었다. 이 약물은 IKK-α의 인산화를 비가역적으로 방지하여 NF-κB 활성을 감소시킬 수 있다.[121]
BAY 11-7082 투여가 NF-κB 조절 산화 스트레스를 억제하여 당뇨병 유발 스프래그-도일리 랫의 신장 기능을 회복시키는 것으로 나타났다.[122]
연구에 따르면 N-아실에탄올아민인 팔미토일에탄올아미드는 PPAR 매개 NF-κB 억제 기능을 한다.[123]
2015년 기준으로, 일본과 중국에서 류마티스 관절염 치료를 위해 판매되는 약물 이구라티모드의 생물학적 표적은 알려지지 않았지만, 주요 작용 기전은 NF-κB 활성 억제로 보였다.[124]
6. 2. 염증성 질환
NF-κB는 염증과 관련된 많은 유전자를 조절하기 때문에, 염증성 장 질환, 관절염, 패혈증, 위염, 천식, 죽상경화증[78] 등 여러 염증성 질환에서 만성적으로 활성화되어 있다. NF-κB는 심혈관 질환으로 인한 사망률 증가[79][80] 및 조현병과도 관련이 있다.[81] 최근 NF-κB 활성화는 골격근의 담배 연기 이화 작용 효과와 근감소증의 분자 메커니즘으로 제시되었다.[82]
세포 기능은 염증 동안 인접 세포와 접촉하여 활성화되는 신호, 특정 수용체를 통해 작용하는 사이토카인의 호르몬 조합에 따라 달라진다.[83] 조직 내 세포 표현형은 다른 세포와 기능을 조정하는 피드백 신호의 상호 자극을 통해 발달한다. 조직이 염증에 노출되면 세포는 표현형을 변경하고, 염증 원인이 제거된 후 조직을 재생하기 위해 유전자 조합을 점진적으로 발현한다. 이러한 세포 기능 재프로그래밍 과정은 특히 두드러진다.[83][84]
다양한 세포 유형과 면역계 간 피드백 반응의 충실도는 NF-κB에 의해 활성화되는 유전자 범위를 제한하는 메커니즘의 무결성에 달려 있다. 이를 통해 효과적인 면역 반응에 기여하고, 염증 해결 후 조직 기능을 완전히 회복하는 유전자만 발현되도록 한다.[84]
NF-κB의 비정상적인 활성화는 많은 암에서 빈번하게 관찰되며, NF-κB 억제는 암세포 증식을 제한한다. NF-κB는 염증 반응의 핵심 요소이므로, NF-κB 신호 전달 억제는 암 및 염증성 질환 치료에 잠재적으로 응용될 수 있다.[109][110]
프로테아좀 억제제인 보르테조밉은 NF-κB에 의해 유발되는 외투 세포 림프종과 다발성 골수종 치료제로 승인되었다.[111][112] 데노수맙은 RANKL을 억제하여 골밀도를 높이고 골절률을 감소시키며, RANKL은 수용체 RANK를 통해 NF-κB를 촉진한다.[114] 디설피람, 올메사탄, 디티오카바메이트는 NF-κB 신호 전달 연쇄 반응을 억제할 수 있다.[115]
이구라티모드는 NF-κB 활성 억제를 주요 작용 기전으로 하는 류마티스 관절염 치료제로, 2015년 기준 일본과 중국에서 판매되고 있으며,[124] 한국에서도 사용되고 있다.
6. 3. 기타 질환
IKBKG 유전자 결함으로 인해 발생하는 희귀 유전 질환인 NEMO 결핍 증후군은 NF-κB 활성화에 이상을 초래한다.[90] 이 질환은 주로 남성에게 영향을 미치며 매우 다양한 증상과 예후를 보인다.[90]NF-κB는 비만과 노화가 진행됨에 따라 발현이 증가하여[91] 항염증, 자가 자가포식, 항-인슐린 저항성 단백질인 시르투인 1의 수치를 감소시킨다. NF-κB는 마이크로RNA miR-34a의 수치를 증가시키고, 이는 니코틴아미드 아데닌 다이뉴클레오티드 (NAD)의 프로모터 부위에 결합하여 NAD 합성을 억제하여[92] 시르투인 1의 수치를 낮춘다.
NF-κB와 인터루킨 1 알파는 세포 노화가 일어나는 세포에서 양성 피드백 루프를 통해 서로 유도하여 노화 관련 분비 표현형 (SASP) 인자를 생성하게 한다.[93] NF-κB와 NAD 분해 효소인 CD38 또한 서로를 유도한다.[94]
NF-κB는 손상에 대한 세포 반응의 핵심 요소이며,[95] 정상적이거나 가속화된 노화를 겪는 다양한 세포 유형에서 활성화된다.[15] NF-κB 활성을 유전자적으로 또는 약리학적으로 억제하면 여러 노화 관련 증상과 병리의 발병을 지연시킬 수 있다.[15] 이러한 효과는 NF-κB의 감소가 미토콘드리아에서 유래된 활성 산소의 생성을 줄여 DNA 손상을 일으킬 수 있다는 발견으로 부분적으로 설명될 수 있다.[15]
NF-κB는 자극에 대한 중독의 발달과 유지를 용이하게 하는 ΔFosB의 유도 전사 표적 중 하나이다.[96][97][98] 꼬리핵에서 NF-κB 유도는 이동성 증가와 관련이 있는 반면, 측좌핵에서 NF-κB 유도는 보상 민감화를 통해 약물의 긍정적 강화 효과를 향상시킨다.[97]
| 표적 유전자 | 표적 유전자 발현 | 신경 효과 | 행동 효과 |
|---|---|---|---|
| c-Fos | ↓ | 만성적인 ΔFosB 유도를 가능하게 하는 분자 스위치 | – |
| 디노르핀 | ↓ | κ-오피오이드 수용체 피드백 루프의 하향 조절 | 약물 혐오 감소 |
| NF-κB | ↑ | 측좌핵 수지상 과정 확장 측좌핵에서의 NF-κB 염증 반응 꼬리핵에서의 NF-κB 염증 반응 | 약물 보상 증가 약물 보상 증가 정형 행동 |
| GluR2 | ↑ | 글루탐산염에 대한 민감성 감소 | 약물 보상 증가 |
| Cdk5 | ↑ | GluR1 시냅스 단백질 인산화 측좌핵 수지상 과정 확장 | 약물 보상 감소 (결과) |
NF-κB는 진핵생물 세포에 널리 분포하며 세포의 증식과 생존에 관여하며, 많은 종양 세포에서 NF-κB가 항상적인 활성화를 받고 있다. NF-κB를 억제함으로써 세포 증식을 억제하고 항암제에 대한 감수성이 증대된다. 이와 같은 이유로 NF-κB는 암의 화학 요법에서 표적으로 주목받고 있다.[130]
그 외에도 NF-κB는 기관지 천식, 염증성 장 질환, 관절염, 패혈증 등의 질환의 병태 형성에도 관여하고 있다.
7. NF-κB 억제제
NF-κB를 억제하는 것으로 알려진 항산화제를 포함한 많은 천연 물질들은 항암 및 항염증 활성을 가지고 있는 것으로 홍보되어 왔다. NF-κB를 차단하여 치료 목적으로 사용할 수 있는 물질의 발견과 사용에 적용되는 논란의 여지가 있는 미국 특허(US patent 6,410,516)[100]가 있다. 이 특허는 Ariad v. Lilly를 포함한 여러 소송과 관련이 있다. Karin,[101] Ben-Neriah[102] 등의 최근 연구를 통해 NF-κB, 염증 및 암 간의 연관성의 중요성이 부각되었고, NF-κB의 활성을 조절하는 치료법의 가치가 강조되었다.[103]
NF-κB의 비정상적인 활성화는 많은 암에서 빈번하게 관찰된다. 또한, NF-κB의 억제는 암세포의 증식을 제한한다. 게다가, NF-κB는 염증 반응의 핵심적인 요소이다. 따라서 NF-κB 신호 전달을 억제하는 방법은 암 및 염증성 질환에 대한 잠재적인 치료적 응용 가능성을 가지고 있다.[109][110]
NF-κB 핵 전위의 활성화가 산화 스트레스 증가와 분리될 수 있다는 발견[113]은 NF-κB 억제를 목표로 하는 전략 개발에 유망한 길을 제시한다.
아나타빈의 항염증 효과는 NF-κB 활성 조절의 결과라고 주장된다.[120] 그러나 그 효능을 주장하는 연구에서는 밀리몰 범위(세포 외 칼륨 농도와 유사)의 비정상적으로 높은 용량을 사용하는데, 이는 인간에게서 달성될 가능성이 낮다.
BAY 11-7082 투여가 NF-κB 조절 산화 스트레스를 억제하여 당뇨병 유발 스프래그-도일리 랫의 신장 기능을 회복시키는 것으로 나타났다.[122]
7. 1. 약물
보르테조밉은 프로테아좀 억제제로, 단백질 분해 효소 분해를 차단하여 외투 세포 림프종과 다발성 골수종 치료제로 승인되었다.[111][112]데노수맙은 RANKL을 억제하여 골밀도를 높이고 골절률을 감소시키는 약물이다. RANKL은 수용체 RANK를 통해 작용하며, RANK는 다시 NF-κB를 촉진한다.[114]
디설피람, 올메사탄, 디티오카바메이트는 NF-κB 신호 전달 연쇄 반응을 억제할 수 있다.[115] (-)-DHMEQ, PBS-1086, IT-603, IT-901과 같은 화합물을 사용한 직접적인 NF-κB 억제제 개발 노력이 있었다.[116][117][118] DHMEQ는 p65의 Cys 38에 공유 결합한다.[119]
BAY 11-7082는 IKK-α의 인산화를 비가역적으로 방지하여 NF-κB 활성을 감소시킨다.[121]
팔미토일에탄올아미드는 PPAR 매개 NF-κB 억제 기능을 한다.[123]
이구라티모드는 류마티스 관절염 치료제로, 주요 작용 기전은 NF-κB 활성 억제로 보인다.[124] 2015년 기준으로 한국, 일본, 중국에서 판매되고 있다.
7. 2. 천연 물질
여러 허브 및 식이 식물 추출물은 시험관 내에서 NF-κB 활성화의 효과적인 억제제이다.[104] 감귤 껍질에서 추출한 플라보노이드인 노빌레틴은 쥐에서 NF-κB 신호 전달 경로를 억제하는 것으로 나타났다.[105] 열대열원충의 환자포자 단백질은 NF-κB의 억제제인 것으로 밝혀졌다.[106] 마찬가지로, 아슈와간다(Withania somnifera)의 다양한 위사놀라이드는 IκBα의 프로테아좀 매개 유비퀴틴 분해를 억제하여 NF-κB에 억제 효과를 나타내는 것으로 밝혀졌다.[107][108]8. 결론
NF-κB는 진핵생물 세포에 널리 분포하며 세포의 증식과 생존에 관여한다. 많은 종양 세포에서 NF-κB가 항상성 활성화를 보이고 있다. NF-κB를 억제함으로써 세포 증식을 억제하고 항암제에 대한 감수성을 증대시킬 수 있다. 이와 같은 이유로 NF-κB는 암의 화학 요법에서 표적으로 주목받고 있다[130]。NF-κB는 기관지 천식, 염증성 장 질환, 관절염, 패혈증 등 질환의 병태 형성에도 관여하고 있다.
참조
[1]
논문
NF-κB Rel subunit exchange on a physiological timescale
2021-09
[2]
논문
NFKB1 and Cancer: Friend or Foe?
2018-09
[3]
논문
Introduction to NF-kappaB: players, pathways, perspectives
2006-10
[4]
논문
The NF-kappaB regulatory network
[5]
논문
Integrating cell-signalling pathways with NF-kappaB and IKK function
2007-01
[6]
논문
The Rel/NF-kappaB signal transduction pathway: introduction
1999-11
[7]
논문
Identification of a nuclear factor kappa B-dependent gene network
[8]
논문
Evidence for the involvement of TNF and NF-kappaB in hippocampal synaptic plasticity
2000-02
[9]
논문
NF-kappa B functions in synaptic signaling and behavior
https://resolver.cal[...]
2003-10
[10]
논문
A bioinformatics analysis of memory consolidation reveals involvement of the transcription factor c-rel
2004-04
[11]
논문
Kappa-B like DNA-binding activity is enhanced after spaced training that induces long-term memory in the crab Chasmagnathus
1998-02
[12]
논문
The IkappaB kinase inhibitor sulfasalazine impairs long-term memory in the crab Chasmagnathus
[13]
논문
Mercury induces the expression of cyclooxygenase-2 and inducible nitric oxide synthase
2013-03
[14]
논문
Multiple nuclear factors interact with the immunoglobulin enhancer sequences
1986-08
[15]
논문
Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene
1998-12
[16]
논문
The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults
1996-09
[17]
웹사이트
The Nobel Prize in Physiology or Medicine 2011
https://www.nobelpri[...]
2022-07-14
[18]
논문
Phosphorylation meets ubiquitination: the control of NF-[kappa]B activity
[19]
논문
Activation by IKKalpha of a second, evolutionary conserved, NF-kappa B signaling pathway
2001-08
[20]
논문
KBF1 (p50 NF-kappa B homodimer) acts as a repressor of H-2Kb gene expression in metastatic tumor cells
1993-06
[21]
논문
DNA binding of repressor nuclear factor-kappaB p50/p50 depends on phosphorylation of Ser337 by the protein kinase A catalytic subunit
2005-03
[22]
논문
Proposed NF-kappa B/I kappa B family nomenclature
1993-11
[23]
논문
NF-kappa B and Rel proteins: evolutionarily conserved mediators of immune responses
[24]
논문
Evolutionary dynamics of immune-related genes and pathways in disease-vector mosquitoes
2007-06
[25]
논문
NF-kappaB p52:RelB heterodimer recognizes two classes of kappaB sites with two distinct modes
2009-02
[26]
논문
Role of oxidants in NF-kappa B activation and TNF-alpha gene transcription induced by hypoxia and endotoxin
2000-07
[27]
논문
The NF-kappaB-mediated control of the JNK cascade in the antagonism of programmed cell death in health and disease
2006-05
[28]
논문
RANKL, RANK, osteoprotegerin: key partners of osteoimmunology and vascular diseases
2007-09
[29]
논문
Toll-like receptors: from the discovery of NFkappaB to new insights into transcriptional regulations in innate immunity
2006-10
[30]
논문
NF-kappaB and the immune response
2006-10
[31]
논문
NF-kappaB regulation in the immune system
2002-10
[32]
논문
The candidate proto-oncogene bcl-3 encodes a transcriptional coactivator that activates through NF-kappa B p50 homodimers
1993-07
[33]
논문
The candidate oncoprotein Bcl-3 is an antagonist of p50/NF-kappa B-mediated inhibition
https://zenodo.org/r[...]
1992-09
[34]
논문
The oncoprotein Bcl-3 directly transactivates through kappa B motifs via association with DNA-binding p50B homodimers
1993-03
[35]
논문
Structure of an IkappaBalpha/NF-kappaB complex
1998-12
[36]
논문
A fourth IkappaB protein within the NF-kappaB signaling module
2007-01
[37]
논문
Specific inhibition of RelB/p52 transcriptional activity by the C-terminal domain of p100
1995-03
[38]
논문
Coordination between NF-kappaB family members p50 and p52 is essential for mediating LTbetaR signals in the development and organization of secondary lymphoid tissues
2006-02
[39]
논문
Activation of nuclear factor kappa B (NF-kappaB) assayed by laser scanning cytometry (LSC)
1998-11
[40]
논문
Oscillations in NF-kappaB signaling control the dynamics of gene expression
2004-10
[41]
논문
Hostile takeovers: viral appropriation of the NF-kappaB pathway
2001-01
[42]
논문
Differential roles of Yersinia outer protein P-mediated inhibition of nuclear factor-kappa B in the induction of cell death in dendritic cells and macrophages
2008-02
[43]
논문
PC4 coactivates MyoD by relieving the histone deacetylase 4-mediated inhibition of myocyte enhancer factor 2C
2005-03
[44]
논문
PC4/Tis7/IFRD1 stimulates skeletal muscle regeneration and is involved in myoblast differentiation as a regulator of MyoD and NF-kappaB
2011-02
[45]
논문
Modulation of NF-kappaB-dependent transcription and cell survival by the SIRT1 deacetylase
2004-06
[46]
논문
Activation of IKKalpha target genes depends on recognition of specific kappaB binding sites by RelB:p52 dimers
2004-10
[47]
논문
Generation and activation of multiple dimeric transcription factors within the NF-kappaB signaling system
2008-05
[48]
논문
A TNF-p100 pathway subverts noncanonical NF-κB signaling in inflamed secondary lymphoid organs
2017-12
[49]
논문
Stimulus-selective crosstalk via the NF-κB signaling system reinforces innate immune response to alleviate gut infection
2015-04
[50]
논문
Late-phase synthesis of IκBα insulates the TLR4-activated canonical NF-κB pathway from noncanonical NF-κB signaling in macrophages
2016-12
[51]
논문
Non-canonical NFκB mutations reinforce pro-survival TNF response in multiple myeloma through an autoregulatory RelB:p50 NFκB pathway
2017-03
[52]
논문
Corticotropin Releasing Factor (CRF) activation of NF-kappaB-directed transcription in leukocytes
2006-07-01
[53]
논문
Tyrosine phosphorylation-dependent activation of NF-kappa B. Requirement for p56 LCK and ZAP-70 protein tyrosine kinases
2001-03
[54]
논문
Roles for NF-kappaB in nerve cell survival, plasticity, and disease
2006-05
[55]
논문
NF-kappaB, IkappaB, and IRAK control glutamate receptor density at the Drosophila NMJ
2007-09
[56]
논문
Nuclear factor kappaB controls acetylcholine receptor clustering at the neuromuscular junction
2010-08
[57]
논문
A requirement for nuclear factor-kappaB in developmental and plasticity-associated synaptogenesis
2011-04
[58]
논문
NF-kappaB signalling regulates the growth of neural processes in the developing PNS and CNS
2005-04
[59]
논문
Effects of glia maturation factor overexpression in primary astrocytes on MAP kinase activation, transcription factor activation, and neurotrophin secretion
2001-12
[60]
논문
Effects of NF-kappaB oligonucleotide "decoys" on gene expression in P7 rat hippocampus after hypoxia/ischemia
2004-07
[61]
논문
NF-kappaB regulates spatial memory formation and synaptic plasticity through protein kinase A/CREB signaling
2006-04
[62]
논문
Minimal NF-κB activity in neurons
2013-10
[63]
논문
Specific deficiency in nuclear factor-kappaB activation in neurons of the central nervous system
2001-09
[64]
논문
Cautionary notes on the use of NF-κB p65 and p50 antibodies for CNS studies
2011-10
[65]
논문
Characterization of a neuronal kappaB-binding factor distinct from NF-kappaB
1999-04
[66]
논문
Unique aspects of transcriptional regulation in neurons--nuances in NFkappaB and Sp1-related factors
2009-05
[67]
논문
Glutamate receptor activation evokes calpain-mediated degradation of Sp3 and Sp4, the prominent Sp-family transcription factors in neurons
2007-03
[68]
논문
Aberrant control of NF-κB in cancer permits transcriptional and phenotypic plasticity, to curtail dependence on host tissue: molecular mode
2017-08
[69]
논문
Dynamic aberrant NF-κB spurs tumorigenesis: a new model encompassing the microenvironment
2015-08
[70]
논문
Death receptor activation complexes: it takes two to activate TNF receptor 1
2003
[71]
논문
Exome and genome sequencing of nasopharynx cancer identifies NF-κB pathway activating mutations
2017-01
[72]
논문
Non-canonical NF-κB signaling pathway
2011-01
[73]
논문
Transient Sox9 Expression Facilitates Resistance to Androgen-Targeted Therapy in Prostate Cancer
2020-04
[74]
논문
NF-κB, inflammation, immunity and cancer: coming of age
2018-05
[75]
논문
Epigenetic regulation of SOX9 by the NF-κB signaling pathway in pancreatic cancer stem cells
2013-08
[76]
논문
The transcription factor nuclear factor-kappa B and cancer
2007-03
[77]
논문
NF-κB directly regulates Fas transcription to modulate Fas-mediated apoptosis and tumor suppression
2012-07
[78]
논문
Canonical pathway of nuclear factor kappa B activation selectively regulates proinflammatory and prothrombotic responses in human atherosclerosis
2004-04
[79]
논문
Osteoprotegerin as a predictor of coronary artery disease and cardiovascular mortality and morbidity
2010-05
[80]
논문
Biomarkers of the osteoprotegerin pathway: clinical correlates, subclinical disease, incident cardiovascular disease, and mortality
2010-09
[81]
논문
The interaction of nuclear factor-kappa B and cytokines is associated with schizophrenia
2009-03
[82]
서적
Neurobiology of Respiration
[83]
논문
Endogenous modulators of inflammatory cell recruitment
2013-01
[84]
논문
The role of "anti-inflammatory" cytokines in axon regeneration
2013-02
[85]
논문
Dangerous liaisons: STAT3 and NF-kappaB collaboration and crosstalk in cancer
2010-02
[86]
논문
Phagocytes as Corrupted Policemen in Cancer-Related Inflammation
[87]
논문
The Multifaceted Roles Neutrophils Play in the Tumor Microenvironment
2015-12
[88]
논문
Targeted destruction of the orchestration of the pancreatic stroma and tumor cells in pancreatic cancer cases: molecular basis for therapeutic implications
2012-12
[89]
논문
A perspective on the role of class III semaphorin signaling in central nervous system trauma
[90]
웹사이트
NEMO deficiency syndrome information
https://www.gosh.nhs[...]
[91]
논문
Antagonistic crosstalk between NF-κB and SIRT1 in the regulation of inflammation and metabolic disorders
2013-10
[92]
논문
Relevance of SIRT1-NF-κB Axis as Therapeutic Target to Ameliorate Inflammation in Liver Disease
2020-05
[93]
논문
Rapamycin inhibits the secretory phenotype of senescent cells by a Nrf2-independent mechanism
2017-06
[94]
논문
Macrophage Immunometabolism and Inflammaging: Roles of Mitochondrial Dysfunction, Cellular Senescence, CD38, and NAD
2020-06
[95]
논문
NF-κB inhibition delays DNA damage-induced senescence and aging in mice
2012-07
[96]
논문
Transcriptional and epigenetic mechanisms of addiction
2011-10
[97]
논문
Molecular neurobiology of addiction: what's all the (Δ)FosB about?
2014-11
[98]
논문
Cellular basis of memory for addiction
2013-12
[99]
논문
Review. Transcriptional mechanisms of addiction: role of DeltaFosB
2008-10
[100]
특허
Nuclear factors associated with transcriptional regulation
[101]
논문
The IkappaB kinase – a bridge between inflammation and cancer
2008-03
[102]
논문
NF-kappaB inhibition: a double-edged sword in cancer?
2006-04
[103]
서적
Targeted Therapies in Cancer
[104]
논문
Extract of oregano, coffee, thyme, clove, and walnuts inhibits NF-kappaB in monocytes and in transgenic reporter mice
2010-05
[105]
논문
Nobiletin Inhibits IL-1β-Induced Inflammation in Chondrocytes ''via'' Suppression of NF-κB Signaling and Attenuates Osteoarthritis in Mice
[106]
논문
The Plasmodium circumsporozoite protein, a novel NF-κB inhibitor, suppresses the growth of SW480
2012-10
[107]
서적
Anti-inflammatory Nutraceuticals and Chronic Diseases
Springer International Publishing
2016
[108]
논문
Pharmacological Effects of Withanolides
https://biomedres.us[...]
2020-02-11
[109]
논문
Nuclear transcription factor-kappaB as a target for cancer drug development
2002-06
[110]
논문
Nuclear factor-kappaB activation: from bench to bedside
2008-01
[111]
논문
Bortezomib: a review of its use in patients with multiple myeloma
2009
[112]
논문
Velcade (Bortezomib) Receives 2 New FDA Indications: For Retreatment of Patients with Multiple Myeloma and for First-Line Treatment of Patients with Mantle-Cell Lymphoma
2015-03
[113]
논문
Nuclear factor-kappaB-dependent induction of interleukin-8 gene expression by tumor necrosis factor alpha: evidence for an antioxidant sensitive activating pathway distinct from nuclear translocation
1999-09
[114]
논문
Denosumab: RANKL inhibition in the management of bone loss
2008-01
[115]
논문
Targeting of nuclear factor-kappaB and proteasome by dithiocarbamate complexes with metals
[116]
논문
NF-κB-activating complex engaged in response to EGFR oncogene inhibition drives tumor cell survival and residual disease in lung cancer
2015-04
[117]
논문
Dual inhibition of canonical and noncanonical NF-κB pathways demonstrates significant antitumor activities in multiple myeloma
2012-09
[118]
논문
Characterization of a c-Rel Inhibitor That Mediates Anticancer Properties in Hematologic Malignancies by Blocking NF-κB-Controlled Oxidative Stress Responses
2016-01
[119]
논문
Inactivation of NF-kappaB components by covalent binding of (-)-dehydroxymethylepoxyquinomicin to specific cysteine residues
2008-09
[120]
웹사이트
Role of RCP006 as an anti-inflammatory agent
http://www.rfdn.org/[...]
Roskamp Institute
2011-09-06
[121]
논문
BAY 11-7082 ameliorates diabetic nephropathy by attenuating hyperglycemia-mediated oxidative stress and renal inflammation via NF-κB pathway
2015-03
[122]
논문
Suppression of NF-κB and NF-κB regulated oxidative stress and neuroinflammation by BAY 11-7082 (IκB phosphorylation inhibitor) in experimental diabetic neuropathy
2012-05
[123]
논문
Crosstalk between Peroxisome Proliferator-Activated Receptors and Toll-Like Receptors: A Systematic Review
2019-02
[124]
논문
Iguratimod for the treatment of rheumatoid arthritis in Japan
2015-05
[125]
간행물
'The Rel/NF-kappaB signal transduction pathway: introduction.'
1999
[126]
간행물
"NF-κB regulation in the immune system."
2002
[127]
간행물
"Introduction to NF-kappaB: players, pathways, perspectives."
2006
[128]
간행물
"Nuclear factor-kappaB modulation as a therapeutic approach in hematologic malignancies."
2004
[129]
간행물
"DNA binding and IκB inhibition of the cloned p65 subunit of NF-κB, a rel-related polypeptide."
1991
[130]
간행물
"The transcription factor nuclear factor-kappa B and cancer."
2007
[131]
논문
Introduction to NF-κB: players, pathways, perspectives
2006-10
[132]
논문
The NF-κB regulatory network
[133]
논문
Integrating cell-signalling pathways with NF-κB and IKK function
2007-01
[134]
논문
The Rel/NF-κB signal transduction pathway: introduction
1999-11
[135]
논문
Identification of a nuclear factor κB-dependent gene network
[136]
논문
Evidence for the involvement of TNF and NF-κB in hippocampal synaptic plasticity
2000-02
[137]
논문
NF-κB functions in synaptic signaling and behavior
https://authors.libr[...]
2003-10
[138]
논문
A bioinformatics analysis of memory consolidation reveals involvement of the transcription factor c-rel
2004-04
[139]
논문
κ-B like DNA-binding activity is enhanced after spaced training that induces long-term memory in the crab ''Chasmagnathus''
1998-02
[140]
논문
The IκB kinase inhibitor sulfasalazine impairs long-term memory in the crab ''Chasmagnathus''
[141]
저널
Mercury induces the expression of cyclooxygenase-2 and inducible nitric oxide synthase
2013-03
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com