산화 납(II,IV)
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
산화 납(II,IV)는 [Pb2+]2[PbO44-]의 화학식을 가지는 화합물로, 사방정계 결정 구조를 갖는다. 산화 납(II)을 공기 중에서 소성하거나, 탄산 납(II)을 어닐링하는 등의 방법으로 제조할 수 있으며, 자연에서는 드물게 미늄이라는 광물로 존재한다. 물과 에탄올에는 거의 녹지 않지만, 위산에는 녹아 독성을 나타내며, 500°C 이상으로 가열하면 산화 납(II)와 산소로 분해된다. 과거에는 안료, 화약, 고무 경화제 등으로 사용되었으며, 고대 로마 시대부터 붉은색 안료로 사용되어 왔다. 흡입하거나 섭취 시 납 중독을 일으킬 수 있으며, 장기간 노출 시 만성 중독 증상이 나타날 수 있어 취급에 주의가 필요하다.
더 읽어볼만한 페이지
- 납 광물 - 방연석
방연석은 황화납을 주성분으로 하는 납의 주요 광석으로, 납 축전지, 리드 시트, 산탄 제조 등에 사용되며, 은을 함유한 경우 은의 광석으로도 활용되고, 과거에는 눈 화장품 재료나 수정 라디오의 검파 다이오드로도 사용되었다. - 납 광물 - 홍연석
밝은 적색을 띠는 반투명 광물인 홍연석은 1766년 러시아 우랄산맥에서 처음 발견되었고, 납 광석층의 산화대에서 주로 발견되며 독성을 지닌 광물이다. - 혼합 원자가 화합물 - 이트륨 바륨 구리 산화물
이트륨 바륨 구리 산화물(YBCO)은 93K의 비교적 높은 임계 온도에서 초전도성을 나타내는 최초의 고온 초전도체 중 하나로, 액체 질소 끓는점 이상에서 초전도성을 보여 초전도 연구 및 응용에 중요한 물질이다. - 혼합 원자가 화합물 - 산화 은(II)
사산화 은(II)는 독특한 구조를 가진 은 화합물로, 두 종류의 은 원자가 서로 다른 배위 환경을 가지며 과거 헤르페스 치료제로 판매되었으나 FDA의 경고를 받았다.
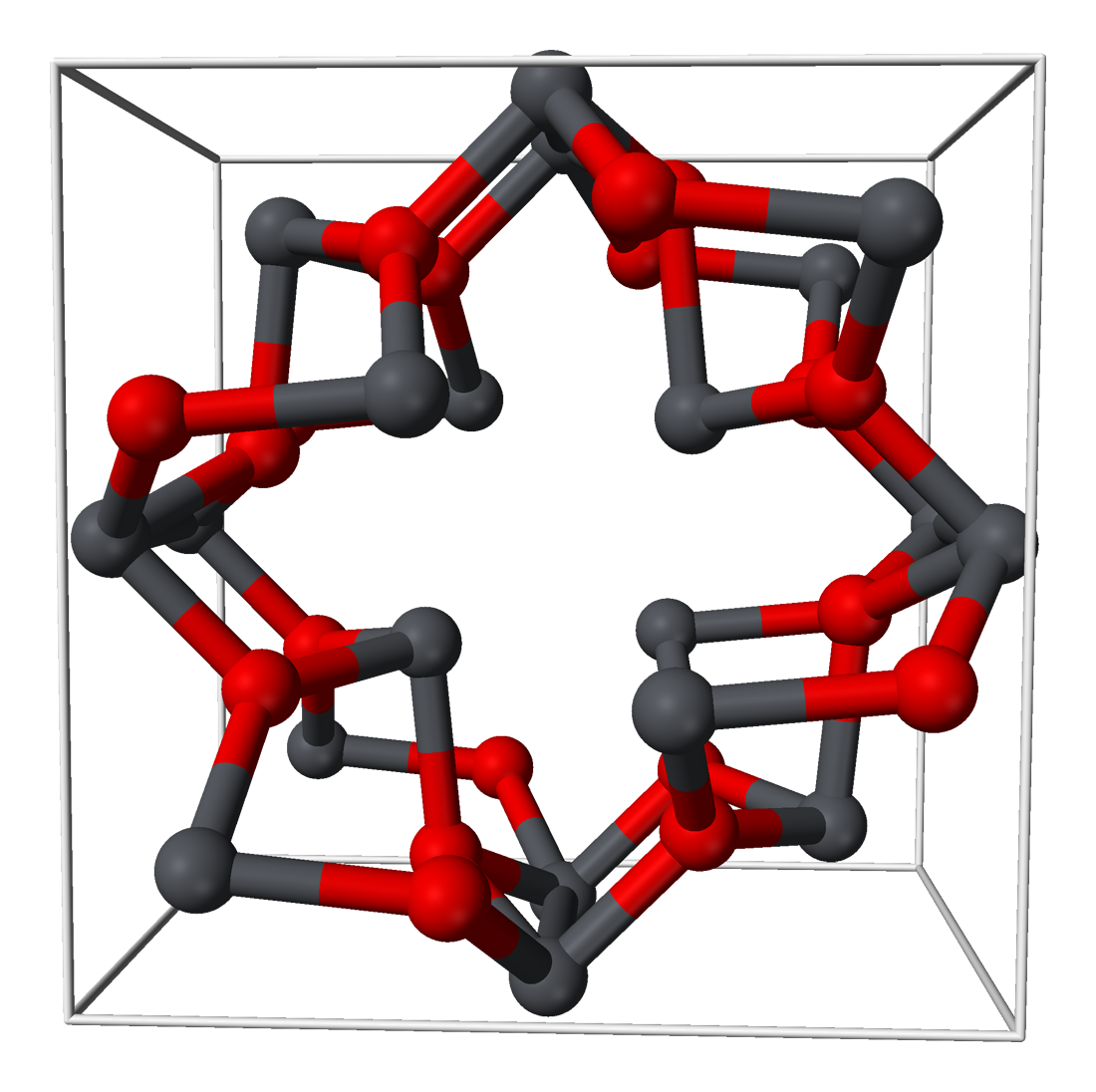
2. 구조
산화 납(II,IV)는 납(II) 오르토플럼베이트(IV) [Pb(2+)]2[PbO4(4−)]이다.[3] 이 물질은 실온에서 사방정계 결정 구조를 가지며, 170,000에서 사방정계 형태로 상전이가 일어난다. 이러한 상 전이는 결정의 대칭성만 변경하며, 원자 간 거리와 각도를 약간 수정한다.[4]
산화 납(II)(PbO, 리사지라고도 함)를 공기 중에서 450~480°C로 소성하여 제조한다.[5]
사산화 삼납은 500°C 이상으로 가열하면 산화 납(II)와 산소로 분해된다.[10] 580°C에서 반응이 완료된다.[10]
철 제품의 프라이머 페인트에 안료로 사용되었으나, 독성 때문에 사용이 제한되고 있다. 일부 아마추어 화약에서 지연 장약으로 제한적으로 사용되며, 과거에는 드래곤 에그 화약 별 제조에 사용되었다.[10]
산화 납(II,IV)의 라틴어 이름인 ''미니움''(minium)은 이베리아반도 북서부에 있는 미뉴강에서 유래되었다.
산화 납(II,IV)을 흡입하면 폐를 자극한다. 고용량의 경우, 금속 맛, 흉통 및 복통을 경험할 수 있다. 섭취하면 위산에 용해되어 흡수되어 납 중독을 일으킨다. 고농도는 피부를 통해서도 흡수될 수 있으며, 납 기반 페인트를 취급할 때는 안전 예방 조치를 따르는 것이 중요하다.[10]
[1]
웹사이트
VOLUNTARY RISK ASSESSMENT REPORT ON LEAD AND SOME INORGANIC LEAD COMPOUNDS
http://echa.europa.e[...]
2012-12-25
(Key: Pb O)
3. 제조 방법
생성된 물질은 PbO로 오염된다. 순수한 화합물을 원할 경우 수산화 칼륨 용액으로 PbO를 제거할 수 있다.
탄산 납(II)(백연광)을 공기 중에서 어닐링하여 제조할 수도 있다.
백납의 산화 어닐링으로도 제조 가능하다.
용액에서 산화 납(II,IV)는 납산 칼륨과 아세트산 납(II)의 반응으로 제조할 수 있으며, 황색의 불용성 산화 납(II,IV) 일수화물을 생성하는데, 이를 약한 가열로 무수 형태로 바꿀 수 있다.
금속 납(Pb)을 600℃로 가열하여 공기 중의 산소(O2)와 반응시켜 일산화 납(PbO)으로 만들고, 생성된 일산화 납을 400℃에서 500℃로 가열하여 제조하기도 한다.
4. 반응
질산은 산화 납(II) 성분을 용해시켜 불용성 이산화 납을 남긴다.[10]
산화철 및 원소 철과 함께, 산화 납(II,IV)는 불용성 철(II) 및 철(III) 납산염을 형성하며, 이는 철제 물체에 칠해진 납 기반 페인트의 방청 특성의 기초이다.[10]
5. 용도
산화 마그네슘 대신 폴리클로로프렌 고무 화합물의 경화제로 사용하여 더 나은 내수성을 제공한다.
스크레이핑에 사용되었지만, 이후 엔지니어 블루로 대체되었다. 사산화 삼납은 압력 하에서 엔지니어 블루만큼 쉽게 흐르지 않기 때문에 여전히 더 정확한 마킹을 제공한다.
강황 가루의 변조제로도 사용된다.
6. 역사
고대 로마에서는 붉은 안료로 사용되었으며, 연백을 소성하여 제조하였다. 고대 및 중세 시대에는 채색 필사본 제작에 안료로 사용되었으며, 이 색상으로 그려진 그림 양식인 ''미니움'' 또는 미니어처에 이름을 부여했다.
아마인유로 만든 페인트에 사용된 연단은 외부 철물을 보호하기 위한 내구성이 강한 페인트였다. 1504년 스코틀랜드 스털링 성의 격자형 성문과 몬스 메그를 포함한 대포가 연단으로 칠해졌다.[7]
미세한 분말 형태의 연단은 리히텐베르크 도형을 연구하기 위해 유전체 표면에 뿌려지기도 했다.
전통 중국 의학에서 연단은 백선과 궤양 치료에 사용되었지만, 독성 때문에 사용이 제한되었다. 멕시코 민간 요법인 ''azarcón''은 최대 95%의 산화 납(II,IV)을 포함하고 있어 위장 장애 치료에 사용되기도 한다.[8]
18세기 이전에는 약으로도 사용되었다.[9] 고대 로마에서는 붉은 안료로 사용되었으며, 폼페이 유적에서 다량 사용된 것이 확인되어 폼페이 레드라고도 불린다. 일본 헤이안 시대 건축물의 주홍색 기둥은 연단이 주원료인 페인트로 칠해져 있다.
선박에서 사용되는 붉은색 선저 페인트의 주성분은 연단이며, 산소를 차단하여 부식을 방지하고 항력을 유발하는 부착 생물의 부착을 막는다.
일본 철도 차량, 특히 전동차의 지붕 페인트로 많이 사용되었다. 짙은 녹색이나 마룬 단색 차체에 연단색 지붕을 칠하는 방식은 전쟁 전 시기 사철에서 널리 사용되었다.
7. 안전성 및 규제
장기간 산화 납(II,IV)에 접촉하면 체내에 납 화합물이 축적되어 급성 납 중독 증상이 나타날 수 있다. 만성 중독은 흥분, 과민성, 시각 장애, 고혈압, 회색빛 안색으로 나타난다.
산화 납(II,IV)은 실험 동물에게 발암성이 있는 것으로 나타났으나, 인간에 대한 발암성은 증명되지 않았다.
일본 공업 규격에서는 사산화 삼납 함량에 따라 다음과 같이 등급을 규정하고 있다.
참조
[2]
서적
Chemistry of the Elements
Butterworth-Heinemann
[3]
서적
Inorganic chemistry
Academic Press
[4]
논문
Oxydes de plomb. IV. Évolution structurale de l'oxyde Pb3O4 entre 240 et 5 K et mécanisme de la transition
[5]
간행물
Lead Compounds
[6]
웹사이트
Minium
http://www.galleries[...]
[7]
문서
Accounts of the Treasurer of Scotland
Edinburgh
[8]
논문
Azarcón por empacho – another cause of lead toxicity
1983
[9]
웹사이트
The London Lancet: A Journal of British and Foreign Medicine, Physiology, Surgery, Chemistry, Criticism, Literature and News
https://books.google[...]
[10]
웹사이트
The Color of Art Pigment Database : Pigment Red,PR
http://www.artiscrea[...]
[11]
웹인용
VOLUNTARY RISK ASSESSMENT REPORT ON LEAD AND SOME INORGANIC LEAD COMPOUNDS
http://echa.europa.e[...]
2012-12-25
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

