일산화 이염소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
일산화 이염소(Cl₂O)는 황색의 자극적인 냄새를 가진 기체로, 차아염소산의 산 무수물에 해당한다. 일산화 이염소는 여러 가지 방법으로 제조되며, 특히 염소 기체를 수화된 탄산 나트륨과 반응시키는 방법이 안전하고 편리하다. 이 화합물은 반응성이 커서 빛이나 열에 의해 분해되며, 유기 화합물과 접촉 시 폭발할 수 있어 주의가 필요하다. 일산화 이염소는 금속 할로겐화물 및 유기 화합물과 반응하며, 광해리를 통해 산소와 염소로 분해된다.
더 읽어볼만한 페이지
- 염소(I) 화합물 - 과산화 염소
과산화 염소는 염소 분자의 광분해로 생성되는 염소 산화물로, 특정 파장 범위에서 빛을 흡수하며 독특한 분자 구조를 갖고, 불안정하여 분해될 때 이산화 염소와 산소를 생성할 수 있다. - 염소 산화물 - 염소산염
염소산염은 화학식 ClO3−를 갖는 염소의 옥시음이온으로, 금속 염소산염은 특정 방식으로 제조되거나 산업적으로 합성되며, 자연적으로 건조 지역이나 화성에서도 발견되고 독성과 산화성으로 인해 규제를 받는다. - 염소 산화물 - 아염소산염
아염소산염은 아염소산의 염으로 불안정하지만, 알칼리 금속 및 알칼리 토금속 아염소산염 형태로 존재하며, 특히 아염소산 나트륨은 표백 및 이산화 염소 생성에 널리 쓰이나 고농도 노출 시 건강에 유해할 수 있다. - 산성 산화물 - 이산화 셀레늄
이산화 셀레늄(SeO₂)은 흡습성 백색 결정으로, 유기 합성에서 산화제 또는 촉매, 유리 제조에서 착색제로 사용되는 강한 독성의 산성 산화물이다. - 산성 산화물 - 이산화 탄소
이산화탄소(CO₂)는 탄소 원자 하나와 산소 원자 두 개로 이루어진 무색·무취의 기체로, 드라이아이스로 승화하며, 탄산 형성, 연소, 호흡, 광합성 등 다양한 과정에서 발생하고, 산업적으로 널리 사용되지만 지구 온난화의 주요 원인이자 고농도에서 인체에 유독한 물질이다.
2. 제법
일산화 이염소를 제작하는 방법에는 크게 두 가지가 있다.[3]
- 하이포아염소산 수용액에 산화 수은(II)을 첨가한 후 30°C에서 공기를 통과시킨다. 이후 통과시킨 공기를 -80°C로 냉각시키면 일산화 이염소를 얻을 수 있다.
- 건조시켜 모래와 혼합한 산화 수은(II)에 9~10°C에서 염소를 반응시킨다. 반응식은 다음과 같다.
::2 HgO + 2 Cl2 → HgO·HgCl2 + '''Cl2O'''
가장 초기의 합성 방법은 산화 수은(II)를 염소 기체로 처리하는 것이었다.[3] 그러나 이 방법은 비용이 많이 들 뿐만 아니라 수은 중독의 위험 때문에 매우 위험하다.
:2 Cl2 + HgO → HgCl2 + Cl2O
더 안전하고 편리한 생산 방법은 20–30 °C에서 염소 기체를 수화된 탄산 나트륨과 반응시키는 것이다.[3]
:2 Cl2 + 2 Na2CO3 + H2O → Cl2O + 2 NaHCO3 + 2 NaCl
:2 Cl2 + 2 NaHCO3 → Cl2O + 2 CO2 + 2 NaCl + H2O
이 반응은 물이 없는 상태에서도 수행할 수 있지만 150–250 °C로 가열해야 한다. 이 온도에서 이염소산 일산화물은 불안정하므로[4] 열분해를 방지하기 위해 지속적으로 제거해야 한다.
:2 Cl2 + Na2CO3 → Cl2O + CO2 + 2 NaCl
3. 성질
상온에서는 황색의 자극적인 냄새를 가진 기체의 형태로 존재한다. 녹는점은 -120.6°C, 끓는점은 22.0°C이다. 공기에 대한 비중은 22.0°C에서 3.02이다. 용해열은 36.6kJ/mole, 증발열은 26kJ/mole이다. 물에 녹는다. 염소 원자와 산소 원자의 결합 길이는 1.701±0.020Å, 결합각은 110.8±1°, 염소 원자 간의 거리는 2.791±0.020Å이다.
일산화 이염소는 반응성이 커서 빛 또는 열이 가해지면 분해되어 염소와 산소를 내놓는다. 수소와의 혼합물은 불꽃에 의해 폭발할 수 있고, 황, 셀레늄, 인, 비소, 안티모니, 탄소 등과는 접촉할 경우 폭발하며 각각의 산화물, 옥시염화물을 내놓는다. 금속과도 반응하여 염화물, 산화물, 옥시염화물을 생성한다. 암모니아, 수소화 비소, 황화 비소, 일산화 이질소 및 각종 황화물 등과도 폭발적인 반응을 일으킨다.
3. 1. 물리적 성질
일산화 이염소는 상온에서 황색의 자극적인 냄새를 가진 기체 형태로 존재한다. 녹는점은 -120.6°C, 끓는점은 22.0°C이다. 공기에 대한 비중은 22.0°C에서 3.02이다. 용해열은 36.6kJ/mole, 증발열은 26kJ/mole이다. 물에 녹는다. 염소 원자와 산소 원자의 결합 길이는 1.701±0.020Å, 결합각은 110.8±1°, 염소 원자 간의 거리는 2.791±0.020Å이다.3. 2. 분자 구조
일산화 이염소는 상온에서 황색의 자극적인 냄새를 가진 기체 형태로 존재한다. 녹는점은 -120.6°C, 끓는점은 22.0°C이다. 공기에 대한 비중은 22.0°C에서 3.02이며, 용해열은 36.6kJ/mole, 증발열은 26kJ/mole이다. 물에 녹는다. 염소 원자와 산소 원자의 결합 길이는 1.701±0.020Å, 결합각은 110.8±1°, 염소 원자 간의 거리는 2.791±0.020Å이다.일산화 이염소는 반응성이 커서 빛이나 열이 가해지면 분해되어 염소와 산소를 내놓는다. 수소와의 혼합물은 불꽃에 의해 폭발할 수 있고, 황, 셀레늄, 인, 비소, 안티모니, 탄소 등과는 접촉할 경우 폭발하며 각각의 산화물, 옥시염화물을 내놓는다. 금속과도 반응하여 염화물, 산화물, 옥시염화물을 생성한다. 암모니아, 수소화 비소, 황화 비소, 일산화 이질소 및 각종 황화물 등과도 폭발적인 반응을 일으킨다.
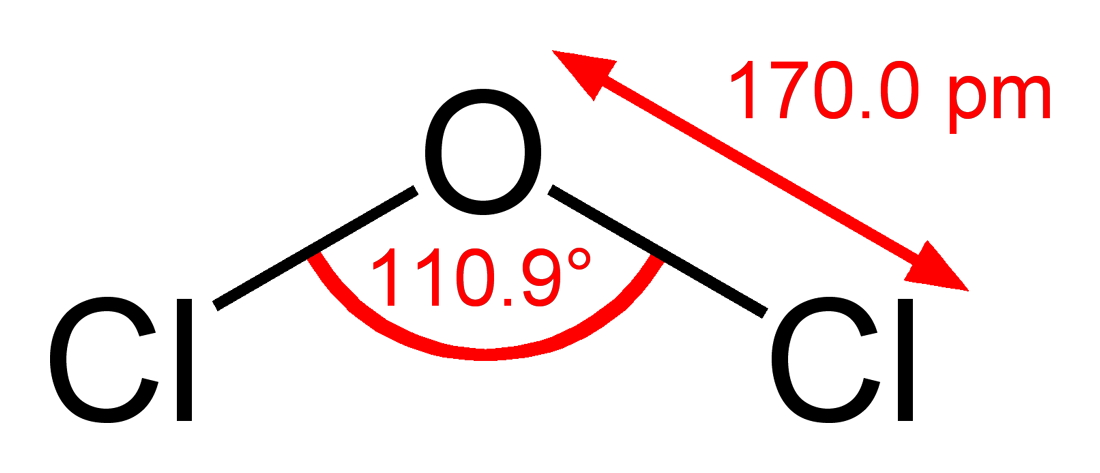
일산화 이염소의 구조는 물 및 차아염소산과 유사하며, 분자는 굽은 분자 구조를 취하고(산소 원자의 고립 전자쌍 때문) C2V 분자 대칭을 나타낸다. 결합각은 일반적인 것보다 약간 더 큰데, 이는 부피가 큰 염소 원자 간의 입체 반발 때문일 가능성이 높다.
고체 상태에서 일산화 이염소는 사면체 공간군 I41/amd로 결정화되어 고압 형태의 물인 얼음 VIII과 동일 구조를 갖는다.
3. 3. 화학적 성질
일산화 이염소는 상온에서 황색의 자극적인 냄새를 가진 기체 형태로 존재한다. 녹는점은 -120.6°C, 끓는점은 22.0°C이다. 공기에 대한 비중은 22.0°C에서 3.02이다. 용해열은 36.6kJ/mole, 증발열은 26kJ/mole이다. 물에 녹는다. 염소 원자와 산소 원자의 결합 길이는 1.701±0.020Å, 결합각은 110.8±1°, 염소 원자 간의 거리는 2.791±0.020Å이다.일산화 이염소는 반응성이 커서 빛 또는 열이 가해지면 분해되어 염소와 산소를 내놓는다. 수소와의 혼합물은 불꽃에 의해 폭발할 수 있고, 황, 셀레늄, 인, 비소, 안티모니, 탄소 등과는 접촉할 경우 폭발하며 각각의 산화물, 옥시염화물을 내놓는다. 금속과도 반응하여 염화물, 산화물, 옥시염화물을 생성한다. 암모니아, 수소화 비소, 황화 비소, 일산화 이질소 및 각종 황화물 등과도 폭발적인 반응을 일으킨다.
4. 반응
이산화 이염소는 물에 매우 잘 녹으며,[6] 여기서 HOCl과 평형을 이룬다. 가수분해 속도가 느려 CCl4와 같은 유기 용매로 Cl2O를 추출할 수 있지만,[3] 평형 상수는 결국 차아염소산의 형성을 선호한다.[7]
:2 HOCl ⇌ Cl2O + H2O K (0 °C) = 3.55x10−3 dm3/mol
그럼에도 불구하고 이산화 이염소는 HOCl이 올레핀 및 방향족 화합물과 반응할 때,[8][9] 식수 염소화 과정에서 활성 종일 수 있다는 제안이 있었다.[10]
일산화 이염소는 차아염소산 (HClO)의 산 무수물에 해당하며, 물과 반응하면 차아염소산으로 변한다. 이로 인해 이 화합물은 '''무수 차아염소산'''이라고도 불린다.
:
일산화 이염소의 냄새를 맡으면 독특한 할로겐 냄새(일반적으로 염소 냄새, 석회 냄새라고 불리는 것)가 난다.
==== 무기 화합물과의 반응 ====
일산화 이염소는 Cl2가 손실되면서 금속 할로겐화물과 반응하여 특이한 옥시할로겐화물을 형성한다.[11][12][3]
: VOCl3 + Cl2O → VO2Cl + 2 Cl2
: TiCl4 + Cl2O → TiOCl2 + 2 Cl2
: SbCl5 + 2 Cl2O → SbO2Cl + 4 Cl2
AsCl3 및 NOCl와 같은 특정 무기 할로겐화물과도 유사한 반응을 보인다.[13][14]
: AsCl3 + 2 Cl2O → AsO2Cl + 3 Cl2
: NOCl + Cl2O → NO2Cl + Cl2
==== 유기 화합물과의 반응 ====
일산화 이염소는 효과적인 염소화 시약이다.[15] 비활성화된 방향족 화합물 기질의 측쇄 또는 고리 염소화에 모두 사용할 수 있다.[15] 페놀 및 아릴 에테르와 같은 활성화된 방향족 화합물의 경우, 주로 고리 할로겐화 생성물을 생성하는 반응을 일으킨다.[16] 일산화 이염소는 HOCl이 올레핀 및 방향족 화합물과 반응할 때 활성 종일 수 있다는 제안이 있었다.[8][9]
==== 광화학 반응 ====
일산화 이염소는 광해리를 겪어 결국 O2와 Cl2를 형성한다. 이 과정은 주로 라디칼 기반이며, 플래시 광분해는 라디칼 차아염소산염 (ClO·)이 핵심 중간체임을 보여준다.[17]
:2 Cl2O → 2 Cl2 + O2
4. 1. 무기 화합물과의 반응
일산화 이염소는 Cl2가 손실되면서 금속 할로겐화물과 반응하여 특이한 옥시할로겐화물을 형성한다.[11][12][3]: VOCl3 + Cl2O → VO2Cl + 2 Cl2
: TiCl4 + Cl2O → TiOCl2 + 2 Cl2
: SbCl5 + 2 Cl2O → SbO2Cl + 4 Cl2
AsCl3 및 NOCl와 같은 특정 무기 할로겐화물과도 유사한 반응을 보인다.[13][14]
: AsCl3 + 2 Cl2O → AsO2Cl + 3 Cl2
: NOCl + Cl2O → NO2Cl + Cl2
4. 2. 유기 화합물과의 반응
일산화 이염소는 효과적인 염소화 시약이다.[15] 비활성화된 방향족 화합물 기질의 측쇄 또는 고리 염소화에 모두 사용할 수 있다.[15] 페놀 및 아릴 에테르와 같은 활성화된 방향족 화합물의 경우, 주로 고리 할로겐화 생성물을 생성하는 반응을 일으킨다.[16] 일산화 이염소는 HOCl이 올레핀 및 방향족 화합물과 반응할 때 활성 종일 수 있다는 제안이 있었다.[8][9]4. 3. 광화학 반응
일산화 이염소는 광해리를 겪어 결국 O2와 Cl2를 형성한다. 이 과정은 주로 라디칼 기반이며, 플래시 광분해는 라디칼 차아염소산염 (ClO·)이 핵심 중간체임을 보여준다.[17]:2 Cl2O → 2 Cl2 + O2
5. 안전성
일산화 이염소는 불안정한 화합물이다.[18][19][20][3][21] 유기 화합물에 접촉할 경우 폭발하므로 취급에 주의를 요한다. 분해를 막기 위해서는 -80°C이하에서 보관하여야 한다.
상온에서 산소와의 혼합물은 23.5% Cl2O 이상을 포함할 때까지 전기 스파크로 폭발하지 않으며, 이는 매우 높은 최소 폭발 한계이다. 강한 빛에 노출되거나 120 °C 이상으로 가열하거나, 낮은 온도에서 급격한 가열도 폭발을 일으키는 것으로 보인다. 액체 이산화 이염소는 충격에 민감하다고 보고되었다.
6. 한국에서의 이용
7. 각주
참조
[1]
웹사이트
CHLORINE MONOXIDE
http://cameochemical[...]
National Oceanic and Atmospheric Administration
2015-05-12
[2]
논문
Recherches sur la nature des combinaisons décolorantes du chlore
https://babel.hathit[...]
1834
[3]
논문
The chemistry of chlorine monoxide (dichlorine monoxide)
1976-08-01
[4]
논문
CCCXIII.—A homogeneous gas reaction. The thermal decomposition of chlorine monoxide. Part I
[5]
논문
Tieftemperatur-Kristallstruktur von Dichlormonoxid, Cl2O
1998-01-01
[6]
논문
Nomograph for the Solubility of Chlorine Monoxide in Water
[7]
서적
Inorganic chemistry
Academic Press, W. de Gruyter.
2001
[8]
논문
Mechanisms of chlorination by hypochlorous acid. The last of chlorinium ion, Cl+
1972-05-01
[9]
논문
Chlorine Monoxide (Cl2O) and Molecular Chlorine (Cl2) as Active Chlorinating Agents in Reaction of Dimethenamid with Aqueous Free Chlorine
2010-05-01
[10]
논문
The active species in drinking water chlorination: the case for Cl2O
2010-05-01
[11]
논문
Untersuchungen an Vanadinoxidchloriden und Vanadinchloriden. I. Gleichgewichte mit VOCl3, VO2Cl und VOCl2
[12]
논문
Titan(IV)-Oxidchlorid TiOCl2
[13]
논문
Über die Oxidchloride PO2Cl, AsO2Cl und SbO2Cl
1964-12-01
[14]
논문
Kinetic Relationships between Reactions in the Gas Phase and in Solution
1966-01-01
[15]
논문
Dichlorine monoxide: a powerful and selective chlorinating reagent
1982-08-01
[16]
논문
Assessing the Reactivity of Free Chlorine Constituents Cl2, Cl2O, and HOCl Toward Aromatic Ethers
2012-02-21
[17]
논문
Reactions of Halogen Oxides Studied by Flash Photolysis. II. The Flash Photolysis of Chlorine Monoxide and of the ClO Free Radical
1971-06-22
[18]
논문
Minimum Explosive Concentration of Chlorine Monoxide Diluted with Oxygen
1945-09
[19]
논문
Photoreaction of Chlorine Monoxide and Hydrogen
1937-04
[20]
논문
The heats of dissociation of chlorine monoxide and chlorine dioxide
1931-01-01
[21]
논문
Chlorine trifluoride oxide. I. Preparation and properties
[22]
웹인용
CHLORINE MONOXIDE
http://cameochemical[...]
National Oceanic and Atmospheric Administration
2015-05-12
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

