황
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
황은 원자 번호 16번의 화학 원소로, 기호는 S이다. 열과 전기를 잘 전달하지 않으며, 다양한 동소체와 결정 다형을 가진다. 황은 오래전부터 자연계에 존재해 왔으며, 녹는점은 112.8 °C, 끓는점은 444.674 °C이다. 황은 다양한 화합물을 형성하며, 황산, 비료, 살충제, 의약품, 고무의 가황 등에 사용된다. 또한, 생물학적 역할도 수행하며, 단백질의 구조 유지와 효소 활성에 중요한 역할을 한다. 그러나 황 자체는 인체에 대한 독성이 낮지만, 황 분진 흡입이나 연소 시 발생하는 이산화황, 황화수소는 환경 문제와 안전 문제를 야기할 수 있다.
더 읽어볼만한 페이지
- 황 - 이황화물
이황화물은 두 개의 황 원자가 단일 결합으로 연결된 화합물로, 유기 이황화물은 시스틴과 리포산이 대표적이며, 단백질 구조 안정화, 고무 가황, 이황화수소 등의 다양한 기능과 종류를 가진다. - 황 - 연실법
연실법은 존 로벅이 기초 기술을 확립하고 니콜라 클레망과 샤를 데졸름이 완성한 후 게이뤼삭 탑과 글로버 탑 등의 설비 개선을 거쳐 산업화된 황산 제조 방법으로, 이산화황, 증기, 이산화 질소를 납으로 덮인 챔버에 주입하는 방식으로, 접촉법 개발로 대체되었으나 환경 오염과 낮은 농도 황산 생산의 단점을 가진다. - 16족 원소 - 텔루륨
텔루륨은 은백색의 금속성 광택을 가진 부서지기 쉬운 반금속 원소로, 광전도성을 보이며 셀레늄, 황과 유사한 화학적 성질을 나타내고 구리 정련 부산물로 얻어져 다양한 산업 분야에 활용되지만, 텔루륨과 그 화합물은 경미한 독성을 지닌 희귀 원소이다. - 16족 원소 - 셀레늄
셀레늄은 육방정계의 회색 형태가 가장 안정적인 비금속 원소로, 생명체의 필수 미량 영양소로서 항산화 효과 및 갑상선 호르몬 대사에 관여하며, 유리 제조, 반도체 등 산업적으로도 활용되지만 과다 섭취 시 독성을 나타낼 수 있다. - 비금속 - 인
인은 화학 원소 기호 P, 원자 번호 15를 가지는 비금속 원소로, 백린, 적린, 흑린 등의 동소체를 가지며, 생명체 필수 구성 성분이자 다양한 산업 분야에 활용되지만, 방사성 동위원소 사용 시 안전에 주의해야 하고, 인산염 광물 형태로 존재하여 매장량과 지속가능한 사용에 대한 논의가 필요하다. - 비금속 - 셀레늄
셀레늄은 육방정계의 회색 형태가 가장 안정적인 비금속 원소로, 생명체의 필수 미량 영양소로서 항산화 효과 및 갑상선 호르몬 대사에 관여하며, 유리 제조, 반도체 등 산업적으로도 활용되지만 과다 섭취 시 독성을 나타낼 수 있다.
2. 특성
황은 열과 전기를 잘 전달하지 않는다. 녹는점(112.8 °C)보다 약간 높은 온도에서는 노란색이지만, 160°C 이상이 되면 어두운 색으로 변한다.[144]
S₈ 황은 녹는점 바로 위 온도에서는 노란색이며 점성도 낮지만, 온도가 상승함에 따라 직쇄상 황으로의 변화가 진행되어, 159.4°C 이상에서는 적갈색(암색)이 되고 점성이 증가하여 거의 유동성을 잃는다. 이 온도 이상에서는 S₈ 황의 고리가 깨지고, 직쇄상 바이라디칼이 발생하며, 직쇄상 S₁₆, S₂₄ 등의 올리고머화가 진행되어 직쇄상 황(Sₙ)이 형성되고 점성이 급격히 증가한다. 더 가열하면 직쇄상의 분자가 끊어져 다시 유동성을 되찾고, 끓는점인 444.674°C에 이른다.
금, 백금 이외의 많은 금속과 반응하여 황화물을 형성한다. 은이나 구리와는 접촉에 의해 실온에서도 반응하여 검은색 황화은이나 황화구리를 생성한다.
많은 동소체와 결정 다형이 존재하며, 녹는점, 밀도는 각각 다르다. 아주 오래전부터 자연계에 존재하는 것이 알려져 있다. 다른 동소체로는 S₂, S₄, S₆, S₇ 등이 있으며, 허블 우주 망원경으로 관측한 목성의 위성 이오에서는 S₂, S₃, S₄가 발견되기도 했다. 2200°C 이상, 저압에서는 원자상 황이 주가 된다.[153]
물에는 잘 녹지 않지만 이황화탄소에 잘 녹고, 벤젠 및 톨루엔에도 소량 녹는다. 알칼리 수용액과 가열하면 다황화물 및 티오황산염을 생성하여 용해된다.
황 자체에는 냄새가 없지만, 화산 분화구나 온천 주변 등 천연 황이 존재하는 장소에서 많이 발생하는 황 화합물인 황화수소는 썩은 계란 냄새가 나고, 이산화황은 자극적인 냄새가 난다. “황 냄새”, “황과 같은 냄새”라고 하는 경우가 있지만, 이것은 이러한 황 화합물의 냄새이며, 황의 냄새라고 부르는 것은 정확하지 않다.[154][155]
2. 1. 물리적 성질
황은 다양한 분자 구조를 가진 형태로 존재한다. 가장 흔한 구조는 사이클로-옥타 황(cyclo-S8)으로, 점군은 D4d이며 쌍극자 모멘트는 0 D이다.[162] 옥타 황은 부드럽고 밝은 노란색 고체로, 성냥과 비슷한 유독성 악취를 풍긴다.[163]황의 녹는점은 115.21°C이고 끓는점은 444.6°C이며, 쉽게 승화하는 성질도 가지고 있다. 95.2°C에서 녹는점 사이에서 사이클로-옥타 황은 "α-옥타 황"에서 "β-옥타 황"으로 동질 이상화한다.[164] S8 고리 구조는 거의 변하지 않지만, 분자 간 상호 작용에 영향을 미친다. 녹는점과 끓는점 사이에서 옥타 황은 다시 "β-옥타 황"에서 "γ-황"으로 구조가 바뀌는데, 밀도는 낮아지지만 중합체 형성으로 점도가 높아진다.[161] 더 높은 온도에서는 해중합 반응으로 점도가 낮아진다. 녹은 황은 200°C 이상에서 어두운 붉은색을 띤다. 황의 밀도는 동소체에 따라 다르지만 대략 2 g·cm-3이며, 모든 안정 동위 원소는 훌륭한 절연체이다.
황은 20°C에서 50°C 사이에서 다소 승화된다.[15] 물에는 녹지 않지만 이황화탄소에 녹고, 벤젠과 톨루엔 같은 무극성 유기 용매에는 조금 녹는다.
황은 사슬결합을 잘 형성하여 30가지 이상의 동소체를 만든다.[146] 일반적으로 자연에서 발견되는 동소체는 고리 모양의 S8황이다.[147]
상온, 상압에서 고체인 S8황은 세 가지 결정형을 가진다.
모두 S8황을 단위 구조로 하지만, 95.6°C 이하에서는 사방황이 안정하고, 그 이상에서는 단사황이 안정하다. 250°C까지 가열하면 50만 개 이상의 황 원자가 연결된 직쇄상 황(Sn)이 되는데, 이를 고무상 황 또는 플라스틱 황이라고 한다. 고무상 황은 노란색을 띠지만, 불순물에 따라 흑갈색을 띠기도 한다.[148][149]
열과 전기를 잘 전달하지 않는다. 112.8°C보다 약간 높은 온도에서는 노란색이지만, 160°C 이상이 되면 어두운 색으로 변한다.[144]
S₈ 황은 녹는점 바로 위에서는 노란색이며 점성도 낮지만, 온도가 올라가면 직쇄상 황으로 변하면서 159.4°C 이상에서는 적갈색이 되고 점성이 증가한다. 이 온도 이상에서는 S₈ 황의 고리가 깨지고 직쇄상 바이라디칼이 발생하며, 직쇄상 S₁₆, S₂₄ 등의 올리고머화가 진행되어 직쇄상 황(Sₙ)이 형성되고 점성이 급격히 증가한다. 더 가열하면 직쇄상 분자가 끊어져 다시 유동성을 되찾고, 끓는점인 444.674°C에 이른다.
고무상 황은 생성 시 가열 온도나 냉각 속도 등에 따라 다른 조성을 나타내므로, 색, 점도, 탄성률 등의 물리적 특성은 합성 조건에 크게 의존한다. 준안정 상태인 고무상 황은 방치하면 사방 황으로 서서히 변해간다.
다른 동소체로는 S₂, S₄, S₆, S₇ 등이 있으며, 목성의 위성 이오에서는 S₂, S₃, S₄가 관측되기도 한다. 2200°C 이상, 저압에서는 원자상 황이 주가 된다.[153]
시클로-S₆는 알켄의 황화 반응성이 S₈ 황보다 높다.
황 자체는 냄새가 없지만, 황화수소는 썩은 계란 냄새, 이산화황은 자극적인 냄새가 난다. 이를 황 냄새로 오인하는 경우가 있지만, 이는 황 화합물의 냄새이다.[154][155]
2. 2. 화학적 성질
황을 불태우면 이산화 황(SO2)이 되면서 푸른 불꽃을 내며 탄다. 이때, 부식성이 있는 질식성 유독 기체를 생성한다. 황은 비수용성 물질이지만, 이황화 탄소에는 녹는 물질이다. 또한, 톨루엔이나 벤젠과 같은 비극성 물질에는 거의 녹지 않는다. 황의 제 1 이온화 에너지와 제 2 이온화 에너지는 각각 999.6과 2252 kJ·mol−1이다. 다만 +2 산화 형태는 드물며, +4와 +6 산화 형태가 보다 일반적으로 발견된다. 제 4 이온화 에너지와 제 6 이온화 에너지는 각각 4556과 8495.8 kJ·mol−1로, 궤도 간 전자 이동에 발생하는 수치의 크기가 커서 플루오린, 산소, 염소와 같은 강력한 산화제와 결합한 물질만이 안정할 수 있다. 황은 금, 백금, 이리듐, 질소, 텔루륨, 아이오딘, 그리고 비활성 기체를 제외한 대부분의 원소와 반응한다. 다만 일부 반응은 높은 열이 필요하다.[165]정상적인 조건에서 황은 매우 느리게 가수분해되어 주로 황화수소와 황산을 형성한다.
:2/8 S8 + 4 H2O → 3 H2S + H2SO4
이 반응은 S8 덩어리에 양성자의 흡착이 뒤따르고, 반응 생성물로의 불균일화를 포함한다.[16]
황의 두 번째, 네 번째, 여섯 번째 이온화 에너지는 각각 2252 kJ/mol, 4556 kJ/mol, 8495.8 kJ/mol이다. 산화제와 황의 반응 생성물의 조성(및 산화 상태)은 반응 에너지의 방출이 이러한 한계를 극복하는지 여부에 따라 달라진다. 촉매를 사용하거나 외부 에너지를 공급하면 황의 산화 상태와 반응 생성물의 조성이 달라질 수 있다. 정상적인 조건에서 황과 산소의 반응은 이산화황(산화 상태 +4)을 생성하지만, 삼산화황(산화 상태 +6)의 형성에는 400°C에서 600°C의 온도와 촉매가 필요하다.
전기음성도가 더 낮은 원소와 반응할 때는 산화제로 작용하여 산화 상태가 -2인 황화물을 형성한다.
황은 비활성 기체를 제외한 거의 모든 다른 원소와 반응하며, 심지어 반응성이 매우 낮은 금속인 이리듐(이황화이리듐 생성)과도 반응한다.[17] 이러한 반응 중 일부는 높은 온도가 필요하다.[18] 황은 열과 전기를 잘 전달하지 않는다.
물에는 잘 녹지 않지만 이황화탄소에 잘 녹고, 벤젠 및 톨루엔에도 소량 녹는다. 알칼리 수용액과 가열하면 다황화물 및 티오황산염을 생성하여 용해된다. 금, 백금 이외의 많은 금속과 반응하여 황화물을 형성한다. 은이나 구리와는 접촉에 의해 실온에서도 반응하여 검은색 황화은이나 황화구리를 생성한다.
시클로-S₆는 알켄의 황화에 사용할 때 S₈ 황보다 반응성이 높다.
황 자체에는 냄새가 없지만, 화산 분화구나 온천 주변 등 천연 황이 존재하는 장소에서 많이 발생하는 황 화합물인 황화수소에는 썩은 계란 냄새가 나고, 이산화황에는 자극적인 냄새가 있다. “황 냄새”, “황과 같은 냄새”라고 하는 경우가 있지만, 이것은 이러한 황 화합물의 냄새이며, 황의 냄새라고 부르는 것은 정확하지 않다.[154][155]
2. 3. 동소체
황은 다양한 화학적 구조를 가진 형태로 존재하며, 그 중 가장 잘 알려진 것은 사이클로-옥타 황(cyclo-S8)이다. 옥타 황은 부드럽고 밝은 노란색 고체이며, 성냥과 비슷한 유독성 악취를 낸다.[163] 황의 녹는점은 115.21°C이고 끓는점은 444.6°C이며, 쉽게 승화하는 성질을 가지고 있다.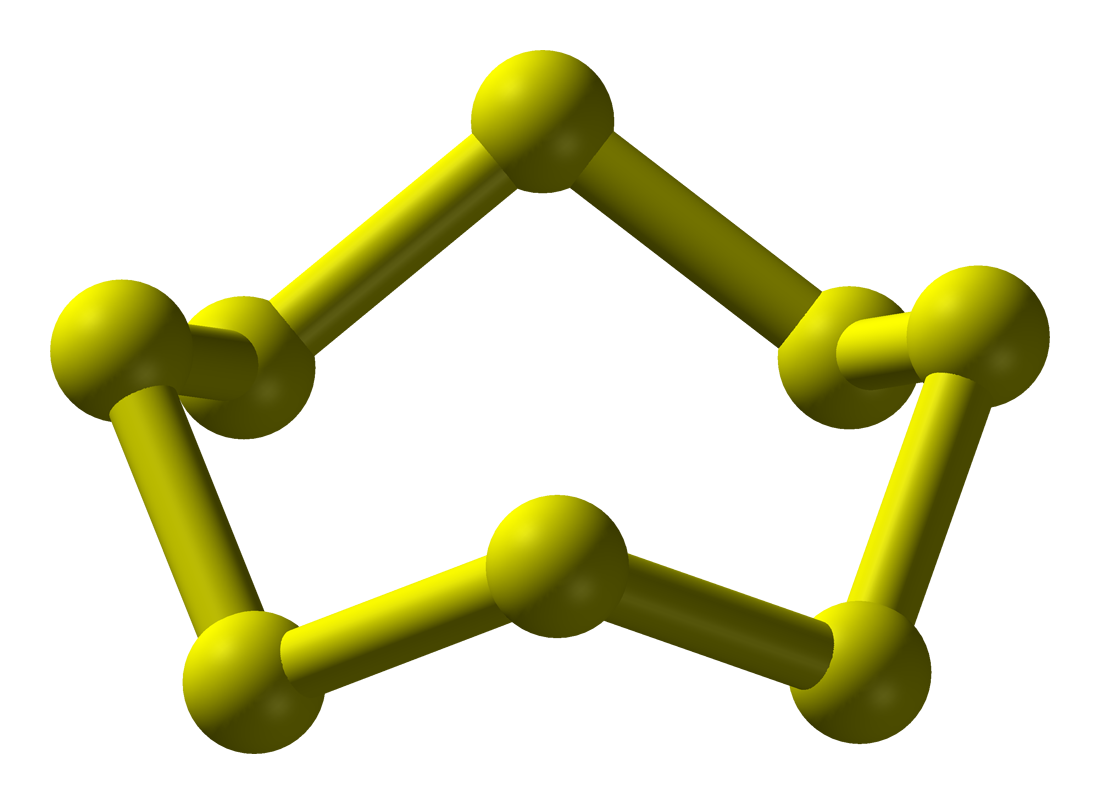
황은 30가지가 넘는 고체 동소체를 형성하는데, 이는 다른 어떤 원소보다 많은 수이다.[19] S8 외에도 S7, S6, S12, S18 등 다양한 고리 모양 동소체가 알려져 있다.[20][21][22][23]
상온, 상압에서 고체인 S8황은 다음과 같은 세 가지 결정형을 가진다.
이들은 모두 S8황을 단위 구조로 하지만, 95.6°C 이하에서는 사방황이, 그 이상에서는 단사황이 안정하다.
95.2°C에서 녹는점인 115.21°C 사이에서는 사이클로-옥타 황의 구조가 "α-옥타 황"에서 "β-옥타 황"으로 동질 이상화한다.[164] 황의 녹는점과 끓는점 사이에서는 "β-옥타 황"에서 "γ-황"으로 구조가 변하며, 밀도는 낮아지지만 중합체 형성으로 점도가 높아진다.[161]
250 ℃까지 가열하면 50만 개 이상의 황 원자가 연결된 직쇄상 황(Sn, 고무상 황 또는 플라스틱 황)이 된다. 고무상 황은 노란색을 띠지만, 불순물에 따라 흑갈색을 띠기도 한다.[148][149]
녹은 황을 빠르게 냉각시켜 비결정질 황(플라스틱 황)을 만들 수 있다. X선 결정학 연구에 따르면 비결정질 황은 한 회전 당 여덟 개의 원자를 갖는 나선형 구조를 가질 수 있다. 이 형태는 상온에서 준안정 상태이며, 시간이 지나면서 결정질 동소체로 되돌아간다.
S₈ 황은 녹는점 부근에서는 노란색이며 점성이 낮지만, 온도가 상승하면 직쇄상 황으로 변하면서 적갈색을 띠고 점성이 증가한다. 159.4°C 이상에서는 S₈ 황의 고리가 깨지고 직쇄상 바이라디칼이 발생하며, 직쇄상 S₁₆, S₂₄ 등의 올리고머화가 진행되어 점성이 급격히 증가한다. 더 가열하면 직쇄상의 분자가 끊어져 다시 유동성을 되찾고, 끓는점인 444.674°C에 이른다.
다른 동소체로는 S₂, S₄, S₆, S₇ 등이 있으며, 목성의 위성 이오에서는 S₂, S₃, S₄가 관측되기도 한다.[153] 또한, 시클로-S₆, 시클로-S₇, 시클로-S₉, 시클로-S₁₀, 시클로-S₁₁, 시클로-S₁₂, 시클로-S₁₈, 시클로-S₂₀ 등 다양한 환상 황 분자가 인위적으로 합성되었다.
2. 4. 동위 원소
황에는 23개의 동위원소가 알려져 있으며, 그중 4개는 안정 동위원소이다. 안정 동위원소는 32S (94.99%), 33S (0.75%), 34S (4.25%), 36S (0.01%)이다.[24][25] 35S(반감기 87일)을 제외한 황의 방사성 동위원소는 반감기가 3시간 미만이다.32S의 압도적인 비율은 폭발하는 별에서 일어나는 알파 과정(주요 핵융합 반응 중 하나)에서 생성된다. 다른 안정적인 황 동위원소는 34Ar과 관련된 우회 과정에서 생성되며, 그 구성은 항성 폭발의 유형에 따라 달라진다. 예를 들어, 더 많은 33S는 초신성보다 신성에서 유래한다.[26]지구상에서 황 동위원소 조성은 태양에 의해 결정되었다. 서로 다른 황 동위원소의 분포가 거의 동일할 것이라고 가정했지만, 두 가지 가장 풍부한 황 동위원소인 32S와 34S의 비율이 서로 다른 샘플에서 다르다는 것이 밝혀졌다. 샘플에서 동위원소 비율 (δ34S) 분석은 그 화학적 역사를 시사하며, 다른 방법의 지원을 받아 샘플의 연대 측정, 광석과 물 사이의 평형 온도 추정, pH와 산소 퓨가시티 결정, 샘플 형성 당시 황산염 환원 박테리아의 활동 확인 또는 생태계에서 황의 주요 공급원 제시가 가능하다.[27] 그러나 δ34S 변화의 실제 원인, 즉 생물 활동 또는 퇴적 후 변화에 대한 논의는 계속되고 있다.[28]
황화물 광물이 침전될 때 고체와 액체 사이의 동위원소 평형은 공유 광물의 δ34S 값에 약간의 차이를 야기할 수 있다. 광물 간의 차이는 평형 온도를 추정하는 데 사용될 수 있다. 공존하는 탄산염 광물과 황화물의 δ13C와 δ34S는 광석 형성 중 광석 함유 유체의 pH와 산소 퓨가시티를 결정하는 데 사용될 수 있다.
과학자들은 암석과 퇴적물의 광물에 대한 황 동위원소를 측정하여 과거 해양의 산화환원 조건을 연구한다. 해양 퇴적물 속의 황산염 환원 박테리아는 황산염을 흡수하고 황화물을 생성함에 따라 황 동위원소를 분획한다. 2010년대 이전에는 황산염 환원이 최대 46 퍼밀까지 황 동위원소를 분획할 수 있다고 생각되었으며,[29] 퇴적물에 기록된 46 퍼밀보다 큰 분획은 퇴적물 내 황 화합물의 불균등화 때문일 것이라고 생각했다. 2010년대 이후로 황산염 환원 박테리아가 66 퍼밀까지 분획할 수 있다는 실험 결과가 나오면서 이러한 견해는 바뀌었다.[30] 불균등화의 기질은 황산염 환원 생성물에 의해 제한되므로, 불균등화의 동위원소 효과는 대부분의 퇴적 환경에서 16 퍼밀 미만이어야 한다.[31]
숲 생태계에서는 황산염이 대부분 대기에서 유래하며, 광석 광물과 증발암의 풍화 작용이 일부 황을 제공한다. 독특한 동위원소 조성을 가진 황은 오염원을 식별하는 데 사용되었으며, 풍부한 황은 수문학적 연구에서 추적자로 추가되었다. 생태계 구성 요소의 34S에 충분한 변화가 있는 시스템에서는 자연적 풍부도의 차이를 사용할 수 있다. 황산염의 대기 공급원이 지배적인 것으로 여겨지는 록키 산맥 호수는 황산염의 유역 공급원이 지배적인 것으로 여겨지는 호수와 측정 가능하게 다른 34S 값을 가지고 있는 것으로 밝혀졌다.
방사성 35S는 대기 40Ar의 우주선 파쇄에서 생성된다. 이 사실은 다양한 물질에서 최근(최대 1년) 대기 퇴적물의 존재를 확인하는 데 사용될 수 있다. 이 동위원소는 다양한 방법으로 인공적으로 얻을 수 있다. 실제로, 35Cl + n → 35S + p 반응은 염화칼륨에 중성자를 조사하여 사용된다.[32] 35S 동위원소는 다양한 황 함유 화합물에서 많은 생물학적 연구(예: 허시-체이스 실험)를 위한 방사성 추적자로 사용된다.35S의 약한 베타 활동으로 인해, 그것의 화합물은 섭취되거나 몸에 흡수되지 않는 한 비교적 안전하다.[33]
3. 화합물
황은 비활성 기체를 제외한 모든 원소와 안정적인 화합물을 형성하며, 일반적인 산화 상태는 -2에서 +6까지 다양하다.
황산은 화학 공업에서 가장 중요한 산 중 하나이며, 묽은 황산은 산으로, 진한 황산은 탈수제나 건조제로 사용된다. 황은 고대부터 표백제, 의식용 향료, 살충제, 접착제 등으로 사용되었고, 흑색화약의 원료로도 쓰였다. 로마인들은 황을 불꽃놀이와 무기 제조에 사용했다.
현대에는 합성섬유, 의약품, 농약, 누염제 등의 원료로 사용되며, 다양한 황화물과 화합물이 여러 분야에서 구성 요소로 사용된다. 농가에서는 곶감, 말린 무화과 등의 표백제로 황을 태워 얻은 이산화황을 사용하고(훈증), 와인의 산화방지제로도 이산화황이 사용된다. 고무에 수 %의 황을 첨가하여 가열(가황)하면 (가교에 의해) 탄성이 증가하고, 첨가량을 늘리면 경도를 높일 수 있으며, 최종적으로는 에보나이트가 된다. 이는 고무 타이어의 성질을 결정하는 중요한 요소이다.
금속의 황화광물은 반도체 성질을 나타내는 경우가 많아, 실리콘검파기나 게르마늄 다이오드가 실용화되기 전에는 검파기의 주요 부품으로 중요하게 사용되었다.
황은 높은 전위를 나타내 이차전지의 양극 활물질로도 이용된다. 나트륨-황 전지가 풍력발전소 등에서 널리 이용되며, 최근에는 전고체전지의 고체 전해질에도 황화물이 이용된다. 이 황화물계 고체 전해질은 높은 이온 전도도를 나타내며, 앞으로 전고체전지가 리튬이온전지를 대체하여 큰 수요가 예상된다.
다음은 황 화합물의 예시이다.
- 황화수소(H2S)
- 황화수은(HgS)
- 이산화황(SO2)
- 삼산화황(SO3)
- 육불화황(SF6)
- 이염화황(SCl2)
- 이황화탄소(CS2)
- 유기황화합물
- 티오황산나트륨(하이포, Na2S2O3)
- 황산바륨(BaSO4)
- 황산염
3. 1. 산화-환원 반응
황을 불태우면 이산화 황(SO2)이 되면서 푸른 불꽃을 내며 타는데, 이때 부식성이 있는 질식성 유독 기체를 생성한다.[165] 황의 제1, 2 이온화 에너지는 각각 999.6 kJ/mol, 2252 kJ/mol이다. +2 산화 상태는 드물고, +4, +6 산화 상태가 일반적이다. 제4, 6 이온화 에너지는 각각 4556 kJ/mol, 8495.8 kJ/mol로 매우 커서 플루오린, 산소, 염소와 같이 강력한 산화제와 결합해야 안정하다.[165]정상 조건에서 황은 매우 느리게 가수분해되어 주로 황화수소와 황산을 형성한다.
:2 + 4 → 3 +
이 반응은 덩어리에 양성자가 흡착된 후 불균일화를 거쳐 생성된다.[16]
황의 두 번째, 네 번째, 여섯 번째 이온화 에너지는 각각 2252 kJ/mol, 4556 kJ/mol, 8495.8 kJ/mol이다. 산화제와 황의 반응 생성물 조성(및 산화 상태)은 반응 에너지 방출량에 따라 달라진다. 촉매나 외부 에너지 공급으로 황의 산화 상태와 반응 생성물 조성을 변화시킬 수 있다. 정상 조건에서 황과 산소는 이산화 황(산화 상태 +4)을 생성하지만, 삼산화황(산화 상태 +6) 형성에는 400°C에서 600°C의 온도와 촉매가 필요하다.
전기음성도가 낮은 원소와 반응 시 황은 산화제로 작용하여 산화 상태가 -2인 황화물을 형성한다.
황은 비활성 기체를 제외한 거의 모든 원소와 반응하며, 심지어 반응성이 매우 낮은 금속인 이리듐(이황화이리듐 생성)과도 반응한다.[17] 이러한 반응 중 일부는 높은 온도가 필요하다.[18]
황 다중 양이온(, 및 )은 강산성 용액에서 황을 산화제와 반응시킬 때 생성된다.[43] 황을 올레움에 용해시켜 생성된 색 용액은 1804년 C. F. 부홀츠에 의해 처음 보고되었지만, 색깔의 원인과 관련된 다중 양이온의 구조는 1960년대 후반에야 밝혀졌다. 는 진한 파란색, 는 노란색, 는 붉은색이다.[10]
황의 환원은 식의 다양한 폴리황화물을 생성하며, 이 중 많은 수가 결정 형태로 얻어졌다. 테트라황화나트륨 생성 반응은 다음과 같다.
:4 Na + S8 → 2 Na2S4
이러한 이중 음이온 중 일부는 라디칼 음이온을 생성하기 위해 해리된다. 예를 들어 는 라피스 라줄리 암석의 푸른색을 나타낸다.
이 반응은 황의 독특한 특성인 사슬 형성(사슬 형성을 통한 자기 결합) 능력을 보여준다. 이러한 폴리황화물 음이온의 양성자화는 폴리설판(H2S''x'', ''x'' = 2, 3, 4)을 생성한다.[45] 궁극적으로 황의 환원은 황화물 염을 생성한다.
:16 Na + S8 → 8 Na2S
이러한 종들의 상호 변환은 나트륨-황 전지에서 활용된다.
황은 여러 종류의 옥소산을 생성하며, 가장 유명한 것은 황산(H2SO4)이다.
3. 2. 수소화 반응
정상적인 조건에서 황은 매우 느리게 가수분해되어 주로 황화수소와 황산을 형성한다. 이 반응은 황 덩어리에 양성자가 흡착된 후, 불균일화를 거쳐 반응 생성물을 만든다.[16]:2 S8 + 4 H2O → 3 H2S + H2SO4
황과 수소의 반응은 황화수소를 생성한다. 황화수소는 물에 녹으면 약산성을 나타낸다.[46]
:H2S ⇌ HS− + H+
황화수소 기체와 수소황이온(hydrosulfide anion)은 헤모글로빈과 특정 시토크롬의 산소 운반 능력을 억제하기 때문에 포유류에 매우 유독하다. 이는 시안화물과 아지드와 유사한 작용 방식이다.
3. 3. 연소
황을 불태우면 이산화 황(SO2)이 되면서 푸른 불꽃을 내며 탄다. 이때, 부식성이 있는 질식성 유독 기체를 생성한다.[165] 황은 비수용성 물질이지만, 이황화 탄소에는 녹는 물질이다. 또한, 톨루엔이나 벤젠과 같은 비극성 물질에는 거의 녹지 않는다.[165] 정상적인 조건에서 황과 산소의 반응은 이산화황(산화 상태 +4)을 생성하지만, 삼산화황(산화 상태 +6)의 형성에는 400°C에서 600°C의 온도와 촉매의 존재가 필요하다.황의 연소를 통해 얻어지는 두 가지 주요 황 산화물은 다음과 같다.[17]
황이 풍부한 산화물에는 일산화황, 일황화이황, 이황화이산화황 등이 포함되며, 과산화 그룹을 포함하는 고급 산화물도 관찰된다.[17]
황 자체에는 냄새가 없지만, 화산 분화구나 온천 주변 등 천연 황이 존재하는 장소에서 많이 발생하는 황 화합물인 황화수소에는 썩은 계란 냄새가 나고, 이산화황에는 자극적인 냄새가 있다. 속칭 “황 냄새”, “황과 같은 냄새”라고 하는 경우가 있지만, 이것은 이러한 황 화합물의 냄새이며, 이것을 황의 냄새라고 부르는 것은 정확하지 않다.[154][155]
3. 4. 할로젠화 반응
황은 플루오린과 반응하여 반응성이 높은 사플루오르화황과 매우 비활성인 육플루오르화황을 생성한다.[47] 염소는 S(II)와 S(I) 유도체를 생성하는 반면, 플루오린은 S(IV)와 S(VI) 화합물을 생성한다. 황의 염소화 과정에서 이황화염소, 이황화이염소, 그리고 더 높은 클로로술판이 생성된다. 황산염화물과 염화황산은 황산의 유도체이며, 염화티오닐(SOCl2)은 유기 합성에서 흔히 사용되는 시약이다.[48] 브롬 또한 황을 산화시켜 이브롬화황과 이황화이브롬화물을 생성한다.[48]3. 5. 기타 반응
황은 비활성 기체를 제외한 거의 모든 다른 원소와 반응하며, 심지어 반응성이 매우 낮은 금속인 이리듐(이황화이리듐 생성)과도 반응한다.[17] 이러한 반응 중 일부는 높은 온도가 필요하다.[18] 황은 시안화물과 아황산염을 각각 티오시안산염과 티오황산염으로 산화시킨다.황 자체는 냄새가 없지만, 화산 분화구나 온천 주변 등 천연 황이 존재하는 장소에서 많이 발생하는 황 화합물인 황화수소는 썩은 계란 냄새가 나고, 이산화황에는 자극적인 냄새가 있다. "황 냄새" 또는 "황과 같은 냄새"라고 불리는 경우가 있지만, 이것은 이러한 황 화합물의 냄새를 표현하는 것이며, 황 자체의 냄새라고 하는 것은 정확하지 않다.[154][155]
3. 6. 유기 황 화합물


주요 유황 함유 유기 화합물은 다음과 같다.[51]
- 티올 또는 머캡탄 (수은을 킬레이트제로써 포획하기 때문에 이렇게 불림)은 알코올의 유황 유사체이다. 염기로 티올을 처리하면 티올레이트 이온이 생성된다.
- 티오에테르는 에테르의 유황 유사체이다.
- 술포늄 이온은 양이온성 황 중심에 세 개의 그룹이 결합되어 있다. 디메틸술포니오프로피오네이트(DMSP)는 해양 유기 황 순환에서 중요한 화합물 중 하나이다.
- 술폭사이드와 술폰은 각각 황 원자에 하나와 두 개의 산소 원자가 결합된 티오에테르이다. 가장 간단한 술폭사이드인 디메틸술폭사이드는 일반적인 용매이며, 일반적인 술폰은 술폴란이다.
- 술폰산은 많은 세제에 사용된다.
탄소-황 다중 결합을 가진 화합물은 드물다. 예외는 이산화탄소와 구조적으로 유사한 휘발성 무색 액체인 이황화탄소이다. 레이온 폴리머와 많은 유기황 화합물을 만드는 시약으로 사용된다. 일산화탄소와 달리 일황화탄소는 태양계 사이에서 발견되는 극도로 희석된 기체로만 안정적이다.[52]
유기황 화합물은 부패하는 유기물의 불쾌한 냄새의 원인 중 일부이다. 가정용 천연가스의 취기제, 마늘 냄새, 스컹크 분무, 입냄새의 성분으로 널리 알려져 있다. 모든 유기황 화합물이 모든 농도에서 불쾌한 냄새가 나는 것은 아니다. 소량의 유황 함유 모노터페노이드인 자몽 머캡탄은 자몽의 특징적인 향이지만, 고농도에서는 일반적인 티올 냄새가 난다. 강력한 수포제인 황 겨자 가스는 제1차 세계 대전에서 무력화제로 사용되었다.[53]
황-황 결합은 단백질을 강화하는 디설파이드 브리지와 유사하게 고무를 강화하는 데 사용되는 구조적 구성 요소이다. 가장 일반적인 산업용 "경화" 또는 천연 고무의 경화 및 강화에서 원소 황은 고무와 함께 가열되어 화학 반응에 의해 폴리머의 이소프렌 단위 사이에 디설파이드 브리지가 형성된다. 1843년에 특허를 받은 이 공정은 특히 자동차 타이어에서 고무를 주요 산업 제품으로 만들었다. 열과 황 때문에 이 과정은 대장간과 화산 활동의 로마 신의 이름을 따서 가황이라고 명명되었다.
4. 역사
황은 고대부터 알려진 물질로, 성경의 창세기에도 언급된다.[54] 영어 성경 번역본에서는 황을 '유황'으로 칭하며, 이는 '유황불과 심판' 설교에 사용되어 회개하지 않는 자들이 지옥에 떨어진다는 의미를 담고 있다. 에베르스 파피루스에 따르면 고대 이집트에서는 황 연고를 눈병 치료에 사용했고, 고대 그리스에서는 훈증에 사용했다는 기록이 오디세이에 남아있다.[55][56] 플리니우스는 자연사에서 황의 원산지로 멜로스 섬을 언급하며, 훈증, 의학, 옷감 표백 등에 사용되었다고 기록했다.[57]
기원전 6세기부터 중국에서는 천연 황(石硫黄중국어)이 알려졌으며,[58] 3세기에는 황철석에서 황을 추출하는 방법이 발견되었다. 중국 도교에서는 황의 가연성과 금속과의 반응성에 주목했지만, 초기에는 중의학에서 주로 사용되었다. 1044년 무경총요에는 질산칼륨, 숯 등과 황을 혼합한 중국 흑색 화약 제조법이 기록되어 있다.[59]
8세기 이후 인도 연금술사들은 수은을 사용한 연금술 작업에서 황을 사용했으며, 라사 샤스트라 전통에서는 황을 '악취 나는 것'(गन्धकsa)이라고 불렀다.[61] 초기 유럽 연금술에서는 황에 독특한 연금술 기호(십자가 위에 삼각형(🜍))를 부여했다. 전통적인 피부 치료에서 황은 옴, 백선, 건선, 습진, 여드름 등의 질환 완화에 사용되었다.[62][63][64]
1777년 앙투안 라부아지에는 연소 실험에 황을 사용했다.[67] 18세기 후반 시칠리아는 황의 주요 공급지였으며, 프랑스 마르세이유에서는 르블랑법에 사용되는 황산 생산을 위해 연간 약 2000ton의 황을 수입했다. 산업혁명 시기 영국에서는 소금 관세 폐지로 시칠리아산 황 수요가 급증했다. 영국의 시칠리아 황 산업 통제와 두 시칠리아 왕국의 페르디난도 2세가 프랑스 회사에 독점권을 부여하면서 1840년 황 위기가 발생했지만, 프랑스의 중재로 해결되었다.[68][69] 1867년 루이지애나주와 텍사스주에서 황이 발견되고 프라슈법이 개발되었다.[70] 18세기 후반 가구 제작자들은 황 상감을 만드는 데 황을 사용했다.[71] 접촉법의 출현 이후 황은 황산 제조에 주로 사용되며, 최근에는 석유와 천연가스가 주요 공급원이 되었다.[6]
일본에서는 화산이 많아 노천 채굴로 유황 생산이 이루어졌다. 8세기 속일본기에는 신슈국에서 조정에 유황을 바쳤다는 기록이 있다. 사쓰마 유황도에서 채굴된 유황은 해외로 수출되었고, 화승총 전래 이후 화약 재료로 중요해졌다. 전국 시대에는 사쓰마국의 시마즈 타다요시가 명과의 조공 무역에서 유황을 수출했다.[157] 에도 시대에는 화구상자 보급으로 유황 수요가 증가했다. 흑선 항해 이후 사쓰마 번은 유황 채굴을 시작했고,[158] 메이지 시대 산업 혁명으로 광산 개발이 본격화되었다. 1881년 유황 무세 수출이 허용되었고,[159] 해상 보험 회사 설립자 히로우미 니사부로는 규슈 유황 사업에 투자했다. 안다 재벌은 아토사누프리 유황으로 부를 축적했다. 순도 높은 일본산 유황은 성냥 재료로 사용되었고, 1889년 지토쿠 유황산 분화로 대량의 유황이 산출되었다. 구니시 시게타다는 1893년 제1차 천도 탁토에서 유황 채굴을 기록했다. 쇼와 20년대 한국 전쟁으로 유황 가격이 급등했지만, 쇼와 30년대 이후 자원 고갈과 석유 탈황 기술 발달로 국내 유황 광산은 모두 폐쇄되었다.[160]
4. 1. 고대
32S는 온도가 2.5×109 K를 초과하는 깊이에서 거대한 별 내부에서 규소 원자핵과 헬륨 원자핵의 핵융합을 통해 생성된다.[34] 이 핵반응은 원소를 풍부하게 생성하는 알파 과정의 일부이기 때문에 황은 우주에서 10번째로 흔한 원소이다.[34]황은 보통 황화물 형태로 여러 종류의 운석에 존재한다. 보통 콘드라이트는 평균 2.1%의 황을 포함하고, 탄소질 콘드라이트는 최대 6.6%의 황을 포함할 수 있다. 일반적으로 트로일라이트(FeS) 형태로 존재하지만, 탄소질 콘드라이트에는 자유 황, 황산염 및 기타 황 화합물이 포함된 예외도 있다.[35] 목성의 화산 위성인 이오의 독특한 색깔은 다양한 형태의 용융, 고체, 기체 황 때문이다.[36] 2024년 7월, 큐리오시티 로버가 바위를 넘어가 부순 후 실수로 화성에서 원소 황이 발견되었는데, 바위 안에서 황 결정이 발견되었다.[37]
황은 지구에서 질량으로 다섯 번째로 흔한 원소이다. 원소 황은 전 세계적으로, 특히 환태평양 조산대를 따라 많은 온천과 화산 지역 근처에서 발견될 수 있으며, 이러한 화산 퇴적물은 인도네시아, 칠레, 일본에서 채굴된다. 역사적으로 시칠리아는 산업혁명 당시 주요 황 생산지였다.[39] 지름이 약 200m에 이르는 용융 황 호수가 해저에서 발견되었는데, 이는 해저 화산과 관련이 있으며, 물의 끓는점이 황의 녹는점보다 높은 깊이에 있다.[40]
원시 황은 황산염 광물(예: 석고)에 작용하는 혐기성 세균에 의해 소금 돔에서 합성된다.[41][42] 소금 돔의 중요한 매장지는 멕시코만 연안과 동유럽 및 서아시아의 증발암에서 발견된다. 원시 황은 지질학적 과정만으로도 생성될 수 있다. 소금 돔에서 나온 화석 기반 황 퇴적물은 한때 미국, 러시아, 투르크메니스탄, 우크라이나에서 상업 생산의 기초가 되었다.[87] 이러한 원천은 상업적 중요성이 2차적으로 되었으며, 대부분 더 이상 채굴되지 않지만, 폴란드 오셰크 광산에서는 여전히 상업 생산이 이루어지고 있다.
일반적인 자연 발생 황 화합물에는 황화물 광물(예: 황철석(황화철), 진사(황화수은), 방연석(황화납), 섬아연석(황화아연), 휘안석(황화안티몬)) 및 황산염 광물(예: 석고(황산칼슘), 명반석(황산알루미늄칼륨), 중정석(황산바륨))이 포함된다. 지구에서와 마찬가지로 목성의 위성 이오에서도 원소 황은 열수 분출구를 포함한 화산 분출물에서 자연적으로 발생한다. 황의 주요 산업적 원천은 석유와 천연가스가 되었다.[6]
황은 고대부터 알려져 있으며, 토라(창세기)에도 언급되어 있다. 기독교 성경 영어 번역본에서는 타는 황을 "유황"으로 흔히 언급하며, 이는 믿지 않고 회개하지 않는 자들을 기다리는 영원한 지옥의 운명을 상기시키는 "유황불과 심판" 설교라는 용어를 낳았다. 성경의 이 부분[54]에서 지옥은 화산 활동과의 연관성 때문에 "황 냄새가 나는 곳"으로 묘사된다. 에베르스 파피루스에 따르면 고대 이집트에서는 황 연고를 사용하여 과립성 안검염을 치료했다. 황은 고전 시대 이전 그리스에서 훈증에 사용되었는데,[55] 이는 ''오디세이''에 언급되어 있다.[56] 플리니우스는 그의 저서 ''자연사'' 35권에서 황에 대해 논하며, 가장 잘 알려진 원산지는 멜로스 섬이라고 말한다. 그는 훈증, 의학 및 옷감 표백에 황을 사용한 것을 언급한다.[57]
(石硫黄중국어)으로 알려진 천연 황은 기원전 6세기부터 한중에서 발견되어 중국에 알려졌다.[58] 3세기까지 중국인들은 황을 황철석에서 추출할 수 있다는 것을 발견했다.[58] 중국 도교도들은 황의 가연성과 특정 금속과의 반응성에 관심이 있었지만, 가장 초기의 실용적인 용도는 중의학에서 찾을 수 있다.[58] 1044년의 ''무경총요''에는 질산칼륨 (), 숯, 그리고 황의 혼합물인 중국 흑색 화약에 대한 다양한 공식이 설명되어 있다.[59]
"화학의 과학" ()을 실천하는 인도 연금술사들은 8세기 이후 수은을 사용한 연금술 작업에서 황의 사용에 대해 광범위하게 저술했다.[61] 전통에서 황은 "악취 나는 것" (गन्धकsa, )이라고 불린다.
초기 유럽 연금술사들은 황에 독특한 연금술 기호(십자가 위에 삼각형(🜍))를 부여했다. 유황으로 알려진 변형은 이중 십자가 위에 렘니스케이트를 결합한 기호(🜏)를 가지고 있다. 전통적인 피부 치료에서 원소 황은 (주로 크림에) 사용되어 옴, 백선, 건선, 습진, 그리고 여드름과 같은 질환을 완화시켰다. 작용 메커니즘은 알려져 있지 않지만, 원소 황은 황산으로 서서히 산화되는데, 이것은 (아황산염의 작용을 통해) 약한 환원제이자 항균제이다.[62][63][64] 황(硫黄)의 일본어 발음인 "이오"(いおう)는 음독인 "류우오우"(リュウオウ)가 변한 것으로, 고대에는 "유와"(ゆわ)나 "유와우"(ゆわう), "유우와우"(ゆうわう)라는 발음도 사용되었다. 영어명 "sulfur"는 라틴어로 "타는 돌"을 의미하는 단어에서 유래한다(brimstone).
4. 2. 근현대

황은 1718년 화학 표에서 고정된(비산성) 알칼리 열에 나타나며,[66] 앙투안 라부아지에는 1777년 연소 실험에 황을 사용해 실험 결과를 기록했습니다.[67]
시칠리아의 황 매장지는 1세기 이상 주요 공급원이었습니다. 18세기 후반, 프랑스 마르세이유로 연간 약 2000ton의 황이 수입되어 황산 생산에 사용되었고, 이는 르블랑법에 사용되었습니다. 산업혁명 시대 영국에서는 1824년 소금 관세 폐지로 시칠리아산 황 수요가 급증했습니다. 증가하는 영국의 시칠리아 광산, 정제 및 운송에 대한 통제와 착취, 그리고 수익성 있는 수출이 시칠리아의 후진적이고 빈곤한 경제를 변화시키지 못한 것은 1840년 황 위기로 이어졌습니다. 두 시칠리아 왕국의 페르디난도 2세는 프랑스 회사에 황 산업 독점권을 부여하여 영국과의 1816년 무역 협정을 위반했고, 결국 프랑스가 평화적인 해결책을 중재했습니다.[68][69]
1867년 루이지애나주와 텍사스주의 지하 매장지에서 원소 황이 발견되었습니다. 이 자원을 추출하기 위해 매우 성공적인 프라슈법이 개발되었습니다.[70]
18세기 후반, 가구 제작자들은 용융 황을 사용하여 장식용 상감을 만들었습니다.[71] 용융 황은 때때로 바닥에 설치된 장비 부착 지점에 높은 충격 저항이 필요한 경우 드릴로 뚫은 콘크리트 구멍에 강철 볼트를 고정하는 데 사용되었으며, 순수한 분말 황은 약용 강장제와 완하제로 사용되었습니다.[87]
접촉법의 출현 이후, 대부분의 황은 다양한 용도, 특히 비료 생산을 위한 황산 제조에 사용됩니다.[72] 최근에는 황의 주요 공급원이 석유와 천연가스가 되었습니다. 이는 산성비를 방지하기 위해 연료에서 황을 제거해야 할 필요성 때문이며, 이로 인해 황이 과잉 생산되었습니다.[6]
4. 3. 현대
황은 1718년 화학 표에서 고정된(비산성) 알칼리 열에 나타납니다.[66] 1777년 앙투안 라부아지에는 연소 실험에 황을 사용하며 일부 실험 결과를 기록했습니다.[67]
시칠리아는 1세기 이상 황의 주요 공급원이었습니다. 18세기 후반, 프랑스 마르세이유에서는 연간 약 2000ton의 황을 수입하여 황산 생산에 사용했고, 이는 르블랑법에 사용되었습니다. 산업혁명 시대 영국에서는 1824년 소금 관세 폐지로 시칠리아산 황 수요가 급증했습니다. 영국의 시칠리아 광산, 정제, 운송에 대한 통제 및 착취와 시칠리아의 낙후되고 빈곤한 경제 상황은 1840년 황 위기로 이어졌습니다. 두 시칠리아 왕국의 페르디난도 2세는 프랑스 회사에 황 산업 독점권을 부여하여 영국과의 1816년 무역 협정을 위반했고, 결국 프랑스의 중재로 평화적인 해결책을 찾았습니다.[68][69]
1867년 루이지애나주와 텍사스주의 지하 매장지에서 원소 황이 발견되었습니다. 이 자원을 추출하기 위해 매우 성공적인 프라슈법이 개발되었습니다.[70]
18세기 후반, 가구 제작자들은 용융 황을 사용해 장식용 상감을 만들었습니다.[71] 용융 황은 높은 충격 저항이 필요한 장비 부착 지점에 강철 볼트를 고정하기 위해 콘크리트 구멍에 사용되기도 했습니다. 순수한 분말 황은 약용 강장제와 완하제로 사용되었습니다.[87]
접촉법의 등장 이후, 대부분의 황은 다양한 용도로 사용되며, 특히 비료 생산을 위한 황산 제조에 사용됩니다.[72]
최근 황의 주요 공급원은 석유와 천연가스입니다. 산성비를 방지하기 위해 연료에서 황을 제거해야 했고, 이로 인해 황이 과잉 생산되었습니다.[6]
4. 4. 한국의 황 역사
쇼와 20년대 한국 전쟁 때 유황 가격이 급등하여 '노란 다이아몬드'라고 불릴 정도였다.5. 생산
황은 원소 상태로 발견되기도 하며, 역사적으로 이런 형태로 많이 채취되었다. 황철석 또한 황의 주요 공급원이었다.[78] 과거 시칠리아의 화산 지대에서는 지표면에서 황이 발견되어 "시칠리아 공정"이 사용되었다. 이 방법은 경사진 언덕에 벽돌 가마를 설치하고 황 광석을 쌓은 뒤, 일부 황을 태워 녹아내리게 하는 방식이었다. 그러나 지표면 광석이 고갈되면서 점차 지하 광맥을 채굴하는 방식으로 전환되었고, 이는 매우 노동 집약적이고 위험한 작업이었다.[79] 부커 T. 워싱턴은 시칠리아 황 광산의 열악한 환경을 "이 세상에서 내가 볼 수 있는 지옥과 가장 가까운 곳"이라고 묘사할 정도였다.[79] 인도네시아와 같은 화산 지대에서는 여전히 지표면에서 황을 채굴하고 있으며, 작업 환경 문제는 여전히 심각하다.[80]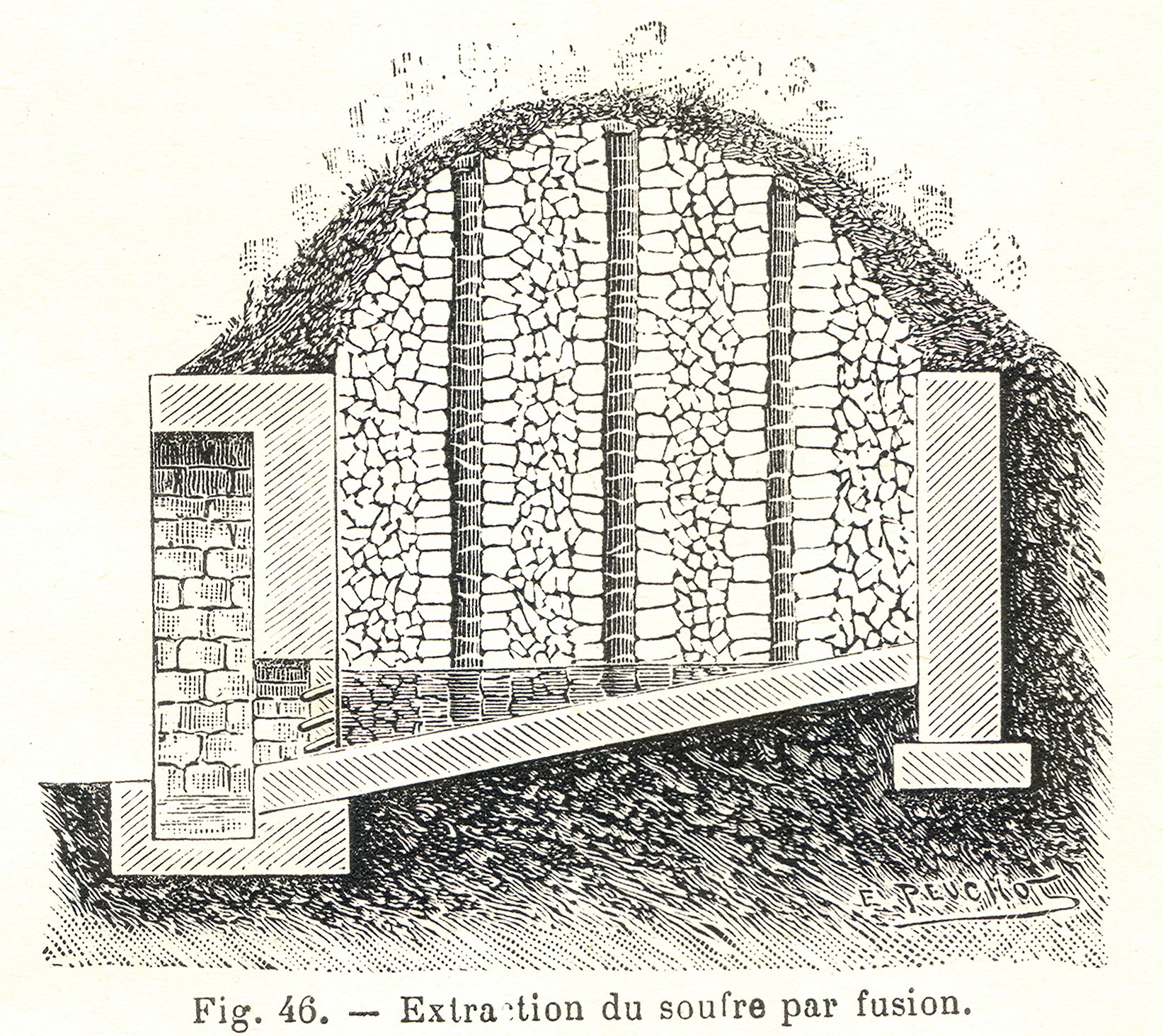

과거에는 소금 돔에서 원소 황을 추출하기도 했지만, 20세기 후반부터는 석유 정제와 같은 산업 공정의 부산물로 황을 얻는 방식이 주를 이루게 되었다. 소금 돔 아래의 천연 황은 황산염 퇴적물에 혐기성 박테리아가 작용하여 생성된 것으로, 프라슈 공정을 통해 채굴되었다.[87] 이 방법은 과열된 물을 황 매장층에 주입하여 황을 녹인 후 압축 공기로 지표면까지 끌어올리는 방식이다. 20세기 동안 이 공정으로 순도 높은 황을 생산했지만, 매장량 제한과 높은 작업 비용으로 인해 2002년 이후로는 거의 사용되지 않고 있다.[81][82]
오늘날 황은 주로 석유, 천연가스 및 관련 화석 자원에서 황화수소 형태로 생산된다.[6] 석유 속 유기황 화합물은 수소 탈황 공정을 통해 제거되는데, 이 과정에서 황화수소가 발생한다.[81][82]
:R-S-R + 2 H2 → 2 RH + H2S
이렇게 생성된 황화수소와 천연가스에 포함된 황화수소는 클라우스 공정을 통해 원소 황으로 전환된다.[81][82]
:3 O2 + 2 H2S → 2 SO2 + 2 H2O
:SO2 + 2 H2S → 3 S + 2 H2O
아사바스카 오일 샌즈에는 황 함량이 높아, 이 과정에서 얻은 원소 황이 캐나다 알버타 주에 대량으로 저장되어 있다.[83]
2011년 세계 황 생산량은 69000000ton이었으며, 중국(9.6 Mt), 미국(8.8 Mt), 캐나다(7.1 Mt), 러시아(7.1 Mt) 등 15개국 이상이 1000000ton 이상을 생산했다.[85] 황 생산량은 1900년부터 2010년까지 꾸준히 증가했으며, 가격은 1980년대와 2010년경에 불안정한 모습을 보였다.[86]
일본의 경우, 화산 가스에 포함된 황화수소와 이산화황이 식으면서 유황이 석출되는 현상을 이용한 승화 유황(화구 유황) 채취법이 있었다. 분기공에 돌로 굴뚝을 만들고, 내부에 돌을 넣어 유황을 부착시키는 방식이었다. 유황산, 나스다케 등 활화산에서 이러한 방식으로 유황을 채굴했다.
광상에서 채굴된 유황은 제련소에서 구멍가마에 넣어 유황분을 용출시킨 후, 액체 상태의 유황을 틀에 넣어 고체로 만들어 출하했다. 구멍가마 방식은 아황산가스 발생 문제가 있어, 이후 오토클레이브를 이용해 고압 수증기로 유황을 녹여내는 방식으로 대체되었다.
플래시법은 독일 태생의 미국인 허먼 플래시가 1891년에 개발한 방법으로, 고온 고압의 물을 광상에 주입하여 유황을 액화시켜 회수한다. 미국의 텍사스주 등지에서 대량으로 채굴된다.
화구호 바닥에 침전된 유황분을 준설선을 이용해 채취하는 방법도 있었다.
현대에는 석유 정제 과정에서 탈황의 부산물로 다량의 황이 공급되고 있다(클라우스법).
5. 1. 전통적인 방법
32S는 온도가 2.5×109 K를 초과하는 깊이에서 거대한 별 내부에서 규소 하나의 원자핵과 헬륨 하나의 원자핵의 핵융합을 통해 생성된다.[34] 이 핵반응은 풍부하게 원소를 생성하는 알파 과정의 일부이기 때문에 황은 우주에서 10번째로 흔한 원소이다.[34]황은 보통 황화물 형태로 많은 종류의 운석에 존재한다. 보통 콘드라이트는 평균 2.1%의 황을 포함하고, 탄소질 콘드라이트는 최대 6.6%의 황을 포함할 수 있다. 일반적으로 트로일라이트(FeS) 형태로 존재하지만, 탄소질 콘드라이트에는 자유 황, 황산염 및 기타 황 화합물이 포함된 예외도 있다.[35] 목성의 화산 위성인 이오의 독특한 색깔은 다양한 형태의 용융, 고체, 기체 황 때문이다.[36]
황은 지구에서 질량으로 다섯 번째로 흔한 원소이다. 원소 황은 전 세계적으로, 특히 환태평양 조산대를 따라 많은 온천과 화산 지역 근처에서 발견될 수 있으며, 이러한 화산 퇴적물은 인도네시아, 칠레, 일본에서 채굴된다. 이러한 퇴적물은 다결정이며, 가장 큰 단결정의 크기는 22x16x11cm로 기록되었다.[38] 역사적으로 시칠리아는 산업혁명 당시 주요 황 생산지였다.[39] 지름이 약 200m에 이르는 용융 황 호수가 해저에서 발견되었는데, 이는 해저 화산과 관련이 있으며, 물의 끓는점이 황의 녹는점보다 높은 깊이에 있다.[40]
원시 황은 황산염 광물(예: 석고)에 작용하는 혐기성 세균에 의해 소금 돔에서 합성된다.[41][42] 소금 돔의 중요한 매장지는 멕시코만 연안과 동유럽 및 서아시아의 증발암에서 발견된다. 원시 황은 지질학적 과정만으로도 생성될 수 있다. 소금 돔에서 나온 화석 기반 황 퇴적물은 한때 미국, 러시아, 투르크메니스탄, 우크라이나에서 상업 생산의 기초가 되었다.[87]
일반적인 자연 발생 황 화합물에는 황화물 광물(예: 황철석(황화철), 진사(황화수은), 방연석(황화납), 섬아연석(황화아연), 휘안석(황화안티몬)) 및 황산염 광물(예: 석고(황산칼슘), 명반석(황산알루미늄칼륨), 중정석(황산바륨))이 포함된다. 지구에서와 마찬가지로 목성의 위성 이오에서도 원소 황은 열수 분출구를 포함한 화산 분출물에서 자연적으로 발생한다.
황은 자체적으로 발견될 수 있으며, 역사적으로 일반적으로 이 형태로 얻어졌다. 황철석 또한 황의 원천이었다.[78] 고대 시칠리아의 화산 지역에서는 지표면에서 발견되었으며, "시칠리아 공정"이 사용되었다. 경사진 언덕에 세워진 벽돌 가마에 황 매장량을 쌓아 올리고, 그 사이에 공간을 두었다. 그런 다음 일부 황을 분쇄하여 쌓인 광석 위에 뿌리고 불을 붙여 자유 황이 언덕 아래로 녹아내리게 했다. 결국 지표면의 매장량이 고갈되자 광부들은 광맥을 발굴했고, 결국 시칠리아 전역에 미궁 같은 광산이 산재하게 되었다. 채굴은 기계화되지 않고 노동 집약적이었으며, 곡괭이질을 하는 사람들이 광석을 암석에서 분리하고, 광산 소년(''카루시'')이 바구니에 광석을 담아 종종 1마일 이상의 터널을 통해 지표면으로 운반했다.
소금 돔(때때로 거의 순수한 형태로 존재하는 곳)에서 원소 황을 추출했지만, 20세기 후반에는 황이 정유와 같은 다른 산업 공정의 부산물이 되었다. 광물로서 소금 돔 아래의 천연 황은 황산염 퇴적물에 대한 혐기성 박테리아의 작용에 의해 생성된 화석 광물 자원으로 여겨진다. 이러한 소금 돔 광산에서 주로 프라슈 공정을 통해 제거되었다.[87] 이 방법에서는 과열된 물을 천연 황 매장량에 주입하여 황을 녹이고, 압축 공기를 사용하여 순도 99.5%의 녹은 제품을 지표면으로 되돌려 보냈다. 20세기 내내 이 과정은 추가 정제가 필요 없는 원소 황을 생산했다.
이후 황은 일반적으로 석유, 천연가스 및 관련 화석 자원에서 생산되며, 주로 황화수소 형태로 얻어진다.[6] 석유에서 바람직하지 않은 불순물인 유기황 화합물은 C-S 결합을 절단하는 수소화 탈황 공정을 거쳐 업그레이드될 수 있다.[81][82]
이 과정에서 생성된 황화수소와 천연가스에서 발생하는 황화수소는 일부 황화수소를 이산화황으로 산화시킨 다음 두 가지를 비례반응시키는 클라우스 공정을 통해 원소 황으로 전환된다.[81][82]
아사바스카 오일 샌즈의 황 함량이 높기 때문에 이 과정에서 얻은 원소 황이 캐나다 알버타 전역에 저장되어 있다.[83]
2011년 세계 황 생산량은 6900만 톤(Mt)에 달했으며, 15개국 이상이 1Mt 이상을 생산했다. 5Mt 이상을 생산하는 국가는 중국(9.6), 미국(8.8), 캐나다(7.1) 및 러시아(7.1)이다.[85] 생산량은 1900년부터 2010년까지 서서히 증가했으며, 가격은 1980년대와 2010년경에 불안정했다.[86]




천연에는 다수의 유황 광물(황화 광물, 황산염 광물)로서 산출된다. 단체로서도 산출된다(자연 유황). 심해에서는 열수 분출공 부근에서 철 등의 금속과 결합한 황화물이나 온천(유황 온천)에서는 유황이 승화한 유황화나, 탕화로서 콜로이드상 유황이 보여 희게 탁해 보인다.
화산 가스에는 황화 수소, 이산화 황이 포함되어 그것이 식으면 유황이 석출된다. 이것을 응용한 것이 승화 유황(화구 유황이라고도 한다)이며, 분기공에서 돌로 굴뚝을 만들고, 내부에 적절히 돌을 넣어, 이 돌에 승화한 유황을 부착시키는 채취법이었다. 가스로부터 분리되어 굴뚝 안에 고인 유황은 처음에는 액상이지만, 온도의 저하에 따라 점차 점도가 증가해 가고, 채취구에 가까워질 무렵에는 거의 고화된 상태로 고순도의 유황이 얻어졌다. 유황산, 나스다케, 메아칸다케, 구주산 등의 활화산에서는 이러한 방법으로 유황 채굴에 종사하는 광산이 산재해 있었다. 19세기의 생산 방식은 시칠리아 공정이 압도적인 주류였지만, 심각한 환경 오염 등의 문제도 있었다.
이와는 별도로, 광상으로부터 얻어지는 유황도 존재하며, 이쪽은 채굴·선광한 후, 제련소에서 구멍가마에 광석을 넣어 유황분을 용출시키고 있었다. 가마에서 추출된 유황은 액체이며, 이것을 형에 흘려 넣어 냉각시켜 원주상의 고체로 하여 출하했다. 구멍가마 방식은 아황산 가스 등이 발생하기 때문에, 나중에 오토클레이브를 사용하여 고압 수증기에 유황을 녹여내어 이것을 회수하는 방법으로 바뀌어 갔다.
단체 유황의 산출에 대해서는, 고래부터 이탈리아의 시칠리아섬이 유명하다.
독일 태생의 미국인 허먼 플래시가 1891년에 개발한, 고온 고압의 물(165 °C, 2.5~3 MPa, 액체)을 광상에 불어넣어 유황을 액화시켜 회수하는 플래시법으로, 미국의 텍사스주나 루이지애나주, 멕시코, 칠레, 남아프리카 공화국의 광산에서 대량으로 채굴된다. 꺼낸 액체를 식히면 유황이 응고한다.
이 외에, 화구호의 호저에서 유황을 채취하는 방법도 취해졌다. 이 경우는, 호상에 준설선을 띄워, 호저에 침전하고 있는 유황분을 많이 포함하는 진흙을 채취하고 있었다.
또 석유 정제의 탈황에 의한 부산물로서 다량의 유황이 공급되고 있다(클라우스법).
5. 2. 현대적인 방법
소금 돔(때때로 거의 순수한 형태로 존재하는 곳)에서 원소 황을 추출했지만, 20세기 후반에는 황이 정유와 같은 다른 산업 공정의 부산물이 되었다. 광물로서 소금 돔 아래의 천연 황은 황산염 퇴적물에 대한 혐기성 박테리아의 작용에 의해 생성된 화석 광물 자원으로 여겨진다. 이러한 소금 돔 광산에서 주로 프라슈 공정을 통해 제거되었다.[87] 이 방법에서는 과열된 물을 천연 황 매장량에 주입하여 황을 녹이고, 압축 공기를 사용하여 순도 99.5%의 녹은 제품을 지표면으로 되돌려 보냈다. 20세기 내내 이 과정은 추가 정제가 필요 없는 원소 황을 생산했다. 그러나 이러한 황 매장량이 제한적이고 작업 비용이 높기 때문에, 2002년 이후 세계 어느 곳에서도 이 채굴 공정을 사용하지 않았다.[81][82]
오늘날 황은 일반적으로 석유, 천연가스 및 관련 화석 자원에서 생산되며, 주로 황화수소 형태로 얻어진다.[6] 석유에서 바람직하지 않은 불순물인 유기황 화합물은 C-S 결합을 절단하는 수소 탈황 공정을 거친다.[81][82]
:R-S-R + 2 H2 → 2 RH + H2S
이 과정에서 생성된 황화수소와 천연가스에서 발생하는 황화수소는 일부 황화수소를 이산화황으로 산화시킨 다음 두 가지를 비례반응시키는 클라우스 공정을 통해 원소 황으로 전환된다.[81][82]
:3 O2 + 2 H2S → 2 SO2 + 2 H2O
:SO2 + 2 H2S → 3 S + 2 H2O
아사바스카 오일 샌즈의 황 함량이 높기 때문에 이 과정에서 얻은 원소 황이 캐나다 알버타 전역에 저장되어 있다.[83] 황을 저장하는 또 다른 방법은 콘크리트의 결합제로 사용하는 것인데, 그 결과 생성물은 몇 가지 바람직한 특성을 가진다(황 콘크리트 참조).[84]
2011년 세계 황 생산량은 69000000ton에 달했으며, 15개국 이상이 1000000ton 이상을 생산했다. 5000000ton 이상을 생산하는 국가는 중국(9.6), 미국(8.8), 캐나다(7.1), 러시아(7.1)이다.[85] 생산량은 1900년부터 2010년까지 서서히 증가했으며, 가격은 1980년대와 2010년경에 불안정했다.[86]
일본의 경우, 화산가스에는 황화수소와 이산화황이 포함되어 있으며, 이것이 식으면 유황이 석출된다. 이를 응용한 것이 승화유황(화구유황)이며, 분기공에서 돌로 굴뚝을 만들고 내부에 돌을 넣어 이 돌에 승화된 유황을 부착시키는 채취법이었다. 가스로부터 분리되어 굴뚝 안에 고인 유황은 처음에는 액체이지만, 온도가 내려가면서 점차 점도가 증가하고, 채취구에 가까워질 무렵에는 거의 고화된 상태로 고순도의 유황을 얻을 수 있었다. 유황산, 나스다케, 메아칸다케, 구주산 등의 활화산에서는 이러한 방법으로 유황 채굴에 종사하는 광산이 있었다.
광상에서 얻어지는 유황은 채굴·선광 후, 제련소에서 구멍가마에 광석을 넣어 유황분을 용출시켰다. 가마에서 추출된 유황은 액체이며, 이것을 형에 넣어 냉각시켜 원주형 고체로 만들어 출하했다. 구멍가마 방식은 아황산가스 등이 발생하기 때문에, 나중에 오토클레이브를 사용하여 고압 수증기에 유황을 녹여 회수하는 방법으로 바뀌었다.
독일 태생의 미국인 허먼 플래시가 1891년에 개발한 플래시법은 고온 고압의 물(165°C, 2.5~3 MPa, 액체)을 광상에 주입하여 유황을 액화시켜 회수하는 방법이다. 미국의 텍사스주나 루이지애나주, 멕시코, 칠레, 남아프리카 공화국의 광산에서 대량으로 채굴되며, 꺼낸 액체를 식히면 유황이 응고한다.
화구호의 호저에서 유황을 채취하기도 했는데, 이 경우 준설선을 호수 위에 띄워 호저에 침전된 유황분을 많이 포함하는 진흙을 채취했다.
석유 정제 과정에서 탈황의 부산물로 다량의 유황이 공급되고 있다(클라우스법).
6. 용도
황은 다양한 용도로 사용되어 온 화학 원소이다. 고대에는 표백제, 의식용 향료, 살충제, 접착제 등으로 사용되었으며, 흑색화약의 원료이기도 했다. 로마인들은 황을 불꽃놀이와 무기 제조에 사용했다.[87]
현대에는 합성섬유, 의약품, 농약, 누염제 등의 원료로 사용되며, 다양한 황화물 화합물의 구성 요소로 활용된다. 농가에서는 곶감, 말린 무화과 등의 표백제로 황을 태워 얻은 이산화 황을 사용하고, 와인의 산화 방지제로도 이용된다.
고무에 소량의 황을 첨가하여 가열하면 탄성이 증가하고, 더 많은 양을 첨가하면 경도를 높일 수 있다. 이는 가황이라고 불리는 과정으로, 가교 결합을 통해 고무의 성질을 변화시킨다. 이러한 황 첨가는 고무 타이어의 성질을 결정하는 데 중요한 역할을 한다.
실리콘검파기나 게르마늄 다이오드가 실용화되기 전에는 금속의 황화광물이 검파기의 주요 부품으로 사용되기도 했다.
황은 높은 전위를 가지기 때문에 이차 전지의 양극 활물질로도 이용된다. 나트륨-황 전지가 대표적인 예시이며, 풍력 발전소 등에서 널리 사용되고 있다. 최근에는 전고체 전지의 고체 전해질에도 황화물이 이용되어 높은 이온 전도도를 나타내며, 앞으로 리튬이온전지를 대체할 것으로 예상된다.
6. 1. 황산 제조
원소 황은 주로 다른 화학 물질의 전구체로 사용된다. 1989년 기준으로 약 85%가 황산(H2SO4)으로 전환된다.2010년 미국은 다른 어떤 무기 화학 물질보다 많은 황산을 생산했다.[86] 황산의 주요 용도는 비료 생산을 위한 인산염 광석의 추출이다. 황산의 다른 용도로는 정유, 폐수 처리 및 광물 추출이 있다.[87] 황으로부터 제조되는 황산(sulfuric acid)은 화학 공업에서 가장 중요한 산이다. 일반적으로 산으로 사용되는 것은 묽은 황산이며, 탈수제나 건조제로 사용되는 것은 진한 황산이다. 또한, 다양한 황을 포함한 화합물이 합성되고 있다.
6. 2. 비료
황은 셀로판 및 레이온 제조에 사용되는 이황화탄소 생성에 사용된다.[87] 폴리황화물 사슬이 유기 고분자를 가교결합시키는 고무의 황화 과정에도 사용된다. 다량의 아황산염은 종이 표백 및 건조 과일 보존에 사용된다. 많은 계면활성제와 세제(예: 라우릴황산나트륨)는 황산염 유도체이다. 황산칼슘인 석고(CaSO4·2H2O)는 포틀랜드 시멘트와 비료에 사용된다.[87]황은 식물 성장에 필수적인 영양소이며, 인 요구량과 같거나 넘는다. 황은 식물 성장, 콩과 식물의 뿌리혹 형성, 면역 및 방어 시스템에 중요한 역할을 한다. 황 결핍은 유럽의 많은 국가에서 광범위하게 나타나고 있다.[89][90][91] 대기 중 황 유입량이 계속 감소함에 따라, 황 비료를 사용하지 않는 한 황 유입/유출의 적자는 증가할 가능성이 높다.[92][88]
비료에 가장 중요한 황의 형태는 석고(CaSO4·2H2O) 광물로 흔히 발견되는 황산칼슘이다. 원소 황은 소수성이므로 식물이 직접 사용할 수 없다. 원소 황(ES)은 유기 황 요구량이 높은 작물의 고갈된 토양을 개량하기 위해 벤토나이트와 혼합되기도 한다. 시간이 지남에 따라 산화 비생물적 과정과 대기 산소 및 토양 박테리아는 원소 황을 산화시켜 가용성 유도체로 전환할 수 있으며, 이는 미생물과 식물이 사용할 수 있다. 황은 특히 질소와 인과 같은 다른 필수 식물 영양소의 효율을 향상시킨다.[88] 생물학적으로 생성된 황 입자는 생체 고분자 코팅으로 인해 자연적으로 친수성이며 희석된 슬러리를 분무하여 토지에 더 쉽게 분산될 수 있으므로 식물의 흡수가 더 빨라진다.
6. 3. 살균제 및 살충제

원소 황은 가장 오래된 살균제 및 살충제 중 하나이다. 분말 형태의 원소 황인 "분말 황"은 포도, 딸기, 많은 채소 및 기타 여러 작물에 대한 일반적인 살균제이다.[84] 이것은 광범위한 흰가루병 질병뿐만 아니라 검은 반점에도 효과가 좋다. 유기농 생산에서 황은 가장 중요한 살균제이다. 추운 조건에서 주요 질병인 사과 검은별무늬병에 대해 유기농으로 재배되는 사과 생산에 사용되는 유일한 살균제이다. 생물 황(친수성 특성을 가진 생물학적으로 생성된 원소 황)도 이러한 용도로 사용할 수 있다.
표준 제형의 분말 황은 황 분무기 또는 살포기를 사용하여 작물에 살포된다. 가용성 황은 물에 혼화되도록 추가 성분이 첨가된 분말 황의 상품명이다.[93] 이것은 유사한 용도로 사용되며 식물과 토양의 흰가루병 및 기타 곰팡이 관련 문제에 대한 살균제로 사용된다.
원소 황 분말은 유기농(즉, "친환경") 살충제(살비제)로서 진드기와 응애에 사용된다. 일반적인 적용 방법은 의류나 사지에 황 분말을 뿌리는 것이다.
생석회를 물 속에서 원소 황과 결합하여 만든 희석된 석회유황합제 용액은 애완동물을 담그는 데 사용되어 무좀(진균), 옴, 및 기타 피부병과 기생충을 제거한다.
거의 순수한 황으로 만들어진 황초는 구조물과 와인통을 훈증하는 데 사용되었지만, 현재는 주택에는 너무 유독하다고 여겨진다.
6. 4. 의약품
황(옥타황, S8)은 여드름 등 여러 질환 치료를 위한 피부 제제에 사용된다. 황은 각질 용해제 역할을 하며 박테리아, 곰팡이, 옴 진드기 및 기타 기생충을 죽인다.[94] 침전 황과 콜로이드 황은 로션, 크림, 분말, 비누 및 목욕 첨가제 형태로 여드름, 주사비, 지루성 피부염 치료에 사용된다.[95]많은 약물에 황이 포함되어 있다.[96] 초기 예로는 '설파제'로 알려진 항균성 설파제가 있다. 더 সাম্প্রতিক 예로는 점액 용해제인 아세틸시스테인이 있다. 황은 많은 박테리아 방어 분자의 일부이다. 베타락탐 계열의 대부분의 항생제, 페니실린, 세팔로스포린, 모노박탐 등에는 황이 포함되어 있다.[51]
6. 5. 기타
황은 많은 금속과 반응하여 다황화물 염을 생성하며, 구리, 아연, 은 등을 부식시킨다. 변색 참조. 금속 황화물은 대부분 원소들의 고온 반응으로 제조된다.[49] 지구과학자들은 암석과 퇴적물 속 금속 황화물의 동위원소를 연구하여 지구 과거 환경 조건을 연구한다.[50]황은 메탄과 직접 반응하여 이황화탄소를 생성하며, 이는 셀로판과 레이온 제조에 사용된다.[87] 원소 상태의 황은 고무의 황화 과정에 사용되어 유기 고분자를 가교결합시킨다. 다량의 아황산염은 종이를 표백하고 건조 과일을 보존하는 데 사용된다. 많은 계면활성제와 세제(예: 라우릴황산나트륨)는 황산염 유도체이다. 황산칼슘인 석고(CaSO4·2H2O)는 매년 1억ton 규모로 채굴되어 포틀랜드 시멘트와 비료에 사용된다.
티오황산나트륨과 티오황산암모늄은 은을 이용한 사진술에서 "정착제"로 널리 사용되었다. 황은 화약("흑색화약")의 구성 성분이다.
황산은 화학 공업에서 가장 중요한 산이다. 묽은 황산은 일반적으로 산으로 사용되며, 진한 황산은 탈수제나 건조제로 사용된다.
황은 고대부터 표백제, 의식용 향료, 살충제, 접착제 등 다양하게 사용되었다. 흑색화약의 원료이며, 로마인들은 황을 불꽃놀이와 무기 제조에 사용했다.
현대에는 합성섬유, 의약품과 농약, 그리고 누염제 등의 중요한 원료이며, 다양한 분야에서 황화물과 여러 가지 화합물이 구성 요소로 사용된다. 농가에서 곶감, 말린 무화과 등의 표백제로는 황을 태워 얻은 이산화황이 사용된다(훈증하여 실시). 와인의 산화방지제로도 이산화황이 사용된다. 고무에 수 %의 황을 첨가하여 가열(가황)하면 (가교에 의해) 탄성이 증가하고, 첨가량을 더 늘리면 경도를 높이는 가공이 가능해지며, 최종적으로는 에보나이트가 된다. 이 황 첨가는 고무 타이어의 성질 결정에 중요한 요소이다.
실리콘검파기나 게르마늄 다이오드가 실용화되기 전에는 금속의 황화광물이 검파기의 주요 부품으로 중요하게 사용되었다.
황은 높은 전위를 나타내기 때문에 이차전지의 양극 활물질로도 이용되고 있다. 대표적인 예로 나트륨-황 전지가 풍력발전소 등에서 널리 이용되고 있다. 최근에는 전고체전지의 고체 전해질에도 황화물이 이용되고 있다. 이 황화물계 고체 전해질은 높은 이온 전도도를 나타내며, 앞으로 전고체전지가 리튬이온전지를 대체하여 큰 수요가 예상된다.
6. 6. 전지
높은 에너지 밀도와 황의 풍부한 매장량으로 인해 리튬-황 전지 연구가 계속되고 있다. 지금까지 탄산염 전해질은 단 한 번의 충전 후에도 이러한 전지의 고장을 일으켰다. 2022년 2월, 드렉셀 대학교 연구원들은 4000회의 충전 사이클을 견딘 시제품 배터리를 만들었을 뿐만 아니라 95도 이하에서 안정적인 상태를 유지하는 최초의 단사정계 감마 황을 발견했다.[97]황은 높은 전위를 나타내기 때문에 이차 전지의 양극 활물질로도 이용되고 있다. 대표적인 예로 나트륨-황 전지가 풍력발전소 등에서 널리 이용되고 있다. 최근에는 전고체 전지의 고체 전해질에도 황화물이 이용되고 있다. 이 황화물계 고체 전해질은 높은 이온 전도도를 나타내며, 앞으로 전고체 전지가 리튬이온전지를 대체하여 큰 수요가 예상된다.
7. 생물학적 역할
황은 모든 생명체 세포의 필수 구성 요소이며, 인체에서 무게 기준으로 8번째로 풍부한 원소이다.[98] 칼륨과 거의 비슷하고 나트륨과 염소보다 약간 더 많다.[99] 70kg의 인체에는 약 140g의 황이 포함되어 있다.[100]
1880년대, 세르게이 위노그라드스키는 ''베기아토아속'' 세균이 황화수소(H2S)를 산화시켜 에너지를 얻는다는 사실을 발견했다.[103] 로버트 발라드는 심해 열수 분출공 주변의 원시 박테리아가 황화수소를 산화시켜 영양분을 얻는다는 것을 발견했다.[7]
황 산화 박테리아는 황화수소, 원소 황, 아황산염, 티오황산염 등 다양한 황 화합물을 에너지원으로 사용하며, 황 산화효소와 아황산염 산화효소를 이용해 황을 황산염으로 산화시킨다.[105] 일부 암석영양생물은 화학합성을 통해 황 화합물의 에너지를 이용해 당을 생산한다. 녹색 황세균과 보라색 황세균은 광합성과 화학합성을 결합하며,[106] 거대관벌레와 같은 유기체는 황 산화 박테리아와 공생 관계를 맺기도 한다.[107]
반대로 황산염 환원 박테리아는 산소 대신 황산염을 "흡입"하여 유기 화합물이나 수소를 에너지원으로 사용하고, 황을 전자 수용체로 사용하여 황화수소로 환원시킨다. 고대 해양 바닥의 천연 황 매장량은 생물학적 기원을 가질 수 있다.[108][109][110]
황은 식물의 뿌리를 통해 황산염으로 흡수되어 시스테인 등 유기 황 화합물로 통합된다.[111] 식물은 먹이 사슬을 통해 동물에게 황을 전달하며, 황 박테리아의 역할은 최근 연구되고 있다.[112][113] 황화합물은 비타민 B1과 비오틴(비타민 B7)에도 포함되어 있다.
7. 1. 필수 원소
미네랄로서의 황은 동물에게서 생물학적으로 2종류의 결합 아미노산이 알려져 있다. 황아미노산인 시스테인과 메티오닌은 황을 미네랄로 포함한 아미노산으로, 셀레늄을 함유한 셀레노시스테인과 함께 미네랄을 성분으로 하는 특수한 형태의 아미노산으로 알려져 있다. 이 중 메티오닌은 필수아미노산이다. 황은 모든 생명체 세포의 필수 구성 요소이다. 인체에서 무게 기준으로 8번째로 풍부한 원소이며,[98] 칼륨과 거의 비슷하고 나트륨과 염소보다 약간 많다.[99] 70kg의 인체에는 약 140g의 황이 포함되어 있다.[100] 사람의 주요 황 섭취원은 식물성 및 동물성 단백질에 함유된 황 함유 아미노산이다.[101][102]메티오닌은 사람에게 필수 아미노산이며, 시스테인은 조건부 필수 아미노산으로 비필수 아미노산인 세린으로부터 합성될 수 있다(이 경우 황 공여체는 메티오닌임). 일반적인 상황에서는 식이 결핍이 드물게 발생한다. 인공적인 메티오닌 결핍은 암 치료에 적용하려는 시도가 있지만,[128] 그 방법은 여전히 위험성이 있다.[129]
분리된 아황산 산화효소 결핍증은 드물지만 치명적인 유전 질환으로, 아황산염을 황산염으로 대사하는 데 필요한 아황산 산화효소의 생성을 방해한다.[130] 황화합물은 생물에서도 필수적인 역할을 한다. 비타민 B1과 비오틴(비타민 B7)에 포함되어 있다.
식물의 뿌리에서는 황이 황산이온 형태로 흡수되어 환원되고, 최종적으로 황화수소가 된 후 시스테인 및 기타 유기 화합물에 흡수된다.
아미노산에서는 시스테인과 메티오닌이 황을 포함하고 있으며, 이들은 더 나아가 펩타이드·단백질에 흡수된다. 그 밖의 함황 아미노산으로는 호모시스테인과 타우린이 있으며, 이들은 펩타이드·단백질에는 흡수되지 않지만 대사적으로 중요하다.
단백질의 시스테인 잔기의 티올기는 시스테인 프로테아제 등의 활성 중심으로 기능한다. 또한 한 쌍의 시스테인 잔기 사이에 이황화 결합(S-S 결합)이 형성되어 단백질의 고차 구조(3차 구조·4차 구조) 형성 및 유지에 중요하다. 대표적인 예로, 깃털이나 모발이 기계적·화학적으로 강한 것은 주요 단백질 케라틴에 다수의 S-S 결합이 포함되어 있기 때문이다. 이들을 태울 때 나는 특유의 냄새나 삶은 달걀의 냄새도 주로 황화합물에 의한 것이다.
황을 포함하는 저분자 펩타이드 중 특히 중요한 것은 글루타티온으로, 세포 내에서 그 티올기를 통해 환원제로서 또는 해독 대사에 작용한다. 또한 아실기와 관련된 많은 반응은, 예를 들어 보효소 A, α-리포산 등의 티올기를 포함하는 보결 분자를 필요로 한다.
일부 광합성·화학합성 세균에서는 황화수소가 물 대신 전자 공여체로 사용된다. 많은 생물의 전자 전달계에서 황과 철로 이루어진 철-황 클러스터가 작용한다(페레독신 등). 또한 호흡 사슬의 시토크롬 c 산화효소의 구리 중심 CuA에도 포함되어 있다.
7. 2. 황 순환
황에는 23개의 동위원소가 알려져 있으며, 그중 4개는 안정 동위원소이다: 32S (94.99%), 33S (0.75%), 34S (4.25%), 그리고 36S (0.01%).[24][25] 35S(반감기 87일)을 제외한 황의 방사성 동위원소는 반감기가 3시간 미만이다.32S의 압도적인 비율은 폭발하는 별에서 일어나는 알파 과정(주요 핵융합 반응 중 하나)에서 생성되기 때문이다. 다른 안정적인 황 동위원소는 34Ar과 관련된 우회 과정에서 생성되며, 그 구성은 항성 폭발의 유형에 따라 달라진다. 예를 들어, 초신성보다 신성에서 33S가 더 많이 생성된다.[26]지구상에서 황 동위원소 조성은 태양에 의해 결정되었다. 서로 다른 황 동위원소의 분포가 거의 동일할 것이라고 가정했지만, 가장 풍부한 두 황 동위원소인 32S와 34S의 비율이 서로 다른 샘플에서 다르다는 것이 밝혀졌다. 샘플에서 동위원소 비율 (δ34S) 분석은 그 화학적 역사를 시사하며, 다른 방법의 지원을 받아 샘플의 연대 측정, 광석과 물 사이의 평형 온도 추정, pH와 산소 퓨가시티 결정, 샘플 형성 당시 황산염 환원 박테리아의 활동 확인 또는 생태계에서 황의 주요 공급원 제시가 가능하다.[27] 그러나 δ34S 변화의 실제 원인, 즉 생물 활동 또는 퇴적 후 변화에 대한 논의는 계속되고 있다.[28]
예를 들어, 황화물 광물이 침전될 때 고체와 액체 사이의 동위원소 평형은 공유 광물의 δ34S 값에 약간의 차이를 야기할 수 있다. 광물 간의 차이는 평형 온도를 추정하는 데 사용될 수 있다. 공존하는 탄산염 광물과 황화물의 δ13C와 δ34S는 광석 형성 중 광석 함유 유체의 pH와 산소 퓨가시티를 결정하는 데 사용될 수 있다.
과학자들은 암석과 퇴적물의 광물에 대한 황 동위원소를 측정하여 과거 해양의 산화환원 조건을 연구한다. 해양 퇴적물 속의 황산염 환원 박테리아는 황산염을 흡수하고 황화물을 생성함에 따라 황 동위원소를 분획한다. 2010년대 이전에는 황산염 환원이 최대 46 퍼밀까지 황 동위원소를 분획할 수 있다고 생각되었으며,[29] 퇴적물에 기록된 46 퍼밀보다 큰 분획은 퇴적물 내 황 화합물의 불균등화 때문일 것이라고 생각했다. 2010년대 이후로 황산염 환원 박테리아가 66 퍼밀까지 분획할 수 있다는 실험 결과가 나오면서 이러한 견해는 바뀌었다.[30] 불균등화의 기질은 황산염 환원 생성물에 의해 제한되므로, 불균등화의 동위원소 효과는 대부분의 퇴적 환경에서 16 퍼밀 미만이어야 한다.[31]
숲 생태계에서는 황산염이 대부분 대기에서 유래하며, 광석 광물과 증발암의 풍화 작용이 일부 황을 제공한다. 독특한 동위원소 조성을 가진 황은 오염원을 식별하는 데 사용되었으며, 풍부한 황은 수문학적 연구에서 추적자로 추가되었다. 생태계 구성 요소의 34S에 충분한 변화가 있는 시스템에서는 자연적 풍부도의 차이를 사용할 수 있다. 황산염의 대기 공급원이 지배적인 것으로 여겨지는 록키 산맥 호수는 황산염의 유역 공급원이 지배적인 것으로 여겨지는 호수와 측정 가능하게 다른 34S 값을 가지고 있는 것으로 밝혀졌다.
방사성 35S는 대기 40Ar의 우주선 파쇄에서 생성된다. 이 사실은 다양한 물질에서 최근(최대 1년) 대기 퇴적물의 존재를 확인하는 데 사용될 수 있다. 이 동위원소는 다양한 방법으로 인공적으로 얻을 수 있다. 실제로, 35Cl + n → 35S + p 반응은 염화칼륨에 중성자를 조사하여 사용된다.[32] 35S 동위원소는 다양한 황 함유 화합물에서 많은 생물학적 연구(예: 허시-체이스 실험)를 위한 방사성 추적자로 사용된다.35S의 약한 베타 활동으로 인해, 그것의 화합물은 섭취되거나 몸에 흡수되지 않는 한 비교적 안전하다.[33]
1880년대, 세르게이 위노그라드스키는 황이 풍부한 환경에 서식하는 세균인 ''베기아토아속''을 연구하면서 황화수소(H2S)를 에너지원으로 산화시켜 세포 내에 황 방울을 형성한다는 사실을 발견했다. 위노그라드스키는 이러한 대사 형태를 무기산화(무기 화합물의 산화)라고 불렀다.[103] 이 연구를 계속해서 진행한 또 다른 기여자는 셀만 왁스만이다.[104] 로버트 발라드가 발견했듯이 심해 화산 분출공 주변에 서식하는 원시 박테리아는 영양분으로 황화수소를 산화시킨다.[7]
황 산화 박테리아는 황화수소, 원소 황, 아황산염, 티오황산염, 그리고 다양한 폴리티온산염(예: 테트라티온산염)을 포함한 환원된 황 화합물을 에너지원으로 사용할 수 있다.[105] 이들은 황 산화효소와 아황산염 산화효소와 같은 효소에 의존하여 황을 황산염으로 산화시킨다. 일부 암석영양생물은 황 화합물에 포함된 에너지를 사용하여 설탕을 생산할 수도 있는데, 이 과정을 화학합성이라고 한다. 일부 세균과 고균은 화학합성에서 물 대신 황화수소를 전자 공여체로 사용하는데, 이는 설탕을 생성하고 산소를 전자 수용체로 사용하는 광합성과 유사한 과정이다.
녹색 황세균과 보라색 황세균은 광합성과 화학합성, 이 두 가지 영양 방식을 결합한다.[106] 또한 황 산화 박테리아는 더 큰 유기체와 공생 관계를 맺을 수 있으며, 이를 통해 더 큰 유기체는 황화수소를 산화시켜 영양분으로 사용할 수 있다. 예를 들어 거대관벌레가 있다.[107]
반대로 황산염 환원 박테리아는 산소 대신 황산염을 "흡입"한다. 이들은 에너지원으로 유기 화합물이나 분자 수소를 사용한다. 이들은 황을 전자 수용체로 사용하고 다양한 산화된 황 화합물을 황화물, 특히 황화수소로 환원시킨다. 이들은 다른 부분적으로 산화된 황 화합물(예: 티오황산염, 티온산염, 폴리황화물, 아황산염)에서도 성장할 수 있다.
고대 해양의 바닥이었던 많은 곳에서 발견되는 천연 황의 매장량이 생물학적 기원을 가지고 있다는 연구 결과가 있다.[108][109][110] 이러한 연구는 이 천연 황이 생물 활동을 통해 얻어졌음을 시사하지만, 그 원인이 황 산화 박테리아인지 황산염 환원 박테리아인지는 아직 확실하지 않다.
황은 식물의 뿌리를 통해 토양으로부터 황산염으로 흡수되어 인산 에스터로 운반된다. 황산염은 시스테인 및 기타 유기 황 화합물에 통합되기 전에 아황산염을 통해 황화물로 환원된다.[111]
식물이 먹이 사슬을 통해 동물에게 황을 전달하는 역할은 어느 정도 이해되고 있지만, 황 박테리아의 역할은 이제 막 조사되기 시작했다.[112][113]
갯내음에서 알 수 있듯이, 바다의 미생물이 분해되어 디메틸설파이드나 황산 이온 등이 되어 대기 중으로 이동하는 것이 알려져 있다. 기상과도 관련이 있으며, 구름의 핵이 되어 비와 함께 지상에 내려와 바다와 육지의 미생물이나 식물 등의 생물로 순환하는 것으로 생각된다.
7. 3. 단백질 구조
미네랄로서 황은 동물에게서 생물학적으로 2종류의 결합 아미노산이 알려져 있다. 황아미노산인 시스테인과 메티오닌은 황을 미네랄로 포함한 아미노산으로 셀레늄을 함유한 셀레노시스테인과 함께 미네랄을 성분으로 하는 특수한 형태의 아미노산으로 알려져 있다. 이 중 메티오닌은 필수아미노산이다.모든 생명체에서 대부분의 황은 두 가지 단백질 생성 아미노산(시스테인, 메티오닌)에 포함되어 있다. 따라서 이러한 아미노산을 포함하는 모든 단백질과 해당 펩타이드에도 황 원소가 존재한다.[114]
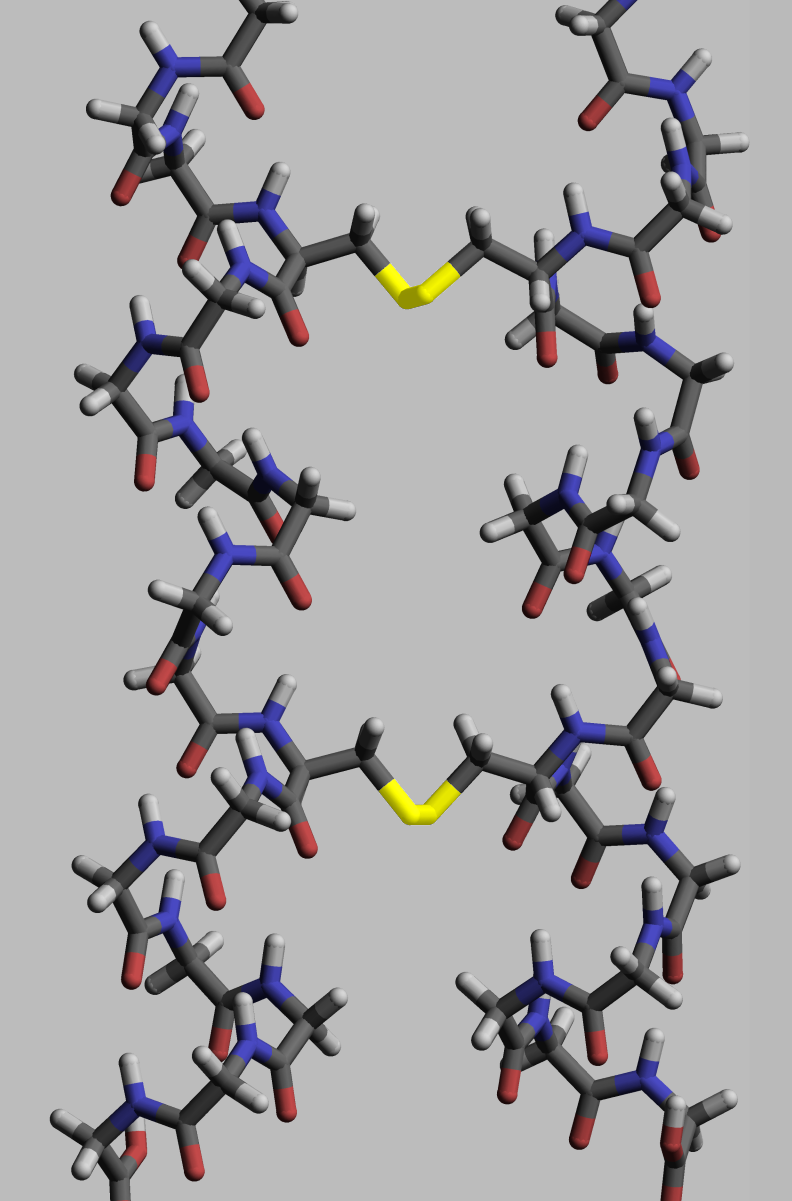
단백질은 생물학적 기능을 수행하기 위해 특정 공간 기하학적 구조를 가져야 한다. 이러한 구조 형성은 단백질 접힘이라는 과정을 통해 이루어지며, 분자 내 및 분자 간 결합에 의해 제공된다. 이 과정은 여러 단계를 거치는데, 초기 단계에서는 폴리펩타이드 사슬이 수소 결합으로 접히지만, 후기 단계에서는 사슬의 서로 다른 부분에 있는 두 개의 시스테인 잔기의 두 황 원자 사이의 공유 결합(이황화 결합)과 두 개의 분리된 단백질 소단위체에 있는 두 개의 시스테인 잔기 사이의 공유 결합에 의해 접힘이 이루어진다(3차 단백질 구조 및 4차 단백질 구조). 이 두 구조는 인슐린에서 쉽게 관찰할 수 있다. 공유 이황화 결합의 결합 에너지는 배위 결합이나 소수성 상호 작용의 에너지보다 높기 때문에, 이황화 결합 함량이 높을수록 단백질 변성에 필요한 에너지가 높아진다. 일반적으로 이황화 결합은 세포 외부에서 기능하는 단백질에 필요하며, 단백질의 구조(기하학적 구조)를 변경하지 않고 안정제 역할을 한다.[115] 세포질 내에서 단백질의 시스테인 잔기는 티오레독신에 의해 환원 상태(-SH 형태)로 유지된다.[116]
이러한 특성은 다음 예에서 나타난다. 리소자임은 약물로 사용될 만큼 충분히 안정적이다.[117] 깃털과 머리카락은 상대적으로 강도가 높으며, 이를 구성하는 케라틴은 대부분의 생물체가 소화할 수 없다. 그러나 케라티나제를 포함하는 균류와 박테리아는 케라틴을 파괴할 수 있다.
아미노산에서는 시스테인과 메티오닌이 황을 포함하고 있으며, 이들은 더 나아가 펩타이드·단백질에 흡수된다. 그 밖의 함황 아미노산으로는 호모시스테인과 타우린이 있으며, 이들은 펩타이드·단백질에는 흡수되지 않지만 대사적으로 중요하다.
단백질의 시스테인 잔기의 티올기는 시스테인 프로테아제 등의 활성 중심으로 기능한다. 또한 한 쌍의 시스테인 잔기 사이에 이황화 결합(S-S 결합)이 형성되어 단백질의 고차 구조(3차 구조, 4차 구조) 형성 및 유지에 중요하다. 대표적인 예로, 깃털이나 모발이 기계적·화학적으로 강한 것은 주요 단백질 케라틴에 다수의 S-S 결합이 포함되어 있기 때문이다.
7. 4. 효소 활성
금속단백질은 활성 부위가 전이 금속 이온(또는 금속-황화물 클러스터)이고, 종종 시스테인 잔기의 황 원자에 배위되어 있는 단백질이다.[124] 이들은 전자 전달 과정에 관여하는 효소의 필수 구성 요소이다. 예로는 플라스토시아닌(Cu2+)과 아산화질소 환원효소(Cu–S)가 있다. 이러한 효소의 기능은 전이 금속 이온이 산화환원 반응을 일으킬 수 있다는 사실에 의존한다. 다른 예로는 많은 아연 단백질[125]과 철-황 클러스터가 있다. 가장 널리 퍼져 있는 것은 세포 내에서 전자 운반체 역할을 하는 페레독신이다. 박테리아에서 중요한 질소 고정효소는 Fe–Mo–S 클러스터를 포함하고 있으며, 대기 중 질소를 암모니아로 전환하는 중요한 기능을 수행하는 촉매이다. 미생물과 식물은 이 암모니아를 이용하여 단백질, DNA, RNA, 알칼로이드 및 생명에 필요한 다른 유기 질소 화합물을 만든다.[126]황은 몰리브덴 보조인자에도 존재한다.[127]
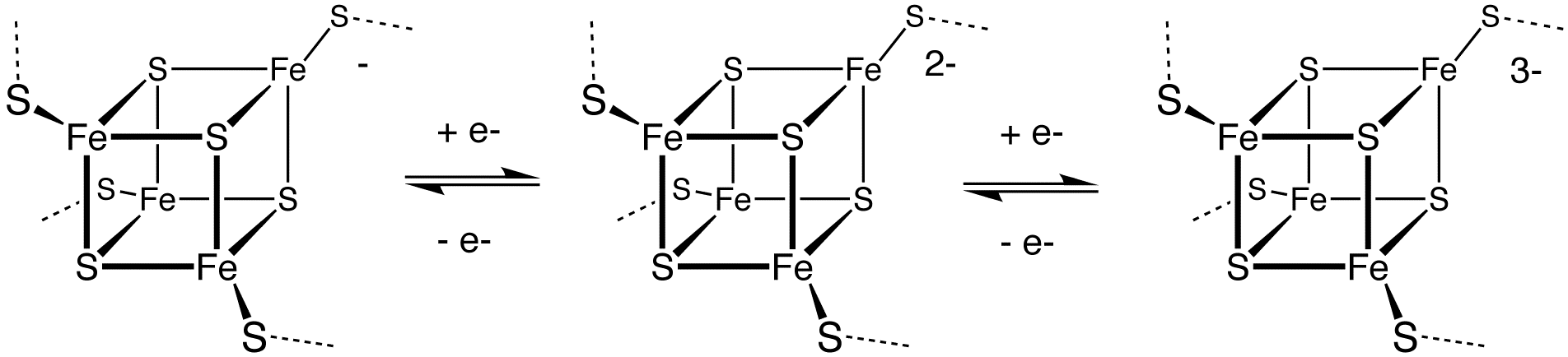
단백질의 시스테인 잔기의 티올기는 시스테인 프로테아제 등의 활성 중심으로 기능한다. 또한 한 쌍의 시스테인 잔기 사이에 이황화 결합(S-S 결합)이 형성되어 단백질의 고차 구조(3차 구조·4차 구조) 형성 및 유지에 중요하다.
8. 환경 문제 및 안전성
원소 상태의 황은 피부를 통해 흡수되는 양이 매우 적고 인체에 대한 독성이 낮지만, 황 분진을 흡입하거나 눈이나 피부에 접촉하면 자극을 받을 수 있다. 과도한 황 섭취는 작열감이나 설사를 유발할 수 있으며,[133] 민간요법으로 황을 의도적으로 섭취한 후 생명을 위협하는 대사성 산증이 발생한 사례가 보고되었다.[134][135]
8. 1. 산성비
황의 연소를 통해 얻어지는 두 가지 주요 황 산화물은 다음과 같다.황이 풍부한 산화물에는 일산화 황, 일황화이황, 이황화이산화황 등이 포함되며, 과산화기를 포함하는 고급 산화물도 관찰된다.
8. 2. 황화수소의 독성
황화수소는 청산화수소의 약 절반 정도의 독성을 가지고 있으며, 동일한 메커니즘(호흡 효소 시토크롬 옥시다제의 억제)을 통해 중독을 일으킨다.[140] 하지만 황화수소는 불쾌한 냄새 때문에 소량 흡입(허용 노출 한계(PEL) 20ppm 근처)으로 인한 갑작스러운 중독을 일으킬 가능성이 낮다.[141] 그러나 100~150ppm 이상의 농도로 주변 공기에 존재하면 후각이 빠르게 마비되고,[142] 심각한 증상으로 사망에 이르기 전까지는 피해자가 농도를 인지하지 못하고 점점 더 많은 양을 흡입할 수 있다. 용해된 황화물과 수소황화물 염은 동일한 메커니즘을 통해 독성을 나타낸다.8. 3. 황 분진
원소 상태의 황은 피부를 통해 흡수되는 양이 매우 적고 인체에 대한 독성이 낮지만, 황 분진을 흡입하거나 눈이나 피부에 접촉하면 자극을 받을 수 있다. 과도한 황 섭취는 작열감이나 설사를 유발할 수 있으며,[133] 민간요법으로 황을 의도적으로 섭취한 후 생명을 위협하는 대사성 산증이 발생한 사례가 보고되었다.[134][135]참조
[1]
서적
Selected Values of the Crystallographic Properties of Elements
ASM International
2018
[2]
서적
CRC Handbook of Chemistry and Physics
https://web.archive.[...]
CRC Press
[3]
서적
CRC, Handbook of Chemistry and Physics
Chemical Rubber Company Publishing
[4]
웹사이트
Sulfur History
http://www.georgiagu[...]
Georgiagulfsulfur.com
2022-02-12
[5]
백과사전
[6]
웹사이트
Sulphur surplus: Up to our necks in a diabolical element
https://www.bbc.com/[...]
BBC
2014-07-19
[7]
웹사이트
Sulfur
https://www.bbc.co.u[...]
BBC
2014-10-11
[8]
학술지
Refinement of the structure of orthorhombic sulfur, α-S8
http://journals.iucr[...]
1987-12-15
[9]
웹사이트
Sulfur {{!}} S (Element) - PubChem
https://pubchem.ncbi[...]
2024-04-15
[10]
서적
[11]
서적
The Properties of Gases and Liquids 5E
https://books.google[...]
McGraw Hill Professional
2000-11-27
[12]
웹사이트
7.5: Changes of State
https://chem.librete[...]
2013-10-03
[13]
학술지
Physical properties of sulfur near the polymerization transition
https://pubmed.ncbi.[...]
2004-10-15
[14]
학술지
Physical and chemical characteristics of active sulfur flows observed at Lastarria volcano (northern Chile) in January 2019
2023
[15]
학술지
Notes on the Sublimation of Sulfur between 25° and 50°C
https://pubs.acs.org[...]
1929-01-01
[16]
학술지
Hydrolysis of Elemental Sulphur in Water and its Effect on the Corrosion of Mild Steel
https://www.tandfonl[...]
1982-01-01
[17]
학술지
The synthesis of iridium disulfide and nickel diarsenide having the pyrite structure
https://htracyhall.o[...]
1968-02
[18]
서적
Inorganic Chemistry
https://books.google[...]
Academic Press
[19]
서적
Solid Sulfur Allotropes Sulfur Allotropes
2003
[20]
서적
Inorganic Ring Systems
1982
[21]
학술지
Composition of Elemental Sulfur in Solution: Equilibrium of {{chem|S|6}}, S7, and S8 at Ambient Temperatures
1982
[22]
학술지
Solid Allotropes of Sulfur
1964
[23]
학술지
Elemental sulfur
1976
[24]
웹사이트
Sulfur
http://www.ciaaw.org[...]
[25]
서적
[26]
웹사이트
Searching for the Origins of Presolar Grains
https://www.energy.g[...]
[27]
서적
Geologic Time Scale
[28]
웹사이트
NASA Astrobiology
https://astrobiology[...]
[29]
학술지
Mechanisms of sulfur incorporation and isotope fractionation during early diagenesis in sediments of the gulf of California
https://linkinghub.e[...]
1980-04
[30]
학술지
Large Sulfur Isotope Fractionation Does Not Require Disproportionation
https://www.science.[...]
2011-07
[31]
학술지
Estimating the effect of elemental sulfur disproportionation on the sulfur-isotope signatures in sediments
https://linkinghub.e[...]
2023-08
[32]
학회
Production of Sulfur-35 by the Cation Exchange Process
https://www.osti.gov[...]
2005-07-01
[33]
웹사이트
Sulfur-35 (35 S) safety information and specific handling precautions
https://ehs.yale.edu[...]
[34]
학술지
Stellar Evolution, Nuclear Astrophysics, and Nucleogenesis
https://fas.org/sgp/[...]
1957
[35]
서적
Meteorites
https://archive.org/[...]
John Wiley & Sons
1962
[36]
논문
Io after Galileo
2005
[37]
웹사이트
NASA's Curiosity rover makes its 'most unexpected' find on Mars
https://www.cnn.com/[...]
2024-07-20
[38]
논문
The largest crystals
http://www.minsocam.[...]
1981
[39]
서적
Sulfur: history, technology, applications & industry
ChemTec
2007
[40]
서적
Volcanic Lakes
Springer
[41]
서적
Manual of Mineralogy
Wiley
[42]
웹사이트
Sulphur: Mineral information, data and localities
https://www.mindat.o[...]
[43]
서적
Inorganic Chemistry, Fifth Edition
W. H. Freeman and Company
[44]
논문
Conducting linear chains of sulphur inside carbon nanotubes
[45]
서적
Handbook of Preparative Inorganic Chemistry
Academic Press
[46]
서적
Chemistry of the Elements
Butterworth-Heinemann
[47]
간행물
1,1,1-Trifluoroheptane
[48]
간행물
Sulfur Halides
[49]
서적
Mineral Chemistry of Metal Sulfides
Cambridge University Press
[50]
논문
Microbial Life Deep Under the Seafloor—A Story of Not Giving Up
2020-05-29
[51]
서적
An Introduction to Organosulfur Chemistry
John Wiley and Sons
1996
[52]
논문
Isotopic abundances in interstellar carbon monosulfide
1976-03-15
[53]
서적
Detection of Biological Agents for the Prevention of Bioterrorism
2011
[54]
웹사이트
Sulfur in the Bible (14 instances)
https://bible.knowin[...]
[55]
서적
Archaeomineralogy
https://books.google[...]
Springer
2009-02-04
[56]
웹사이트
Odyssey, book 22, lines 480–495
https://www.perseus.[...]
2012-08-16
[57]
서적
Pliny the Elder on science and technology
Oxford University Press
[58]
논문
The History of Science Society: Ancient Chinese Sulfur Manufacturing Processes
1986
[59]
서적
Science and Civilisation in China, Volume 5: Chemistry and Chemical Technology, Part 6, Military Technology: Missiles and Sieges
Cambridge University Press
[60]
서적
The book of signs : which contains all manner of symbols used from the earliest times to the Middle Ages by primitive peoples and early Christians
Dover Publications
1955
[61]
서적
The Alchemical Body — Siddha Traditions in Medieval India
University of Chicago Press
1996
[62]
논문
Sulfur revisited
1988
[63]
논문
Sulfur revisited
1990
[64]
논문
The use of sulfur in dermatology
2004
[65]
논문
The Use of Sulfur in Dermatology
https://pubmed.ncbi.[...]
2004-07-08
[66]
서적
Antoine Lavoisier: Science, Administration and Revolution
https://books.google[...]
Cambridge University Press
[67]
서적
Lavoisier: Chemist, Biologist, Economist
https://books.google[...]
University of Pennsylvania Press
[68]
서적
Sicily and the Unification of Italy: Liberal Policy and Local Power, 1859–1866
https://books.google[...]
Oxford University Press
1998
[69]
논문
Prelude to the Sulphur War of 1840: The Neapolitan Perspective
1995-04
[70]
논문
Chemiker, Techniker, Unternehmer: Zum 150. Geburtstag von Hermann Frasch
2001
[71]
논문
Pennsylvania German sulfur-inlaid furniture: characterization, reproduction, and ageing phenomena of the inlays
[72]
서적
Industrial minerals & rocks: commodities, markets, and uses
Littleton
2006
[73]
OED
Sulphur
[74]
논문
So long sulphur
2009-08-04
[75]
서적
Nomenclature of Inorganic Chemistry, (Recommendations 1990)
Blackwell Scientific Publications
1990
[76]
논문
Journal style update
1991
[77]
웹사이트
sulphur – definition of sulphur in English
https://en.oxforddic[...]
2016-11-19
[78]
서적
Kent and Riegel's Handbook of Industrial Chemistry and Biotechnology
Springer
2007
[79]
서적
The Man Farthest Down: A Record of Observation and Study in Europe
https://archive.org/[...]
Doubleday, Page.
[80]
논문
The Men Who Mine Volcanos
https://www.theatlan[...]
2015-02-26
[81]
논문
Recovery of sulfur from sour acid gas: A review of the technology
2002
[82]
논문
Der Claus-Prozess. Reich an Jahren und bedeutender denn je
2008
[83]
서적
Sulfur: New Sources and Uses
1982
[84]
서적
Sulfur concrete for the construction industry: a sustainable development approach
https://books.google[...]
J. Ross
2010
[85]
간행물
Sulfur
https://d9-wret.s3.u[...]
United States Geological Survey
2012
[86]
웹사이트
Mineral Yearbook 2010: Sulfur
https://d9-wret.s3.u[...]
United States Geological Survey
[87]
서적
Ullmann's Encyclopedia of Industrial Chemistry
Wiley-VCH Verlag
2006
[88]
웹사이트
FAQ – The Sulphur Institute
https://www.sulphuri[...]
The Sulphur Institute
2020-02-27
[89]
논문
Sulphur Assimilation and Effects on Yield and Quality of Wheat
1999
[90]
논문
Diagnosing sulfur deficiency in field-grown oilseed rape (Brassica napus L.) and wheat (Triticum aestivum L.)
2000
[91]
논문
Plant nutrient sulphur-a review of nutrient balance, environmental impact and fertilizers
1996
[92]
웹사이트
Glossary
http://earthobservat[...]
NASA Earth Observatory
2013-02-15
[93]
웹사이트
Method for Preparation of Wettable Sulfur
http://www.freepaten[...]
1968-08-20
[94]
서적
Hagers Handbuch der Pharmazeutischen Praxis
Springer
1978
[95]
서적
Arzneibuch-Kommentar. Wissenschaftliche Erläuterungen zum Europäischen Arzneibuch und zum Deutschen Arzneibuch
Wissenschaftliche Verlagsgesellschaft
2004
[96]
서적
Analysis of US FDA-Approved Drugs Containing Sulfur Atoms
https://par.nsf.gov/[...]
Springer International Publishing
2023-03-08
[97]
논문
Stabilization of gamma sulfur at room temperature to enable the use of carbonate electrolyte in Li–S batteries
2022-02-10
[98]
뉴스
Sulphur and the Human Body
https://www.sulphuri[...]
The Sulfur Institute
2021-04-03
[99]
웹사이트
What is the body made of?
https://www.newscien[...]
2021-11-09
[100]
웹사이트
Elemental Composition of the Human Body by Mass
https://www.thoughtc[...]
2021-11-21
[101]
논문
Sulfur in human nutrition and applications in medicine
https://pubmed.ncbi.[...]
2002-02
[102]
논문
Nutritional essentiality of sulfur in health and disease
2013-07
[103]
논문
Sergei Winogradsky: a founder of modern microbiology and the first microbial ecologist
2012-03
[104]
논문
On the Growth and Respiration of Sulfur-Oxidizing Bacteria
1923-01-20
[105]
논문
Oxidation of reduced inorganic sulphur compounds by acidophilic thiobacilli
1990
[106]
논문
Sulfur Metabolism in Phototrophic Sulfur Bacteria
https://www.scienced[...]
Academic Press
2022-05-17
[107]
논문
Microbial Symbiosis: Patterns of Diversity in the Marine Environment
1994
[108]
논문
Biological Origin of Native Sulfur in Salt Domes of Texas and Louisiana
https://www.science.[...]
1956-06-22
[109]
논문
On the origin of native sulfur deposits in Gebel El Zeit, Gulf of Suez, Egypt
https://doi.org/10.1[...]
1994-09-01
[110]
웹사이트
Petrography and mineralogy of the crystalline limestone of Fatha Formation from Mishraq area, Iraq
https://www.research[...]
2022-04-15
[111]
서적
Pflanzenbiochemie
Spektrum Akademischer Verlag
[112]
논문
Microbiology of thiobacilli and other sulphur-oxidizing autotrophs, mixotrophs and heterotrophs
https://pubmed.ncbi.[...]
1982-09-13
[113]
논문
The life sulfuric: microbial ecology of sulfur cycling in marine sediments: Microbial sulfur cycling in marine sediments
August 2017
[114]
논문
An Evolutionary Perspective on Amino Acids
https://www.nature.c[...]
2010
[115]
서적
Molecular Biology of the Cell. 4th edition.
https://www.ncbi.nlm[...]
Garland Science
[116]
논문
Physiological functions of thioredoxin and thioredoxin reductase: Thioredoxin and thioredoxin reductase
2001-12-25
[117]
웹사이트
Lysozyme
https://www.drugs.co[...]
2022-05-19
[118]
서적
Lehninger, Principles of Biochemistry
https://archive.org/[...]
Worth Publishing
2000
[119]
논문
Homocysteine metabolism
https://www.annualre[...]
1999-07-01
[120]
논문
Physiological actions of taurine
https://journals.phy[...]
1992-01-01
[121]
웹사이트
The Function of Biotin
https://www.chem.uwe[...]
2022-06-10
[122]
웹사이트
Thiamine Biochemistry
http://thiamine.dnr.[...]
2022-06-10
[123]
논문
Biochemistry of methanogenesis: a tribute to Marjory Stephenson:1998 Marjory Stephenson Prize Lecture
1998
[124]
논문
Zinc-binding cysteines: diverse functions and structural motifs
2014-04-17
[125]
논문
Metal and Redox Modulation of Cysteine Protein Function
2003-08-01
[126]
서적
Principles of Bioinorganic Chemistry
University Science Books
1994
[127]
논문
Molybdenum cofactor biosynthesis and molybdenum enzymes
2006
[128]
논문
The effects of dietary methionine restriction on the function and metabolic reprogramming in the liver and brain – implications for longevity
https://pubmed.ncbi.[...]
2019-07-26
[129]
논문
Dietary Methionine Deficiency Enhances Genetic Instability in Murine Immune Cells
2021-02-27
[130]
논문
Structural analysis of missense mutations causing isolated sulfite oxidase deficiency
https://pubs.rsc.org[...]
2005-10-18
[131]
웹사이트
Sulfur 84683
https://www.sigmaald[...]
[132]
웹사이트
Chemical Datasheet. SULFUR, MOLTEN
https://cameochemica[...]
[133]
웹사이트
Sulfur General Fact Sheet
http://npic.orst.edu[...]
2022-09-02
[134]
논문
Sublimed (Inorganic) Sulfur Ingestion: A Cause of Life-Threatening Metabolic Acidosis With a High Anion Gap
https://doi.org/10.1[...]
1986-07-01
[135]
논문
Metabolic Acidosis after Sulfur Ingestion
https://www.nejm.org[...]
2022-09-02
[136]
웹사이트
Sulfur Dioxide {{!}} Toxicological Profile {{!}} ATSDR
https://wwwn.cdc.gov[...]
2023-10-24
[137]
웹사이트
Sulfur General Fact Sheet
http://npic.orst.edu[...]
2024-01-20
[138]
간행물
The dehydration of sucrose
https://edu.rsc.org/[...]
Royal Society of Chemistry
2018-06-14
[139]
웹사이트
4.1: Fossil Fuels and Products of Combustion
https://eng.libretex[...]
2023-10-24
[140]
웹사이트
Hydrogen Sulfide Toxicity: Practice Essentials, Pathophysiology, Etiology
https://emedicine.me[...]
2017-03-30
[141]
웹사이트
Hydrogen Sulfide or Hydrogen Cyanide: Which is More Dangerous?
https://www.quirkysc[...]
2017-04-08
[142]
웹사이트
Hydrogen Sulfide – Hazards Occupational Safety and Health Administration
https://www.osha.gov[...]
[143]
PDF
Magnetic susceptibility of the elements and inorganic compounds
https://web.archive.[...]
CRC press
2004-03-24
[144]
웹사이트
硫黄
http://www.kagakukan[...]
[145]
서적
ROCK and GEM 岩石と宝石の大図鑑
誠文堂新光社
[146]
저널
Solid Sulfur Allotropes Sulfur Allotropes
[147]
저널
Homocyclic Sulfur Molecules
[148]
저널
硫黄の同素体
日本化学会
[149]
서적
化学
数研出版
2016-01-10
[150]
뉴스
ゴム状硫黄「黄色」です―17歳が実験、教科書変えた
http://www.asahi.com[...]
2009-01-05
[151]
저널
[152]
저널
[153]
서적
コットン・ウィルキンソン無機化学
培風館
[154]
뉴스
御嶽山リポート「硫黄のような臭いが・・・」 東大教授がツッコミ「硫黄は無臭だ」
https://www.j-cast.c[...]
2014-09-30
[155]
웹사이트
温泉などの「硫黄の臭い」は,本当は何のにおいなのか?
https://www.hamajima[...]
浜島書店
[156]
서적
[157]
서적
戦国大名の経済学
講談社現代新書
[158]
웹사이트
島津久籌
[159]
법률
「硫黄無税輸出差許ス件」
https://hourei.ndl.g[...]
[160]
뉴스
政治よ追いつけ1 エネルギー革命 進歩の陰に犠牲続出
1969-12-15
[161]
서적
Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics
http://www-d0.fnal.g[...]
CRC press
[162]
저널
Refinement of the structure of orthorhombic sulfur, α-S8
1987-12-15
[163]
일반
유황의 냄새
[164]
저널
Greenwood&Earnshaw
[165]
서적
Inorganic Chemistry
https://books.google[...]
Academic Press
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com




