멜라놉신
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
멜라놉신은 포유류 망막에 존재하는 광색소로, 시각적 이미지 형성에 관여하지 않고, 시상하부의 시각교차 위핵(SCN)에서 빛 정보를 처리하여 일주기 리듬, 수면, 생체 시계 등 신체 활동을 조절하는 데 기여한다. 1998년 아프리카 발톱 개구리에서 처음 발견되었으며, 멜라놉신을 포함하는 망막 신경절 세포는 빛에 반응하여 고유 광과민성 망막 신경절 세포(ipRGC)로 명명되었다. 멜라놉신은 광수용 특성을 가지며, 청색광 파장에서 최대 흡수율을 보이며, 빛의 존재에 대한 뇌의 반응에 기여한다. 또한, 멜라놉신은 광유전학 분야의 발전에 기여하여 망막 색소 변성, 제2형 당뇨병, 수면-각성 조절, 편두통 등 다양한 질환의 치료에 활용될 수 있다.
더 읽어볼만한 페이지
- G 단백질 연결 수용체 - P2Y12
P2Y12 길항제는 P2Y12 수용체에 결합해 혈소판 활성화를 억제하는 항혈소판제로, 클로피도그렐, 프라수그렐, 티카그렐러, 캉그렐러 등이 있으며, 아스피린과 병용하는 이중 항혈소판 치료는 급성 관상 동맥 증후군의 주요 치료법으로 쓰인다. - G 단백질 연결 수용체 - 로돕신
로돕신은 간상 세포의 외부 분절 원반에서 발견되는 단백질로, 어두운 환경에서의 시각을 담당하며 빛을 흡수하면 구조적 변화를 일으켜 시신경에 빛 신호를 전달하는 광변환 과정을 유발하고, 로돕신 유전자의 돌연변이는 망막 질환의 주요 원인이 되기도 한다. - 활동일 주기 - 시차증
시차증은 여러 시간대 이동으로 생체리듬이 깨지면서 수면 장애, 소화 불량, 두통, 피로 등을 유발하는 현상이며, 빛 노출 조절, 멜라토닌 복용 등으로 관리하고 조울증 재발 및 자살률에도 영향을 미칠 수 있다. - 활동일 주기 - 주행성
주행성은 낮에 활동하고 밤에 휴식을 취하는 생활 방식으로, 빛, 온도, 먹이, 포식자와 같은 요인들의 영향을 받으며, 초기 동물들의 주요 생활 방식이었으나 야행성으로 진화한 종들도 있고, 기술 분야에서도 활용되는 용어이다.
| 멜라놉신 | |
|---|---|
| 기본 정보 | |
| 유전자 기호 | OPN4 |
| 단백질 | 옵신 4 |
| 외부 데이터베이스 | OMIM: 607256 Gene ID: 498348 |
| 상세 정보 | |
| 염색체 | 10q23.2 |
| 위치 | 염색체 10 장완 23.2 |
| 기능 | |
| 기능 | 내재적으로 광과민성을 갖는 망막 신경절 세포의 광색소 |
| 역할 | 동공 빛 반사 일주기 리듬 조절 |
| 추가 정보 | |
| 관련 질병 | 수면 장애 |
2. 발견
멜라놉신은 1998년 이그나시오 프로벤시오(Ignacio Provencio)가 아프리카 발톱 개구리의 멜라닌 세포에서 처음 발견했다.[7] 이후 포유류의 망막 신경절 세포에도 존재하며, 일주기 시계 동조화 등 비시각적 광수용 기능을 수행한다는 것이 밝혀졌다.[13],[9],[11]
2. 1. 초기 연구
포유류 망막에는 시각적 이미지 형성에 관여하는 두 가지 추가 범주의 다른 옵신이 있다. 이들 시세포는 각각 간상체 및 원추형 광 수용체 세포에 있는 로돕신 및 포톱신을 생성한다. 한편, 이와 다른 특수한 망막세포의 광색소인 멜라놉신은 막대세포나 원뿔세포와는 또 다른 광색소로서 시상을 통한 시각정보처리에는 관여하지 않으나 시상하부의 SCN(시각교차위핵) 영역에서 빛정보처리에 관여하는 것으로 알려져있다. SCN은 일주율, 수면, 생체 시계 등 광범위한 신체활동을 조절하고 영향을 미친다.
멜라놉신은 1998년 이그나시오 프로벤시오(Ignacio Provencio)에 의해 아프리카 발톱 개구리의 멜라닌 세포 또는 빛에 민감한 피부 세포에서 새로운 옵신으로 발견되었다.[7] 1년 후, 연구자들은 시세포나 원추 세포가 없는 쥐(이미지 형성 시각에 관여하는 세포)가 여전히 빛-어둠 주기에 동조화(Entrainment (chronobiology))된다는 것을 발견했다.[8] 이러한 관찰은 망막 바깥쪽에 위치한 시세포와 원추 세포가 일주기 동조화에 필요하지 않으며 포유류의 눈에 세 번째 종류의 광수용체가 존재한다는 결론으로 이어졌다.[9] 그 후 프로벤시오와 동료들은 2000년에 멜라놉신이 마우스 망막, 특히 망막 신경절 세포에도 존재하며 비시각적 광수용 과제를 매개한다는 것을 발견했다.[13] 멜라놉신은 다양한 유기체에서 상동 유전자를 가진 ''Opn4'' 유전자에 의해 암호화된다.[9]
이러한 망막 신경절 세포는 격리된 상태에서도 빛에 반응했기 때문에 선천적으로 광과민성이 있는 것으로 밝혀졌으며, 따라서 고유 광과민성 망막 신경절 세포(Intrinsically photosensitive retinal ganglion cells, ipRGC)라고 명명되었다.[10] 이들은 이미 알려진 시세포와 원추 세포 외에 포유류 망막에서 세 번째 종류의 광수용체 세포를 구성하며 일주기 동조화(Entrainment (chronobiology))에 대한 빛 입력을 위한 주요 통로인 것으로 나타났다.[13] 실제로, 나중에 사치다난다 판다(Satchidananda Panda)와 동료들에 의해 멜라놉신 색소가 맹인 쥐가 빛에 반응하는 데 멜라놉신이 필요했기 때문에 포유류의 빛 주기에 대한 일주기 시계의 동조화에 관여할 수 있다는 것이 입증되었다.[11]
2. 2. 포유류에서의 발견
포유류 망막에는 간상체 및 원추형 광 수용체 세포에 있는 로돕신 및 포톱신 외에 두 가지 추가 범주의 다른 옵신이 있다. 멜라놉신은 막대세포나 원뿔세포와는 다른 광색소로서 시상을 통한 시각정보처리에는 관여하지 않으나 시상하부의 SCN 영역에서 빛정보처리에 관여하는 것으로 알려져있다. SCN은 일주율, 수면, 생체 시계 등 신체활동을 조절한다.멜라놉신은 1998년 이그나시오 프로벤시오(Ignacio Provencio)에 의해 아프리카 발톱 개구리의 빛에 민감한 피부 세포에서 새로운 옵신으로 발견되었다.[7] 1년 후, 연구자들은 시세포나 원추 세포가 없는 쥐가 여전히 빛-어둠 주기에 동조화(Entrainment (chronobiology))된다는 것을 발견했다.[8] 이러한 관찰은 망막 바깥쪽에 위치한 시세포와 원추 세포가 일주기 동조화에 필요하지 않으며 포유류의 눈에 세 번째 종류의 광수용체가 존재한다는 결론으로 이어졌다.[9] 2000년, 프로벤시오 연구팀은 쥐의 망막, 특히 망막 신경절 세포에도 멜라놉신이 존재하며 비시각적 광수용 과제를 매개한다는 것을 발견했다.[13] 멜라놉신은 다양한 유기체에서 상동 유전자를 가진 ''Opn4'' 유전자에 의해 암호화된다.[9]
이러한 망막 신경절 세포는 격리된 상태에서도 빛에 반응했기 때문에 고유 광과민성 망막 신경절 세포(Intrinsically photosensitive retinal ganglion cells, ipRGC)라고 명명되었다.[10] 이들은 이미 알려진 시세포와 원추 세포 외에 포유류 망막에서 세 번째 종류의 광수용체 세포를 구성하며 일주기 동조화(Entrainment (chronobiology))에 대한 빛 입력을 위한 주요 통로인 것으로 나타났다.[13] 사치다난다 판다(Satchidananda Panda)와 동료들은 멜라놉신 색소가 맹인 쥐가 빛에 반응하는 데 필요했기 때문에 포유류의 빛 주기에 대한 일주기 시계의 동조화에 관여할 수 있다는 것을 입증했다.[11]
3. 종 분포
멜라놉신 유전자는 포유류와 비포유류 척추동물에서 각각 다른 형태로 존재한다. 포유류는 ''Opn4m''이라는 상동 멜라놉신 유전자를 가지고 있으며, 비포유류 척추동물은 ''Opn4x''라는 멜라놉신 유전자를 가지고 있다.[12][14] 포유류는 진화 초기에 ''Opn4x'' 유전자를 잃어 광수용 능력이 감소했는데, 이는 야행성 포유류가 진화하는 시기에 발생했다.[14]
3. 1. 포유류
포유류는 ''Opn4m''이라는 상동 멜라놉신 유전자를 가지는데, 이는 ''Opn4'' 계열에서 유래되었고 약 50-55%의 보존율을 보인다.[14] 닭과 제브라피쉬를 포함한 비포유류 척추동물은 멜라놉신 유전자의 또 다른 버전인 ''Opn4x''를 가지는데, 이는 약 3억 6천만 년 전에 ''Opn4m''과 분화된 별개의 계통으로 보인다.[12] 포유류는 진화 초기에 ''Opn4x'' 유전자를 잃어 광수용 능력이 전반적으로 감소했다. 이는 야행성 포유류가 진화하는 시기에 발생했다는 사실로 설명할 수 있다.[14]3. 2. 비포유류 척추동물
닭과 제브라피쉬를 포함한 비포유류 척추동물은 ''Opn4x''라는 멜라놉신 유전자를 가지고 있는데, 이는 약 3억 6천만 년 전에 ''Opn4m''과 분화된 별개의 계통으로 보인다.[12] 포유류는 진화 초기에 ''Opn4x'' 유전자를 잃었으며, 이로 인해 광수용 능력이 전반적으로 감소했다. 이 사건은 야행성 포유류가 진화하는 시기에 발생했다는 사실로 설명할 수 있다고 생각된다.[14]4. 구조
멜라놉신은 G 단백질 연결 수용체(GPCR)의 일종이다. 사머 하타르와 동료들의 연구에 의해 ipRGC에서 발현된다는 것이 밝혀졌으며,[38] RGC의 1~2%를 차지한다. 비포유류 척추동물에서 멜라놉신은 망막뿐만 아니라 눈의 홍채 근육, 뇌 심부 영역, 송과체, 피부와 같은 망막 외부의 광수용 구조에서도 발견된다.[14] ''Opn4''의 상동 유전자에는 OPN1LW, OPN1MW, 로돕신, 뇌옵신이 있다.[15]
4. 1. 유전자 구조
인간 멜라놉신 유전자 ''opn4''는 ipRGC에서 발현되며, 사머 하타르와 동료들의 연구에서 밝혀졌다.[38] 이 유전자는 10번 염색체의 장완(긴 팔)에 위치하며, 9개의 인트론과 10개의 엑손을 포함한다.[13]4. 2. 단백질 구조
멜라놉신 단백질은 세포 외 N-말단 영역, 세포 내 C-말단 영역, 그리고 형질막을 가로지르는 7개의 알파 나선을 가지고 있다.[7] 일곱 번째 나선은 라이신을 가지고 있으며,[7] 이는 쉬프 염기를 통해 공유 결합으로 레티날과 결합하여[17][18] 멜라놉신을 빛에 민감하게 만든다.4. 3. 다른 옵신과의 관계
멜라놉신은 로돕신을 포함한 다른 모든 동물 옵신과 마찬가지로 G 단백질 연결 수용체(GPCR)이다. 멜라놉신은 척추 동물 시각 옵신(섬모체 옵신)보다 무척추 동물 시각 옵신(rhabdomeric 옵신)과 더 밀접하게 관련되어 있다.[7][20][21] 이는 하위 신호 전달 연쇄 반응에도 반영되는데, 멜라놉신은 ipRGC에서 G(q), G(11), G(14)와 결합하며, 이들은 모두 G(q) 유형이다.[22] 이들은 기능적으로 서로 대체할 수 있어서, 단 두 개만 녹아웃해도 표현형 효과가 나타나지 않는다.[23] G 단백질은 포스포리파제 C PLCB4를 활성화시키고,[2] 이는 TRP 채널 TRPC6 및 TRPC7을 열어 세포를 탈분극시킨다.[10][2] 이는 초파리 눈의 광수용 세포와 유사하며, 시각 광변환이 결국 세포를 과분극시키는 척추 동물의 간상체 및 원추 세포와는 대조적이다.[24] 다른 rhabdomeric 옵신과 마찬가지로 멜라놉신은 고유의 광이성질화 효소 활성을 가지고 있다.[25]5. 기능
포유류 망막에는 시각 이미지 형성에 관여하는 두 가지 범주의 옵신 외에, 멜라놉신이라는 특수한 광색소가 있다. 멜라놉신은 막대세포나 원뿔세포와는 다른 광색소로 시상을 통한 시각 정보 처리에는 관여하지 않지만, 시상하부의 SCN(시각교차위핵) 영역에서 빛 정보를 처리하여 일주율, 수면, 생체 시계 등 광범위한 신체 활동 조절에 영향을 미친다.[26]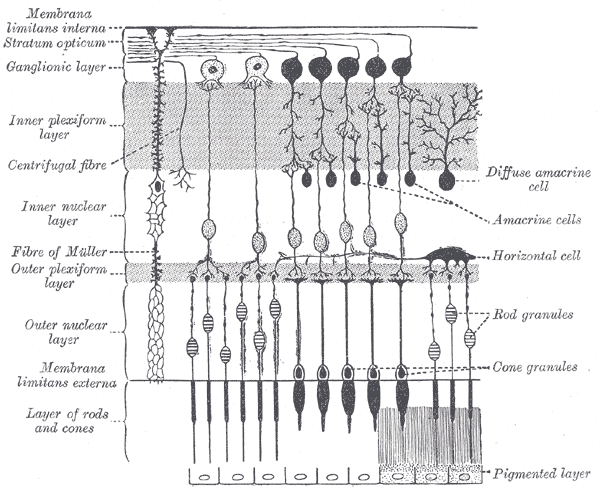
멜라놉신 함유 신경절 세포[26]는 막대 세포, 원추 세포와 마찬가지로 빛과 어둠에 모두 적응하며, 빛 노출의 최근 역사에 따라 민감도를 조절한다.[27]
5. 1. 광수용 특성
멜라놉신 광수용체는 다양한 파장에 민감하며, 480 나노미터(nm) 부근의 청색광 파장에서 빛을 가장 많이 흡수한다.[31] 다른 파장의 빛도 멜라놉신 신호 체계를 활성화하지만, 480 nm에서 멀어질수록 효율은 떨어진다. 예를 들어, 445 nm 부근의 더 짧은 파장(가시광선 스펙트럼에서 보라색에 더 가까움)은 480 nm 빛의 절반 정도만 멜라놉신 광수용체를 자극한다.[31]쥐를 이용한 실험에서, 원래 빛에 반응하지 않는 Neuro-2a 세포주에 인간 멜라놉신을 넣으면 빛에 민감해지는 것을 확인했다. 이 반응은 짧은 파장의 빛에 선택적으로 민감하며(최대 흡수 ~479 nm),[28][29] 색이 더 긴 파장으로 이동하는 고유한 광이성질화효소 재생 기능을 갖는다.[30]
5. 2. 비시각적 기능
포유류 망막의 특수한 광색소인 멜라놉신은 시상을 통한 시각 정보 처리에는 관여하지 않으나, 시상하부의 SCN(시각 교차 위핵) 영역에서 빛 정보 처리에 관여하는 것으로 알려져 있다.[26] SCN은 일주율, 수면, 생체 시계 등 광범위한 신체 활동을 조절하고 영향을 미친다. 멜라놉신을 함유한 ipRGC는 빛의 존재에 대한 뇌와 신체의 다양한 반사 반응에 기여한다.[10]멜라놉신은 빛과 어둠에 모두 적응하며, 빛 노출의 최근 역사에 따라 민감도를 조절한다.[27] 멜라놉신 광수용체는 다양한 파장에 민감하며, 480 나노미터 부근의 청색광 파장에서 최대 빛 흡수에 도달한다.[31] 다른 파장의 빛은 멜라놉신 신호 시스템을 활성화하며, 480 nm에서 멀어질수록 효율성이 감소한다. 예를 들어, 445 nm 부근의 더 짧은 파장(보라색에 더 가까움)은 480 nm의 빛만큼 멜라놉신 광수용체 자극에 절반 정도의 효과를 보인다.[31]
쥐를 대상으로 한 실험에서 멜라놉신의 생리학적 빛 감지에 대한 증거가 확인되었다. 일반적으로 광수용성이 아닌 쥐 세포주인 Neuro-2a는 인간 멜라놉신을 첨가함으로써 빛에 민감해진다. 광반응은 짧은 파장의 빛에 선택적으로 민감하며(최대 흡수 ~479 nm),[28][29] 색상적으로 더 긴 파장으로 이동된 고유의 광이성질화효소 재생 기능을 가지고 있다.[30]
일부, 주로 야행성 포유류의 홍채에 있는 멜라놉신은 빛에 노출되면 홍채를 닫는다. 이러한 국소적 동공 빛 반사(PLR)는 영장류의 홍채가 멜라놉신을 발현하더라도 영장류에서는 나타나지 않는다.[2]
5. 3. 메커니즘
적절한 주파수의 빛이 눈에 들어오면, 내재적 광수용성 망막 신경절 세포(ipRGC)에 포함된 멜라놉신이 활성화되어 활동 전위를 유발한다. 이러한 신경 전기 신호는 축삭을 통해 중뇌의 올리브 전전뇌 핵(OPN)과 같이 동공 조절의 중심과 같은 특정 뇌 표적으로 이동한다. 결과적으로 ipRGC의 멜라놉신 자극은 동공 수축 및 송과선에서의 멜라토닌 방출 억제와 같은 빛에 대한 행동 및 생리적 반응을 매개한다.[32][33] 포유류 망막의 ipRGC는 시상하부 시신경로의 한 종착점이며, 이는 시상하부의 시교차상핵(SCN)으로 투사된다. 시교차상핵은 때때로 뇌의 "주 시계"[34]라고 묘사되는데, 일주기 리듬을 유지하며, ipRGC에서 SCN으로의 신경 신호는 내부 일주기 리듬을 해 뜨고 지는 시간에 맞춰 조정한다. SCN은 막대세포와 원뿔세포로부터 시상하부 시신경로를 통해 입력을 받으므로, 포유류 망막의 세 가지 광수용성 세포 유형(막대 세포, 원추 세포 및 ipRGC)에서 얻은 정보가 SCN으로 전달된다.[35]멜라놉신을 함유한 신경절 세포는 축삭 말단에서 신경전달물질 글루탐산과 뇌하수체 아데닐산 시클라제 활성 폴리펩타이드(PACAP)를 방출하여 이러한 표적에 영향을 미치는 것으로 생각된다.[36] 멜라놉신을 함유한 신경절 세포는 또한 막대 세포와 원추 세포로부터 입력을 받아 이러한 경로에 대한 입력에 추가할 수 있다.
5. 4. 생체 리듬에 대한 영향
멜라놉신은 포유류의 생체 시계 동조에 중요한 역할을 한다. 광동조된 유기체는 지구의 태양 주기인 대략 24시간 주기에 맞춰 활동을 조정한다.[37] 포유류에서 멜라놉신을 발현하는 축삭은 시상하부망막로 (RHT)를 통해 시교차상핵(SCN)을 표적으로 한다.[38] SCN은 일주율, 수면, 생체 시계 등 광범위한 신체 활동을 조절하고 영향을 미친다.포유류의 눈은 빛 신호를 뇌로 전달하는 주요 광수용 기관이지만, 시각 장애가 있는 사람들도 빛을 의식적으로 인식하지 못하더라도 환경의 명암 주기에 동조할 수 있다. 한 연구에서 피험자를 오랫동안 밝은 빛에 노출시키고 멜라토닌 농도를 측정했는데, 멜라토닌은 시각 기능이 손상되지 않은 사람뿐만 아니라 시각 장애가 있는 참가자에서도 억제되었다. 이는 생체 시계 시스템에서 사용되는 광학 경로가 시각 장애에도 불구하고 기능적으로 온전하다는 것을 시사한다.[39] 따라서 눈이 생체 시계 페이스메이커의 광동조에 중요한 역할을 하기 때문에 의사들은 더 이상 시각 장애 환자의 눈 적출이나 출생 시 눈 제거술을 시행하지 않는다.
막대 세포만 있거나, 원뿔 세포만 있거나, 또는 막대 세포와 원추 세포 모두가 없는 돌연변이 쥐 품종에서 모든 품종의 쥐가 환경의 변화하는 빛 자극에 동조했지만, 반응은 제한적이었다. 이는 막대 세포와 원추 세포가 생체 시계 광동조에 필요하지 않으며, 포유류의 눈은 생체 리듬 시계를 조절하는 데 필요한 다른 광색소를 가지고 있어야 함을 시사한다.[8]
멜라놉신-녹아웃 쥐는 광동조가 감소한다. 멜라놉신을 정상적으로 발현하는 야생형 쥐와 비교했을 때, 멜라놉신 결손 쥐(''Opn4 -/-'')에서 빛으로 유도된 이동 활동의 위상 변화에 결함이 나타났다.[5] 이러한 멜라놉신 결핍 쥐는 생체 리듬을 완전히 잃지 않았으며, 비록 정상적인 쥐보다 느리지만 환경 자극의 변화에 동조할 수 있었다.[40] 이는 멜라놉신이 동조에 충분하지만, 정상적인 광동조 활동을 위해서는 다른 광색소와 함께 작용해야 함을 나타낸다. 막대 세포가 없고, 원추 세포가 없고, 멜라놉신이 없는 삼중 돌연변이 쥐는 생체 리듬을 완전히 상실하므로, 이러한 광수용체의 세 가지 광색소인 로돕신, 포톱신, 멜라놉신은 광동조에 필요하다.[41] 따라서 포유류의 광동조 경로에는 세 가지 광색소 사이에 기능적 중복성이 존재한다. 하나의 광색소만 삭제하는 것은 유기체가 환경의 명암 주기에 동조하는 능력을 제거하지 않지만, 반응의 강도를 감소시킨다.
6. 조절
포유류 망막에는 시각적 이미지 형성에 관여하는 두 가지 추가 범주의 다른 옵신이 있다. 이들 시세포는 각각 간상체 및 원추형 광 수용체 세포에 있는 로돕신 및 포톱신을 생성하는 기제를 가지고 있다. 한편, 멜라놉신은 막대세포나 원뿔세포와는 다른 광색소로서 시상을 통한 시각정보처리에는 관여하지 않으나 시상하부의 SCN 영역에서 빛 정보처리에 관여한다. SCN은 일주율, 수면, 생체 시계 등 광범위한 신체활동을 조절하고 영향을 미친다.
6. 1. 인산화
멜라놉신은 기능을 비활성화하기 위해 세포 내 카르복시 말단에서 인산화를 거친다. 다른 옵신과 비교하여 멜라놉신은 37개의 세린과 트레오닌 아미노산 부위를 포함하는 특이하게 긴 카르복시 말단을 가지고 있어 인산화를 겪을 수 있다.[42] 그러나 7개의 아미노산 클러스터만으로도 제브라피쉬 멜라놉신의 비활성화에 충분하다. 이 부위는 멜라놉신이 빛에 노출될 때 탈인산화되며, 로돕신을 조절하는 부위와는 다르다.[43] 특히 세린-381과 세린-398에서 기능적 인산화 부위가 없으면 전압 개폐 칼슘 이온 채널이 열릴 때 빛에 의해 유도된 칼슘 이온 유입에 대한 세포의 반응이 감소하므로, ipRGC에서 칼슘 이온에 대한 적절한 반응에 중요하다.[44]6. 2. 도파민에 의한 조절
도파민(DA)은 Opn4 유전자와 관련하여 ipRGC에서 멜라놉신 mRNA 조절 요인이다.[45]7. 임상적 의의
멜라놉신은 비시각적 시각에서의 역할이 밝혀지면서 광유전학 분야의 성장을 이끌었고, 이는 여러 질환 치료에 응용될 가능성을 보여주었다. Opn4 유전자의 미스센스 돌연변이 P10L은 계절성 정동 장애 환자의 5%와 관련이 있는데,[47] 이는 빛의 감소로 인해 겨울에 우울한 생각을 경험하는 질환이다. 멜라놉신 기반 수용체는 편두통과도 관련이 있다.[48]
7. 1. 광유전학적 응용
멜라놉신이 비시각적 시각에서 하는 역할이 밝혀지면서 광유전학 분야가 성장했다. 이 분야는 망막 색소 변성, 제2형 당뇨병과 같은 인간의 안과 질환 치료를 포함하여 임상 응용 분야에서 가능성을 보여주었다.[46] 멜라놉신 유전자(Opn4)의 미스센스 돌연변이 P10L은 계절성 정동 장애 환자의 5%와 관련이 있다.[47] 이는 사람들이 빛의 감소로 인해 겨울에 우울한 생각을 경험하는 질환이다. 또한, 멜라놉신 기반 수용체는 편두통과 관련되어 있다.[48]7. 2. 시력 회복
멜라놉신을 이용한 광유전학 치료는 망막 색소 변성증 환자의 시력 회복에 기여할 수 있다는 연구가 최근 진행되었다.[49] 망막 변성이 일어난 쥐의 눈에 기능성 멜라놉신을 재도입하면 동공 빛 반사가 회복된다. 이러한 쥐들은 빛 자극과 어둠 자극을 구별할 수 있었고, 실내 조명에 대한 감수성이 증가했다. 이 쥐들이 보인 높은 감수성은 인간에게 적용 가능한 시력 회복 가능성을 보여주며, 인간의 눈 질환 치료에도 기여할 수 있을 것으로 기대된다.[46][50]7. 3. 수면-각성 조절
멜라놉신은 수면 주기와 각성을 조절하는 데 도움을 줄 수 있다. 츠네마츠 연구진은 유전자 변형 쥐를 제작하여 시상하부 오렉신 신경세포에서 멜라놉신을 발현시켰다. 광섬유를 통해 유도된 4초간의 짧은 청색광 자극으로, 유전자 변형 쥐는 서파 수면(SWS) 상태에서 장시간의 각성 상태로 성공적으로 전환될 수 있었다. 청색광을 끄면 시상하부 오렉신 신경세포는 수십 초 동안 활성을 보였다.[46][51] 막대세포와 원뿔세포는 빛에 의한 수면 개시에는 아무런 역할을 하지 않으며, 이는 ipRGC와 멜라놉신과는 구별된다는 것이 밝혀졌다. 이는 인간의 ipRGC와 각성 상태, 특히 고주파 빛(예: 청색광) 사이의 연관성을 강력하게 시사한다. 따라서 멜라놉신은 수면-각성 주기를 조절하는 치료 표적으로 사용될 수 있다.[52]7. 4. 혈당 조절
2011년 Ye와 동료들의 논문에 따르면, 멜라놉신은 Fc-글루카곤 유사 펩타이드 1 (Fc-GLP-1) 생성을 위한 광유전학적 합성 전사 장치 제작에 사용되었다. Fc-GLP-1은 제2형 당뇨병을 앓는 포유류의 혈당 조절에 도움을 주는 융합 단백질이다.[46][53] 연구자들은 멜라놉신 유전자와 관심 유전자를 각각 NFAT (활성화 T 세포의 핵 인자) 프로모터 하에 포함하는 두 개의 벡터와 공동 형질 감염된 HEK 293 세포를 미세 캡슐화하여 쥐에 피하 이식하였다. 이들은 이러한 공학적 경로를 통해 이중 열성 당뇨병 쥐에서 Fc-GLP-1 발현을 성공적으로 제어하고, 고혈당증 (높은 혈당 수치)을 감소시켰다. 이는 제2형 당뇨병 치료를 위한 광유전학적 도구로서 멜라놉신이 사용될 가능성을 보여준다.[46][53]7. 5. 기타 질환
멜라놉신이 비시각적 시각에서 하는 역할이 밝혀지면서 광유전학 분야가 성장했다. 이 분야는 망막 색소 변성 및 제2형 당뇨병과 같은 인간의 안과 질환 치료를 포함하여 임상 응용 분야에서 가능성을 보여주었다.[46] 미스센스 돌연변이 P10L(Opn4 유전자)은 계절성 정동 장애 환자의 5%와 관련이 있다.[47] 이는 사람들이 빛의 감소로 인해 겨울에 우울한 생각을 경험하는 질환이다. 또한, 멜라놉신 기반 수용체가 편두통과 관련되어 있다.[48]참조
[1]
논문
Melanopsin, the photopigment of intrinsically photosensitive retinal ganglion cells
[2]
논문
Melanopsin signalling in mammalian iris and retina
2011-11
[3]
논문
Melanopsin-expressing amphioxus photoreceptors transduce light via a phospholipase C signaling cascade
[4]
논문
P-780 – The abundance and distribution of melanopsin (OPN4) protein in human brain
[5]
논문
Immunohistochemical evidence of a melanopsin cone in human retina
2006-04
[6]
논문
Human trichromacy revisited
2013-01
[7]
논문
Melanopsin: An opsin in melanophores, brain, and eye
1998-01
[8]
논문
Regulation of mammalian circadian behavior by non-rod, non-cone, ocular photoreceptors
1999-04
[9]
논문
Melanopsin: an exciting photopigment
2008-01
[10]
논문
Phototransduction by retinal ganglion cells that set the circadian clock
2002-02
[11]
논문
Melanopsin (Opn4) requirement for normal light-induced circadian phase shifting
2002-12
[12]
논문
Phylogeny of the major tetrapod groups: morphological data and divergence dates
1990-05
[13]
논문
A novel human opsin in the inner retina
2000-01
[14]
논문
Evolution of melanopsin photoreceptors: discovery and characterization of a new melanopsin in nonmammalian vertebrates
2006-07
[15]
논문
The opsins
2005-03-01
[16]
논문
The Gluopsins: Opsins without the Retinal Binding Lysine
2022-08
[17]
논문
Rhodopsin and indicator yellow
1953-03
[18]
논문
Studies on rhodopsin. VIII. Retinylidenemethylamine, an indicator yellow analogue
1955-01
[19]
논문
Melanopsin triggers the release of internal calcium stores in response to light
2007-03
[20]
논문
Shedding new light on opsin evolution
2012-01
[21]
논문
The last common ancestor of most bilaterian animals possessed at least 9 opsins
2016-10-26
[22]
논문
Using siRNA to define functional interactions between melanopsin and multiple G Protein partners
2015-01
[23]
논문
Loss of gq/11 genes does not abolish melanopsin phototransduction
2014-05-28
[24]
논문
Melanopsin and mechanisms of non-visual ocular photoreception
2012-01
[25]
논문
Illumination of the melanopsin signaling pathway
2005-01
[26]
논문
Melanopsin-expressing intrinsically photosensitive retinal ganglion cells in retinal disease
https://eprints.qut.[...]
2014-08
[27]
논문
Photoreceptor adaptation in intrinsically photosensitive retinal ganglion cells
2005-12
[28]
논문
Human melanopsin forms a pigment maximally sensitive to blue light (λmax ≈ 479 nm) supporting activation of G(q/11) and G(i/o) signalling cascades
2013-05
[29]
논문
Phototransduction in ganglion-cell photoreceptors
2007-08
[30]
논문
Addition of human melanopsin renders mammalian cells photoresponsive
2005-02
[31]
논문
A "melanopic" spectral efficiency function predicts the sensitivity of melanopsin photoreceptors to polychromatic lights
2011-08
[32]
논문
Intrinsically photosensitive melanopsin retinal ganglion cell contributions to the pupillary light reflex and circadian rhythm
2010-05
[33]
논문
Short-wavelength light sensitivity of circadian, pupillary, and visual awareness in humans lacking an outer retina
2007-12
[34]
논문
Collective timekeeping among cells of the master circadian clock
2016-07
[35]
논문
Coordination of circadian timing in mammals
2002-08
[36]
논문
Target areas innervated by PACAP-immunoreactive retinal ganglion cells
2004-04
[37]
논문
Stopping time: the genetics of fly and mouse circadian clocks
2001
[38]
논문
Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity
2002-02
[39]
논문
Suppression of melatonin secretion in some blind patients by exposure to bright light
1995-01
[40]
논문
Melanopsin, ganglion-cell photoreceptors, and mammalian photoentrainment
2003-06
[41]
논문
Melanopsin is required for non-image-forming photic responses in blind mice
2003-07
[42]
논문
Light-dependent phosphorylation of the carboxy tail of mouse melanopsin
2012-05
[43]
논문
Identification of critical phosphorylation sites on the carboxy tail of melanopsin
2014-04
[44]
논문
Phosphorylation of rat melanopsin at Ser-381 and Ser-398 by light/dark and its importance for intrinsically photosensitive ganglion cells (ipRGCs) cellular Ca2+ signaling
2014-12
[45]
논문
Dopamine regulates melanopsin mRNA expression in intrinsically photosensitive retinal ganglion cells
2005-12
[46]
논문
The manipulation of neural and cellular activities by ectopic expression of melanopsin
2013-01
[47]
논문
A missense variant (P10L) of the melanopsin (OPN4) gene in seasonal affective disorder
2009-04
[48]
웹사이트
Why Light Makes Migraines Worse – ScienceNOW
https://www.science.[...]
2011-04-03
[49]
논문
Optogenetic therapy for retinitis pigmentosa
2012-02
[50]
논문
Restoration of visual function in retinal degeneration mice by ectopic expression of melanopsin
2008-10
[51]
논문
Ectopic expression of melanopsin in orexin/hypocretin neurons enables control of wakefulness of mice in vivo by blue light
2013-01
[52]
논문
The acute light-induction of sleep is mediated by OPN4-based photoreception
2008-09
[53]
논문
A synthetic optogenetic transcription device enhances blood-glucose homeostasis in mice
2011-06
[54]
논문
Melanopsin: an exciting photopigment
http://homes.mpimf-h[...]
2020-08-15
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com