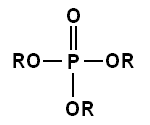
인산과 인산염
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
인산과 인산염은 인 원자를 포함하는 화합물로, 다양한 형태로 존재하며 여러 산업 분야에서 널리 사용된다. 인산은 가장 단순한 형태인 오르토인산(H3PO4)을 포함하여 올리고인산, 폴리인산, 고리형 인산 등으로 분류된다. 인산염은 인산에서 수소 이온이 제거되어 생성되는 음이온으로, 오르토인산염, 선형 및 고리형 폴리인산염 등이 있다. 인산은 알코올과 반응하여 인산 에스터를 형성하며, 이는 생화학적 과정에서 중요한 역할을 한다. 인산염은 세제, 수처리, 부식 방지, 식품 첨가물 등 다양한 분야에서 활용되며, 특히 세제 및 수처리 과정에서 물때 방지 및 부식 제어에 기여한다.
인산은 가장 단순하고 흔하게 접할 수 있는 오르토인산(H3PO4)을 의미하는 경우가 많지만, 넓은 의미로는 여러 인산들이 축합된 형태나 고리형 인산 등 다양한 화합물을 포함한다.
인산염은 인산에서 수소 이온(양성자, H+)이 제거되면서 생성되는 음이온이다. 부분적으로 제거하면 다양한 인산수소 음이온이 생성된다.[9][10]
2. 인산
두 개 이상의 오르토인산 분자가 탈수되어 축합되면 더 큰 분자가 만들어진다. 몇 개의 단위체가 축합되면 올리고인산, 더 큰 분자는 폴리인산이라고 불린다.
반면에 동일 분자 내에서 두 하이드록실기(-OH) 단위가 축합되면 고리형 인산이 생성될 수 있다.
인산의 일반식은 H''n''−2''x''+2P''n''O3''n''−''x''+1이며, 여기서 ''n''은 인 원자의 수이고, ''x''는 분자 구조의 기본 고리 수이다.
모든 산소 원자가 공유되고 수소 원자가 없는 내부 축합의 극한 경우는 오산화 인(P4O10)과 같은 무수물(P''n''O5''n''/2)이다.
2. 1. 오르토인산
오르토인산(H3PO4)은 인산 중에서 가장 단순하고 흔하게 접할 수 있는 화합물이다. 실제로 "인산"이라는 용어는 보통 이 화합물을 구체적으로 의미하며, IUPAC 명명법으로도 "인산"이라고 불린다.
2. 2. 올리고인산 및 폴리인산
두 개 이상의 오르토인산 분자는 탈수 축합 반응을 통해 더 큰 분자로 결합될 수 있다. 몇 개의 단위체가 축합되면 올리고인산이 생성되고, 더 큰 분자는 폴리인산이라고 한다. 그러나 올리고인산과 폴리인산 두 용어의 구분은 잘 정의되어 있지 않다.
피로인산(파이로인산), 삼인산(트리인산), 사인산(테트라포스포르산)은 다음의 반응에 의해 얻을 수 있다.
폴리인산 분자의 "골격"은 P(인)와 O(산소) 원자가 번갈아가며 연결된 사슬이다. 축합되는 추가 오르토인산 단위에 의해 1개의 추가 H(수소) 원자, 1개의 추가 P 원자 및 3개의 추가 O 원자가 더해지게 된다. 폴리인산의 일반식은 H''n''+2P''n''O3''n''+1 또는 HO(–P(O)(OH)–O–)''n''H이다.
폴리인산은 유기 합성에서 고리화 반응 및 아실화 반응에 사용된다.[9][10]
2. 3. 고리형 인산
인산 단위체들이 고리 형태로 결합된 화합물을 고리형 인산이라고 한다. 가장 간단한 고리형 인산은 트라이메타인산(trimetaphosphoric acid영어) 또는 사이클로-삼인산으로, 화학식은 H3P3O9이다. 트라이메타인산의 구조는 아래 그림과 같으며, 끝이 축합되었기 때문에 트리폴리인산보다 H2O (물) 분자가 하나 적다.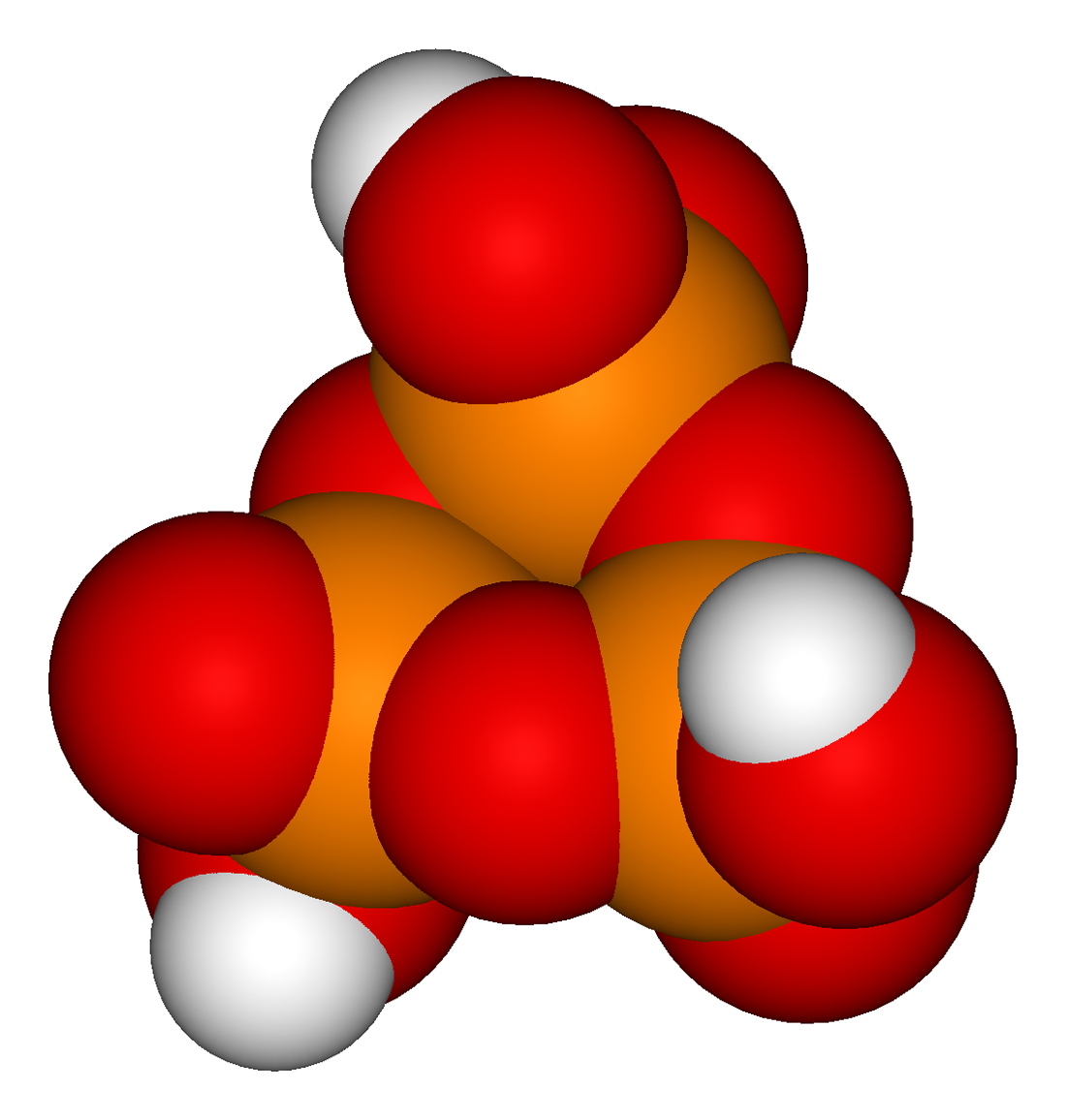
인산의 일반식은 H''n''−2''x''+2P''n''O3''n''−''x''+1이며, 여기서 ''n''은 인 원자의 수이고 ''x''는 분자 구조의 기본 사이클 수, 즉 모든 사이클을 제거하기 위해 끊어야 하는 최소 결합 수이다.
동일한 분자의 두 하이드록실기(–OH) 단위 사이의 축합은 두 개의 수소 원자와 한 개의 산소 원자를 제거하여 고리를 생성하는데, 이는 삼메타인산의 형성에서 볼 수 있다.
: H5P3O10 → H3P3O9 + H2O
H3PO4
H4P2O7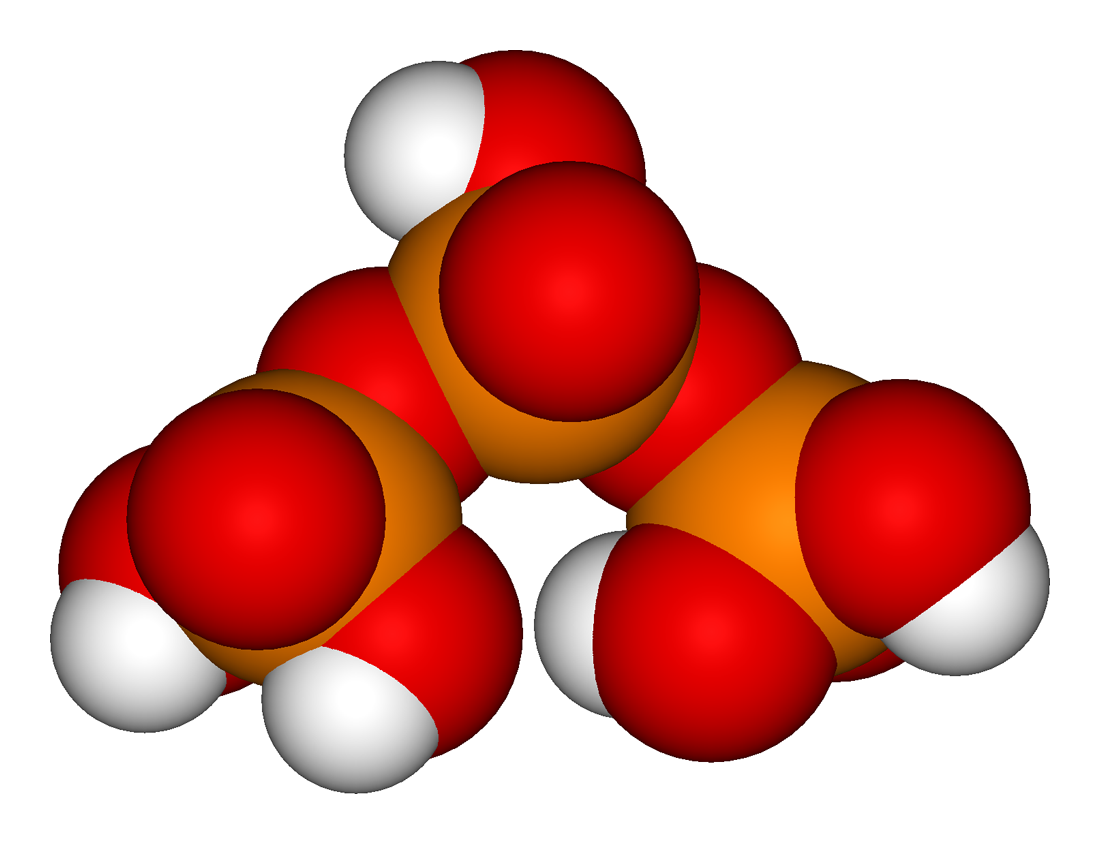
H5P3O10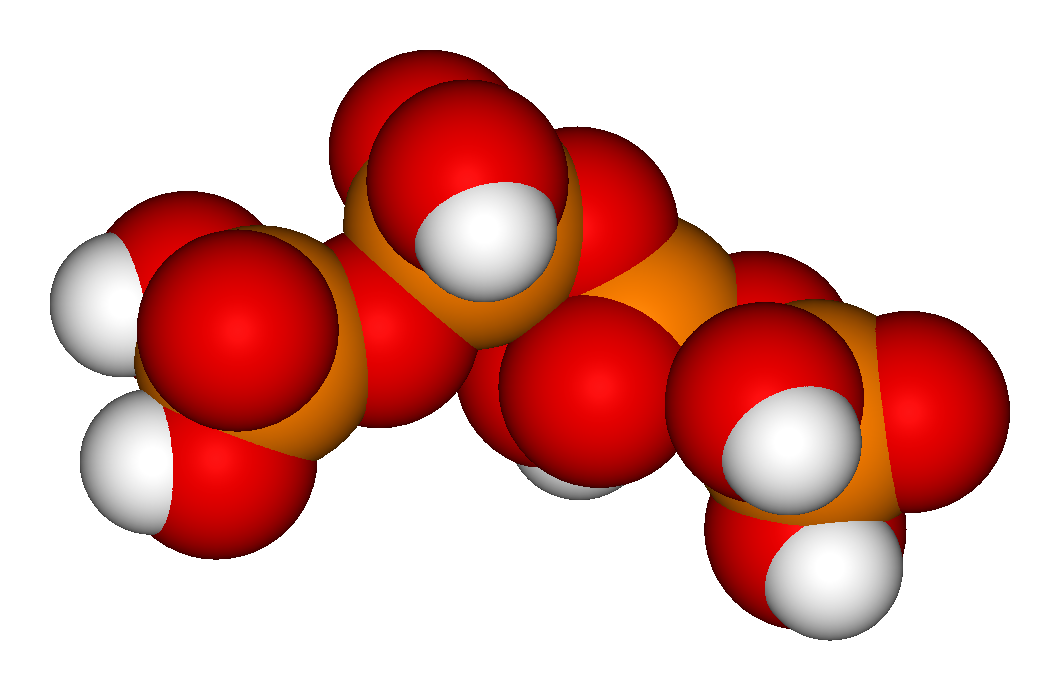
H6P4O13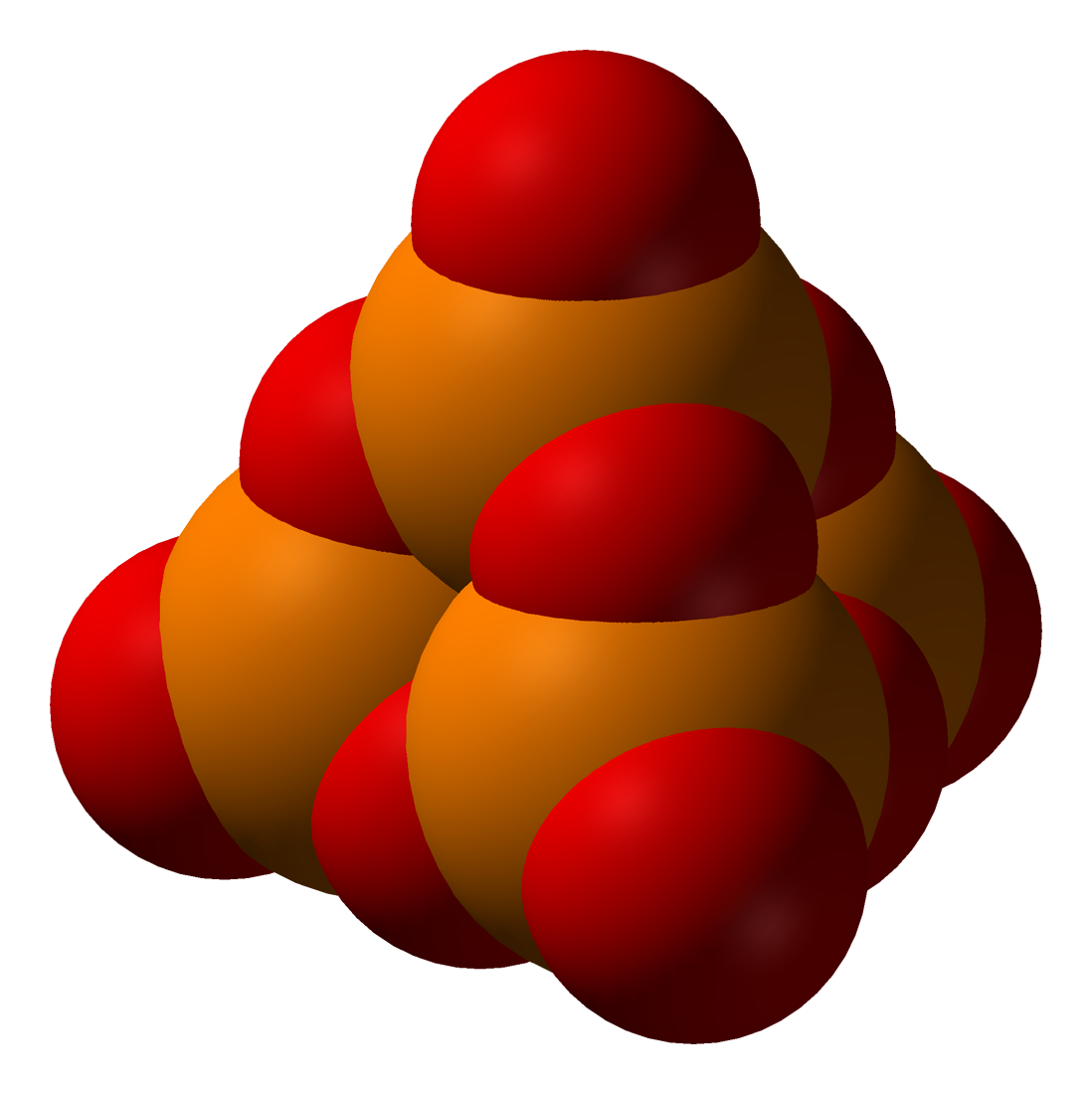
P4O10
모든 산소 원자가 공유되고 수소 원자가 없는 내부 축합의 극한 경우(''x'' = (''n''+2)/2)는 무수물(P''n''O5''n''/2)인 오산화 인(P4O10)이다.
3. 인산염
3. 1. 오르토인산염
수소 원자를 양성자(H+)로 제거하면 인산이 인산염 음이온으로 바뀐다. 부분적으로 제거하면 다양한 인산수소 음이온이 생성된다. 오르토인산(H3PO4)의 음이온은 오르토인산염(PO43-), 인산수소(HPO42-), 인산이수소(H2PO4-)이다.
3. 2. 선형 올리고인산염 및 폴리인산염
두 개 이상의 오르토인산 분자는 탈수되어 더 큰 분자로 축합될 수 있다. 몇 개의 단위체가 축합되면 올리고인산이 생성되고, 더 큰 분자는 폴리인산이라고 한다. 그러나 올리고인산과 폴리인산 이 두 용어의 구분은 잘 정의되어 있지 않다.
예를 들어 피로인산, 삼인산 및 사인산은 다음의 반응에 의해 얻을 수 있다.[9][10]
: 2 → +
: + → +
: + → +
폴리인산 분자의 "골격"은 P와 O 원자가 번갈아가며 연결된 사슬이다. 축합되는 추가 오르토인산 단위에 의해 1개의 추가 H(수소) 원자, 1개의 추가 P(인) 원자 및 3개의 추가 O(산소) 원자가 더해지게 된다. 폴리인산의 일반식은 또는 HO(–P(O)(OH)–O–)''n''H이다.
피로인산()의 해리는 4가지 음이온(''k''−)을 생성하게 되며, 여기서 ''k''의 범위는 1~4이다. 마지막의 것은 피로인산염()이다. 피로인산염은 대부분 수용성이다.
마찬가지로 삼인산()은 삼인산염()을 포함하여 ''k''가 1~5 사이의 범위인 5가지 이상의 음이온 ''k''−을 생성한다. 사인산()은 사인산염()을 포함하여 마찬가지의 방식으로 6가지 이상의 음이온을 생성한다. 각각의 추가되는 인산 단위체에 의해 1개의 인 원자, 3개의 산소 원자, 1개의 수소 원자 또는 음전하가 더해지게 된다.
분지된 폴리인산은 유사하게 분지된 폴리인산 음이온을 생성한다. 이것의 가장 간단한 예는 트라이포스포노 인산(9−) 및 이의 부분적으로 해리된 이온들이다.
선형 또는 분지형의 이러한 고리형이 아닌 폴리인산염 음이온의 일반식은 ''k''−이며, 여기서 ''k''는 1에서 ''n''+2까지 다양할 수 있다. 일반적으로 수용액에서 해리되는 정도 또는 백분율은 용액의 pH에 따라 다르다.
3. 3. 고리형 폴리인산염
인산 단위는 고리(고리형 구조)로 함께 결합되어 메타인산(metaphosphoric acid)을 형성할 수 있다. 가장 단순한 화합물은 화학식이 H3P3O9인 트라이메타인산(trimetaphosphoric acid) 또는 사이클로삼인산(cyclo-triphosphoric acid)이다. 트라이메타인산은 말단이 응축되어 있기 때문에 화학식은 삼인산보다 H2O(물)가 하나 적다. 일반적으로 트라이메타인산염(trimetaphosphate)이라고 불리는 것은 실제로 고리 크기가 혼합되어 있다. 이러한 고리형 화합물의 일반식은 (HPO3)x이며, 여기서 x는 분자 내의 인산 단위체의 수이다. 질산과 원자가가 등전자인 가상의 단량체 모노메타인산(HPO3)은 존재하지 않는 것으로 알려져 있다.
이러한 메타인산이 H+로 수소를 잃으면 메타인산염(metaphosphate)이라고 하는 고리형 음이온이 형성된다. 이러한 음이온을 가지고 있는 화합물의 예로는 격리제 및 식품 첨가물로 사용되는 핵사메타인산 나트륨(Na6P6O18)이 있다.
4. 인산의 화학적 성질
인산 및 인산염 화합물은 극성을 띠기 때문에 일반적으로 물에 잘 용해된다. 알칼리 금속 인산염과 암모늄 인산염은 물에 잘 녹지만, 알칼리 토금속 염은 용해도가 낮다.[11] 모든 산소 원자가 공유되고 수소 원자가 없는 내부 축합의 경우 오산화 인(P4O10)과 같은 무수물(P''n''O5''n''/2)이 생성된다.
4. 1. 용해도
인산 계열은 분자의 극성 때문에 일반적으로 물에 용해된다. 암모늄과 알칼리 금속 인산염은 물에 매우 잘 용해된다. 알칼리 토금속 염은 용해도가 낮아지기 시작하며, 다른 다양한 금속의 인산염은 용해도가 더욱 낮다.[11]4. 2. 가수분해 및 축합
두 개 이상의 오르토인산 분자는 탈수되어 더 큰 분자로 축합될 수 있다. 몇 개의 단위체가 축합되면 올리고인산이 생성되고, 더 큰 분자는 폴리인산이라고 한다. 그러나 올리고인산과 폴리인산 이 두 용어의 구분은 잘 정의되어 있지 않다.
예를 들어 피로인산, 삼인산 및 사인산은 다음의 반응에 의해 얻을 수 있다.
: 2 H3PO4 → H4P2O7 + H2O
: H4P2O7 + H3PO4 → H5P3O10 + H2O
: H5P3O10 + H3PO4 → H6P4O13 + H2O
폴리인산 분자의 "골격"은 P와 O 원자가 번갈아가며 연결된 사슬이다. 축합되는 추가 오르토인산 단위에 의해 1개의 추가 H(수소) 원자, 1개의 추가 P(인) 원자 및 3개의 추가 O(산소) 원자가 더해지게 된다. 폴리인산의 일반식은 H''n''+2P''n''O3''n''+1 또는 HO(–P(O)(OH)–O–)''n''H이다.
반면에 동일한 분자의 두 하이드록실기(–OH) 단위 사이의 축합은 두 개의 수소 원자와 한 개의 산소 원자를 제거하여 삼메타인산의 형성에서와 같이 고리를 생성한다.
: H5P3O10 → H3P3O9 + H2O
인산의 일반식은 H''n''−2''x''+2P''n''O3''n''−''x''+1이며 여기서 ''n''은 인 원자의 수이고, ''x''는 분자 구조의 기본 고리 수이다. 즉 모든 고리를 제거하기 위해 끊어야 하는 결합의 최소수이다.
수용액(물 용액)에서 물은 충분한 물이 공급되면 가수분해를 통해 폴리인산염을 더 작은 인산염으로, 최종적으로는 오르토인산염으로 서서히(몇 시간에 걸쳐) 가수분해한다. 더 높은 온도나 산성 조건은 가수분해 화학 반응을 상당히 가속화할 수 있다.[5]
반대로, 폴리인산 또는 폴리인산염은 종종 인산 용액을 탈수하여 형성된다. 즉, 종종 가열하고 물을 증발시켜 물을 제거함으로써 형성된다.
5. 인산 에스터
인산의 하이드록실기(-OH)는 알코올의 하이드록실기와 축합하여 인산 에스터를 형성할 수 있다. 오르토인산은 3개의 하이드록실기를 갖고 있기 때문에 1, 2 또는 3개의 알코올 분자와 에스터화하여 모노 에스터, 다이에스터 또는 트라이에스터를 형성할 수 있다. 여기서 R기 중 하나는 수소 또는 유기 라디칼일 수 있다. 이인산 에스터 및 삼인산 에스터 등도 또한 가능하다. 이러한 에스터 분자의 인산염에 있는 하이드록실기는 H+ 이온을 잃고 음이온을 형성할 수 있으며, 이는 다시 용액의 pH에 따라 달라진다. 생화학에는 많은 종류의 일인산, 이인산, 삼인산 화합물(본질적으로 에스터)이 있으며, 이들 중 다수는 아데노신 이인산(ADP) 및 아데노신 삼인산(ATP)와 같이 대사에 중요한 역할을 한다.
6. 인산의 응용
인산염 화합물은 세제 및 수처리 등 다양한 분야에 응용된다.
오르토인산염, 피로인산염, 삼인산염 화합물은 세제(세정제) 제형에 널리 사용되어 왔으며, 삼인산 나트륨이 대표적인 예시이다. 피로인산염, 삼인산염, 사인산염 등은 생화학에서 인산 에스터의 일부인 경우 이인산, 삼인산, 사인산 등으로 불리기도 한다.[12][13]
폴리인산염은 식수 공급업체에서 물때 및 부식 제어에 사용된다.[12] 폴리인산염은 상수도관 내부 표면에 보호막을 형성하여 부식을 방지한다.[13]
6. 1. 세제
오르토인산염, 피로인산염, 삼인산염 화합물은 세제(세정제) 제형에 널리 사용되어 왔다. 예를 들어 삼인산 나트륨이 있다. 때때로 피로인산염, 삼인산염, 사인산염 등은 특히 생화학에서 인산 에스터의 일부인 경우 이인산, 삼인산, 사인산 등으로 불린다.[12][13]6. 2. 수처리
폴리인산염은 식수 공급업체에서 물때 및 부식 제어에 사용된다.[12] 폴리인산염은 상수도관 내부 표면에 보호막을 형성하여 부식을 방지한다.[13]6. 3. 기타 응용
오르토인산염, 피로인산염, 삼인산염 화합물은 세제 (세정제) 제제에 일반적으로 사용된다. 삼인산 나트륨이 그 예시이다. 피로인산염, 삼인산염, 사인산염 등은 생화학에서 인산 에스터의 일부인 경우 이인산, 삼인산, 사인산 등으로 불리기도 한다. 또한 이들은 음용수 공급업체에서 물때 및 부식 제어를 위해 사용된다.[12] 폴리인산염은 파이프 내부 표면에 보호막을 형성하여 부식 방지제로 작용한다.[13]7. 한국 사회와 인산
주어진 원본 소스가 없으므로, 이전 응답과 동일하게 섹션 내용을 작성할 수 없습니다. 따라서 수정할 내용도 없습니다.
참조
[1]
논문
Synthesis of anthracyclinones. Part 1. Regioselective alkylation of 5-hydroxyquinizarin
1984
[2]
논문
Studies on the Application of Polyphosphoric Acid as a Condensing Agent. II
1954
[3]
논문
Phosphorus pentoxide-methanesulfonic acid. Convenient alternative to polyphosphoric acid
[4]
서적
CRC Handbook of Chemstry and Physics
Chemical Rubber Co.
1968
[5]
간행물
Phosphoric acid and phosphates
The Interscience Encyclopedia, Inc.
[6]
웹사이트
Polyphosphates for scale and corrosion control
http://www.tramfloc.[...]
Tramfloc, INC.
2009-01
[7]
논문
Ortho-Polyphosphate Corrosion Inhibitors
http://www.govengr.c[...]
2006
[8]
논문
Complete Field Guide to Asymmetric BINOL-Phosphate Derived Brønsted Acid and Metal Catalysis: History and Classification by Mode of Activation; Brønsted Acidity, Hydrogen Bonding, Ion Pairing, and Metal Phosphates
[9]
논문
Synthesis of anthracyclinones. Part 1. Regioselective alkylation of 5-hydroxyquinizarin
1984
[10]
논문
Studies on the Application of Polyphosphoric Acid as a Condensing Agent. II
1954
[11]
간행물
Phosphoric acid and phosphates
The Interscience Encyclopedia, Inc.
[12]
웹인용
Polyphosphates for scale and corrosion control
http://www.tramfloc.[...]
Tramfloc, INC.
2010-12-23
[13]
논문
Ortho-Polyphosphate Corrosion Inhibitors
http://www.govengr.c[...]
2006
[14]
논문
Complete Field Guide to Asymmetric BINOL-Phosphate Derived Brønsted Acid and Metal Catalysis: History and Classification by Mode of Activation; Brønsted Acidity, Hydrogen Bonding, Ion Pairing, and Metal Phosphates
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com