크롬산칼륨
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
크롬산칼륨은 화학식 K₂CrO₄를 갖는 칼륨의 크롬산염이다. 사방정계 결정 구조를 가지며, 중크롬산칼륨을 수산화칼륨으로 처리하거나 삼산화크롬과 수산화칼륨을 용융시켜 제조할 수 있다. 주로 실험실에서 산화제, 분석 시약으로 사용되며, 특히 은 이온의 비색 분석, 침전 적정의 지시약으로 활용된다. 타라파카이트라는 천연 광물 형태로도 존재하지만 매우 드물다. 다른 Cr(VI) 화합물과 마찬가지로 발암 물질이며, 부식성이 있어 눈 손상, 생식 능력 저하, 유전적 손상 등을 유발할 수 있다.
더 읽어볼만한 페이지
- 크로뮴산염 - 다이크로뮴산 포타슘
다이크로뮴산 포타슘은 유기 화학에서 강력한 산화제로 사용되며 다양한 분야에서 활용되지만, 인체와 환경에 유해하여 법적으로 규제받고 취급 및 폐기 시 주의가 필요한 무기 화합물이다. - 칼륨 화합물 - 염화 칼륨
염화칼륨(KCl)은 칼륨 이온과 염화물 이온으로 이루어진 이온성 화합물로, 칼륨 비료, 화학 공업, 의학, 사형 집행 등 다양한 용도로 사용되며, 면심입방구조와 광학적 특성을 지니고, 캐나다, 러시아, 벨라루스 등에서 주로 생산된다. - 칼륨 화합물 - 아세트산 칼륨
아세트산 칼륨은 아세트산을 칼륨 염기로 처리하여 제조되며, 제빙제, 소화제, 식품 첨가물, 의약품, 조직 보존 등 다양한 용도로 사용된다. - 산화제 - 왕수
왕수는 진한 질산과 염산을 1:3 몰 비율로 혼합한 것으로, 금이나 백금 같은 귀금속을 녹일 수 있는 강력한 산화력을 가진 용액이며, 염화 금산 제조, 식각, 분석화학 등에 사용된다. - 산화제 - 질산
질산은 강산이자 강력한 산화력을 지닌 무색 액체로, 비료, 폭발물, 나일론 생산 등 산업에 널리 쓰이지만 부식성과 테러 악용 위험성도 있으며, 현재는 주로 암모니아 산화법으로 생산된다.
2. 구조
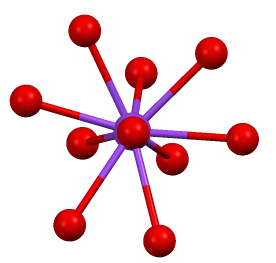
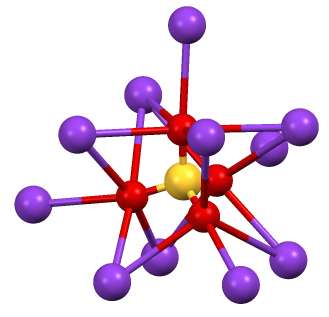
두 가지 결정 형태가 알려져 있으며, 둘 다 황산칼륨과 매우 유사하다. 일반적인 형태는 사방정계 β-K2CrO4이지만, 66°C 이상에서는 α-형태로 변환된다.[1] 고체는 황산칼륨과 유사한 결정 구조를 가지며, 사방정계에 속하고 격자 상수는 a = 5.92Å, b = 10.39Å, c = 7.68Å이다.[6] 구조는 복잡하지만, 사면체형 크로뮴산염 이온(CrO42-)은 전형적인 사면체 기하학 구조를 가진다.[2]
중크롬산칼륨(Potassium dichromate)을 수산화칼륨(Potassium hydroxide)으로 처리하여 제조할 수 있다.
크롬산칼륨은 가격이 저렴한 나트륨염과 달리, 주로 무수염이 필요한 실험실 작업에 사용된다.[1] 유기 합성에서는 산화제로 활용되며,[1] 분석화학 분야에서도 중요한 역할을 한다. 예를 들어, 정성 무기 분석에서 은 이온을 검출하는 비색 분석 시약으로 사용되고, 질산은과 염화나트륨을 이용한 침전 적정에서는 반응의 종말점을 나타내는 지시약으로 쓰인다.[1] 또한 특정 이온을 검출하기 위한 침전 시약으로도 이용된다. 공업적으로는 산화제, 매염제, 분석용 시약 등으로 사용된다.
3. 제조 및 반응
:
또는 수산화칼륨과 삼산화크롬(Chromium trioxide)을 용융시켜 만들기도 한다.
:
공업적으로는 중크롬산칼륨을 탄산칼륨과 반응시켜 생산하며, 이렇게 생성된 크롬산칼륨은 산화제, 매염제, 분석용 시약 등으로 사용된다.
:
용액 상태에서 칼륨 및 나트륨 중크롬산염의 거동은 매우 유사하다. 납(II)질산염으로 처리하면 주황색의 납(II)크롬산염 침전물이 생성된다.
고체 상태의 크롬산칼륨은 황산칼륨과 유사한 결정구조를 가지며, 사면체 형태의 크롬산 이온을 포함한다. 결정계는 사방정계에 속하고, 격자상수는 a = 5.92Å, b = 10.39Å, c = 7.68Å이다.[6]
수용액은 크롬산 이온의 가수분해 반응 때문에 약염기성을 띤다.
:
이 수용액을 산성으로 만들면 중크롬산 이온이 생성되면서 용액의 색이 황색에서 주황색으로 변한다.
:
분석화학에서는 침전 시약으로 활용된다. 은 이온(Ag⁺)과 반응하면 적갈색의 크롬산은(Ag₂CrO₄) 침전이 생기고, 바륨 이온(Ba²⁺)과 반응하면 황색의 크롬산바륨(BaCrO₄) 침전이 생긴다.
:
:
4. 응용
4. 1. 산화제
크롬산칼륨은 산화제로서 유기 합성에 사용된다.[1] 또한 공업적으로도 산화제로 사용된다.
4. 2. 분석 시약
정성 무기 분석에 사용되는데, 예를 들어 은 이온의 비색 분석 시약으로 활용된다. 또한 질산은과 염화나트륨을 이용한 침전 적정(모어법)에서 지시약으로 사용되며, 과량의 Ag+ 이온이 존재할 때 크롬산칼륨은 적색의 Ag2CrO4 침전을 형성하여 반응 종말점을 나타낸다.[1]
분석화학에서는 특정 이온을 검출하기 위한 침전 시약으로도 사용된다.4. 3. 기타
저렴한 나트륨염과 달리, 크롬산칼륨은 주로 무수염이 필요한 실험실 작업에 사용된다.[1] 산화제로서 유기 합성에 사용되며, 정성 무기 분석에도 사용되는데, 예를 들어 은 이온의 비색 분석 시약으로 활용된다. 또한 질산은과 염화나트륨을 이용한 침전 적정에서 지시약으로 사용되며(이들은 서로 표준물질이자 적정액으로 사용될 수 있다), 과량의 은 이온이 존재할 때 크롬산칼륨은 적색으로 변한다.
공업적으로는 중크롬산칼륨을 탄산칼륨과 반응시켜 생성한다. 이 방법으로 만들어진 크롬산칼륨은 산화제, 매염제, 분석용 시약 등에 사용된다.
: K2Cr2O7 + K2CO3 → 2 K2CrO4 + CO2
고체 상태의 크롬산칼륨은 황산칼륨과 유사한 결정구조를 가지며, 사면체형 크롬산 이온(CrO42-)을 포함한다. 사방정계 결정계에 속하며, 그 격자상수는 a = 5.92 Å, b = 10.39 Å, c = 7.68 Å이다.[6]
수용액 상태에서는 크롬산 이온의 가수분해 반응으로 인해 약염기성을 나타낸다.
: CrO42- + H2O ⇌ HCrO4- + OH-
수용액을 산성으로 만들면 중크롬산 이온(Cr2O72-)이 생성되면서 용액의 색이 황색에서 오렌지색으로 변한다.
: 2 CrO42- + 2 H+ ⇌ Cr2O72- + H2O
분석화학에서는 침전 시약으로 사용되기도 한다. 은 이온(Ag+)과 반응하면 적갈색의 크롬산은(Ag2CrO4) 침전이 생성되고, 바륨 이온(Ba2+)과 반응하면 황색의 크롬산바륨(BaCrO4) 침전이 생성된다.
: 2 Ag+ + CrO42- → Ag2CrO4
: Ba2+ + CrO42- → BaCrO4
5. 발생
타라파카이트는 크롬산칼륨의 천연 광물 형태이다. 이는 매우 드물게 발생하며, 현재까지 아타카마 사막의 일부 지역에서만 발견된 것으로 알려져 있다.
6. 안전성
다른 6가 크롬(Cr(VI)) 화합물과 마찬가지로, 크롬산칼륨은 발암물질이다.[3] 이 화합물은 또한 부식성이 있으며, 노출되면 심각한 눈 손상이나 실명을 초래할 수 있다.[4] 사람에게 노출될 경우 생식능력 저하, 유전적 손상, 태아 손상 등을 일으킬 수 있다.
산업안전보건법에서는 "크롬산 및 그 염"으로 제2류 특정화학물질로 지정되어 있다.
참조
[1]
논문
Chromium Compounds
Wiley-VCH
[2]
논문
Structure cristalline de la forme 'basse temperature' du sulfate de potassium K2SO4-beta (Crystal structure of the "low temperature" β-form of potassium sulfate)
[3]
서적
Volume 100C: Arsenic, Metals, Fibres, and Dusts
https://publications[...]
International Agency for Research on Cancer
2020-01-05
[4]
웹사이트
Potassium dichromate MSDS
http://hazard.com/ms[...]
JT Baker
[5]
논문
The NBS tables of chemical thermodynamics properties
[6]
서적
化学大辞典
共立出版
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com