민무늬근육
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
민무늬근육은 액틴과 미오신을 포함하는 방추형 세포로 구성되며, 자율 신경의 지배를 받는다. 골격근이나 심근과 달리 가로무늬가 없고, 신호 전달 방식에 따라 단위성 및 다원성 평활근으로 분류된다. 단위 민무늬근은 갭 연접을 통해 활동 전위가 전파되어 조화롭게 수축하며, 다원성 민무늬근은 개별적으로 신경의 지배를 받는다. 민무늬근은 수축 조절, 흥분-수축 연결 등에서 골격근, 심장근과 다르며, 탄성이 뛰어나 위장관, 방광 등에서 중요한 역할을 한다. 수축은 미오신 경쇄의 인산화, 즉 미오신 경쇄 키나아제(MLCK)에 의해 조절되며, 이완은 미오신 경쇄 인산분해효소(MLCP)에 의한 탈인산화로 일어난다. 민무늬근육은 혈압 조절, 연동 운동, 레닌 분비 등 다양한 생리적 기능을 수행하며, 여러 성장 인자와 신경체액성 인자에 의해 성장과 분화가 조절된다. 관련 질병으로는 다계통 평활근 기능 장애 증후군, 자가면역 질환, 평활근 종양, 동맥경화증 등이 있다.
더 읽어볼만한 페이지
- 근육조직 - 심장근육
심장근육은 심장 벽을 구성하는 가로무늬근으로, 심근세포들이 사이원반을 통해 연결되어 심장 융합체를 이루고 전기적 신호 전달을 통해 심장의 펌프 기능을 효율적으로 수행하며, 관련 질환은 선진국 주요 사망 원인이다. - 근육계 - 힘줄
힘줄은 건세포로 이루어진 밀집규칙결합조직으로, 근육과 뼈를 연결하여 힘을 전달하며, I형 콜라겐 섬유와 프로테오글리칸으로 구성되어 탄성과 강도를 가지며, 위치 힘줄과 에너지 저장 힘줄로 기능이 나뉘고, 손상 시 염증, 수복/증식, 개조 단계를 거쳐 치유되며, 과거에는 섬유로 활용되고 일부 문화권에서는 식용으로도 사용되었다. - 근육계 - 단백질 보충제
단백질 보충제는 근력 훈련과 함께 섭취 시 근육량 증가 및 근력 향상에 도움을 줄 수 있으며, 과체중인 사람의 체중 및 지방 감소, 노인의 단백질 섭취 요구량 충족에도 기여할 수 있다.
| 민무늬근육 | |
|---|---|
| 개요 | |
| 유형 | 불수의근 |
| 형태 | 비가로무늬근 |
| 상세 정보 | |
| 영어 명칭 | Smooth muscle |
| 라틴어 명칭 | muscularis levis, muscularis nonstriatus |
| 전구체 | 해당 정보 없음 |
| 계통 | 해당 정보 없음 |
| 동맥 | 해당 정보 없음 |
| 정맥 | 해당 정보 없음 |
| 신경 | 해당 정보 없음 |
| 림프 | 해당 정보 없음 |
2. 구조
민무늬근육(평활근)은 방추형의 개별 세포로 구성되며, 세포 내부에 액틴과 미오신 단백질이 존재한다. 골격근이나 심근과는 달리 가로무늬가 보이지 않는 것이 특징이다. 민무늬근육은 자율 신경의 지배를 받으며, 신호 전달 메커니즘에 따라 '''단위성 평활근'''과 '''다원성 평활근'''으로 분류된다.
2. 1. 맨눈 해부학

민무늬근은 구조와 기능에 따라 크게 두 가지 유형으로 나눌 수 있다: '''단위 민무늬근'''(single-unit smooth muscle)과 '''다단위 민무늬근'''(multi-unit smooth muscle)이다.
=== 단위 민무늬근 ===
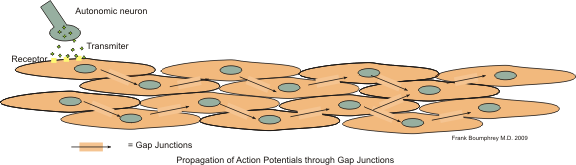
내장 민무늬근(visceral smooth muscle) 또는 단일 연접 평활근이라고도 불린다. 대부분의 민무늬근이 이 유형에 속하며, 주로 내부 기관(내장)의 벽에서 발견된다. 예를 들어, 혈관(큰 탄성 동맥 제외), 요로, 소화관 등을 덮고 있다. (심장은 심장근으로 이루어져 있어 민무늬근이 발견되지 않는다.)
단위 민무늬근의 세포들은 다발을 이루며, 자율 신경 섬유에 의해 지배된다. 이 세포들은 서로 간극 연접(gap junction) 또는 갭 결합으로 촘촘하게 연결되어 있어, 활동 전위가 한 세포에서 인접한 세포로 빠르게 전파될 수 있다. 이러한 구조 덕분에 단위 민무늬근 다발은 마치 하나의 큰 세포처럼(세포 융합체, syncytium) 작동하여 전체 근육이 조화롭게 수축하거나 이완할 수 있다. 예를 들어, 출산 중 자궁 근육의 수축이 이에 해당한다.[3]
단위 민무늬근은 근원성(myogenic) 특징을 가지는데, 이는 운동 뉴런의 직접적인 자극 없이도 스스로 규칙적인 수축 활동을 일으킬 수 있음을 의미한다. 일부 세포는 내재적인 전기적 활동으로 리듬을 만드는 페이스메이커 세포(pacemaker cell) 역할을 하여 활동 전위를 생성한다. 따라서 신경 자극 없이도 활성화될 수 있다. 일반적으로 교감 신경과 부교감 신경의 이중 지배를 받는다.
=== 다단위 민무늬근 ===
다단위 민무늬근(multiunit smooth muscle) 또는 다원성 평활근이라고도 불린다. 이 유형의 민무늬근은 기관, 눈의 홍채, 그리고 큰 탄성 동맥 등에서 발견된다.
단위 민무늬근과 달리, 다단위 민무늬근의 세포들은 간극 연접이 거의 없어 서로 전기적으로 연결되어 있지 않다. 각 세포는 독립적으로 자율 신경계 뉴런의 지배를 받으며, 수축은 신경 자극에 의해 시작된다(신경성, neurogenic). 따라서 각 세포가 개별적으로 수축하며, 전체 근육의 정교한 조절이 가능하다. 교감 신경 또는 부교감 신경 중 어느 한쪽의 지배를 받는다. 눈동자의 크기를 조절하는 동공산대근과 동공괄약근이 다단위 민무늬근의 대표적인 예이다.
=== 분류의 복잡성 ===
'단일 단위'와 '다단위'라는 분류는 다소 단순화된 측면이 있다. 실제 민무늬근은 대부분 다양한 신경 요소의 복합적인 제어를 받으며, 세포 간의 통신이나 국소적으로 생성되는 활성제/억제제의 영향도 받는다. 이로 인해 다단위 민무늬근에서도 어느 정도 조정된 반응이 나타날 수 있다.[4]
=== 다른 근육과의 차이 및 세포 특징 ===
민무늬근은 구조, 기능, 수축 조절, 흥분-수축 연결 방식 등에서 골격근 및 심장근과 차이가 있다. 특히 줄무늬근보다 탄성이 뛰어나며, 더 넓은 길이 범위 내에서도 장력을 유지하며 수축할 수 있다. 이러한 신축성은 내용물의 부피 변화가 큰 창자나 방광과 같은 기관에서 중요하다. 위장관의 민무늬근은 민무늬근 세포(SMC), 카할 간질 세포(ICC), 혈소판 유래 성장 인자 수용체 알파(PDGFRα) 세포들이 전기적으로 연결된 복합체(SIP 기능적 세포 융합체)에 의해 활성화된다.[5][6]
개별 민무늬근 세포는 방추형(가늘고 긴 모양)이며, 내부에 액틴과 미오신 필라멘트가 존재한다. 하지만 골격근이나 심근과 달리 규칙적인 배열이 없어 가로무늬가 보이지 않는다. 민무늬근을 지배하는 신경은 자율 신경이며, 골격근처럼 명확한 신경-근육 접합부 대신 신경 섬유 곳곳의 팽대부(varicosity)에서 신호 전달 물질이 방출되어 근육 세포에 영향을 미친다. 세포 자체의 구체적인 수축 메커니즘이나 분화 및 탈분화 과정은 아직 완전히 밝혀지지 않았다.
2. 2. 미세해부학
민무늬근육을 이루는 개별 세포는 방추형이며, 내부에 액틴과 미오신 같은 수축 단백질을 포함하고 있다. 하지만 이 단백질들이 골격근이나 심근처럼 규칙적으로 배열되어 있지 않아 가로무늬는 보이지 않는다. 민무늬근육은 자율 신경의 지배를 받으며, 신호 전달 방식에 따라 '''단위성 평활근'''과 '''다원성 평활근'''으로 분류된다.2. 2. 1. 평활근 세포
민무늬근육 세포는 중간이 넓고 양쪽 끝이 가늘어지는 방추형 근육 세포로, 하나의 핵을 가지고 있다. 가로무늬근과 마찬가지로 민무늬근육도 근육 수축을 할 수 있다. 이완된 상태에서 각 세포는 길이가 30~200 마이크로미터로, 골격근 세포보다 수천 배 짧다.[1] 근원섬유는 없지만, 세포질의 대부분은 수축 능력을 가진 단백질 미오신과 액틴으로 채워져 있다.[7]
평활근의 개별 세포는 방추형이며, 내부에 액틴과 미오신이 존재하는 것이 확인되었다. 골격근, 심근과 달리 가로무늬는 보이지 않으며, 세포 자체의 수축 메커니즘은 아직 불명확하다. 지배 신경은 자율 신경이다. 평활근 세포의 분화 및 탈분화 메커니즘은 아직 밝혀지지 않았다. 골격근과 달리 신경-근육 접합부는 명확하지 않으며, 신경 섬유의 곳곳에 있는 팽창으로부터 신호가 전달된다.
신호 전달 메커니즘에 따라, '''단위성 평활근'''과 '''다원성 평활근'''으로 분류된다.
2. 2. 2. 미오신
민무늬근육에서 발견되는 미오신은 주로 II형이다.[10]- 미오신 II는 두 개의 ''중쇄''(MHC)를 포함하며, 이들은 각각 머리와 꼬리 도메인을 구성한다. 각 중쇄는 N-말단에 머리 도메인을 가지고 있으며, C-말단의 꼬리 부분은 코일 코일 구조를 이루며 두 개의 중쇄를 함께 묶는다. 이는 마치 두 마리의 뱀이 서로 감겨 있는 카두케우스와 유사한 형태이다. 결과적으로 미오신 II는 두 개의 머리를 가진다. 민무늬근에는 중쇄 미오신 II를 암호화하는 단일 유전자(MYH11[8])가 존재하지만, 이 유전자의 스플라이스 변이체를 통해 네 가지 뚜렷한 아이소폼이 만들어진다.[10] 또한, 민무늬근에는 수축에 직접 관여하지 않는 다른 여러 유전자에서 유래한 MHC가 포함될 수도 있다.[10]
- 미오신 II는 또한 4개의 ''경쇄''(MLC)를 포함한다. 각 머리에는 2개씩 결합하며, 이들은 각각 20 kDa(MLC20)과 17 kDa(MLC17)의 분자량을 가진다.[10] 이 경쇄들은 머리와 꼬리 사이의 "목" 영역에서 중쇄에 결합한다.
- MLC20은 ''조절 경쇄''라고도 불리며, 근육 수축 과정에 능동적으로 참여한다.[10] 민무늬근에는 두 가지 MLC20 아이소폼이 존재하며, 이들은 서로 다른 유전자에 의해 암호화된다. 하지만 이 중 하나의 아이소폼만이 수축에 관여하는 것으로 알려져 있다.
- MLC17은 ''필수 경쇄''라고도 불린다.[10] 정확한 기능은 아직 명확히 밝혀지지 않았지만, MLC20과 함께 미오신 머리의 구조적 안정성을 유지하는 데 기여하는 것으로 여겨진다.[10] MLC17 유전자에서 대립 유전자 스플라이싱이 일어나 두 가지 변이체(MLC17a/b)가 존재한다.[10]
이러한 다양한 중쇄와 경쇄의 조합을 통해 이론적으로는 수백 가지 종류의 미오신 구조가 가능하지만, 특정 민무늬근 조직 내에서는 실제로 몇 가지 조합만이 사용되거나 허용될 가능성이 높다.[10] 예를 들어, 자궁에서는 미오신 발현의 변화가 생리 주기 동안 관찰되는 자궁 수축 방향의 변화를 가능하게 할 수 있다는 가설이 제기되었다.[10]
2. 2. 3. 액틴
민무늬근육 세포질의 대부분은 근육 수축 능력을 가진 단백질인 미오신과 액틴으로 채워져 있다.[7] 골격근이나 심근과 달리 가로무늬가 보이지 않는데, 이는 액틴과 미오신 필라멘트의 배열 방식이 다르기 때문이다. 민무늬근육 세포 내부에서 액틴과 미오신이 어떻게 상호작용하여 수축을 일으키는지에 대한 정확한 메커니즘은 아직 완전히 밝혀지지 않았다.
2. 2. 4. 기타 관련 단백질
민무늬근육은 가로무늬근육과 달리 트로포닌 단백질을 포함하지 않는다. 대신 다음과 같은 단백질들이 중요한 역할을 한다.- '''칼모듈린''': 민무늬근육에서 조절 기능을 수행한다.
- '''칼데스몬''': 액틴, 미오신, 트로포미오신을 서로 연결하여 민무늬근육이 장력을 유지하는 능력을 향상시키는 데 관여하는 것으로 여겨진다.[10]
- '''칼포닌''': 액틴과 거의 같은 수로 존재하며, 하중을 지지하는 역할을 하는 것으로 추정된다.[10]
- '''트로포미오신''': 민무늬근육에도 존재하며, 가는 필라멘트 전체 길이에 걸쳐 분포한다. 가로무늬근육에서는 칼슘이 없을 때 액틴-미오신 상호작용을 차단하지만, 민무늬근육에서의 기능은 아직 명확히 밝혀지지 않았다.[10]
또한, 칼모듈린, 칼데스몬, 칼포닌 세 단백질은 미오신 복합체의 ATP가수분해효소 활성을 억제하여 근육 수축에 필요한 에너지 사용을 조절하는 역할을 할 수도 있다.[10]
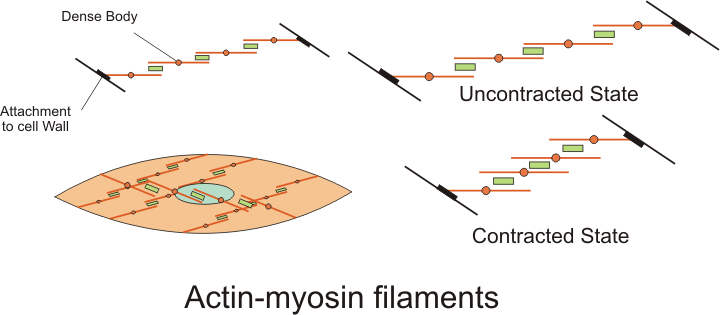
2. 2. 5. 치밀 소체
액틴 필라멘트가 부착되는 구조로, 횡문근의 Z선과 유사한 역할을 한다.[7] 치밀 소체는 알파-액티닌(α-액티닌)이 풍부하며,[10] 중간 섬유(주로 비멘틴과 데스민으로 구성)를 부착하여 액틴 필라멘트가 힘을 가할 수 있는 닻 역할을 하는 것으로 보인다.[10] 또한 세포 골격에서 발견되는 베타-액틴과 관련이 있어, 수축 기구와 세포 골격 양쪽에서 발생하는 장력을 조절하는 기능을 할 수 있음을 시사한다.[10] 전자 현미경으로 관찰 시 다른 부분보다 어둡게 나타나 전자 밀도가 높다고 묘사되기도 한다.[15]중간 섬유는 치밀 소체를 통해 다른 중간 섬유와 연결되고, 최종적으로는 민무늬근 세포의 세포막에 있는 부착 반점(국소 접착이라고도 함)에 부착된다. 이 부착 반점은 세포막 주변에 흩어져 있는 ''치밀 띠''(또는 치밀 판)를 형성하며,[7] 액틴과 미오신 복합체가 수축할 때 발생하는 힘은 중간 섬유를 통해 치밀 띠와 부착 반점을 거쳐 세포막으로 전달된다.[7][10]
2. 2. 6. 수축
민무늬근육 세포는 내부에 액틴과 미오신 필라멘트를 가지고 있으며, 이들의 상호작용을 통해 수축한다. 이는 골격근이나 심근과 달리 가로무늬가 보이지 않는 특징과 관련된다. 그러나 세포 자체의 구체적인 수축 메커니즘은 아직 완전히 밝혀지지 않았다.[10]수축 과정 동안 힘 발생을 최적화하기 위해 세포 내부의 수축 기계 장치가 공간적으로 재구성된다.[10] 이러한 재구성의 한 예로, 세린56 위치에서 p21 활성화 키나아제에 의해 비멘틴 단백질이 인산화되면, 비멘틴 중합체가 부분적으로 분해되어 구조 변화에 기여한다.[10] 또한, 일부 조직에서는 이완 상태와 수축 상태 사이에서 액틴과 미오신의 비율이 변하며, 미오신 필라멘트의 수와 길이도 역동적으로 변화하는 것으로 관찰되었다.
분리된 단일 평활근 세포를 관찰하면, 나선형 코르크 나사처럼 꼬이는 방식으로 수축하는 것을 볼 수 있다. 세포가 수축할 때 긴 축을 따라 수축성 단백질인 액틴과 미오신이 상호작용하는 구역이 나타난다.
평활근을 포함하는 조직은 종종 늘어나야 하므로 탄력성은 평활근의 중요한 속성이다. 평활근 세포는 콜라겐(주로 I형 및 III형), 엘라스틴, 당단백질, 프로테오글리칸 등을 포함하는 복잡한 세포외 기질을 분비할 수 있다. 평활근 세포는 또한 세포외 기질의 이러한 단백질과 상호 작용하는 특정 엘라스틴 및 콜라겐 수용체를 가지고 있다. 이러한 섬유들은 세포외 기질과 함께 조직의 점탄성에 기여한다. 예를 들어, 대동맥은 중간막 내의 평활근 덕분에 점탄성을 가지며, 심장의 펌프 작용으로 인한 혈압 변화를 완충하고 혈류를 일정하게 유지하는 Windkessel 효과를 나타낸다.[10]
평활근의 수축은 자율 신경에 의해 조절된다. 골격근과 달리 명확한 신경-근육 접합부는 없으며, 신경 섬유의 여러 군데에 있는 팽창된 부분(varicosity)으로부터 신호가 전달된다. 신호 전달 메커니즘에 따라, 여러 세포가 하나의 단위처럼 동시에 수축하는 단위성 평활근과 각 세포가 개별적으로 신경의 지배를 받아 수축하는 다원성 평활근으로 분류된다. 평활근 세포의 분화 및 탈분화 메커니즘은 아직 명확히 밝혀지지 않았다.
2. 2. 7. 작은함몰(소포)
근육세포막(근초)에는 작은함몰(Caveolae, 소포)이라고 불리는 구조가 존재한다. 작은함몰은 지질 뗏목이라는 특수한 막 영역에 위치한 미세한 함몰 구조로, 세포 신호전달 과정과 이온 통로 기능에 중요한 역할을 수행한다. 근육세포의 세포질인 근형질 쪽으로 움푹 들어간 이 구조 안에는 신호 전달 및 이온 수송과 관련된 다양한 분자들이 밀집되어 있다.작은함몰 내부에 존재하는 주요 분자들은 다음과 같다.
| 종류 | 포함된 분자 예시 |
|---|---|
| 수용체 | 프로스타사이클린, 엔도텔린, 세로토닌, 무스카린 수용체, 아드레날린 수용체 | |
| 이차 전달자 생성기 | 아데닐산 고리화효소, 포스포리파제 C | |
| G 단백질 | RhoA, G 알파 | |
| 키나아제 | Rho 키나아제(ROCK), 단백질 키나아제 C, 단백질 키나아제 A | |
| 이온 통로 | L형 칼슘 통로, ATP 민감성 칼륨 통로, 칼슘 민감성 칼륨 통로 |
민무늬근육은 외부 자극을 받으면 흥분하여 수축을 일으킨다. 민무늬근육 세포는 길쭉한 방추 모양이며, 내부에 액틴과 미오신 필라멘트를 가지고 있지만 골격근이나 심근과는 달리 가로무늬 구조는 보이지 않는다. 세포 자체의 수축 메커니즘은 아직 불명확하다.
작은함몰은 종종 근소포체나 미토콘드리아와 가까운 위치에 존재하며, 세포막에서 신호 전달에 관여하는 여러 분자들을 효율적으로 조직화하고 배열하는 역할을 하는 것으로 여겨진다. 이를 통해 세포는 외부 신호에 보다 빠르고 정확하게 반응할 수 있다.
3. 흥분-수축 결합
민무늬근육은 주로 자율 신경계의 지배를 받는다. 골격근처럼 명확한 신경근 접합부 구조는 없으며, 대신 신경 섬유 중간중간에 부풀어 오른 부분(팽대부)에서 신경전달물질이 방출되어 주변의 근육 세포로 신호가 전달된다. 신호 전달 메커니즘에 따라 크게 '''단위성 민무늬근'''(single-unit smooth muscle)과 '''다원성 민무늬근'''(multi-unit smooth muscle)으로 나눌 수 있다. 평활근 세포의 분화 및 탈분화 메커니즘은 아직 밝혀지지 않았다.
3. 1. 자극 및 요인 유도
민무늬근육은 스스로 수축하는 능력을 가지고 있다. 이는 이온 통로의 활동이나, 창자 내 특수한 페이스메이커 세포인 카할 간질 세포가 만들어내는 리듬에 따른 것이다.
또한, 민무늬근육의 수축과 이완은 다양한 외부 요인에 의해서도 조절된다. 호르몬, 약물, 신경전달물질과 같은 여러 물리화학적 작용제가 이에 해당하며, 특히 자율 신경계의 조절이 중요하다.
혈관, 기도 및 폐, 신장, 질 등 몸의 여러 부위에 있는 민무늬근육은 서로 다른 특징을 가진다. 각 부위의 민무늬근육 세포는 이온 통로, 호르몬 수용체, 세포 내부의 신호 전달 경로, 그리고 기능을 결정하는 여러 단백질의 종류와 양에서 차이를 보인다. 이러한 차이 때문에 같은 자극이라도 부위에 따라 다른 반응을 나타낼 수 있다.
3. 1. 1. 외부 물질
민무늬근육의 수축과 이완은 다양한 외부 물질에 의해 조절될 수 있다. 여기에는 호르몬, 약물, 신경전달물질 등이 포함되며, 특히 자율 신경계에서 분비되는 물질이 중요한 역할을 한다.
예를 들어, 신경전달물질인 노르에피네프린과 호르몬인 에피네프린은 혈관 평활근에 작용하여 혈관의 수축 또는 이완을 유발한다. 피부, 위장 관계, 신장, 뇌의 혈관에 분포하는 민무늬근육은 교감 신경계 자극이나 부신 수질에서 분비되는 노르에피네프린과 에피네프린에 반응하여 혈관 수축을 일으킨다. 이 반응은 주로 알파-1 아드레날린 수용체를 통해 매개된다. 반면, 골격근과 심근 내 혈관의 민무늬근육은 동일한 카테콜아민에 대해 혈관 확장 반응을 보이는데, 이는 베타 아드레날린 수용체를 가지고 있기 때문이다. 이처럼 혈관의 위치에 따라 다른 종류의 아드레날린 수용체가 분포하기 때문에 동일한 외부 물질이라도 다른 생리적 반응을 나타낼 수 있다.
기체 농도 역시 민무늬근육의 중요한 조절 인자이다. 일반적으로 동맥 평활근은 이산화탄소(CO₂) 농도가 높아지면 이완하여 혈관이 확장되고, 산소(O₂) 농도가 높아지면 수축한다. 그러나 폐의 폐 혈관 평활근은 독특한 반응을 보여, 높은 산소 농도에 노출되면 혈관이 확장되고 산소 농도가 감소하면 오히려 수축한다. 또한, 폐의 기도를 구성하는 세기관지 평활근은 이산화탄소 농도가 높을 때 확장하고 낮을 때 수축한다. 이러한 폐 혈관과 세기관지 평활근의 반응은 폐 내부에서 혈류(관류)와 공기 흐름(환기)이 효율적으로 이루어지도록 조절하는 데 기여한다.
최근 연구에서는 스핑고신-1-인산(S1P)이라는 신호 전달 물질이 혈관 평활근 수축 조절에 중요한 역할을 하는 것으로 밝혀졌다. 혈관 벽에 가해지는 압력(경벽압)이 증가하면, 스핑고신 인산화효소 1이 스핑고신을 S1P로 인산화시킨다. 생성된 S1P는 세포막의 S1P2 수용체에 결합하여 세포 내 칼슘 농도를 일시적으로 증가시키고, Rac 및 Rhoa 신호 전달 경로를 활성화한다. 이 일련의 과정은 미오신 가벼운-사슬 인산화효소(MLCK)의 활성을 높이고 미오신 경쇄 인산가수분해효소(MLCP)의 활성을 낮추어 결과적으로 근육 수축을 촉진한다. 이를 통해 세동맥은 혈압이 상승할 때 저항을 증가시켜 혈류를 일정하게 유지할 수 있다. 신호 전달 경로 중 Rhoa 및 Rac 부분은 저항성 동맥의 긴장도를 조절하는 칼슘 비의존적인 방식을 제공하기도 한다.[21][16]
3. 2. 자극의 확산
민무늬근에서 자극, 즉 흥분이 퍼져나가는 방식은 근육의 종류에 따라 다르다. 특히 단위 민무늬근(내장 민무늬근 또는 단일 연접 평활근이라고도 함)은 자극 확산에서 독특한 특징을 보인다.[3]
단위 민무늬근을 구성하는 여러 근육세포들은 서로 간극 연접(gap junction)이라는 특수한 연결 구조를 통해 매우 가깝게 연결되어 있다. 이 간극 연접은 세포들 사이에 작은 통로 역할을 하여, 한 세포에서 발생한 활동 전위(전기적 신호)나 칼슘 이온 같은 화학 물질이 인접한 세포로 빠르게 전달될 수 있도록 한다.[3][5]
따라서 단위 민무늬근에서는 자율 신경계로부터 신호를 받은 하나의 세포가 흥분하면, 그 흥분이 마치 파도처럼 간극 연접을 통해 주변의 다른 세포들로 빠르게 퍼져나간다. 이러한 방식으로 연결된 근육 세포 그룹 전체는 거의 동시에 수축하게 되는데, 마치 하나의 큰 세포처럼 움직인다고 하여 이를 기능적 세포 융합체(functional syncytium)라고 부르기도 한다.[3] 이러한 특성 덕분에 소화관, 자궁, 방광과 같은 내부 기관의 벽을 이루는 단위 민무늬근은 전체적으로 조화롭고 일사불란하게 수축하거나 이완할 수 있다.[3]
단위 민무늬근은 교감 신경과 부교감 신경의 이중 지배를 받으며 조절되지만, 일부 세포는 외부 신경 자극 없이도 스스로 규칙적인 전기 신호를 만들어내는 페이스메이커 세포 역할을 하기도 한다. 이는 신경계의 직접적인 명령 없이도 근육이 자체적으로 리듬을 가지고 수축할 수 있게 하는 근원성(myogenic) 특징이다.[3]
결론적으로, 단위 민무늬근에서 자극이 퍼지는 핵심 원리는 간극 연접을 통한 세포 간의 긴밀한 전기적·화학적 소통이며, 이는 근육 조직 전체가 하나의 단위처럼 효율적으로 작동하게 한다.
3. 3. 수축
민무늬근육의 수축은 미오신과 액틴 필라멘트가 서로 미끄러지는 현상(미끄럼 필라멘트 기전)에 의해 발생한다. 이 과정에 필요한 에너지는 ATP의 가수분해를 통해 공급된다. 미오신은 ATP를 활용하여 분자 구조를 변화시키며 움직임을 생성하는 ATP가수분해효소로 기능한다. 미오신 필라멘트에서 돌출된 구형 머리가 액틴 필라멘트에 부착되어 가교를 형성하고, 액틴 필라멘트를 따라 작은 거리(10nm–12nm)만큼 끌어당긴다. 이후 머리는 액틴 필라멘트를 놓고 각도를 변경하여 다음 지점으로 이동한 뒤 다시 결합하여 끌어당기는 과정을 반복한다. 이 과정을 가교 주기라고 하며, 모든 근육에서 동일하게 일어난다(근육 수축 참조).
심근이나 골격근과 달리, 민무늬근육에는 칼슘 결합 단백질인 트로포닌이 없다. 대신 수축은 칼슘 이온(Ca2+) 농도 증가에 따른 미오신 경쇄 키나아제(MLCK)의 활성화와 미오신 경쇄의 인산화를 통해 시작된다. (상세한 활성화 과정은 미오신 머리의 활성화 섹션 참조)
최근 연구에 따르면 스핑고신-1-인산(S1P) 신호는 혈관 평활근 수축의 중요한 조절자로 밝혀졌다. 경벽압이 증가하면 스핑고신 인산화효소 1이 스핑고신을 S1P로 인산화시키고, 이는 세포막의 S1P2 수용체에 결합한다. 이로 인해 세포 내 칼슘이 일시적으로 증가하고 Rac 및 Rhoa 신호 전달 경로가 활성화되어, 결과적으로 MLCK 활성을 증가시키고 미오신 경쇄 포스파타아제(MLCP) 활성을 감소시켜 근육 수축을 촉진한다.[21] 이를 통해 세동맥은 혈압 상승에 반응하여 저항을 증가시켜 일정한 혈류를 유지할 수 있다. Rhoa 및 Rac 신호 전달 경로는 저항성 동맥 긴장도를 조절하는 칼슘 비의존적인 방식을 제공한다.[21]
민무늬근육을 포함하는 조직은 종종 늘어나야 하므로 탄력성은 중요한 속성이다. 민무늬근육 세포는 콜라겐(주로 I형 및 III형), 엘라스틴, 당단백질, 프로테오글리칸 등을 포함하는 복잡한 세포외 기질을 분비할 수 있다. 또한 특정 엘라스틴 및 콜라겐 수용체를 통해 세포외 기질과 상호 작용한다. 이러한 섬유들은 세포외 기질과 함께 조직의 점탄성에 기여한다. 예를 들어, 대동맥은 심실 수축을 전파하고 맥동성 혈류를 완화시키는 Windkessel처럼 작용하는데, 중간막 내의 평활근이 이러한 특성에 기여한다.
혈관 평활근은 수축과 이완을 통해 혈관 지름을 조절한다. 혈관 단면의 원주 방향으로 배열되어 있어 수축 시 혈관 지름이 좁아지고 저항이 높아진다. 심근과 달리 평활근 세포 간의 전기적 연결은 약하며, 교감신경계 말단에서 방출되는 노르아드레날린 등 다양한 액성 인자에 반응하여 천천히 수축하고 이완한다. 신체 손상 복구나 혈액 요구량 증가 시, 평활근은 수축 기능을 억제하고 증식능과 유주능을 높여 혈관 재구성에 대응한다. 이처럼 수축형과 증식형 표현형을 유연하게 전환하며 혈관 항상성을 유지하지만, 이 전환을 조절하는 분자 기전은 아직 완전히 밝혀지지 않았다.[19] 혈관 평활근의 과도한 증식은 동맥경화나 폐동맥성 폐고혈압증의 주요 원인 중 하나로 알려져 있다.
3. 3. 1. 위상 또는 긴장
민무늬근육은 급속한 수축과 이완을 보이는 위상 수축(phasic contraction)과 느리고 지속적인 수축을 보이는 긴장 수축(tonic contraction)으로 수축할 수 있다. 생식기, 소화기, 호흡기 및 비뇨기, 피부, 눈, 혈관 등은 긴장성 수축을 하는 민무늬근육을 포함한다. 이러한 유형의 민무늬근육은 에너지를 거의 사용하지 않고도 오랫동안 힘을 유지할 수 있는 특징이 있다. 미오신 중쇄(heavy chain)와 경쇄(light chain)의 차이가 긴장성 및 위상성 민무늬근육 간의 수축 패턴 및 수축 운동 속도 차이와 관련이 있는 것으로 알려져 있다.
3. 3. 2. 미오신 머리의 활성화
교차다리 주기는 미오신 머리가 활성화되어야 일어날 수 있다. 미오신 머리의 활성화는 미오신 경쇄(light chain, 특히 MLC20)가 인산화될 때 이루어진다. 이 인산화 과정을 통해 미오신 머리는 액틴 필라멘트와 상호작용하여 근육 수축을 일으킬 준비를 갖추게 된다.
미오신 경쇄를 인산화하는 효소는 미오신 경쇄 키나아제(Myosin light-chain kinase, MLCK)이다.[10] MLCK는 평소에는 비활성 상태로 있다가, 근육이 수축하라는 자극을 받아야만 활성화된다. 자극이 오면 세포 내 칼슘 이온(Ca2+)의 농도가 증가한다. 증가한 칼슘 이온은 칼모듈린(calmodulin)이라는 단백질과 결합하여 칼슘-칼모듈린 복합체를 형성한다. 이 복합체가 MLCK에 결합하면 MLCK가 활성화되어 미오신 경쇄를 인산화시킬 수 있게 된다.[1]
활성화된 MLCK는 MLC20 경쇄의 특정 아미노산 잔기를 인산화한다. 주로 19번 위치의 세린(Ser19)이 인산화되는데, 이는 미오신 분자의 목 부분 구조에 변화를 일으켜 각도를 증가시킨다.[10] 이러한 구조 변화는 미오신 머리가 액틴 필라멘트에 결합하지 않은 상태에서 다음 결합 위치로 이동하는 데 필요하다. 미오신 머리가 액틴 필라멘트에 결합한 후에는, 이 세린 인산화가 미오신 머리의 ATPase 활성을 촉진하여, ATP를 분해하고 근육 수축에 필요한 에너지를 생산하도록 돕는다.[10] 경우에 따라 18번 위치의 트레오닌(Thr18)도 인산화될 수 있으며, 이는 ATPase 활성을 더욱 증가시키는 효과를 나타낸다.[10]
3. 3. 3. 지속적인 유지보수
민무늬근육의 미오신 경쇄(MLC20) 인산화는 근육의 단축 속도와 밀접한 관련이 있다. 수축 초기에는 인산화 수준이 높아지면서 산소 소비량으로 측정되는 에너지 소모가 급격히 증가한다.[10] 하지만 수축 시작 후 몇 분이 지나면 칼슘 수치가 현저하게 감소하고, MLC20의 인산화 수준도 낮아지며 에너지 소모 역시 줄어든다. 이 상태에서 근육은 이완될 수 있다.
민무늬근육은 이러한 상황에서도 힘을 지속적으로 유지하는 독특한 능력을 가지는데, 이는 래치-브릿지(latch-bridge)라고 불리는 특정 미오신 가교(cross-bridge) 덕분이다. 래치-브릿지는 매우 느리게 순환하며, 특히 탈인산화된 미오신이 액틴에서 분리되는 단계를 지연시켜[10] 저에너지 비용으로 힘을 유지하게 한다.[10] 이 기전은 지속적인 수축이 필요한 민무늬근육에 특히 중요하다.[10]
혈관 및 내장 민무늬근육의 분리된 표본을 탈분극시키는 고농도 칼륨 용액으로 처리하면 일정한 수축력을 생성한다. 하지만 엔도텔린이나 세로토닌과 같은 작용제로 정상 생리 식염수에서 자극하면 동일한 표본에서 더 큰 수축력이 발생한다. 이러한 힘의 증가는 칼슘 감작(calcium sensitization)이라고 불린다. 이는 미오신 경쇄 포스파타아제(myosin light-chain phosphatase)가 억제되어, 미오신 경쇄 키나제(MLCK)의 칼슘에 대한 민감도가 증가하기 때문이다. 미오신 경쇄 포스파타아제의 억제를 조절하는 세포 신호 전달 경로로는 RhoA-Rock 키나제 경로, 단백질 키나제 C(PKC)-단백질 키나제 C 강화 억제 단백질 17 (CPI-17) 경로, 텔로킨(telokin) 및 Zip 키나제 경로 등이 있는 것으로 생각된다. 또한, Rock 키나제와 Zip 키나제는 20kDa 미오신 경쇄(MLC20)를 직접 인산화하는 데에도 관여하는 것으로 알려져 있다.
3. 3. 4. 기타 수축 메커니즘
수축 동안 힘 발생을 최적화하기 위해 수축 기계 장치가 공간적으로 재구성된다.[10] 이러한 재구성의 한 예로 Ser56에서 p21 활성화 키나아제에 의해 비멘틴이 인산화되어 비멘틴 중합체가 부분적으로 분해되는 과정이 있다.[10]
또한, 일부 조직에서는 액틴과 미오신의 비율이 변하면서 이완 상태와 수축 상태 사이에 미오신 필라멘트의 수가 역동적으로 변하며, 미오신 필라멘트의 길이와 수도 함께 변화한다.
단일 민무늬근육 세포를 분리하여 관찰한 결과, 세포는 나선형 코르크 마개 따개 방식으로 수축하는 모습을 보였다. 유리에 부착된 투과성 민무늬근육 세포(수축성 단백질이 내부적으로 수축 가능)를 관찰하면, 세포가 수축함에 따라 긴 축을 따라 수축성 단백질 상호작용 구역이 나타나는 것을 볼 수 있다.
기본적인 미오신-액틴 상호작용 외에도 다른 세포 신호 전달 경로와 단백질 키나아제 (단백질 키나아제 C, Rho 키나아제, Zip 키나아제, 초점 부착 키나아제 등)가 민무늬근육 수축 조절에 관여하는 것으로 알려졌다. 또한, 액틴 중합 역학도 힘 유지에 역할을 한다. 미오신 경쇄 인산화는 수축 속도와 밀접한 관련이 있지만, 다른 세포 신호 전달 경로는 힘 발생 및 유지에 중요한 역할을 하는 것으로 밝혀졌다. 특히, 특정 티로신 키나아제에 의해 초점 부착 어댑터 단백질인 팍실린의 특정 티로신 잔기가 인산화되는 것은 힘 발생과 유지에 필수적이다.
예를 들어, 고리형 뉴클레오티드는 미오신-액틴 교차 가교 인산화를 줄이지 않고도 동맥 민무늬근육을 이완시킬 수 있는데, 이를 '힘 억제'라고 부른다. 이 과정은 작은 열 충격 단백질인 hsp20의 인산화를 통해 매개되며, 인산화된 hsp20은 인산화된 미오신 머리가 액틴과 상호작용하는 것을 방해할 수 있다.
3. 4. 이완
민무늬근육의 이완은 주로 미오신 경쇄 인산분해효소(MLCP)에 의해 조절된다. MLCP는 미오신 경쇄(MLC20)를 탈인산화시켜 근수축을 억제하고 이완을 유도한다.[10] 이는 미오신 경쇄 키나제(MLCK)에 의한 인산화와 반대되는 작용이다.
일반적으로 민무늬근육의 이완은 다음과 같은 여러 기전을 통해 일어난다.
이러한 이완 과정은 다양한 신호 전달 경로에 의해 매개될 수 있다. 특히 내피세포에서 유래하는 이완 인자들이 중요한 역할을 한다. 여기에는 일산화질소(NO), 내피 유래 과분극 인자(EDHF, 예: 내인성 카나비노이드, 시토크롬 P450 대사 산물, 과산화수소), 프로스타사이클린(PGI2) 등이 포함된다.[10]
일산화질소는 세포 내 가용성 구아닐산 시클라제를 활성화하고, 프로스타사이클린은 세포막에 결합된 아데닐산 시클라제를 자극한다. 이들 시클라제는 각각 순환 GMP(cGMP)와 순환 AMP(cAMP)를 생성한다. 생성된 cGMP와 cAMP는 각각 단백질 키나제 G(PKG)와 단백질 키나제 A(PKA)를 활성화시킨다.[10]
활성화된 PKG와 PKA는 여러 표적 단백질을 인산화시켜 다음과 같은 효과를 나타내며 근이완을 유도한다.[10]
내피 유래 과분극 인자(EDHF)는 주로 칼슘 감수성 칼륨 채널(KCa)이나 ATP 감수성 칼륨 채널(KATP)을 자극한다. 이는 칼륨 이온의 유출을 촉진하여 세포를 과분극시키고 결과적으로 민무늬근육의 이완을 유도한다.[10]
4. 무척추동물 평활근
무척추동물의 민무늬근육(평활근) 수축은 칼슘 이온이 직접 미오신에 결합하면서 시작된다. 이후 미오신과 액틴 필라멘트 사이의 가교(cross-bridge)가 빠르게 형성되고 분리되는 과정을 반복하며 힘을 발생시킨다. 척추동물의 민무늬근육과 유사하게, 일단 수축이 시작되면 적은 칼슘 농도와 낮은 에너지 소비로도 수축 상태를 유지하는 단계가 존재한다. 이 유지 단계는 '트위친'(eng)이라는 단백질과 관련이 있는 것으로 알려져 있다. 트위친은 척추동물의 미오신 경쇄 키나아제(MLCK)나 티틴과 유사한 기능을 수행하는 탄성 단백질로 추정된다. 조개를 포함한 이매패류 연체동물은 이러한 민무늬근육의 유지 단계를 이용하여 거의 에너지를 소모하지 않고도 껍데기(패각)를 오랫동안 닫힌 상태로 유지할 수 있다.
5. 특정 효과
민무늬근육 세포는 다양한 기관에서 구조와 기능이 기본적으로 동일하지만, 구체적인 효과 또는 최종 기능은 서로 다르다.
혈관 민무늬근육은 저항 동맥이라 불리는 작은 동맥 및 세동맥의 내강 직경을 조절하여 혈압과 혈류 조절에 중요한 역할을 한다. 민무늬근육은 천천히 수축하며 혈관, 세기관지, 일부 조임근 등에서 긴장성 수축을 통해 수축 상태를 오래 유지할 수 있다. 세동맥 민무늬근육이 활성화되면 내강 직경이 평소의 1/3까지 줄어들어 혈류와 혈관 저항에 큰 변화를 일으킨다. 반면, 대동맥 민무늬근육의 활성화는 내강 직경에 큰 영향을 주지 않지만 혈관벽의 점탄성을 높인다.
소화관에서는 연동 운동과 같은 리듬 있는 수축을 통해 음식물을 이동시킨다.
수축 외 기능도 수행하는데, 사구체 옆 장치의 구심성 세동맥에 위치한 특수 민무늬근육 세포는 삼투압과 압력 변화를 감지하여 레닌을 분비한다. 또한 사구체 여과율 조절 과정에서 ATP를 분비하는 것으로 추정된다. 분비된 레닌은 레닌-안지오텐신 시스템을 활성화시켜 혈압 조절에 관여한다.
6. 성장과 재배열
민무늬근육의 성장과 재배열을 유도하는 외부 요인의 정확한 메커니즘은 아직 완전히 규명되지 않았다. 여러 성장 인자와 신경체액성 조절 인자가 민무늬근육의 성장과 분화에 영향을 미치는 것으로 알려져 있다. 특히 Notch 수용체와 세포 신호 전달 경로는 혈관 신생, 동맥 및 정맥 형성에 필수적인 역할을 하는 것으로 나타났다. 민무늬근육 세포의 증식은 죽상동맥경화증의 발병 과정에 관여하며, 산화 질소는 이러한 증식을 억제하는 효과를 가진다.
민무늬근육의 발생 기원은 일반적으로 중배엽에서 유래하며, 근육 세포가 생성된 후 근육 형성 과정을 거친다. 그러나 모든 민무늬근육이 중배엽에서 유래하는 것은 아니다. 예를 들어, 대동맥과 폐동맥(심장의 주요 동맥) 내의 민무늬근육은 신경 능선에서 기원한 외배엽간엽에서 유래한다. 반면, 관상 동맥의 민무늬근육은 중배엽에서 기원한다.
혈관에 있는 민무늬근육(혈관 평활근)은 수축과 이완을 통해 혈관의 지름을 조절하는 중요한 역할을 한다. 혈관 벽의 단면을 기준으로 원주 방향으로 배열되어 있어, 이 근육이 수축하면 혈관 지름이 좁아져 혈류 저항이 높아진다. 심근과 달리 민무늬근육 세포 간의 전기적 연결은 약하며, 교감신경 말단에서 분비되는 노르아드레날린과 같은 다양한 액성 인자에 반응하여 비교적 천천히 수축하고 이완한다. 신체 조직이 손상되어 혈관을 복구해야 하거나, 특정 부위의 혈액 요구량이 증가하여 혈관 확장이 필요할 때, 민무늬근육은 수축 기능을 억제하는 동시에 세포 증식 능력과 이동 능력을 높여 혈관의 구조를 재구성하는 데 기여한다. 이처럼 혈관 민무늬근육은 수축 능력이 높은 '수축형'과 증식 능력이 높은 '증식형'이라는 두 가지 표현형 사이를 유연하게 전환하며 혈관의 항상성을 유지한다. 그러나 이러한 표현형 전환을 조절하는 정확한 분자 메커니즘은 아직 명확히 밝혀지지 않았다.[19] 혈관 민무늬근육의 과도한 증식은 동맥경화나 폐동맥성 폐고혈압증과 같은 질병 발생의 주요 원인 중 하나로 지목된다.
7. 관련 질병
다계통 평활근 기능 장애 증후군은 발달 중인 배아의 신체가 위장관계에 충분한 양의 평활근을 생성하지 못하는 유전 질환이다. 이 질환은 치명적이다.
항평활근 항체(ASMA)는 자가면역 질환의 증상일 수 있는데, 예를 들어 간염, 간경변, 또는 루푸스 등이 있다.
평활근 종양은 대개 양성 종양이며, 이 경우 평활근종이라고 불린다. 이 종양은 모든 장기에서 발생할 수 있지만, 일반적으로 자궁, 소장, 그리고 식도에서 발생한다. 악성 평활근 종양은 평활근육종이라고 불리며, 이는 더 흔한 유형의 연조직 육종 중 하나이다.
혈관 평활근 종양은 매우 드물다. 이 종양은 악성 또는 양성일 수 있으며, 두 유형 모두에서 심각한 이환율을 보일 수 있다. 혈관내 평활근종증은 정맥을 통해 확장되는 양성 신생물이다. 혈관 평활근종은 사지의 양성 신생물이며, 혈관 평활근육종은 하대정맥, 폐동맥 및 폐정맥 그리고 다른 말초 혈관에서 발견될 수 있는 악성 신생물이다.
동맥경화증도 평활근과 관련된 질병 중 하나이다.
8. 혈관 평활근 (일본어 문서 내용)
혈관 민무늬근육(평활근)의 수축 기능은 저항 동맥이라 불리는 작은 동맥-세동맥의 내부 지름(내강 직경)을 조절하여 혈압 수준과 각 혈관으로 가는 혈류량을 결정하는 데 중요한 역할을 한다. 민무늬근육은 천천히 수축하며, 혈관, 세기관지 등에서는 수축 상태를 오랫동안 유지할 수 있다. 특히 세동맥의 민무늬근육이 활성화되면 내강 직경이 평소의 1/3까지 줄어들어 혈류와 혈관 저항에 큰 변화를 일으킨다. 반면, 대동맥과 같은 큰 혈관의 민무늬근육 활성화는 내강 직경을 크게 바꾸지는 않지만, 혈관벽의 탄력성을 조절하는 역할을 한다.
혈관 평활근은 혈관 단면의 원주 방향으로 배열되어 있으며, 수축과 이완을 통해 혈관 지름을 조절한다. 평활근이 수축하면 혈관 지름이 좁아지고 혈액 흐름에 대한 저항이 높아진다. 심근과 달리 평활근 세포 사이의 전기적 연결은 약하며, 주로 교감신경계 말단에서 분비되는 노르아드레날린(noradrenaline)과 같은 다양한 체액성 인자(액성 인자)에 반응하여 천천히 수축하고 이완한다.
신체가 손상을 입어 혈관을 복구해야 하거나, 혈액 요구량이 늘어 혈관을 확장해야 할 때, 혈관 평활근은 단순히 수축 기능을 조절하는 것 외에도 세포 자체의 증식 능력과 이동 능력을 높여 혈관 구조를 재편성(재구성)하는 데 기여한다. 이처럼 혈관 평활근은 수축 능력이 높은 수축형과 증식 능력이 높은 증식형이라는 두 가지 상태(표현형)를 상황에 맞게 오가며 혈관의 안정적인 상태(항상성)를 유지한다. 그러나 이러한 표현형 전환을 조절하는 구체적인 분자 메커니즘은 아직 완전히 밝혀지지 않았다.[19]
한편, 혈관 평활근 세포가 비정상적으로 과도하게 증식하는 것은 동맥경화나 폐동맥성 폐고혈압증과 같은 혈관 질환 발생의 주요 원인 중 하나로 알려져 있다.
참조
[1]
웹사이트
Smooth muscle
https://opentextbc.c[...]
2013-03-06
[2]
웹사이트
Thesaurus results for Striated
https://www.merriam-[...]
2022-04-22
[3]
웹사이트
10.8 Smooth Muscle - Anatomy and Physiology {{!}} OpenStax
https://openstax.org[...]
2013-04-25
[4]
서적
Physiology
[5]
논문
"[Physiological and pathophysiological meanings of gastrointestinal smooth muscle motor unit SIP syncytium]."
2016-10-25
[6]
논문
Interstitial cells: regulators of smooth muscle function.
2014-07
[7]
서적
The vascular smooth muscle cell: molecular and biological responses to the extracellular matrix
https://books.google[...]
Academic Press
[8]
논문
Human smooth muscle myosin heavy chain gene mapped to chromosomal region 16q12
[9]
논문
The actin gene family: function follows isoform
[10]
논문
Physiological pathways and molecular mechanisms regulating uterine contractility
[11]
문서
Aguilar_2010 (above reference) "In skeletal or striated muscle, there is 3-fold more myosin than actin."
[12]
간행물
Single muscle fibre contractile properties in young and old men and women
2003
[13]
간행물
Comprehensive Human Physiology
Springer, Berlin
[14]
서적
Lawrie's Meat Science
[15]
서적
Ultrastructure of Smooth Muscle
https://books.google[...]
Springer Science & Business Media
[16]
논문
Sphingosine-1-phosphate modulates spiral modiolar artery tone: A potential role in vascular-based inner ear pathologies?
[17]
논문
Atromentin: a smooth muscle stimulant in Clitocybe subilludens
[18]
논문
Smooth muscle autoantibodies and autoantigens
https://pubmed.ncbi.[...]
1979-12-XX
[19]
논문
TRPC6 regulates phenotype switching of vascular smooth muscle cells through plasma membrane potential-dependent coupling with PTEN.
[20]
웹사이트
대한의협 의학용어 사전, 대한해부학회 의학용어 사전
https://www.kmle.co.[...]
[21]
저널 인용
Sphingosine-1-phosphate modulates spiral modiolar artery tone: A potential role in vascular-based inner ear pathologies?
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com