조혈모세포 이식
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
조혈모세포 이식은 혈액 질환 치료를 위해 손상된 조혈모세포를 건강한 세포로 대체하는 치료법이다. 1939년 최초의 골수 수혈 이후, 1950년대 E. 도널 토머스를 중심으로 줄기 세포 이식이 발전했으며, 1968년 로버트 A. 굿에 의해 암 이외 질환에 대한 성공적인 이식이 처음으로 시행되었다. 조혈모세포는 골수, 말초 혈액, 제대혈에서 얻을 수 있으며, 자가 이식, 동종 이식, 제대혈 이식 등 다양한 종류가 있다. 이식은 악성 및 비악성 혈액 질환, 일부 자가면역 질환에 적용되며, 이식 전 전처치, 조혈모세포 주입, 생착 및 회복 과정을 거친다. 주요 합병증으로는 이식편대숙주병, 감염, 간정맥폐쇄성 질환 등이 있으며, 이식편대종양 효과를 통해 암 재발을 억제할 수 있다.
조혈모세포 이식 연구는 1950년대부터 1970년대까지 프레드 허친슨 암 연구 센터의 E. 도널 토머스가 이끄는 팀에 의해 본격적으로 개척되었다. 토머스는 골수 유래 줄기 세포를 이용한 연구를 통해 정맥으로 주입된 골수 세포가 다시 골수를 형성하고 새로운 혈액 세포를 만들 수 있음을 증명했으며, 생명을 위협할 수 있는 이식편대숙주병 발생 가능성을 줄이는 데 기여했다.[73] 이러한 업적으로 그는 훗날 노벨 생리학·의학상을 수상했다. 또한 워싱턴 대학교의 엘로이즈 기블렛과 협력하여 공여자 일치를 확인할 수 있는 유전자 표지자를 발견하기도 했다.[73]
조혈모세포 이식은 사용하는 조혈모세포의 공급원에 따라 다음과 같이 분류할 수 있다.
2. 역사
암 이외의 질병에 대한 첫 성공적인 사람 골수 이식은 1968년 미네소타 대학교의 로버트 A. 굿에 의해 이루어졌다.[74] 1975년에는 같은 대학의 존 커시가 림프종을 치료하기 위해 최초로 성공적인 골수 이식을 수행했으며, 당시 16세였던 그의 환자는 현재 림프종 이식 생존자 중 가장 오랫동안 생존한 인물로 알려져 있다.[75]
2. 1. 초기 연구 및 동물 실험
1939년, 재생불량성 빈혈을 앓고 있는 한 여성이 최초로 사람의 골수 수혈을 받았다. 이 환자는 정기적인 수혈을 받고 있었으며, 정맥 내 골수 주사를 통해 백혈구 및 혈소판 수를 늘리려는 시도가 이루어졌다.[72]
1950년대에는 치사량의 방사선을 조사한 생쥐에게 골수 세포를 이식하는 동물 실험이 진행되었다.[92] 이 실험을 통해 이식된 세포가 공여자의 골수에서 유래했다는 사실이 밝혀졌고[93], 이는 골수 이식(더 나아가 조혈모세포 이식)을 사람에게 적용하는 연구의 기초가 되었다.
본격적인 줄기 세포 이식 연구는 1950년대부터 1970년대까지 프레드 허친슨 암 연구 센터(Fred Hutchinson Cancer Research Center)의 E. 도널 토머스(E. Donnall Thomas)가 이끄는 팀에 의해 개척되었다. 토머스의 연구는 정맥으로 주입된 골수 세포가 다시 골수를 형성하고 새로운 혈액 세포를 만들어낼 수 있음을 증명했다. 또한 그의 연구는 생명을 위협할 수 있는 이식편대숙주병의 발생 가능성을 줄이는 데 기여했다.[73] 이러한 업적으로 토머스는 훗날 노벨 생리학·의학상을 수상했다. 그는 워싱턴 대학교(University of Washington)의 엘로이즈 기블렛(Eloise Giblett)과 협력하여 공여자 일치를 확인할 수 있는 유전자 표지자를 발견하기도 했다.[73]
암 이외의 질병에 대한 성공적인 사람 골수 이식은 1968년 미네소타 대학교(University of Minnesota)의 로버트 A. 굿(Robert A. Good)에 의해 처음으로 이루어졌다.[74] 1975년에는 같은 대학의 존 커시(John Kersey)가 림프종을 치료하기 위해 최초로 성공적인 골수 이식을 수행했다. 당시 16세였던 그의 환자는 현재 림프종 이식 생존자 중 가장 오랫동안 생존한 사람으로 기록되어 있다.[75]
2. 2. 인체 적용 및 초기 발전
1939년, 오스굿(Osgood)이 재생불량성 빈혈 환자에게 골수액을 수혈했다는 보고가 있었지만[72][94], 이는 현재의 전처치 과정 없이 이루어진 것이었다.
본격적인 조혈모세포 이식은 1950년대부터 1970년대까지 프레드 허친슨 암 연구 센터의 E. 도널 토머스가 이끄는 팀에 의해 개척되었다. 그의 연구는 노벨 생리학·의학상으로 인정받았다. 토머스는 1957년, 항암제와 전신 방사선 조사를 전처치로 사용하여 백혈병 치료에 골수 이식을 시행했는데, 이것이 현재 치료법의 시초로 여겨진다[95]. 그의 연구는 정맥으로 주입된 골수 세포가 골수를 재형성하고 새로운 혈액 세포를 만들 수 있음을 보여주었으며, 치명적인 이식편대숙주병(GVHD) 발생 가능성을 줄이는 데 기여했다.[73] 토머스는 워싱턴 대학교의 엘로이즈 기블렛과 협력하여 공여자 적합성을 확인할 수 있는 유전자 표지자를 발견하기도 했다.[73]
1958년에는 유고슬라비아[96]에서 발생한 원자로 사고 피폭자 6명에게 골수 이식이 시행되어 5명의 생명을 일시적으로 구하는 데 성공했다[97]. 그러나 1968년까지 시행된 203건의 골수 이식 중 생착에 성공한 사례는 11건(5.4%)에 불과했다[98]. 이는 당시 인간 백혈구 항원(HLA) 적합성이 고려되지 않았고[99], 생착 부전이나 GVHD를 막을 효과적인 면역 억제제가 없었기 때문이다. 이러한 낮은 성공률로 인해 골수 이식의 시행은 한동안 줄어들었다[98].
이후 1968년, 미네소타 대학교의 로버트 A. 굿은 암이 아닌 질환(선천성 면역 결핍증)에 대해 처음으로 성공적인 골수 이식을 수행했다.[74] 1975년에는 같은 대학의 존 커시가 림프종 환자에게 최초로 성공적인 골수 이식을 시행했으며, 당시 16세였던 환자는 현재 림프종 이식 생존자 중 가장 오래 생존한 인물이다.[75]
2. 3. 현대적 골수 이식의 확립
1939년, 재생불량성 빈혈을 앓던 한 여성이 최초로 사람의 골수를 수혈받았다. 이 환자는 정기적인 수혈을 받고 있었으며, 예상치 못한 반응 없이 정맥 내 골수 주사를 통해 백혈구 및 혈소판 수를 늘리려는 시도가 이루어졌다.[72]
본격적인 줄기 세포 이식 연구는 1950년대부터 1970년대까지 프레드 허친슨 암 연구 센터의 E. 도널 토머스가 이끄는 팀에 의해 개척되었다. 토머스는 골수에서 유래한 줄기 세포를 이용한 연구를 통해, 정맥으로 주입된 골수 세포가 다시 골수를 형성하고 새로운 혈액 세포를 만들어낼 수 있음을 증명했다. 또한 그의 연구는 생명을 위협할 수 있는 이식편대숙주병(GVHD)의 발생 가능성을 줄이는 데 기여했다.[73] 이러한 업적으로 토머스는 훗날 노벨 생리학·의학상을 수상했다. 그는 워싱턴 대학교의 교수 엘로이즈 기블렛과 협력하여, 골수 공여자와 수혜자 간의 유전적 일치 여부를 확인할 수 있는 유전자 표지자를 발견하기도 했다.[73]
암이 아닌 다른 질병에 대해 성공적인 사람 골수 이식을 처음으로 수행한 의사는 1968년 미네소타 대학교의 로버트 A. 굿이었다.[74] 1975년에는 같은 대학의 존 커시가 림프종을 치료하기 위해 최초로 성공적인 골수 이식을 시행했다. 당시 16세였던 그의 환자는 현재 림프종 이식 생존자 중 가장 오래 생존한 사람으로 알려져 있다.[75]
토머스 등은 개를 이용한 골수 이식 연구를 통해 주요 조직 적합 유전자 복합체(MHC, 사람의 경우 HLA)의 적합성 확인, 전처치(고용량 항암제와 전신 방사선 조사), 면역 억제제 투여 방법 등을 개발하여 개 사이의 골수 이식에 성공했다.[100] 이러한 연구 결과를 바탕으로 1970년대 중반에는 현재 시행되는 것과 거의 동일한 현대적 골수 이식 방법이 확립되었다. 이 방법은 HLA가 적합한 공여자로부터 골수를 받아 이식하는 것을 기본으로 하며, 이식 전 전처치를 시행하고 메토트렉세이트 등을 사용하여 GVHD를 예방하는 것을 포함한다.[100] 특히 백혈병 환자를 대상으로 골수 이식을 적극적으로 시행함으로써[101] 장기 생존율이 50% 이상으로 크게 향상되었고[102], 골수 이식은 완치를 기대할 수 있는 치료법으로 자리 잡게 되었다.
2. 4. 조혈모세포 공급원의 다양화
초기 골수 이식에는 주로 일란성 쌍둥이나 형제자매의 골수가 사용되었다. 하지만 혈연관계가 없는 사람 중에서도 HLA 유전형이 일치하는 기증자의 골수를 이용한 이식이 시도되었고, 그 효과가 입증되면서 조혈모세포 공급원의 범위가 넓어지기 시작했다.[103][104] 이러한 배경 속에서 1970년대 후반 영국과 미국에서 골수 은행이 처음 설립되었으며, 일본에서는 1991년에 설립되었다.
한편, 1980년대 초반에는 제대혈(탯줄 혈액)에도 조혈모세포가 존재한다는 사실이 밝혀졌다. 이를 바탕으로 1988년, 글럭먼(Gluckman) 연구팀은 판코니 빈혈을 앓고 있는 환자에게 형제의 제대혈을 이용한 첫 제대혈 이식을 성공적으로 시행했다.[105] 이후 1992년 미국에서 제대혈 은행이 설립되었고[106], 전 세계적으로 제대혈 은행 설립이 확산되었다. 일본에서는 1998년에 제대혈 이식이 보험 적용 대상이 되었고, "일본 제대혈 뱅크 네트워크"가 구축되었다.
또한, 1980년대 후반부터는 환자 자신의 말초혈액에서 채취한 조혈모세포를 이용하는 자가 말초혈 조혈모세포 이식이 시행되어 현재까지 이어지고 있다. 더 나아가 1993년에는 다른 사람의 말초혈 조혈모세포를 이용하는 동종 말초혈 조혈모세포 이식에도 성공하면서[107], 오늘날 사용되는 다양한 조혈모세포 공급원이 마련되었다.
3. 조혈모세포 이식의 종류
이러한 분류는 조혈모세포를 어디서 얻는지에 따른 구분이며, 실제 이식 과정에서는 환자 자신에게서 얻은 세포를 사용하는지(자가 조혈모세포 이식), 다른 사람에게서 얻은 세포를 사용하는지(동종 조혈모세포 이식)에 따라 다시 나눌 수 있다. 각 이식 방법에 대한 자세한 내용은 하위 섹션에서 다룬다.
3. 1. 자가 조혈모세포 이식
자가 조혈모세포 이식(HSCT)은 환자 자신의 조혈모세포(HSC)를 이용하는 치료법이다. 먼저 환자로부터 조혈모세포를 채취하여 냉동 보관하는데, 이는 주로 다음 두 가지 방법을 통해 이루어진다.[2]
세포 채취 후, 환자는 고용량 화학 요법이나 방사선 치료를 받는다. 이 치료는 몸 안의 악성 세포(암세포 등)를 제거하는 것을 목표로 하지만, 동시에 환자 자신의 골수 기능을 파괴하여 새로운 혈액 세포를 만드는 능력을 없애게 된다. 치료가 끝나면 미리 보관해 두었던 환자 자신의 조혈모세포를 혈류로 다시 주입한다. 이식된 조혈모세포는 파괴된 골수 조직을 대체하고 정상적인 혈액 세포 생성을 다시 시작하게 한다.[2]
자가 이식은 다음과 같은 장점이 있다.
이러한 장점 덕분에 자가 조혈모세포 이식은 림프종과 같은 특정 질병에서 표준적인 2차 치료법 중 하나로 사용된다.[23]
하지만 급성 골수성 백혈병과 같은 일부 암에서는 자가 이식보다 동종 조혈모세포 이식이 더 선호될 수 있다. 자가 이식은 동종 이식에 비해 치료 관련 사망률은 낮출 수 있지만, 암이 재발할 가능성이 더 높을 수 있기 때문이다.[24]
최근에는 자가 조혈모세포 이식을 다른 질병 치료에 적용하려는 연구도 진행 중이다. 소아 및 성인의 제1형 당뇨병 치료를 위해 골수 기능을 완전히 파괴하지 않는 방식(비골수제거적)의 자가 이식을 소규모로 연구한 결과, 긍정적인 가능성을 보였으나 아직 효과적인 치료법으로 확립되지는 않았다(2019년 기준).[25][26][27] 또한, 공격적인 다발성 경화증 치료에도 자가 조혈모세포 이식이 효과적인 것으로 나타났으며, 비교적 안전하고 심각한 부작용은 드문 것으로 알려져 있다.[28][29]
3. 2. 동종 조혈모세포 이식
동종 조혈모세포 이식(Allogeneic hematopoietic stem cell transplantation|동종 조혈모세포 이식eng, allo-HSCT)은 건강한 공여자로부터 얻은 조혈모세포를 환자(수혜자)에게 이식하는 치료법이다.[30] 이식 성공을 위해서는 공여자와 수혜자 간의 조직(사람 백혈구 항원, HLA) 형이 일치하는 것이 매우 중요하다. 일반적으로 HLA 유전자의 주요 유전자좌(예: ''HLA-A'', ''HLA-B'', ''HLA-C'', ''HLA-DR'', ''HLA-DQB1'')에서 최대한 일치하는 공여자를 찾는다. HLA-A, B, C와 같은 I형 유전자의 불일치는 이식편 거부 반응의 위험을 높이고, HLA-DR, DQB1과 같은 II형 유전자의 불일치는 이식편대숙주병(GVHD)의 위험을 증가시킨다. 따라서 주요 이식 센터에서는 최소 5개의 HLA 유전자 모두에 대한 정밀 검사를 통해 일치 여부를 확인한다. HLA 유전자는 인종 및 민족 집단별로 유사성을 보이는 경향이 있어, 공여자 탐색 시 이러한 요인이 중요하게 고려된다.[33]
동종 이식 공여자는 다음과 같이 분류될 수 있다.
HLA가 일치하더라도 미세한 차이로 인해 이식편대숙주병이 발생할 수 있으므로, 수혜자는 면역 억제제 치료를 받게 된다.[30][31][32] 동종 조혈모세포 이식은 건강한 면역 체계를 재건하여 질병의 완치 또는 장기적인 관해 가능성을 높이는 것을 목표로 한다.[30][31][32]
동종 이식에 사용되는 조혈모세포의 주요 공급원은 다음과 같다.
2013년 현재, 최소 두 가지 상용화된 동종 세포 치료법인 프로키말과 카티스템이 개발되었다.[34] 오미두비셀은 2023년 4월 미국에서 의료용으로 승인되었다.
3. 2. 1. 형제간 조혈모세포 이식
조혈모세포 공여자로 조직적합 항원(HLA)이 일치하는 형제가 있는 경우를 말한다. 이 방식은 이식편대숙주병과 같은 합병증 발생 위험이 상대적으로 적고, 이식 후 장기 생존율도 다른 종류의 조혈모세포 이식에 비해 우수한 장점이 있다.[118] 동종 조혈모세포 이식 시 이식 거부 반응이나 심각한 이식편대숙주병 발생 위험을 줄이기 위해 기증자와 수혜자의 HLA형이 동일한 것이 바람직하다.[36]
하지만 가족 내에서 골수 이식에 필수적인 조직적합 항원이 일치하는 형제를 찾을 확률은 약 25~30% 정도에 불과하다.[118][36] 소위 "완벽한 일치"라고 하더라도, 이식편대숙주병의 원인이 될 수 있는 미세한 대립 유전자가 일치하지 않을 수도 있다.[36]
혈연 내에 적합한 공여자가 없는 경우에는 타인 중에서 기증자를 찾아야 하지만, 이 경우에도 적합한 공여자를 찾지 못할 수 있다. 이러한 상황에서는 조직 적합항원 불일치 이식이나 제대혈 이식이 차선책으로 고려되기도 한다.[118] 최근에는 이식 후 사이클로포스파미드와 같은 T 세포 고갈 요법의 발전으로, 반일치 이식을 통해 기증자를 찾기 어려웠던 많은 환자들에게도 성공적인 이식이 가능해지고 있다.[36]
3. 2. 2. 비혈연간 조혈모세포 이식
비혈연간 조혈모세포 이식은 형제나 가족 중에 조직적합 항원(HLA)이 일치하는 공여자가 없을 경우, 타인 중에서 적합한 공여자를 찾아 이식하는 방법이다. 먼저 국내의 골수은행에 환자에게 적합한 골수 기증자가 있는지 검색하고, 만약 없다면 일본, 대만, 중국뿐만 아니라 미국, 독일 등 해외 골수은행까지 검색하여 기증자를 찾는다. 적합한 공여자를 찾고 그가 기증 의사를 밝히면, 공여자의 조직적합성 일치 여부를 정밀 검사를 통해 다시 확인하여 최종적으로 공여자로 선정한다.
과거에는 비혈연간 조혈모세포 이식이 이식편대숙주병 및 이식 관련 합병증 발생 가능성이 높아 혈연간 이식보다 성공률이 낮았다. 하지만 최근 이식 관련 치료 기술이 발전하면서 이식 관련 사망률이 점차 감소하고 있으며, 공여자에 따른 이식 성공률의 차이도 점점 줄어들고 있다.[118]
동종 조혈모세포 이식에서는 이식된 줄기세포에 대한 이식 거부 반응이나 심각한 이식편대숙주병 발생 위험을 줄이기 위해 기증자와 수혜자의 HLA 형이 일치하는 것이 중요하다. 동종 조혈모세포 이식을 받는 환자 중 약 25~30%만이 HLA가 일치하는 형제를 가지고 있다. HLA가 완전히 일치하는 경우에도 이식편대숙주병의 원인이 될 수 있는 미세한 대립 유전자가 일치하지 않을 수 있다. 최근에는 이식 후 사이클로포스파미드와 같은 T 세포 고갈 요법이 발전하면서, HLA가 절반만 일치하는 반일치 이식을 통해서도 성공적인 이식이 가능해져 기증자를 찾지 못했던 많은 환자들이 치료 기회를 얻게 되었다.[36]
3. 2. 3. 제대혈 이식
신생아 분만 시 버려지는 태반이나 탯줄 안에 있는 조혈모세포를 이용하는 이식 방법이다. 1980년대 초, 태반이나 탯줄에도 많은 수의 조혈모세포가 존재한다는 사실이 알려졌으며, 1988년 프랑스에서 선천성 재생불량성빈혈인 판코니 빈혈 환자에게 처음으로 제대혈 이식이 성공적으로 이루어졌다. 이후 2000년까지 전 세계적으로 약 2,000건 이상의 제대혈 이식이 시행되었다.[118]
제대혈은 두 가지 방법으로 얻을 수 있다. 하나는 환자의 형제나 자녀가 태어날 때 그 탯줄과 태반에서 제대혈을 채취하는 것이고, 다른 하나는 환자와 관련 없는 일반 산모가 분만할 때 버려지는 태반과 탯줄에서 제대혈을 수집하는 것이다. 후자의 경우, 분만 후 버려지는 조직을 활용하므로 공여자에게 전혀 부담을 주지 않으며, 잠재적으로 무제한 공급이 가능하다. 이렇게 수집된 제대혈은 저온 보존 기술을 통해 냉동 보관되며, 이미 HLA 검사를 포함한 여러 검사가 완료된 상태이므로 이식이 필요한 경우 즉시 사용할 수 있다.[118]
제대혈 이식의 주요 장점 중 하나는 HLA 유전자가 서로 달라도 이식이 가능하다는 점이다. 제대혈의 조혈모세포는 면역학적으로 미숙하기 때문에, HLA가 완전히 일치하지 않아도 이식편대숙주병 발생 빈도나 정도가 낮아, 이식 후 환자의 삶의 질 향상에 기여할 수 있다.[118] 일반적으로 동종 조혈모세포 이식에서는 이식된 세포에 대한 이식 거부 반응이나 심각한 이식편대숙주병 발생 위험을 줄이기 위해 기증자와 수혜자의 HLA형이 일치하는 것이 중요하며, 형제자매 간 HLA 일치 확률은 약 25~30% 정도이다.[36] 제대혈 이식은 HLA 일치 기증자를 찾기 어려운 환자들에게 중요한 대안이 될 수 있다.
하지만, 제대혈에 포함된 조혈모세포의 수가 상대적으로 적어 체중이 많이 나가는 소아나 성인에게는 사용이 제한될 수 있다는 단점이 있다.[118]
제대혈은 출산 시에만 얻을 수 있기 때문에 제대혈 은행에 저온 보존 상태로 보관된다. 조혈모세포를 장기간 안전하게 보존하기 위해서는 보존제인 디메틸 설폭사이드(DMSO)를 첨가하고, 세포가 얼음 결정 형성 과정에서 삼투압으로 인해 손상되는 것을 막기 위해 조절된 속도로 천천히 냉각해야 한다. 이렇게 처리된 제대혈은 액체 질소를 이용한 저온 냉동고에서 수년간 보관될 수 있다.[41]
제대혈 이식은 골수 이식이나 말초 혈액 줄기 세포 이식과 함께 주요 조혈모세포 이식 방법 중 하나이다.
4. 조혈모세포 이식의 적응증
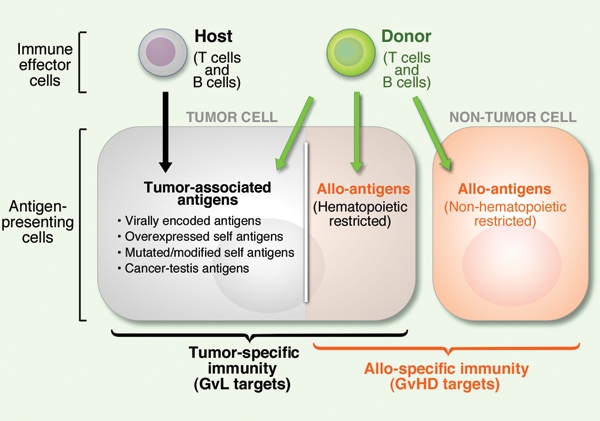
조혈모세포 이식은 다양한 혈액 질환의 근본적인 치료를 목표로 하는 강력한 치료법이다. 하지만 치료 과정에서 환자가 겪는 부담이 크고, 치료 관련 합병증으로 인해 오히려 환자의 생명을 위협할 수도 있는 위험성을 내포하고 있다. 따라서 어떤 환자에게 이식을 시행할지 결정하는 것은 매우 신중하게 이루어져야 한다.
환자의 상태, 질병의 특성, 예상되는 치료 효과와 위험성 등을 종합적으로 평가하여 이식 여부를 판단하는데, 이러한 과정을 층화(Stratification)라고 부른다. 층화를 통해 환자 개개인에게 가장 적합한 치료 방향을 결정하며, 이식 필요성에 대한 기준은 의학 기술의 발전에 따라 계속해서 발전하고 있다.[108][109] 구체적으로 어떤 질환들이 조혈모세포 이식의 대상이 되는지는 아래 하위 섹션에서 자세히 다룬다.
4. 1. 악성 질환 (암)
조혈모세포 이식은 다음과 같은 악성 질환(암) 치료에 사용될 수 있다.
- 급성 골수성 백혈병
- 만성 골수성 백혈병
- 급성 림프모구 백혈병
- 청소년 골수단핵구 백혈병
- 호지킨 림프종 (재발, 불응성)
- 비호지킨 림프종 (재발, 불응성)
- 신경모세포종
- 유잉 육종
- 다발성 골수종
- 골수형성이상 증후군
- 교종, 기타 고형 종양
조혈모세포 이식은 혈액 질환의 근본적인 치료를 기대할 수 있는 강력한 치료법이지만, 치료 과정에서 환자가 겪는 부담이 크고, 치료 독성으로 인해 오히려 생명을 위협하는 경우도 발생할 수 있다. 따라서 환자의 위험 상태와 예후를 객관적으로 평가하여 이식 여부를 신중하게 결정하는 것이 중요하다. 이러한 평가 과정을 통해 환자에게 가장 적합한 치료 방향을 정하는 것을 층화(Stratification)라고 한다.
과거에는 주로 질환의 염색체 이상, FAB 분류, 치료 반응성 등을 바탕으로 층화를 시도했다.[108] 이후 유전자 분석 기술이 발달하면서 질환 관련 유전자 변이 분석을 통해 더욱 정밀한 층화가 가능해졌다. 이러한 연구를 통해 기존에 예후가 나빠 이식이 필요하다고 여겨졌던 특정 유전자 변이형이 실제로는 예후가 양호하여 이식이 불필요할 수 있다는 사실이 밝혀지기도 했다.[109]
그러나 새로운 유전자 검사법이나 치료법이 연구되더라도, 실제 임상 현장에 적용되기까지는 각국의 의료 시스템 및 규제 환경에 따라 시간이 걸리거나 제약이 따를 수 있다. 이로 인해 특정 국가나 환경에서는 최신 연구 결과를 즉각적으로 반영하기 어려운 경우가 발생하기도 한다.[109]
4. 2. 비악성 질환
조혈모세포 이식(HSCT)은 백혈병이나 다발성 골수종[15]과 같은 악성 혈액 질환[16]뿐만 아니라, 다양한 비악성 질환 치료에도 사용된다. 주요 대상 질환은 다음과 같다.
- 지중해빈혈
- 겸상 적혈구 빈혈증 (또는 겸상 적혈구병)
- 재생 불량성 빈혈[17]
- 판코니 빈혈
- 악성 영아 골화증
- 점액다당류증
- 발작성 야간 혈색소뇨증
- 피루브산 키나아제 결핍증
- 면역 결핍 증후군 (예: 중증 복합 면역 결핍증, 위스콧-알드리치 증후군)
- 자가면역 질환[12] (예: 다발성 경화증[13][14])
- 선천성 호중구 감소증
- 만성 육아종증
HSCT는 특히 중증 복합 면역 결핍증이나 줄기 세포 결함이 있는 선천성 호중구 감소증과 같이 선천적 결함을 가진 소아 환자에게 중요한 치료법이다. 또한, 출생 후 줄기 세포를 잃게 되는 재생 불량성 빈혈을 앓는 어린이 또는 성인 환자에게도 적용될 수 있다.[17] 그 외 겸상 적혈구병, 만성 육아종증, 위스콧-알드리치 증후군 등 여러 비악성 질환의 치료[18]에도 활용된다.
최근에는 이식 전 화학 요법 및 방사선 치료의 강도를 낮춘 비-골수 제거적 이식, 즉 미니 이식 방법이 개발되었다. 이를 통해 고령이거나 기존의 강한 치료를 견디기 어려운 환자들도 조혈모세포 이식을 받을 수 있게 되었다.[19]
5. 조혈모세포 이식 과정
조혈모세포 이식 방법은 이식 종류에 따라 조금씩 차이가 있다. 여기서는 가장 일반적인 동종 골수 이식을 기준으로 전체 과정을 개략적으로 설명한다.
5. 1. 조혈모세포 채취
조혈모세포를 얻는 방법에는 크게 골수에서 직접 채취하는 방법과 말초 혈액에서 채취하는 방법이 있다.골수 채취골수 이식에 사용될 조혈모 줄기 세포(HSC)는 기증자의 큰 뼈, 주로 골반에서 뼈 중심부까지 들어가는 큰 주사 바늘을 이용해 채취한다. 이 과정을 골수 채취라고 부르며, 국소 마취나 전신 마취 하에 진행된다.[37]
말초 혈액 줄기 세포 채취
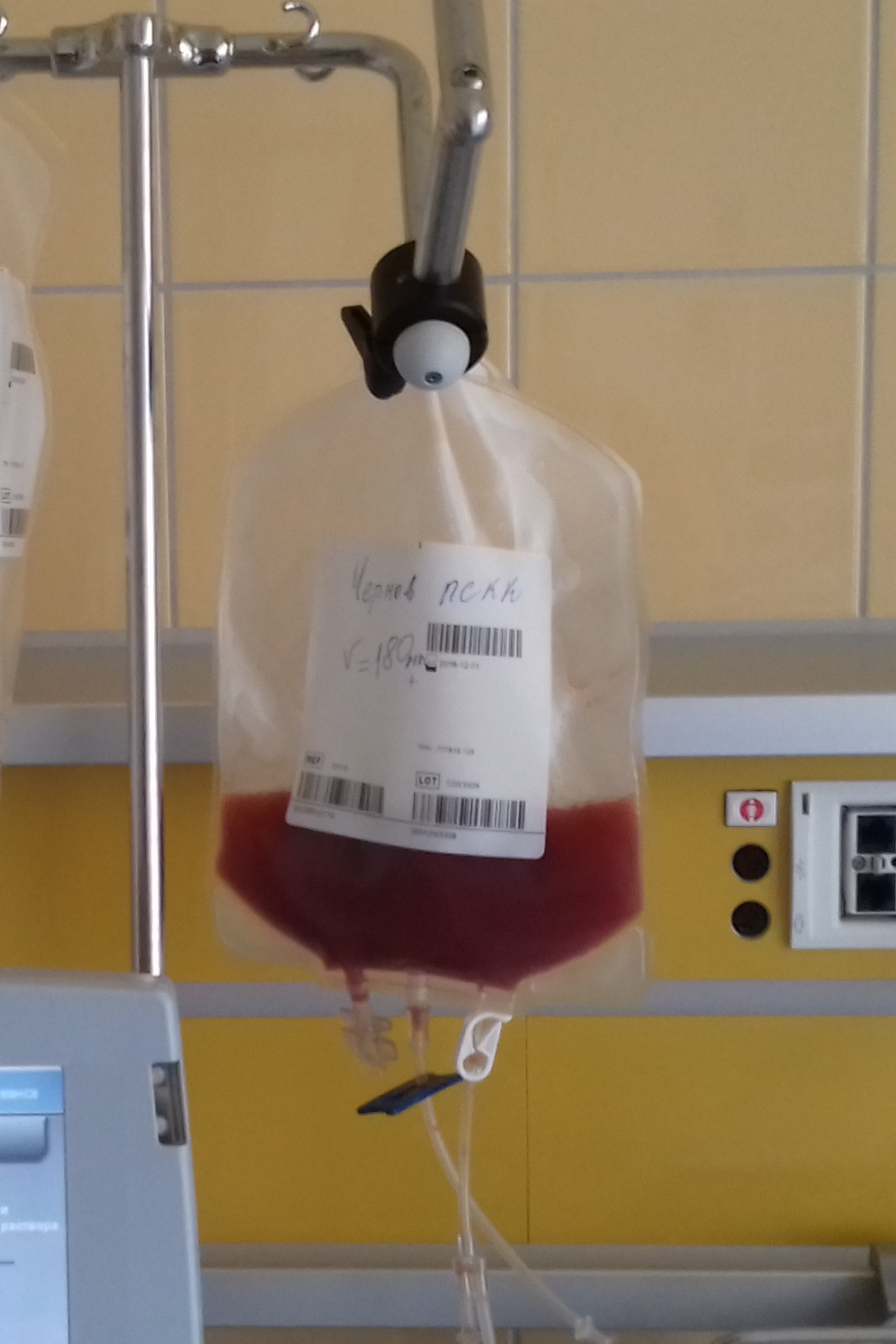
말초 혈액 줄기 세포[38]는 현재 조혈모세포 이식(HSCT)에서 가장 흔하게 사용되는 줄기 세포 공급원이다. 이는 성분채집술이라는 과정을 통해 혈액에서 얻는다. 기증자의 한쪽 팔에 꽂은 멸균 바늘을 통해 혈액을 빼내어, 특정 기계를 통과시키면서 백혈구를 분리한다. 분리 과정 후 남은 적혈구 등은 다시 기증자에게 돌려준다. 말초 혈액에서 더 많은 줄기 세포를 얻기 위해, 기증자는 며칠간 과립구 집락 자극 인자를 매일 피하 주사로 맞는다. 이 주사는 골수에 있는 줄기 세포를 혈액으로 이동시키는 역할을 한다.[39]
채취 방법은 이식 종류에 따라 조금씩 차이가 있을 수 있다. 가장 일반적인 동종 골수 이식을 기준으로 보면, 먼저 환자와 HLA 유형이 일치하는 기증자를 찾는다. 기증자의 건강 상태가 양호하면 전신 마취를 하고 골수 천자를 통해 골수를 채취한다. 채취 후 처리 과정은 환자와 기증자의 혈액형 일치 여부나 HLA 일치 정도에 따라 달라질 수 있다.
5. 2. 전처치
조혈모세포 이식 직전에 시행되는 항암 화학 요법 또는 방사선 요법을 전처치(conditioning regimen)라고 한다. 전처치의 목적은 이식 전에 환자의 질병 세포를 최대한 제거하고, 이식될 조혈모세포에 대한 면역 거부 반응을 억제하는 데 있다.[42] 골수는 다른 조직에 비교적 적은 손상을 주면서 파괴될 수 있다.전처치는 강도에 따라 크게 골수 파괴적 전처치(Myeloablative Conditioning, MAC)와 골수 비파괴적 전처치(Non-Myeloablative Conditioning, NMA) 또는 강도 완화 전처치(Reduced-Intensity Conditioning, RIC)로 나눌 수 있다. 어떤 분류를 사용할지에 대한 통일된 기준은 아직 없으며, RIC는 MAC과 NMA의 중간 강도로 분류되기도 한다.
=== 골수 파괴적 전처치 (MAC) ===
MAC는 조혈모세포 이식 전처치의 기본적인 형태로, 환자 자신의 골수 기능을 완전히 제거하는 것을 목표로 한다. 과거에는 동종 이식에서 사이클로포스파미드(CY)와 전신 방사선 조사(TBI)의 조합이 널리 사용되었다. 이 치료법은 이식 거부 반응을 막는 면역억제 효과도 가진다.[42] 그러나 현재는 급성 골수성 백혈병(AML)의 경우, TBI 없이 대량 화학 요법만으로도 동등하거나 더 나은 치료 효과를 기대할 수 있다는 연구 결과가 있어, 병원의 인력이나 시설 상황에 맞춰 선택할 수 있게 되었다. 반면, 급성 림프구성 백혈병(ALL) 치료에는 여전히 TBI를 포함한 전처치가 더 효과적인 것으로 여겨진다.[111]
MAC에서는 골수 기능 억제를 고려하지 않고 약물을 투여하므로, 약물 용량을 결정하는 주요 제한 요인(용량 규정 인자)은 골수가 아닌 다른 장기의 독성이 된다. 예를 들어, 사이클로포스파미드는 심장 독성, 부설판은 간 독성, 방사선 조사는 폐 독성이 용량 제한의 원인이 될 수 있다. 일반적으로 알킬화제나 백금 계열 항암제는 농도를 높일수록 항암 효과가 크게 증가하지만, 대사 길항제는 특정 농도 이상에서는 효과 증가가 뚜렷하지 않다. 이러한 이유로 CY-TBI 요법이 자주 선택되어 왔다.
표준적인 CY-TBI 요법의 예로는, CY를 60 mg/kg/day 용량으로 이식 3일 전과 2일 전에 투여하고, TBI를 2 Gy씩 하루 2번, 이식 7일 전부터 5일 전까지 3일간 시행하는 방식이 있다. 항암제나 방사선 치료에 반응이 없거나, 환자의 전신 상태가 나빠 치료를 견디기 어려운 경우에는 조혈모세포 이식 대상이 되지 않는다. 소아의 난치성 고형암 치료를 위한 조혈모세포 이식에서는 HiMEC이라는 다른 종류의 전처치가 주로 사용된다.
=== 골수 비파괴적 전처치 (NMA) / 강도 완화 전처치 (RIC) ===
골수 비파괴적 전처치(NMA) 또는 강도 완화 전처치(RIC)는 수혜자의 골수 세포를 완전히 제거하지 않을 정도의 낮은 용량의 화학 요법과 방사선 조사를 사용하는 새로운 접근법이다.[43][112] 이러한 방식의 이식은 '미니 이식'이라고도 불린다.
NMA/RIC는 MAC에 비해 심각한 감염이나 이식과 관련된 사망 위험이 낮다는 장점이 있다.[44][45] 대신, 환자의 질병 세포를 완전히 제거하지 못할 수 있어 암 재발 위험이 높아질 수 있는데, 이를 극복하기 위해 공여자 면역 세포가 암세포를 공격하는 이식편대종양 효과(Graft-versus-tumor effect, GVT)에 크게 의존한다.[44][113][114] 특정 백혈병의 경우, 이 GVT 효과는 암 재발을 막는 데 도움이 될 수 있지만, 생명을 위협할 수 있는 급성 및 만성 이식편대숙주병(GVHD)을 유발할 수도 있다.[42] 치료 초기에는 면역억제제가 필요하지만, MAC보다 낮은 용량을 사용한다.[46][115] 이식 후 초기에는 수혜자의 세포와 공여자의 세포가 함께 존재하는 혼합 키메라 상태가 된다.[47]
이후 면역억제 요법의 강도를 점차 줄이면, 공여자의 T 세포가 활성화되어 남아있는 수혜자의 조혈모세포를 제거하고 GVT 효과를 유도하게 된다. 이 과정에서 종종 경미한 이식편대숙주병(GVHD)이 나타날 수 있는데, 이는 GVT 효과가 나타나고 있다는 신호로 해석되기도 하며, 면역억제제 용량을 조절하는 지표가 될 수 있다.[48]
NMA/RIC는 전처치의 강도가 낮아 이식 관련 위험이 적기 때문에, 고령이거나 다른 건강 문제로 인해 기존의 MAC 동종 이식을 받기 어려웠던 환자들에게 완치의 가능성을 제공할 수 있다. 하지만 각 질병과 환자에게 맞는 최적의 전처치 방법은 아직 연구 중이며, 특히 암 재발 위험이 높은 환자에게는 신중한 접근이 필요하다.[43][45][112][114] 2016년 기준으로 미니 이식의 효과에 대한 증거는 아직 충분하지 않아 연구 단계의 치료로 간주된다.
5. 3. 조혈모세포 주입
조혈모세포 주입 방법은 이식 종류에 따라 차이가 있으며, 여기서는 가장 일반적인 동종 골수 이식을 기준으로 설명한다. 골수액의 동결 여부에 따라 주입 방법이 조금 달라질 수 있으나 기본적인 절차는 동일하다.적혈구의 ABO식 혈액형이 공여자와 수여자 간에 일치하거나 부분적으로 불일치하는 경우, 교차반응 검사를 시행하여 음성 반응을 확인해야 한다. 만약 교차반응 검사 결과가 양성이면, 주입 전에 골수액에서 적혈구를 제거하는 처리가 필요하다.
주입 전에는 코르티손 100mg을 미리 투여하고 수혈(주입)을 시작한다. 적혈구 혈액형이 불일치하는 이식의 경우에는 용혈 반응을 예방하기 위해 합토글로빈 4,000단위를 투여할 수 있다. 하지만 수혈(주입)되는 적혈구 양이 10ml~20ml 정도로 적다면 합토글로빈 투여는 필요하지 않은 것으로 본다.
5. 4. 생착 및 회복
조혈모세포 이식 후 수 주 동안 골수에서 조혈모세포(HSC)와 그 후손들이 충분히 증식하면, 혈구 수치가 정상화되고 면역 체계가 다시 기능하기 시작한다. 과거에는 공여자로부터 유래한 HSC의 후손들이 심장, 간, 근육 등 수혜자의 여러 다른 장기에 분포하며 손상된 조직을 재생할 수 있다는 주장이 있었지만, 최근 연구에 따르면 이러한 현상은 일반적이지 않은 것으로 보인다.이식 후에는 환자 자신의 줄기세포와 공여자의 새로운 줄기세포 사이의 균형을 확인하기 위해 키메라 현상 모니터링을 시행한다. 만약 치료 후 환자 자신의 줄기세포 수가 다시 증가한다면, 이식이 기대한 만큼 효과를 보지 못했을 가능성이 있다.[49]
가장 일반적인 동종 골수 이식을 기준으로 보면, 공여자 세포의 생착은 주로 호중구 수치의 회복으로 판단한다. 호중구 수치가 500/μL를 2~3회 연속으로 넘어서면, 그 첫 번째 날을 생착일로 간주하는 경우가 많다. 더 정확하게는 키메리즘 분석을 통해 공여자 유래 세포인지 확인해야 하지만, 골수를 완전히 파괴하지 않는 미니 이식을 제외하면 이식 후 1개월 이내에 증가한 호중구는 대부분 공여자 유래로 본다.
이식 후 생착이 전혀 이루어지지 않는 경우를 일차성 생착 부전, 일단 생착했으나 이후 조혈 기능이 다시 상실되는 경우를 이차성 생착 부전이라고 한다. 생착까지 걸리는 시간은 이식된 줄기세포의 종류(골수, 말초혈, 제대혈 등), 공여자와 환자의 관계, 과립구 집락 자극 인자(G-CSF) 투여 여부, 면역억제제인 메토트렉세이트의 사용량 등에 따라 달라진다. 일반적으로 생착까지 걸리는 시간의 중앙값은 약 21일 전후이며, 제대혈 이식의 경우 약 30일 전후로 더 오래 걸릴 수 있다. 만약 이식 후 21일(day 21)이 지나도 호중구 회복의 기미가 보이지 않으면, 골수 천자를 시행하여 골수 내에 조혈 전구 세포가 있는지 확인한다. 전구 세포가 발견되지 않으면 28일(day 28)에 다시 골수 천자를 시행하고, 이때도 확인되지 않으면 재이식을 고려하게 된다.
생착 시기에는 과도한 염증성 사이토카인 분비로 인해 발열, 피진, 폐부종 등 이식편대숙주병(GVHD)과 유사한 증상이 나타날 수 있는데, 이를 생착 증후군이라고 한다. 생착 증후군의 치료에는 주로 스테로이드제인 프레드니솔론이 사용된다.
6. 합병증
조혈모세포 이식은 이식받는 환자에게 치료와 관련된 높은 사망률을 동반하며, 이 때문에 생명을 위협하는 심각한 질환에 대해서만 제한적으로 사용된다. 이식 후 1년 생존율은 약 60% 정도로 추정되지만, 이 수치에는 원래 앓고 있던 질환으로 인한 사망과 이식 과정 자체로 인한 사망이 모두 포함된다.[50] 주요 합병증으로는 정맥 폐쇄성 질환, 점막염, 감염(패혈증), 이식편대숙주반응, 그리고 새로운 암의 발생 등이 있다.[51]
6. 1. 이식편대숙주병 (GVHD)
이식편대숙주병(Graft-versus-host disease, GVHD)은 동종 조혈모세포 이식에서 발생하는 주요 합병증 중 하나이다. 이는 이식된 공여자의 면역 세포(주로 T 세포)가 수혜자의 신체 조직을 외부 물질로 인식하고 공격하는 염증성 질환이다.[57] 공여자와 수혜자의 인간 백혈구 항원(HLA) 유형이 일치하더라도, 면역계가 조직 간의 다른 미세한 차이를 인식하여 발생할 수 있다. 즉, 이식된 세포(이식편)가 수혜자의 몸(숙주)을 공격하는 반응이다.[57] GVHD는 발생하는 시기와 특징에 따라 급성과 만성으로 나뉜다.=== 급성 GVHD ===
급성 GVHD는 일반적으로 조혈모세포 이식 후 100일 이내에 발생하며, 이식편에 함께 들어온 성숙한 공여자 T세포가 주요 원인으로 작용한다.[58] 강력한 전처치 요법(골수 파괴적 이식)을 받은 경우 이식 후 2~3주경에 잘 발생하고, 약한 전처치 요법(골수 비파괴적 미니 이식)의 경우 60일 이후에도 발병할 수 있다.
주요 침범 장기는 피부, 소화관, 간이다.[58] 초기 증상으로는 피부 발진이 가장 흔하며, 소화관 증상으로는 설사(특히 녹색의 물 설사나 혈성 설사)가 나타날 수 있다. 간이 침범되면 황달(빌리루빈 수치 상승) 등이 나타날 수 있다. 특정 장기의 손상이 48시간 이상 지속되고 다른 원인이 배제될 때 급성 GVHD로 진단할 수 있다. 중증도는 발진의 범위, 설사의 양, 빌리루빈 수치 등으로 평가한다.
급성 GVHD의 예방을 위해 면역억제제 투여가 필수적이다. 사이클로스포린 A(CsA)와 단기 메토트렉세이트(MTX) 병용 요법이 표준적인 예방법 중 하나이지만, 구체적인 방법은 환자 상태나 병원 방침에 따라 다양하다. CsA는 보통 이식 전날부터 투여를 시작하여 이식 후 상태를 보며 점진적으로 감량하고, MTX는 이식 후 1일, 3일, 6일, 11일 등 정해진 날짜에 투여한다. HLA 일치도에 따라 용량이 조절될 수 있다.
예방 조치에도 불구하고 등급 II 이상의 중등도-중증 급성 GVHD가 발생하면, 고용량 코르티코스테로이드(예: 메틸프레드니솔론 ) 투여가 표준 치료법이다.[58] 치료 반응을 보면서 용량을 조절하며 점차 감량한다. 스테로이드에 잘 반응하지 않는 경우에는 스테로이드 펄스 요법(고용량 스테로이드를 짧은 기간 집중 투여)이나 항흉선세포 글로불린(ATG) 등 다른 강력한 면역억제제 사용을 고려한다. 급성 GVHD와 증상이 유사할 수 있는 혈전성 미세혈관병증(TMA)과의 감별 진단이 중요하다.
급성 GVHD는 이식편대백혈병 효과(Graft-versus-leukemia effect, GVL)와 관련이 있다. 이는 이식된 면역 세포가 환자의 몸을 공격하는 동시에 남아있을 수 있는 백혈병 세포 등 악성 세포도 공격하는 효과를 말한다. 따라서 급성 GVHD가 발생한 환자는 기저 질환의 재발률이 낮아지는 경향이 있다. 그러나 GVHD 자체의 위험성이 크기 때문에 의도적으로 GVHD를 유도하는 치료는 일반적으로 하지 않는다.
=== 만성 GVHD ===
만성 GVHD는 이식 후 100일 이후에 발생하는 GVHD를 의미하며, 급성 GVHD와는 다른 병태 생리를 가진다. 이식된 조혈모세포에서 새로 분화하고 성숙한 T세포가 관여하는 것으로 생각되고 있다.[58]
만성 GVHD는 급성 GVHD보다 더 다양한 장기를 침범하며, 류마티스 관절염이나 루푸스와 같은 자가면역 질환과 유사한 양상을 보이기도 한다.[58] 경피증과 유사하게 피부나 내부 장기가 딱딱해지는 섬유증이 특징적으로 나타날 수 있다.[58] 주요 증상으로는 간 기능 이상, 간질성 폐렴, 피부 경화 및 색소 침착, 입안 건조 및 염증(구강 병변), 눈 건조(안구 건조증), 관절통 및 관절 경직, 백내장, 생식기 점막염, 근육염, 전신 권태감, 혈액 수치 감소 등 매우 다양하며 삶의 질에 큰 영향을 미친다.
만성 GVHD의 치료는 증상의 범위와 중증도에 따라 달라진다. 증상이 경미하고 특정 부위에 국한된 경우 스테로이드 연고나 점안액 등 국소 치료를 시도할 수 있다. 여러 장기를 침범하거나 심각한 기능 장애를 유발하는 경우에는 전신적인 면역 억제 요법(주로 스테로이드 및 기타 면역억제제)이 필요하다. 하지만 이러한 약물 치료가 효과가 충분하지 않거나, 장기간 사용으로 인한 부작용(감염 위험 증가, 고혈압, 당뇨병, 골다공증 등) 때문에 치료를 지속하기 어려울 수 있다.[58]
만성 GVHD 역시 GVL 효과와 관련이 있는 것으로 알려져 있다.
간엽 줄기 세포가 GVHD의 예방 및 치료에 효과적인지 확인하기 위한 연구가 진행 중이다.[59]
6. 2. 감염
조혈모세포 이식은 이식받는 환자에게 치료와 관련된 높은 사망률을 동반하며, 주요 합병증 중 하나는 감염이다.[51] 이식 과정에서 수혜자의 골수를 파괴하는 과정(골수 절제)이 필요한 경우가 많은데, 새로운 세포를 투여하기 전(생착)까지 환자는 감염에 대항하는 백혈구 수가 매우 적은 상태로 몇 주를 보내게 된다. 이 기간 동안 예방적 항생제를 사용하더라도 감염, 패혈증, 패혈성 쇼크의 위험이 높다. 하지만 아시클로버나 발라시클로버와 같은 항바이러스제는 혈청 반응 양성 환자에게서 조혈모세포 이식과 관련된 단순 포진 감염 발생을 예방하는 데 효과적이다.[52]동종 이식의 경우, 이식편대숙주병(GVHD)을 예방하거나 치료하기 위해 사용하는 면역억제제는 기회 감염의 위험을 더욱 높인다. 면역억제제는 보통 이식 후 최소 6개월 동안 투여되며, GVHD 치료가 필요하면 더 오래 사용될 수도 있다. 이식 환자는 홍역이나 소아마비 같은 질병에 대한 기존 면역력을 잃게 되므로, 면역억제제 투여를 중단한 후에는 소아 백신을 다시 접종해야 한다.[53]
일본에서는 감염 예방을 위해 무균실에서 환자를 관리하는 경우가 많으며, 이식 전 처치 시작 전후부터 생착이 확인될 때까지 무균실에서 지내는 경우가 일반적이다. 감염은 발생하는 시기에 따라 원인 병원체나 환자 상태가 다르므로, 시기별로 특수한 감염 대책이 필요하다. 일반적으로 초기에는 단순 헤르페스 바이러스 감염이나 폐포자충 폐렴이 흔하고, 이후에는 거대세포 바이러스 감염이나 아스페르길루스 감염이 많이 발생하는 경향이 있다.
6. 3. 간정맥폐쇄성 질환 (VOD)
조혈모세포 이식의 주요 합병증 중 하나로 심각한 간 손상을 일으킬 수 있는 간정맥폐쇄성 질환(VOD)이 있다. 이 질환은 새롭게 동양혈관폐쇄증후군(SOS)으로도 불린다.[54] VOD/SOS는 간 내 작은 혈관(동양 혈관)의 내피 세포 손상 및 폐쇄로 인해 발생하는 것으로 알려져 있다. 임상적으로는 빌리루빈 수치 상승, 간비대, 체액 저류 등이 특징적으로 나타난다. 중증 SOS는 사망률이 매우 높다. 항응고제 또는 데피브로타이드와 같은 약물이 VOD의 심각성을 줄이는 데 효과적일 수 있으나, 출혈 관련 합병증 위험을 증가시킬 수 있다. 한편, 우르소데옥시콜산은 담즙 흐름을 촉진하는 기전을 통해 VOD 예방에 도움이 되는 것으로 보고되었다.6. 4. 출혈성 방광염
조혈모세포 이식을 받는 어린이의 약 5%는 방광 점막에 영향을 받을 수 있다. 이로 인해 혈뇨(소변에 피가 섞여 나옴), 빈뇨, 복통, 혈소판 감소증 등의 증상이 나타날 수 있다.[56]6. 5. 기타 합병증
조혈모세포 이식은 치료와 관련된 높은 사망률을 동반하며, 이 때문에 생명을 위협하는 심각한 질환에 대해서만 제한적으로 사용된다. 이식 후 1년 생존율은 약 60% 정도로 추정되지만, 이 수치에는 원래 앓고 있던 질환으로 인한 사망과 이식 과정 자체로 인한 사망이 모두 포함된다.[50] 주요 합병증으로는 정맥 폐쇄성 질환, 점막염, 감염(패혈증), 이식편대숙주반응, 그리고 새로운 암의 발생 등이 있다.[51]이식 전 처치 과정에서 흔히 나타나는 부작용 중 하나는 점막염으로, 특히 입안과 목구멍 점막에 손상이 생긴다. 생명을 직접적으로 위협하는 경우는 드물지만, 매우 고통스러워 음식이나 음료를 섭취하기 어렵게 만든다. 점막염 치료는 통증 완화제를 사용하고, 탈수와 영양실조를 막기 위해 정맥 주사를 통해 수분과 영양을 공급하는 방식으로 이루어진다.[55]
또한, 조혈모세포 이식을 받은 환자는 구강 편평 세포 암종과 같은 구강암 발생 위험이 높아진다. 이식 후 발생하는 구강암은 이식을 받지 않은 환자에게 생기는 구강암보다 더 공격적인 경향을 보이며 예후가 좋지 않을 수 있다.[62]
한 메타 분석 연구에 따르면, 조혈모세포 이식 후에는 이차적인 암 발생 위험이 눈에 띄게 증가한다. 예를 들어, 골암, 두경부암, 흑색종의 발생률은 일반 인구에 비해 각각 10.04배, 6.35배, 3.52배 높게 나타났다. 따라서 이식 환자들은 이러한 암들을 예방하고 조기에 발견하기 위해 정기적인 선별 검사 프로그램에 관련 진단 검사를 포함하는 것이 중요하다.[63]
7. 이식편대종양 효과 (GVT)
이식편대종양 효과(GVT) 또는 이식편대백혈병 효과는 이식편대숙주반응(GvHD) 현상의 긍정적인 측면으로 볼 수 있다. 예를 들어, 동종 조혈모세포 이식을 받은 환자 중 급성 또는 특히 만성 GvHD를 겪는 경우, 암 재발 위험이 낮아지는 경향이 있다.[60][42] 이는 이식된 공여자의 T 림프구가 수혜자의 질병에 걸린 골수를 공격하는 치료적 면역 반응 때문이다. 이러한 낮은 재발률은 일란성 쌍둥이 간의 이식에 비해 동종 조혈모세포 이식의 성공률을 높이는 중요한 요인이며, 이는 동종 조혈모세포 이식이 일종의 면역 요법임을 보여준다. GVT는 강력한 면역억제 요법을 사용하지 않는 이식 방법에서 얻을 수 있는 주요 이점이다.
이식편대종양 효과는 만성 백혈병, 저등급 림프종과 같이 비교적 천천히 진행되는 질환이나 일부 다발성 골수종에서 주로 유익한 효과를 보이지만, 빠르게 진행하는 급성 백혈병에서는 그 효과가 상대적으로 떨어진다.[61]
조혈모세포 이식 후 암이 재발할 경우, 공여자의 백혈구(특히 림프구)를 추가로 환자에게 주입하는 공여 림프구 주입(DLI, Donor Lymphocyte Infusion)을 시행하여 치료 효과를 기대할 수 있다.[61]
8. 기증자 등록 및 관리
2006년 전 세계 71개국 1,327개 센터를 대상으로 한 조사에 따르면, 한 해 동안 50,417건의 첫 조혈모세포 이식(HSCT)이 이루어졌다. 이 중 약 57%는 자가 이식이었고, 43%는 동종 이식(가족 기증자 11,928건, 비혈연 기증자 9,588건)이었다. 이식의 주요 적응증은 림프증식성 질환(55%)과 백혈병(34%)이었으며, 대부분 유럽(48%) 또는 아메리카(36%)에서 시행되었다.
전 세계적인 기증자 등록 및 이식 노력은 꾸준히 확대되어, 전 세계 조혈모세포 이식 네트워크(Worldwide Network for Blood and Marrow Transplantation)는 2012년 12월에 100만 번째 조혈모세포 이식이 이루어졌다고 보고했다. 또한 세계 골수 기증자 협회(World Marrow Donor Association)에 따르면 2014년에는 전 세계적으로 비혈연 이식을 위해 제공된 줄기 세포 제품이 20,604건(골수 기증 4,149건, 말초 혈액 줄기 세포 기증 12,506건, 제대혈 3,949건)으로 증가했다.
8. 1. 한국의 기증 현황
주어진 원본 소스에는 '한국의 기증 현황'에 대한 내용이 포함되어 있지 않습니다. 따라서 해당 섹션에 대한 내용을 작성할 수 없습니다.8. 2. 기증자 등록 절차
2012년 말 기준으로, 전 세계 49개국 67개 조혈모세포 기증자 등록소에 약 2,020만 명이 기증 의사를 등록했다. 이 중 약 1,790만 명은 유전자형(ABDR 형식) 확인이 가능하여 쉽게 일치 여부를 확인할 수 있었다. 또한, 30개국 46개 제대혈 은행에는 약 56만 1,000개의 제대혈이 보관되어 있었다.[76]국가별 등록 인원을 보면 미국이 800만 명으로 가장 많았고, 키프로스는 인구 대비 등록률(15.4%)이 가장 높았다.[76]
미국 내에서는 소수 인종 집단의 등록률이 낮아, 이들이 생명을 구할 수 있는 일치하는 기증자를 찾을 가능성이 상대적으로 낮다. 1990년에는 아프리카계 미국인 중 단 6명만이 조혈모세포 일치를 찾을 수 있었는데, 이들은 모두 유럽인의 일반적인 유전자 특징을 가지고 있었다.[77]
아프리카계 인구는 유럽계보다 유전적으로 더 다양하기 때문에, 일치하는 기증자를 찾기 위해서는 더 많은 수의 기증자 등록이 필요하다. 남아프리카 공화국에는 조혈모세포 및 제대혈 은행이 운영되고 있으며, 나이지리아에서도 새로운 프로그램이 시작되고 있다.[77] 아프리카계, 혼혈, 라틴 아메리카계, 원주민 및 기타 여러 공동체에서 기증자가 부족한 상황이어서, 다양한 인종 배경을 가진 사람들의 기증 참여가 요청되고 있다.
미국에는 비혈연 관계의 동종 기증자를 모집하는 두 개의 주요 등록소가 있다: NMDP (Be the Match)와 Gift of Life Marrow Registry.
기증자가 조혈모세포를 제공하는 과정에는 다양한 위험과 부담이 따를 수 있으며, 이러한 측면에 대한 충분한 검토와 논의가 필요하다.
9. 향후 전망
2007년, 독일 베를린의 게로 휘터를 포함한 의료진은 급성 골수성 백혈병과 HIV를 동시에 앓고 있던 티모시 레이 브라운에게 조혈모세포 이식을 시행했다.[78] 의료진은 60명의 기증 후보자 중에서 HIV 감염에 저항성을 보이는 드문 유전적 특성(CCR5-Δ32 동형 접합체)을 가진 기증자를 선택했다. 이 유전적 특성은 HIV 바이러스가 세포에 부착하는 것을 막아준다. 이러한 돌연변이는 유럽계 인구 약 1,000명 중 1명꼴로 발견되지만, 다른 인종 집단에서는 훨씬 드물다.[79][80] 브라운은 백혈병 재발 후 1년 뒤 두 번째 이식을 받았다. 첫 이식 후 3년 이상, 항레트로바이러스 약물 치료 중단 후에도 그의 혈액이나 조직 어디에서도 HIV는 검출되지 않았다.[81] HIV 특이 항체 수치 감소는 그가 기능적으로 완치되었을 가능성을 시사했지만, 과학자들은 이것이 매우 이례적인 사례임을 강조한다.[82] 이식 과정 자체의 위험성(이식편대숙주반응, 백질뇌병증 등) 때문에, 적합한 기증자를 찾더라도 HIV 환자에게 이 치료법을 널리 적용하기는 어렵다.[83][84]
2012년, 다니엘 쿠리츠케스는 HIV 환자 두 명에게 CCR5-Δ32 유전자 변이가 없는 기증자의 조혈모세포를 이식한 결과를 보고했다. 이식 후 항레트로바이러스 치료를 받는 동안에는 민감한 검사에서도 HIV가 검출되지 않았으나(3 copies/ml 미만), 치료를 중단하자 두 환자 모두에게서 바이러스가 다시 나타났다.[85]
2019년에는 영국에서 CCR5-Δ32 기증자로부터 골수 이식을 받은 두 번째 HIV 완치 사례("런던 환자")가 보고되었다.[86]
한편, 조혈모세포 이식은 다발성 경화증(MS) 치료에도 활용될 가능성을 보이고 있다. 1997년 만성 골수성 백혈병(CML) 치료를 위해 MS 환자에게 골수 이식을 시행한 보고[87] 이후, MS 치료 목적의 조혈모세포 이식(HSCT) 연구가 600건 이상 발표되었다.[88] 특히 공격적이고 활동성이 높은 MS 환자에게서 HSCT는 지속적인 재발 감소, 추가적인 진행 억제, 장애 부담 감소 등의 효과를 보였다.[88] 110명의 환자를 대상으로 한 무작위 임상 시험에서는 HSCT가 기존의 질병 완화 치료보다 질병 진행까지의 시간을 유의미하게 연장시키는 것으로 나타났다.[89] 중증 환자의 장기 추적 연구에서도 HSCT 후 완전한 질병 관해가 가능하다는 결과가 보고되었다.[90]
2007년 기준으로 조혈모세포 이식은 급성 골수성 백혈병, 다발성 골수종, 악성 림프종 치료에 활발히 이용되고 있다. 앞으로는 더 많은 환자들이 치료받을 수 있도록 조혈모세포 공급원을 늘리는 것이 중요한 과제이다. 또한, 최근에는 GVL 효과를 이용한 T세포 분리 기술 등이 발전하면서, 환자의 상태에 맞춰 이식할 세포를 조절하는 맞춤형 세포 치료로 발전할 가능성도 있다.
참조
[1]
논문
Revisiting hematopoiesis: applications of the bulk and single-cell transcriptomics dissecting transcriptional heterogeneity in hematopoietic stem cells
2022-03
[2]
논문
Brazilian Nutritional Consensus in Hematopoietic Stem Cell Transplantation: Children and adolescents
[3]
서적
Thomas' hematopoietic cell transplantation: stem cell transplantation
Wiley-Blackwell
[4]
논문
Hematopoietic stem cells: potential new applications for translational medicine
2014
[5]
논문
Hematopoietic stem cell expansion and generation: the ways to make a breakthrough
2015-12
[6]
논문
Stem Cells Applications in Regenerative Medicine and Disease Therapeutics
[7]
논문
Autologous haematopoietic stem cell transplants for autoimmune disease{{snd}}feasibility and transplant-related mortality. Autoimmune Disease and Lymphoma Working Parties of the European Group for Blood and Marrow Transplantation, the European League Against Rheumatism and the International Stem Cell Project for Autoimmune Disease
1999-10
[8]
논문
Clinical applications of blood-derived and marrow-derived stem cells for nonmalignant diseases
2008-02
[9]
논문
Reversal of skeletal radiographic pathology in a case of malignant infantile osteopetrosis following hematopoietic stem cell transplantation
2017-03
[10]
논문
Radiologic resolution of malignant infantile osteopetrosis skeletal changes following hematopoietic stem cell transplantation
2015-09
[11]
논문
Progression of Hip Dysplasia in Mucopolysaccharidosis Type I Hurler After Successful Hematopoietic Stem Cell Transplantation
2016-03
[12]
논문
Resetting the immune system with immunoablation and autologous haematopoietic stem cell transplantation in autoimmune diseases
2016-07-01
[13]
논문
Long-term results of stem cell transplantation for MS: A single-center experience
https://n.neurology.[...]
2011-03-22
[14]
논문
Autologous HSCT for severe progressive multiple sclerosis in a multicenter trial: impact on disease activity and quality of life
2005-03-15
[15]
논문
Criteria for evaluating disease response and progression in patients with multiple myeloma treated by high-dose therapy and haemopoietic stem cell transplantation. Myeloma Subcommittee of the EBMT. European Group for Blood and Marrow Transplant
1998-09
[16]
논문
Unrelated donor marrow transplantation for B-cell chronic lymphocytic leukemia after using myeloablative conditioning: results from the Center for International Blood and Marrow Transplant research
2005-08
[17]
논문
Outcome of patients with acquired aplastic anemia given first line bone marrow transplantation or immunosuppressive treatment in the last decade: a report from the European Group for Blood and Marrow Transplantation (EBMT)
2007-01
[18]
웹사이트
CIBMTR Summary Slides I
https://campus.mcw.e[...]
Center for International Blood and Marrow Transplant Research
[19]
논문
Microtransplantation: clinical applications and mechanisms
2018-11
[20]
논문
Hematopoietic stem cell transplantation: a global perspective
2010-04
[21]
논문
One million haemopoietic stem-cell transplants: a retrospective observational study
[22]
웹사이트
Annual Report, 2014
https://collaboratio[...]
World Marrow Donor Association
[23]
논문
Lymphoma Update: 1997
[24]
논문
A comparison of allografting with autografting for newly diagnosed myeloma
2007-03
[25]
논문
C-peptide levels and insulin independence following autologous nonmyeloablative hematopoietic stem cell transplantation in newly diagnosed type 1 diabetes mellitus
2009-04
[26]
논문
Microvascular Complications in Type 1 Diabetes: A Comparative Analysis of Patients Treated with Autologous Nonmyeloablative Hematopoietic Stem-Cell Transplantation and Conventional Medical Therapy
2017-11-23
[27]
논문
Autologous nonmyeloablative hematopoietic stem cell transplantation in new-onset type 1 diabetes: a multicenter analysis
2014-09
[28]
논문
Autologous haematopoietic stem cell transplantation for treatment of multiple sclerosis
https://pubmed.ncbi.[...]
2017-07
[29]
논문
Efficacy and safety of autologous hematopoietic stem-cell transplantation in multiple sclerosis: a systematic review and meta-analysis
https://pubmed.ncbi.[...]
2019-03
[30]
논문
Allogeneic haemopoietic stem cell transplantation for multiple myeloma or plasma cell leukaemia using fractionated total body radiation and high-dose melphalan conditioning
[31]
논문
Haemopoietic stem cell transplantation in Australia and New Zealand, 1992–2001: progress report from the Australasian Bone Marrow Transplant Recipient Registry
2005-01
[32]
웹사이트
The Only Real Cure Out There, for Now
http://clltopics.org[...]
CLL Topics, Inc.
2005-07-19
[33]
논문
Cost-effectiveness of Single-Use Technologies for Commercial Cell Therapy Manufacture
2013-03
[34]
웹사이트
FDA approves omidubicel to reduce time to neutrophil recovery and infection in patients with hematologic malignancies
https://www.fda.gov/[...]
2023-04-20
[36]
논문
Haploidentical HSCT in the Treatment of Pediatric Hematological Disorders
2024-06-09
[37]
서적
Bone Marrow Harvesting for HSCT
Springer
2019
[38]
논문
Peripheral blood stem cells for allogeneic transplantation: a review
2001
[39]
논문
Stem Cells Collection and Mobilization in Adult Autologous/Allogeneic Transplantation: Critical Points and Future Challenges
2024-03-28
[40]
논문
Multipotent fetal stem cells in reproductive biology research
2023-06-07
[41]
논문
Cryopreservation of Hematopoietic Stem Cells: Emerging Assays, Cryoprotectant Agents, and Technology to Improve Outcomes
2019-06
[42]
논문
Myeloablative allografting for chronic lymphocytic leukemia: evidence for a potent graft-versus-leukemia effect associated with graft-versus-host disease
2005-11
[43]
서적
Williams Hematology
McGraw-Hill
[44]
논문
Impact of conditioning regimen intensity on outcome of allogeneic hematopoietic cell transplantation for advanced acute myelogenous leukemia and myelodysplastic syndrome
2006-10
[45]
논문
Comparative outcome of nonmyeloablative and myeloablative allogeneic hematopoietic cell transplantation for patients older than 50 years of age
2005-02
[46]
논문
Graft-versus-host disease after nonmyeloablative versus conventional hematopoietic stem cell transplantation
2003-07
[47]
논문
Immune monitoring of transplant patients in transient mixed chimerism tolerance trials
2018-05
[48]
논문
The two-step approach to allogeneic hematopoietic stem cell transplantation
2023-09-01
[49]
논문
Prospects and Potential for Chimerism Analysis after Allogeneic Hematopoietic Stem Cell Transplantation
2024-06-06
[50]
웹사이트
MSK's One-Year Survival Rate after Allogeneic Bone Marrow Transplant Exceeds Expectations – Memorial Sloan Kettering Cancer Center
https://www.mskcc.or[...]
2012
[51]
간행물
Complications, Graft-Versus-Host Disease, and Late Effects After Pediatric Hematopoietic Stem Cell Transplant (PDQ®): Health Professional Version
National Cancer Institute (US)
2024-06-13
[52]
논문
A systematic review of viral infections associated with oral involvement in cancer patients: a spotlight on Herpesviridea
2010-08
[53]
논문
Facilitators and Barriers to Successful Revaccination after Hematopoietic Stem Cell Transplantation among Adult Survivors: A Scoping Review
2024-03
[54]
웹사이트
Sinusoidal Obstruction
https://livertox.nih[...]
2012
[55]
논문
Prevention and management of acute toxicities from conditioning regimens during hematopoietic stem cell transplantation
2024-04-03
[56]
논문
Hemorrhagic Cystitis Following Hematopoietic Stem Cell Transplants in Children: Single Center Experience
[57]
논문
Transplantation of purified hematopoietic stem cells: requirements for overcoming the barriers of allogeneic engraftment
1996-02
[58]
논문
Treatment of steroid-refractory graft versus host disease in children
2023-09-15
[59]
논문
Mesenchymal stromal cells as treatment or prophylaxis for acute or chronic graft-versus-host disease in haematopoietic stem cell transplant (HSCT) recipients with a haematological condition
2019-01
[60]
논문
Graft-versus-tumor effects after allogeneic hematopoietic cell transplantation with nonmyeloablative conditioning
http://orbi.ulg.ac.b[...]
2005-03
[61]
웹사이트
Memorial Sloan-Kettering Cancer Center > Blood & Marrow Stem Cell Transplantation > The Graft-versus-Tumor Effect
http://www.mskcc.org[...]
2003-11-20
[62]
논문
Oral cancer in patients after hematopoietic stem-cell transplantation: long-term follow-up suggests an increased risk for recurrence
2010-12
[63]
논문
The risk of malignancies in patients receiving hematopoietic stem cell transplantation: a systematic review and meta-analysis
2020-10
[64]
웹사이트
Data analysis slides by Center for International Blood and Marrow Transplant Research
https://campus.mcw.e[...]
[65]
논문
Hematopoietic cell transplantation (HCT)-specific comorbidity index: a new tool for risk assessment before allogeneic HCT
2005-10
[66]
논문
A new method of classifying prognostic comorbidity in longitudinal studies: development and validation
[67]
논문
Exercise capacity in young adults after hematopoietic cell transplantation in childhood
2018-02
[68]
웹사이트
Neupogen Prescription information
http://pi.amgen.com/[...]
[69]
논문
Severe events in donors after allogeneic hematopoietic stem cell donation
2009-01
[70]
논문
Adverse events among 2408 unrelated donors of peripheral blood stem cells: results of a prospective trial from the National Marrow Donor Program
2009-04
[71]
논문
Stem cell donation--what advice can be given to the donor?
2009-10
[72]
논문
Aplastic Anemia Treated with Daily Transfusions and Intravenous Marrow: Case Report Treated with Daily
https://www.acpjourn[...]
1939-08-01
[73]
논문
Intravenous infusion of bone marrow in patients receiving radiation and chemotherapy
1957-09
[74]
뉴스
Robert A. Good, 81, Founder of Modern Immunology, Dies
https://www.nytimes.[...]
2003-06-18
[75]
웹사이트
Cancer Research Pioneer Dies
http://bonemarrowfou[...]
2013-10-06
[76]
웹사이트
WMDA
https://wmda.info/
[77]
뉴스
Finding a Match, and a Mission: Helping Blacks Survive Cancer
https://www.nytimes.[...]
2012-05-15
[78]
뉴스
German HIV patient cured after stem cell transplant
http://www.belfastte[...]
2010-12-15
[79]
뉴스
Bone marrow 'cures HIV patient'
http://news.bbc.co.u[...]
BBC News
2009-01-02
[80]
논문
The geographic spread of the CCR5 Delta32 HIV-resistance allele
2005-11
[81]
논문
Evidence for the cure of HIV infection by CCR5Δ32/Δ32 stem cell transplantation
2011-03
[82]
웹사이트
Transplanting Hope: Stem Cell Experiment Raises Eyebrows at CROI
http://www.aidsmeds.[...]
2018-05-02
[83]
논문
Not an HIV cure, but encouraging new directions
2009-02
[84]
논문
Gene therapy strategies: can we eradicate HIV?
2011-06
[85]
뉴스
HIV returns in two Boston patients after bone marrow transplants
http://edition.cnn.c[...]
CNN
2013-12-09
[86]
뉴스
H.I.V. Is Reported Cured in a Second Patient, a Milestone in the Global AIDS Epidemic
https://www.nytimes.[...]
2019-03-04
[87]
논문
Allogeneic bone marrow transplant for chronic myelogenous leukemia in a patient with multiple sclerosis
1997-02
[88]
논문
Hematopoietic stem cell therapy for multiple sclerosis: top 10 lessons learned
2013-01
[89]
논문
Effect of Nonmyeloablative Hematopoietic Stem Cell Transplantation vs Continued Disease-Modifying Therapy on Disease Progression in Patients With Relapsing-Remitting Multiple Sclerosis: A Randomized Clinical Trial
2019-01
[90]
논문
Sustained remission in multiple sclerosis after hematopoietic stem cell transplantation
2019-11
[91]
논문
Autologous haematopoietic stem cell transplantation for neurological diseases
2018-02
[92]
논문
Modification of
[93]
서적
骨髄移植
中外医学社
[94]
논문
Aplastic anemia treated with daily transfusion and intravenous marrow
[95]
논문
Hematopoietic-Cell Transplantation at 50
2007-10-11
[96]
문서
現在のセルビア。
[97]
논문
Study of six cases of accidental acute total irradiation
1959-05-04
[98]
논문
A compendium of reported human bone marrow transplants.
[99]
문서
そもそもHLAの存在は1952年に発見されてはいたものの、個体おのおののHLAを検査する方法がこの段階では確立していなかった。
[100]
논문
Bone-Marrow Transplantation
1975-04-24
[101]
문서
非寛解期での骨髄移植は、現在でも予後が悪い。
[102]
논문
Marrow Transplantation for Acute Nonlymphoblastic Leukemia in First Remission
1979-09-13
[103]
논문
Analysis of 462 transplantations from unrelated donors facilitated by the National Marrow Donor Program
1993-03-04
[104]
논문
Analysis of 500 bone marrow transplants from unrelated donors (UR-BMT) facilitated by the Japan Marrow Donor Program: confirmation of UR-BMT as a standard therapy for patients with leukemia and aplastic anemia
[105]
논문
Hematopoietic Reconstitution in a Patient with Fanconi's Anemia by Means of Umbilical-Cord Blood from an HLA-Identical Sibling
1989-10-26
[106]
웹사이트
ThermoGenesis Applauds the U.S. Congress for Passing the 'Stem Cell Therapeutic and Research Act of 2005'
http://www.prnewswir[...]
A UBM plccompany
2014-01-18
[107]
논문
Allogeneic granulocyte colony-stimulating factor-mobilized peripheral blood progenitor cells for treatment of engraftment failure after bone marrow transplantation
1993-03-01
[108]
논문
血液疾患における同種造血幹細胞移植の適応について
https://doi.org/10.1[...]
[109]
논문
急性骨髄性白血病の造血幹細胞移植における遺伝子変異解析の実臨床への応用
https://doi.org/10.7[...]
[110]
간행물
[111]
간행물
[112]
서적
Williams Hematology
McGraw-Hill
[113]
논문
Impact of conditioning regimen intensity on outcome of allogeneic hematopoietic cell transplantation for advanced acute myelogenous leukemia and myelodysplastic syndrome
[114]
논문
Comparative outcome of nonmyeloablative and myeloablative allogeneic hematopoietic cell transplantation for patients older than 50 years of age
[115]
논문
Graft-versus-host disease after nonmyeloablative versus conventional hematopoietic stem cell transplantation
[116]
논문
Hematopoietic stem cells: potential new applications for translational medicine.
2014
[117]
논문
Hematopoietic stem cell expansion and generation: the ways to make a breakthrough.
2015-12
[118]
웹인용
조혈모세포이식
http://health.mw.go.[...]
보건복지부
2013-11-12
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com