조혈모세포
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
조혈모세포(HSC)는 림프구와 유사한 모양을 가진 원형 세포로, 혈액 세포를 생성하는 조혈 작용을 수행한다. 주로 뼈의 적색 골수에서 발견되며, 배아 발생 과정 중에는 대동맥-생식선-중신부 부위와 태아 간 등에서 나타난다. 조혈모세포는 'niche'라는 특수한 미세 환경에서 자가 증식과 분화를 하며, 여러 종류의 Colony forming units (CFU)로 분류된다. 조혈모세포는 혈액 세포 형성, 즉 조혈에 필수적이며, 골수 이식에 활용된다. 노화 과정에서 DNA 손상이 축적되며, 이식, 혈액 질환 치료, 암 치료 등 임상적으로 중요한 역할을 한다. 조혈모세포 연구는 유량 측량 분석, Colony Forming Cell Assays, Co-culture Assays 등의 방법으로 진행된다.
더 읽어볼만한 페이지
- 조혈모세포 - 조혈모세포 이식
조혈모세포 이식은 손상된 환자의 조혈모세포를 건강한 조혈모세포로 대체하는 치료법으로, 골수, 말초 혈액, 제대혈 이식 등으로 나뉘며 자가 및 동종 이식으로 구분되고, 혈액암과 비악성 질환 치료에 사용되며, HLA형 일치가 중요하고 이식 후 합병증에 대한 주의가 필요하다. - 혈액 세포 - 호산구
호산구는 골수에서 생성되어 혈액을 통해 이동하는 백혈구의 한 종류로, 기생충 감염이나 알레르기 반응과 관련된 면역 반응에 관여하고 염증을 조절하는 기능을 수행하며, 호산구증가증은 다양한 원인에 의해 발생할 수 있고 코르티코스테로이드 등으로 치료한다. - 혈액 세포 - 혈구
혈구는 혈액의 주요 구성 요소인 적혈구, 백혈구, 혈소판으로 구성되어 각 세포는 산소 운반, 면역 방어, 혈액 응고와 같은 고유한 기능 수행하며 혈액 검사를 통해 혈구 관련 질병 진단 및 건강 상태를 평가할 수 있다. - 줄기 세포 - 배아줄기세포
배아줄기세포는 초기 포유류 배아에서 유래하여 모든 세포로 분화 가능하며 자기 재생 능력을 갖춘 만능 세포로, 재생 의학, 신약 개발 등에 활용되지만, 윤리적 문제와 면역 거부 반응 등의 과제를 안고 있다. - 줄기 세포 - 제대혈
제대혈은 탯줄 혈액으로, 조혈모 줄기 세포를 다량 함유하여 조혈모세포 이식의 공급원으로 활용되지만, 세포 수 부족으로 생착률이 낮고 조혈 회복이 늦는 단점도 있으며, 제대혈 은행에 보관되고 활용에 대한 논의가 이루어진다.
2. 구조
조혈모세포(HSCs)는 림프구와 유사하게 둥근 모양의 핵을 가지고 있다. 조혈모세포는 배양 상태에서 일반 백혈구처럼 보이고 작용하기 때문에 외형으로 구분하기 매우 어렵다. 따라서 현재 연구자들은 세포 표면에 발현하는 표면단백질을 이용하여 조혈모세포를 포함하는 세포군을 구분한다.[53][54][55][56]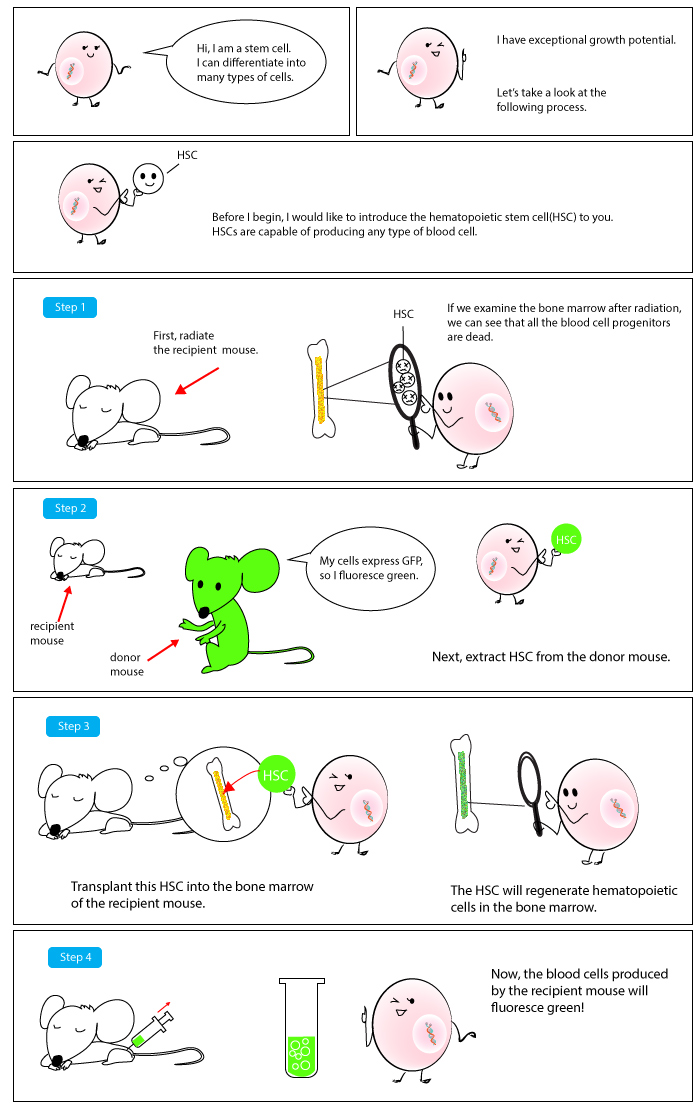
조혈모세포는 순수 집단으로 분리될 수 없기 때문에 현미경으로 확인할 수 없다. 여러 개의 서로 다른 세포 표면 표지의 조합을 사용하여 희귀한 조혈모세포를 주변 혈액세포로부터 분리하는 유량측정분석으로 확인되거나 분리될 수 있다. 또한 rhodamine 123이나 Hoechst 33342와 같은 필수적인 염색 dye로 크기가 작고 얼룩이 적은 것으로 특징지어진다.
사람 조혈모세포의 대표적인 마커는 CD34이다. 화학요법이나 질병으로 혈액 생성에 문제가 있는 환자의 혈액 체계를 복구하기 위해 필요한 조혈모세포를 분리하는 데에 CD34 marker가 활용된다. Mouse의 경우 골수 세포 10,000~15,000개당 1개의 HSC가, 말초 혈액 내에는 약 10만 개 세포당 1개의 세포가 포함되어 있는 것으로 추정된다. HSC에 대한 판단 기준은, 자체 혈액을 생성하는 조혈모세포와 혈액 세포를 충분한 양의 방사선 조사로 모두 제거한 Mouse에 세포가 주입되었을 때 모든 종류의 혈액을 다시 생산해 낼 수 있는지 여부이다.[57]
현재 활용되고 있는 HSC를 포함하는 세포 군의 주요 표면 마커는 다음과 같다.
- Mouse: CD34low/-, SCA-1+, Thy1+/low, CD38+, C-kit+, Lin-
- Human: CD34+, CD59+, Thy1+, CD38low/-, C-kit-/low, Lin-
2. 1. 위치
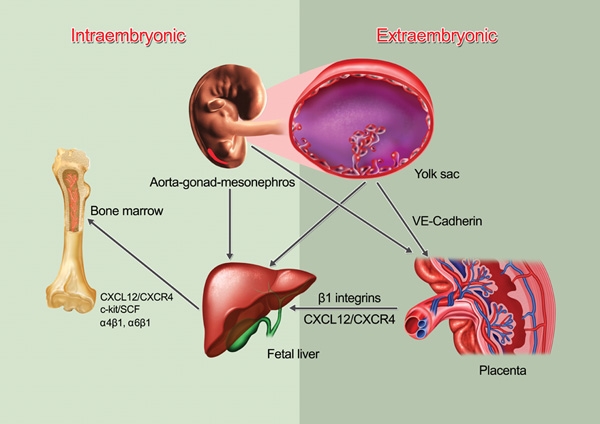
조혈모세포의 중요한 기능인 조혈작용은 혈액 속의 혈구(血球)가 만들어지는 과정으로, 대부분 뼈의 중심에 있는 적색 골수에서 일어나며 일부는 말초 혈액에서도 발견할 수 있다.[50] 조혈모세포는 포유류의 발생과정 중 중배엽에서 유래하며, 최초의 조혈모세포는 AGM (aorta-gonad-mesonephros)에서 발견되고, 이후 태아의 간에서 크게 증식하여 출생 전 골수에 정착하게 된다.[57]생쥐와 인간의 배아 발생 과정에서 가장 먼저 조혈모세포는 대동맥-생식선-중신부 부위, 난황 및 제 동맥에서 발견된다.[8][9][10] 조금 더 늦게, HSC는 태반, 난황, 배아 머리 및 태아 간에서도 발견된다.[3][18]
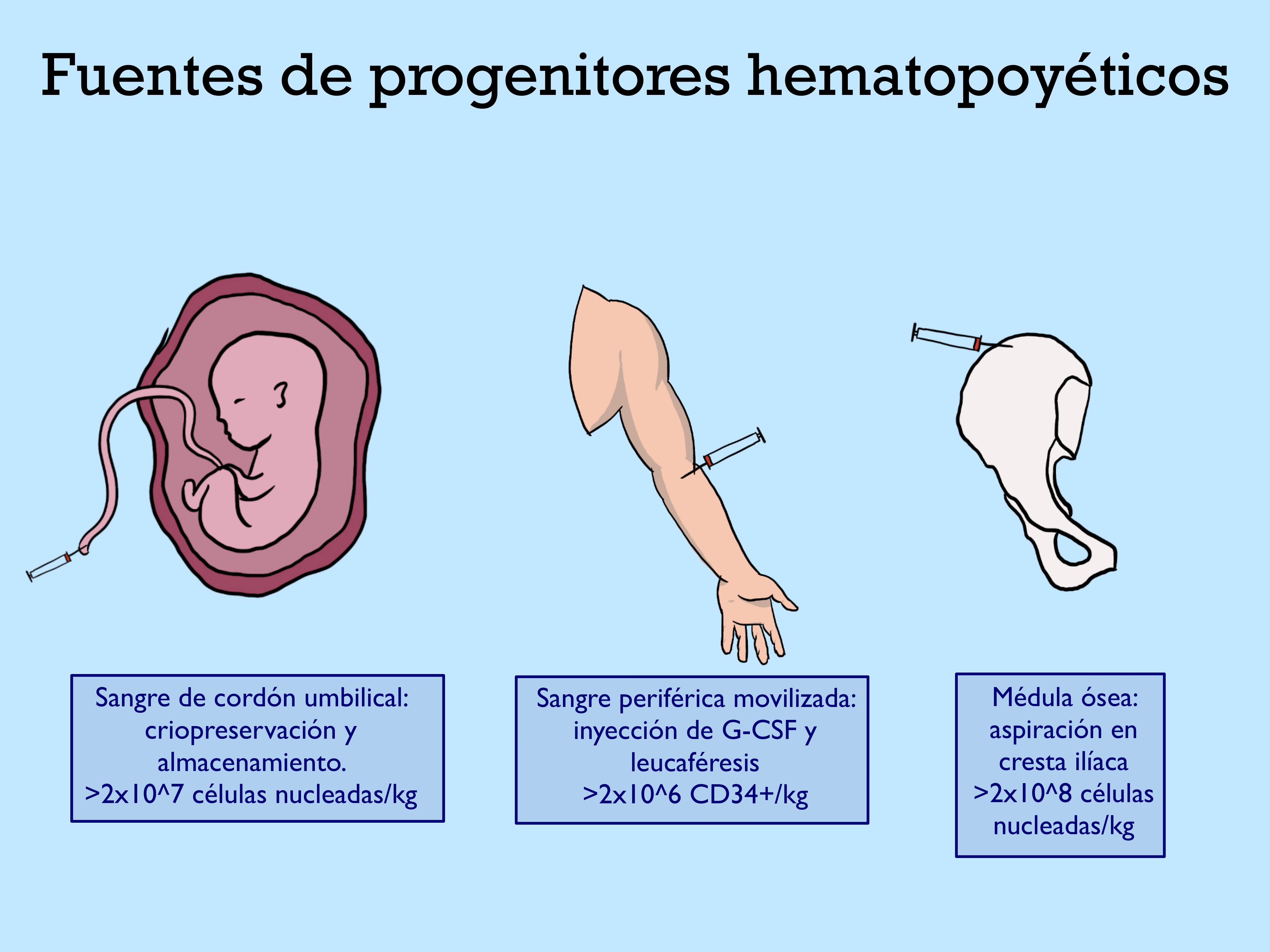
줄기 세포와 전구 세포는 바늘과 주사기를 사용하여 장골 능선의 골반에서 채취할 수 있다.[11]
2. 2. 미세 환경
조혈모세포가 혈액에서 적절하게 자가증식 및 분화를 하려면 "niche"라는 특수한 미세환경이 필요하다. 조혈작용에 관여하는 niche는 조혈모세포를 유지하고 조절하는 미세환경으로 구성되어 있다. 줄기세포의 자가증식은 골수의 줄기세포 niche에서 발생하는 것으로 생각되며, 이곳에 존재하는 핵심 신호가 자가증식에 중요할 것으로 보는 것이 타당하다.[51]niche는 줄기세포의 정지 및 세포주기 진입을 통제하고, 조직과 유기체 상태에 대한 정보를 줄기세포에 제공하며, 줄기세포의 돌연변이를 억제한다.[52]
생쥐와 인간의 배아 발생 과정에서 가장 먼저 조혈모세포는 대동맥-생식선-중신부 부위, 난황 및 제 동맥에서 발견된다.[8][9][10] 조금 더 늦게는, HSC는 태반, 난황, 배아 머리 및 태아 간에서도 발견된다.[3][18]
2. 3. 분류
조혈모세포의 분화 방향성이 정해진 조혈모세포의 아형을 집락 형성 단위(Colony forming units, CFU)라고 부른다. 조혈모세포 CFU에는 다음과 같은 다양한 종류가 있다.
CFU-S는 계통 기반의 다른 CFU와 달리 ''생체 내'' 클론 집락 형성을 기반으로 한다. 이는 방사선 조사된 쥐의 비장에 주입된 골수 세포가 8~12일 후 성숙하는 조혈 세포의 클론을 생성하는 능력에 달려 있다. 초기 연구에서 광범위하게 사용되었지만, 현재는 줄기 세포보다는 더 성숙한 전구 세포 또는 '''전이 증폭 세포'''를 측정하는 것으로 간주된다.
3. 기능
조혈모세포는 혈액 내 세포 형성, 즉 조혈에 필수적이며, 모든 혈액 세포 유형을 재생산할 수 있는 다능성과 자기 재생 능력을 가지고 있다. 소수의 조혈모세포는 증식하여 매우 많은 수의 딸 조혈모세포를 생성할 수 있는데, 이러한 현상은 골수 이식에 사용된다.[12]
조혈모세포는 골수 관문을 통과하여 한 뼈의 골수에서 다른 뼈로 혈액 속을 이동할 수 있다. 흉선에 정착하면 T세포로 발전할 수 있으며, 태아의 경우 간이나 비장에 안착해 발육하기도 한다.
노화 과정에서 DNA 손상은 장기적으로 조혈모세포에 축적된다.[60] 이는 조혈모세포의 휴지 상태에 따라 달라지는 DNA 수리 및 반응 경로의 광범위한 약화와 관련이 있다.[60] DNA 이중 가닥 절단을 복구하는 경로인 비상동 말단 연결(NHEJ)이 이러한 손상 복구에 중요한 역할을 한다.
3. 1. 조혈 작용
조혈작용은 혈액 속의 혈구(血球)가 만들어지는 과정으로, 혈액 내의 다양한 세포를 만들어내며 대부분 뼈의 중심에 있는 적색 골수에서 일어난다. 체내에서는 조혈작용을 통하여 매일 5000억 개 이상의 혈액세포가 생성되며, 각 종류의 세포 수는 혈액 내에서 비교적 정교하게 조절되어 균형이 유지되고 있다. 이는 해당 세포의 수적 증가를 초래하는 증식(proliferation)과 성숙하여 다음 단계의 세포로 진행하는 분화(differentiation)의 균형을 의미하며, 이러한 균형이 깨지게 되면 조혈모세포로부터 혈액 세포로의 조혈 과정에서 정상적인 증식과 분화에 이상이 발생하여 분화가 정지되고 비정상적인 증식이 진행된다.
조혈모세포는 혈액 내 세포 형성, 즉 조혈에 필수적이다. 조혈모세포는 모든 혈액 세포 유형을 재생산할 수 있으며(즉, 다능성을 가짐) 자기 재생을 한다. 소수의 조혈모세포는 증식하여 매우 많은 수의 딸 조혈모세포를 생성할 수 있는데, 이러한 현상은 골수 이식에 사용된다.[12] 골수 이식 시 소수의 조혈모세포가 조혈계를 재구성한다. 이 과정은 골수 이식 후 두 개의 딸 조혈모세포로의 대칭적 세포 분열이 발생해야 함을 나타낸다.
줄기 세포 자기 재생은 골수 내 줄기 세포 틈새에서 발생하는 것으로 생각되며, 이 틈새에 존재하는 주요 신호가 자기 재생에 중요할 것으로 추정된다.[2] HSC(조혈모줄기세포)의 자기 재생에 대한 환경적, 분자적 요구 사항에 대한 관심이 높으며, HSC의 자가 재생 능력을 이해하면 궁극적으로 치료 목적으로 사용될 수 있는 ''시험관 내''에서 HSC의 확장된 집단을 생성할 수 있을 것이다.
지센 학설은 조혈은 소화 기관, 특히 소장에서 이루어진다고 주장하지만, 이 설은 과학적, 의학적으로 인정되지 않는다.
3. 2. 정지
조혈모세포는 모든 성체줄기세포와 마찬가지로 대부분 정지 상태, 즉 가역적 성장 억제 상태에서 존재한다. 진행이 중단되어 변화된 조혈모세포의 신진대사는 세포가 혈중 산소가 감소된 골수 환경에서 장기간 생존하도록 돕는다.[58] 세포 사멸이나 손상에 의해 자극되면 조혈모세포는 정지를 벗어나 다시 활발하게 분열하기 시작한다. 정지 상태에서 분열 상태로의 전환은 MEK/ERK 경로 및 PI3K/AKT/mTOR 경로에 의해 규제된다.[59] 이러한 전이의 조절이 잘못되면 줄기세포가 다 쓰여져버리거나 혈액 체계의 활성화된 조혈모세포를 점차적으로 잃을 수 있다.[59]
3. 3. 이동성
조혈모세포는 다른 미성숙 혈구보다 골수 관문을 통과할 가능성이 높아 한 뼈의 골수에서 다른 뼈로 혈액 속을 이동하기도 한다. 만약 조혈모세포가 흉선에 정착한다면, T세포로 발전할 수도 있다. 태아 등의 경우 조혈모세포는 간이나 비장에 안착해 발육할 수도 있다. 이러한 특성으로 혈액에서 직접 조혈모세포를 채취할 수 있다.
3. 4. 노화에 따른 DNA 손상
노화 과정에서 DNA 손상은 장기적으로 조혈모세포에 축적된다.[60] 이러한 축적은 조혈모세포의 휴지 상태에 따라 달라지는 DNA 수리 및 반응 경로의 광범위한 약화와 관련이 있다.[60] 비상동 말단 연결(NHEJ)은 DNA 이중 가닥 절단을 복구하는 경로로, 리가제 4, DNA 중합효소 μ 및 NHEJ 인자 1 (NHEJ1, Cernunnos 또는 XLF)을 포함한 여러 단백질에 의존한다.
Lig4, DNA 중합효소 μ 및 NHEJ1 결핍에 대한 조혈모세포의 민감도는 NHEJ가 시간이 지남에 따라 생리적 스트레스로부터 줄기세포를 유지하는 능력의 핵심 요소임을 시사한다.[65]
Rossi 등[66]의 연구에 따르면, 야생형 조혈모세포에서도 내인성 DNA 손상이 나이가 들면서 축적되며, 이는 DNA 손상이 줄기세포 노화의 중요한 생리적 메커니즘일 수 있음을 보여준다.
4. 임상적 중요성
조혈모세포 이식(HSCT)은 골수, 말초혈액, 제대혈 등에 존재하는 조혈모세포를 이식하는 것이다.[67] 다발성 골수종, 백혈병 등 혈액 또는 골수 암 환자에게 주로 시행되며,[16] 이식 전 방사선이나 화학 요법으로 환자의 면역 체계를 파괴한다. 동종 이식의 주요 합병증으로는 감염과 이식편대숙주병이 있다.[16]
조혈모세포 이식은 생명을 위협하는 질환자에게 사용되지만, 생존율 증가에 따라 자가면역 질환[19][20], 유전성 골격 이형성증[21][22], 점액다당증[23] 등에도 사용이 확대되고 있다. 비조혈 조직 재생을 위한 임상 시험도 진행 중이다.[24]
70세 전후로 조혈모세포의 클론 다양성이 급격히 감소한다. 이는 수십 년 전 발생한 돌연변이로 인해 소수의 클론이 빠르게 성장하여 조혈모세포의 상당 부분을 차지하기 때문이다.[32][33] 이는 새로운 노화 이론을 뒷받침하며, 건강한 노화를 가능하게 할 수 있다.[32][33]
4. 1. 조혈모세포 이식
조혈모세포 이식(HSCT)은 골수, 말초혈액, 제대혈에 존재하는 조혈모세포를 이식하는 것을 의미한다.[67] 자가 조혈모세포 이식(환자 자신의 줄기 세포 사용), 동종 이식(공여자의 줄기 세포 사용), 동계 이식(일란성 쌍둥이의 줄기 세포 사용)이 있다.[15][16]
주로 다발성 골수종, 백혈병 등 혈액 또는 골수 암 환자에게 시행된다.[16] 이식 전 방사선 또는 화학 요법으로 환자의 면역 체계를 파괴하며, 감염과 이식편대숙주병이 동종 이식의 주요 합병증이다.[16] 초기에는 조직적합성항원이 일치하는 형제간에만 시행되었으나, 현재는 비혈연간 이식이나 HLA 불일치 상황에서도 활발히 이루어진다.
신경모세포종, 소세포폐암, 유방암, 난소암, 고환종양 등은 강력한 화학요법으로 치료하는데, 이때 골수 억제 부작용이 발생하므로 조혈모세포 이식을 실시한다. 조혈모세포 이식은 백혈병, 악성림프종 등 혈액종양, 재생불량성빈혈, 선천성 대사이상, 선천적 면역결핍, 불응성 자가면역질환, 고형암 등 다양한 질환에 효과적인 치료 수단이다.
조혈모세포 이식은 합병증 위험이 있는 시술이므로, 생명을 위협하는 질환을 가진 환자에게 사용된다. 생존율 증가에 따라 자가면역 질환[19][20], 유전성 골격 이형성증(특히 악성 영아 골연화증[21][22], 점액다당증[23]) 등으로 사용이 확대되고 있다.
HSC는 비조혈 조직 재생에도 사용하기 위해 임상 시험 중이다.[24]
4. 1. 1. 역사
1951년 Jacobson과 Lorenz는 쥐를 이용한 실험에서 방사선 조사 후 비장세포 또는 골수세포를 투여하면 회복된다는 것을 증명하였다.[68] 1957년 Thomas는 백혈병 환자에게 사람의 골수 세포를 처음 투여하였고, 1958년 Mathe 등은 유고슬라비아 원자로 사고 피해자에게 골수 세포를 투여하였다.[68]Gatti 등은 면역부전환자에게 HLA를 고려하여 형제간 이식을 시행하여 생착을 얻었으며, 가벼운 이식편대숙주반응(GVHD)이 있었다고 보고하였다.[68] 1968년 Bach 등은 cyclophosphamide영어 (CY) 200 mg/kg를 전처치로 사용하여 HLA 일치 형제간 이식으로 생착을 유도하여 HLA 적합성의 중요성을 보여주었다.[68]
1971년 Santos 등은 CY를 활용하여 백혈병 환자에게 동종골수이식(Allogeneic BMT)을 시행하였고, busulfan영어과 CY를 병용 투여하여 현재 임상에서 활용되는 조혈모세포이식을 위한 전처치의 기본 틀을 만들었다. 1972년 Thomas 등은 10 Gy의 전신방사선조사를 전처치로 활용하여 재생불량성빈혈 환자에게 동종골수이식을 실시하였다.[68] 일본에서는 나고야 그룹이 1974년 재생불량성빈혈 환자에게 CY 200 mg/kg로 전처치한 후 HLA 일치 형제간 이식을 실시하였다.[68]
국내에서는 1983년 급성림프구성백혈병 환자를 대상으로 처음으로 동종골수이식을 성공시켰다.
1980년경 How 등은 다른 고형 장기 이식에 사용되던 면역억제제인 싸이클로스포린(cyclosporin영어)을 도입하면서 이식편대숙주반응 억제가 가능해졌고, 메토트렉세이트(methotrexate영어)와 병용 투여하면서 효과적인 이식편대숙주반응 예방이 가능해졌다.[68]
4. 1. 2. 이식 과정
조혈모세포 이식은 골수이식, 말초혈액(PB)과 제대혈(CB)에 존재하는 모든 형태의 조혈모세포를 이식원으로 활용하여 이식하는 것을 의미한다.[67]공여자의 적혈구, 백혈구, 혈소판은 다시 공여자의 혈액 속으로 돌아가고 조혈모세포만 채취한다. 골수이식 치료를 위해서는 주조직적합성 항원인 HLA (Human leukocyte antigen)가 공여자와 수용자 간에 일치해야 한다. HLA가 최대한으로 일치하는 동종 이형 HSC를 이용하여 이식하며, 이식 전후에 면역억제제를 투여하여 면역거부반응을 억제함으로써 골수이식 치료가 이루어진다. 조혈모세포이식은 초기에는 조직적합성항원이 일치하는 형제간에만 시행되었지만, 이식 면역학의 발전으로 현재는 비혈연간 이식 혹은 HLA 불일치 상황에서도 이식이 활발하게 이루어지고 있다. 환자 자신의 말초혈액 조혈모세포(PBSC)를 이용한 자가조혈모세포 이식도 환자의 질환에 따라 표준화된 진료 방법이다.
4. 1. 3. 이식 종류
조혈모세포 이식(HSCT)은 골수이식(BMT), 말초 혈액(PB), 제대혈(CB) 등 모든 형태의 조혈모세포를 이식하는 것을 의미한다.[67] 공여자의 적혈구, 백혈구, 혈소판은 다시 공여자의 혈액 속으로 돌아가고 조혈모세포만 채취한다.조혈모세포 이식은 초기에는 조직적합성항원(HLA)이 일치하는 형제간에만 시행되었지만, 이식 면역학의 발전으로 현재는 비혈연간 이식 혹은 HLA 불일치 상황에서도 이식이 활발하게 이루어지고 있다. 환자 자신의 말초혈액 조혈모세포(PBSC)를 이용한 자가조혈모세포 이식도 환자의 질환에 따라 표준화된 진료 방법이다.
말초 혈액 조혈모세포 이식(PBSCT)은 자가(autologous) 또는 동종(allogeneic)의 두 종류가 있으며, 혈액종양과 고형암 치료에 있어 고용량 화학요법 후 조혈기능의 빠른 회복을 위해 시행된다. 말초 혈액 조혈모세포는 성장촉진인자(G-CSF)를 피하 주사하여 골수를 자극, 말초혈액 내 조혈모세포 양을 증가시킨 후 헌혈과 유사한 혈액분반술(apheresis)을 통해 채집한다. 이는 골수에 비해 채취가 용이하고 이식 후 조혈기능 회복이 빠르다는 장점이 있다. 또한 골수를 침범하지 않는 고형암의 경우에는 종양세포 오염이 적다.[69]
4. 2. 노화와 클론 다양성 감소
70세 즈음에 조혈모세포의 클론 다양성이 급격히 감소한다. 이는 수십 년 전에 발생한 돌연변이로 인해 더욱 빠르게 성장하게 된 소수의 클론이 조혈모세포의 30~60%를 차지하게 되면서 나타나는 현상이다. 이는 새로운 노화 이론을 뒷받침하며, 건강한 노화를 가능하게 할 수 있다.[32][33] 노화 과정에서의 클론 다양성 변화는 2008년 캘리포니아 샌디에고의 크리스타 뮐러-시버그 연구실에서 마우스 시스템에 대해 처음 보고되었다.[34]5. 연구
조혈모세포 연구는 이식을 위한 조혈모세포의 제한된 가용성 때문에, 다양한 유전적 골수 장애 및 빈혈 치료를 위한 조혈모세포 확장 및 유전자 편집 기술 개발의 필요성으로 이어진다. 초기 연구에서는 사이토카인과 성장인자를 사용하여 조혈모세포 확장을 시도했다. 그러나 시험관 내(in vitro) 실험 중 조혈모세포가 다른 혈통으로 자발적으로 분화되는 문제가 발생했다.
최근 연구는 유전자 편집 연구에 따른 조혈모세포의 단일 세포 확장뿐만 아니라, 시험관 내 조혈모세포 확장 시 세포 주기 진행 및 차단 억제 신호 메커니즘을 향상시킬 수 있는 작은 분자를 찾고, RNA 간섭 기술을 개발하는 방향으로 진행되고 있다.
5. 1. 연구 방법
조혈모세포는 순수 집단으로 분리될 수 없기 때문에 현미경으로 확인할 수 없다. 여러 개의 서로 다른 세포 표면 표지의 조합을 사용하여 희귀한 조혈모세포를 주변 혈액세포로부터 분리하는 유량측정분석으로 확인되거나 분리될 수 있다.[53][54][55][56] 또한 로다민 123이나 Hoechst 33342와 같은 필수적인 염색 dye로 크기가 작고 얼룩이 적은 것으로 특징 지어진다. 사람 조혈모세포의 대표적인 마커는 CD34이다. 화학요법이나 질병의 결과로 혈액 생성에 문제가 있는 환자의 혈액 체계를 복구하기 위해 필요한 조혈모세포를 분리하는 데에 CD34 marker가 활용된다.Mouse의 경우는 대략 10,000 내지 15,000 개의 골수 세포 당 1개의 HSC가 포함되어 있는 것으로 추정되고, 말초 혈액 내에는 약 십만 개의 세포당 1개의 세포가 포함되어 있는 것으로 추정된다. HSC에 대한 판단 기준은 자체의 혈액을 생성하는 조혈모세포와 혈액 세포를 충분한 양의 방사선 조사로 모두 제거한 Mouse에서 세포가 주입되었을 때 모든 종류의 혈액을 다시 생산해 낼 수 있는 능력을 지녔는지 여부이다.[57]
[현재 활용되고 있는 HSC를 포함하는 세포 군의 주요 표면 마커]
조혈모세포(HSCs)는 성인의 골수에 들어 있는 희귀 세포로 모든 종류의 차별화된 혈구를 평생 동안 유지한다. 이식을 위해서 사용할 수 있는 조혈모세포가 제한되어 있기 때문에, 다양한 유전적인 골수 장애와 빈혈을 치료하기 위해서는 조혈모세포 확장 및 유전자 편집 기술의 개발이 필요하다. 이를 위해 조혈모세포 확장을 위한 사이토카인 및 성장인자의 사용에 대한 다양한 연구가 다루어졌다. 이러한 연구의 주요 문제는 생체외 시술 중 조혈모세포가 다른 혈통으로 저절로 분화가 일어난다는 점이 밝혀졌다. 따라서, 연구는 유전자 편집 연구에 따른 HSC의 단일 세포 확장뿐만 아니라 생체 외 조혈모세포 확장 시 세포 주기 진행 및 차단 억제 신호 메커니즘을 향상시키기 위해 잠재력을 가진 작은 분자의 식별과 RNA 간섭 기술의 개발로 나아간다.
조혈모세포 연구 방법으로는 Flow Cytometric Analysis, Colony Forming Cell Assays, Co-culture Assays 등이 있다. 미성숙 조혈모세포의 식별 및 정량화를 위한 여러 가지 체외 분석 방법이 개발되었다.
- Flow Cytometric Analysis
가장 빠른 방법인 유량 측량 분석(Flow Cytometric Analysis)은 조혈모세포를 전진적으로 식별하고 분리할 수 있는 유일한 방법이지만, 기능적 데이터를 제공하지 않는 방법이다. 그러나 그것은 repopulating ability와 강하게 상관되어 왔으므로 널리 받아들여지고 있다.
- Colony Forming Cell Assays
Colony Forming Cell Assay(CFC)는 성체 골수, 말초혈액, 탯줄혈액에 소수로 존재하는 조혈모세포 유전자를 식별하는 두 번째 빠른 방법을 나타내는 시험관 내 기능 검사다. 적절한 성장인자로 보충되는 반고체의 메틸셀룰로스 기반의 배양배지에 세포 배양한 경우 조혈모세포가 증식하고 분화하여 성숙 세포의 세포군체를 만들어낸다. 세포군체를 형성할 수 있는 능력에는 분화 능력뿐만 아니라 일부 제한된 자가증식 기능이 모두 필요하기 때문에 이러한 기능분석은 제한된 기능분석을 제공한다. CFC방법은 세포군체를 형성하는 능력에 의한 조혈모세포의 증식 및 분화 패턴을 연구하는데 사용된다. 세포를 전체 혹은 개별 세포군체로부터 채취하여 유량 측량 분석방법이나 김자염색(메틸렌블루와 에오신이 화합된 복합체로 말초에 있는 혈액세포나 골수세포의 염색에 주로 이용됨)을 통한 형태학적 분석으로 세포의 수와 분화 상태를 평가할 수 있다.[70] CFC 검사는 기초 혈액학 연구에 중요한 기술이지만 또한 세포이식에 사용되는 성체 골수, 탯줄혈액, 말초혈액의 전구 세포 함량을 측정하기 위해 임상 세포 실험실에서 사용되었다. 사람 전구체 세포에 대한 표준 CFC 검사에는 세포 준비에서 최대 CFC수의 최적 성장과 분화가 가능하도록 최소 14일의 배양기간이 필요하다. CFC 검사는 골수성 분화를 평가하는데 유용하지만 림프성 분화에서는 유용하지 않다. 이러한 의미에서 골수체라는 용어는 과립백혈구, 단핵백혈구, 적혈구, 거핵구 혈통을 포함한다. CFC 검사는 말초혈액에서 파생된 사람 CD34+세포의 분화에 대한 유전자의 영향을 평가하기 위해 사용해왔다.이러한 경우 NUP98-HOXA9의 경우 RNA종양바이러스의 구조를 조절하거나 종양 형성 유전자를 나타내는 구조로 변환된다.[71]
- Co-culture Assays
훨씬 더 많은 시간을 소요하는 실험 방법인, cobblestone area-forming cells (CAFC) 및 long-term culture initiating cells (LTC-IC)는 체외에서 기능적으로 검사할 수 있는 가장 초기의 조혈 세포 집단을 나타내기 위해 사용된다. 이 두 검사 모두 CFC 검사보다 더 광범위한 자가증식 능력이 필요하다.
조혈모세포는 순수한 상태로 분리될 수 없기 때문에 현미경으로 식별하는 것이 불가능하다. 조혈모세포는 여러 가지 세포 표면 마커(특히 CD34)의 조합을 사용하여 주변 혈액 세포로부터 희귀한 조혈모세포를 분리하는 유세포 분석을 통해 식별하거나 분리할 수 있다. 조혈모세포는 성숙한 혈액 세포 마커를 발현하지 않으므로 Lin-라고 불린다. 계통 마커의 발현 부족은 여러 양성 세포 표면 마커의 검출과 함께 조혈모세포를 분리하는 데 사용된다. 또한 조혈모세포는 작은 크기와 로다민 123 (로다민 lo) 또는 Hoechst 33342 (측면 집단)과 같은 생체 염료에 대한 낮은 염색성을 특징으로 한다.
''조약돌 영역 형성 세포(CAFC)'' 분석은 세포 배양 기반의 경험적 분석이다. 기질 피더층의 밀집된 배양에 접종하면,[35] 조혈모세포의 일부가 틈새 사이를 기어 들어가 (기질 세포가 서로 닿아 있음에도 불구하고) 결국 기질 세포와 기질(여기서는 접시 표면) 사이에 자리 잡거나 기질 세포 사이의 세포 과정에 갇히게 된다. 엠페리폴레시스는 한 세포가 다른 세포 안으로 완전히 삼켜지는 ''생체 내'' 현상(예: 흉선 세포가 흉선 간호 세포로 들어가는 것)이다. 반면, ''시험관 내''에서 림프구 계열 세포가 간호 세포 유사 세포 아래로 기어 들어가는 과정은 가성 엠페리폴레시스라고 불린다. 이와 유사한 현상은 HSC 분야에서 세포 배양 용어인 ''조약돌 영역 형성 세포(CAFC)''로 더 일반적으로 알려져 있으며, 이는 위상차 현미경으로 볼 때 세포의 영역 또는 클러스터가 다른 조혈모세포와 비교하여 둔한 조약돌 모양을 나타낸다는 것을 의미한다. 이는 기질 세포 위에 느슨하게 떠 있는 세포는 구형이어서 굴절성이 있기 때문에 발생한다. 그러나 기질 세포 아래로 기어 들어가는 세포는 평평해져서 굴절성이 없다. 가성 엠페리폴레시스의 메커니즘은 최근에야 밝혀지고 있다. 이는 CXC 케모카인(예: SDF1)의 수용체인 CXCR4 (CD184)와 α4β1 인테그린과의 상호 작용을 통해 매개될 수 있다.[36]
5. 2. 계통 편향
조혈모세포(HSC)는 직접 관찰이 어려워 간접적인 추론을 통해 연구한다. 클론 연구는 HSC의 단일 세포 생체 내 연구에 가까운 기술로, 치사량의 방사선에 노출된 숙주에게 단일 HSC가 포함된 이식편을 투여하고, 혈액 내 공여체형 세포 비율을 모니터링하여 HSC의 재구축 동역학을 관찰한다.재구축 동역학은 매우 이질적이지만, 기호 역학을 사용하면 제한된 수의 클래스로 나뉜다는 것을 알 수 있다.[37] 클론 Thy-1lo SCA-1+ lin−(B220, CD4, CD8, Gr-1, Mac-1 및 Ter-119)[38] c-kit+ HSC에서 얻은 수백 개의 실험적 재구축 동역학을 기호 시퀀스로 변환하고, 해밍 거리를 이용한 클러스터 분석을 통해 16개의 뚜렷한 동역학 그룹을 얻었다. 라플라스 가산 접근법을 사용하여 이 16개 그룹에 포함되지 않은 동역학을 찾을 확률이 매우 작다는 것을 확인했다. 이는 조혈모세포 구획이 동적 기준에 의해 이질적임을 보여준다.
원래 모든 조혈모세포는 자기 재생 및 분화 능력에서 유사하다고 여겨졌으나, 2002년 뮐러-지버그 연구진은 서로 다른 줄기 세포가 뚜렷한 재구축 패턴을 보일 수 있음을 발견했다.[39][40][41] 이는 클론 Thy-1lo Sca-1+ lin− c-kit+ HSC의 후생유전학적으로 미리 결정된 고유 특성으로, '''계통 편향''' 개념으로 이어졌다.
혈액 내 림프구(L) 대 골수구(M) 세포의 비율()을 기준으로, 조혈모세포는 세 가지 범주로 나뉜다.
- '''균형 잡힌 (Bala) 조혈모세포''': 조작되지 않은 생쥐와 동일한 비율의 골수구 대 림프구 세포(평균 15% 골수구, 85% 림프구, 3 ≤ ρ ≤ 10)로 말초 백혈구를 재구축한다.
- '''골수구 편향 (My-bi) 조혈모세포''': 매우 적은 수의 림프구를 생성하며, 0 < ρ < 3의 비율을 보인다.
- '''림프구 편향 (Ly-bi) 조혈모세포''': 매우 적은 수의 골수구 세포를 생성하며, ρ > 10의 비율을 보인다.
세 가지 유형 모두 정상적인 HSC이며, 분화 단계를 나타내는 것이 아니라 후생유전학적으로 고정된 분화 프로그램을 가진 세 가지 클래스의 HSC이다. 계통 편향은 확률적으로 조절되거나 환경적 영향에 의존하지 않는다. My-bi HSC는 균형 잡힌 또는 Ly-bi HSC보다 더 오래 자기 재생하며, 골수구 편향은 림프구 생성인자 인터루킨 7 (IL-7)에 대한 반응 감소의 결과이다.[40]
이후 다른 연구 그룹들도 이러한 발견을 확인하고 강조했다.[42] 2007년 이브스(Eaves) 연구진은 재구축 동역학, 장기적 자기 재생 능력, My-bi와 Ly-bi가 안정적으로 유전되는 고유한 HSC 특성임을 확인했다.[43] 2010년 굿델(Goodell) 연구진은 사이드 포퓰레이션 (SP) SCA-1+ lin− c-kit+ HSC에서 계통 편향의 분자적 기초에 대한 추가적인 통찰력을 제공했다.[44] 변형 성장 인자 (TGF-beta) 계열의 구성원이 My-bi 및 Ly-bi HSC의 증식을 각각 유도하고 억제하는 것으로 밝혀졌다.
6. 기타
'조혈모세포'의 '조혈'은 '피'를 의미하는 그리스어 'haima'의 결합 형태인 'haimato-'에서 유래했다. '만드는 능력이 있는, 창조적인, 생산적인'을 의미하는 그리스어 'poietikos'의 라틴어화 형태에서 유래했으며, 'poiein'(만들다, 창조하다)에서 파생되었다.[45]
6. 1. 지센 학설 (한국의 관점에서 비판적으로 서술)
지센 학설은 조혈이 소화 기관, 특히 소장에서 이루어진다고 주장한다. 그러나 이 설은 과학적, 의학적으로 인정되지 않는다.참조
[1]
논문
Revisiting hematopoiesis: applications of the bulk and single-cell transcriptomics dissecting transcriptional heterogeneity in hematopoietic stem cells
2022-03
[2]
논문
Niche heterogeneity in the bone marrow
2016-04
[3]
논문
Blood Development: Hematopoietic Stem Cell Dependence and Independence
2018-05
[4]
논문
Endothelial-to-haematopoietic transition: an update on the process of making blood
2019-04
[5]
논문
A direct measurement of the radiation sensitivity of normal mouse bone marrow cells
1961-02
[6]
웹사이트
5. Hematopoietic Stem Cells.
http://stemcells.nih[...]
National Institutes of Health, U.S. Department of Health and Human Services
2011-06-17
[7]
논문
Hematopoietic Stem Cells in Regenerative Medicine: Astray or on the Path?
2016-07
[8]
논문
Definitive hematopoietic stem cells first develop within the major arterial regions of the mouse embryo
2000-06
[9]
논문
Definitive hematopoiesis is autonomously initiated by the AGM region
http://repub.eur.nl/[...]
1996-09
[10]
논문
Highly potent human hematopoietic stem cells first emerge in the intraembryonic aorta-gonad-mesonephros region
2011-11
[11]
웹사이트
Bone Marrow Transplant Process
http://www.mayoclini[...]
2015-03-18
[12]
논문
Stem Cells Applications in Regenerative Medicine and Disease Therapeutics
2016
[13]
논문
Anaerobic Glycolysis and HIF1α Expression in Haematopoietic Stem Cells Explains Its Quiescence Nature
2015
[14]
논문
An ERK-Dependent Feedback Mechanism Prevents Hematopoietic Stem Cell Exhaustion
2018-06
[15]
논문
Hematopoietic stem cells: potential new applications for translational medicine
2014
[16]
논문
Hematopoietic stem cell expansion and generation: the ways to make a breakthrough
2015-12
[17]
웹사이트
5. Hematopoietic Stem Cells – stemcells.nih.gov
https://stemcells.ni[...]
2018-01-18
[18]
논문
Of lineage and legacy: the development of mammalian hematopoietic stem cells
2008-02
[19]
논문
Autologous haematopoietic stem cell transplants for autoimmune disease--feasibility and transplant-related mortality. Autoimmune Disease and Lymphoma Working Parties of the European Group for Blood and Marrow Transplantation, the European League Against Rheumatism and the International Stem Cell Project for Autoimmune Disease
1999-10
[20]
논문
Clinical applications of blood-derived and marrow-derived stem cells for nonmalignant diseases
2008-02
[21]
논문
Reversal of skeletal radiographic pathology in a case of malignant infantile osteopetrosis following hematopoietic stem cell transplantation
2017-03
[22]
논문
Radiologic resolution of malignant infantile osteopetrosis skeletal changes following hematopoietic stem cell transplantation
2015-09
[23]
논문
Progression of Hip Dysplasia in Mucopolysaccharidosis Type I Hurler After Successful Hematopoietic Stem Cell Transplantation
2016-03
[24]
논문
Hematopoietic Stem Cells in Regenerative Medicine: Astray or on the Path?
https://doi.org/10.1[...]
2016-07-26
[25]
논문
Quiescent hematopoietic stem cells accumulate DNA damage during aging that is repaired upon entry into cell cycle
2014-07
[26]
논문
DNA repair is limiting for haematopoietic stem cells during ageing
2007-06
[27]
논문
A human iPSC model of Ligase IV deficiency reveals an important role for NHEJ-mediated-DSB repair in the survival and genomic stability of induced pluripotent stem cells and emerging haematopoietic progenitors
2013-08
[28]
논문
Altered hematopoiesis in mice lacking DNA polymerase mu is due to inefficient double-strand break repair
2009-02
[29]
논문
Hematopoietic stem cell dysfunction underlies the progressive lymphocytopenia in XLF/Cernunnos deficiency
2014-09
[30]
논문
Brief report: a human induced pluripotent stem cell model of cernunnos deficiency reveals an important role for XLF in the survival of the primitive hematopoietic progenitors
2013-09
[31]
논문
Deficiencies in DNA damage repair limit the function of haematopoietic stem cells with age
2007-06
[32]
뉴스
Research may reveal why people can suddenly become frail in their 70s
https://www.theguard[...]
The Guardian
2022-07-18
[33]
논문
Clonal dynamics of haematopoiesis across the human lifespan
2022-06
[34]
논문
A new mechanism for the aging of hematopoietic stem cells: aging changes the clonal composition of the stem cell compartment but not individual stem cells
https://ashpublicati[...]
2008
[35]
논문
Feeder Layer Cell Actions and Applications
2015
[36]
논문
CXCR4 chemokine receptors (CD184) and alpha4beta1 integrins mediate spontaneous migration of human CD34+ progenitors and acute myeloid leukaemia cells beneath marrow stromal cells (pseudoemperipolesis)
2003-08
[37]
논문
Classification of short kinetics by shape
[38]
논문
Mouse hematopoietic stem cell identification and analysis
2009-01
[39]
논문
Deterministic regulation of hematopoietic stem cell self-renewal and differentiation
2002-08
[40]
논문
Myeloid-biased hematopoietic stem cells have extensive self-renewal capacity but generate diminished lymphoid progeny with impaired IL-7 responsiveness
2004-06
[41]
논문
The hematopoietic stem compartment consists of a limited number of discrete stem cell subsets
2006-03
[42]
논문
Hematopoietic stem cell heterogeneity: subtypes, not unpredictable behavior
2010-03
[43]
논문
Long-term propagation of distinct hematopoietic differentiation programs in vivo
2007-08
[44]
논문
Distinct hematopoietic stem cell subtypes are differentially regulated by TGF-beta1
2010-03
[45]
서적
Random House Unabridged Dictionary
Random House
1993
[46]
웹사이트
옛 대한의협 2 의학용어 사전
https://www.kmle.co.[...]
[47]
웹사이트
대한의협 의학용어 사전, 대한해부학회 의학용어 사전
https://www.kmle.co.[...]
[48]
논문
Regulation of hematopoietic stem cell self-renewal
[49]
문서
"[건강백과] 서울대학교 병원 신체기관일정보"
[50]
웹사이트
"Cord Blood 2.0: Umbilical Cord Stem Cell Banking - Americord"
cordadvantage.com
[51]
논문
"Niche heterogeneity in the bone marrow"
2016-03-01
[52]
논문
"Where Hematopoietic Stem Cells Live: The Bone Marrow Niche"
2018-07-10
[53]
논문
"Antigenic analysis of haematopoiesis:III. hematopoietic cell surface antigen defined by a monoclonal antibody raised against KG-1a cells"
1984
[54]
논문
"A novel monoclonal antibody BI-3C5 recognises myeloblasts and non-B non-T lymphoblasts in acute leukaemias and CGL blast crises, and reacts with immature cells in normal bone marrow"
1985
[55]
논문
"BI-3C5 (CD34) defines multipotential and lineage restricted progenitor cells and their leukaemic counterparts"
1987
[56]
논문
"Characterization of myeloid antigens on human bone marrow using multicolour immunofluorescence"
1987
[57]
웹사이트
"[네이버 지식백과] 조혈모세포[Hematopoietic stem cell] (분자·세포생물학백과)"
[58]
논문
"Anaerobic Glycolysis and HIF1α Expression in Haematopoietic Stem Cells Explains Its Quiescence Nature"
2015
[59]
논문
"An ERK-Dependent Feedback Mechanism Prevents Hematopoietic Stem Cell Exhaustion"
2018-06
[60]
논문
"Quiescent hematopoietic stem cells accumulate DNA damage during aging that is repaired upon entry into cell cycle"
2014-07
[61]
논문
"A human iPSC model of Ligase IV deficiency reveals an important role for NHEJ-mediated-DSB repair in the survival and genomic stability of induced pluripotent stem cells and emerging haematopoietic progenitors"
2013-08
[62]
논문
"Altered hematopoiesis in mice lacking DNA polymerase mu is due to inefficient double-strand break repair"
2009-02
[63]
논문
"Hematopoietic stem cell dysfunction underlies the progressive lymphocytopenia in XLF/Cernunnos deficiency"
2014-09
[64]
논문
"Brief report: a human induced pluripotent stem cell model of cernunnos deficiency reveals an important role for XLF in the survival of the primitive hematopoietic progenitors"
2013-09
[65]
논문
"DNA repair is limiting for haematopoietic stem cells during ageing"
2007-06
[66]
논문
"Deficiencies in DNA damage repair limit the function of haematopoietic stem cells with age"
2007-06
[67]
논문
"Hematopoietic stem cells: potential new applications for translational medicine"
2014
[68]
웹사이트
"[네이버 지식백과] 조혈모세포이식 [stem cell transplantation] (국가건강정보포털 의학정보, 국가건강정보포털)"
[69]
웹사이트
"[질환백과] 조혈모세포이식[Hematopoietic stem cell transplantation] (서울아산병원 질환백과)"
[70]
논문
"Colony Forming Cell (CFC) Assay for Human Hematopoietic Cells"
2010-12-18
[71]
논문
Colony Forming Cell (CFC) Assay for Human Hematopoietic Cells
2010-12-18
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

