활성인자
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
활성인자는 DNA 결합 도메인과 전사 활성 도메인으로 구성되며, 유전자 전사를 조절하는 단백질이다. 활성인자는 DNA의 특정 염기 서열에 결합하여 RNA 중합효소의 활성화를 통해 유전자 전사를 촉진한다. 활성인자는 알로스테릭 부위, 번역 후 변형, 협동 효과 등 다양한 방식으로 조절되며, 환경적 자극이나 세포 내 신호에 의해 활성화 또는 비활성화될 수 있다. 대장균의 말토스 이화작용과 lac 오페론 조절 등에서 활성인자의 예시를 찾아볼 수 있다.
더 읽어볼만한 페이지
- 전사인자 - 에스트로겐 수용체
에스트로겐 수용체는 세포 내에서 에스트로겐과 결합하여 유전자 발현을 조절하는 단백질로, ERα와 ERβ의 두 가지 주요 아이소폼이 존재하며, 유방암, 폐경, 비만 등 다양한 질병과 관련되어 선택적 에스트로겐 수용체 조절제의 표적이 되고 비유전체적 신호 전달 경로에도 관여한다. - 전사인자 - 핵 수용체
핵 수용체는 동물 특이적인 단백질로서, 친유성 물질과 결합하여 유전자 발현을 조절하고, 모듈형 구조를 가지며, DNA 결합 방식과 리간드 결합 여부에 따라 분류되어 다양한 질병과 관련된 유전자들을 조절하는 약물 표적이 된다. - 유전자 발현 - RNA 간섭
RNA 간섭은 이중가닥 RNA에 의해 유전자 발현이 억제되는 과정으로, 다이서 효소에 의해 생성된 작은 간섭 RNA가 RNA 유도 침묵 복합체와 결합하여 표적 mRNA를 분해하거나 번역을 억제하며, 바이러스 방어, 발생 조절, 유전체 안정성 유지 등 다양한 기능과 응용 분야를 가진다. - 유전자 발현 - 유전자 재조합
유전자 재조합은 유성 생식 생물의 염색체 유전자 교차를 통한 유전자 재배열 현상으로, 유전적 변이를 증가시키고 유전학적 지도 작성에 활용되며, 생명공학 등 다양한 분야에서 기술로 이용된다. - 유전학 - 우생학
우생학은 인간의 유전적 특질 개선을 목표로 19세기 후반 골턴에 의해 체계화되었으며, 긍정적·부정적 방식으로 전개되었으나, 나치 독일의 인종정책과 결부되어 비판받으며 쇠퇴하였지만, 현대 사회에서도 유전자 선별과 관련된 논쟁이 지속되고 있다. - 유전학 - 행동유전학
행동유전학은 행동에 영향을 주는 유전적 요인과 환경적 요인을 연구하는 학문으로, 프랜시스 골턴의 연구에서 시작되었으나 우생학 논란을 겪었으며, 가족 연구, 쌍둥이 연구 등을 통해 발전해 왔지만 사회적 논쟁과 방법론적 한계에 대한 비판도 존재한다.
2. 구조
활성인자는 크게 두 개의 주요 단백질 도메인으로 구성된다. 하나는 활성인자가 특정 DNA 서열에 결합하도록 하는 DNA 결합 도메인이고, 다른 하나는 다른 분자들과 상호작용하여 유전자 전사를 증가시키는 전사 활성 도메인이다.[1][6]
DNA 이중 나선의 홈 안에는 염기쌍의 작용기가 노출되어 있다.[2][7] 이러한 DNA 서열은 가능한 수소 결합, 이온 결합, 그리고 소수성 효과를 통해 고유한 표면 특징 패턴을 만든다.[2][7] 활성 인자 단백질 역시 DNA 내 작용기와 상호 작용할 수 있는 특정 아미노산 배열과 측쇄를 가지고 있다.[2][3][7][8] 활성 인자를 구성하는 아미노산 측쇄의 패턴은 결합하도록 설계된 특정 DNA 조절 서열의 표면 특징과 상보적이며,[1][2][3][6][7][8] 이 상호 작용을 통해 활성 인자와 해당 조절 DNA 서열 사이에 "정확한 적합" 특이성이 생긴다.[2][7]
DNA 결합 도메인은 헬릭스-턴-헬릭스, 아연 핑거, 류신 지퍼 등 다양한 구조를 가질 수 있다.[1][2][3][7][8] 이 도메인은 특정 DNA 서열에 대한 특이성을 가지므로, 활성인자는 특정 유전자만을 선택적으로 활성화할 수 있다.[1][2][3][6][7][8]
전사 활성 도메인은 그 아미노산 서열에 따라 알라닌 풍부 도메인, 글루타민 풍부 도메인, 산성 도메인 등으로 분류된다.[1][6] 이 도메인들은 DNA 결합 도메인에 비해 특이성이 낮으며, 다양한 표적 분자들과 상호작용하여 전사를 촉진하는 경향이 있다.[1][6]
또한, 일부 활성인자는 알로스테릭 부위를 가지고 있기도 하다. 이 부위는 활성인자 자체의 활성을 조절하여 켜고 끄는 역할을 한다.[4][9]
3. 작용 기작
대부분의 활성 인자는 이중 나선에서 더 넓은 주 홈(major groove)에 결합하지만, 일부는 좁은 소 홈(minor groove)에 결합하기도 한다.[1][2][3][6][7][8]
활성 인자가 결합하는 부위는 프로모터 바로 옆에 위치할 수도 있고, 수많은 염기쌍만큼 멀리 떨어져 있을 수도 있다.[2][3][7][8] 조절 서열이 멀리 떨어져 있는 경우, 결합된 활성 인자가 프로모터 부위에 있는 전사 기구와 상호 작용하기 위해 DNA 가닥이 스스로 고리 모양으로 구부러지는 DNA 루핑(DNA looping) 현상이 일어난다.[2][3][7][8]
원핵생물에서는 여러 유전자가 하나의 단위인 오페론으로 묶여 함께 전사되므로, 동일한 조절 서열의 제어를 받는다.[2][7] 반면, 진핵생물에서는 유전자가 개별적으로 전사되는 경향이 있으며, 각 유전자는 자신만의 조절 서열에 의해 제어된다.[2][7] 활성 인자가 결합하는 조절 서열은 일반적으로 프로모터의 상류(upstream)에서 발견되지만, 프로모터 하류(downstream)나, 진핵생물의 경우 인트론 내부에서도 발견될 수 있다.[1][2][3][6][7][8]
3. 1. 전사 증가 기능
활성 인자가 조절 서열에 결합하면 RNA 중합효소 활성화를 통해 유전자 전사를 촉진한다.[1][2][3][4] 이는 전사 기구를 프로모터로 끌어오거나(리크루트), RNA 중합효소가 전사를 계속 진행하도록 유도하는(해제) 등 다양한 메커니즘을 통해 이루어진다.[1][2][3][4]
3. 1. 1. 리크루트
활성인자에 의해 조절되는 유전자들은 전사 기구를 프로모터 영역으로 모집하기 위해 조절 부위에 활성인자가 결합해야 한다.[1][2][3][6][7][8]
활성인자와 RNA 중합효소의 상호작용 방식은 원핵생물과 진핵생물에서 차이를 보인다.[2][7] 원핵생물에서는 활성인자가 프로모터에 결합하는 것을 돕기 위해 RNA 중합효소와 직접 접촉하는 경향이 있다.[2][7] 반면 진핵생물에서는 활성인자가 주로 다른 단백질들과 상호작용하며, 이 단백질들이 RNA 중합효소와 상호작용하는 간접적인 방식으로 이루어진다.[2][7]
3. 1. 2. RNA 중합효소의 해제
활성 인자는 RNA 중합효소가 프로모터를 지나 DNA를 따라 이동하여 전사를 시작하도록 신호를 보내 유전자 전사를 촉진할 수 있다.[2][7] RNA 중합효소는 전사를 시작한 직후 잠시 멈추는 경우가 있는데, 이때 활성 인자는 이러한 "정지된" 상태의 RNA 중합효소를 해제하는 데 필요하다.[1][2][6][7]
이 정지된 RNA 중합효소를 해제하는 데에는 여러 가지 메커니즘이 존재한다.
4. 활성인자의 조절
활성인자의 활성은 다양한 방식으로 조절되는데, 이는 유전자 전사가 필요한 시기와 적절한 수준에서 일어나도록 하기 위함이다.[1] 활성인자의 활성은 주변 환경의 변화나 세포 내부에서 전달되는 신호에 따라 증가하거나 감소할 수 있다.[1][6]
4. 1. 활성인자 단백질의 활성화
활성 인자는 유전자 전사를 촉진하기 전에 활성화되어야 하는 경우가 많다.[2][3][4][7][8][9] 활성 인자의 활성은 DNA의 특정 조절 부위에 결합하는 능력에 따라 조절된다.[2][3][4][7][8][9] 활성 인자에는 DNA 결합 도메인이 있으며, 이 도메인은 활성 형태와 비활성 형태를 가질 수 있다.[4][9] 이러한 상태 변화는 알로스테릭 이펙터라는 분자가 활성 인자의 특정 부위(알로스테릭 부위)에 결합함으로써 제어된다.[4][9]알로스테릭 이펙터가 결합하지 않은 상태의 활성 인자는 비활성 형태이다.[4][9] 이 비활성 상태에서는 활성 인자가 DNA의 특정 조절 서열에 결합할 수 없으므로, 유전자 전사에 영향을 미치지 못한다.[4][9]
반면, 알로스테릭 이펙터가 활성 인자의 알로스테릭 부위에 결합하면, 활성 인자의 DNA 결합 도메인에서 구조적인 변화가 일어난다.[2][4][7][9] 이 구조 변화로 인해 활성 인자는 DNA에 결합할 수 있게 되며, 결과적으로 유전자 전사를 증가시키는 역할을 수행하게 된다.[2][4][7][9]
4. 2. 번역 후 변형
활성 인자 중 일부는 세포 내 활성에 영향을 미치는 번역 후 변형을 겪을 수 있다.[1] 인산화, 아세틸화, 유비퀴틴화와 같은 과정이 활성 인자의 활성을 조절하는 것으로 알려져 있다.[1] 부착되는 화학 그룹과 활성 인자 자체의 특성에 따라, 번역 후 변형은 활성 인자의 활성을 증가시키거나 감소시킬 수 있다.[1] 예를 들어, 아세틸화는 DNA 결합 친화도를 증가시키는 등의 기전을 통해 일부 활성 인자의 활성을 증가시키는 것으로 알려져 있다.[1] 반면에, 유비퀴틴화는 활성 인자가 그 기능을 마친 후 분해되도록 표지하기 때문에 활성 인자의 활성을 감소시킨다.[1]4. 3. 협동 효과 (시너지)
원핵생물에서는 하나의 활성 인자만으로도 전사를 촉진할 수 있다.[2][3][7][8] 그러나 진핵생물에서는 일반적으로 두 개 이상의 활성 인자가 특정 DNA 결합 부위에 모여 복합체를 형성해야 전사를 효과적으로 촉진할 수 있다.[1][2][6][7]이러한 진핵생물의 활성 인자들은 결합 부위에 협동적으로 결합하는 특징을 보인다. 이는 한 활성 인자가 DNA에 결합하면, 그 주변의 다른 활성 인자나 전사 조절 인자가 결합할 부위의 친화력이 높아지는 현상을 의미한다. 결과적으로 여러 활성 인자가 함께 DNA에 더 쉽게 결합하게 된다.[1][2][6][7]
이러한 협동적 결합은 활성 인자들 사이에 상승 작용을 일으킨다. 즉, 여러 활성 인자가 함께 작용하여 나타나는 전사 촉진 효과는 각 활성 인자가 개별적으로 작용할 때의 효과를 단순히 합친 것보다 훨씬 크다. 이를 통해 진핵생물은 전사 과정을 더욱 정교하고 효율적으로 조절할 수 있다.[1][2][6][7]
5. 예시
활성인자가 유전자 발현을 조절하는 구체적인 예시는 생물학에서 다양하게 찾아볼 수 있다. 대표적인 예로는 대장균(Escherichia coli)에서의 말토스 대사 조절과 lac 오페론 조절 과정이 있다. 이들 과정에서 활성인자는 특정 신호 분자(예: 말토스, 사이클릭 AMP)의 존재 유무에 따라 구조가 변형되어 DNA의 특정 부위에 결합하거나 분리됨으로써 유전자의 전사를 촉진하거나 억제하는 방식으로 작용한다.
5. 1. 말토스 이화작용 조절
대장균(Escherichia coli)에서 말토스의 분해는 유전자 활성화에 의해 조절된다.[3][8] 말토스의 이화 작용을 담당하는 효소를 암호화하는 유전자는 활성 인자가 존재할 때만 전사될 수 있다.[3][8]말토스 분해 효소의 전사를 조절하는 활성 인자는 말토스가 없을 때는 비활성 상태("오프" 상태)가 된다.[3][8] 이 비활성 상태에서는 활성 인자가 DNA에 결합하여 말토스 유전자의 전사를 촉진할 수 없다.[3][4][8][9]
세포 내에 말토스가 존재하면, 말토스는 활성 인자 단백질의 알로스테릭 부위에 결합하여 DNA 결합 도메인의 구조적 변화(컨포메이션 변화)를 일으킨다.[3][4][8][9] 이러한 구조적 변화는 활성 인자를 활성 상태("온" 상태)로 만들어 특정 조절 DNA 서열에 결합할 수 있게 한다.[3][4][8][9] 활성 인자가 조절 부위에 결합하면 RNA 중합효소가 프로모터에 결합하는 것을 촉진하여 전사가 활발해지고, 결과적으로 세포 내로 들어온 말토스를 분해하는 데 필요한 효소가 생성된다.[3][8]
5. 2. ''lac'' 오페론 조절
카타볼라이트 활성 단백질(CAP, cAMP 수용체 단백질(CRP)이라고도 함)은 박테리아 대장균(Escherichia coli)의 lac 오페론에서 전사를 활성화하는 역할을 한다.[5][10] 포도당이 부족한 기아 상태가 되면 세포 내에서 사이클릭 AMP(cAMP)가 생성된다. 이 cAMP는 CAP에 결합하는 알로스테릭 효과제로 작용하며, CAP 단백질의 구조적 변화(컨포메이션 변화)를 일으킨다. 이 변화를 통해 CAP는 ''lac'' 프로모터 근처의 특정 DNA 부위에 결합할 수 있게 된다.[5][10] DNA에 결합한 CAP는 RNA 중합효소와 직접적인 단백질-단백질 상호작용을 하여, RNA 중합효소를 ''lac'' 프로모터로 끌어오는(리크루트하는) 역할을 수행한다. 결과적으로 이 과정은 ''lac'' 오페론의 전사를 촉진시킨다.[5][10]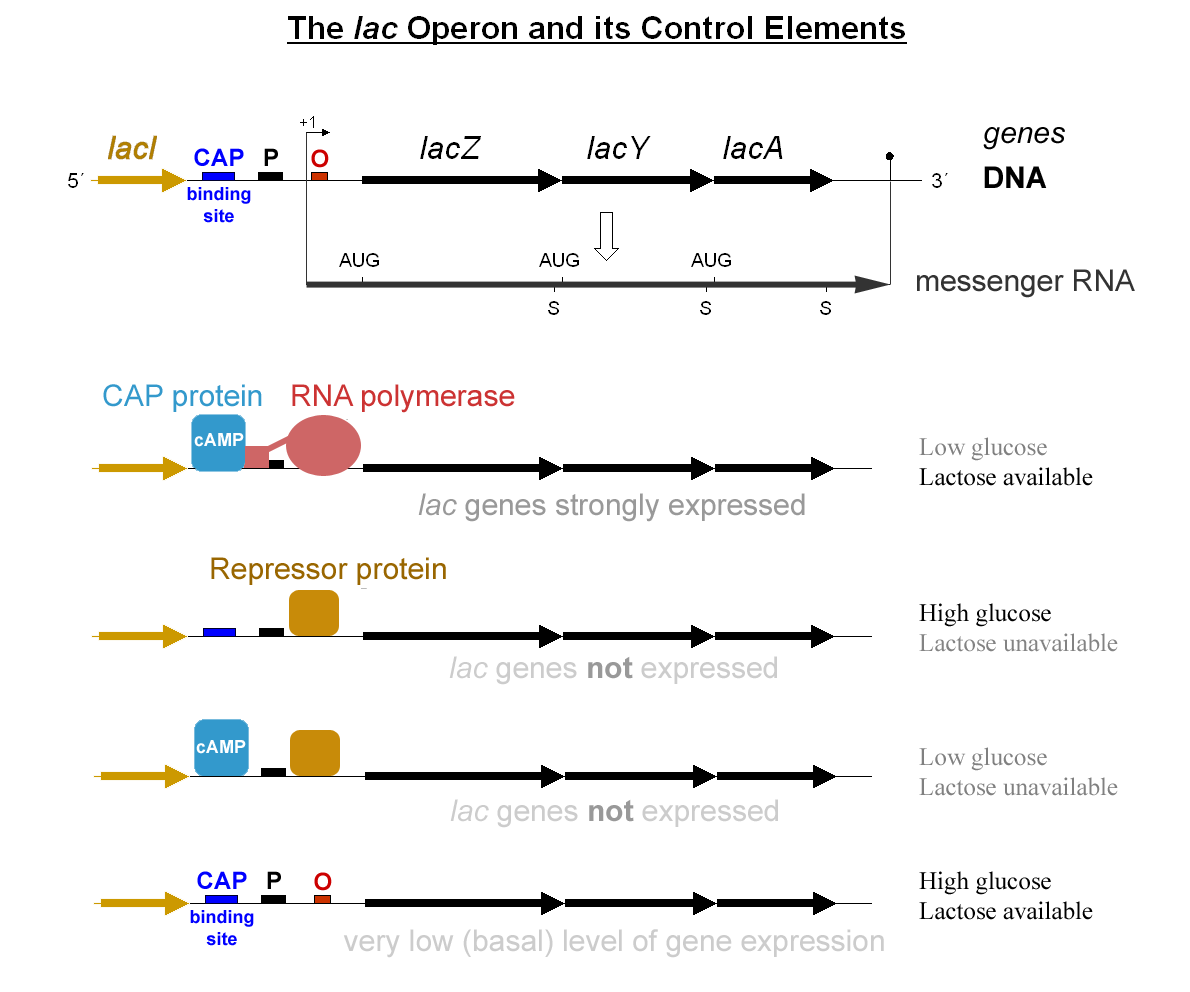
참조
[1]
논문
Transcriptional activators and activation mechanisms
2011
[2]
서적
Molecular Biology of the Cell
https://www.worldcat[...]
Garland Science
[3]
서적
Brock Biology of Microorganisms
https://www.worldcat[...]
Pearson
[4]
논문
The Basics of Prokaryotic Transcriptional Regulation
https://www.ncbi.nlm[...]
1999
[5]
논문
Transcription activation by catabolite activator protein (CAP)
http://www.sciencedi[...]
1999-10-22
[6]
논문
Transcriptional activators and activation mechanisms
https://pubmed.ncbi.[...]
2011
[7]
서적
Molecular Biology of the Cell
https://www.worldcat[...]
Garland Science
[8]
서적
Brock Biology of Microorganisms
https://www.worldcat[...]
Pearson
[9]
논문
The Basics of Prokaryotic Transcriptional Regulation
https://www.ncbi.nlm[...]
1999
[10]
논문
Transcription activation by catabolite activator protein (CAP)
http://www.sciencedi[...]
1999-10-22
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
