나이트로메테인
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
나이트로메테인은 다양한 용도로 사용되는 유기 화합물로, 산업적 생산 및 실험실 제법을 통해 얻을 수 있다. 주요 용도로는 유기 합성, 용매, 연료 첨가제 등이 있으며, 특히 모터스포츠와 모형 엔진 연료로 널리 사용된다. 나이트로메테인은 폭발성이 있으며, 과거 폭발물로 사용된 사례가 있고, 현재도 안전에 유의하여 취급해야 한다.
더 읽어볼만한 페이지
- 나이트로 화합물 - 피크르산
피크르산은 쓴맛을 내는 노란색 결정으로, 다양한 용도로 사용되며 충격과 마찰에 민감하여 안전에 유의해야 하는 페놀류의 일종이다. - 나이트로 화합물 - 트라이나이트로톨루엔
트라이나이트로톨루엔(TNT)은 1863년 요제프 빌브란트가 합성한 폭발성 유기 화합물로, 염료로 사용되다 1901년부터 폭약으로 널리 쓰이며 환경 오염을 유발하고 대한민국에서는 법적 규제를 받는다. - 1개의 탄소 원자를 가진 유기 화합물 - 요소 (화학)
요소는 화학식 CO(NH₂)₂을 가지는 무색무취의 결정성 화합물로, 포유류와 양서류의 소변에 다량 함유되어 있으며, 비료, 목재 패널 제조, 배기가스 저감, 단백질 연구 등 다양한 분야에 사용되고, 1828년 뵐러에 의해 무기물에서 합성된 최초의 유기 화합물이다. - 1개의 탄소 원자를 가진 유기 화합물 - 폼산
자극적인 냄새가 나는 무색 액체인 폼산은 개미 독액에서 처음 발견된 카복실산의 일종으로, 가축 사료 보존제, 항균제 등으로 사용되며 메탄올과 일산화 탄소 등으로부터 생산된다. - IARC 2B군 발암 물질 - 클로로포름
클로로포름은 화학식 CHCl3을 갖는 무색의 휘발성 액체 유기 화합물로, 마취 효과가 있어 과거에 마취제로 사용되었으나 독성 문제로 현재는 냉매 생산, 유기 용매 등으로 사용되며, 발암 가능성과 유독 물질 생성 위험으로 취급에 주의가 필요하고 사용을 줄이는 추세이다. - IARC 2B군 발암 물질 - 다우노루비신
다우노루비신은 DNA에 삽입되어 복제와 전사를 억제하는 항암제로, 급성 골수성 백혈병과 신경모세포종 치료에 사용되며, 암세포 성장과 증식을 억제하고 다른 항암제 원료나 유사 약물 제조에도 사용되지만 심각한 심장 독성 부작용이 있다.
2. 제조
니트로메테인은 주로 프로페인과 질산을 고온에서 반응시켜 산업적으로 생산한다. 이 외에도 클로로아세트산 나트륨과 아질산 나트륨을 수용액에서 반응시켜 니트로메테인을 생성하는 방법이 있으며, 이는 교육적 가치가 있다.[33]
2. 1. 산업적 생산
니트로메테인은 350°C에서 450°C의 고온에서 프로페인과 질산을 반응시켜 산업적으로 생산한다. 이 발열 반응은 니트로메테인, 니트로에테인, 1-니트로프로페인, 2-니트로프로페인의 네 가지 니트로알케인을 생성한다. 이 반응은 CH3CH2CH2O 유형의 알콕시 라디칼을 포함한 자유 라디칼이 관여하며, 이는 해당 아질산 에스터의 균일 분해를 통해 발생한다. 이러한 알콕시 라디칼은 C—C 단편화 반응에 취약하며, 이로 인해 생성물은 여러 성분의 혼합물이 된다.[13][32]2. 2. 실험실 제법
클로로아세트산나트륨과 아질산나트륨을 수용액에서 반응시키면 니트로메테인이 생성된다. 이 방법은 교육적인 가치가 있다.[14]: ClCH2COONa + NaNO2 + H2O → CH3NO2 + NaCl + NaHCO3
3. 용도
나이트로메테인은 다양한 용도로 사용되는 화합물이다.
- 전구체 및 시약: 나이트로메테인은 여러 화합물 합성의 중요한 재료이다. 살충제인 클로로피크린을 만드는 데 사용되며,[13] 포름알데히드와 반응시켜 완충제나 알키드 수지의 성분인 트리스(하이드록시메틸)아미노메탄(트리스)를 생성한다.[13] 유기 합성에서는 탄소 원자를 하나 추가하는 시약으로 사용되며, 염기 촉매 하에서 알데히드와 반응하거나 마이클 반응을 통해 특정 화합물에 결합한다.
- 용매 및 안정제: 나이트로메테인은 극성이 크고 비양성자성이면서 약염기성을 띠는 독특한 용매이다. 양전하를 띤 물질을 잘 용해하며, 특히 순간접착제의 성분인 시아노아크릴레이트를 녹이는 데 사용된다.[13] 염소화 용매의 안정제로 사용되며, 유기 화학 및 전기 분석 화학 분야에서도 활용된다.[34]
- 연료: 나이트로메테인은 모터스포츠, 특히 드래그 레이싱에서 "니트로"라고 불리는 고출력 연료 또는 연료 첨가제로 사용된다.[15] 무선 조종 모형 자동차, 비행기, 보트 등의 엔진 연료로도 사용된다.[15] 산소 함량이 높아 일반 연료보다 적은 공기로도 연소할 수 있다.[16] 가솔린 1kg 연소에는 14.7kg의 공기가 필요하지만, 나이트로메테인 1kg은 1.7kg의 공기만 필요하다. 엔진 실린더는 한 번에 제한된 양의 공기만 담을 수 있으므로, 가솔린보다 더 많은 나이트로메테인을 연소시켜 높은 출력을 얻을 수 있다. 하지만 나이트로메테인의 에너지 밀도는 가솔린보다 낮아, 주어진 산소량에서 가솔린의 약 2.3배 출력을 낸다. 층류 화염 속도가 빠르고 단열 화염 온도가 높아 고속 엔진에 적합하며, 높은 증발열로 흡입 혼합물을 냉각시킨다. 보통 농후 혼합기와 함께 사용되며, 수소와 일산화탄소가 연소 생성물로 발생한다. 소량의 히드라진을 섞으면 출력이 증가하지만, 불안정하여 위험하다.[22] 모형 항공기 및 모형 자동차의 글로우 연료에는 메탄올이 주성분이며, 니트로메테인(0~65%, 보통 30% 이하)과 윤활유가 첨가된다.
- 기타 용도: 과거 폭발물 산업에서 질산 암모늄과 함께 사용되거나 성형 작약에 사용되었다. 할로겐화 탄화수소의 분해를 막는 안정제로도 사용되었다.[23] 겔화제를 섞어 젤 형태로 만든 PLX나 질산 암모늄, 니트로메탄, 알루미늄 분말 혼합물(ANNM, ANNMAl)도 있다.
3. 1. 전구체 및 시약
나이트로메테인은 다양한 화합물 합성에 사용되는 중요한 전구체이다. 널리 사용되는 살충제인 클로로피크린(Chloropicrin|클로로피크린영어)을 만드는 데 사용된다.[13] 포름알데히드와 반응하여(헨리 반응) 널리 사용되는 완충제이자 알키드 수지의 성분인 트리스(하이드록시메틸)아미노메탄(트리스)을 생성한다.[13]유기 합성에서는 1탄소 증탄 시약으로 사용된다. 약하지만 산성인 프로톤을 가지며, 카르보닐 화합물과 마찬가지로 이를 탈프로톤화시킴으로써 축합 반응에 사용할 수 있다. 즉, 염기촉매의 존재 하에서 알데히드에 1,2-부가 반응을 일으킨다. 이 반응은 니트로알돌 반응이라고 불린다. 마이클 공여체로도 작용하여, 마이클 반응에 의해 α,β-불포화 카르보닐 화합물에 1,4-부가 반응을 한다.
3. 2. 용매 및 안정제
나이트로메테인은 극성이 크고(20°C에서 εr = 36, μ = 3.5 디바이) 비양성자성이면서 약염기성을 띠는 특이한 성질을 가진 유기 용매이다. 이러한 특성 덕분에 양전하를 띠고 강한 친전자성을 가진 물질을 용해하는 데 유용하다. 특히 시아노아크릴레이트(순간접착제)와 같은 아크릴레이트 단량체의 용매로 사용된다.[13] 주요 용도는 염소화 용매의 안정제이다. 극성 용매로서 유기 화학, 전기 분석 화학 분야에서 사용된다.[34]3. 3. 연료
니트로메테인은 모터스포츠, 특히 드래그 레이싱에서 고출력 연료 또는 연료 첨가제로 사용되며, "니트로"라고도 불린다.[15] 무선 조종 모형 자동차, 비행기, 보트 등의 모형 엔진 연료로도 사용된다.[15]니트로메테인은 산소 함량이 높아 기존 연료보다 훨씬 적은 대기 산소로 연소할 수 있다.[16] 가솔린영어 1kg을 연소하는 데 필요한 공기량은 14.7kg이지만, 니트로메테인 1kg에는 1.7kg의 공기만 필요하다. 엔진 실린더는 각 스트로크마다 제한된 양의 공기만 담을 수 있으므로, 가솔린보다 훨씬 많은 니트로메테인을 한 번의 스트로크로 연소할 수 있다. 하지만 니트로메테인은 비에너지 밀도가 낮아, 가솔린(약 42–44 MJ/kg)보다 낮은 11.3 MJ/kg을 제공한다. 이러한 이유로 니트로메테인은 주어진 양의 산소와 결합할 때 가솔린의 약 2.3배의 출력을 생성한다.
니트로메테인은 약 0.5 m/s의 층류 화염 속도를 가지며, 가솔린보다 약간 빨라 고속 엔진에 적합하다. 또한 약 2400°C의 높은 단열 화염 온도를 가지고 있다. 0.56 MJ/kg의 높은 증발열과 높은 연료 유량은 흡입되는 혼합물을 냉각시켜 비교적 낮은 온도를 유지하게 한다.
일반적으로 니트로메테인은 농후 혼합기와 함께 사용되는데, 이는 대기 중 산소가 없어도 출력을 제공하기 때문이다. 농후 혼합기를 사용할 경우 수소와 일산화탄소가 연소 생성물로 발생하며, 이러한 가스들은 배기 포트를 빠져나올 때 점화되기도 한다.
소량의 히드라진을 니트로메테인에 혼합하면 출력을 더욱 높일 수 있지만,[22] 이 혼합물은 불안정하여 심각한 안전 위험을 초래한다.
모형 항공기 및 모형 자동차의 글로우 연료에서 주요 성분은 메탄올이며, 니트로메테인(0%에서 65%, 드물게 30% 초과)과 윤활유(보통 피마자유 및/또는 합성유)가 첨가된다. 적당량의 니트로메테인은 엔진 출력을 높이고 튜닝을 쉽게 만든다.
3. 4. 기타 용도
과거에는 폭발물 산업에서 질산 암모늄과의 2성분 폭발물 조성의 구성 요소로 사용되었으며, 성형 작약에도 사용되었다. 또한 다양한 할로겐화 탄화수소의 분해를 방지하는 화학적 안정제로도 사용되었다.[23]몇 퍼센트의 겔화제를 사용하여 젤 형태로 만들면 폭발물로 사용할 수 있다. 이러한 유형의 혼합물을 PLX라고 한다. 다른 혼합물로는 질산 암모늄, 니트로메탄 및 알루미늄 분말의 폭발성 혼합물인 ANNM, ANNMAl이 있다.
4. 화학적 성질
나이트로메테인은 비교적 산성인 탄소산이다. DMSO 용액에서 pKa는 17.2이며, 이는 수용액에서 pKa가 약 11임을 나타낸다.[24] 음이온이 안정화된 대체 공명 구조를 가지기 때문에 산성도가 높다. 산은 느리게 탈양성자화된다. 짝염기 O2NCH2−의 양성자화는 질산염과 거의 등전자성이며, 처음에는 산소에서 일어난다.[25]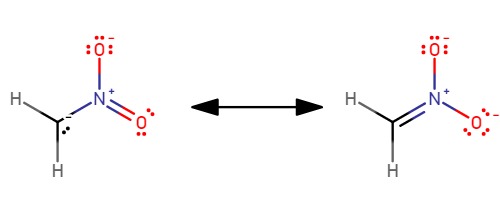
유기 합성에서 나이트로메테인은 1개의 탄소 빌딩 블록으로 사용된다.[26][27] 이 물질의 산성도는 탈양성자화를 가능하게 하여 카보닐 화합물과 유사한 축합 반응을 수행할 수 있게 한다.
4. 1. 산-염기 성질
나이트로메테인은 비교적 산성인 탄소산이다. DMSO 용액에서 pKa는 17.2이다. 이 값은 수용액에서 pKa가 약 11임을 나타낸다.[24] 음이온이 안정화된 대체 공명 구조를 가지기 때문에 산성도가 높다.산은 느리게 탈양성자화된다. 짝염기 O2NCH2−의 양성자화는 질산염과 거의 등전자성이며, 처음에는 산소에서 일어난다.[25]
4. 2. 유기 반응
유기 합성에서 나이트로메테인은 1개의 탄소 빌딩 블록으로 사용된다.[26][27] 이 물질의 산성도는 탈양성자화를 가능하게 하여 카보닐 화합물과 유사한 축합 반응을 수행할 수 있게 한다. 따라서 염기 촉매 하에서 나이트로메테인은 알데히드에 1,2-첨가로 니트로알돌 반응을 일으킨다. 몇 가지 중요한 유도체로는 살충제인 클로로피크린 (Cl3CNO2), 베타-니트로스티렌, 그리고 트리스(히드록시메틸)니트로메테인 ((HOCH2)3CNO2) 등이 있다. 후자의 환원은 트리스(히드록시메틸)아미노메테인, (HOCH2)3CNH2를 생성하며, 이는 널리 사용되는 완충 용액인 트리스로 더 잘 알려져 있다. 더욱 전문적인 유기 합성에서 나이트로메테인은 마이클 공여체 역할을 하여, 마이클 반응에서 1,4-첨가 반응을 통해 α,β-불포화 카보닐 화합물에 첨가된다.5. 정제
니트로메테인은 유기 화학 및 전기 분석 화학 분야에서 널리 사용되는 용매이다. 어는점 이하로 냉각시킨 후 차가운 다이에틸 에테르로 고체를 세척하고 증류하여 정제할 수 있다.[28]
6. 안전성
나이트로메테인은 급성 독성이 적은 편이다. 그러나 미국 정부 보고서에 따르면 "인간 발암 물질로 추정"된다.[29]
1958년 6월 1일에 발생한 나이트로메테인 적재 철도 탱크차 폭발 사고[30] 이후 고성능 폭발물로 알려지게 되었다. 여러 실험을 통해 TNT보다 강력하지만, 폭굉 속도와 파괴력은 TNT가 더 높다는 것이 밝혀졌다.
질산 암모늄과 혼합하면 ANNM으로 알려진 폭발성 혼합물이 형성된다. 이 혼합물은 오클라호마 폭탄 테러 당시 알프레드 P. 머라 연방 빌딩 폭파에 사용되었다.
순수한 나이트로메테인은 충격에 둔감하지만, 단열 압축으로 인해 폭발할 수 있다.[30] 염기를 첨가하여 pH를 높이면 충격에 더 민감해진다.
6. 1. 독성
나이트로메테인은 급성 독성이 적다. LD50 (경구, 쥐)는 1210mg/kg이다.[13] 미국 정부 보고서에 따르면 나이트로메테인은 "인간 발암 물질로 추정"된다.[29]6. 2. 폭발성
나이트로메테인은 1958년 6월 1일에 발생한 나이트로메테인 적재 철도 탱크차 폭발 사고[30] 이후 고성능 폭발물로 알려지게 되었다. 여러 실험을 통해 TNT보다 더 강력한 폭발물임이 밝혀졌지만, 폭굉 속도와 파괴력은 TNT가 더 높다. 이 두 폭발물은 모두 산소가 부족하므로 산화제인 질산 암모늄과 혼합하면 더 큰 효과를 얻을 수 있다.질산 암모늄과 혼합하면 ANNM으로 알려진 폭발성 혼합물이 형성된다. 이 혼합물은 오클라호마 폭탄 테러 당시 알프레드 P. 머라 연방 빌딩 폭파에 사용되었다.
순수한 나이트로메테인은 충격에 둔감하지만, 단열 압축으로 인해 폭발할 수 있다.[30] 이는 작은 공기 방울이 압축되면서 급격한 압력 상승으로 과열될 때 발생한다. 또한, 염기를 첨가하여 pH를 높이면 충격에 더 민감해진다.
7. 유사 화합물
테트라니트로메탄, 트리니트로메탄
참조
[1]
서적
Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)
The Royal Society of Chemistry
2014
[2]
문서
Haynes
[3]
문서
Haynes
[4]
웹사이트
Bordwell pKa table: "Nitroalkanes"
http://www.chem.wisc[...]
2022-01-27
[5]
문서
Haynes
[6]
문서
Haynes
[7]
문서
Haynes
[8]
문서
Haynes
[9]
문서
Haynes
[10]
문서
Haynes
[11]
간행물
PGCH
[12]
간행물
IDLH
[13]
백과사전
Wiley-VCH
[14]
간행물
Nitromethane
[15]
웹사이트
HPBG: The Power of Racing Fuels
https://www.enginebu[...]
2013-01-06
[16]
웹사이트
What is Nitro Methane Fuel: Understanding High-Performance Racing's Power Source - Ran When Parked - Car, Vehicle & Truck Guides and Repair Journals.
https://ranwhenparke[...]
2024-03-05
[17]
학술지
Insights into nitromethane combustion from detailed kinetic modeling – Pyrolysis experiments in jet-stirred and flow reactors
https://hal.archives[...]
2020-02-01
[18]
학술지
Insights into nitromethane combustion from detailed kinetic modeling – Pyrolysis experiments in jet-stirred and flow reactors
https://hal.archives[...]
2020-02-01
[19]
학술대회
Characteristics of Nitromethane for Propulsion Applications
https://arc.aiaa.org[...]
2006-01
[20]
서적
Ignition! an informal history of liquid rocket propellants
https://archive.org/[...]
Rutgers University Press
1972
[21]
학술대회
Nitromethane as a Green Propellant: First Results of a Combustion Test Campaign
https://www.eucass.e[...]
2023
[22]
웹사이트
AMA Competition Regulations 2015–2016 Part 7. Fuels
https://www.modelair[...]
Academy of Model Aeronautics
2016-02-15
[23]
웹사이트
Nitromethane: An Ultimate Guide to Properties, Uses and Synthesis
https://safrole.com/[...]
[24]
학술지
Is Resonance Important in Determining the Acidities of Weak Acids or the Homolytic Bond Dissociation Enthalpies (BDEs) of Their Acidic H-A Bonds?
[25]
서적
Progress in Inorganic Chemistry
[26]
간행물
Cycloheptanone
[27]
간행물
2-Nitroethanol
[28]
학술지
Recommended Methods for the Purification of Solvents and Tests for Impurities: Nitromethane
http://www.iupac.org[...]
[29]
웹사이트
National Toxicology Program 15th Report on Carcinogens
https://ntp.niehs.ni[...]
2021-12-21
[30]
웹사이트
Accident Near Mt. Pulaski, ILL
http://www.blet602.o[...]
[31]
간행물
ICSC-ref
1997-10
[32]
문서
Sheldon B. Markofsky “Nitro Compounds, Aliphatic” Ullmann's Encyclopedia of Industrial Chemistry 2002 by Wiley-VCH, Weinheim, 2002
[33]
간행물
Nitromethane
[34]
학술지
Recommended Methods for the Purification of Solvents and Tests for Impurities: Nitromethane
[35]
서적
Automotive Fuels Reference Book - 2nd edition
1995
[36]
문서
但し、自動車の話題で「ニトロ」と言った場合、これとは全く違う[[亜酸化窒素]]を利用した[[ナイトラス・オキサイド・システム]]のことを指す場合も多いので注意が必要である。
[37]
서적
Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)
The Royal Society of Chemistry
2014
[38]
문서
Haynes, p. 3.414
[39]
문서
Haynes, p. 5.94
[40]
웹인용
Bordwell pKa table: "Nitroalkanes"
http://www.chem.wisc[...]
2016-01-17
[41]
문서
Haynes, p. 6.231
[42]
문서
Haynes, p. 6.231
[43]
문서
Haynes, p. 3.576
[44]
문서
Haynes, p. 15.19
[45]
문서
Haynes, p. 6.69
[46]
문서
Haynes, p. 5.20
[47]
문서
PGCH|0457
[48]
문서
IDLH|75525|Nitromethane
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

