원자 질량 단위
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
원자 질량 단위는 원자 및 분자의 질량을 나타내는 데 사용되는 질량 단위로, 탄소-12 원자 질량의 1/12로 정의된다. 1961년 국제순수 및 응용화학 연합(IUPAC)은 탄소-12를 기준으로 하는 통일 원자 질량 단위(u)를 정의했고, 이후 달톤(Da)이라는 명칭이 사용되면서, 2019년 국제도량형국(BIPM)은 달톤을 SI 부속 단위로 채택했다. 달톤은 원자, 이온, 분자, 그리고 생체 고분자 등의 질량을 나타내는 데 사용되며, 원자 질량 상수, 몰 질량 상수와 연관된다.
더 읽어볼만한 페이지
- SI 단위 - 전자볼트
전자볼트는 전자가 1볼트의 전위차를 통과할 때 얻거나 잃는 에너지 단위로, 1.602 × 10⁻¹⁹ 줄과 같으며, 다양한 물리학 분야와 공학에서 에너지, 질량, 운동량, 온도, 거리 등을 표현하는 데 널리 활용된다. - SI 단위 - 제곱킬로미터
제곱킬로미터는 한 변의 길이가 1킬로미터인 정사각형의 넓이를 나타내는 단위로, 1,000,000 m², 100 헥타르, 247.105381 에이커와 같으며, 지도에서 축척에 따라 다르게 표현되고 국토지리정보원에서 면적을 파악하고 관리하는 데 활용된다. - SI와 함께 사용되는 비SI 단위 - 전자볼트
전자볼트는 전자가 1볼트의 전위차를 통과할 때 얻거나 잃는 에너지 단위로, 1.602 × 10⁻¹⁹ 줄과 같으며, 다양한 물리학 분야와 공학에서 에너지, 질량, 운동량, 온도, 거리 등을 표현하는 데 널리 활용된다. - SI와 함께 사용되는 비SI 단위 - 옹스트롬
옹스트롬은 안데르스 옹스트롬의 이름을 딴 길이의 단위로 10⁻¹⁰ 미터 또는 0.1 나노미터와 같았으나, 현재는 국제단위계의 공식 단위가 아니다. - 단위 - 데시벨
데시벨은 신호 손실 측정, 물리량 비율 표현, 이득/손실 표현 등에 사용되는 단위로, 계산 편의성 등의 장점이 있으나 차원 분석에 부적합하다는 비판도 있으며, 음향학 등 다양한 분야에서 활용된다. - 단위 - 로그 눈금
로그 눈금은 값의 비율을 로그 함수로 나타내어 넓은 범위의 값을 효과적으로 표현하고 분석하는 척도로, 지진 강도, 소리 크기, pH, 별의 등급 등에 사용되며, 인간 감각과 지수 함수 데이터 분석에도 활용되는 척도이다.
2. 역사
화학자 존 돌턴은 원자 질량 단위로 수소 원자를 제안했고, 프랜시스 윌리엄 애스턴은 산소-16 원자 질량의 1/16을 원자 질량 단위로 제안했다.
1961년 이전에는 물리학에서 amu는 산소-16 원자의 1/16로, 화학에서는 평균적 산소 원자의 1/16로 정의되었다. 두 단위 모두 현재의 원자량 단위보다 작았다. 1960년(물리학)과 1961년(화학)에 현재의 단위를 도입했다.
:1 u = 1.000 317 9 amu (물리) = 1.000 043 amu (화학)
일정 성분비의 법칙을 물질의 원자론으로 해석하면, 여러 원소의 원자 질량은 원소에 따라 정해진 비율을 가진다. 실제 질량은 알 수 없었지만, 상대 질량은 추론할 수 있었다.
20세기 초, 산소 원자 질량의 1/16이 원자 질량 단위(amu)로 정의되었다. 그러나 1929년 산소 동위원소(17O, 18O) 발견으로 “산소”는 여러 동위원소의 혼합물이며, “산소 원자 질량”은 각 동위원소 원자 질량의 동위원소 비율에 따른 평균임이 밝혀졌다. 동위원소 비율도 일정하지 않아 원자 질량 단위 정의는 불확실해졌다.
물리학계는 산소-16의 질량의 1/16로 정의된 새로운 원자 질량 단위(physical amu영어)를, 화학계는 기존 정의의 원자 질량 단위(chemical amu영어)를 사용했다.
: 1 physical amu ≒
: 1 chemical amu ≒ (동위원소 비율 차이로 높은 정확도로는 결정 불가)
약 1/3600의 차이로 인해 두 정의가 혼재했다.
국제순수 및 응용물리학 연합(IUPAP)과 국제순수 및 응용화학 연합(IUPAC)은 1960년 탄소-12 원자 질량의 1/12인 통일 원자 질량 단위를 정의했다.[55] 동위원소 비율 문제를 없애고, chemical amu에 가장 가까워 기존 값을 변경할 필요가 없도록 선택되었다. 단위 기호는 unified(통일)의 약자인 u로 정해졌다.
2006년 국제도량형국은 달톤을 통일 원자 질량 단위와 같은 정의의 SI 부속 단위로 채택했다.[56] 2019년에는 달톤만 SI 부속 단위로 채택하고 통일 원자 질량 단위는 제외했다.
국제단위계 국제문서(SI 문서) 각 판의 SI 부속 단위 장에서 달톤과 통일 원자 질량 단위의 위치 변화는 다음과 같다.
2. 1. 개념의 기원
화학자 존 돌턴은 최초로 원자 질량의 단위로 수소 원자를 제안했다. 1803년 돌턴은 가장 가벼운 원소인 수소의 원자 질량을 원자 질량의 자연 단위로 사용할 것을 제안했는데, 이는 원자량 척도의 기초가 되었다.[25]1898년 화학자 빌헬름 오스트발트 등은 기술적인 이유로 원자 질량 단위를 산소 원자 질량의 1/16로 재정의할 것을 제안했다.[26] 이 제안은 1903년 국제 원자량 위원회(ICAW)에서 공식적으로 채택되었다. 이는 대략 수소 원자 하나의 질량과 같았지만, 산소가 실험적으로 결정하기에 더 적합했기 때문이다. 이 제안은 1912년 동위원소 발견 이전에 이루어졌다.[25]
1909년, 물리학자 장 페랭은 원자 질량과 아보가드로 수를 결정하는 실험에서 동일한 정의를 채택했다.[22] 이 정의는 1961년까지 변경되지 않았다.[11][21]
2. 2. 동위원소 발견과 정의의 변화
1929년 산소의 동위원소(16O, 17O, 18O) 발견으로 인해 단위에 대한 보다 정밀한 정의가 필요하게 되었다.[26] 화학자들은 원자 질량 단위(AMU)를 자연계에 존재하는 산소 원자의 평균 질량의 1/16으로 정의했다. 즉, 알려진 동위원소의 질량을 자연 존재비로 가중 평균한 값이다. 반면에 물리학자들은 산소-16의 질량의 1/16으로 정의했다.[26]2. 3. IUPAC의 정의와 BIPM의 채택
1961년, 국제순수 및 응용화학연합(IUPAC)은 탄소-12(12C) 원자 질량의 1/12을 기준으로 하는 새로운 "통일 원자 질량 단위(u)"를 정의했다.[25][26] 이 값은 이전의 화학 및 물리학 정의의 중간값이면서, 화학자들이 사용하던 값에 더 가까웠다.[25][26]1971년, 국제도량형국(BIPM)은 통일 원자 질량 단위(u)를 SI와 함께 사용이 허용되는 비SI 단위로 채택했다.[34]
2006년 국제도량형국은 달톤을 통일 원자 질량 단위와 정확히 같은 정의의 단위로 SI 부속 단위로 채택했다.[56] 그러나 2019년 국제도량형국은 달톤만을 SI 부속 단위로 채택하고 통일 원자 질량 단위를 SI 부속 단위에서 제외했다.[24]
국제단위계 국제문서(SI 문서) 각 판의 SI 부속 단위 장에서 달톤과 통일 원자 질량 단위의 위치는 다음과 같다.
2. 4. 단위 명칭의 변화 (달톤)
1993년, 국제순수 및 응용화학 연합(IUPAC)은 통일 원자 질량 단위의 더 짧은 이름으로 "달톤"(기호 Da)을 제안했다.[12][9] 다른 단위 이름과 마찬가지로 "달톤"은 영어에서 대문자로 시작하지 않지만, 기호 "Da"는 대문자로 시작한다. 2005년, 국제 순수 및 응용 물리 연맹(IUPAP)은 달톤 명칭을 승인했다.[29]2003년, 국제도량형위원회(CIPM) 산하 단위 자문 위원회는 "더 짧고 SI 접두어와 더 잘 어울리기 때문에" 국제도량형국(BIPM)에 달톤 명칭을 권장했다.[13] 2006년, BIPM은 공식 정의에 관한 SI 소책자 제8판에 달톤을 SI와 함께 사용이 허용되는 비SI 단위로 포함시켰다.[23] 2009년, 국제 표준화 기구(ISO)는 "통일 원자 질량 단위"의 대안으로 달톤을 등재했다.[14][15] 현재 여러 과학 출판사에서 달톤을 권장하고 있으며,[16] 일부 출판사는 "원자 질량 단위"와 "amu"를 더 이상 사용하지 않는 것으로 간주한다.[17] 2019년, BIPM은 SI 소책자 제9판에서 달톤을 유지했지만, SI와 함께 사용이 허용되는 비SI 단위 표에서 통일 원자 질량 단위를 삭제했다. 단, 달톤(Da)과 통일 원자 질량 단위(u)는 동일한 단위에 대한 대안 명칭(및 기호)임을 명시했다.[24]
국제단위계 국제문서(SI 문서) 각 판의 SI 병용 단위 장에서 달톤과 통일 원자 질량 단위의 위치는 다음과 같다.
2. 5. 2019년 SI 기본 단위 재정의의 영향
2019년 SI 기본 단위 재정의에 달톤의 정의는 영향을 받지 않았다.[27][28][24] 즉, SI에서 1 Da는 여전히 탄소-12 원자 질량의 1/12이며, 이 값은 SI 단위로 실험적으로 결정해야 한다. 그러나 몰의 정의는 정확히 개의 구성입자로 이루어진 물질의 양으로 변경되었고, 킬로그램의 정의 또한 변경되었다. 결과적으로 몰 질량 상수는 여전히 1 g/mol에 가깝지만 더 이상 정확히 1 g/mol이 아니며, 어떤 물질 1몰의 질량(g)은 평균 분자 질량(달톤)과 거의 같지만 더 이상 정확히 수치적으로 같지 않다.[33] 하지만 재정의 당시 의 상대 표준 불확도는 모든 실용적인 목적에 있어 무시해도 될 정도로 작다.[24]SI 국제문서 각 판의 SI 부속 단위 장에서 달톤과 통일 원자 질량 단위의 위치는 다음과 같다.
달톤(Dalton)이라는 명칭은 근대 원자론을 제창한 존 돌턴의 이름에서 유래했다.[50] 단위 기호는 "Da"이며, 인명에서 유래했으므로 첫 글자는 대문자로 쓴다. 과거에는 "D"라는 기호가 사용되었지만, 현재는 사용하지 않는다.[50] 과거에는 '''원자 질량 단위'''(atomic mass unit)(기호 amu)라고 불렸으나, 공식적으로 폐지되었으며 사용하는 것은 부적절하다.[50]
달톤 (Da) 또는 통일 원자 질량 단위 (u)는 정지 상태이고 바닥 상태에 있는 자유로운 12C 원자 질량의 1/12로 정의된다.[27][28][24] 2019년 국제단위계(SI) 재정의 이전에는 이 값이 실험적으로 결정되었으나, 재정의 이후에는 12C 원자 질량의 1/12와 '''같다고''' 여겨진다.
달톤은 원자, 이온, 분자(DNA나 단백질과 같은 거대 고분자 포함), 리보솜과 같이 여러 개의 초거대 분자 복합체의 질량을 나타내는 데 사용된다. 생화학에서 생체 고분자나 복합체의 질량을 나타낼 때에도 달톤이 사용된다.[1]
원자 질량 상수(''m''u)는 원자 질량과 원자량을 관련짓는 물리 상수로, 통일 원자 질량 단위와 같다.[58] 즉, ''m''u = 1 u = 1 Da이다.
시간이 지남에 따라 달톤과 통일 원자 질량 단위의 위치가 역전되었음을 알 수 있다.
3. 명칭과 기호
4. 정의 및 값
정의에 따라, 엄밀하게
: ''m''(¹²C) = 12 Da
이다.
1 Da의 국제단위계(SI) 문서 및 CODATA 권장값은 다음과 같다. 괄호 안의 숫자는 표준 불확도이다.
달톤의 정의는 “12 g의 탄소 12의 물질량”이라고 되었던 몰의 이전 정의의 반대가 되어,
: 1 g ≒ {''N''A} Da = Da (2018CODATA)
이다. 즉, 어떤 분자 등의 질량을 달톤으로 나타낸 수치는, 그 분자로 이루어진 순물질 1 mol(아보가드로 수()개의 분자)의 질량을 그램으로 나타낸 수치와 거의 같다(2019년 SI 기본 단위의 재정의 이전에는 정확히 같았다).
¹²C 원자는, ¹²C원자핵과 그것을 둘러싼 6개의 전자로 구성된다. 전자의 질량은 원자핵의 질량보다 훨씬 작다. 탄소 12의 질량수(양성자 수와 중성자 수의 합계)는 12이므로, 핵자(양성자와 중성자) 및 ¹H 원자의 질량은 거의 1 Da이다. 하지만 실제로는 약간 무겁고
: ''m''p = 1.0073 u[52]
: ''m''n = 1.0087 u[53]
: ''m''(¹H) = 1.0078 u[54]
이다. 이것은 자유 핵자가 높은 핵에너지를 질량의 형태로 가지고 있기 때문이다. 이 정도의 차이는 오차로 허용한다면, 질량수 의 원자의 질량은 대략 u라고 말할 수 있다.
원자 질량 단위는 질량-에너지 등가량 ''m''u''c''2로도 표현할 수 있다. 질량 등가량은 입자 물리학에서 질량 단위 대신 흔히 사용되며, 이 값들은 상대 원자 질량을 실제로 결정하는 데에도 중요하다.
5. 사용
달톤이 SI 조합 단위가 되기 전에는 "달톤이 사용되지만 공식적으로는 통일 원자 질량 단위를 사용해야 한다"는 식으로 기술되기도 했다.[1] 생물학에서는 분자량을 나타낼 때 "달톤"이 잘못 사용되기도 했다.[1]
6. 다른 단위와의 관계
원자 E의 상대 원자 질량 ''A''r(E) (원자 E의 원자량)는 원자 E의 질량 ''m''a(E)과 원자 질량 상수 ''m''u의 비로 정의된다.[59] 분자 B의 상대 분자 질량 ''M''r(B) (분자 B의 분자량)는 분자 B의 질량 ''m''(B)와 ''m''u의 비로 정의된다.[59] 원소 E의 상대 원자 질량 ''A''r(E) (원소 E의 원자량)는 원소 E의 평균 질량 ''m''a(E)와 ''m''u의 비로 정의된다.[60]
몰 질량 상수(''M''u)는 원자 질량 상수(''m''u)와 아보가드로 상수(''N''A)의 곱으로 정의된다.[59] 몰 질량을 원자량이나 분자량과 관련짓는 물리 상수이며, 몰의 정의가 변경된 2019년 5월 20일 이후로는 g mol-1이다.[61]
:''M''u = ''m''u''N''A
달톤(Da)에는 SI 접두어를 붙일 수 있다(SI 조합 단위#SI 조합 단위). 킬로달톤(kDa), 메가달톤(MDa), 나노달톤(nDa), 피코달톤(pDa) 등이 사용된다.[51] 통일 원자 질량 단위(u)에 SI 접두어를 붙이는 것은 금지되어 있지는 않지만, 실제로는 거의 없다. 밀리마스유닛(mmu)은 비공식 단위로, 1 mmu = 1/1000 u = 1 mDa로 정의되지만, SI 접두어 시스템과의 일관성이 없어 사용은 권장되지 않는다.
6. 1. 원자 질량 상수
'''원자 질량 상수'''(原子質量定數, atomic mass constant|아토믹 매스 콘스턴트영어)는 기호 ''m''u로 표시되는, 원자 질량과 원자량을 관련짓는 물리 상수이다. 통일 원자 질량 단위와 같다.[58] 즉 ''m''u = 1 u = 1 Da이다.
원자 E의 상대 원자 질량(즉, 원자 E의 원자량) ''A''r(E)는 원자 E의 질량 ''m''a(E)과 원자 질량 상수 ''m''u의 비로 정의된다.[59]
:''A''r(E) = ''m''a(E)/''m''u
마찬가지로 분자 B의 상대 분자 질량(즉, 분자 B의 분자량) ''M''r(B)는 분자 B의 질량 ''m''(B)와 원자 질량 상수 ''m''u의 비로 정의된다.[59]
:''M''r(B) = ''m''(B)/''m''u
원소 E의 상대 원자 질량(즉, 원소 E의 원자량) ''A''r(E)는 원소 E의 평균 질량 ''m''a(E)와 원자 질량 상수 ''m''u의 비로 정의된다.[60]
:''A''r(E) = ''m''a(E)/''m''u
몰 질량 상수 ''M''u는 원자 질량 상수 ''m''u와 아보가드로 상수 ''N''A의 곱으로 정의된다.[59]
:''M''u = ''m''u''N''A
6. 2. 몰 질량 상수
'''몰 질량 상수'''(molar mass constant영어, )는 원자 질량 상수()와 아보가드로 상수()의 곱으로 정의된다.[59]
:
는 몰 질량을 원자량이나 분자량과 관련짓는 물리 상수이며, 몰의 정의가 변경된 2019년 5월 20일 이후로는 g mol-1이다.[61]
6. 3. SI 접두어
달톤(Da)에는 SI 접두어를 붙일 수 있다(SI 조합 단위#SI 조합 단위). 킬로달톤(kDa), 메가달톤(MDa), 나노달톤(nDa), 피코달톤(pDa) 등의 단위와 기호가 사용된다.[51]
통일 원자 질량 단위(u)에 SI 접두어를 붙이는 것은 금지되어 있지는 않지만, 실제로는 거의 없다.
밀리마스유닛(milli mass unit, mmu)이라는 비공식 단위도 있으며, 1 mmu = 1/1000 u = 1 mDa로 정의되지만, SI 접두어 시스템과의 일관성이 없어 사용은 권장되지 않는다.
7. 측정
상대적 원자 질량은 중성 원자에 대해 정의되지만, 실제로는 질량 분석법으로 이온에 대해 측정된다. 따라서 측정값은 이온을 형성하기 위해 제거된 전자의 질량과 전자 결합 에너지에 해당하는 질량만큼 보정되어야 한다. 탄소-12 원자의 여섯 개 전자의 총 결합 에너지는 원자 질량의 약 1천만 분의 1이다.[2]
2019년 SI 개정 전에는 통일 원자 질량 단위의 값을 구하기 위해 아보가드로 수를 결정하는 실험이 수행되었다.
7. 1. 요제프 로슈미트
1865년, 요제프 로슈미트는 기체의 주어진 부피에 있는 입자의 수를 추정하여 원자 질량 단위의 값을 처음으로 간접적으로 얻었다.[31]7. 2. 장 페랭
20세기 초, 장 페랭은 여러 가지 방법으로 아보가드로 수를 추정했으며, 이 연구로 1926년 노벨 물리학상을 받았다.[30]
7. 3. 쿨로미터법
쿨로미터법은 마이클 패러데이가 1834년에 발표한 전기분해 연구 결과를 바탕으로 한다.[32] 1몰의 기본 전하량은 패러데이 상수 ''F''로 알려져 있다. 1910년 로버트 밀리컨이 전자의 전하량(-''e'')을 최초로 측정했고, ''F''/''e''를 통해 아보가드로 수를 추정할 수 있었다.[32]고전적인 쿨로미터법 실험은 NIST의 보워(Bower)와 데이비스(Davis)가 수행했다.[3] 이 실험은 일정한 전류 ''I''를 알려진 시간 ''t'' 동안 흘려보내면서 전기분해 전지의 양극에서 은(silver) 금속을 용해시키는 방식으로 진행된다. 양극에서 손실된 은의 질량을 ''m'', 은의 원자량을 ''A''r이라 하면, 패러데이 상수는 다음과 같이 계산된다.
:
NIST 과학자들은 기계적인 원인으로 양극에서 손실된 은을 보정하고, 사용된 은의 동위원소 분석을 통해 원자량을 결정했다. 그 결과, 기준 패러데이 상수 값은 ''F'' = 96485.39°C/mol 이었으며, 이는 아보가드로 수 값 에 해당한다. 두 값 모두 상대 표준 불확실도는 이다.
7. 4. 전자 질량 측정
원자 질량 단위는 전자 정지 질량(m)과 전자의 상대 원자 질량(A(e))으로부터 결정된다.[4] 전자의 상대 원자 질량은 사이클로트론 실험에서 측정할 수 있으며, 전자의 정지 질량은 다른 물리 상수로부터 유도할 수 있다.:
:
여기서 ''c''는 빛의 속도, ''h''는 플랑크 상수, ''α''는 미세구조 상수, ''R''는 리드베리 상수이다.
7. 5. X선 결정 밀도법
X선 결정 밀도법은 고순도 규소 단결정의 격자 상수를 측정하여 아보가드로 수를 결정하는 방법이다. 오늘날 상업 시설에서는 매우 높은 순도와 적은 격자 결함을 가진 규소 단결정을 생산할 수 있다. 이 방법은 아보가드로 수를 몰 부피 ''V''m와 원자 부피 ''V''atom의 비율로 정의한다.: NA = ''V''m / ''V''atom
여기서 Vatom영어 = Vcell영어 / ''n'' 이고, ''n''은 부피 Vcell영어인 단위세포 당 원자 수이다.
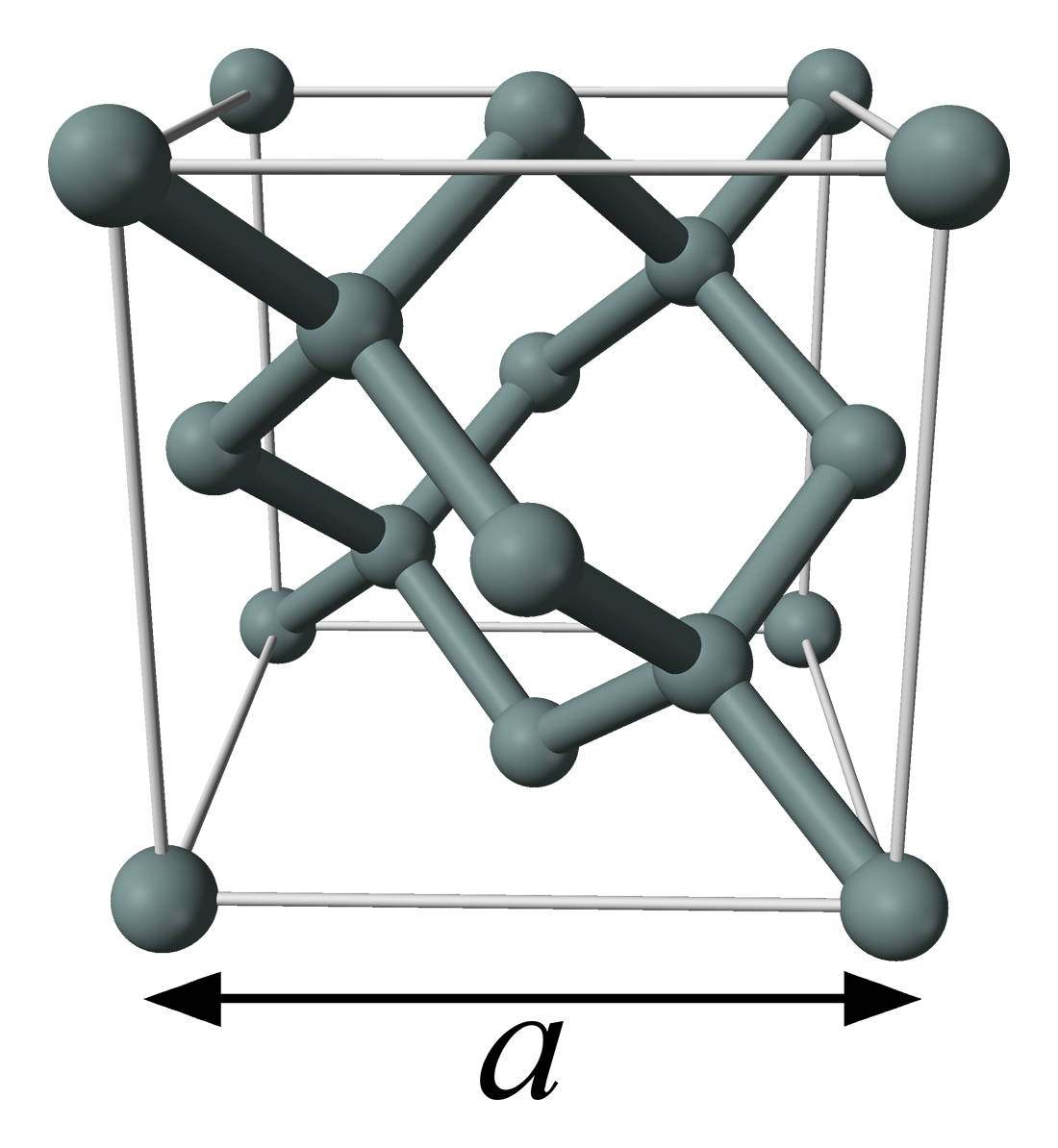
규소의 단위세포는 8개의 원자가 입방 밀집 구조로 배열되어 있으며, 단위세포의 부피는 단위세포의 한 변의 길이인 격자상수 ''a''를 측정하여 구할 수 있다.[6] 실제로는 {220}으로 표시되는 면 간의 거리인 ''d''220(Si)를 측정한다. 이 거리는 a/√8영어과 같다.
사용된 시료의 동위원소 비율을 측정하고 고려해야 한다. 규소는 세 가지 안정 동위원소(Si, Si, Si)로 존재하며, 이들의 비율의 자연 변화는 측정의 다른 불확실성보다 크다. 세 가지 핵종의 표준 원자량이 매우 정확하게 알려져 있으므로, 시료 결정의 원자량 ''A''r를 계산할 수 있다. 이 값과 측정된 시료의 밀도 ''ρ''를 사용하여 몰 부피 ''V''m를 결정할 수 있다.
: Vm = ''A''r''M''u / ''ρ''
여기서 ''M''u는 몰 질량 상수이다.
참조
[1]
논문
Molar mass and related quantities in the new SI
https://tsapps.nist.[...]
[2]
논문
CODATA recommended values of the fundamental physical constants: 2002
https://www.nist.gov[...]
[3]
논문
CODATA recommended values of the fundamental physical constants: 1998
https://www.nist.gov[...]
[4]
논문
CODATA recommended values of the fundamental physical constants: 1998
https://www.nist.gov[...]
[5]
웹사이트
Constants bibliography, source of the CODATA internationally recommended values
https://physics.nist[...]
2021-08-04
[6]
웹사이트
Unit Cell Formula
https://webmineral.c[...]
2007-12-09
[7]
GoldBookRef
atomic mass constant
[8]
GoldBookRef
unified atomic mass unit
2010-07-16
[9]
GoldBookRef
dalton
2015-04-28
[10]
논문
The Ame2016 atomic mass evaluation (II). Tables, graphs and references
[11]
서적
Physical Chemistry for the Biosciences
https://books.google[...]
University Science Books
2005
[12]
서적
Quantities, Units and Symbols in Physical Chemistry International Union of Pure and Applied Chemistry; Physical Chemistry Division
https://archive.org/[...]
International Union of Pure and Applied Chemistry and published for them by Blackwell Science Ltd
[13]
웹사이트
Consultative Committee for Units (CCU); Report of the 15th meeting (17–18 April 2003) to the International Committee for Weights and Measures
https://www.bipm.org[...]
2010-08-14
[14]
간행물
International Standard ISO 80000-1:2009 – Quantities and Units – Part 1: General
International Organization for Standardization
[15]
간행물
International Standard ISO 80000-10:2009 – Quantities and units – Part 10: Atomic and nuclear physics
International Organization for Standardization
[16]
웹사이트
Instructions to Authors
https://www.oxfordjo[...]
Oxford journals; Oxford University Press
2010-08-22
[17]
논문
Author guidelines
Wiley-Blackwell
[18]
서적
Biochemistry
https://archive.org/[...]
Macmillan
[19]
웹사이트
Molecular Facts and Figures
https://sfvideo.blob[...]
Integrated DNA Technologies
2019-07-08
[20]
논문
Damped elastic recoil of the titin spring in myofibrils of human myocardium
2003-10
[21]
서적
Chemistry: The Practical Science
https://books.google[...]
Cengage Learning
2008
[22]
논문
Mouvement brownien et réalité moléculaire
https://web.lemoyne.[...]
[23]
SIbrochure8th
[24]
간행물
The International System of Units (SI)
https://www.bipm.org[...]
Bureau International des Poids et Mesures
[25]
논문
The atomic mass unit
https://zenodo.org/r[...]
[26]
논문
Atomic Weights and the International Committee—A Historical Review
https://www.iupac.or[...]
[27]
간행물
Proceedings of the 106th meeting of the International Committee for Weights and Measures (CIPM), 16-17 and 20 October 2017
https://www.bipm.org[...]
International Bureau for Weights and Measures
[28]
간행물
Resolutions Adopted - 26th Conference Générale des Poids et Mesures
https://www.bipm.org[...]
International Bureau for Weights and Measures
[29]
웹사이트
IUPAP: C2: Report 2005
https://archive.iupa[...]
2018-07-15
[30]
웹사이트
Presentation Speech for the 1926 Nobel Prize in Physics
https://nobelprize.o[...]
1926-12-10
[31]
논문
Zur Grösse der Luftmoleküle
https://web.archive.[...]
[32]
웹사이트
Introduction to the constants for nonexperts, 1900–1920
https://physics.nist[...]
NIST
2019-07-03
[33]
논문
Unified Atomic Mass Unit
2016-02-29
[34]
웹사이트
14th Conference Générale des Poids et Mesures
https://www.bipm.org[...]
Bureau International des Poids et Mesures
[35]
서적
The Feynman Lectures on Physics
[36]
서적
McGraw-Hill Encyclopedia of Science and Technology
[37]
서적
Atomic Physics
https://books.google[...]
[38]
웹사이트
Avogadro constant
2019-02-08
[39]
논문
Atomic Weight: The Name, Its History, Definition and Units
[40]
논문
Glossary of terms in quantities and units in Clinical Chemistry (IUPAC-IFCC Recommendations 1996)
https://goldbook.iup[...]
[41]
서적
Particle Physics: The Quest for the Substance of Substance
https://books.google[...]
OPA Ltd.
[42]
서적
General Chemistry
https://books.google[...]
[43]
논문
Essai d'une maniere de determiner les masses relatives des molecules elementaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons
https://web.lemoyne.[...]
[44]
논문
Loschmidt's Number
https://web.archive.[...]
[45]
서적
Chemistry and Chemical Reactivity
https://web.archive.[...]
Brooks/Cole
[46]
웹사이트
CODATA Value: unified atomic mass unit
https://physics.nist[...]
NIST
2021-04-18
[47]
문서
SI接頭語の一つであるヨクトを用いた1 Daの表現
[48]
서적
物理・科学の単位・記号がまとめてわかる事典
ペレ出版
[49]
간행물
表7 SI単位で表される数値が実験的に求められる非SI単位
https://web.archive.[...]
(独)産業技術総合研究所 計量標準総合センター
[50]
문서
国際単位系(SI)第9版(2019), pp.114-115
[51]
간행물
表7注(c)
https://web.archive.[...]
(独)産業技術総合研究所 計量標準総合センター
[52]
문서
CODATA proton mass in u
[53]
문서
CODATA neutron mass in u
[54]
문서
NIST Relative Atomic Mass
[55]
논문
The Atomic Mass Unit
https://zenodo.org/r[...]
[56]
간행물
国際単位系(SI)、国際文書第8版(2006)
https://web.archive.[...]
[57]
웹사이트
unified atomic mass unit
https://physics.nist[...]
US National Institute of Standards and Technology
2019-05-20
[58]
문서
Gold Book A00497
[59]
문서
グリーンブック (2009) pp. 57-58
[60]
문서
グリーンブック (2009) p. 143
[61]
문서
CODATA molar mass constant
[62]
서적
Elements of Physical Chemistry 6th Edition
Oxford University Press
[63]
서적
Fundamentals of Nuclear Reactor Physics
Academic Press
[64]
서적
Biochemistry (6th ed.)
New York Freeman
[65]
웹인용
원자질량단위
https://terms.naver.[...]
2024-11-15
[66]
웹인용
CODATA Value: unified atomic mass unit
http://physics.nist.[...]
2017-05-06
[67]
서적
The International System of Units
http://www.bipm.org/[...]
[68]
서적
Physical Chemistry for the Biosciences
[69]
서적
Chemistry: The Practical Science
https://archive.org/[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com