단백질 표적화
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
단백질 표적화는 세포 내에서 단백질이 특정 위치로 이동하는 과정을 의미한다. 1970년대 귄터 블로벨의 연구를 통해 단백질 표적화의 기본 원리가 밝혀졌으며, 단백질 내의 표적 신호(신호 펩타이드, 신호 패치 등)가 세포 내 수송 기구를 통해 단백질을 특정 세포소기관으로 이동시키는 역할을 한다. 단백질 표적화는 번역 동시 전위와 번역 후 전위 두 가지 경로를 통해 이루어지며, 소포체, 미토콘드리아, 엽록체, 퍼옥시좀, 핵 등 다양한 세포소기관으로 단백질을 운반한다. 이러한 과정의 이상은 젤웨거 증후군, 부신백질이영양증 등과 같은 질병을 유발할 수 있으며, 생물정보학 도구를 통해 단백질 표적화 서열을 예측하고 분석할 수 있다.
더 읽어볼만한 페이지
- 단백질 표적화 - 트랜스로콘
트랜스로콘은 세균의 SecYEG, 진핵생물의 Sec61로 불리는 삼량체 단백질 복합체이며, 단백질이 세포막을 통과하도록 돕는 채널로서, 펩타이드의 양방향 이동을 가능하게 하고, 공동 번역 및 번역 후 트랜스로케이션 과정을 거치며, 소포체 내강의 손상된 단백질을 세포질로 이동시켜 분해를 돕는 역할을 한다. - 막 단백질 - 나트륨-칼륨 펌프
나트륨-칼륨 펌프는 ATP 에너지를 사용하여 나트륨 이온과 칼륨 이온을 세포 내외로 능동 수송하는 막 단백질로, 세포의 휴지 전위 유지, 물질 수송, 세포 부피 조절 등 생리적 기능 수행 및 세포 활동 조절에 중요한 역할을 한다. - 막 단백질 - 짝풀림 단백질
짝풀림 단백질은 미토콘드리아 내막에서 양성자 흐름을 조절하여 ATP 합성 없이 열을 발생시키는 단백질로, 포유류에는 5가지 종류가 있으며, 체온 유지, 활성 산소 농도 조절, 뉴런 기능 등에 관여한다. - 번역 후 변형 - 단백질 카보닐화
- 번역 후 변형 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다.
| 단백질 표적화 | |
|---|---|
| 개요 | |
| 분야 | 분자생물학, 세포생물학 |
| 하위 분야 | 단백질 합성 소포체 골지체 리소좀 미토콘드리아 엽록체 퍼옥시좀 |
| 관련 과정 | 단백질 합성 단백질 수송 단백질 번역 후 변형 단백질 분해 |
| 상세 내용 | |
| 정의 | 세포 내에서 단백질이 올바른 위치로 이동하는 과정 |
| 메커니즘 | 신호 펩타이드 수송 단백질 막 횡단 수송 소포 수송 |
| 관련 질병 | 낭포성 섬유증 알츠하이머병 파킨슨병 |
| 중요성 | 세포 기능 유지, 세포 소기관의 정확한 구성, 세포 생존 |
| 연구 분야 | 단백질 구조 연구 세포 소기관 연구 단백질 수송 메커니즘 연구 질병 치료 연구 |
| 관련 기술 | 유전자 재조합 기술 단백질 분리 및 정제 기술 세포 이미징 기술 질량 분석법 |
| 역사 | 조지 팔라데 (단백질 합성 및 분비 경로 연구) 귄터 블로벨 (신호 가설) |
| 미래 연구 방향 | 단백질 표적화의 정확성 및 효율성 향상 새로운 단백질 표적화 경로 발견 단백질 표적화 오류로 인한 질병 치료법 개발 |
| 추가 정보 | |
| 관련 용어 | 신호 펩타이드 (signal peptide) 소포체 (endoplasmic reticulum, ER) 골지체 (Golgi apparatus) 리소좀 (lysosome) 미토콘드리아 (mitochondria) 엽록체 (chloroplast) 퍼옥시좀 (peroxisome) 단백질 수송 (protein translocation) 단백질 번역 후 변형 (post-translational modification) 단백질 분해 (protein degradation) |
| 참고 문헌 | Nelson DL, Cox MM, Lehninger AL. Lehninger principles of biochemistry. Seventh edition. New York, NY: W.H. Freeman; January 2017. Lodish, Berk, Kaiser, Krieger, Bretscher, Ploegh, Martin, Yaffe, Amon. Molecular Cell Biology. 9th ed. New York, NY: W.H. Freeman and Company; 2021. Blobel G, Dobberstein B. Transfer of proteins across membranes. I. Presence of proteolytically processed and unprocessed nascent immunoglobulin light chains on membrane-bound ribosomes of murine myeloma. The Journal of Cell Biology. 1975 Dec;67(3):835–51. Schmidt V, Willnow TE. Protein sorting gone wrong--VPS10P domain receptors in cardiovascular and metabolic diseases. Atherosclerosis. 2016 Feb;245:194–9. Guo Y, Sirkis DW, Schekman R. Protein sorting at the trans-Golgi network. Annual Review of Cell and Developmental Biology. 2014 Oct 11;30(1):169–206. |
2. 역사
1970년, 귄터 블로벨은 막을 통한 단백질 이동에 대한 실험을 수행했다. 당시 록펠러 대학교의 조교수였던 블로벨은 동료 조지 팔라데의 연구를 바탕으로 했다.[6] 팔라데는 이전에 비분비 단백질은 세포질 내 자유 리보솜에 의해 번역되는 반면, 분비 단백질(그리고 일반적으로 표적 단백질)은 소포체에 결합된 리보솜에 의해 번역된다는 것을 증명했다.[6] 당시 유력한 설명은 자유 리보솜과 ER 결합 리보솜 사이의 가공 차이를 가정했지만, 블로벨은 단백질 표적화가 리보솜의 차이보다는 단백질 고유의 특성에 의존한다고 가설을 세웠다. 그의 가설을 뒷받침하기 위해 블로벨은 많은 단백질이 세포 내 또는 세포 외 목적지를 지정하는 우편 번호와 같은 기능을 하는 한쪽 끝에 짧은 아미노산 서열을 가지고 있음을 발견했다.[3] 그는 이 짧은 서열(일반적으로 13~36개의 아미노산 잔기)[1]를 신호 펩타이드 또는 신호 서열이라고 묘사했으며, 이 공로로 1999년 노벨 생리학·의학상을 수상했다.[7]
표적 신호는 세포 수송체가 단백질을 세포 내부 또는 외부에 정확하게 위치시킬 수 있게 하는 신호이다. 이 정보는 폴리펩타이드 사슬 또는 접힌 단백질에 포함되어 있다. 표적화를 가능하게 하는 사슬 내 아미노산 잔기의 연속을 시그널 펩타이드 또는 표적 펩타이드라고 한다. 표적 펩타이드에는 사전 서열 펩타이드와 내부 표적화 펩타이드 두 가지 유형이 있다. 표적화 펩타이드의 사전 서열은 종종 N 말단 연장부에서 발견되며 6~136개의 염기성 및 소수성 아미노산으로 구성된다. 퍼옥시좀의 경우, 표적화 서열은 주로 C 말단 연장에 존재한다.
3. 표적화 신호
1970년, 귄터 블로벨은 막을 통한 단백질 이동에 대한 실험을 수행했다. 당시 록펠러 대학교의 조교수였던 블로벨은 동료 조지 팔라데의 연구를 바탕으로 했다.[6] 팔라데는 이전에 비분비 단백질은 세포질 내 자유 리보솜에 의해 번역되는 반면, 분비 단백질(그리고 일반적으로 표적 단백질)은 소포체에 결합된 리보솜에 의해 번역된다는 것을 증명했다.[6] 당시 유력한 설명은 자유 리보솜과 ER 결합 리보솜 사이의 가공 차이를 가정했지만, 블로벨은 단백질 표적화가 리보솜의 차이보다는 단백질 고유의 특성에 의존한다고 가설을 세웠다. 그의 가설을 뒷받침하기 위해 블로벨은 많은 단백질이 세포 내 또는 세포 외 목적지를 지정하는 우편 번호와 같은 기능을 하는 한쪽 끝에 짧은 아미노산 서열을 가지고 있음을 발견했다.[3] 그는 이 짧은 서열(일반적으로 13~36개의 아미노산 잔기)[1]을 신호 펩타이드 또는 신호 서열이라고 묘사했으며, 이 공로로 1999년 노벨 생리학·의학상을 수상했다.[7]
신호 패치는 단백질의 1차 서열 상에서는 분리되어 있지만, 3차 구조에서 서로 모여 형성되는 표적화 신호이다. 단백질 접힘 이후 기능하며, 시그널 펩타이드와 달리 절단되지 않는다. 글리코실화와 같은 번역 후 변형도 단백질 표적화를 유도할 수 있다.
3. 1. 신호 펩타이드 (Signal peptide)
신호 펩타이드는 표적화 신호 역할을 하며, 세포 내 수송 기구가 단백질을 특정 세포 내 또는 세포 외 위치로 이동하도록 지시한다. 합의 서열은 확인되지 않았지만, 많은 신호 펩타이드는 다음과 같은 특징적인 세 부분 구조를 가진다.[1]
# N-말단 근처에 양전하를 띠는 친수성 영역.
# 신호 펩타이드 중간 부근의 10~15개 소수성 아미노산 영역.
# C-말단 근처의 약간 극성 영역, 일반적으로 절단 부위에 접근하는 위치에 작은 측쇄를 가진 아미노산을 선호한다.
단백질이 목적지에 도달하면 신호 펩타이드는 일반적으로 신호 펩티다제에 의해 절단된다.[1] 결과적으로, 대부분의 성숙한 단백질은 신호 펩타이드를 포함하지 않는다. 대부분의 신호 펩타이드는 N-말단에서 발견되지만, 페록시솜에서는 표적화 서열이 C-말단에 있다.[8]
3. 2. 신호 패치 (Signal patch)
신호 패치는 단백질의 1차 서열 상에서는 분리되어 있지만, 3차 구조에서 서로 모여 형성되는 표적화 신호이다. 단백질 접힘 이후 기능하며, 시그널 펩타이드와 달리 절단되지 않는다. 신호 패치는 1차 서열에서 분리된 부분으로 구성되지만, 접힐 때 단백질 표면에서 그 기능을 발휘한다.
3. 3. 기타 표적화 신호
글리코실화와 같은 번역 후 변형도 단백질 표적화를 유도할 수 있다.[1]
4. 단백질 전위 (Protein translocation)
1970년 권터 블로벨은 막을 통한 단백질 전위에 관한 실험을 통해, 많은 단백질들이 표적 소기관으로 이동하기 위한 일종의 우편 번호 역할을 하는 짧은 아미노산 서열인 시그널 펩타이드를 가지고 있음을 발견했다. 이 서열은 보통 13~36개의 아미노산 잔기로 구성된다.[1] 블로벨은 이 발견으로 1999년 노벨 생리학·의학상을 수상했다.[7]
리보솜에서 mRNA가 단백질로 번역되는 과정은 세포질에서 일어난다.[11] 이후, 생성된 단백질이 특정 세포 소기관으로 이동해야 할 경우, 번역 동시 전위 또는 번역 후 전위의 두 가지 방식으로 이동이 일어난다.[12]
번역 동시 전위와 번역 후 전위에 대한 자세한 내용은 각각 해당 문서를 참조하라.
4. 1. 번역 동시 전위 (Co-translational translocation)
1970년 권터 블로벨은 막을 통한 단백질 전위에 관한 실험을 통해, 많은 단백질들이 표적 소기관에 대한 일종의 우편 번호와 같은 기능을 하는 짧은 아미노산 서열인 시그널 펩타이드를 가지고 있음을 발견했다. 그는 이 공로로 1999년 노벨상을 수상했다.[13]리보솜에서 전령 RNA(mRNA)가 단백질로 번역되는 과정은 세포질에서 일어난다. 합성된 단백질이 다른 세포 소기관으로 이동해야 하는 경우, 단백질은 번역 동시 전위 또는 번역 후 전위 방식을 통해 수송될 수 있다. 번역 동시 전위는 단백질이 리보솜에서 합성되는 동안 소포체(ER), 골지체, 엔도솜 등으로 이동하는 방식이다.
대부분의 분비 단백질과 막 결합 단백질은 번역 동시 전위 과정을 거친다. 이 과정은 신호 인식 입자(SRP)가 새로 합성된 단백질의 N-말단 시호 펩타이드를 인식하면서 시작된다.[13] SRP가 결합하면 리보솜-단백질 복합체가 진핵생물의 ER, 원핵생물의 세포막에 있는 SRP 수용체로 이동하는 동안 합성이 일시 중단된다.[14] 이후, 새로 합성된 단백질은 트랜스로콘이라는 막 관통 채널에 삽입된다. 트랜스로콘은 진핵생물에서는 Sec61 전위 복합체, 원핵생물에서는 상동성 SecYEG 복합체로 구성된다.[15]
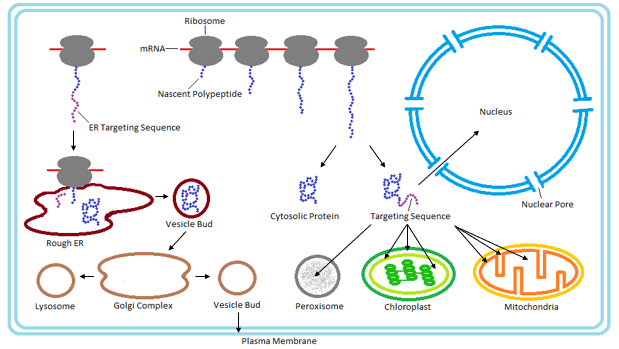
4. 1. 1. 소포체 (Endoplasmic reticulum, ER)
소포체(ER)는 진핵생물에서 단백질 합성과 수송을 담당하는 주요 세포 기관이다. 대부분의 단백질은 번역 동시 전위 경로를 통해 소포체로 이동한다. 이 과정은 리보솜에서 단백질이 합성되는 동안 신호 인식 입자(SRP)가 N-말단 신호 펩타이드를 인식하면서 시작된다. 리보솜-단백질 복합체는 진핵생물의 소포체에 있는 SRP 수용체로 이동하고, 합성은 일시 중단된다. 이후 초기 단백질은 트랜스로콘에 삽입되는데, 이는 진핵생물에서 Sec61 전위 복합체로 구성된 막 결합 단백질 전도 채널이다.[15]분비 단백질과 I형 막 단백질의 경우, 신호 서열은 신호 펩티다아제에 의해 ER 막으로 전위된 후 즉시 신생 폴리펩타이드에서 잘려 나간다. 반면, II형 막 단백질 및 일부 다중 토폴로지 막 단백질의 신호 서열은 잘리지 않아 신호 앵커 서열이라고 불린다. 소포체 내에서 단백질은 샤페론 단백질에 의해 덮여 올바른 단백질 폴딩을 위한 시간을 갖는다. 폴딩이 완료되면, 단백질은 필요에 따라 당화와 같은 변형을 거친 후 추가 처리를 위해 골지체로 수송되거나, 다양한 ER 유지 메커니즘에 의해 ER에 남게 된다.
막 수용체인 막 단백질의 아미노산 사슬은 막을 여러 번 통과할 수 있다. 이러한 단백질은 전위에 의해 막에 삽입되다가 전사 중지 서열(막 앵커 또는 신호 앵커 서열)에 의해 중단된다.[16] 7개의 막 관통 도메인을 갖는 G 단백질 연결 수용체는 대부분 아미노 말단 신호 서열을 가지고 있지 않다. 분비 단백질과 달리, 첫 번째 막 관통 도메인이 첫 번째 신호 서열 역할을 하여 ER 막으로 표적화되며, 이는 단백질의 아미노 말단이 ER 막 내강으로 전위되는 결과를 낳는다. 옵신을 사용한 시험관 내 실험에서 증명된 바와 같이,[17][18] 이러한 전위는 ER로 표적화된 포유류 단백질에서 일반적으로 나타나는 "동시 번역" 전위 패턴과는 다르다.
4. 1. 2. 막관통 단백질 (Transmembrane protein)
막관통 단백질은 세포막을 한 번 또는 여러 번 통과하는 단백질이다. 이러한 단백질은 전위에 의해 막에 삽입되다가, 정지-전달 서열(막 앵커 또는 신호 앵커 서열이라고도 함)에 의해 전위 과정이 중단된다.[16] 막관통 단백질은 현재 분비 단백질을 위해 개발된 표적 모델을 사용하여 이해되고 있다. 그러나 다수의 복잡한 다중 막 통과 단백질은 이 모델에 적합하지 않은 구조적 측면을 포함한다. 7개의 막을 통과하는 G 단백질 결합 수용체(인간 유전자의 약 5%를 차지함)는 대부분 아미노 말단 신호 서열을 가지고 있지 않다. 분비 단백질과는 달리, 제1 막 횡단 도메인은 제1 신호 서열로서 작용하여 소포체 막에 표적화된다. 이는 또한 단백질의 아미노 말단이 소포체 막 내강으로 전위되는 결과를 낳는다. 이는 소포체를 표적으로 하는 포유류 단백질에서 항상 유지되어 온 번역 동시 전위 규칙을 어기는 것이며, 옵신을 사용한 인 비트로 실험에서 증명되었다.[17][18]4. 2. 번역 후 전위 (Post-translational translocation)
1970년에 권터 블로벨은 막을 통한 단백질의 전위에 관한 실험을 수행하여 1999년 노벨상을 수상했다. 그는 많은 단백질들이 시그널 펩타이드라는 짧은 아미노산 서열을 가지고 있으며, 이것이 표적 소기관으로의 이동에 중요한 역할을 한다는 것을 발견했다. 리보솜에 의한 전령 RNA의 번역은 세포질에서 일어나며, 합성된 단백질이 다른 세포소기관으로 이동하는 경우, 번역 동시 전위와 번역 후 전위의 두 가지 방식이 있다.대부분의 분비 단백질은 동시 번역적으로 전위되지만, 일부는 세포 기질에서 번역된 후 번역 후 시스템에 의해 소포체, 원형질막으로 운반된다. 원핵생물에서는 SecA, SecB와 같은 특정 보조인자가 필요하다. 이 경로는 진핵생물에서는 잘 이해되지 않지만, 2개의 막 결합 단백질인 Sec62, Sec63에 의해 촉진된다.[19] Sec63 복합체는 ATP의 가수 분해를 유발하여 샤페론 단백질이 펩타이드 사슬에 결합하여 폴리펩티드를 소포체 내강으로 이동시킨다. 내강에 들어가면 폴리펩티드 사슬이 적절하게 접힐 수 있다. 이 과정은 세포질에 위치한 펼쳐진 단백질에서만 발생한다.[20]
미토콘드리아, 엽록체 또는 퍼옥시좀과 같은 다른 목적지를 표적으로 하는 단백질은 번역 후 경로를 특수하게 사용한다. 또한 핵을 목표로 하는 단백질은 핵 국소화 신호 (NLS)를 통해 핵공을 통과하여 핵막을 지나 번역 후 전위된다.[21]
5. 세포소기관별 단백질 분류
단백질 표적화는 세포 내에서 합성된 단백질이 특정 세포소기관으로 이동하는 기작을 의미한다. 세포소기관별로 단백질을 분류하면 다음과 같다.
- 미토콘드리아: 대부분의 미토콘드리아 단백질은 세포질에서 합성되며, 흡수 펩타이드 신호를 통해 미토콘드리아로 이동한다. 샤페로닌 단백질은 이 과정을 돕고, 단백질은 서열에 따라 미토콘드리아 기질, 외막, 막간 공간, 내막 등 다양한 위치로 이동한다.
- 엽록체: 엽록체 단백질은 기질 수입 서열 또는 기질 및 틸라코이드 표적화 서열을 가지며, TIC/TOC 복합체를 통해 엽록체로 이동한다. 스트로마에서 수입 서열이 절단되고, 단백질은 틸라코이드 등으로 추가 정렬된다.
- 퍼옥시좀: 퍼옥시좀 단백질은 퍼옥시좀 표적 신호(PTS)를 가지며, PTS1과 PTS2 두 가지 유형이 있다. 이 신호에 따라 PEX5 등의 단백질이 퍼옥시좀으로 단백질을 이동시킨다.
- 핵: 핵으로 이동하는 단백질은 핵 국소화 신호를 가지며, 핵 수입 수용체가 이 신호를 인식하여 핵공을 통해 단백질을 핵 안으로 이동시킨다.
5. 1. 미토콘드리아 (Mitochondria)
대부분의 미토콘드리아 단백질은 흡수 펩타이드 신호를 포함하는 세포질 전구체로 합성된다.[22][23][24][25] 세포기질 샤페로닌은 미토콘드리아 막에 연결된 수용체를 채널로 단백질을 전달한다. 미토콘드리아로 표적화된 세포질 샤페론 단백질 hsp70에 의해 결합된 변성 단백질은 서열에 따라 미토콘드리아 기질, 외막, 막간 공간, 또는 내막의 네 가지 다른 영역으로 위치할 수 있다.[2][25][26]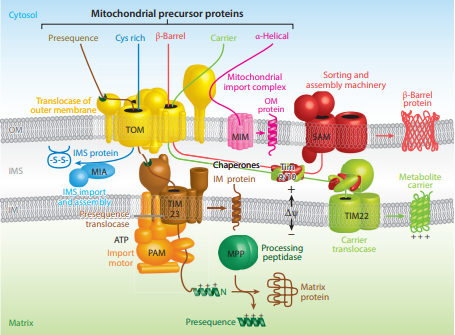
미토콘드리아 기질로 향하는 단백질은 시작 부분(N-말단)에 20~50개의 아미노산으로 구성된 특정 신호 서열을 갖는다. 이러한 서열은 단백질을 미토콘드리아 내부의 올바른 위치로 안내하는 수용체와 상호 작용하도록 설계되었다. 이 서열은 친수성 아미노산과 소수성 아미노산의 클러스터로 독특한 구조를 가지며, 이는 양쪽성을 부여한다. 이러한 양쪽성 서열은 일반적으로 한쪽에는 전하를 띤 아미노산이, 반대쪽에는 소수성 아미노산이 있는 나선형(알파 나선)을 형성한다. 이 구조적 특징은 단백질을 기질로 유도하는 데 있어 서열이 올바르게 기능하는 데 필수적이다.[33]
미토콘드리아 기질을 표적으로 하는 단백질은 먼저 N-말단에 위치한 기질 표적 서열과 외부 막 수입 수용체 복합체 TOM20/22 사이의 상호 작용을 포함한다.[2][23][28] 또한 내부 서열과 세포질 샤페론이 TOM70에 결합한다.[2][23][28] 여기서 TOM은 외부 막의 전위 이동(translocase of the outer membrane)의 약자이다. 기질 표적 서열이 수입 수용체에 결합하면 폴리펩타이드가 TOM40으로 알려진 일반 수입 코어(GIP)로 전달된다.[2][23][28] 일반 수입 코어(TOM40)는 폴리펩타이드 사슬을 막간 공간을 통해 내막에 위치한 또 다른 전위 이동 복합체 TIM17/23/44로 보낸다.[2][24][25][29] 이는 미토콘드리아에 들어가기 전에 펼쳐진 상태를 유지하는 세포질 샤페론의 필수적인 방출을 동반한다. 폴리펩타이드가 기질에 들어가면 신호 서열은 처리 펩티다아제에 의해 절단되고, 나머지 서열은 미토콘드리아 샤페론에 의해 결합되어 적절한 폴딩 및 활성을 기다린다.[25][26]
산화적 인산화 동안 미토콘드리아에 의해 설정된 전기화학적 기울기에 의해 세포질에서 막간 공간으로, 그리고 기질로 폴리펩타이드의 밀고 당김이 이루어진다.[1][24][25][26] 대사에 활성적인 미토콘드리아는 기질 내부에 음전위를 생성하고 막간 공간에 양전위를 생성한다.[25][30] 표적 서열의 양전하 부위를 원하는 위치로 유도하는 것은 기질 내부의 이러한 음전위이다.
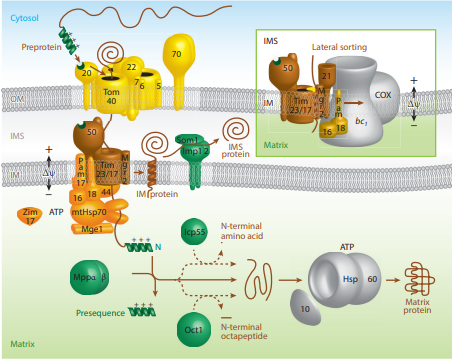
미토콘드리아 단백질의 내막 표적화는 전체 서열에 따라 3가지 다른 경로를 따를 수 있지만, 외막으로부터의 진입은 수입 수용체 복합체 TOM20/22 및 TOM40 일반 수입 코어를 사용하여 동일하게 유지된다.[2][24]
내막을 표적으로 하는 단백질의 첫 번째 경로는 매트릭스로 지정된 단백질과 동일한 단계를 따르며, 여기에는 폴리펩티드를 전위 복합체 TIM17/23/44를 포함하는 내막 복합체로 유도하는 매트릭스 표적 서열이 포함된다.[2][24][25] 그러나 매트릭스가 아닌 내막으로 지정된 펩타이드에는 stop-transfer-anchor 서열이라고 하는 상위 서열이 포함되어 있다는 차이점이 있다.[2] 이 stop-transfer-anchor 서열은 소수성 영역으로, 내막의 인지질 이중층에 삽입되어 미토콘드리아 내부로의 추가적인 전위를 방지한다.[24][25]
내막을 표적으로 하는 단백질의 두 번째 경로는 매트릭스 국소화 경로를 전체적으로 따른다. 그러나 stop-transfer-anchor 서열 대신, 매트릭스 내에서 Oxa-1이라고 하는 내막 단백질과 상호 작용하여 내막에 삽입하는 또 다른 서열을 포함한다.[2][24][25]
내막을 표적으로 하는 미토콘드리아 단백질의 세 번째 경로는 다른 단백질과 마찬가지로 외막으로 들어가는 경로를 따르지만, 이 경로는 막으로 들어오는 펩타이드를 고정하기 위해 막간 공간에서 복합체 TIM9/10의 도움을 받는 전위 복합체 TIM22/54를 사용한다.[2][24][25] 이 마지막 경로의 펩타이드는 매트릭스 표적 서열을 포함하지 않고 대신 여러 내부 표적 서열을 포함한다.
전구 단백질이 미토콘드리아의 내막 간 공간으로 지정되면, 인식되는 서열에 따라 두 가지 경로가 있다. 내막 간 공간으로 향하는 첫 번째 경로는 내막 표적 단백질과 동일한 단계를 따른다. 그러나 내막에 결합되면 고정된 단백질의 C-말단은 펩티다제를 통해 절단되어 전구 단백질을 내막 간 공간으로 방출하여 활성 상태로 접힐 수 있도록 한다.[2][25] 이 경로를 따르는 단백질의 가장 좋은 예 중 하나는 절단된 후 헴 보조 인자와 상호 작용하여 활성화되는 사이토크롬 b2이다.[2][31] 두 번째 내막 간 공간 경로는 내막 복합체를 사용하지 않으므로 매트릭스 표적 신호가 포함되어 있지 않다. 대신 일반적인 수입 코어 TOM40을 통해 들어가 내막 간 공간에서 추가로 변형되어 활성 형태를 갖게 된다. TIM9/10은 내막 표적화를 돕기 위해 필요한 위치에 있기 위해 이 경로를 따르는 단백질의 예이다.[2][25][32]
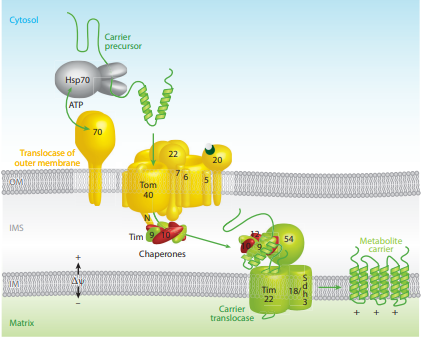
미토콘드리아 외막 표적화는 전구 단백질이 외막 통과 복합체와 상호 작용하는 것을 포함하며, 이는 소수성 알파 나선 또는 인지질 이중층을 가로지르는 베타 배럴을 형성하는 내부 표적 시퀀스를 통해 막에 삽입된다.[2][24][25] 이는 전구 단백질 내부 시퀀스에 따라 두 가지 다른 경로로 발생할 수 있다. 전구 단백질에 알파 나선을 형성할 수 있는 내부 소수성 영역이 포함되어 있으면 전구 단백질은 미토콘드리아 수입 복합체(MIM)를 사용하고 측면으로 막으로 이동된다.[24][25] 베타 배럴 형성 단백질과 관련된 소수성 내부 시퀀스를 포함하는 전구 단백질의 경우, 앞서 언급한 외막 복합체 TOM20/22에서 내막 공간으로 수입된다. 이들은 분류 및 조립 기계 (SAM)로 이동하는 TIM9/10 내막 공간 단백질 복합체와 상호 작용하여 표적 단백질을 베타 배럴로 측면으로 이동시킨다.[24][25]
미토콘드리아 외막 수용체에는 다음 3가지가 있다.
TOM 채널(TOM40)은 분자량이 410kDa이고 기공 직경이 21Å인 양이온이 많은 채널이다.
전서열 translocase23 (TIM23)은 미토콘드리아 내막에 국한되어 있으며 전구체 단백질과 N 말단을 결합시키는 기공 형성 단백질을 작용시킨다. TIM23은 미토콘드리아 매트릭스, 내부 미토콘드리아 막 및 자궁 내막 공간을 위한 예비 단백질에 대한 전위기 역할을 한다. TIM50은 내부 미토콘드리아 측에서 TIM23에 결합하고 전치 서열에 결합하는 것으로 밝혀졌다. TIM44가 매트릭스 측에 결합되어 mtHsp70에 결합하는 것으로 밝혀졌다. 전서열 translocase22 (TIM22)는 내부 미토콘드리아 막에 독점적으로 결합된 예비 단백질에 결합한다.
미토콘드리아 세포질 표적화 서열은 양으로 하전된 아미노산 및 하이드록실화된 것이 풍부하다. 단백질은 다수의 신호 및 몇몇 경로에 의해 복막 외 구획을 목표로 한다. 외부 막, 막간 공간, 내부 막을 표적화하는 것은 매트릭스 표적화 서열 외에 다른 신호 서열을 필요로 한다.
5. 2. 엽록체 (Chloroplast)
엽록체의 전단백질은 기질 수입 서열 또는 기질 및 틸라코이드 표적화 서열을 함유할 수 있다. 전단백질의 대부분은 엽록체 외피 내에 위치한 Toc 및 Tic 복합체를 통해 전위된다. 스트로마에서 스트로마 수입 서열은 절단되어 접혀지며 틸라코이드에 대한 엽록체 정렬이 계속된다. 엽록체의 외피를 표적으로 하는 단백질은 일반적으로 절단 가능한 분류 순서가 부족하다.[2]미토콘드리아와 엽록체에는 많은 단백질이 필요하다. 일반적으로 표적화 펩타이드는 2개의 특정 펩타이드에 대해 중간 특성을 갖는다. 이들 단백질의 표적화 펩타이드는 높은 함량의 염기성 및 소수성 아미노산, 음으로 하전된 아미노산을 갖는다. 그들은 알라닌 함량이 낮고 류신 및 페닐알라닌 함량이 높다. 이중 표적 단백질은 미토콘드리아 및 엽록체 단백질보다 더 소수성 표적화 펩타이드를 갖는다.
엽록체는 자체 DNA를 가지고 있어 일부 구성 요소를 생산한다는 점에서 미토콘드리아와 유사하다. 그러나 대부분의 단백질은 번역 후 전위 과정을 거쳐 핵 유전자에서 생성된다. 단백질은 겉막, 속막, 기질, 틸라코이드 루멘 또는 틸라코이드 막과 같은 서열에 따라 엽록체의 여러 부위로 표적화될 수 있다.[2] 단백질은 세균 단백질 전위와 관련된 메커니즘에 의해 틸라코이드로 표적화된다.[33] 엽록체 외피로 표적화된 단백질은 일반적으로 절단 가능한 분류 서열이 없고 막 분류 복합체를 통해 측면으로 이동한다.
대부분의 전구 단백질에 대한 일반적인 수입은 엽록체 외피 내에 위치한 Toc 및 Tic 복합체를 통해 세포질에서 전위가 필요하다. 여기서 Toc는 엽록체 외막의 전위 효소의 약자이고 Tic는 엽록체 내막의 전위 효소의 약자이다. Toc 복합체의 기능을 구성하는 최소 3개의 단백질이 있다. 그 중 Toc159와 Toc34로 불리는 두 개의 단백질은 기질 수입 서열의 도킹을 담당하며 둘 다 GTPase 활성을 가지고 있다. Toc75로 알려진 세 번째 단백질은 Toc159/34에 의해 인식된 전구 단백질을 엽록체로 공급하는 실제 전위 채널이다.[34]
단백질을 스트로마로 표적화하려면, 전구 단백질이 Toc 복합체에 의해 외막을 통해 이동된 후 내막의 Tic 복합체에 의해 인식되는 스트로마 수입 서열을 가져야 한다. Tic 복합체는 내막을 가로지르는 이동 채널을 형성하는 데 필요한 최소 5가지 다른 Tic 단백질로 구성된다.[35] 스트로마로 전달되면 스트로마 수입 서열은 신호 펩티다제를 통해 잘려나간다. 이 스트로마로의 전달 과정은 현재 단백질 수입을 추진하기 위해 미토콘드리아에 확립된 막 횡단 전기화학적 기울기 대신 스트로마 HSP 샤페론을 통해 ATP 가수 분해에 의해 구동되는 것으로 알려져 있다.[34] 추가적인 엽록체 내 정렬은 틸라코이드 막 또는 틸라코이드 루멘에 지정된 것과 같은 추가적인 표적 서열에 따라 달라진다.
단백질이 틸라코이드 루멘으로 표적화되려면, 세균 단백질 수송 메커니즘과 매우 유사한 네 가지 다른 경로를 통해 이루어질 수 있다. 어떤 경로를 따를지는 스트로마로 전달되는 단백질이 펼쳐진 상태인지 금속 결합된 접힌 상태인지에 따라 달라진다. 이 두 가지 경우 모두 루멘으로 들어갈 때 절단되는 틸라코이드 표적화 서열을 포함한다. 단백질이 스트로마로 수입되는 것은 ATP에 의해 구동되지만, 금속 결합된 접힌 상태의 단백질이 틸라코이드 루멘으로 가는 경로는 pH 기울기에 의해 구동되는 것으로 나타났다.
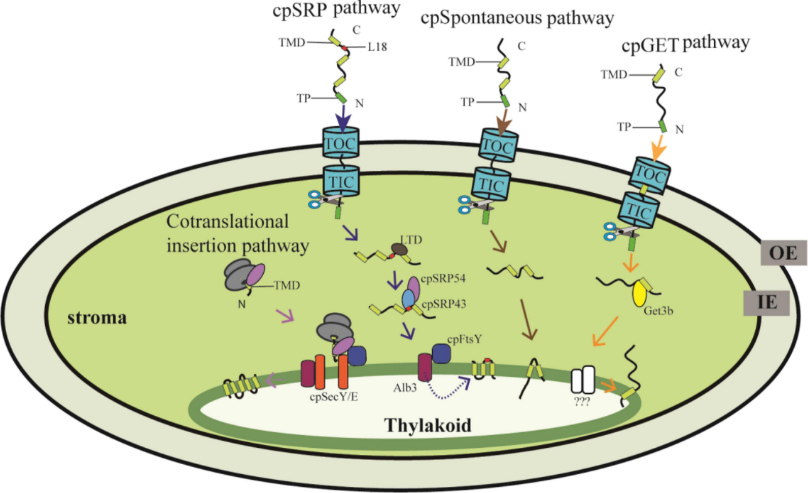
틸라코이드 막으로 향하는 단백질은 위 그림에 나와 있는 네 가지 경로를 따를 수 있다.
5. 3. 퍼옥시좀 (Peroxisome)
퍼옥시좀은 동화 작용과 이화 작용에 참여하는 다양한 단백질과 효소를 포함하는 퍼옥시좀 기질을 둘러싸는 단일 인지질 이중층으로 구성된 세포 소기관이다. 퍼옥시좀은 분자 산소를 사용하여 특정 산화 반응을 수행한다. 퍼옥시좀의 주요 기능은 유기 분자에서 수소 원자를 제거하여 과산화 수소(H2O2)를 생성하는 것이다.[38][20] 퍼옥시좀 내 카탈라아제는 생성된 과산화수소를 사용하여 페놀, 개미산, 포름알데히드, 알코올 등 다른 물질을 산화시키는 "과산화" 반응을 수행한다.[38][20]
퍼옥시좀은 간과 신장 세포에서 혈류로 들어가는 유해 물질을 해독하는 데 중요하며, 섭취하는 에탄올의 약 25%를 아세트알데히드로 산화시킨다.[38] 또한 퍼옥시좀 내 카탈라아제는 과도한 과산화수소를 물과 산소로 분해하여 H2O2 축적으로 인한 손상을 예방한다.[38][20] 미토콘드리아나 엽록체와 달리 내부 DNA가 없기 때문에 모든 퍼옥시좀 단백질은 핵 유전자에 의해 암호화된다.[37]
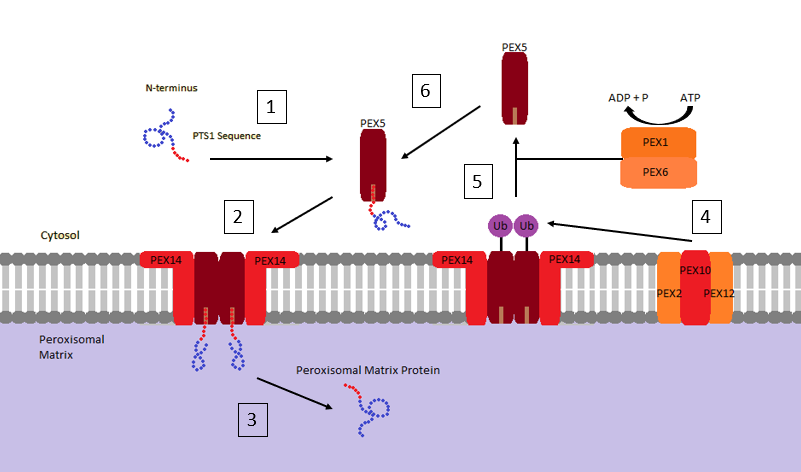
현재까지 알려진 퍼옥시좀 표적 신호(PTS)에는 두 가지 유형이 있다.
# '''퍼옥시좀 표적화 신호 1 (PTS1)''': (S/A/C)-(K/R/H)-(L/A) 컨센서스 서열을 갖는 C-말단 삼중 펩타이드. 가장 흔한 PTS1은 세린-라이신-류신(SKL)이다.[38] 초기 연구에서 반딧불이 루시페라아제가 배양된 곤충 세포에서 발현될 때 퍼옥시좀으로 표적화되는 것을 관찰, 유전자 돌연변이 테스트를 통해 컨센서스 서열을 결정했다.[39] SKL C-말단 서열을 세포질 단백질에 추가하면 퍼옥시좀으로 수송된다. 대부분의 퍼옥시좀 기질 단백질은 PTS1 유형 신호를 갖는다.
# '''퍼옥시좀 표적화 신호 2 (PTS2)''': (R/K)-(L/V/I)-XXXXX-(H/Q)-(L/A/F) 컨센서스 서열을 갖는 N-말단 근처 9개 아미노산 펩타이드 (X는 임의의 아미노산).[38]
이러한 신호가 없는 단백질은 "편승" 메커니즘을 통해 PTS1을 가진 기질 단백질과 결합하여 퍼옥시좀 기질로 이동한다.[40]
PTS1 C-말단 서열을 가진 세포질 단백질은 펙스5(peroxin 5)와 결합하여 퍼옥시좀 기질로 이동한다. 펙스5는 퍼옥시좀 막 단백질 펙스14와 상호작용하여 복합체를 형성하고, 표적 단백질을 기질로 방출한다. 이후 펙스2, 펙스12, 펙스10으로 구성된 막 복합체에 의한 유비퀴틴화와 펙스1, 펙스6을 포함하는 ATP 의존적 제거를 통해 펙스5가 펙스14로부터 분리된다.[42] 펙스5 매개 수입 주기는 유비퀴틴의 ATP 의존적 제거 후 복원되어 PTS1 서열을 포함하는 다른 단백질과 결합할 수 있다.[41] PTS2 표적 서열을 포함하는 단백질은 다른 세포질 단백질에 의해 매개되지만, PTS1 서열을 포함하는 단백질과 유사한 메커니즘을 따르는 것으로 여겨진다.[38]
5. 4. 핵 (Nucleus)
세포의 핵은 두 겹으로 구성된 핵막으로 둘러싸여 있으며, 내부 층은 염색체와 핵 라미나에 대한 구조적 지지 및 닻 역할을 한다.[16] 외부 층은 소포체(ER) 막과 유사하다. 이 막에는 약 30가지의 서로 다른 단백질로 만들어진 복잡한 구조인 핵공이 있다.[16] 이 공들은 핵 안팎으로 분자의 흐름을 제어하는 선택적인 관문 역할을 한다.작은 분자는 이러한 공을 문제없이 통과할 수 있지만, RNA와 핵으로 향하는 단백질과 같은 더 큰 분자는 통과하기 위해 특정 신호를 가져야 한다.[20] 이러한 신호는 핵 국소화 신호로 알려져 있으며, 일반적으로 라이신이나 아르기닌과 같이 양전하를 띠는 아미노산이 풍부한 짧은 서열로 구성된다.[16]
핵 수입 수용체라고 하는 단백질은 이러한 신호를 인식하고, 핵공을 채우는 무질서하고 그물과 같은 단백질과 상호 작용하여 큰 분자를 핵공을 통해 안내한다.[16] 이 과정은 역동적이며, 수용체가 분자를 그물망을 통해 이동시켜 핵에 도달하게 한다.[20]
일단 내부로 들어가면, GTP에 결합된 형태와 GDP에 결합된 형태, 두 가지 다른 형태로 존재할 수 있는 Ran이라고 하는 GTP 가수분해 효소가 핵 내부에서 화물의 방출을 촉진하고 수용체를 세포질로 재활용한다.[16][20] 이 수송에 대한 에너지는 Ran에 의한 GTP의 가수 분해로부터 발생한다. 마찬가지로, 핵 수출 수용체는 다른 신호를 사용하여 단백질과 RNA를 핵 밖으로 이동시키는 데 도움을 주며, 또한 Ran의 에너지 변환을 활용한다.[16]
전반적으로 핵공 복합체는 고속으로 거대 분자를 효율적으로 수송하여, 단백질이 접힌 상태로 이동하고 리보솜 구성 요소가 완전한 입자로 이동할 수 있도록 하며, 이는 대부분의 다른 세포 소기관으로 단백질이 수송되는 방식과 다르다.[16]
6. 세균 및 고균에서의 단백질 표적화
원핵생물의 막 결합 및 분비 단백질은 대부분 세균 SRP를 이용하는 번역 동시 경로 또는 SecA 및 SecB를 필요로 하는 번역 후 경로에 의해 원형질막으로 표적화된다. 이 두 경로는 원형질막에서 단백질을 SecYEG 트랜스로콘으로 전달하여 전좌시킨다. 세균은 단일 원형질막(그람 양성 세균)을 가지거나, 내막과 주변 세포질로 분리된 외막(그람 음성 세균)을 가질 수 있다. 대부분의 원핵생물은 진핵생물에 있는 막 결합 세포 소기관이 없지만, 가스 소포나 저장 과립과 같은 다양한 유형의 봉입체에 단백질을 조립할 수 있다.
그람 음성 세균의 단백질은 원형질막, 외막, 주변 세포질에 위치하거나 환경으로 분비될 수 있다. 세포 외막을 가로질러 단백질을 분비하는 시스템은 복잡하며 병원성에서 중요한 역할을 한다. 이러한 시스템에는 타입 I 분비, 타입 II 분비 등이 있다.
대부분의 그람 양성 세균에서 특정 단백질은 원형질막을 통해 외부로 나와 세균 세포벽에 공유 결합으로 부착되도록 표적화된다. 특수 효소인 소타제(sortase)는 LPXTG 모티프 (여기서 X는 임의의 아미노산)와 같은 단백질 C 말단 근처의 특정 인식 부위에서 표적 단백질을 절단한 후, 단백질을 세포벽으로 옮긴다. 이와 유사하게 세포 외면, C 말단 막 횡단 도메인, 단백질의 극한 C 말단 세포질 쪽에 염기성 잔기 클러스터를 특징으로 하는 여러 시스템이 발견되었다. 많은 그람 음성 세균에서 발견되는 PEP-CTERM/엑소소타제(exosortase) 시스템은 세포외 고분자 물질 생산과 관련이 있는 것으로 보인다. 고균의 PGF-CTERM/아르케소타제 A 시스템은 S-층 생산과 관련이 있다. Shewanella, Vibrio 및 몇몇 다른 속에서 발견되는 GlyGly-CTERM/롬보소타제 시스템은 단백질 분해 효소, 핵산 분해 효소 및 기타 효소의 방출에 관여하는 것으로 보인다.
7. 단백질 표적화 관련 질병
단백질 표적화 과정에 이상이 생기면 다양한 질병이 발생할 수 있다.
퍼옥시좀 관련 단백질 수송에 문제가 생기면 다음과 같은 유전 질환이 나타날 수 있다.
단백질 수송에 문제가 생길 경우, 아래와 같은 유전 질환들이 나타날 수 있다.
8. 생물정보학 도구 (Bioinformatic tools)
미니모티프 마이너(Minimotif Miner)는 단백질 서열 질의에서 알려진 단백질 표적화 서열 모티프를 검색하는 생물정보학 도구이다.[1] 포비우스(Phobius)는 주어진 1차 서열을 기반으로 신호 펩타이드를 예측한다.[2] 시그널P(SignalP)는 신호 펩타이드 절단 부위를 예측한다.[3] 로크트리(LOCtree)는 단백질의 세포 내 위치를 예측한다.[4]
참조
[1]
서적
Lehninger principles of biochemistry
https://www.worldcat[...]
2017-01
[2]
서적
Molecular Cell Biology
W.H. Freeman and Company
[3]
논문
Transfer of proteins across membranes. I. Presence of proteolytically processed and unprocessed nascent immunoglobulin light chains on membrane-bound ribosomes of murine myeloma
1975-12
[4]
논문
Protein sorting gone wrong--VPS10P domain receptors in cardiovascular and metabolic diseases
2016-02
[5]
논문
Protein sorting at the trans-Golgi network
2014-10-11
[6]
논문
Lost in translation: the signal hypothesis
2005-08
[7]
웹사이트
The Nobel Prize in Physiology or Medicine 1999
https://www.nobelpri[...]
2020-09-19
[8]
논문
Metabolic and molecular basis of peroxisomal disorders: a review
2004-05
[9]
논문
Hot spots--a review of the protein-protein interface determinant amino-acid residues
2007-09
[10]
간행물
Q39664981
[11]
논문
Protein targeting and transport as a necessary consequence of increased cellular complexity
2014-08
[12]
논문
Translocation of proteins across the endoplasmic reticulum. I. Signal recognition protein (SRP) binds to in-vitro-assembled polysomes synthesizing secretory protein
1981-11
[13]
논문
Toward a structural understanding of co-translational protein translocation
2016-08
[14]
논문
Co-translational targeting and translocation of proteins to the endoplasmic reticulum
2013-11
[15]
논문
Translocation of proteins through the Sec61 and SecYEG channels
2009-08
[16]
서적
Essential cell biology
https://www.worldcat[...]
2018-11
[17]
논문
"Co-translational targeting and translocation of the amino terminus of opsin across the endoplasmic membrane requires GTP but not ATP"
[18]
논문
"The amino terminus of opsin translocates "posttranslationally" as efficiently as cotranslationally"
[19]
논문
Protein translocation across the eukaryotic endoplasmic reticulum and bacterial plasma membranes
2007-11
[20]
서적
Molecular Cell Biology
W.H. Freeman and Company
2008
[21]
논문
Classical nuclear localization signals: definition, function, and interaction with importin alpha
2007-02
[22]
서적
Molecular Biology Principles and Practice
W.H. Freeman and Company
[23]
논문
Structural overview of the translocase of the mitochondrial outer membrane complex
2022
[24]
논문
Targeting and Insertion of Membrane Proteins in Mitochondria
2021
[25]
논문
Mitochondrial Machineries for Protein Import and Assembly
2017
[26]
논문
Transport of proteins into mitochondria
2001
[27]
논문
Mitochondrial protein transport in health and disease
2018
[28]
논문
Versatility of the mitochondrial protein import machinery
https://www.nature.c[...]
2001
[29]
논문
Protein translocation into mitochondria: the role of TIM complexes
2000
[30]
서적
Principles of Biochemistry
W.H. Freeman and Company
[31]
논문
Targeting of cytochrome b2 into the mitochondrial intermembrane space: specific recognition of the sorting signal.
1993
[32]
논문
Biogenesis of Tim Proteins of the Mitochondrial Carrier Import Pathway: Differential Targeting Mechanisms and Crossing Over with the Main Import Pathway
2017
[33]
서적
Molecular Cell Biology
W.H. Freeman and Company
[34]
논문
Protein import into chloroplasts
https://www.nature.c[...]
2004
[35]
논문
Toc, Tic, Tat et al.: structure and function of protein transport machineries in chloroplasts
https://pubmed.ncbi.[...]
2005
[36]
논문
Rather rule than exception? How to evaluate the relevance of dual protein targeting to mitochondria and chloroplasts
2018-12
[37]
서적
Encyclopedia of biological chemistry
https://www.worldcat[...]
2013-01-08
[38]
서적
Molecular Biology of the Cell
Garland Science
[39]
논문
Firefly luciferase is targeted to peroxisomes in mammalian cells
1987
[40]
논문
Pnc1 piggy-back import into peroxisomes relies on Gpd1 homodimerisation
2017-02
[41]
논문
Peroxisome protein import: a complex journey
2016
[42]
논문
Peroxisomal-protein import: is it really that complex?
2002
[43]
논문
RAB7L1 interacts with LRRK2 to modify intraneuronal protein sorting and Parkinson's disease risk
2013-02
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
