세포예정사
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
세포예정사(PCD)는 다세포 생물에서 일어나는 프로그램된 세포 사멸 과정으로, 세포의 형태 변화와 죽음을 유도한다. 1964년 곤충 조직 발달 연구에서 처음 사용되었으며, 아폽토시스, 자가포식, 괴사 등 여러 유형으로 분류된다. PCD는 신경계 발달, 식물 조직, 점균류 등 다양한 생물학적 과정에서 중요한 역할을 하며, 미토콘드리아의 진화와 DNA 손상, 암 발생과도 관련이 있다. 또한, 개체 전체의 죽음인 페노토시스와도 연관되며, 암 발생 및 전이에 중요한 영향을 미친다.
더 읽어볼만한 페이지
- 미토콘드리아 - 미토콘드리아 내막
미토콘드리아 내막은 크리스타 구조로 표면적을 넓혀 산화적 인산화 효율을 높이고 미토콘드리아 기질을 분리하며 물질대사에 중요한 역할을 하는 다양한 단백질과 수송체를 포함하고 특정 분자에 대해 조절된 투과성을 갖는 미토콘드리아의 안쪽 막이다. - 미토콘드리아 - 고동물
고동물은 미토콘드리아가 없는 원시 진핵생물이 존재했다는 가설에서 파생된 분류군이었으나, 이후 연구에서 아르케조아로 여겨졌던 생물들이 미토콘드리아를 잃어버린 생물로 밝혀지면서 가설과 분류군 모두 쇠퇴하고 폐기되었다. - 세포 노화 - 세포 주기
세포 주기는 세포가 성장하고 분열하여 두 개의 딸세포를 생성하는 과정으로, 간기(G1기, S기, G2기)와 분열기(핵분열 및 세포질 분열)로 나뉘어 사이클린과 CDK에 의해 조절되며, 세포 주기 검문점을 통해 DNA 손상 등을 감지하고 복구하여 정상적인 세포 분열을 보장하지만 조절 장애 시 종양 형성과 같은 질병을 유발할 수 있다. - 세포 노화 - 헬라 세포
헬라 세포는 1951년 헨리에타 랙스라는 자궁경부암 환자의 종양에서 유래된 최초의 인간 불멸 세포주로, 의학 연구에 큰 기여를 했지만 환자의 동의 없이 채취 및 사용되어 윤리적 논란을 야기했다. - 세포예정사 - 사이토크롬 c
사이토크롬 c는 진핵생물의 미토콘드리아 내막에 존재하는 전자 전달계 구성 요소이자 세포자멸사 관여 단백질로서, 작은 크기와 보존된 서열 덕분에 분자 계통학 연구에 활용되며 항산화 효소 및 저준위 레이저 치료에서의 역할 등 다양한 응용 가능성이 제시된다. - 세포예정사 - 오토파지
오토파지는 세포 내 구성 성분을 분해 및 재활용하여 항상성을 유지하고, 영양 결핍 시 에너지와 물질을 공급하는 과정으로, 거대 자가포식, 미세 자가포식, 샤페론 매개 자가포식의 세 유형으로 나뉘며, 오스미 요시노리의 노벨상 수상 이후 질병 치료 표적으로 연구가 활발하다.
| 세포예정사 | |
|---|---|
| 일반 정보 | |
 | |
| 발견 시기 | 1842년 |
| 발견자 | Carl Vogt |
| 연구 분야 | 세포 생물학 분자 생물학 생화학 |
| 상세 정보 | |
| 유형 | 세포 사멸 |
| 설명 | 프로그램된 세포 사멸은 다세포 생물에서 발생하여 세포가 자체 파괴되는 조절된 세포 사멸의 한 형태이다. |
| 관련 질병 | 암 신경퇴행성 질환 |
| 세포자멸사 | |
| 형태 | 세포질의 수축 염색질 응축 세포막의 수포 형성 세포자멸사 소체의 형성 |
| 과정 | 개시 단계 실행 단계 |
| 조절 | Bcl-2 단백질 IAP 단백질 미토콘드리아 |
| 기타 세포 사멸 유형 | |
| 유형 | 괴사 오토파지 각질화 네크롭토시스 |
| 유발 인자 | |
| 내부 요인 | DNA 손상 소포체 스트레스 산화 스트레스 |
| 외부 요인 | 세포자멸사 리간드 사이토카인 성장 인자 결핍 |
| 관련 용어 | |
| 관련 용어 | 카스파제 세포 사멸 소체 Bcl-2 패밀리 IAP 세포 주기 세포 신호 전달 |
2. 역사
세포 예정사(Programmed Cell Death, PCD)의 개념은 1964년 리처드 A. 록신과 윌리엄스가 곤충 조직 발달과 관련하여 사용했으며, 이는 "아폽토시스"라는 용어가 만들어지기 약 8년 전이었다.[7] PCD라는 용어는 혼란을 야기했으나, 듀런드와 램지는 기작적, 진화적 정의를 제공함으로써 이 개념을 발전시켰다.[8] PCD는 유전적 구성 요소를 가진 모든 다른 유형의 세포 죽음을 지칭하는 일반적인 용어가 되었다.
세포자살 (제1형 세포사)과 오토파지 (제2형 세포사)는 세포예정사(PCD)의 주요 유형이다. 세포예정사는 1964년 리처드 A. 록신과 윌리엄스에 의해 곤충 조직 발달과 관련하여 처음 사용되었다.[7]
세포예정사는 다세포 생물에서 발생할 수 있는 프로그래밍된 세포 사멸(PCD) 과정이다.[12] 생화학적 사건은 특징적인 세포 변화(형태)와 죽음으로 이어진다. 이러한 변화에는 블레브, 세포 수축, 핵 파편화, 염색질 응축, 염색체 DNA 파편화가 포함된다.[13]
이 기작에 대한 첫 번째 통찰은 BCL2 연구를 통해 얻어졌다. BCL2는 염색체 전좌에 의해 활성화되는 잠재적인 암 유전자의 산물로, 흔히 여포 림프종에서 발견된다. 다른 암 유전자들이 세포 증식을 자극하여 암을 촉진하는 것과 달리, BCL2는 림프종 세포가 스스로 죽지 못하게 하여 암을 촉진했다.[9]
PCD 연구는 점점 더 많은 관심과 노력을 받고 있다. 2002년 시드니 브레너(영국), H. 로버트 호비츠(미국), 존 설스턴(영국)이 노벨 생리학·의학상을 수상하면서 이러한 추세가 더욱 강조되었다.[10]
3. 분류
프로그램된 세포 사멸(PCD)은 형태학적 특징에 따라 세 가지 유형으로 분류된다.
; 유형 1 세포사
: 아폽토시스라고도 불리며, 염색질 응축(핵농축)과 핵 단편화(핵붕괴)가 특징이다. 동물에서 흔히 볼 수 있는 PCD의 한 형태이다.[12]
; 유형 2 세포사
: 자가포식을 동반하며, 세포질 내에 자가파고솜이라는 소포가 형성되는 것이 특징이다. 세포핵의 위축은 관찰되지만, 단편화는 뚜렷하지 않다.[81][82]
; 유형 3 세포사
: 괴사와 유사한 형태의 프로그램된 세포사로, 네크롭토시스라고도 불린다. 세포 내 소기관과 세포질 막이 팽창하는 것이 특징이다.
:: 유형 3 세포사는 리소좀 의존성 여부에 따라 3A와 3B로 세분화되기도 한다(1990년 Clarke의 분류).
식물의 PCD는 자가포식성 세포사와 유사하지만, 식물과 원생생물에서 공통적으로 나타나는 PCD의 특징도 존재한다.
PCD는 아폽토시스보다 더 포괄적인 개념으로 사용된다. 식물 세포사멸 과정에서 "아폽토시스"라는 용어를 사용하기도 하지만, 이는 정확한 표현은 아니다.
4. 유형
프로그램된 세포사는 일반적으로 형태학적 차이에 따라 다음 세 가지 유형으로 분류된다.[81][82]
아폽토시스(세포자살)와 자가포식 외에도 "비-세포자멸사성 프로그램 세포사멸"(또는 "카스파제-독립적 프로그램 세포사멸" 또는 "괴사성 세포사멸")이라고 불리는 여러 대체 경로가 발견되었다.[16] 이 경로는 세포자멸사만큼 효율적이며 백업 메커니즘 또는 PCD의 주요 유형으로 기능할 수 있다.
다른 형태의 프로그램 세포사멸에는 다음이 포함된다.
괴사성 세포사멸은 프로그램된 괴사의 한 형태 또는 염증성 세포사멸이다. 네모시스는 섬유아세포에서 발생하는 또 다른 프로그램된 괴사 형태이다.[18] 에리프토시스는 자살성 적혈구 사멸의 한 형태이다.[19] 아포네크로시스는 세포자멸사와 괴사의 혼합 형태이며 괴사에 의해 완료되는 불완전한 세포자멸사 과정을 의미한다.[20] NETosis는 NETs에 의해 생성되는 세포 사멸 과정이다.[21] 파라토시스는 MAPK에 의해 IGF-1의 활성화를 통해 매개되는 또 다른 유형의 비세포자멸사성 세포 사멸이다. 이는 세포 내 액포 형성 및 미토콘드리아 팽창으로 특징지어진다.[22] 파이롭토시스는 염증성 세포 사멸의 한 유형으로, 카스파제 1에 의해 독특하게 매개된다.[22]
식물 세포는 자가포식성 세포 사멸과 유사한 PCD의 특정 과정을 거친다. 그러나 PCD의 몇 가지 일반적인 특징은 식물과 원생생물을 포함한 후생동물 모두에서 매우 보존되어 있다.
4. 1. 아폽토시스
세포자살의 일종인 아폽토시스는 다세포 생물에서 일어나는 프로그래밍된 세포 사멸(PCD) 과정이다.[12] 생화학적 변화를 통해 세포는 블레브, 세포 수축, 핵 파편화, 염색질 응축, 염색체 DNA 파편화와 같은 특징적인 형태 변화를 보이며 결국 죽음에 이른다.[13]
세포예정사에는 외인성 경로와 내인성 경로 두 가지가 있으며, 두 경로 모두 세포 사멸에 핵심적인 역할을 하는 카스파제를 활성화시킨다.[13]
키나아제의 일종인 mTOR는 세포사멸 유도의 중요한 조절 인자이다. mTOR가 활성화되면 자가포식을 억제하고, 비활성화되면 자가포식을 촉진한다.[13]
자가포식과 세포자멸사는 긍정적, 부정적으로 연결되어 있으며, 서로 광범위하게 상호작용한다. 영양 결핍 시에는 자가포식이 생존을 촉진하지만, 과도한 자가포식은 세포 죽음을 유발할 수 있다. 이는 형태학적으로 세포자멸사와는 다르다. TNF, TRAIL, FADD와 같은 세포자멸사 촉진 세포 신호 전달 신호는 자가포식을 유도하기도 한다. Bcl-2는 Beclin-1 의존적 자가포식을 억제하여 생존을 촉진하고 자가포식을 억제하는 두 가지 역할을 모두 수행한다.[13]
세포예정사는 형태학적 차이에 따라 다음 세 가지 유형으로 분류된다.[81][82]4. 2. 자가포식
거대자가포식작용, 흔히 자가포식이라고 불리는 것은 대량의 세포질 내용물, 비정상적인 단백질 덩어리, 과도하거나 손상된 세포 소기관의 자가포식소체-리소좀 분해를 초래하는 이화 작용 과정이다.
자가포식은 일반적으로 영양 결핍 상태에 의해 활성화되지만, 발달, 분화, 신경 퇴행성 질환, 스트레스, 감염 및 암과 같은 생리학적 및 병리학적 과정과도 관련이 있다. 세포사멸 유도의 중요한 조절 인자는 키나아제인 mTOR로, 활성화되면 자가포식을 억제하고 비활성화되면 이를 촉진한다. 효모 Atg1과 유사한 역할을 하는 UNC-51 유사 키나아제 -1, -2, -3 (ULK1, ULK2, UKL3)는 mTOR 복합체의 하류에서 작용한다. ULK1과 ULK2는 자가포식 관련(Atg) 유전자 산물(mAtg13)의 포유류 상동체와 스캐폴드 단백질 FIP200과 함께 큰 복합체를 형성한다. hVps34, Beclin-1, p150 및 Atg14 유사 단백질 또는 자외선 조사 저항 관련 유전자(UVRAG)를 포함하는 III형 PI3K 복합체는 자가포식 유도에 필요하다.
ATG 유전자는 ATG12-ATG5 및 LC3-II (ATG8-II) 복합체를 통해 자가포식소포 형성을 제어한다. ATG12는 ATG7 및 ATG10이 필요한 유비퀴틴 유사 반응에서 ATG5에 결합된다. Atg12–Atg5 접합체는 ATG16과 비공유 결합하여 큰 복합체를 형성한다. LC3/ATG8은 ATG4 프로테아제에 의해 C 말단에서 절단되어 세포질 LC3-I을 생성한다. LC3-I은 Atg7 및 Atg3이 필요한 유비퀴틴 유사 반응에서도 포스파티딜에탄올아민(PE)에 결합된다. LC3의 지질화된 형태인 LC3-II는 자가포식소포 막에 부착된다.
자가포식과 세포자멸사는 긍정적, 부정적으로 모두 연결되어 있으며, 이 둘 사이에는 광범위한 상호 작용이 존재한다. 영양 결핍 동안, 자가포식은 생존 촉진 기전으로 기능하지만, 과도한 자가포식은 세포 죽음으로 이어질 수 있으며, 이는 형태학적으로 세포자멸사와 구별된다. TNF, TRAIL, FADD와 같은 여러 세포자멸사 촉진 세포 신호 전달 신호는 자가포식 또한 유도한다. 또한, Bcl-2는 Beclin-1 의존적 자가포식을 억제하여 생존 촉진 및 자가포식 억제 조절자로서 모두 기능한다.
4. 3. 기타 유형
세포자멸사 외에도 여러 유형의 PCD 경로가 발견되었다.[16] 이러한 경로는 "비-세포자멸사성 프로그램 세포사멸"(또는 "카스파제-독립적 프로그램 세포사멸" 또는 "괴사성 세포사멸")이라고 불리며, 세포자멸사만큼 효율적이고 백업 메커니즘 또는 PCD의 주요 유형으로 기능할 수 있다.
다른 형태의 프로그램 세포사멸에는 다음이 포함된다.
괴사성 세포사멸은 프로그램된 괴사의 한 형태 또는 염증성 세포사멸이다. 일반적으로 괴사는 세포자멸사를 통한 정돈된 프로그램 세포사멸과는 대조적으로, 세포 손상이나 병원체의 침투로 인한 비프로그램 세포사멸과 관련이 있다. 네모시스는 섬유아세포에서 발생하는 또 다른 프로그램된 괴사 형태이다.[18]
에리프토시스는 자살성 적혈구 사멸의 한 형태이다.[19]
아포네크로시스는 세포자멸사와 괴사의 혼합 형태이며 괴사에 의해 완료되는 불완전한 세포자멸사 과정을 의미한다.[20]
NETosis는 NETs에 의해 생성되는 세포 사멸 과정이다.[21]
파라토시스는 MAPK에 의해 IGF-1의 활성화를 통해 매개되는 또 다른 유형의 비세포자멸사성 세포 사멸이다. 이는 세포 내 액포 형성 및 미토콘드리아 팽창으로 특징지어진다.[22]
파이롭토시스는 염증성 세포 사멸의 한 유형으로, 특정 미생물에 의한 감염에 대한 반응으로, 세포자멸사에 관여하지 않는 효소인 카스파제 1에 의해 독특하게 매개된다.[22]
식물 세포는 자가포식성 세포 사멸과 유사한 PCD의 특정 과정을 거친다. 그러나 PCD의 몇 가지 일반적인 특징은 식물과 후생동물 모두에서 매우 보존되어 있다.
5. 위축 인자
세포를 위축시켜 사멸에 이르게 하는 힘이다. 세포에 가해지는 자연적인 힘만이 위축 인자로 간주되며, 기계적 또는 화학적 학대, 세포 용해 등은 위축 인자로 간주되지 않는다. 일반적인 유형의 위축 인자는 다음과 같다.[23]
- 작업량 감소
- 신경 지배 상실
- 혈액 공급 감소
- 부적절한 영양
- 내분비 자극 상실
- 노쇠
- 압박
6. 신경계 발달에서의 역할

발달 중인 신경계의 초기 확장은 뉴런과 그 과정의 제거로 균형을 이룬다.[24] 신경계 발달 과정에서 세포 예정사는 증식 세포뿐만 아니라 분열 후 세포에서도 관찰된다.[24]
세포 예정사는 유도 유전자를 표적 삭제하거나 항세포 예정사 유전자를 과발현시킴으로써 발달 중인 신경계에서 감소하거나 제거될 수 있다. 부재 또는 감소는 심각한 해부학적 기형을 유발할 수 있지만, 표적 유전자, 신경 세포 집단, 발달 단계에 따라 최소한의 결과만 초래할 수도 있다.[27] 과도한 전구 세포 증식은 뇌의 심각한 기형을 초래하여 종종 치명적인데, 이는 카스파제-3 또는 카스파제-9 넉아웃 마우스에서 관찰되며, 이들은 전뇌에서 두개외뇌증을 발달시킨다.[40][41] 그러나 이들 마우스의 뇌간, 척수, 말초 신경절은 정상적으로 발달하므로, 발달 중 세포 예정사에 카스파제의 관여는 뇌 영역 및 세포 유형에 따라 달라진다는 것을 시사한다.[42] APAF1의 넉아웃 또는 억제 또한 기형을 유발하고 배아 치사율을 증가시킨다.[43][44][45] Bcl-2 과발현 또는 Bax 삭제는 망막, 삼차 신경 핵, 소뇌 및 척수와 같은 신경계 특정 영역에서 뉴런의 수를 증가시킨다.[46][47][48][49][50][51][52] 그러나 Bax 삭제 또는 Bcl-2 과발현으로 인한 뉴런의 세포 예정사는 마우스에서 두드러진 형태학적 또는 행동적 이상을 초래하지 않는다. Bcl-2를 과발현하는 마우스는 일반적으로 정상적인 운동 능력과 시력을 가지며 학습 및 불안과 같은 복잡한 행동에서만 장애를 보인다.[53][54][55] 이러한 정상적인 행동 표현형은 과도한 뉴런을 보상하기 위해 적응 기전이 관여할 수 있음을 시사한다.[27]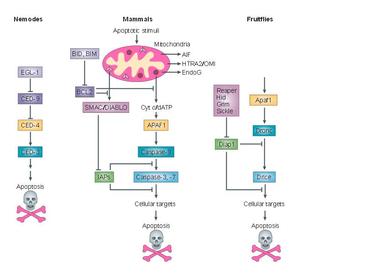
다양한 종에서 PCD를 배우는 것은 신경계 발달에서 세포 예정사의 진화적 기반과 이유를 이해하는 데 필수적이다. 무척추동물 신경계 발달 동안, PCD는 종에 따라 다른 역할을 한다.[56] 선충류와 거머리에서 비대칭 세포 사멸 기전의 유사성은 PCD가 신경계 발달에 진화적 중요성을 가질 수 있음을 시사한다.[57] 절지동물의 세포 사멸은 외배엽 세포가 분화하고 한 딸세포가 신경모세포가 되고 다른 딸세포가 세포 예정사를 겪을 때 신경계에서 먼저 발생한다.[59]
무척추동물과 달리, 프로그램된 세포 사멸 기전은 척추동물에서 더 잘 보존되어 있다. 다양한 척추동물에 대한 연구에 따르면, 뉴런 및 신경교의 PCD는 발달 동안 신경계 대부분의 부분에서 발생한다. 이는 중추신경계와 말초신경계의 시냅스 형성 전후에 관찰되었다.[27] 그러나 척추동물 종 사이에는 몇 가지 차이점이 있다. 예를 들어, 포유류는 망막에서 광범위한 분지화를 보인 후 PCD가 발생하는 반면, 조류에서는 그렇지 않다.[61] 척추동물 시스템의 시냅스 정교화는 PCD에 크게 의존하지만, 다른 진화적 기전도 역할을 한다.[27]
6. 1. 신경 발달에서의 역할
신경계 발달 과정에서 발달 중인 뉴런의 거의 50%가 프로그램된 세포사멸(PCD)에 의해 자연적으로 제거된다.[25] 신경계에서의 PCD는 1896년 존 비어드에 의해 처음으로 인식되었다.[26]세포예정사는 전구 세포의 수를 조절하고, 신경 세포와 표적 간의 연결을 최적화하며, 잘못된 신경 세포 오류를 수정하는 역할을 한다.
- 전구 세포 수 조절: 인간의 경우, 전구 세포에서의 세포 예정사는 임신 7주차에 시작하여 첫 번째 삼 분기까지 지속된다.[28] 이러한 세포 사멸 과정은 대뇌 피질, 소뇌, 시상, 뇌간, 척수의 생장 영역을 비롯한 여러 부위에서 확인되었다.[27]
- 신경 세포와 표적 간 연결 최적화: 임신 19-23주차에는 분열 후 세포에서 세포 예정사가 관찰된다.[29] 신경영양 가설에 따르면, 신경 세포와 구심성 입력 및 원심성 표적 간의 연결을 최적화하기 위해 세포 예정사가 필요하다.[27]
- 잘못된 신경 세포 오류 수정: 신경계 발달 과정에서 일어나는 세포 예정사는 이소성으로 이동했거나, 잘못된 표적을 지배했거나, 경로 탐색 과정에서 축삭이 잘못된 신경 세포의 오류를 수정하기 위해 발생한다.[30]
신경영양 가설은 발달 중인 신경계에서 세포예정사의 역할을 설명하기 위해 사용되는 주요 가설이다.[31] 이 가설은 표적의 최적 지배를 보장하기 위해 먼저 과잉의 뉴런을 생성한 다음 제한된 양의 보호 신경영양 인자를 놓고 경쟁하며, 일부만 생존하고 다른 뉴런은 세포예정사에 의해 죽는다고 가정한다.[28]
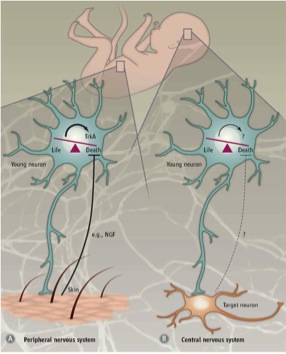
말초 신경계(PNS)와 중추 신경계(CNS)에서 세포 예정사(PCD)를 조절하는 기전은 다르다.
- 말초 신경계: 표적의 신경 지배는 표적에서 방출되는 신경 영양 인자 신경 성장 인자(NGF) 및 NT3의 양에 비례한다.[37][38]
- 중추 신경계: 세포 예정사는 외부의 성장 인자에 의존하지 않고, 대신 내인적으로 유래된 신호에 의존한다. 신피질에서는 흥분성 대 억제성 사이신경세포의 4:1 비율이 환경과 무관한 것으로 보이는 세포자멸사 기전에 의해 유지된다.[38]
6. 2. 신경영양 가설
신경영양 가설은 발달 중인 신경계에서 세포예정사의 역할을 설명하는 데 사용되는 주된 가설이다.[31] 이 가설에 따르면, 표적을 최적으로 지배하기 위해 먼저 과잉의 뉴런이 생성된다. 그 후, 제한된 양의 보호 신경영양 인자를 놓고 뉴런 간 경쟁이 벌어지며, 일부만 생존하고 나머지는 세포예정사에 의해 죽는다.[28] 또한, 이 가설은 미리 결정된 요인이 생존하는 뉴런의 양을 조절하며, 지배하는 뉴런 집단의 크기는 그들의 표적 영역의 영향과 직접적인 상관관계가 있다고 설명한다.[32]표적 세포가 매력적이거나 유도하는 인자를 분비하고, 그들의 성장 원뿔이 주화성 민감성을 가진다는 기본적인 아이디어는 1892년 산티아고 라몬 이 카할에 의해 처음 제시되었다.[33] 카할은 이 아이디어를 축삭이 표적을 찾을 때 나타나는 "지적인 힘"에 대한 설명으로 제시했지만, 경험적 데이터가 없다고 인정했다.[33] 이후 축삭 표적을 실험적으로 조작한 결과, 모든 지배하는 뉴런의 죽음을 초래하면서 이 가설은 더 많은 관심을 받게 되었다. 이는 신경영양 가설의 주요 원리가 된 표적 유래 조절의 개념을 발전시켰다.[34][35] 이 가설을 더욱 뒷받침하는 실험을 통해 최초의 신경영양 인자인 신경 성장 인자(NGF)가 확인되었다.[36]
6. 3. 말초 신경계 vs 중추 신경계
말초 신경계 (PNS)와 중추 신경계 (CNS)는 세포예정사(PCD) 조절 기전에서 차이를 보인다. PNS에서는 표적에서 방출되는 신경영양 인자인 신경 성장 인자 (NGF) 및 NT3의 양에 따라 표적의 신경 지배가 결정된다.[37][38] TrkA 및 TrkC 신경영양 수용체는 해당 리간드가 없어도 세포자멸사를 유도할 수 있다.[25] 따라서 PNS의 PCD는 신경 영양 인자의 방출에 의존하며, 신경 영양 이론을 따른다.반면, CNS의 세포 예정사는 외부 성장 인자에 의존하지 않고 내인성 신호에 의존한다. 신피질에서 흥분성 대 억제성 사이신경세포의 4:1 비율은 세포자멸사 기전에 의해 유지되며, 이는 환경과 무관하다.[38] 체외 배양이나 마우스 신피질에 이식된 사이신경세포 전구체는 2주령에 사망했는데, 이는 내인성 사이신경세포가 세포자멸사를 겪는 시기와 같다.[39] 이식 크기와 관계없이 세포자멸사를 겪는 세포 비율은 일정하게 유지되었다. 또한, 뇌 유래 신경 영양 인자 (Bdnf)의 수용체인 TrkB 파괴는 세포사에 영향을 미치지 않았다. Bcl-2 관련 X 단백질 (Bax) 결손 마우스는 야생형 마우스보다 더 많은 사이신경세포가 생존했다.[39] 이러한 결과는 CNS의 세포 예정사가 부분적으로 Bax 매개 신호를 활용하며, BDNF 및 환경과 무관하다는 것을 보여준다. CNS의 세포자멸사 기전은 아직 명확히 밝혀지지 않았지만, 사이신경세포의 세포자멸사는 자율적인 과정으로 여겨진다.
6. 4. 세포 사멸 부재 시 신경계 발달
세포예정사 유도 유전자를 표적 삭제하거나 항세포예정사 유전자를 과발현시키면 발달 중인 신경계에서 세포예정사가 감소하거나 제거될 수 있다. 세포예정사의 부재나 감소는 심각한 해부학적 기형을 유발할 수 있지만, 표적 유전자, 신경 세포 집단, 발달 단계에 따라 최소한의 결과만 초래할 수도 있다.[27]카스파제-3 또는 카스파제-9 넉아웃 마우스는 전뇌에서 두개외뇌증을 발달시켜 뇌의 심각한 기형과 함께 종종 치명적인 결과를 초래한다.[40][41] 그러나 이들 마우스의 뇌간, 척수, 말초 신경절은 정상적으로 발달하므로, 발달 중 세포예정사에서 카스파제의 역할은 뇌 영역 및 세포 유형에 따라 다르다는 것을 알 수 있다.[42]
APAF1의 넉아웃 또는 억제 또한 기형을 유발하고 배아 치사율을 증가시킨다.[43][44][45]
Bcl-2 과발현 또는 Bax 삭제는 망막, 삼차 신경 핵, 소뇌 및 척수와 같은 신경계의 특정 영역에서 뉴런의 수를 증가시킨다.[46][47][48][49][50][51][52] 그러나 Bax 삭제 또는 Bcl-2 과발현으로 인한 뉴런의 세포예정사는 마우스에서 두드러진 형태학적 또는 행동적 이상을 초래하지는 않는다. 예를 들어, Bcl-2를 과발현하는 마우스는 일반적으로 정상적인 운동 능력과 시력을 가지며, 학습 및 불안과 같은 복잡한 행동에서만 장애를 보인다.[53][54][55] 이러한 결과는 과도한 뉴런을 보상하기 위한 적응 기전이 관여할 수 있음을 시사한다.[27]
6. 5. 무척추동물 및 척추동물
무척추동물의 신경계 발달 과정에서 PCD는 종에 따라 다른 역할을 한다.[56] 선충류와 거머리에서 비대칭 세포 사멸 기전이 유사하다는 점은 PCD가 신경계 발달에 진화적으로 중요할 수 있음을 시사한다.[57] 선충류에서 PCD는 발달 첫 시간 내에 발생하여 신경 계통을 포함한 비생식 세포의 12%를 제거한다.[58] 절지동물에서 세포 사멸은 외배엽 세포가 분화하여 한 딸세포는 신경모세포가 되고 다른 딸세포는 세포 예정사를 겪을 때 신경계에서 먼저 발생한다.[59] 또한, 성별에 따른 표적 세포 사멸은 수컷과 암컷에서 특정 기관의 신경 지배 차이를 유발한다.[60] 초파리의 경우, PCD는 발달 과정에서 분절과 지정을 위해 필수적이다.척추동물에서는 무척추동물과 달리 프로그램된 세포 사멸 기전이 더 잘 보존되어 있다. 다양한 척추동물에 대한 광범위한 연구에 따르면, 뉴런 및 신경교의 PCD는 발달 중인 신경계의 대부분에서 발생한다. 이는 중추신경계와 말초신경계의 시냅스 형성 전후에 관찰되었다.[27] 그러나 척추동물 종 간에도 몇 가지 차이점이 있다. 예를 들어, 포유류는 망막에서 광범위한 분지화가 일어난 후 PCD가 발생하지만, 조류에서는 그렇지 않다.[61] 척추동물 시스템에서 시냅스 정교화는 PCD에 크게 의존하지만, 다른 진화적 기전도 작용한다.[27]
7. 식물 조직에서의 역할
식물 세포 예정사는 동물 세포자멸사와 분자 수준에서 여러 유사점을 보이지만, 몇 가지 뚜렷한 차이점을 가진다. 가장 큰 차이점은 식물 세포는 세포벽을 가지고 있다는 점과 죽은 세포 조각을 제거하는 면역 체계가 없다는 점이다.[62] 식물은 면역 반응 대신, 죽어가는 세포가 자신을 분해하는 물질을 합성하여 세포가 죽을 때 파열되는 액포에 넣는다.[62]
관다발 식물에서 세포예정사(PCD)는 중요한 구조적 역할을 한다. 물관은 관다발 식물의 두 가지 장거리 수송 시스템 중 하나로, 여러 세포 유형으로 구성되어 있으며, 이들의 분화는 정교한 세포벽 증착과 PCD를 수반한다.[63]
식물 PCD의 기본적인 형태학적 및 생화학적 특징은 식물과 동물 모두에서 보존되어 있다.[64] 특정 유형의 식물 세포는 고유한 세포 사멸 프로그램을 수행하는데, 예를 들어 물관의 가도관에서는 액포의 붕괴로 인해 세포 핵 분해가 유발된다.[65]
옥스퍼드 대학교 연구진은 해바라기 세포의 미토콘드리아 게놈 돌연변이에 대한 연구를 통해 미토콘드리아가 관다발 식물 PCD에서도 핵심적인 역할을 한다는 것을 밝혀냈다.[66]
또한 식물에서는 바이러스 등의 병원체를 막는 과정인 '과민반응 세포사'가 잘 알려져 있다. 이것도 액포의 붕괴에 의해 유발된다.[85]
7. 1. 꽃가루의 PCD와 자가불화합성
자가불화합성은 자신의 꽃가루로 수정할 수 없는 현상이다. 개양귀비의 자가불화합성에서 암술의 단백질이 자기 꽃가루에 꽃가루관 생장의 저해와 PCD를 일으킨다는 것이 밝혀졌다.[86]8. 점균류에서의 역할
사회성 점균 ''Dictyostelium discoideum''(이형자점균)은 단세포 형태에서는 포식성 아메바와 유사한 행동을 하고, 다음 세대를 낳을 포자를 분산시킬 때는 이동 가능한 민달팽이와 유사한 형태로 합쳐진다.[68]
자루는 세포 내부에 거대한 액포가 형성되고, 어느 정도의 크로마틴 응축이 일어나지만 DNA 절편화는 없는, 자가포식성 세포 사멸과 많은 특징을 공유하는 일종의 PCD를 겪은 죽은 세포로 구성되어 있다.[69]
''D. discoideum''은 진핵생물 조상으로부터 약 10억 년 전에 분화되었을 가능성이 있는 계통의 점균류이다. 이들은 녹색식물의 조상과 균류 및 동물의 조상이 분화된 후에 나타난 것으로 보인다. 그러나 PCD가 단순하고, 여섯 개의 염색체를 가진 ''D. discoideum''에서 관찰되었다는 사실은 진화 계통수에서의 위치 외에도 추가적인 의미를 갖는다. 이는 아폽토시스의 특징인 카스파제에 의존하지 않는 발생적 PCD 경로 연구를 가능하게 한다.[70]
세포성 점균 (원생생물)의 ''Dictyostelium discoideum영어''은 처음에는 박테리아를 포식하는 단세포 아메바 형태이지만, 먹이가 줄어들면 합체하여 민달팽이 형태의 가변형체가 된다. 이것은 다시 줄기를 형성하고 그 위에 자실체를 형성하여 포자를 만든다. 줄기는 일종의 PCD를 거쳐 죽은 세포로 이루어져 있는데, 이 PCD는 자가포식성 세포사멸의 성질(소포 형성, 크로마틴 응축)을 갖는다. 그러나 DNA 단편화는 일어나지 않는다. 이는 식물의 PCD와 유사하다.[87]
9. 미토콘드리아 아폽토시스의 진화적 기원
미토콘드리아는 더 큰 진핵 세포의 공생체(내부 공생)로 통합된 세균에서 유래했을 것으로 오랫동안 추정되어 왔다. 린 마굴리스는 1967년부터 이 이론을 옹호했으며, 이후 널리 받아들여졌다.[75] 이 이론을 뒷받침하는 가장 설득력 있는 증거는 미토콘드리아가 자체 DNA를 가지고 있으며, 유전자와 복제 장치를 갖추고 있다는 사실이다.
이러한 진화적 단계는 에너지 생산 세균을 삼키기 시작한 원시 진핵 세포와 자신의 원시 진핵 숙주를 침범하기 시작한 미토콘드리아 조상 모두에게 위험한 단계였다. 이 과정은 오늘날에도 인간 백혈구와 세균 사이에서 확인할 수 있다. 대부분의 경우 침입하는 세균은 백혈구에 의해 파괴되지만, 원핵생물의 화학전이 성공하여 감염이 발생하고 손상을 입는 경우도 드물지 않다.
약 20억 년 전, 특정 진핵생물과 에너지 생산 원핵생물이 공존하며 서로의 공생으로부터 상호 이익을 얻는 드문 진화적 사건이 발생했다.[76]
미토콘드리아를 가진 진핵 세포는 생명과 죽음 사이에서 균형을 이루며 살아가는데, 이는 미토콘드리아가 여전히 세포 자살을 유발할 수 있는 분자의 레퍼토리를 유지하고 있기 때문이다.[77] 아폽토시스 기계가 현존하는 단세포 유기체에서 유지되는 이유는 명확하지 않다. 이 과정은 현재 프로그래밍된 경우(예: 이웃으로부터의 피드백, 스트레스 또는 DNA 손상)에만 발생하도록 진화했다.[78] 세포에 미토콘드리아는 세포 사멸 유도 생화학적 연쇄 반응을 유발하는 카스파제 활성제를 방출한다. 따라서 세포 자살 반응 메커니즘은 이제 우리 모두의 삶에 매우 중요하다.
10. DNA 손상과 아폽토시스
DNA 복구와 세포 예정사는 인간의 게놈 완전성을 유지하는 데 필수적인 두 가지 과정이다. DNA 복구가 결핍된 세포는 DNA 손상을 축적하는 경향이 있으며, 세포 예정사에도 결함이 있으면 과도한 DNA 손상에도 불구하고 생존할 수 있다.[79] 이러한 세포에서 DNA 복제는 돌연변이를 유발하며, 이는 암을 유발할 수 있다.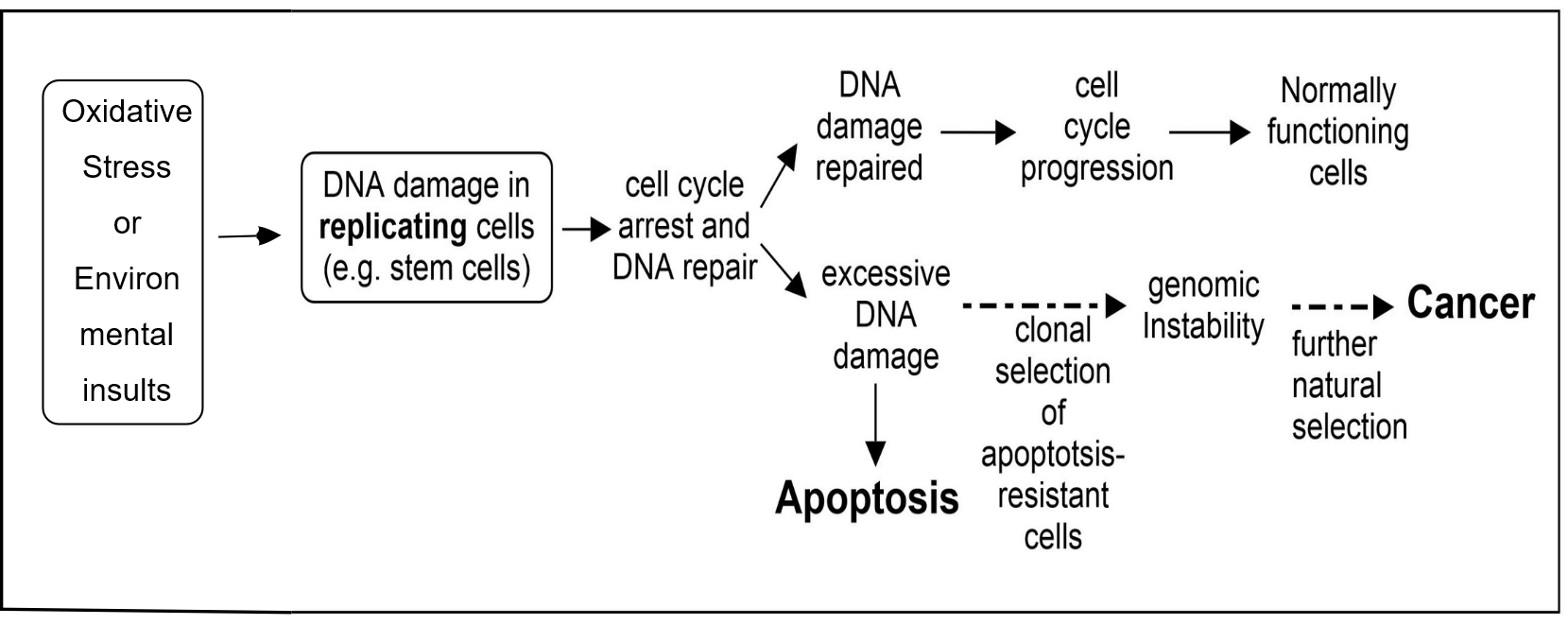
여러 효소 경로는 다양한 종류의 DNA 손상을 복구하기 위해 진화했으며, 5가지 잘 연구된 DNA 복구 경로에서 특정 효소가 이중 역할을 수행한다는 사실이 밝혀졌다. 이중 역할 단백질은 DNA 손상 수준이 세포의 복구 능력을 넘어설 경우 세포 예정사를 유도한다.[1] 이러한 이중 역할 단백질은 암 발달을 방지하는 경향이 있다.
각 복구 과정에서 이중 역할을 수행하는 단백질은 다음과 같다.
| DNA 복구 경로 | 이중 역할 단백질 |
|---|---|
| DNA 미스매치 복구 | MSH2, MSH6, MLH1, PMS2 |
| 염기 절제 복구 | APEX1 (REF1/APE), 폴리(ADP-리보스) 중합효소 (PARP) |
| 뉴클레오티드 절제 복구 | XPB, XPD (ERCC2), p53, p33(ING1b) |
| 비상동 말단 연결 | DNA-PK의 촉매 서브유닛 |
| 상동 재조합 복구 | BRCA1, ATM, ATR, WRN, BLM, Tip60, p53 |
11. 개체 전체의 프로그램된 죽음
이 템플릿은 제거되어야 한다.
페노토시스에 대한 설명을 추가한다.
12. 임상적 의의
세포 예정사(PCD)는 1964년 리처드 A. 록신과 윌리엄스가 곤충 조직 발달과 관련하여 처음 사용한 개념이다.[7] 이후 2002년 시드니 브레너, H. 로버트 호비츠, 존 설스턴이 이 연구로 노벨 생리학·의학상을 수상하면서 더욱 주목받게 되었다.[10]
BCL2는 염색체 전좌에 의해 활성화되는 잠재적 암 유전자로, 여포 림프종에서 흔히 발견된다. BCL2는 세포 증식을 자극하는 다른 암 유전자와 달리, 림프종 세포가 스스로 죽는 것을 막아 암을 촉진한다.[9]
12. 1. ABL
BCR-ABL 종양 유전자는 인간의 암 발생에 관여하는 것으로 밝혀졌다.[80]12. 2. c-Myc
c-Myc는 Bcl-2 유전자를 하향 조절하는 역할을 통해 세포 예정사 조절에 관여한다. 이는 조직의 무질서한 성장에 영향을 미친다.[80]12. 3. 전이
전이 세포의 분자적 특징은 여러 세포자멸사 유전자의 발현 변화이다.[80]참조
[1]
논문
Cell suicide for beginners.
1998-11-12
[2]
논문
Bacterial Programmed Cell Death and Multicellular Behavior in Bacteria
[3]
서적
Means To An End
http://celldeathbook[...]
Cold Spring Harbor Laboratory Press
[4]
서적
Histology and Cell Biology - An Introduction to Pathology
ELSEVIER SAUNDERS
[5]
논문
Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury
2005-07-01
[6]
논문
Regulated necrosis: the expanding network of non-apoptotic cell death pathways
[7]
논문
Programmed cell death—II. Endocrine potentiation of the breakdown of the intersegmental muscles of silkmoths
[8]
논문
The nature of programmed cell death
http://philsci-archi[...]
2019
[9]
논문
Bcl-2 gene promotes haemopoietic cell survival and cooperates with c-myc to immortalize pre-B cells
1988-09
[10]
웹사이트
The Nobel Prize in Physiology or Medicine 2002
http://nobelprize.or[...]
The Nobel Foundation
2009-06-21
[11]
논문
Do all programmed cell deaths occur via apoptosis?
[11]
논문
Programmed cell death (PCD). Apoptosis, autophagic PCD, or others?
[12]
서적
Means To An End
http://celldeathbook[...]
Cold Spring Harbor Laboratory Press
[13]
논문
Cell Biology International 17
http://www.cellbioli[...]
2012-10-03
[14]
Youtube
Apoptosis | Intrinsic and extrinsic pathway | USMLE step 1 | Pathology
https://www.youtube.[...]
2023-01-08
[15]
Youtube
Apoptosis
https://www.youtube.[...]
2019-03-30
[16]
논문
Caspase-independent cell death
[17]
논문
Ferroptosis: An Iron-Dependent Form of Nonapoptotic Cell Death
[18]
논문
Cell-cell contacts trigger programmed necrosis and induce cyclooxygenase-2 expression.
[19]
논문
Mechanisms and significance of eryptosis.
[20]
논문
aponecrosis: morphological and biochemical exploration of a syncretic process of cell death sharing apoptosis and necrosis
[21]
논문
A perspective on NETosis in diabetes and cardiometabolic disorders.
2015-11-25
[22]
서적
Histology: A Text and Atlas
Wolters Kluwer Health
[23]
웹사이트
Chapter 10: All the Players on One Stage
http://www.psycheduc[...]
2013-05-28
[24]
논문
Normal development of brain circuits
[25]
논문
Death of developing neurons: new insights and implications for connectivity
[26]
서적
Neuronal cell death and some related regressive phenomena during neurogenesis: a selective historical review and progress report
Oxford University Press
[27]
논문
Adaptive roles of programmed cell death during nervous system development
[28]
논문
Cell death in early neural development: beyond the neurotrophic theory
2000-10-23
[29]
논문
In vivo cellular and molecular mechanisms of neuronal apoptosis in the mammalian CNS
2003-04
[30]
논문
Control of cell number in the developing mammalian visual system
[31]
논문
Programmed Cell Death in Neurodevelopment
2015-02-23
[32]
서적
Patterning and Cell Type Specification in the Developing CNS and PNS: Comprehensive Developmental Neuroscience
Academic Press
[33]
서적
Changing Views of Cajal's Neuron
[34]
논문
The neurotrophic theory and naturally occurring motorneuron death
[35]
논문
Cell biology in neuroscience: Death of developing neurons: new insights and implications for connectivity
2013-11-11
[36]
논문
Viktor Hamburger and Rita Levi-Montalcini: the path to the discovery of nerve growth factor
[37]
논문
The 1986 Nobel Prize for Physiology or Medicine awarded for discovery of growth factors: Rita Levi-Montalcini, M.D., and Stanley Cohen, Ph.D.
1987-02-08
[38]
논문
Programmed Cell Death in Neuronal Development
2013-04-05
[39]
논문
Intrinsically determined cell death of developing cortical interneurons
2012-11
[40]
논문
Reduced apoptosis and cytochrome c-mediated caspase activation in mice lacking caspase 9
[41]
논문
Decreased apoptosis in the brain and premature lethality in CPP32-deficient mice
[42]
논문
Programmed cell death of developing mammalian neurons after genetic deletion of caspases
[43]
논문
Apaf1 (CED-4 homolog) regulates programmed cell death in mammalian development
[44]
논문
Specific ablation of the apoptotic functions of cytochrome c reveals a differential requirement for cytochrome c and Apaf-1 in apoptosis
[45]
논문
Apaf1 is required for mitochondrial pathways of apoptosis and brain development
[46]
논문
Protection of retinal ganglion cells from natural and axotomy-induced cell death in neonatal transgenic mice overexpressing bcl-2
[47]
논문
Overexpression of BCL-2 in transgenic mice protects neurons from naturally occurring cell death and experimental ischemia
[48]
논문
Increased cerebellar Purkinje cell numbers in mice overexpressing a human bcl-2 transgene
[49]
논문
Overexpression of bcl-2 reduces sex differences in neuron number in the brain and spinal cord
[50]
논문
Elimination of Bax expression in mice increases cerebellar Purkinje cell numbers but not the number of granule cells
[51]
논문
Suppression of developmental retinal cell death but not of photoreceptor degeneration in Bax-deficient mice
[52]
논문
Widespread elimination of naturally occurring neuronal death in Bax-deficient mice
[53]
논문
Behavioral visual acuity of wild type and bcl2 transgenic mouse
[54]
논문
To die or not to die, does it change the function? Behavior of transgenic mice reveals a role for developmental cell death
[55]
논문
Transgenic mice with neuronal overexpression of bcl-2 gene present navigation disabilities in a water task
[56]
논문
Adaptive Roles of Programmed Cell Death During Nervous System Development
2006-07-21
[57]
논문
The Caenorhabditis elegans male: postembryonic development of nongonadal structures
[58]
논문
The embryonic cell lineage of the nematode Caenorhabditis elegans
[59]
논문
Development and segmental differences in the pattern of neuronal precursor cells
[60]
논문
Sexual differentiation in the terminal ganglion of the moth Manduca sexta: role of sex-specific neuronal death
[61]
논문
Developmental neuronal death is not a universal phenomenon among cell types in the chick embryo retina
[62]
논문
Programmed cell death in plants resembles apoptosis of animals
http://elfosscientia[...]
[63]
논문
APL regulates vascular tissue identity in Arabidopsis
[64]
논문
The involvement of cysteine proteases and protease inhibitor genes in the regulation of programmed cell death in plants
[65]
논문
ZEN1 Is a Key Enzyme in the Degradation of Nuclear DNA during Programmed Cell Death of Tracheary Elements
[66]
논문
The PET1-CMS Mitochondrial Mutation in Sunflower Is Associated with Premature Programmed Cell Death and Cytochrome c Release
[67]
논문
Self-incompatibility triggers programmed cell death in Papaver pollen
[68]
논문
Ecology. Social slime molds meet their match
[69]
논문
Dictyostelium cell death: early emergence and demise of highly polarized paddle cells
[70]
논문
Developmental cell death in dictyostelium does not require paracaspase
[71]
논문
Programmed cell death in protists
[72]
간행물
Evolution of apoptosis-like programmed cell death in unicellular protozoan parasites
[73]
논문
Cell death in parasitic protozoa: regulated or incidental?
http://www.gla.ac.uk[...]
2014-11-14
[74]
논문
Evolution of apoptosis-like programmed cell death in unicellular protozoan parasites
[75]
논문
The birth of complex cells
[76]
논문
Ancient invasions: from endosymbionts to organelles
[77]
논문
Cell biology. PARP-1--a perpetrator of apoptotic cell death?
[78]
간행물
Apoptosis: its origin, history, maintenance and the medical implications for cancer and aging
http://iopscience.io[...]
[79]
간행물
DNA repair/pro-apoptotic dual-role proteins in five major DNA repair pathways: fail-safe protection against carcinogenesis
[80]
서적
Apoptosis, Cell Signaling, and Human Diseases
Humana Press
[81]
간행물
"Do all programmed cell deaths occur via apoptosis?"
http://www.pnas.org/[...]
[82]
간행물
"Programmed cell death (PCD). Apoptosis, autophagic PCD, or others?"
http://www.ncbi.nlm.[...]
[83]
간행물
"ZEN1 is a key enzyme in the degradation of nuclear DNA during programmed cell death of tracheary elements"
http://www.plantcell[...]
[84]
간행물
"The PET1-CMS mitochondrial mutation in sunflower is associated with premature programmed cell death and cytochrome c release"
http://www.plantcell[...]
[85]
간행물
"A plant vacuolar protease, VPE, mediates virus-induced hypersensitive cell death."
http://www.ncbi.nlm.[...]
[86]
간행물
"Self-incompatibility triggers programmed cell death in Papaver pollen."
http://www.ncbi.nlm.[...]
[87]
간행물
"Dictyostelium cell death : early emergence and demise of highly polarized paddle cells"
http://jcb.rupress.o[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com