글리세롤 3-인산 탈수소효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
글리세롤 3-인산 탈수소효소(GPDH)는 지질 생합성 및 산화환원 전위 유지에 중요한 역할을 하는 효소이다. GPDH는 다이하이드록시아세톤 인산을 글리세롤 3-인산으로 환원시키며, 세포질과 미토콘드리아에서 글리세롤 3-인산 셔틀을 통해 NADH를 NAD+로 산화하는 반응을 촉매한다. GPDH는 두 가지 형태로 존재하며, 세포질의 GPD1은 NADH를 사용하여 다이하이드록시아세톤 인산을 글리세롤 3-인산으로 전환하고, 미토콘드리아의 GPD2는 FAD를 보조 인자로 사용하여 글리세롤 3-인산을 다이하이드록시아세톤 인산으로 산화시킨다. GPDH는 pH 변화에 큰 영향을 받지 않지만, 고염 농도에서는 GPD1의 활성이 증가하며, 비만, 브루가다 증후군, 당뇨병과 같은 질병과 관련이 있다.
더 읽어볼만한 페이지
- 단백질 도메인 - CD4
CD4는 보조 T 세포 표면에서 T 세포 수용체의 공동수용체로 작용하여 항원제시세포와 상호작용을 돕고 T 세포 활성화 신호를 증폭시키는 면역계의 당단백질이며, HIV의 숙주 세포 침투 수용체로 작용하여 HIV 감염 및 AIDS 발병에 중요한 역할을 한다. - 단백질 도메인 - 인터루킨 4
인터루킨 4(IL-4)는 B 세포와 T 세포를 자극하고 형질세포로 분화시키는 사이토카인으로, 체액성 및 후천성 면역 조절, IgE 및 IgG4 생산 유도, MHC 클래스 II 생산 촉진과 함께 알레르기 질환, 기관지 천식, 만성 염증, 상처 치유, 암 발병 및 진행, HIV 질환 등 다양한 질병에 관여하는 것으로 알려져 있다. - 인간 12번 염색체상 유전자 - 젖산 탈수소효소
젖산 탈수소효소(LDH)는 피루브산을 젖산으로 또는 그 역반응을 촉매하는 효소로, 해당 과정과 코리 회로에서 작용하며, 5가지 동질효소 형태로 존재하고, 혈청 내 수치는 조직 손상 지표로 사용되며, 암세포 에너지 대사 및 유전 질환과도 관련되어 그 기능과 관련 질환에 대한 연구가 지속적으로 진행되고 있다. - 인간 12번 염색체상 유전자 - 리소자임
리소자임은 펩티도글리칸의 β-1,4-글리코사이드 결합을 분해하는 효소로, 그람 양성균의 세포벽 분해를 통한 항균 작용을 하며, 질병 예방 및 치료, 식품 보존 등 다양한 분야에 활용된다. - 인간 2번 염색체상 유전자 - 말산 탈수소효소
말산 탈수소효소는 말산을 옥살로아세트산으로 전환하는 효소로, 세포 내 위치와 기능에 따라 여러 동위효소가 존재하며, 시트르산 회로, 말산-아스파르트산 셔틀, 포도당 신생합성과 같은 대사 경로에서 중요한 역할을 한다. - 인간 2번 염색체상 유전자 - 부신겉질자극호르몬
부신겉질자극호르몬은 뇌하수체 전엽에서 생성되어 부신 겉질 세포를 자극, 글루코코르티코이드 스테로이드 호르몬의 분비를 촉진하는 호르몬으로, 시상하부에서 분비되는 부신피질자극 호르몬 방출 호르몬에 의해 조절되며, POMC에서 유래하고, 분비 이상은 쿠싱 증후군 등과 관련되며 웨스트 증후군 치료에도 사용된다.
2. 대사 기능
글리세롤 3-인산 탈수소효소(GPDH)는 지질 생합성에서 중요한 역할을 한다. GPDH는 다이하이드록시아세톤 인산을 글리세롤 3-인산으로 환원시켜 글리세롤 3-인산을 글리세롤로 빠르게 탈인산화할 수 있게 한다.[19] 또한 GPDH는 미토콘드리아 내막을 가로질러 산화환원 전위를 유지하는 데 관여한다.[19]
NAD+/NADH 조효소는 물질대사의 산화환원반응에서 전자를 한 반응에서 다른 반응으로 운반하는 저장소 역할을 한다.[21] 이러한 반응의 대부분은 미토콘드리아에서 일어난다. 세포질의 NADH는 추가 사용을 위해 NAD+로 다시 산화되어야 하는데, 미토콘드리아 내막은 NADH와 NAD+에 대해 불투과성이므로 이들은 세포질과 미토콘드리아 기질 사이를 자유롭게 이동할 수 없다.[20]
이러한 환원 당량을 막 사이로 이동시키는 한 가지 방법은 글리세롤 3-인산 셔틀을 이용하는 것이다. 글리세롤 3-인산 셔틀은 두 가지 형태의 GPDH를 사용한다.[20]
- 세포질 GPDH (GPD1)는 세포질 쪽에 있는 미토콘드리아 외막에 위치하며, 다이하이드록시아세톤 인산을 글리세롤 3-인산으로 환원시킨다.
- 미토콘드리아 GPDH (GPD2)는 미토콘드리아 내막의 바깥쪽 표면에 붙어 있으며, 글리세롤 3-인산을 다이하이드록시아세톤 인산으로 산화시킨다.[22]
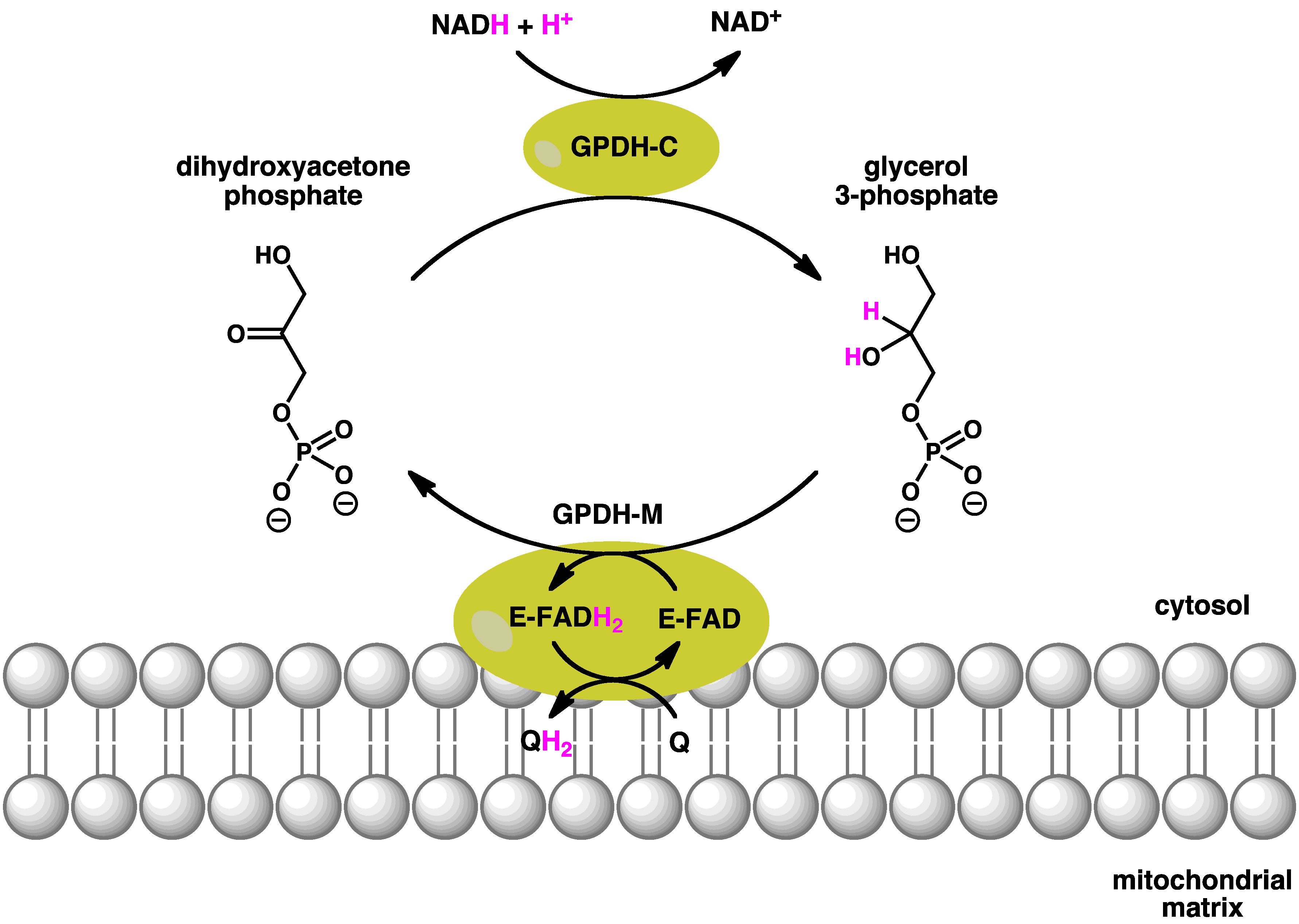
3. 반응
글리세롤 3-인산 탈수소효소는 다이하이드록시아세톤 인산과 글리세롤 3-인산을 상호전환시키는 반응을 촉매한다. 이 효소는 미토콘드리아와 세포질에 각각 다른 형태로 존재하며, 글리세롤 3-인산 셔틀에서 핵심적인 역할을 한다.
세포질의 글리세롤 3-인산 탈수소효소(GPDH-C)는 NADH를 NAD+로 산화시키면서 다이하이드록시아세톤 인산을 글리세롤 3-인산으로 환원시킨다. 미토콘드리아의 글리세롤 3-인산 탈수소효소(GPDH-M)는 FAD를 보조 인자로 사용하여 글리세롤 3-인산을 다시 다이하이드록시아세톤 인산으로 산화시키고, 이 과정에서 퀴논을 퀴놀로 환원시킨다. 이러한 짝지음 반응을 통해 글리세롤 3-인산 셔틀이 작동하며, 결과적으로 ATP 1분자에 해당하는 에너지가 순손실된다.[23]
3. 1. 글리세롤 3-인산 셔틀
NAD+/NADH 조효소 커플은 물질대사의 산화환원반응을 위한 전자 저장소 역할을 하며 한 반응에서 다른 반응으로 전자를 운반한다.[21] 이러한 물질대사 반응의 대부분은 미토콘드리아에서 일어난다. 추가적인 사용을 위해 NAD+를 재생하려면 세포질의 NADH 풀을 재산화해야 한다. 미토콘드리아 내막은 NADH와 NAD+ 모두에 대해 불투과성이므로 이들은 세포질과 미토콘드리아 기질 사이에서 자유롭게 교환될 수 없다.[20]막을 가로질러 이 환원 당량을 이동시키는 한 가지 방법은 2가지 형태의 글리세롤 3-인산 탈수소효소를 사용하는 글리세롤 3-인산 셔틀을 이용하는 것이다.
- 세포질의 글리세롤 3-인산 탈수소효소(GPDH) 또는 GPD1은 세포질과 마주하는 미토콘드리아 외막에 국한되어 있으며 다이하이드록시아세톤 인산을 글리세롤 3-인산으로 환원하는 것을 촉매한다.
- 이와 함께 미토콘드리아의 글리세롤 3-인산 탈수소효소(GPDH) 또는 GPD2는 세포질을 내려다보는 미토콘드리아 내막의 바깥쪽 표면에 묻혀 있으며 글리세롤 3-인산을 다이하이드록시아세톤 인산으로 산화하는 것을 촉매한다.[22]
세포질의 글리세롤 3-인산 탈수소효소(가용성) 및 미토콘드리아의 글리세롤 3-인산 탈수소효소에 의해 촉매되는 반응은 다음과 같다.
미토콘드리아의 글리세롤 3-인산 탈수소효소와 세포질의 글리세롤 3-인산 탈수소효소는 서로 협력하여 작동한다. 세포질의 글리세롤 3-인산 탈수소효소에 의해 NADH는 NAD+로 산화되고 다이하이드록시아세톤 인산이 글리세롤 3-인산으로 전환된다. 일단 글리세롤 3-인산이 미토콘드리아 내막을 통해 이동하면 퀴논을 산화제로 사용하고 FAD를 보조 인자로 사용하는 미토콘드리아의 글리세롤 3-인산 탈수소효소에 의해 다이하이드록시아세톤 인산으로 산화될 수 있다. 결과적으로 ATP 1분자에 필적하는 에너지의 순손실이 일어난다.[23]
이러한 효소의 조합된 작용은 NAD+/NADH 비율을 유지하여 대사의 지속적인 작동을 가능하게 한다.
4. 종류
글리세롤 3-인산 탈수소효소(GPDH)는 글리세롤 3-인산 셔틀을 통해 미토콘드리아 내막을 가로질러 산화환원 전위를 유지하는 데 관여한다.[19]
NAD+/NADH 조효소는 물질대사의 산화환원반응에서 전자를 운반하는 역할을 한다.[21] 미토콘드리아 내막은 NADH와 NAD+에 대해 불투과성이기 때문에, 이들은 글리세롤 3-인산 셔틀을 통해 세포질과 미토콘드리아 기질 사이를 이동한다.[20]
글리세롤 3-인산 셔틀은 두 가지 형태의 글리세롤 3-인산 탈수소효소를 이용한다.[22]
- 세포질 글리세롤 3-인산 탈수소효소(GPD1)는 세포질과 마주하는 미토콘드리아 외막에 위치하며, 다이하이드록시아세톤 인산을 글리세롤 3-인산으로 환원시킨다.
- 미토콘드리아 글리세롤 3-인산 탈수소효소(GPD2)는 미토콘드리아 내막의 바깥쪽 표면에 묻혀 있으며, 글리세롤 3-인산을 다이하이드록시아세톤 인산으로 산화시킨다.[22]
글리세롤 3-인산 탈수소효소에는 다음과 같은 두 가지 형태가 있다.
4. 1. GPD1 (세포질)
세포질 글리세롤 3-인산 탈수소효소(GPD1)는 다이하이드록시아세톤 인산을 글리세롤 3-인산으로 환원시키는 NAD+ 의존성 효소이다.[24] 이와 동시에 NADH는 NAD+로 산화된다. 이러한 과정을 통해 추가적인 대사를 위해 NAD+가 재생성된다.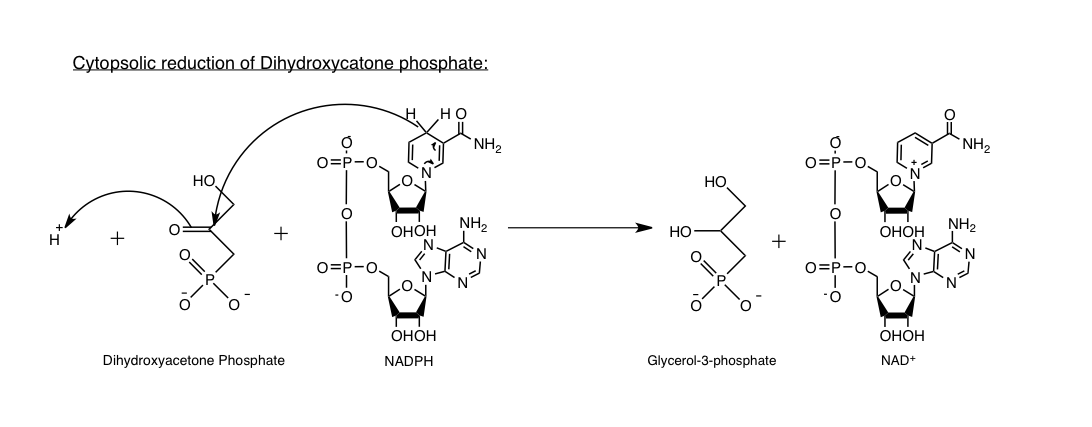
GPD1은 두 개의 소단위체로 구성되어 있으며,[25] 다이하이드록시아세톤 인산 및 NAD+와 반응한다.
4. 2. GPD2 (미토콘드리아)
미토콘드리아의 글리세롤 3-인산 탈수소효소(GPD2)는 글리세롤 3-인산을 다이하이드록시아세톤 인산으로 비가역적으로 산화시키는 반응을 촉매하며, 동시에 2개의 전자를 FAD로 전달하여 FADH2를 생성한다.[26] GPD2는 4개의 동일한 소단위체로 구성된다.[26]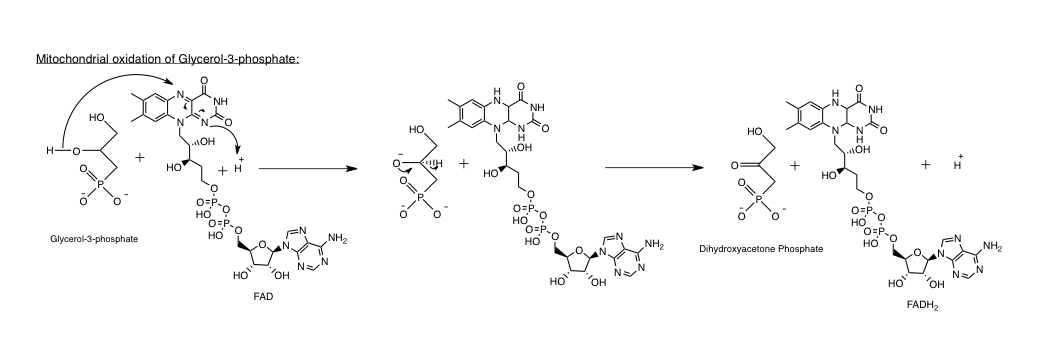
5. 환경 스트레스 반응
글리세롤 3-인산 탈수소효소는 pH 변화에 대해 대부분 영향을 받지 않는다. 특정 pH 조건에서 GPD1이나 GPD2가 선호되지 않는다.[27] 높은 염 농도(예: NaCl)에서 배지의 염도가 증가하면 반응으로 글리세롤이 축적되기 때문에 GPD1의 활성이 GPD2보다 향상된다. 온도의 변화는 GPD1과 GPD2 모두에게 유리한 것으로 보이지 않는다.[27]
6. 질병과의 관련성
글리세롤 3-인산 탈수소효소(GPDH)는 NAD+/NADH 균형 유지 및 지질 대사에 관여하기 때문에 비만이나 브루가다 증후군과 같은 질환과 관련이 있다.[28][29] 또한 미토콘드리아 글리세롤 3-인산 탈수소효소는 제2형 당뇨병의 치료제인 메트포르민에 의해 억제되는 것으로 알려져 있다.[30][14]
6. 1. 비만
NAD+/NADH 퍼텐셜을 유지하는 글리세롤 3-인산 탈수소효소의 기본적인 역할과 지질 대사에서의 역할은 글리세롤 3-인산 탈수소효소를 비만과 같은 지질 불균형 질환의 요인으로 만든다.[28]글리세롤 3-인산 탈수소효소의 활성 향상, 특히 GPD2는 글리세롤의 생산을 증가시킨다. 글리세롤은 지질 대사의 주요 소단위체이기 때문에 글리세롤이 풍부하면 세포 수준에서 트라이글리세라이드의 축적이 쉽게 증가할 수 있다. 그 결과 지방 조직이 형성되어 비만에 유리한 지방이 축적되는 경향이 있다.[28]
6. 2. 브루가다 증후군
GPDH는 NAD+/NADH의 균형을 유지하는 기본적인 역할과 지질 대사에 관여하는 역할 때문에 브루가다 증후군의 요인이 될 수 있다. GPD1을 암호화하는 유전자의 돌연변이는 전자 전달계의 결함을 유발하는 것으로 입증되었다. 세포 내 NAD+/NADH 수치의 불일치는 심장 나트륨 이온 채널 조절의 결함에 기여하고 영아기에 치명적인 부정맥을 유발할 수 있다고 여겨진다.[13]6. 3. 당뇨병
미토콘드리아의 글리세롤 3-인산 탈수소효소는 제2형 당뇨병의 1차 치료제인 메트포르민에 의해 억제되는 것으로 생각된다.[30][14]7. 구조
글리세롤 3-인산 탈수소효소는 두 개의 단백질 도메인으로 구성된다. N-말단 도메인은 NAD 결합 도메인이고, C-말단 도메인은 기질 결합 도메인으로 작용한다.[31] 그러나 글리세롤 3-인산 탈수소효소는 RNA 결합 및 안정성의 조절을 포함하여 여러 달빛(moonlighting) 활성을 나타낼 수 있기 때문에 이량체 및 사량체 계면 잔기는 글리세롤 3-인산 탈수소효소와 RNA의 결합에 관여한다.[32]
참조
[1]
논문
Crystal structures of human glycerol 3-phosphate dehydrogenase 1 (GPD1)
2006-03
[2]
논문
Crystal structures of human glycerol 3-phosphate dehydrogenase 1 (GPD1)
2006-03
[3]
논문
Role of glycerol 3-phosphate dehydrogenase in glyceride metabolism. Effect of diet on enzyme activities in chicken liver
1975-01
[4]
논문
Physiological and genetic engineering of cytosolic redox metabolism in Saccharomyces cerevisiae for improved glycerol production
2006-11
[5]
논문
The two isoenzymes for yeast NAD+-dependent glycerol 3-phosphate dehydrogenase encoded by GPD1 and GPD2 have distinct roles in osmoadaptation and redox regulation
1997-05
[6]
논문
Role of glycerol-3-phosphate dehydrogenase 2 in mouse sperm capacitation
2010-09
[7]
서적
Biochemistry
W.H. Freeman
[8]
논문
The influence of obstructive sleep apnea on the expression of glycerol-3-phosphate dehydrogenase 1 gene
http://ebm.rsmjourna[...]
2011-05-16
[9]
논문
Competition of electrons to enter the respiratory chain: a new regulatory mechanism of oxidative metabolism in Saccharomyces cerevisiae
2005-02
[10]
논문
Tyrosine phosphoproteome of hamster spermatozoa: role of glycerol-3-phosphate dehydrogenase 2 in sperm capacitation
2009-04
[11]
논문
Differential response of the catalase, superoxide dismutase and glycerol-3-phosphate dehydrogenase to different environmental stresses in Debaryomyces nepalensis NCYC 3413
2011-02
[12]
논문
Attenuating effect of casein glycomacropeptide on proliferation, differentiation, and lipid accumulation of in vitro Sprague-Dawley rat preadipocytes
2011-02
[13]
논문
Molecular and functional characterization of novel glycerol-3-phosphate dehydrogenase 1 like gene (GPD1-L) mutations in sudden infant death syndrome
2007-11
[14]
논문
The target of metformin in type 2 diabetes
2014-10
[15]
논문
A potential target enzyme for trypanocidal drugs revealed by the crystal structure of NAD-dependent glycerol-3-phosphate dehydrogenase from Leishmania mexicana
2000-05
[16]
논문
A dimer interface mutation in glyceraldehyde-3-phosphate dehydrogenase regulates its binding to AU-rich RNA
2015-01
[17]
논문
Crystal structures of human glycerol 3-phosphate dehydrogenase 1 (GPD1)
2006-03
[18]
논문
Crystal structures of human glycerol 3-phosphate dehydrogenase 1 (GPD1)
2006-03
[19]
논문
Role of glycerol 3-phosphate dehydrogenase in glyceride metabolism. Effect of diet on enzyme activities in chicken liver
1975-01
[20]
논문
Physiological and genetic engineering of cytosolic redox metabolism in Saccharomyces cerevisiae for improved glycerol production
2006-11
[21]
논문
The two isoenzymes for yeast NAD+-dependent glycerol 3-phosphate dehydrogenase encoded by GPD1 and GPD2 have distinct roles in osmoadaptation and redox regulation
1997-05
[22]
논문
Role of glycerol-3-phosphate dehydrogenase 2 in mouse sperm capacitation
2010-09
[23]
서적
Biochemistry
W.H. Freeman
[24]
논문
The influence of obstructive sleep apnea on the expression of glycerol-3-phosphate dehydrogenase 1 gene
http://ebm.rsmjourna[...]
2011-05-16
[25]
논문
Competition of electrons to enter the respiratory chain: a new regulatory mechanism of oxidative metabolism in Saccharomyces cerevisiae
2005-02
[26]
논문
Tyrosine phosphoproteome of hamster spermatozoa: role of glycerol-3-phosphate dehydrogenase 2 in sperm capacitation
2009-04
[27]
논문
Differential response of the catalase, superoxide dismutase and glycerol-3-phosphate dehydrogenase to different environmental stresses in Debaryomyces nepalensis NCYC 3413
2011-02
[28]
논문
Attenuating effect of casein glycomacropeptide on proliferation, differentiation, and lipid accumulation of in vitro Sprague-Dawley rat preadipocytes
https://archive.org/[...]
2011-02
[29]
논문
Molecular and functional characterization of novel glycerol-3-phosphate dehydrogenase 1 like gene (GPD1-L) mutations in sudden infant death syndrome
2007-11
[30]
논문
The target of metformin in type 2 diabetes
2014-10
[31]
논문
A potential target enzyme for trypanocidal drugs revealed by the crystal structure of NAD-dependent glycerol-3-phosphate dehydrogenase from Leishmania mexicana
2000-05
[32]
논문
A dimer interface mutation in glyceraldehyde-3-phosphate dehydrogenase regulates its binding to AU-rich RNA
2015-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

