다이하이드로리포일 아세틸기전이효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
다이하이드로리포일 아세틸기전이효소는 아세틸-CoA:효소 N6-(다이하이드로리포일)리신 S-아세틸기전이효소라고도 불리며, 피루브산 탈수소효소 복합체의 구성 효소이다. 이 효소는 3개의 리포일 도메인, 상호작용 도메인, 촉매 도메인으로 구성된 다중 도메인 구조를 가지며, 종에 따라 24개 또는 60개의 소단위체로 배열되어 입방체 또는 12면체 모양을 형성한다. 다이하이드로리포일 아세틸기전이효소는 해당과정과 시트르산 회로를 연결하는 피루브산 탈카복실화 반응에 관여하며, 원발 쓸개관 간경화 및 피루브산 탈수소효소 결핍증과 같은 질병과 관련이 있다.
더 읽어볼만한 페이지
- EC 2.3.1 - 지방산 생성효소
지방산 생성효소는 지방산 합성을 촉매하는 효소로, I형과 II형으로 나뉘며, 다양한 생물체에서 발견되고, 암, 고지혈증 등 질병과 관련되어 약물 개발의 표적으로 연구된다. - EC 2.3.1 - 지방산 아실-CoA 생성효소
지방산 아실-CoA 생성효소는 지방산, 조효소 A, ATP를 이용하여 지방산 아실-CoA를 생성하는 효소로서, 지방산 대사에서 중요한 역할을 하며 I형은 진핵생물, II형은 원핵생물에서 발견되고 암, 비만 등의 질병과 관련되어 연구되고 있습니다. - 미토콘드리아 단백질 - 시트르산 생성효소
시트르산 생성효소는 옥살아세트산과 아세틸-CoA를 결합하여 시트르산을 생성하는 효소로, ATP:ADP 비율, NADH:NAD 비율, 석시닐-CoA, 프로피오닐-CoA, 시트르산 등에 의해 활성이 조절되어 TCA 회로를 조절한다. - 미토콘드리아 단백질 - 내막의 자리옮김효소
미토콘드리아 내막의 자리옮김효소는 TIM23과 TIM22 복합체로 나뉘어 각각 다른 메커니즘과 구성 요소로 단백질 이동 및 삽입을 돕는다. - 인간 11번 염색체상 유전자 - 뇌유래신경영양인자
뇌유래신경영양인자(BDNF)는 TrkB 및 p75 수용체에 결합하여 신경세포의 생존, 성장, 분화를 촉진하는 단백질로서 뇌의 학습, 기억, 고차원적 사고에 중요한 역할을 하며, 운동, 니아신 섭취, 다양한 신경정신 질환, 시냅스 가소성 조절, 신경 발생 등과 관련되어 있고 유전자 변이는 기능에 영향을 줄 수 있다. - 인간 11번 염색체상 유전자 - 젖산 탈수소효소
젖산 탈수소효소(LDH)는 피루브산을 젖산으로 또는 그 역반응을 촉매하는 효소로, 해당 과정과 코리 회로에서 작용하며, 5가지 동질효소 형태로 존재하고, 혈청 내 수치는 조직 손상 지표로 사용되며, 암세포 에너지 대사 및 유전 질환과도 관련되어 그 기능과 관련 질환에 대한 연구가 지속적으로 진행되고 있다.
2. 명명법
다이하이드로리포일 아세틸기전이효소의 계통명은 '''아세틸-CoA:효소 N6-(다이하이드로리포일)리신 ''S''-아세틸기전이효소'''(acetyl-CoA:enzyme N6-(dihydrolipoyl)lysine ''S''-acetyltransferase영어)이다.
일반적으로 사용되는 다른 이름들은 다음과 같다.
- '''아세틸-CoA:다이하이드로리포아마이드 ''S''-아세틸기전이효소'''(acetyl-CoA:dihydrolipoamide ''S''-acetyltransferase영어)
- '''아세틸-CoA:효소 6-''N''-(다이하이드로리포일)리신 ''S''-아세틸기전이효소'''(acetyl-CoA:enzyme 6-''N''-(dihydrolipoyl)lysine ''S''-acetyltransferase영어)
- '''다이하이드로리포아마이드 ''S''-아세틸기전이효소'''(dihydrolipoamide ''S''-acetyltransferase영어)
- '''다이하이드로리포산 아세틸기전이효소'''(dihydrolipoate acetyltransferase영어)
- '''다이하이드로리포산 트랜스아세틸레이스'''(dihydrolipoic transacetylase영어)
- '''다이하이드로리포일 트랜스아세틸레이스'''(dihydrolipoyl transacetylase영어)
- '''효소-다이하이드로리포일리신:아세틸-CoA ''S''-아세틸기전이효소'''(enzyme-dihydrolipoyllysine:acetyl-CoA ''S''-acetyltransferase영어)
- '''리포산 아세틸기전이효소'''(lipoate acetyltransferase영어)
- '''리포산 트랜스아세틸레이스'''(lipoate transacetylase영어)
- '''리포일아세틸기전이효소'''(lipoylacetyltransferase영어)
- '''싸이올트랜스아세틸레이스 A'''(thioltransacetylase A영어)
- '''트랜스아세틸레이스 X'''(transacetylase X영어)
3. 구조
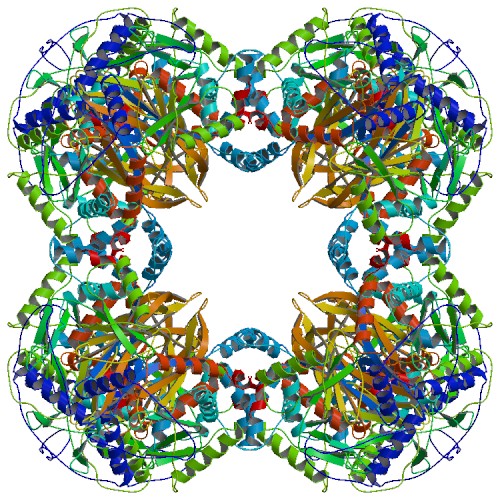
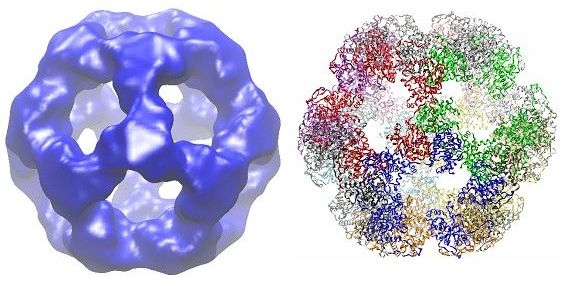
다이하이드로리포일 아세틸기전이효소는 N 말단에서 C 말단 순서로 3개의 리포일 도메인, 상호작용 도메인, 촉매 도메인으로 구성된 독특한 다중 도메인 구조를 가진다. 각 도메인은 무질서하고 복잡성이 낮은 링커 영역으로 연결되어 있다.
종에 따라 다이하이드로리포일 아세틸기전이효소의 여러 소단위체는 입방체 또는 12면체 모양으로 배열될 수 있다. 이러한 구조는 피루브산 탈수소효소 복합체의 촉매 핵심을 형성하며, 아세틸기를 CoA로 전달하는 반응을 촉매하고 전체 복합체의 구조를 생성하는 데 중요한 역할을 한다.[15]
3. 1. 소단위체 배열
모든 다이하이드로리포일 아세틸기전이효소는 3개의 리포일 도메인, 상호작용 도메인, 촉매 도메인으로 구성된(N에서 C까지) 독특한 다중 도메인 구조를 가지고 있다. 모든 도메인은 무질서하고 복잡성이 낮은 링커 영역에 의해 연결된다.종에 따라 다이하이드로리포일 아세틸기전이효소의 여러 소단위체는 입방체 또는 12면체 모양으로 함께 배열될 수 있다. 이러한 구조는 아세틸기를 CoA로 전달하는 반응을 촉매할 뿐만 아니라 전체 복합체의 구조를 생성하는 데 중요한 구조적 역할을 수행하는 피루브산 탈수소효소 복합체의 촉매 핵심을 형성한다.[15]
아조토박터 비넬란디이(''Azotobacter vinelandii'')와 같은 종에서 발견되는 입방체 코어 구조는 총 24개의 소단위체로 구성된다.[16][17] 촉매 도메인은 소단위체 인터페이스에 위치한 활성 부위와 함께 삼량체로 조립된다. 이 삼량체 활성 부위의 위상은 클로람페니콜 아세틸기전이효소의 위상과 동일하다. 그런 다음 이러한 삼량체 중 8개를 속이 빈 잘린 입방체로 배열한다. 두 개의 주요 기질인 CoA와 리포아마이드(Lip(SH)2)는 소단위체 사이를 흐르며 촉매 중심을 형성하는 30Å 길이 통로의 두 반대쪽 입구에서 발견된다. CoA는 입방체의 내부로부터 들어가고 리포아마이드는 외부로부터 들어간다.[18]
게오바실루스 스테아로테르모필루스(''Geobacillus stearothermophilus'') 및 엔테로코쿠스 파에칼리스(''Enterococcus faecalis'')[15]와 같은 세균 뿐만 아니라 사람[19]과 소[20]와 같은 포유류를 포함한 많은 종에서 12면체 코어 구조는 총 60개의 소단위체로 구성된다. 소단위체는 입방체 코어 모양의 삼량체와 유사하게 3개의 세트로 배열되며, 각 세트는 20개의 정십이면체 꼭지점 중 하나를 구성한다.
3. 2. 활성 부위
아조토박터 비넬란디이( ''Azotobacter vinelandii'')와 같은 종에서 발견되는 입방체 코어 구조는 총 24개의 소단위체로 구성된다.[16][17] 촉매 도메인은 소단위체 인터페이스에 위치한 활성 부위와 함께 삼량체로 조립된다. 이 삼량체 활성 부위의 위상은 클로람페니콜 아세틸기전이효소의 위상과 동일하다. 그런 다음 이러한 삼량체 중 8개를 속이 빈 잘린 입방체로 배열한다. 두 개의 주요 기질인 CoA와 리포아마이드(Lip(SH)2)는 소단위체 사이를 흐르며 촉매 중심을 형성하는 30Å 길이 통로의 두 반대쪽 입구에서 발견된다. CoA는 입방체의 내부로부터 들어가고 리포아마이드는 외부로부터 들어간다.[18]4. 기능
다이하이드로리포일 아세틸기전이효소는 해당과정과 시트르산 회로를 연결하는 피루브산 탈카복실화 반응에 참여한다. 이 대사 과정은 영양분의 생화학적 에너지를 아데노신 삼인산(ATP)으로 변환하여 세포 내에서 수많은 생물학적 반응을 수행하는 세포 호흡에 중요하다. 세포 호흡의 다양한 단계는 세포의 다른 부분에서 일어난다. 진핵생물에서 해당과정은 세포질에서 일어나고, 피루브산의 산화와 시트르산 회로는 미토콘드리아 기질에서 일어나며, 산화적 인산화는 미토콘드리아 내막에서 일어난다. 따라서 피루브산 탈수소효소 복합체(다이하이드로리포일 아세틸기전이효소를 포함)는 진핵생물의 미토콘드리아(원핵생물에서는 세포질)에서 발견된다.[1]
4. 1. 촉매 메커니즘
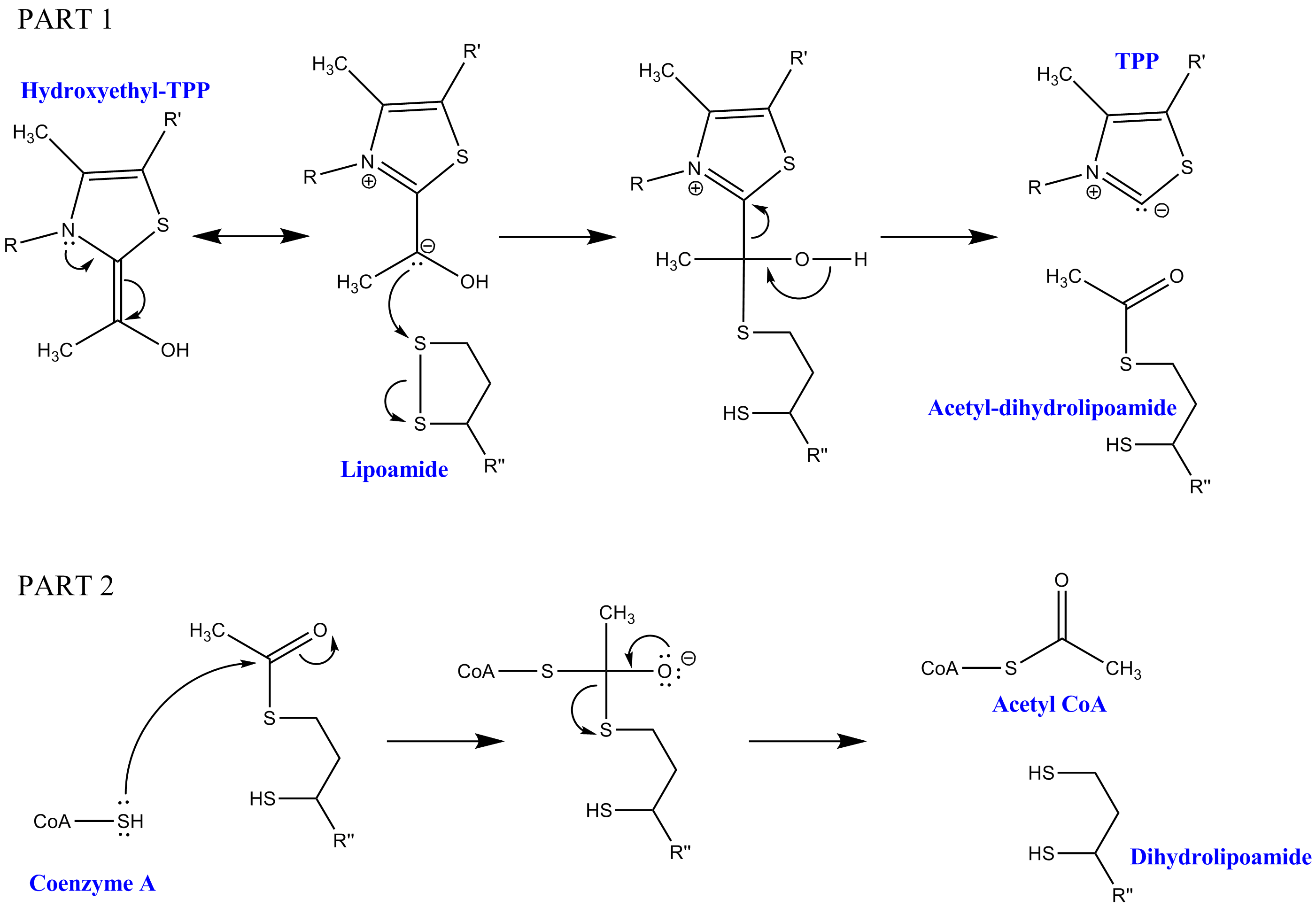
피루브산 탈수소효소 복합체를 구성하는 3가지 효소 외에 5가지 보조 인자가 피루브산 탈카복실화에 필요하다. 3가지 효소는 피루브산 탈수소효소(E1), 다이하이드로리포일 아세틸기전이효소(E2), 다이하이드로리포일 탈수소효소(E3)이고, 5가지 보조 인자는 티아민 피로인산(TPP), 리포산, 조효소 A(CoA), 니코틴아마이드 아데닌 다이뉴클레오타이드(NAD+), 플라빈 아데닌 다이뉴클레오타이드(FAD)이다. 첫 번째 보조 인자인 티아민 피로인산(TPP)은 피루브산 탈수소효소에 의해 피루브산을 산화하고 하이드록시에틸-TPP 중간생성물을 형성하는 데 사용된다. 이 중간생성물은 다이하이드로리포일 아세틸기전이효소에 의해 흡수되고 두 번째 보조 인자인 리포아마이드와 반응하여 아세틸-다이하이드로리포일 중간생성물을 생성하고 이 과정에서 티아민 피로인산(TPP)을 방출한다. 이 두 번째 중간생성물은 조효소 A(CoA)에 부착된 친핵성 황의 공격을 받아 다이하이드로리포아마이드가 방출되게 된다. 이로 인해 피루브산 탈카복실화의 최종 목표인 아세틸-CoA가 생성된다. 다이하이드로리포아마이드는 다이하이드로리포일 탈수소효소에 의해 흡수되고 추가적인 보조 인자인 FAD 및 NAD+와 함께 원래의 리포아마이드(유용한 부산물인 NADH를 포함)를 재생한다.
5. 임상적 중요성
다이하이드로리포일 아세틸기전이효소는 원발 쓸개관 간경화(PBC) 및 피루브산 탈수소효소 결핍증(PDCD)과 관련이 있다. 원발 쓸개관 간경화는 자가면역 질환으로, 이 효소가 주요 항원으로 작용한다.[21] 피루브산 탈수소효소 결핍증은 유전 질환으로, 드물게 E2 소단위체의 돌연변이로 인해 발생하며, 이 경우 비교적 가벼운 증상을 보인다.[24]
5. 1. 원발 쓸개관 간경화 (Primary Biliary Cirrhosis, PBC)
원발 쓸개관 간경화(PBC)는 미토콘드리아 항원 및 핵 항원에 대한 자가항체가 특징인 자가면역 질환이다. 이들은 각각 항미토콘드리아 항체(AMA)와 항핵항체(ANA)라고 한다. 이들 항체는 원발 쓸개관 간경화 환자의 혈청에서 검출 가능하며 항원결정기 특이성과 관련하여 환자마다 크게 다르다. 원발 쓸개관 간경화 환자에서 자가항체 반응성을 생성할 수 있는 미토콘드리아 항원 중에서 피루브산 탈수소효소 복합체의 E2 소단위체인 다이하이드로리포일 아세틸기전이효소가 가장 일반적인 항원결정기이다(다른 항원에는 α-케토글루타르산 탈수소효소 복합체의 효소 뿐만 아니라 피루브산 탈수소효소 복합체의 다른 효소들도 포함된다).[21] 최근의 증거에 따르면 촉매 부위 내의 펩타이드가 원발 쓸개관 간경화 환자의 항-피루브산 탈수소효소 복합체-E2 항체(항-PDC-E2 항체)에 의해 인식되는 면역우세 항원결정기를 나타낼 수 있음이 제시되었다.[22] 자가면역성 간염(AIH) 환자에게서도 항-PDC-E2 항체가 나타난다는 증거도 있다.[23]5. 2. 피루브산 탈수소효소 결핍증 (Pyruvate Dehydrogenase Deficiency, PDCD)
피루브산 탈수소효소 결핍증(PDCD)은 유아기 및 유년기 초기에 젖산산증과 신경학적 기능 장애를 일으키는 유전 질환이다. 일반적으로 피루브산 탈수소효소 결핍증은 피루브산 탈수소효소 복합체의 E1 소단위체에 대한 X 연관 유전자의 돌연변이의 결과이다. 그러나 피루브산 탈수소효소 결핍증 환자가 실제로 E2 소단위체에 대한 상염색체 유전자에 돌연변이를 갖는 경우는 드물다. 이 환자들은 훨씬 덜 심각한 증상을 보이는 것으로 보고되었으며, 가장 두드러진 질병 증상은 일시적 근육긴장이상이지만 근육긴장저하와 운동실조도 모두 존재했다.[24]참조
[1]
논문
Chromosome localization and RFLP analysis of PDC-E2: the major autoantigen of primary biliary cirrhosis
[2]
논문
Crystallographic analysis of substrate binding and catalysis in dihydrolipoyl transacetylase (E2p)
1993-04
[3]
논문
Principles of quasi-equivalence and Euclidean geometry govern the assembly of cubic and dodecahedral cores of pyruvate dehydrogenase complexes
1999-02
[4]
논문
The pyruvate dehydrogenase multi-enzyme complex from Gram-negative bacteria
1998-06
[5]
논문
The quaternary structure of the dihydrolipoyl transacetylase component of the pyruvate dehydrogenase complex from Azotobacter vinelandii. A reconsideration
1989-02
[6]
논문
Atomic structure of the cubic core of the pyruvate dehydrogenase multienzyme complex
1992-03
[7]
논문
Subunit and catalytic component stoichiometries of an in vitro reconstituted human pyruvate dehydrogenase complex
2009-05
[8]
논문
The remarkable structural and functional organization of the eukaryotic pyruvate dehydrogenase complexes
2001-12
[9]
논문
The peculiar autoimmunity of primary biliary cirrhosis
http://www3.intersci[...]
2000-04
[10]
논문
Catalytic domain of PDC-E2 contains epitopes recognized by antimitochondrial antibodies in primary biliary cirrhosis
2010-02
[11]
논문
Long-term follow-up of antimitochondrial antibody-positive autoimmune hepatitis
2008-08
[12]
논문
Clinical and genetic spectrum of pyruvate dehydrogenase deficiency: dihydrolipoamide acetyltransferase (E2) deficiency
2005-08
[13]
논문
Chromosome localization and RFLP analysis of PDC-E2: the major autoantigen of primary biliary cirrhosis
[14]
논문
Crystallographic analysis of substrate binding and catalysis in dihydrolipoyl transacetylase (E2p)
1993-04
[15]
논문
Principles of quasi-equivalence and Euclidean geometry govern the assembly of cubic and dodecahedral cores of pyruvate dehydrogenase complexes
1999-02
[16]
논문
The pyruvate dehydrogenase multi-enzyme complex from Gram-negative bacteria
1998-06
[17]
논문
The quaternary structure of the dihydrolipoyl transacetylase component of the pyruvate dehydrogenase complex from Azotobacter vinelandii. A reconsideration
1989-02
[18]
논문
Atomic structure of the cubic core of the pyruvate dehydrogenase multienzyme complex
https://archive.org/[...]
1992-03
[19]
논문
Subunit and catalytic component stoichiometries of an in vitro reconstituted human pyruvate dehydrogenase complex
2009-05
[20]
논문
The remarkable structural and functional organization of the eukaryotic pyruvate dehydrogenase complexes
2001-12
[21]
논문
The peculiar autoimmunity of primary biliary cirrhosis
http://www3.intersci[...]
2000-04
[22]
논문
Catalytic domain of PDC-E2 contains epitopes recognized by antimitochondrial antibodies in primary biliary cirrhosis
2010-02
[23]
논문
Long-term follow-up of antimitochondrial antibody-positive autoimmune hepatitis
2008-08
[24]
논문
Clinical and genetic spectrum of pyruvate dehydrogenase deficiency: dihydrolipoamide acetyltransferase (E2) deficiency
https://archive.org/[...]
2005-08
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com