사산화 오스뮴
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
사산화 오스뮴(OsO₄)은 옅은 황갈색의 결정성 고체로, 염소 냄새와 유사한 특유의 냄새를 가지며, 휘발성이 있어 상온에서 승화한다. 오스뮴 금속 분말과 산소를 반응시켜 합성하며, 유기 합성에서 알켄을 다이올로 산화시키는 데 사용된다. 또한 투과 전자 현미경(TEM)에서 지질 염색제로 사용되며, 오스뮴 광석 정제 및 풀러렌 부가물 형성에도 활용된다. 사산화 오스뮴은 독성이 강하며, 특히 눈에 접촉 시 실명을 유발할 수 있으므로 취급에 주의해야 한다.
더 읽어볼만한 페이지
- 전이 금속 산화물 - 산화 철
산화 철은 철과 산소의 화합물로, 철의 산화 상태에 따라 다양한 화학량론적 조성을 가지며, 안료, 화장품, 식품 첨가물 등 다양한 산업 분야에서 활용된다. - 전이 금속 산화물 - 이산화 타이타늄
이산화 타이타늄(TiO₂)은 흰색 안료, 자외선 차단제, 광촉매 등 다양한 용도로 사용되는 무기 화합물이며, 높은 굴절률과 은폐력을 지니고 금홍석, 예휘석 등의 광물 형태로 자연에 존재하지만, 식품 첨가물로서의 안전성과 나노 입자 형태의 유해성에 대한 연구가 진행 중이고, 주로 일메나이트 광물에서 추출되어 황산법과 염소법으로 생산된다. - 염색 염료 - H&E 염색
H&E 염색은 헤마톡실린과 에오신을 사용하여 조직의 핵은 파란색 또는 보라색으로, 세포질은 분홍색 또는 붉은색으로 염색하는 조직학적 염색법이다. - 염색 염료 - 질-닐슨 염색
질-닐슨 염색은 결핵균 등 항산성 세균 검출을 위해 개발된 염색 방법으로, 석탄산 푹신으로 1차 염색 후 산성 알코올로 탈색하고 대비 염색하여 항산성 세균을 붉은색으로, 비항산성 세균을 다른 색으로 염색한다.
2. 물리적 특성
사산화 오스뮴은 옅은 황갈색의 결정성 고체로, 염소와 유사한 특유의 냄새를 가진다.[3][28] 화학 원소 이름은 그리스어로 냄새를 뜻하는 ''osme''에서 유래되었다. 휘발성이 있어 상온에서 승화한다. 다양한 유기 용매에 용해되며, 물에도 약간 용해되어 가역적으로 반응하여 오스뮴산(osmic acid)을 형성한다.[8] '순수한' 사산화 오스뮴은 무색으로 추정되지만,[9] 황색을 띠는 것은 이산화 오스뮴 (OsO2) 불순물 때문으로 여겨진다.[10] 사산화 오스뮴 분자는 사면체 구조를 가지므로 무극성이다. 이러한 무극성은 사산화 오스뮴이 하전된 세포막을 통과하는 데 도움을 준다. 단사정계 결정을 형성한다.[3][28]
사산화 오스뮴(osmium tetroxide영어)은 오스뮴 가루가 실온에서 산소(O2)와 반응하여 천천히 생성된다. 덩어리 형태의 오스뮴은 400°C로 가열해야 반응한다.[11] 반응식은 다음과 같다.
알켄은 사산화 오스뮴(OsO4)과 반응하여 다이올레이트를 생성하며, 이는 가수분해되어 ''시스''-다이올을 생성한다. 이 과정을 이중 수산화 반응이라고 부른다. 이 반응은 OsO4와 알켄 간의 [3+2] 고리 첨가 반응을 통해 중간체 오스메이트 에스테르를 형성하며, 이는 빠르게 가수분해되어 인접 다이올을 생성한다. 산소 원자는 협동적인 단계로 첨가되므로, 결과적인 입체화학은 ''시스''이다.[12]
3. 구조 및 전자 구성
사산화 오스뮴(OsO4)에서 오스뮴은 +8의 산화수를 가지며, 이는 전이금속이 가질 수 있는 가장 높은 산화 상태이다. 오스뮴 원자는 8개의 외곽 전자를 가진다. 4개의 산화 리간드로부터 각각 2개의 전자가 공유되면 전체 전자 수는 과망가니즈산염, 크롬산염과 같이 16개가 된다.
주족 원소와 전이금속의 화학적 성질을 비교하면 이 화합물에서 오스뮴의 높은 산화 상태를 설명할 수 있다. 3족에서 7족 원소들이 화합물을 형성하는 것처럼, 13족에서 17족 원소들도 유사한 화합물을 형성한다. 예를 들어 TiCl4와 GeCl4, VF5와 AsF5, CrO42−와 SeO42− 등이 있다. 따라서 8족 원소들이 비활성 기체와 유사한 화합물을 형성할 것으로 짐작할 수 있으며, 이는 OsO4나 XeO4의 경우처럼 명백한 사실이다.
사산화 오스뮴(OsO4)의 오스뮴은 VIII의 산화수를 갖지만, 금속은 8+ 전하를 갖지 않는다. 왜냐하면 화합물의 결합이 주로 공유 결합 특성을 띠기 때문이다. (형식적인 8+ 전하를 생성하는 데 필요한 이온화 에너지는 일반적인 화학 반응에서 얻을 수 있는 에너지를 훨씬 초과한다.) 오스뮴 원자는 네 개의 산화물 리간드와 이중 결합을 하여 16 전자 복합체를 형성하며, 과망가니즈산염 및 크롬산 이온과 전자수가 같다.
4. 합성
:Os + 2 O2 → OsO4
5. 반응
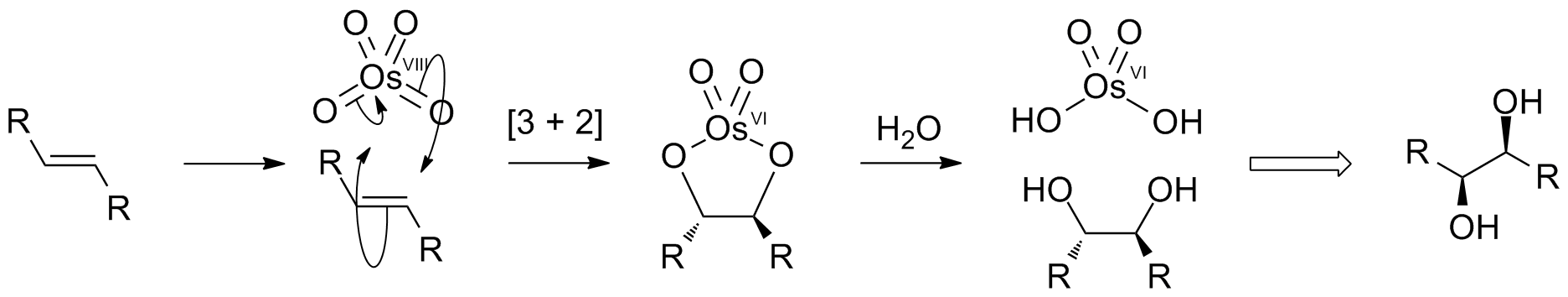
사산화 오스뮴(OsO4)은 비싸고 독성이 강하여 화학량론적 양으로 사용하기에는 적합하지 않다. 그러나 부산물인 Os(VI)를 다시 Os(VIII)로 재산화하기 위해 재산화제를 첨가하여 반응을 촉매 반응으로 만들 수 있다. 일반적인 재산화제로는 H2O2 (밀라스 수산화 반응), N-메틸모르폴린 N-옥사이드 (업존 이중 수산화 반응), K3Fe(CN)6/물 등이 있다. 이러한 재산화제는 단독으로는 알켄과 반응하지 않는다. 다른 오스뮴 화합물도 촉매로 사용할 수 있는데, 오스메이트(VI) 염 ([OsO2(OH)4)]2−) 및 삼염화 오스뮴 수화물 (OsCl3·''x''H2O) 등이 있다. 이러한 종들은 산화제의 존재 하에 오스뮴(VIII)로 산화된다.[12]
3급 아민 및 피리딘과 같은 루이스 염기는 이중 수산화 반응의 속도를 증가시킨다. 이 "리간드-가속"은 첨가물 OsO4L의 형성을 통해 발생하며, 이는 알켄에 더 빠르게 첨가된다. 아민이 키랄성인 경우, 이중 수산화 반응은 거울상 선택성을 가지고 진행될 수 있다 (샤플레스 비대칭 이중 수산화 반응 참조).[13] 사산화 오스뮴(OsO4)은 대부분의 탄수화물과 반응하지 않는다.[24]
과요오드산염을 사용하여 다이올 절단을 수행하고 촉매량의 OsO4를 재생성하는 르뮤-존슨 산화에서 두 개의 알데히드를 생성하도록 이 과정을 확장할 수 있다. 이 과정은 오존 분해와 동일하다.
유기 합성에서 사산화 오스뮴(OsO4)은 알켄을 인접 다이올로 산화시키는 데 널리 사용되며, 두 개의 수산기를 동일한 방향으로 첨가한다(신 부가). 이 반응은 촉매 반응(업존 다이하이드록실화) 및 비대칭 반응(샤플레스 비대칭 다이하이드록실화)으로 이루어졌다. 사산화 오스뮴은 또한 샤플레스 옥시아미네이션에서 촉매량으로 사용되어 인접 아미노 알코올을 생성한다.
과요오드산 나트륨과 조합하여 사산화 오스뮴은 알켄의 산화적 절단에 사용된다(르미외-존슨 산화). 과요오드산염은 다이하이드록실화로 형성된 다이올을 절단하고 OsO3을 OsO4로 재산화시키는 역할을 한다. 순변환은 오존 분해에 의해 생성된 것과 동일하다. 다음은 이소스테비올의 총합성에서 얻은 예시이다.[19]
5. 1. 배위 화학
사산화 오스뮴(OsO4)은 루이스 산이자 온화한 산화제이다. 알칼리성 수용액과 반응하여 과오스메이트 음이온(
)을 생성한다.[15] 이 종은 쉽게 오스메이트 음이온()으로 환원된다.
루이스 염기가 아민일 경우 부가물이 형성되기도 한다. 따라서 사산화 오스뮴은 OsO4가 배위되어 있는 '''오스메스''' 형태로 저장할 수 있으며, 이때 헥사민과 결합한다. 오스메스는 테트라하이드로푸란(THF)에 용해된 후 수성 완충 용액에서 희석하여 묽은 (0.25%) 사산화 오스뮴의 작동 용액을 만들 수 있다.[16]
tert-BuNH2와 반응하면, 이미도 유도체가 생성된다:
:OsO4 + Me3CNH2 → OsO3(NCMe3) + H2O
마찬가지로, NH3와 반응하면 니트리도 착물을 얻을 수 있다:
:OsO4 + NH3 + KOH → K[Os(N)O3] + 2 H2O
[Os(N)O3]− 음이온은 OsO4와 등전자 및 등구조적이다.
사산화 오스뮴은 tert-부틸 알코올에 매우 잘 녹는다. 용액 상태에서 수소에 의해 쉽게 오스뮴 금속으로 환원된다. 부유된 오스뮴 금속은 이중 또는 삼중 결합을 포함하는 광범위한 유기 화학 물질을 촉매적으로 수소화하는 데 사용할 수 있다.
:OsO4 + 4 H2 → Os + 4 H2O
사산화 오스뮴은 400 K 및 200 sbar에서 메탄올 내 일산화 탄소와 "환원성 카르보닐화" 반응을 거쳐 삼각 클러스터 Os3(CO)12를 생성한다:
:3 OsO4 + 24 CO → Os3(CO)12 + 12 CO2[1]
5. 2. 옥소플루오라이드
사산화 오스뮴은 여러 종류의 옥소플루오라이드를 형성하며, 이들은 모두 수분에 매우 민감하다.
보라색 ''cis''-OsO2F4는 무수 HF 용액에서 77 K에서 형성된다.[17]
: OsO4 + 2 KrF2 → ''cis''-OsO2F4 + 2 Kr + O2
OsO4는 F2와 반응하여 노란색 OsO3F2를 형성하기도 한다.[18]
: 2 OsO4 + 2 F2 → 2 OsO3F2 + O2
OsO4는 298 K에서 1당량의 [Me4N]F와, 253 K에서 2당량의 [Me4N]F와 반응한다.[1]
: OsO4 + [Me4N]F → [Me4N][OsO4F]
: OsO4 + 2 [Me4N]F → [Me4N]2[''cis''-OsO4F2]
6. 응용
사산화 오스뮴(OsO4)은 다음과 같은 다양한 분야에서 활용된다.
- 유기 합성: 알켄을 인접 다이올로 산화시키는 데 널리 사용되며, 두 개의 수산기를 같은 방향으로 첨가한다.[19] 이 반응은 업존 다이하이드록실화와 샤플레스 비대칭 다이하이드록실화와 같은 촉매 반응으로도 이루어진다. 또한 샤플레스 옥시아미네이션에서 촉매량으로 사용되어 인접 아미노 알코올을 생성하며, 과요오드산 나트륨과 함께 사용하여 알켄의 산화적 절단(르미외-존슨 산화)에도 사용된다.[19]
- 생물학적 염색: 투과 전자 현미경(TEM)에서 영상의 대비를 높이기 위해 널리 사용되는 염색 시약이다.[20] 지질 염색제로, 주사 전자 현미경(SEM)에서도 스퍼터 코팅의 대안으로 유용하다. 세포막에 직접 중금속을 삽입하여 높은 전자 산란율을 생성하며, 세포막 염색에서 인지질 머리 부분에 결합하여 인접한 원형질과 대비를 이룬다.[24]
6. 1. 유기 합성
알켄은 사산화 오스뮴(OsO4)에 부가되어 다이올레이트 종을 생성하며, 이는 가수분해되어 ''시스''-다이올을 생성한다. 이 순 과정은 이중 수산화 반응이라고 불린다. 이는 OsO4와 알켄 간의 [3+2] 고리 첨가 반응을 통해 진행되어 중간체 오스메이트 에스테르를 형성하며, 이는 빠르게 가수분해되어 인접 다이올을 생성한다. 산소 원자는 협동적인 단계로 첨가되므로, 결과적인 입체화학은 ''시스''이다.[12]OsO4는 비싸고 독성이 강하여 화학량론적 양으로 사용하기에 매력적이지 않은 시약이다. 그러나 부산물인 Os(VI)를 다시 Os(VIII)로 재산화하기 위해 재산화제를 첨가하여 반응을 촉매적으로 만들 수 있다. 일반적인 시약으로는 H2O2 (밀라스 수산화 반응), N-메틸모르폴린 N-옥사이드 (업존 이중 수산화 반응), K3Fe(CN)6/물이 있다. 이러한 재산화제는 단독으로는 알켄과 반응하지 않는다. 다른 오스뮴 화합물도 촉매로 사용할 수 있는데, 오스메이트(VI) 염 ([OsO2(OH)4)]2−) 및 삼염화 오스뮴 수화물 (OsCl3·''x''H2O) 등이 있다. 이러한 종들은 이러한 산화제의 존재 하에 오스뮴(VIII)로 산화된다.[12]
3급 아민 및 피리딘과 같은 루이스 염기는 이중 수산화 반응의 속도를 증가시킨다. 이 "리간드-가속"은 첨가물 OsO4L의 형성을 통해 발생하며, 이는 알켄에 더 빠르게 첨가된다. 아민이 키랄성인 경우, 이중 수산화 반응은 거울상 선택성을 가지고 진행될 수 있다 (샤플레스 비대칭 이중 수산화 반응 참조).[13] OsO4는 대부분의 탄수화물과 반응하지 않는다.[24]
이 과정은 과요오드산염을 사용하여 다이올 절단을 수행하고 촉매량의 OsO4를 재생성하는 르뮤-존슨 산화에서 두 개의 알데히드를 생성하도록 확장할 수 있다. 이 과정은 오존 분해와 동일하다.
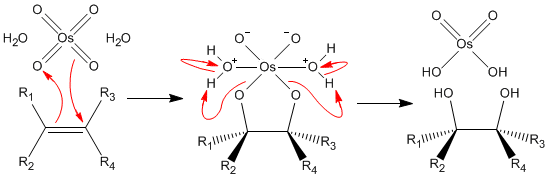
유기 합성에서 사산화 오스뮴(OsO4)은 알켄을 인접 다이올로 산화시키는 데 널리 사용되며, 두 개의 수산기를 동일한 방향으로 첨가한다(신 부가). 이 반응은 촉매 반응(업존 이중 수산화 반응) 및 비대칭 반응(샤플레스 비대칭 이중 수산화 반응)으로 이루어졌다.
사산화 오스뮴은 또한 샤플레스 옥시아미네이션에서 촉매량으로 사용되어 인접 아미노 알코올을 생성한다.
과요오드산 나트륨과 조합하여 사산화 오스뮴은 알켄의 산화적 절단에 사용된다(르뮤-존슨 산화). 과요오드산 나트륨은 다이하이드록실화로 형성된 다이올을 절단하고 OsO3을 OsO4로 재산화시키는 역할을 한다. 순변환은 오존 분해에 의해 생성된 것과 동일하다.
6. 2. 생물학적 염색
사산화 오스뮴(OsO4)은 투과 전자 현미경(TEM)에서 영상의 대비를 높이기 위해 널리 사용되는 염색 시약이다.[20] 이 염색 방법은 OTO[21][22] (오스뮴-티오카르보하이드라지드-오스뮴) 방법, 오스뮴 함침[23] 기술 또는 단순히 오스뮴 염색으로 알려져 있다. 지질 염색제이며, 스퍼터 코팅의 대안으로 주사 전자 현미경(SEM)에서도 유용하다. 사산화 오스뮴은 세포막에 직접 중금속을 삽입하여 높은 전자 산란율을 생성하는데, 이는 세포막의 세부 사항을 가릴 수 있는 금속층으로 막을 코팅할 필요가 없게 한다. 세포막 염색에서 사산화 오스뮴은 인지질 머리 부분에 결합하여 인접한 원형질(세포질)과 대비를 이룬다.또한, 사산화 오스뮴은 염화수은(HgCl2)과 함께 생물학적 시료를 고정하는 데에도 사용된다. 사산화 오스뮴의 빠른 살상 능력은 원생동물과 같은 살아있는 표본을 신속하게 죽이는 데 사용된다. OsO4는 구조적 특징을 파괴하지 않고 많은 단백질을 겔로 변환시켜 안정화시킨다. OsO4에 의해 안정화된 조직 단백질은 탈수 과정에서 알코올에 의해 응고되지 않는다.[24] 사산화 오스뮴은 광학 현미경에서 지질 염색제로도 사용된다.[25]

전자 현미경을 사용하여 생물 시료나 고분자 합금 등의 시료를 관찰할 때, 콘트라스트를 증강하기 위해 사산화 오스뮴이 사용되는 경우가 있다. 이러한 기법은 '''오스뮴 염색'''·'''도전 염색'''이라고 불린다. 산화 오스뮴(VIII)은 탄소-탄소 이중 결합에 부가되는 성질이 있다. 시료를 산화 오스뮴(VIII) 수용액 또는 증기 속에 방치한 후 전자 현미경으로 관찰하면, 시료 중 탄소-탄소 이중 결합이 있는 부분(예: 폴리부타디엔)이 짙게 보이고, 그 외의 부분(예: PMMA)은 그대로이므로, 각 물질이 어떻게 분포하고 있는지를 쉽게 판단할 수 있다.
또한, 생물 시료 등을 전자 현미경으로 관찰할 때, 전처리로서 팔라듐이나 금, 백금 등의 금속 박막을 증착할 때, 박막의 부착성 및 균일성을 높이기 위해 산화 오스뮴(VIII) 처리를 하는 경우가 있다. 전자 현미경이나 전자선을 입사하는 분석 장치를 위해 비정질 도전성 막을 성막할 수 있는 코팅 장치가 시판되고 있다.
6. 3. 고분자 염색
사산화 오스뮴은 공중합체, 특히 블록 공중합체를 선택적으로 염색하여 재료의 미세 구조를 보여주는 데 사용된다. 예를 들어 스티렌-부타디엔 블록 공중합체는 폴리스티렌 엔드 캡이 있는 중앙 폴리부타디엔 사슬을 가지고 있는데, OsO4로 처리하면 부타디엔 매트릭스가 우선적으로 반응하여 산화물을 흡수한다. 중금속이 존재하면 전자빔을 차단하기에 충분하므로, TEM에서 얇은 필름 내 폴리스티렌 도메인을 명확하게 볼 수 있다.[20]6. 4. 오스뮴 광석 정제
사산화 오스뮴(OsO4)은 오스뮴 광석에서 오스뮴을 추출하는 과정의 중간 생성물이다. 오스뮴을 함유한 잔류물은 과산화 나트륨(Na2O2)으로 처리하여 수용성인 Na2[OsO4(OH)2]를 형성한다. 이 염은 염소에 노출되면 OsO4를 생성한다. 정제의 마지막 단계에서 조잡한 OsO4는 알코올성 NaOH에 용해되어 Na2[OsO2(OH)4]를 형성하며, 이 물질을 NH4Cl으로 처리하면 (NH4)4[OsO2Cl2]가 생성된다. 이 염은 수소 하에서 환원되어 오스뮴을 생성한다.[8]6. 5. 버크민스터풀러렌 부가물
사산화 오스뮴(OsO4)은 60개의 탄소 동소체인 버크민스터풀러렌의 축구공 모델을 확인하는 데 사용되었다. OsO4의 유도체로 형성된 부가물은 C60(OsO4)(4-''tert''-뷰틸피리딘)2였다. 이 부가물은 풀러렌의 대칭성을 깨뜨려 X선 결정학으로 C60의 구조를 결정하고 확인하는 데 기여했다.[26]7. 안전 고려 사항
사산화 오스뮴(OsO4)은 독성이 강하여 흡입하거나 피부에 닿으면 위험하며, 특히 눈에 접촉하면 각막을 영구적으로 손상시켜 실명에 이를 수 있다. 허용 노출 한계(8시간 시간 가중 평균)는 2μg/m3이다.[28] 플라스틱과 식품 포장재를 투과할 수 있으므로 냉장 보관해야 한다.[24]
무색에서 담황색을 띠는 고체로, 오스뮴을 가열하면 쉽게 생성된다. 끓는점보다 낮은 온도에서도 쉽게 기화하거나 승화하며, 특유의 자극적인 냄새가 난다. 가열하면 분해되어 오스뮴과 산소를 생성한다. 강한 산화제이므로 가연성 물질이나 환원성 물질과 반응한다. 최근에는 산화 오스뮴(VIII)을 폴리스티렌이나 ABS 수지로 마이크로캡슐화하여 기화와 용출을 막아 안전하게 취급할 수 있는 시약이 개발되어 판매되고 있다.
대한민국에서는 독물 및 극물 단속법에 해당되지 않는다.
8. 기타
일본에서는 독물 및 극물 단속법에는 해당되지 않는다.
참조
[1]
웹사이트
Osmium tetroxide ICSC: 0528
http://www.inchem.or[...]
InChem
[2]
논문
Boiling Points and Ideal Solutions of Ruthenium and Osmium Tetraoxides
1986
[3]
논문
Refinements of the Crystal Structures of KTcO4, KReO4 and OsO4. The Bond Lengths in Tetrahedral Oxo-Anions and Oxides of d0 Transition Metals
[4]
문서
PGCH|0473
[5]
문서
IDLH|20816120|Osmium tetroxide (as Os)
[6]
논문
Osmium weighs
[7]
서적
Advanced Inorganic Chemistry
[8]
웹사이트
Osmium tetroxide (OsO4)
http://www.chm.bris.[...]
Bristol University
2012-04-07
[9]
서적
Inorganic Chemistry: Principles and Applications
https://books.google[...]
Benjamin / Cummings
2012-04-07
[10]
서적
Advanced Inorganic Chemistry
https://books.google[...]
J. Wiley
[11]
문서
Housecroft2nd
[12]
논문
On the timing of hydrolysis / reoxidation in the osmium-catalyzed asymmetric dihydroxylation of olefins using potassium ferricyanide as the reoxidant
[13]
논문
Ligand-Accelerated Catalysis
[14]
논문
Reactions of Dimesityldioxo-Osmium(VI) with Donor Ligands; Reactions of MO2(2,4,6-Me3C6H2)2, M = Os or Re, with Nitrogen Oxides. X-Ray Crystal Structures of [2,4,6-Me3C6H2N2]+[OsO2(ONO2)2(2,4,6-Me3C6H2)]–, OsO(NBut)(2,4,6-Me3C6H2)2, OsO3(NBut), and ReO3[N(2,4,6-Me3C6H2)2]
[15]
서적
Chemistry of the Elements
Butterworth-Heinemann
[16]
웹사이트
Re: "Disposal" of Osmium Tetroxide "Waste"
http://www.histosear[...]
Department of Anatomy & Cell Biology, The University of Western Ontario
[17]
논문
Osmium tetrafluoride dioxide, cis-OsO2F4
[18]
서적
Chemistry of Precious Metals
Chapman and Hall
[19]
논문
Total Syntheses of (±)-Isosteviol and (±)-Beyer-15-ene-3β,19-diol by Manganese(III)-Based Oxidative Quadruple Free-Radical Cyclization
[20]
서적
Electron Microscopy: Principles and Techniques for Biologists
Jones and Bartlett
[21]
논문
A new staining method (OTO) for enhancing contrast of lipid--containing membranes and droplets in osmium tetroxide--fixed tissue with osmiophilic thiocarbohydrazide(TCH)
1966-08-01
[22]
논문
Improving Serial Block Face SEM by Focal Charge Compensation
Springer US
2020
[23]
논문
High contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy
2012-01-12
[24]
서적
Principles and Techniques of Electron Microscopy: Biological Applications
https://books.google[...]
Cambridge University Press
[25]
논문
A simple protocol for paraffin-embedded myelin sheath staining with osmium(VIII) oxide for light microscope observation
[26]
논문
Crystal Structure of Osmylated C60: Confirmation of the Soccer Ball Framework
[27]
논문
Intra-articular osmic acid in rheumatoid arthritis: five years' experience
1980
[28]
웹사이트
Osmium tetroxide (as Os)
https://www.cdc.gov/[...]
Centers for Disease Control
2018-11-02
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com




