전압 개폐 이온 통로
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
전압 개폐 이온 통로는 세포막을 가로질러 이온의 이동을 조절하는 막 단백질이다. 구조적으로는 여러 개의 서브유닛으로 구성되며, 전압 센서, 이온이 통과하는 기공, 그리고 게이트의 세 부분으로 기능한다. 전압 변화에 반응하여 통로가 열리고 닫히는 방식으로 작동하며, 칼륨, 나트륨, 칼슘, 염소, 양성자 등 다양한 종류가 존재한다. 이러한 이온 통로는 신경 신호 전달, 세포 내 칼슘 농도 조절, 세포 부피 조절 등 다양한 생리적 과정에 관여한다.
더 읽어볼만한 페이지
- 이온 통로 - 니코틴성 아세틸콜린 수용체
니코틴성 아세틸콜린 수용체는 아세틸콜린에 의해 활성화되어 이온을 통과시키는 리간드 개폐 이온 채널 막단백질로, 척추동물에서 근육형과 신경형으로 나뉘어 신경 전달에 중요한 역할을 하며, 활성화는 뉴런 탈분극을 유발하고 니코틴 의존증과 같은 질병 위험과도 연관된다. - 이온 통로 - 고리형 뉴클레오타이드 개폐 이온 통로
고리형 뉴클레오타이드 개폐 이온 통로는 cAMP 또는 cGMP에 의해 활성화되는 이온 채널로, 다양한 생물학적 시스템에서 생체 신호 전달, 시각, 후각 등 다양한 생리적 기능을 수행하며, 구조는 4개의 단백질 소단위체로 구성된다. - 전기생리학 - 바이오피드백
바이오피드백은 정밀 기기로 생리적 활동을 측정하여 사용자에게 피드백을 제공, 사고, 감정, 행동 변화를 유도하여 생리적 변화를 지원하며, 치료 및 성적 향상에 활용되는 과정이다. - 전기생리학 - 근전도 검사
근전도 검사는 근육과 신경의 기능 이상을 진단하기 위해 근육의 전기적 활동을 측정하는 검사로, 신경근 질환 진단, 운동 연구, 보툴리눔 독소 주입 보조 등 다양한 분야에서 활용되며 인터페이스 제어 기술로도 연구된다. - 내재성 막 단백질 - 광계
광계는 틸라코이드 막에 위치하며 빛 에너지를 화학 에너지로 전환하는 단백질 복합체로, 광수집 복합체에 둘러싸인 반응 중심을 가지며 물 분해를 통해 전자를 얻고 산소를 방출하는 광계 II와 NADPH를 생성하는 광계 I 두 가지 주요 유형으로 나뉜다. - 내재성 막 단백질 - 사이토크롬 b6f 복합체
사이토크롬 b6f 복합체는 광합성에서 광계 II와 광계 I 사이의 전자 및 에너지 전달을 매개하고 틸라코이드 막을 가로질러 양성자를 수송하여 ATP 합성을 촉진하는 단백질 복합체로서, 순환적 광인산화에도 중요한 역할을 하며 사이토크롬 bc1 복합체와 구조적 유사성을 갖는 8개의 소단위체로 구성된 이량체이다.
2. 구조
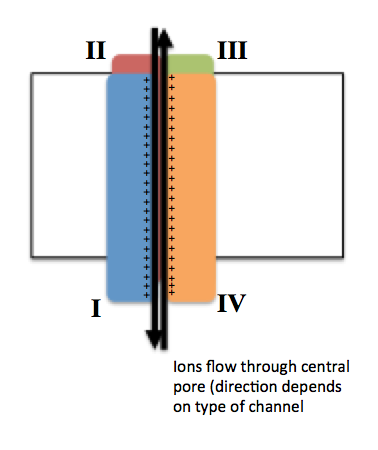
전압 개폐 이온 통로는 일반적으로 여러 개의 서브유닛(subunit)으로 구성되며, 이 서브유닛들이 배열되어 중심부에 이온이 통과할 수 있는 통로, 즉 기공(pore)을 형성한다. 이 통로를 통해 이온은 전기화학적 기울기를 따라 이동한다. 통로는 특정 이온에 대한 선택성(이온 특이성)을 가지는 경향이 있지만, 크기와 전하가 비슷한 다른 이온들도 통과할 수 있다.
전압 개폐 이온 통로의 기능은 크게 세 가지 주요 단위에 의해 결정된다: 전압 센서(voltage sensor), 기공(pore) 또는 전도 경로(conduction pathway), 그리고 게이트(gate)이다.[3][25]
Na+, K+, Ca2+ 통로는 모두 중심의 기공 주위에 4개의 막 관통 도메인(transmembrane domain)이 배열된 구조를 가진다. 대부분의 Na+ 및 Ca2+ 통로에서 이 4개의 도메인은 하나의 거대한 알파(α) 서브유닛 단백질의 일부이다. 반면, 대부분의 K+ 통로에서는 4개의 개별적인 α-서브유닛이 각각 하나의 막 관통 도메인을 제공하여 통로를 형성한다.[4][26] 이 K+ 통로를 구성하는 4개의 α-서브유닛은 서로 동일할 수도 있고 다를 수도 있다.
각 막 관통 도메인은 S1부터 S6까지 번호가 매겨진 6개의 막 관통 세그먼트(segment)로 구성되며, 이들은 모두 알파 나선 구조를 가진다. 각 세그먼트는 특수한 기능을 수행한다.[3][25]
- S5, S6 세그먼트와 기공 루프(pore loop): 이 부분들은 통로의 게이트와 기공 자체를 형성하며, 이온이 통과하는 경로를 만들고 조절하는 데 핵심적인 역할을 한다.
- S1-S4 세그먼트: 이 부분들은 전압 감지 영역(voltage-sensing domain)을 구성한다. 막 전압의 변화를 감지하여 통로의 개폐를 조절한다.
특히 S4 세그먼트는 전압 감지의 핵심 역할을 한다. S4 나선에는 양전하를 띤 리신이나 아르기닌 아미노산 잔기가 반복적으로 존재한다.[3][25][6][28] 세포가 휴지 상태일 때는 세포 외부의 높은 양전하가 S4 나선을 밀어 통로가 닫힌 상태를 유지한다. 막 탈분극이 일어나면 막 전위 변화에 따라 S4 나선의 양전하 잔기들이 세포 외부 쪽으로 이동한다. 이 처음 4개의 아르기닌 잔기의 이동이 게이트 전류(gating current)를 만들고, 약 10-12개의 단백질 결합 양전하 이동이 단백질 전체의 구조 변화(형태 변화, conformational change)를 유발하여 통로의 게이트를 열게 된다.[4][26] 결정 구조 연구를 통해 칼륨 통로는 막에 전위차가 생기면 관련 전기장이 형태 변화를 유도하여 통로 단백질 모양을 왜곡시키고, 이로 인해 이온이 통과하는 통로가 열린다는 것이 밝혀졌다. 이러한 전하 이동과 구조 변화가 일어나는 정확한 메커니즘에 대해서는 여러 모델(정규 모델, 수송체 모델, 패들 모델, 꼬인 모델 등)이 제안되었으나 아직 완전히 합의되지는 않았다.[7][29]
전압 센서의 중요한 부분 중 하나는 S3b와 S4 나선으로 구성된 영역으로, 모양 때문에 "패들(paddle)"이라고 불린다. 이 패들 구조는 다양한 세포와 생물 종에 걸쳐 잘 보존된 서열이며, 서로 다른 종 간에 교환해도 기능을 유지하는 모듈성을 보인다. 예를 들어, 화산에 서식하는 고세균의 패들 영역을 쥐의 뇌 칼륨 통로에 유전자 조작으로 이식해도 완전히 기능하는 통로가 만들어진다.[8][30][9][31] 이러한 모듈성 덕분에 연구하기 어려운 통로 대신 간단하고 저렴한 모델 시스템을 이용하여 패들 영역의 기능, 질병과의 연관성, 약물 개발 등을 연구할 수 있다.[10][32]
통로의 게이트는 전압 센서의 움직임에 따라 열리고 닫히며 이온의 흐름을 물리적으로 막는 역할을 하는 것으로 생각된다.[11][33] S6 세그먼트가 이 게이트 역할을 하는 주요 부분으로 여겨지지만, 정확한 작동 방식은 아직 불분명하다. S6 세그먼트가 가위처럼 움직여 열리거나,[12][34] 두 부분으로 나뉘거나,[13][35] S6 자체가 게이트로 작용한다는[14][36] 등의 가설이 있다. S4 세그먼트의 움직임이 어떻게 S6 게이트를 여는지에 대한 메커니즘도 아직 연구 중이며, S4와 S5 사이의 연결 부위(S4-S5 linker)의 움직임이 S6의 개방을 유도한다는 가설이 제기되었다.[3][25]
중심의 α-서브유닛 외에도, 조절 기능을 하는 베타(β) 서브유닛이 존재할 수 있다. 이 β-서브유닛은 산화환원효소 활성을 가지며, 세포막의 안쪽 표면에 위치하고 막을 관통하지 않는다. β-서브유닛은 소포체에서 α-서브유닛과 함께 조립되어 통로의 기능을 조절한다.[5][27]
대부분의 전압 개폐 이온 통로는 막 탈분극에 의해 활성화(열림)되지만, 내향 정류 칼륨 이온 통로와 같이 과분극에 의해 활성화되는 예외적인 경우도 있다.
통로가 열린 후에는 빠른 시간 내(수 밀리초)에 비활성화(inactivation)되어 이온 흐름이 차단된다. 이 빠른 비활성화는 세포 내부에 위치한 또 다른 게이트에 의해 일어나는 것으로 생각되며, 흔히 볼 앤 체인(ball-and-chain) 모델로 설명된다.[15][37] 이 모델에서는 단백질의 일부(볼)가 유연한 사슬(체인)에 연결되어 있다가, 통로가 열리면 이 볼 부분이 기공 입구를 막아 이온 흐름을 차단한다고 본다.[16][38] 이 빠른 비활성화는 S4 세그먼트의 움직임에 따른 통로 활성화와 직접적으로 연결되어 있지만, 두 과정을 연결하는 정확한 메커니즘은 아직 밝혀지지 않았다.[17]
3. 작동 메커니즘
X선 결정학 연구에 따르면, 칼륨 통로는 막 양단에 전위차가 발생하면 형성된 전기장에 의해 구조적 변화를 겪는다. 이 변화는 통로 단백질의 모양을 변형시켜 이온이 통과할 수 있는 통로를 열고, 막을 가로지르는 이온의 유입 또는 유출을 가능하게 한다. 농도 기울기에 따른 이러한 이온 이동은 세포막을 탈분극시키기에 충분한 전류를 생성한다.
전압 개폐 나트륨 통로와 칼슘 통로는 4개의 상동 도메인이 하나의 폴리펩타이드 사슬로 연결된 형태로 구성된다. 각 도메인은 6개의 막 관통 알파 나선(S1-S6)을 포함하며, 이 중 네 번째 나선인 S4가 전압 감지 나선으로 기능한다.[6][28] S4 나선에는 양전하를 띤 리신이나 아르기닌 잔기가 다수 존재하는데,[3][25] 세포 외부의 양전하 환경은 이 양전하 나선을 밀어내 통로를 닫힌 상태로 유지하는 데 기여한다.
일반적으로 이온 통로의 전압 감지 부분(S1-S4 나선)은 막 전위 변화를 감지하여 통로의 개폐를 조절한다.[3] 휴지 상태에서는 각 S4 나선의 일부가 세포질과 접하고 있다가, 막이 탈분극되면 S4 도메인의 양전하 잔기들이 막의 바깥쪽(세포외) 표면으로 이동한다. 특히 처음 4개의 아르기닌 잔기가 게이트 전류(gating current)를 형성하며 세포 외부 용매 쪽으로 이동하는 것으로 여겨진다. 단백질에 결합된 약 10~12개의 양전하 이동은 통로를 여는 구조적 변화를 유발한다.[4][26] 이 전압 감지 메커니즘의 정확한 방식에 대해서는 아직 완전히 합의되지 않았으며, 정규(canonical), 수송체(transporter), 패들(paddle), 꼬인(twisted) 모델 등 여러 이론이 제시되었다.[7][29]
전압 센서의 움직임은 이온 흐름을 제어하는 전도 경로(pore)의 게이트(gate)에 구조 변화를 일으킨다.[3] 전압 감지 도메인의 핵심 기능 부위 중 하나는 S3b와 S4 나선으로 구성된 "패들(paddle)" 영역이다. 이 패들 구조는 다양한 세포와 생물 종에서 발견되는 보존된 서열이며, 서로 다른 종의 통로 간에 교환해도 기능을 유지하는 경우가 있다. 유사한 전압 센서 패들은 전압 감지 포스파타아제에서도 발견된다.[8][30] 예를 들어, 화산 지대에 서식하는 고세균의 패들 영역 유전자를 쥐 뇌의 칼륨 통로 유전자에 유전자 조작으로 삽입하여 패들 전체를 교체했을 때, 완전히 기능하는 이온 통로가 만들어졌다.[9][31] 이러한 구조적 "모듈성" 덕분에, 연구하기 어렵거나 비용이 많이 드는 시스템 대신 간단하고 저렴한 모델 시스템을 이용하여 패들 영역의 기능, 질병과의 연관성, 약물을 통한 조절 등을 연구할 수 있다.[10][32]
대부분의 전압 개폐 이온 통로는 막의 탈분극에 의해 활성화되지만, 내향 정류 칼륨 이온 통로와 같은 일부 통로는 반대로 과분극에 의해 활성화된다.
게이트는 통로의 전압 감지 영역과 연결되어 이온 흐름을 물리적으로 차단하는 역할을 하는 것으로 생각된다.[11][33] 일반적으로 여섯 번째 막 관통 나선인 S6 도메인이 이 게이트의 일부로 작용한다고 여겨지지만, 정확한 작동 방식은 불분명하다. S6 세그먼트가 가위처럼 움직여 통로를 열거나,[12][34] 두 부분으로 나뉘어 이온 통과를 허용하거나,[13][35] S6 자체가 게이트 역할을 한다는[14][36] 등의 가설이 있다. S4 나선의 움직임이 어떻게 S6 게이트에 영향을 미치는지는 명확하지 않지만, S4와 S5를 연결하는 링커(S4-S5 linker)의 움직임이 S6의 개방을 유도할 수 있다는 가설이 제기되었다.[3][25]
이온 통로는 열린 후 수 밀리초(ms) 이내에 불활성화(inactivation)되기도 한다. 이 불활성화는 통로의 세포 내 쪽 입구를 막는 별도의 게이트에 의해 조절되는 것으로 생각된다.[15][37] 이는 흔히 볼 앤 체인 비활성화 모델로 설명되는데, 단백질의 특정 부분이 접혀서 통로 입구를 막아 이온 흐름을 차단하는 방식이다.[16][38] 이러한 빠른 불활성화는 S4 나선의 막 내 이동에 의한 통로 활성화와 직접적으로 연결되어 있지만,[17] S4의 움직임이 어떻게 불활성화 게이트의 작동으로 이어지는지에 대한 정확한 메커니즘은 아직 밝혀지지 않았다.
4. 종류
전압 개폐 이온 통로는 통과시키는 이온의 종류에 따라 다양하게 분류된다. 각 통로는 특정 이온에 대한 선택성을 가지며, 세포 내외의 이온 농도 기울기를 조절하고 전기 신호를 생성하는 데 중요한 역할을 한다. 주요 전압 개폐 이온 통로의 종류는 다음과 같다.
- 칼륨(K+) 통로
- 나트륨(Na+) 통로
- 칼슘(Ca2+) 통로
- 염소(Cl-) 통로
- 양성자(H+) 통로
각 통로의 구체적인 구조와 기능은 이어지는 하위 섹션에서 자세히 다룬다.
4. 1. 칼륨 (K+) 통로
칼륨 통로(K+ 통로)는 가장 크고 다양한 종류의 전압 개폐 이온 통로이며, 인간의 유전자 중 100개 이상이 이 통로를 암호화한다.[29] 이 통로들은 게이트(gate) 특성에서 뚜렷한 차이를 보이는데, 어떤 종류는 매우 느리게 불활성화되는 반면 다른 종류는 매우 빠르게 불활성화된다.[29] 이러한 활성화 시간의 차이는 활동 전위 발화의 지속 시간과 속도에 영향을 미치며, 이는 축삭을 따른 전기 전도뿐만 아니라 시냅스 전달에도 중요한 영향을 미친다.[29]구조적으로 칼륨 통로는 다른 주요 전압 개폐 이온 통로들과 차이가 있다. 대부분의 Na+ 통로나 Ca2+ 통로는 하나의 폴리펩타이드 사슬 안에 4개의 유사한 도메인이 반복되는 구조를 가지지만[26], 칼륨 통로는 4개의 개별적인 폴리펩타이드 소단위체(subunit)가 모여 하나의 통로를 형성한다.[29][26] 이 4개의 α 소단위체는 각각 하나의 막관통 도메인을 이루며[26], 4개가 모두 동일한 종류일 수도 있고 서로 다른 종류일 수도 있다.[27]
각 α 소단위체는 일반적으로 6개의 막을 관통하는 알파 나선 구조의 세그먼트(S1-S6)를 포함한다. 이 중 S5, S6 세그먼트와 그 사이의 포어 루프(pore loop)는 이온이 통과하는 통로인 포어를 형성하고 이온의 흐름을 조절하는 게이트 역할을 한다. 반면, S1부터 S4까지의 세그먼트는 막 전위 변화를 감지하는 전압 센서(voltage sensor) 영역을 구성한다.[25]
중심 통로를 형성하는 4개의 α 소단위체 외에도, 보조적인 β 소단위체가 결합하는 경우도 있다. β 소단위체는 산화 환원 효소 활성을 가지며 통로의 기능을 조절하는 데 관여한다. 이들은 세포막의 안쪽 면에 위치하며 막을 관통하지 않고, 소포체에서 α 소단위체와 함께 조립되어 막으로 이동한다.[27]
4. 2. 나트륨 (Na+) 통로
나트륨 통로는 여러 다른 세포 종류에서 유사한 기능을 갖는다. 사람에서는 나트륨 통로를 암호화하는 유전자가 10종류 확인되었지만, 일반적으로 이러한 기능은 다른 생물종이나 세포 종류 사이에서 보존되어 있다.[39]4. 3. 칼슘 (Ca2+) 통로
사람에서는 칼슘 통로의 유전자가 16종류 확인되었다. 이 타입의 통로는 세포 종류에 따라 기능이 다르다. 일부 신경 세포에서는 나트륨 통로처럼 활동 전위를 형성하는 데 관여한다. 또한 시냅스 전 신경 종말에서는 신경 전달 물질의 방출에 중요한 역할을 한다. 대부분의 세포에서는 세포 내 칼슘 농도를 조절하며 다양한 생화학적 과정을 제어하는 데 관여한다[35]。4. 4. 염소 (Cl-) 통로
염소 이온 통로는 모든 유형의 뉴런에 존재한다.[1][23] 이 통로는 신경 세포의 흥분성을 제어하는 주요 역할을 담당하며, 세포의 휴지 막 전위 유지와 세포 부피 조절에도 기여한다.[1][23]4. 5. 양성자 (H+) 통로
전압 개폐 양성자 통로는 하이드로늄(H3O+) 형태의 수소 이온(H+)에 의해 매개되는 전류를 전달하며, pH에 따라 탈분극에 의해 활성화된다. 이는 세포에서 산을 제거하는 기능을 한다.[18][19][20][40][41][42]5. 계통 발생
세균에서 발현되는 단백질에 대한 계통발생적 연구는 전압 개폐 나트륨 채널의 슈퍼패밀리의 존재를 밝혀냈다.[21][43] 후속 연구에서는 다음을 포함하여 다양한 다른 이온 채널과 수송체가 전압 개폐 이온 통로와 계통발생적으로 관련되어 있음을 보여주었다.[22][44]
- 내향성 정류 칼륨 채널 (K+ 채널)
- 라이아노딘 수용체-이노시톨 삼인산 수용체 Ca2+ 채널
- TRP 채널 (Ca2+ 채널 계열)
- 폴리시스틴 양이온 채널 계열
- 이온성 글루탐산 수용체
- 칼슘 의존성 염소 채널
- 일가 양이온:양성자 반수송체, 유형 1
- 칼륨 수송체 패밀리
참조
[1]
서적
Neuroscience
Sinauer Associates
2001
[2]
논문
From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels
2000-04
[3]
논문
Voltage-gated ion channels
2005-03
[4]
서적
Molecular Cell Biology
https://archive.org/[...]
Scientific American Books
2000
[5]
논문
Structure of a voltage-dependent K+ channel beta subunit
1999-06
[6]
논문
Ion channel voltage sensors: structure, function, and pathophysiology
[7]
논문
Voltage-gated ion channels
[8]
논문
Phosphoinositide phosphatase activity coupled to an intrinsic voltage sensor
2005-06
[9]
논문
Portability of paddle motif function and pharmacology in voltage sensors
2007-11
[10]
논문
Atomic structure of a voltage-dependent K+ channel in a lipid membrane-like environment
2007-11
[11]
논문
The moving parts of voltage-gated ion channels
1998-08
[12]
논문
Structural rearrangements underlying K+-channel activation gating
1999-07
[13]
논문
Crystal structure and mechanism of a calcium-gated potassium channel
2002-05
[14]
논문
Intracellular gate opening in Shaker K+ channels defined by high-affinity metal bridges
2004-04
[15]
논문
Sodium channels and gating currents
1981-07
[16]
논문
Inhibition of inactivation of single sodium channels by a site-directed antibody
1989-10
[17]
논문
Molecular dynamics of the sodium channel pore vary with gating: interactions between P-segment motions and inactivation
1999-03
[18]
논문
The voltage-activated hydrogen ion conductance in rat alveolar epithelial cells is determined by the pH gradient
[19]
논문
Voltage-gated proton channels and other proton transfer pathways
[20]
논문
An aqueous H+ permeation pathway in the voltage-gated proton channel Hv1
2010
[21]
논문
A superfamily of voltage-gated sodium channels in bacteria
2004-03
[22]
논문
Phylogeny as a guide to structure and function of membrane transport proteins
2004
[23]
서적
Neuroscience
Sinauer Associates
2001
[24]
논문
From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels
2000-04
[25]
논문
Voltage-gated ion channels
2005-03
[26]
서적
Molecular Cell Biology
https://archive.org/[...]
Scientific American Books
2000
[27]
논문
Structure of a voltage-dependent K+ channel beta subunit
1999-06
[28]
논문
Ion channel voltage sensors: structure, function, and pathophysiology
[29]
논문
Voltage-gated ion channels
[30]
논문
Phosphoinositide phosphatase activity coupled to an intrinsic voltage sensor
2005-06
[31]
논문
Portability of paddle motif function and pharmacology in voltage sensors
2007-11
[32]
논문
Atomic structure of a voltage-dependent K+ channel in a lipid membrane-like environment
2007-11
[33]
논문
The moving parts of voltage-gated ion channels
1998-08
[34]
논문
Structural rearrangements underlying K+-channel activation gating
https://semanticscho[...]
1999-07
[35]
논문
Crystal structure and mechanism of a calcium-gated potassium channel
2002-05
[36]
논문
Intracellular gate opening in Shaker K+ channels defined by high-affinity metal bridges
2004-04
[37]
논문
Sodium channels and gating currents
1981-07
[38]
논문
Inhibition of inactivation of single sodium channels by a site-directed antibody
1989-10
[39]
논문
Molecular dynamics of the sodium channel pore vary with gating: interactions between P-segment motions and inactivation
1999-03
[40]
간행물
The voltage-activated hydrogen ion conductance in rat alveolar epithelial cells is determined by the pH gradient
1995-06
[41]
간행물
Voltage-gated proton channels and other proton transfer pathways
2003
[42]
논문
An aqueous H+ permeation pathway in the voltage-gated proton channel Hv1
2010
[43]
논문
A superfamily of voltage-gated sodium channels in bacteria
2004-03
[44]
논문
Phylogeny as a guide to structure and function of membrane transport proteins
2004
[45]
서적
Neuroscience
Sinauer Associates
2001
[46]
저널
From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels
2000-04
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
