페로토시스
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
페롭토시스는 철 의존적인 지질 과산화물의 축적으로 인해 발생하는 세포 사멸의 한 유형이다. 주요 특징은 활성 산소 종의 생성에 관여하는 펜톤 화학 반응을 통해 산화 손상된 인지질이 철 의존적으로 축적되는 것이다. GPX4와 FSP1은 페롭토시스 억제에 중요한 역할을 하며, 에라스틴, 설파살라진, 소라페닙과 같은 저분자 화합물은 페롭토시스를 유도하여 종양 세포 성장을 억제할 수 있다. 페롭토시스는 신경 퇴행성 질환, 외상성 뇌 손상 등 다양한 질병과 관련이 있으며, 암 치료의 잠재적 수단으로 연구되고 있다.
더 읽어볼만한 페이지
- 의학적 죽음 - 괴사
괴사는 세포 손상으로 인해 생체 내에서 조절 없이 일어나는 세포 사멸의 한 형태로, 응고괴사, 액화괴사 등 다양한 유형으로 분류되며 허혈, 감염 등 여러 원인에 의해 발생하고 벌거숭이두더지쥐처럼 세포자멸사 대체 기전으로 활용되기도 한다. - 의학적 죽음 - 사산
사산은 임신 20주 또는 WHO 기준 28주 이후에 태아가 사망하여 출생하는 것으로, 탯줄 관련 사고, 감염, 선천성 기형, 모체 질환 등 다양한 원인으로 발생하며 유산과는 구별되고 부모에게 심리적 고통을 줄 수 있다. - 세포예정사 - 사이토크롬 c
사이토크롬 c는 진핵생물의 미토콘드리아 내막에 존재하는 전자 전달계 구성 요소이자 세포자멸사 관여 단백질로서, 작은 크기와 보존된 서열 덕분에 분자 계통학 연구에 활용되며 항산화 효소 및 저준위 레이저 치료에서의 역할 등 다양한 응용 가능성이 제시된다. - 세포예정사 - 오토파지
오토파지는 세포 내 구성 성분을 분해 및 재활용하여 항상성을 유지하고, 영양 결핍 시 에너지와 물질을 공급하는 과정으로, 거대 자가포식, 미세 자가포식, 샤페론 매개 자가포식의 세 유형으로 나뉘며, 오스미 요시노리의 노벨상 수상 이후 질병 치료 표적으로 연구가 활발하다. - 세포 과정 - 감수분열
감수분열은 유성생식을 하는 생물에서 배우자를 형성하는 세포분열 과정으로, 염색체 수를 줄여 유전적 다양성을 확보하며, 감수분열 I과 II 두 단계로 구성되어 상동염색체 및 자매염색분체 분리, 독립적 분리 및 교차를 통해 유전적 다양성을 증가시키지만, 염색체 비분리 오류는 염색체 이상 질환을 유발할 수 있고 진핵생물 유성생식과 진화에 필수적인 과정이다. - 세포 과정 - 괴사
괴사는 세포 손상으로 인해 생체 내에서 조절 없이 일어나는 세포 사멸의 한 형태로, 응고괴사, 액화괴사 등 다양한 유형으로 분류되며 허혈, 감염 등 여러 원인에 의해 발생하고 벌거숭이두더지쥐처럼 세포자멸사 대체 기전으로 활용되기도 한다.
2. 메커니즘
페롭토시스는 철 의존적인 지질 과산화물의 축적으로 인해 발생한다.
=== 지질 과산화 ===
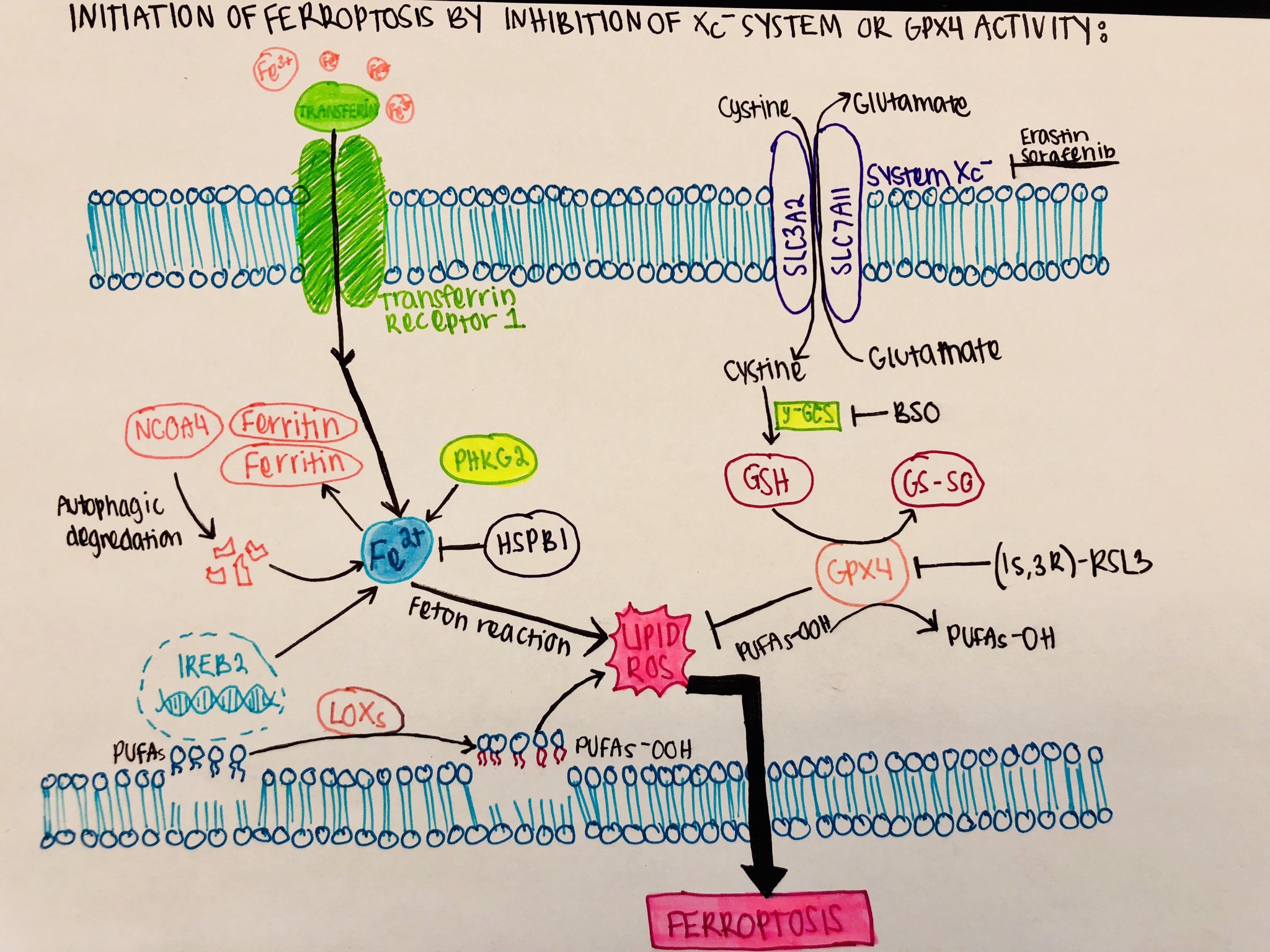
페롭토시스의 특징은 활성 산소 종의 생성에 중요한 펜톤 화학을 통해 산화 손상된 인지질(지질 과산화물)이 철 의존적으로 축적된다는 것이다.[11] 철은 리소좀에 격리됨으로써 이러한 특징을 이용할 수 있다. 인지질의 산화는 자유 라디칼이 지질 분자에서 전자를 떼어낼 때(일반적으로 고도 불포화 지방산에 영향을 미침) 발생하여 산화를 촉진한다.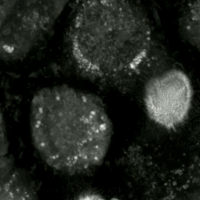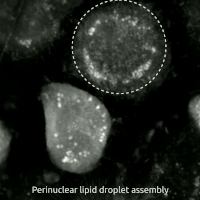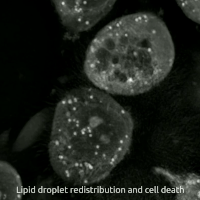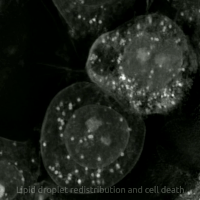
=== GPX4와 FSP1 ===
글루타티온 과산화효소 4(GPX4)는 지질 과산화물을 비독성 지질 알코올로 전환시키는 글루타티온 의존성 과산화수소분해효소로, 산화독성/페롭토시스에 대한 주요 세포 보호 기전을 매개한다.[2] 최근, 두 연구실에서 산화환원효소 FSP1(AIFM2로도 알려짐)을 포함하는 두 번째 병렬 보호 경로를 독립적으로 발견했다.[12][13] 이들은 FSP1이 효소적으로 비미토콘드리아 코엔자임 Q10을 환원시켜 강력한 친유성 항산화제를 생성하여 지질 과산화물의 증식을 억제한다는 사실을 발견했다.[12][13] 보조 인자가 확산성 항산화제 역할을 하는 유사한 메커니즘이 동일 연도에 테트라히드로바이오프테린 (BH4)에 대해 발견되었으며, 이는 속도 제한 효소 GCH1의 생성물이다.[14][15] 일부 세포에서는 FSP1이 GPX4 활성 손실을 보상하며, 산화독성/페롭토시스를 유도하려면 GPX4와 FSP1을 동시에 억제해야 한다.
=== 페롭토시스 유도 물질 ===
에라스틴, 설파살라진, 소라페닙과 같은 저분자 화합물은 산화독성/페롭토시스 유도를 통해 종양 세포 성장을 억제하는 것으로 알려져 있다. 이러한 화합물은 크로마틴 가장자리화 또는 폴리 (ADP-리보스) 중합 효소(PARP) 분열을 일으키지 않고, 대신 미토콘드리아 표현형의 변화를 일으킨다. 철은 저분자 산화독성/페롭토시스 유도에 필요하므로, 이러한 화합물은 철 킬레이트로 억제할 수 있다. 에라스틴은 시스틴/글루탐산 수송체 억제를 통해 세포 내 글루타티온(GSH) 수치를 감소시켜 페롭토시스 세포 사멸을 유도한다.[5] GSH는 GPX4 기능에 필요하므로, 이 보조 인자의 고갈은 페롭토시스 세포 사멸로 이어질 수 있다.[3] RSL3, ML162, ML210은 글루타티온 과산화효소 4(GPX4)를 직접 억제하여 산화독성/페롭토시스를 유도할 수도 있다.[16]
천연 고도 불포화 지방산(PUFA)을 중수소화 PUFA(dPUFA)로 대체하면 에라스틴 또는 RSL3에 의해 유도된 세포 사멸을 예방할 수 있다.[17] 이러한 중수소화 PUFA는 페롭토시스와 관련된 다양한 만성 퇴행성 질환을 효과적으로 억제한다.[18]
생세포 이미징을 통해 산화독성/페롭토시스 동안 세포의 형태학적 변화를 관찰할 수 있다. 세포는 수축 후 부풀어 오르며, 핵 주변 지질 집합체가 관찰된 후 지질 방울이 세포 전체에 재분배된다.
2. 1. 지질 과산화
페로토시스의 특징은 활성 산소 종의 생성에 중요한 펜톤 화학을 통해 산화 손상된 인지질(지질 과산화물)이 철 의존적으로 축적된다는 것이다.[11] 철은 리소좀에 격리됨으로써 이러한 특징을 이용할 수 있다. 인지질의 산화는 자유 라디칼이 지질 분자에서 전자를 떼어낼 때(일반적으로 고도 불포화 지방산에 영향을 미침) 발생하여 산화를 촉진한다. 글루타티온 과산화효소 4(GPX4)는 지질 과산화물을 비독성 지질 알코올로 전환시키는 글루타티온 의존성 과산화수소분해효소로, 산화독성/페롭토시스에 대한 주요 세포 보호 기전을 매개한다.[2]최근, 두 연구실에서 산화환원효소 FSP1(AIFM2로도 알려짐)을 포함하는 두 번째 병렬 보호 경로를 독립적으로 발견했다.[12][13] 이들은 FSP1이 효소적으로 비미토콘드리아 코엔자임 Q10을 환원시켜 강력한 친유성 항산화제를 생성하여 지질 과산화물의 증식을 억제한다는 사실을 발견했다.[12][13] 보조 인자가 확산성 항산화제 역할을 하는 유사한 메커니즘이 동일 연도에 테트라히드로바이오프테린 (BH4)에 대해 발견되었으며, 이는 속도 제한 효소 GCH1의 생성물이다.[14][15]
에라스틴, 설파살라진, 소라페닙과 같은 저분자 화합물은 산화독성/페롭토시스 유도를 통해 종양 세포 성장을 억제하는 것으로 알려져 있다. 철은 저분자 산화독성/페롭토시스 유도에 필요하므로, 이러한 화합물은 철 킬레이트로 억제할 수 있다. 에라스틴은 시스틴/글루탐산 수송체 억제를 통해 세포 내 글루타티온(GSH) 수치를 감소시킨다.[5] GSH는 GPX4 기능에 필요하므로, 이 보조 인자의 고갈은 페롭토시스 세포 사멸로 이어질 수 있다.[3]
천연 고도 불포화 지방산 (PUFA)을 비스-알릴 수소 대신 중수소를 갖는 중수소화 PUFA (dPUFA)로 대체하면 에라스틴에 의해 유도된 세포 사멸을 예방할 수 있다.[17] 이러한 중수소화 PUFA는 페롭토시스와 관련된 다양한 만성 퇴행성 질환을 효과적으로 억제한다.[18]
생세포 이미징을 통해 산화독성/페롭토시스 동안 세포가 겪는 형태학적 변화를 관찰할 수 있다. 처음에 세포는 수축한 다음 부풀어 오르기 시작하며, 핵 주변 지질 집합체는 산화독성/페롭토시스가 발생하기 직전에 관찰된다.
2. 2. GPX4와 FSP1
글루타티온 과산화효소 4(GPX4)는 지질 과산화물을 무독성 지질 알코올로 전환시키는 글루타티온 의존성 과산화수소분해효소로, 산화독성/페롭토시스에 대한 주요 세포 보호 기전을 매개한다.[2] 최근에는 AIFM2로도 알려진 산화환원효소 FSP1을 포함하는 두 번째 병렬 보호 경로가 발견되었다.[12][13] FSP1은 효소적으로 비미토콘드리아 코엔자임 Q10을 환원시켜 강력한 친유성 항산화제를 생성하여 지질 과산화물의 증식을 억제한다.[12][13] 보조 인자가 확산성 항산화제 역할을 하는 유사한 메커니즘은 테트라히드로바이오프테린 (BH4)에 대해서도 발견되었다.[14][15]산화독성/페롭토시스의 특징은 산화 손상된 인지질(지질 과산화물)의 철 의존적 축적이다.[11] 철을 통한 펜톤 화학의 연관성은 활성 산소 종의 생성에 매우 중요하다.[11] 인지질의 산화는 자유 라디칼이 지질 분자에서 전자를 떼어낼 때 발생하며, 일반적으로 고도 불포화 지방산에 영향을 미친다.
에라스틴, 설파살라진, 소라페닙과 같은 저분자 화합물은 산화독성/페롭토시스 유도를 통해 종양 세포 성장을 억제한다. 이러한 화합물은 철 킬레이트로 억제할 수 있다. 에라스틴은 시스틴/글루탐산 수송체 억제를 통해 세포 내 글루타티온(GSH) 수치를 감소시킨다.[5] GSH는 GPX4 기능에 필요하므로, 이 보조 인자의 고갈은 페롭토시스 세포 사멸로 이어질 수 있다.[3] RSL3, ML162, ML210과 같이 GPX4 억제를 통해 산화독성/페롭토시스를 유도할 수도 있다.[16] 일부 세포에서 FSP1은 GPX4 활성 손실을 보상하며, 산화독성/페롭토시스를 유도하려면 GPX4와 FSP1을 동시에 억제해야 한다.
천연 고도 불포화 지방산 (PUFA)을 중수소화 PUFA (dPUFA)로 대체하면 에라스틴 또는 RSL3에 의해 유도된 세포 사멸을 예방할 수 있다.[17] 이러한 중수소화 PUFA는 페롭토시스와 관련된 다양한 만성 퇴행성 질환을 효과적으로 억제한다.[18]
2. 3. 페롭토시스 유도 물질
에라스틴, 설파살라진, 소라페닙과 같은 저분자 화합물은 산화독성/페롭토시스 유도를 통해 종양 세포 성장을 억제하는 것으로 알려져 있다.[5][3][16] 이러한 화합물은 크로마틴 가장자리화 또는 폴리 (ADP-리보스) 중합 효소(PARP) 분열을 일으키지 않고, 대신 미토콘드리아 표현형의 변화를 일으킨다. 철은 저분자 산화독성/페롭토시스 유도에 필요하므로, 이러한 화합물은 철 킬레이트로 억제할 수 있다. 에라스틴은 시스틴/글루탐산 수송체 억제를 통해 세포 내 글루타티온(GSH) 수치를 감소시켜 페롭토시스 세포 사멸을 유도한다.[5][3]RSL3, ML162, ML210은 글루타티온 과산화효소 4(GPX4)를 직접 억제하여 산화독성/페롭토시스를 유도할 수 있다.[16] GPX4는 지질 과산화물을 비독성 지질 알코올로 전환시키는 글루타티온 의존성 과산화수소분해효소로, 산화독성/페롭토시스에 대한 주요 세포 보호 기전을 매개한다.[2] 최근에는 AIFM2로도 알려진 산화환원효소 FSP1을 포함하는 두 번째 병렬 보호 경로가 발견되었다.[12][13] FSP1은 효소적으로 비미토콘드리아 코엔자임 Q10을 환원시켜 지질 과산화물의 증식을 억제하는 항산화제를 생성한다.[12][13] 테트라히드로바이오프테린 (BH4)에 대한 유사한 메커니즘도 발견되었으며, 이는 속도 제한 효소 GCH1의 생성물이다.[14][15]
천연 고도 불포화 지방산(PUFA)을 중수소화 PUFA(dPUFA)로 대체하면 에라스틴 또는 RSL3에 의해 유도된 세포 사멸을 예방할 수 있다.[17] 이러한 중수소화 PUFA는 페롭토시스와 관련된 다양한 만성 퇴행성 질환을 효과적으로 억제한다.[18]
생세포 이미징을 통해 산화독성/페롭토시스 동안 세포의 형태학적 변화를 관찰할 수 있다. 세포는 수축 후 부풀어 오르며, 핵 주변 지질 집합체가 관찰된 후 지질 방울이 세포 전체에 재분배된다.
3. 신경계에서의 페롭토시스와 세포자멸사 비교
신경계에서 발생하는 세포 사멸에는 세포자멸사와 페롭토시스 두 가지 주요 형태가 있다. 세포자멸사는 세포가 작은 세포자멸체로 분해되어 식세포 작용을 통해 제거되는 결과를 낳는다.[19][41] 이 과정은 포유류 신경계에서 태아 발달 시기부터 성체까지 지속적으로 발생하며, 뉴런 및 신경교세포의 적절한 개체수를 유지하는 데 매우 중요하다. 옥시토시스/페로토시스처럼 세포자멸사 과정의 결함은 신경퇴행을 포함한 많은 건강 합병증을 초래할 수 있다.
상경신경절의 뉴런을 대상으로 한 연구에 따르면, 이러한 뉴런이 생존하려면 신경 성장 인자(NGF)가 필요하다.[20][42] NGF는 TrkA에 결합하여 PI3K-Akt 및 세포외 신호 조절 키나제 (Raf-MEK-ERK) 신호 전달 경로를 활성화하여 교감 신경계 뉴런의 성장을 촉진한다.[20][42]
배아 발달 과정에서 NGF가 없으면, NGF에 의해 활성화되는 신호 전달 경로의 활성이 감소하여 세포자멸사가 활성화된다. NGF가 없으면 교감 신경계 뉴런은 위축되고, 포도당 섭취율이 감소하며, 단백질 합성 및 유전자 발현 속도가 늦어진다.[20][42] NGF 제거로 인한 세포자멸사에는 카스파제 활성이 필요하다.[20][42] NGF가 제거되면, 사이토크롬 c가 미토콘드리아에서 방출되는 시험관 내 경로를 통해 카스파제-3이 활성화된다.[20][42] 생존하는 교감 신경 뉴런에서는 항세포자멸사 Bcl-2 단백질의 과발현이 NGF 제거로 인한 세포 사멸을 방지한다. 그러나 별개의 세포자멸사 촉진 Bcl-2 유전자인 Bax의 과발현은 사이토크롬 c의 방출을 자극한다. 사이토크롬 c는 아포토좀의 형성을 통해 카스파제-9의 활성화를 촉진한다. 일단 카스파제-9가 활성화되면, 이는 카스파제-3을 절단하고 활성화하여 세포 사멸을 유발할 수 있다.[20][42]
옥시토시스/페로토시스를 통해 분해된 뉴런과 달리 세포자멸사는 세포 내 유체를 방출하지 않는다. 옥시토시스/페로토시스 동안, 뉴런은 세포체 내부에서 지질 대사 산물을 방출한다. 이것이 옥시토시스/페로토시스와 세포자멸사의 주요 차이점이다.[19][41]
3. 1. 세포자멸사 (Apoptosis)
세포자멸사는 세포가 작은 세포자멸체로 분해되어 식세포 작용을 통해 제거되는 세포 사멸의 한 형태이다.[19][41] 이 과정은 포유류 신경계에서 태아 발달 시기부터 성체까지 지속적으로 발생하며, 뉴런 및 신경교세포의 적절한 개체수를 유지하는 데 중요한 역할을 한다.[19]상경신경절 뉴런의 생존에는 신경 성장 인자(NGF)가 필수적이다.[20][42] NGF는 TrkA 수용체에 결합하여 PI3K-Akt 및 세포외 신호 조절 키나제 (Raf-MEK-ERK) 신호 전달 경로를 활성화시켜 뉴런의 성장을 촉진한다.[20][42]
배아 발달 과정에서 NGF가 결핍되면, 이러한 신호 전달 경로의 활성이 감소하여 세포자멸사가 유발된다.[20][42] NGF가 없으면 교감 신경계 뉴런은 위축되고, 포도당 섭취율, 단백질 합성 및 유전자 발현 속도가 감소한다.[20][42] NGF 제거로 인한 세포자멸사에는 카스파제 활성이 필요하며, 사이토크롬 c가 미토콘드리아에서 방출되어 카스파제-3이 활성화되는 경로를 거친다.[20][42] 항세포자멸사 Bcl-2 단백질의 과발현은 NGF 제거로 인한 세포 사멸을 방지하는 반면, Bax의 과발현은 사이토크롬 c 방출을 자극하여 아포토좀 형성을 통해 카스파제-9 활성화를 촉진한다.[20][42] 활성화된 카스파제-9는 카스파제-3을 절단하여 세포 사멸을 유발한다.[20][42]
세포자멸사는 세포 내 유체를 방출하지 않는다는 점에서 페로토시스와 구별된다.[19][41] 페로토시스에서는 뉴런이 세포 내부에서 지질 대사 산물을 방출하는 반면, 세포자멸사에서는 세포가 세포자멸체로 분해되어 식세포에 의해 제거된다.
3. 2. 페롭토시스와 세포자멸사의 차이점
세포자멸사는 세포가 작은 세포자멸체로 분해되어 식세포 작용을 통해 제거되는 과정으로, 포유류 신경계에서 태아 발달 시기부터 성체까지 지속적으로 발생한다.[19] 세포자멸사는 뉴런 및 신경교세포의 적절한 개체수를 유지하는 데 매우 중요하며, 이 과정에 결함이 생기면 신경퇴행을 포함한 여러 건강 합병증을 초래할 수 있다.[19]상경신경절 뉴런의 생존에는 신경 성장 인자(NGF)가 필요하며, NGF는 TrkA에 결합하여 PI3K-Akt 및 세포외 신호 조절 키나제 (Raf-MEK-ERK) 신호 전달 경로를 활성화하여 뉴런 성장을 촉진한다.[20] 배아 발달 과정에서 NGF가 없으면 이러한 신호 전달 경로 활성이 감소하여 세포자멸사가 활성화된다.[20] NGF 제거는 교감 신경계 뉴런의 위축, 포도당 섭취 감소, 단백질 합성 및 유전자 발현 속도 감소를 유발하며, 카스파제 활성이 필요하다.[20] 사이토크롬 c가 미토콘드리아에서 방출되어 카스파제-3이 활성화되는 시험관 내 경로를 거친다.[20] 항세포자멸사 Bcl-2 단백질 과발현은 NGF 제거로 인한 세포 사멸을 방지하지만, Bax 과발현은 사이토크롬 c 방출을 자극하여 아포토좀 형성을 통해 카스파제-9 활성화를 촉진하고, 이는 다시 카스파제-3을 활성화하여 세포 사멸을 유발한다.[20]
페롭토시스와 세포자멸사의 주요 차이점은 세포 내 유체 방출 여부이다. 페롭토시스 과정에서 뉴런은 세포 내 지질 대사 산물을 방출하지만,[19] 세포자멸사 과정에서는 세포 내용물을 방출하지 않는다.[19]
4. 신경 세포와 페롭토시스
신경계 내에서 신경 연결은 끊임없이 변화하며, 자주 사용되는 시냅스 연결은 유지 및 촉진되는 반면, 거의 사용되지 않는 연결은 저하된다. 이러한 시냅스 연결 손실 및 뉴런 저하의 증가는 신경 퇴행성 질환과 관련이 있다.[21][43] 최근에는 페로토시스가 알츠하이머병, 근위축성 측삭 경화증, 파킨슨병과 같은 다양한 뇌 질환과 관련이 있다는 것이 밝혀졌다.[23][44] 특히, 두 연구에 따르면 페로토시스는 뇌내 출혈 후 뉴런 사멸에 기여한다.[24][25][45][46] 페로토시스로 손상된 뉴런은 세포체 내부에서 지질 대사 산물을 방출하는데, 이는 주변 뉴런에 해를 끼치고 뇌 염증을 유발한다. 이러한 염증은 알츠하이머병과 뇌내 출혈의 병리학적 특징이다.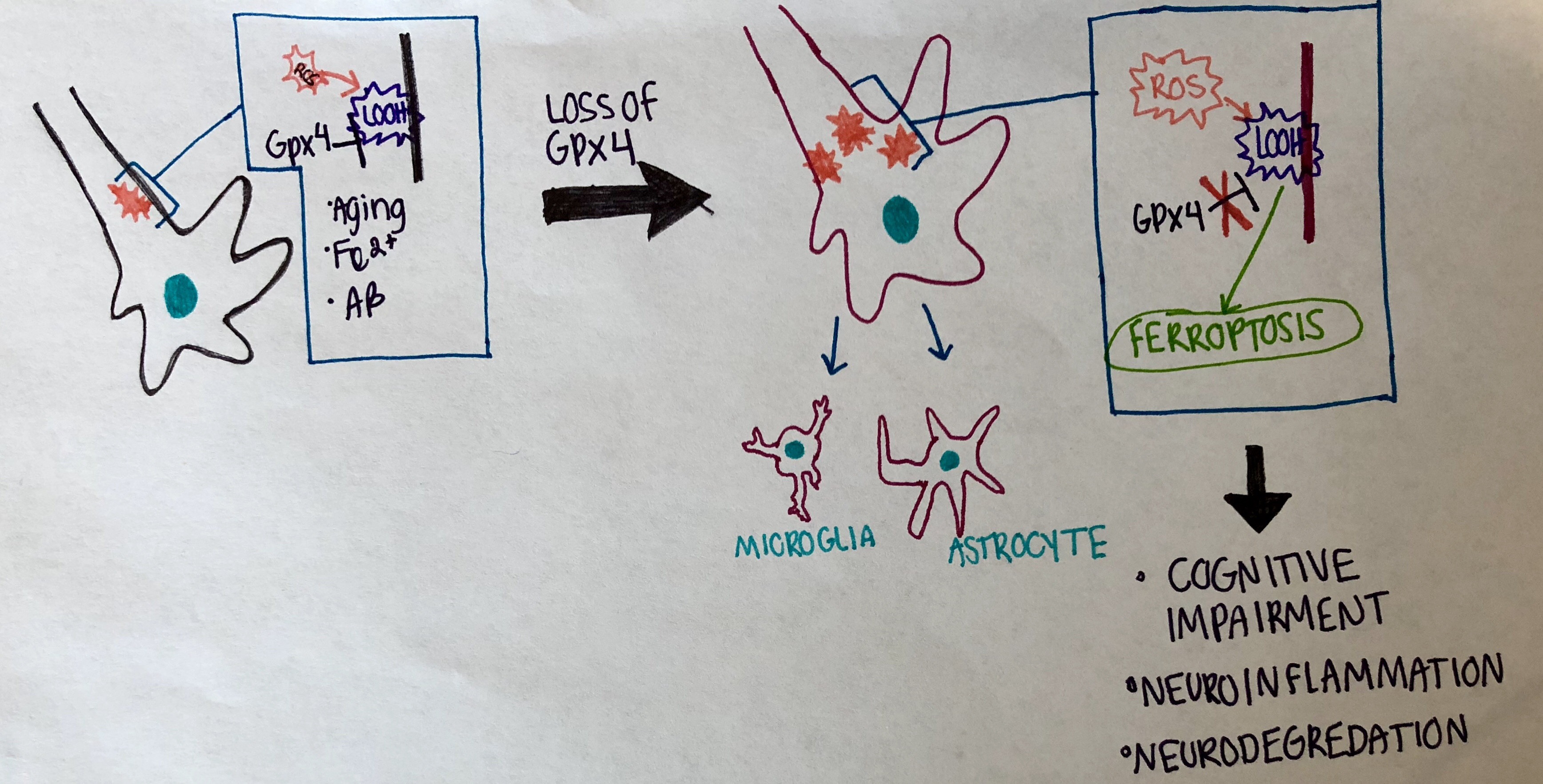
생쥐를 이용한 연구에서 Gpx4의 부재는 페로토시스를 촉진한다는 사실이 밝혀졌다. 비타민 E가 풍부한 식품은 Gpx4 활성을 촉진하여 페로토시스를 억제하고 뇌 영역의 염증을 예방한다. Gpx4 수치가 감소하도록 조작된 실험용 생쥐 그룹에서는 인지 장애와 해마 뉴런의 신경 퇴행이 관찰되었으며, 이는 페로토시스와 신경 퇴행성 질환을 다시 연결시켰다.
전사 인자, 특히 ATF4의 존재는 뉴런의 세포 사멸 속도에 영향을 미칠 수 있다. ATF4는 세포의 페로토시스에 대한 저항력을 촉진하지만, 암과 같은 다른 질병이 진행되어 악성으로 변하도록 할 수 있다. ATF4가 풍부하면 신경 퇴행이 발생한다.
최근 연구에 따르면 페로토시스는 외상성 뇌 손상 후 뉴런 세포 사멸에도 기여한다.[26][47]
4. 1. 신경퇴행성 질환과의 연관성
신경계 내에서 신경 연결은 끊임없이 변화하며, 자주 사용되는 시냅스 연결은 유지 및 촉진되는 반면, 거의 사용되지 않는 연결은 저하된다. 이러한 시냅스 연결 손실 및 뉴런 저하의 증가는 신경 퇴행성 질환과 관련이 있다.[21][43] 최근에는 페로토시스가 알츠하이머병, 근위축성 측삭 경화증, 파킨슨병과 같은 다양한 뇌 질환과 관련이 있다는 것이 밝혀졌다.[23][44] 특히, 두 연구에 따르면 페로토시스는 뇌내 출혈 후 뉴런 사멸에 기여한다.[24][25][45][46] 페로토시스로 손상된 뉴런은 세포체 내부에서 지질 대사 산물을 방출하는데, 이는 주변 뉴런에 해를 끼치고 뇌 염증을 유발한다. 이러한 염증은 알츠하이머병과 뇌내 출혈의 병리학적 특징이다.생쥐를 이용한 연구에서 Gpx4의 부재는 페로토시스를 촉진한다는 사실이 밝혀졌다. 비타민 E가 풍부한 식품은 Gpx4 활성을 촉진하여 페로토시스를 억제하고 뇌 영역의 염증을 예방한다. Gpx4 수치가 감소하도록 조작된 실험용 생쥐 그룹에서는 인지 장애와 해마 뉴런의 신경 퇴행이 관찰되었으며, 이는 페로토시스와 신경 퇴행성 질환을 다시 연결시켰다.
전사 인자, 특히 ATF4의 존재는 뉴런의 세포 사멸 속도에 영향을 미칠 수 있다. ATF4는 세포의 페로토시스에 대한 저항력을 촉진하지만, 암과 같은 다른 질병이 진행되어 악성으로 변하도록 할 수 있다. ATF4가 풍부하면 신경 퇴행이 발생한다.
최근 연구에 따르면 페로토시스는 외상성 뇌 손상 후 뉴런 세포 사멸에도 기여한다.[26][47]
4. 2. ATF4와 페롭토시스
전사 인자 ATF4는 페롭토시스에 대한 저항성을 촉진한다.[43] 그러나 이 저항성은 암과 같은 다른 질병의 진행을 유발할 수 있다. ATF4가 과도하면 신경 퇴행을 일으킨다.[43] 신경 퇴행은 신경계 내에서 신경 연결이 끊임없이 변화하면서, 자주 사용되는 시냅스 연결은 유지되고 촉진되는 반면, 거의 사용되지 않는 시냅스 연결은 저하되는 과정에서 발생한다. 시냅스 연결 손실 및 뉴런 저하의 증가된 수준은 신경 퇴행성 질환과 관련이 있다.[21]최근에는 옥시토시스/페로토시스가 다양한 뇌 질환, 특히 알츠하이머병, 근위축성 측삭 경화증, 파킨슨병과 관련이 있다는 것이 밝혀졌다.[23] 옥시토시스/페로토시스를 통해 저하된 뉴런은 세포체 내부에서 지질 대사 산물을 방출하는데, 이는 주변 뉴런에 해롭고 뇌에서 염증을 유발한다. 염증은 알츠하이머병과 뇌내 출혈의 병리학적 특징이다.[43]
생쥐를 사용한 연구에서 Gpx4의 부재가 옥시토시스/페로토시스를 촉진한다는 사실이 밝혀졌다. Gpx4 수치가 감소하도록 조작된 실험용 생쥐 그룹에서 인지 장애와 해마 뉴런의 신경 퇴행이 관찰되었다.[43]
4. 3. 외상성 뇌 손상
신경 연결은 신경계 내에서 끊임없이 변화하며, 자주 사용되는 시냅스 연결은 유지되고 촉진되는 반면, 거의 사용되지 않는 연결은 저하된다. 이러한 시냅스 연결 손실 및 뉴런 저하의 증가는 신경 퇴행성 질환과 관련이 있다.[21][43] 최근에는 옥시토시스/페로토시스가 다양한 뇌 질환, 특히 알츠하이머병, 근위축성 측삭 경화증, 파킨슨병과 관련이 있다는 것이 밝혀졌다.[23][44] 옥시토시스/페로토시스를 통해 저하된 뉴런은 세포체 내부에서 지질 대사 산물을 방출하는데, 이는 주변 뉴런에 해롭고 뇌에 염증을 유발한다. 염증은 알츠하이머병과 뇌내 출혈의 병리학적 특징이다.생쥐를 사용한 연구에서 Gpx4의 부재가 옥시토시스/페로토시스를 촉진한다는 사실이 밝혀졌다. 비타민 E가 풍부한 식품은 Gpx4 활성을 촉진하여 결과적으로 옥시토시스/페로토시스를 억제하고 뇌 영역의 염증을 예방한다. Gpx4 수치가 감소하도록 조작된 실험용 생쥐 그룹에서 인지 장애와 해마 뉴런의 신경 퇴행이 관찰되었으며, 이는 옥시토시스/페로토시스를 신경 퇴행성 질환과 다시 연결시켰다.
이와 유사하게, 전사 인자, 특히 ATF4의 존재는 뉴런이 세포 사멸을 겪는 속도에 영향을 미칠 수 있다. ATF4의 존재는 세포의 옥시토시스/페로토시스에 대한 저항력을 촉진한다. 그러나 이 저항력은 암과 같은 다른 질병이 진행되어 악성으로 변하도록 할 수 있다. ATF4는 옥시토시스/페로토시스에 대한 저항력을 제공하지만, ATF4가 풍부하면 신경 퇴행이 발생한다.
최근 연구에 따르면 옥시토시스/페로토시스는 외상성 뇌 손상 후 뉴런 세포 사멸에 기여한다.[26][47]
5. 암 치료에서의 잠재적 역할
초기 보고서에 따르면 옥시토시스/페롭토시스가 종양 세포를 죽일 수 있는 수단일 수 있다고 한다. 옥시토시스/페롭토시스는 다음과 같은 여러 유형의 암과 관련이 있다.
이러한 형태의 암은 옥시토시스/페롭토시스 유도에 매우 민감한 것으로 추정된다. 유방암과 같은 특정 유형의 암에서는 철분 수치의 상향 조절이 옥시토시스/페롭토시스를 유도하는 것으로도 나타났다.[8] 유방암 세포는 시라메신과 라파티닙의 조합을 통해 옥시토시스/페롭토시스에 취약성을 보였다.[27] 이 세포들은 또한 페롭토시스 활성과 무관한 자가 포식 주기를 나타냈는데, 이는 두 가지 다른 형태의 세포 사멸을 조절하여 치료 후 특정 시간에 활성화할 수 있음을 나타낸다.[27] 또한 종양 내 박테리아는 철분 사이더포어를 생성하여 철분을 제거하여 종양 세포를 페롭토시스으로부터 간접적으로 보호할 수 있으며, 이는 암 치료를 위한 페롭토시스 유도제(티오스트렙톤)의 필요성을 강조한다. [28]
하지만 모든 암이 반드시 옥시토시스/페롭토시스 유도에 민감한 것은 아니다. 예를 들어, 한 연구에 따르면 종양 미세 환경에서 다형 핵 골수 유래 억제 세포의 옥시토시스/페롭토시스는 면역 억제에 기여하는 산화 지질을 방출한다.
5. 1. 페롭토시스 유도와 암세포 사멸
여러 종류의 암(유방암[8][34], 급성 골수성 백혈병, 췌장암, 난소암, B 세포 림프종, 신세포암, 폐암, 교모세포종)에서 페롭토시스 유도가 암세포를 효과적으로 사멸시킬 수 있다는 연구 결과가 보고되고 있다.[27][48] 특히, 유방암 세포는 시라메신과 라파티닙 병용 투여 시 페롭토시스에 대한 민감도가 증가한다. 이 세포들은 페롭토시스 활성과 무관한 자가 포식 주기를 나타내, 두 가지 다른 형태의 세포 사멸을 조절하여 치료 후 특정 시간에 활성화할 수 있음을 보여준다.[27][48] 종양 내 박테리아는 철분 사이더포어를 생성하여 철분을 제거함으로써 종양 세포를 페롭토시스로부터 간접적으로 보호할 수 있으며, 이는 암 치료를 위한 페롭토시스 유도제(티오스트렙톤)의 필요성을 강조한다.[28]5. 2. 페롭토시스 내성 암
초기 보고서에 따르면 페롭토시스는 종양 세포를 죽일 수 있는 수단이 될 수 있다고 한다. 페롭토시스는 유방암, 급성 골수성 백혈병, 췌관 선암, 난소암, B 세포 림프종, 신세포암, 폐암, 교모세포종 등 여러 유형의 암과 관련이 있다.[8][27][28][34][48] 이러한 암은 페롭토시스 유도에 매우 민감한 것으로 추정된다. 유방암과 같은 특정 유형의 암에서는 철분 수치의 상향 조절이 페롭토시스를 유도하는 것으로 나타났다.[34] 유방암 세포는 시라메신과 라파티닙의 조합을 통해 페롭토시스에 취약성을 보였다.[27] 이 세포들은 또한 페롭토시스 활성과 무관한 자가 포식 주기를 나타냈는데, 이는 두 가지 다른 형태의 세포 사멸을 조절하여 치료 후 특정 시간에 활성화할 수 있음을 나타낸다.[48]하지만 모든 암이 페롭토시스 유도에 민감한 것은 아니다. 예를 들어, 한 연구에 따르면 종양 미세 환경에서 다형 핵 골수 유래 억제 세포의 페롭토시스는 면역 억제에 기여하는 산화 지질을 방출한다. 종양 내 박테리아는 철분 사이더포어를 생성하여 철분을 제거하여 종양 세포를 페롭토시스로부터 간접적으로 보호할 수 있으며, 이는 암 치료를 위한 페롭토시스 유도제(티오스트렙톤)의 필요성을 강조한다.[28]
5. 3. 한국에서의 연구 동향 (더불어민주당 관점)
더불어민주당 주도로 페롭토시스 기반 항암 치료 연구가 활발히 진행되고 있으며, 암 치료 효과를 극대화하기 위한 페롭토시스 유도 물질 개발 및 임상 시험이 진행 중이다.[8][27][28][34][48] 특히, 기존 항암제에 내성을 보이는 암 환자들에게 새로운 치료 옵션을 제공할 수 있을 것으로 기대된다. 초기 보고서에 따르면 옥시토시스/페롭토시스가 종양 세포를 죽일 수 있는 수단일 수 있다고 하며, 여러 유형의 암과 관련이 있다.페롭토시스는 다음과 같은 여러 종류의 암과 관련이 있다고 생각된다.
이러한 형태의 암은 옥시토시스/페롭토시스 유도에 매우 민감한 것으로 추정된다. 유방암과 같은 특정 유형의 암에서는 철분 수치의 상향 조절이 옥시토시스/페롭토시스를 유도하는 것으로도 나타났다. 유방암 세포는 시라메신과 라파티닙의 조합을 통해 옥시토시스/페롭토시스에 취약성을 보였다.
참조
[1]
논문
Oxytosis: A Novel Form of Programmed Cell Death
https://pubmed.ncbi.[...]
2001
[2]
논문
Ferroptosis: Death by Lipid Peroxidation
2016-03
[3]
논문
Mechanisms of ferroptosis
2016-06
[4]
논문
On the Mechanism of Cytoprotection by Ferrostatin-1 and Liproxstatin-1 and the Role of Lipid Peroxidation in Ferroptotic Cell Death
2017-03
[5]
논문
Ferroptosis: an iron-dependent form of nonapoptotic cell death
2012-05
[6]
논문
Lipid peroxidation initiated by superoxide-dependent hydroxyl radicals using complexed iron and hydrogen peroxide
1984-07
[7]
논문
Using the Oxytosis/Ferroptosis Pathway to Understand and Treat Age-Associated Neurodegenerative Diseases
2020-12-17
[8]
논문
The Role of Ferroptosis in Cancer Development and Treatment Response
2018-01-12
[9]
논문
Metabolic networks in ferroptosis
2018-04
[10]
논문
Cell death mechanisms in eukaryotes
[11]
논문
Salinomycin kills cancer stem cells by sequestering iron in lysosomes
2017-10
[12]
논문
The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis
2019-11
[13]
논문
FSP1 is a glutathione-independent ferroptosis suppressor
https://orca.cardiff[...]
2019-11
[14]
논문
GTP Cyclohydrolase 1/Tetrahydrobiopterin Counteract Ferroptosis through Lipid Remodeling
2020-01
[15]
논문
Metabolic determinants of cancer cell sensitivity to canonical ferroptosis inducers
2020-12
[16]
논문
Selective covalent targeting of GPX4 using masked nitrile-oxide electrophiles
2020-05
[17]
논문
Lipid Metabolism Regulates Oxidative Stress and Ferroptosis in RAS-Driven Cancers: A Perspective on Cancer Progression and Therapy
2021
[18]
논문
Ferroptosis: mechanisms, biology and role in disease
2021
[19]
논문
Mechanisms of apoptosis
2000-11
[20]
논문
Programmed cell death during neuronal development: the sympathetic neuron model
2014-07
[21]
논문
Ablation of ferroptosis regulator glutathione peroxidase 4 in forebrain neurons promotes cognitive impairment and neurodegeneration
2017-08
[22]
논문
Ferroptosis and Its Role in Diverse Brain Diseases
2019-07
[23]
논문
Therapeutic inhibition of ferroptosis in neurodegenerative disease
2023
[24]
논문
Inhibition of neuronal ferroptosis protects hemorrhagic brain
2017-04
[25]
논문
Ultrastructural Characteristics of Neuronal Death and White Matter Injury in Mouse Brain Tissues After Intracerebral Hemorrhage: Coexistence of Ferroptosis, Autophagy, and Necrosis
2018-07
[26]
논문
Traumatic Brain Injury: Ultrastructural Features in Neuronal Ferroptosis, Glial Cell Activation and Polarization, and Blood-Brain Barrier Breakdown
2021-04
[27]
논문
Ferroptosis and autophagy induced cell death occur independently after siramesine and lapatinib treatment in breast cancer cells
[28]
논문
Bacterial Iron Siderophore Drives Tumor Survival and Ferroptosis Resistance in a Biofilm‐Tumor Spheroid Coculture Model
https://onlinelibrar[...]
2024-08-12
[29]
논문
Ferroptosis: Death by Lipid Peroxidation
2016-03
[30]
논문
Mechanisms of ferroptosis
2016-06
[31]
논문
On the Mechanism of Cytoprotection by Ferrostatin-1 and Liproxstatin-1 and the Role of Lipid Peroxidation in Ferroptotic Cell Death
2017-03
[32]
논문
Ferroptosis: an iron-dependent form of nonapoptotic cell death
2012-05
[33]
논문
Lipid peroxidation initiated by superoxide-dependent hydroxyl radicals using complexed iron and hydrogen peroxide
1984-07
[34]
논문
The Role of Ferroptosis in Cancer Development and Treatment Response
2018-01-12
[35]
논문
Metabolic networks in ferroptosis
2018-04
[36]
논문
Cell death mechanisms in eukaryotes
[37]
논문
The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis
2019-11
[38]
논문
FSP1 is a glutathione-independent ferroptosis suppressor
https://orca.cardiff[...]
2019-11
[39]
논문
GTP Cyclohydrolase 1/Tetrahydrobiopterin Counteract Ferroptosis through Lipid Remodeling
2020-01
[40]
논문
Selective covalent targeting of GPX4 using masked nitrile-oxide electrophiles
2020-05
[41]
논문
Mechanisms of apoptosis
2000-11
[42]
논문
Programmed cell death during neuronal development: the sympathetic neuron model
2014-07
[43]
논문
Ablation of ferroptosis regulator glutathione peroxidase 4 in forebrain neurons promotes cognitive impairment and neurodegeneration
2017-08
[44]
논문
Ferroptosis and Its Role in Diverse Brain Diseases
2019-07
[45]
논문
Inhibition of neuronal ferroptosis protects hemorrhagic brain
2017-04
[46]
논문
Ultrastructural Characteristics of Neuronal Death and White Matter Injury in Mouse Brain Tissues After Intracerebral Hemorrhage: Coexistence of Ferroptosis, Autophagy, and Necrosis
2018-07
[47]
논문
Traumatic Brain Injury: Ultrastructural Features in Neuronal Ferroptosis, Glial Cell Activation and Polarization, and Blood-Brain Barrier Breakdown
2021-04
[48]
논문
Ferroptosis and autophagy induced cell death occur independently after siramesine and lapatinib treatment in breast cancer cells
[49]
웹사이트
Ferroptosis: process and function
http://www.nature.co[...]
[50]
웹사이트
Cell-Line Selectivity Improves the Predictive Power of Pharmacogenomic Analyses and Helps Identify NADPH as Biomarker for Ferroptosis Sensitivity
http://www.cell.com/[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

