오토파지
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
오토파지는 세포가 손상된 세포 소기관이나 단백질을 분해하여 재활용하는 세포 내 청소 과정이다. 1960년대에 처음 발견되었으며, 기아 상태에서 영양을 공급하고 세포 내 항상성을 유지하는 데 중요한 역할을 한다. 오토파지는 거대자가포식, 미세자가포식, 샤프론 매개 자가포식의 세 가지 유형으로 나뉘며, 다양한 유전자(ATG)에 의해 조절된다.
1962년 1월, 키스 R. 포터(Keith R. Porter)와 토마스 애시포드(Thomas Ashford)는 록펠러 대학교에서 쥐의 간세포에 글루카곤을 첨가한 후 리소좀 수가 증가하고 일부 리소좀이 미토콘드리아 등 다른 세포 소기관을 포함하는 것을 관찰하여 자가포식을 처음 발견했다. 이들은 크리스티안 드 듀브(Christian de Duve)와 알렉스 B. 노비코프(Alex B. Novikoff)의 이름을 따서 자가용해라고 불렀으나, 리소좀 형성에 대한 오해였다.[20]
오토파지는 크게 거대자가포식(macroautophagy), 미세자가포식(microautophagy), 샤프론 매개 자가포식(chaperone-mediated autophagy)의 세 가지로 나뉜다.[204] 이 중 거대자가포식은 세포 내 환경을 유지하기 위해 손상되거나 불필요한 세포소기관을 분해하는 주요 경로이며, 영양소 또는 에너지 결핍 등의 스트레스 조건에서 유도될 수 있다. 거대자가포식은 다음과 같은 여러 단계로 진행된다.[205]
오토파지는 감염 방어, 발생 및 분화, 노화 억제 등 다양한 생리적 기능에 관여하며, 암, 신경퇴행성 질환, 감염병 등 다양한 질병과 관련되어 있다. 오토파지 조절은 암 치료, 신경퇴행성 질환 치료, 수명 연장 등 다양한 분야에서 활용될 가능성이 높아 연구가 활발히 진행되고 있다.
2. 역사
1963년, Hruban, Spargo와 동료들은 "초점 세포질 분해"에 대한 상세한 초미세 구조적 설명을 발표하며, 격리된 세포질이 리소좀으로 성숙하는 세 단계를 제시하고, "세포 물질의 재활용" 및 분화 중 "소기관의 처리"를 위한 생리적 조건에서 작용한다고 보았다.[21] 드 듀브는 이 현상을 "자가포식"이라 명명하고, 자가포식을 리소좀 기능의 일부로 간주했다. 그의 제자 러셀 데터(Russell Deter)와 함께 리소좀이 글루카곤 유도 자가포식을 담당한다는 것을 밝혀내며, 리소좀이 세포 내 자가포식 부위임을 처음으로 확립했다.[22][23][3][24][25]
1990년대에는 여러 과학자 그룹이 효모를 이용해 자가포식 관련 유전자를 발견했다. 오스미 요시노리와 마이클 텀(Michael Thumm)은 기아 유도 비선택적 자가포식을 연구했고,[15][16][17] 다니엘 J. 클리온스키(Daniel J. Klionsky)는 선택적 자가포식의 한 형태인 세포질-액포 표적화(CVT) 경로를 발견했다.[14][18] 이들은 서로 다른 관점에서 동일한 경로를 연구하고 있음을 알게 되었다.[26][27] 초기에는 APG, AUT, CVT, GSA, PAG, PAZ, PDD 등 서로 다른 이름이 부여되었으나, 2003년 효모 연구자들은 자가포식 유전자를 ATG로 통일하여 사용하자고 제안했다.[28] 1992년 오스미 요시노리 등은 출아 효모(''Saccharomyces cerevisiae'')의 오토파지를 처음으로 관찰했고, 1993년 APG1을 포함하여 14종의 오토파지에 필수적인 유전자를 확정하여 발표했다.[122][130] 2003년 APG와 동일한 유전자를 다른 이름으로 연구하던 그룹들에 의해 오토파지 관련 유전자 이름이 ''ATG'' ('''A'''u'''t'''opha'''g'''y)로 통일되었다.[131]
2016년 노벨 생리학·의학상은 오스미 요시노리에게 수여되었으나,[19] 일각에서는 상이 더 포괄적일 수 있었다는 지적이 있었다.[29]
21세기 초, 자가포식 연구 분야는 급성장했다. ATG 유전자에 대한 지식은 인간의 건강과 질병에서 자가포식의 기능을 연구하는 도구를 제공했다. 1999년, 베스 레빈(Beth Levine) 그룹은 자가포식과 암을 연결하는 획기적인 발견을 발표했고,[30] 암과 자가포식의 관계는 주요 연구 주제가 되었다. 신경 퇴행 및 면역 방어에서 자가포식의 역할도 주목받았다. 2003년 첫 번째 고든 연구 회의,[31] 2005년 ''자가포식'' 창간,[32] 2007년 첫 번째 키스톤 심포지아가 개최되었다. 2008년, 캐롤 A. 머서(Carol A Mercer)는 BHMT 융합 단백질(GST-BHMT)을 만들었다.
2. 1. 초기 연구
1953년부터 1955년까지 크리스티앙 드 뒤브에 의해 다양한 가수분해 효소를 포함하는 세포 소기관으로서 리소좀이 발견되었다.[122] 1962년 1월, 록펠러 대학교의 키스 R. 포터(Keith R. Porter)와 토마스 애쉬포드(Thomas Ashford)는 쥐의 기아 상태에서 처음으로 오토파지를 관찰했다. 처음부터 자기 자신을 먹어서 영양을 섭취하고 기아를 방지한다고 추측되었으며,[123] 이후 이 추측은 옳다는 것이 밝혀졌다.[123]
1963년, 드 뒤브는 세포가 자신의 단백질을 소포 (오토파고좀)와 리소좀을 융합하여 분해하는 현상을 오토파지라고 명명했다.[122][124]
이후 유비퀴틴-프로테아좀 계에 의한 단백질 분해 기작은 해명되었으나, 오토파지의 분자생물학적인 해명은 거의 진전이 없었다. 이는 전자 현미경에 의한 관찰이 오토파고좀을 검출하는 유일한 수단이었기 때문이었다.[122] 또한 오토파지 현상을 부정하는 논문도 발표되었다.[124]
2. 2. 오토파지 유전자 발견
'''ATG'''는 "'''A'''u'''T'''opha'''G'''y"-관련의 약자로, 자가소화 작용(오토파지)의 생물학적 과정과 관련된 유전자와 단백질 모두에 적용된다.[52] 효모에서 인간에 이르기까지 보존된 많은 핵심 ATG 단백질을 코딩하는 약 16-20개의 보존 서열 ''ATG'' 유전자가 있다.[52]
자가소화는 ATG 유전자에 의해 실행된다. 2003년 이전에는 10개 이상의 이름이 사용되었지만, 이 시점 이후 곰팡이 자가소화 연구자에 의해 통일된 명명법이 고안되었다.[55] 첫 번째 자가소화 유전자는 ''사카로미세스 세레비시아(출아 효모)''에서 수행된 유전자 스크린에 의해 확인되었다.[14][15][16][17][18] 이러한 유전자가 확인된 후, 기능적으로 특성화되었고 다양한 다른 유기체에서 그들의 상동유전자가 확인되어 연구되었다.[11][56]
1992년, 오스미 요시노리(당시 도쿄 대학 교양학부 조교수) 등은 출아 효모(''Saccharomyces cerevisiae'')의 오토파지를 처음으로 관찰했다.[122] 오스미 등은 1988년에 출아 효모의 액포 내로 단백질 등이 흡수되는 현상을 확인했으며, 1992년의 관찰을 통해 출아 효모에서의 오토파지를 실증했다.[125]
오스미 요시노리 등은 출아 효모를 돌연변이 유발제로 처리하여 무작위로 유전자를 손상시키는 방식으로 오토파지 불능 변이체의 생성을 시도했다. 5000개의 돌연변이체 중 단 하나의 변이주가 발견되었으며, 오토파지('''A'''uto'''p'''ha'''g'''y)의 철자를 따서 "''apg1'' 변이체"라고 명명했다.[122][129] 자세한 분석 결과, 당시 역할이 알려지지 않은 유전자에 손상이 있는 것을 확인하고, "''APG1'' 유전자"라고 명명했다.[122][130] 오스미 등은 ''APG1''을 포함하여 14종의 오토파지 불능 변이체를 동정하고, 이들 유전자 분석을 통해 오토파지에 필수적인 14종의 유전자를 확정하여 1993년 『FEBS Letters』에 논문을 발표했다.[122][130]
2003년에 여러 해외 연구 그룹이 ''APG''와 동일한 유전자를 다른 이름으로 연구하고 있었다는 사실이 밝혀지면서, 오토파지 관련 유전자 이름이 ''ATG'' ('''A'''u'''t'''opha'''g'''y)로 통일되었다. ''APG1''은 ''ATG1''으로, ''APG16''은 ''ATG16''으로 오스미가 부여한 번호가 그대로 이어졌다.[131]
현재(2016년 기준) 41종의 ''ATG'' 유전자가 동정되어 있다. 그중 총 18개(''Atg1'' - ''Atg10'', ''Atg12'' - ''Atg14'', ''Atg16'' - ''Atg18'', ''Atg29'', ''Atg31'')가 오토파고솜 형성에 필수적인 유전자로 여겨진다.[122][132]
오스미 요시노리 등이 효모에서 오토파지 유전자를 동정하던 당시, 사람과 생쥐의 전체 게놈 해독이 진행되었다. 이러한 성과를 바탕으로 ''ATG'' 유전자의 사람 및 생쥐 호모로그가 발견되었다. 1998년에는 최초의 포유류 Atg 호모로그인 Atg12와 Atg5가, 1999년에는 Atg6 호모로그인 Beclin1이 발견되었다. 2000년에는 Atg8의 포유류 호모로그인 LC3에 대한 논문이 발표되었다.
2. 3. 오토파지 연구의 발전
1962년 1월, 키스 R. 포터(Keith R. Porter)와 그의 제자 토마스 애시포드(Thomas Ashford)는 록펠러 대학교(Rockefeller Institute)에서 쥐의 간세포에 글루카곤을 첨가한 후 리소좀의 수가 증가하고, 일부 리소좀이 미토콘드리아 등 다른 세포 소기관을 포함하고 있음을 발견하여 자가포식을 처음 관찰했다. 이들은 크리스티안 드 듀브(Christian de Duve)와 알렉스 B. 노비코프(Alex B. Novikoff)의 이름을 따서 이를 자가용해라고 불렀으나, 리소좀 형성에 대한 오해였다.[20] 1963년, Hruban, Spargo와 동료들은 "초점 세포질 분해"에 대한 상세한 초미세 구조적 설명을 발표하며, 격리된 세포질이 리소좀으로 성숙하는 세 단계를 제시하고, "세포 물질의 재활용" 및 분화 중 "소기관의 처리"를 위한 생리적 조건에서 작용한다고 보았다.[21] 드 듀브는 이 현상을 "자가포식"이라 명명하고, 자가포식을 리소좀 기능의 일부로 간주했다. 그의 제자 러셀 데터(Russell Deter)와 함께 리소좀이 글루카곤 유도 자가포식을 담당한다는 것을 밝혀내며, 리소좀이 세포 내 자가포식의 부위임을 처음으로 확립했다.[22][23][3][24][25]
1990년대에는 여러 과학자 그룹이 효모를 이용해 자가포식 관련 유전자를 발견했다. 오스미 요시노리와 마이클 텀(Michael Thumm)은 기아 유도 비선택적 자가포식을 연구했고,[15][16][17] 다니엘 J. 클리온스키(Daniel J. Klionsky)는 선택적 자가포식의 한 형태인 세포질-액포 표적화(CVT) 경로를 발견했다.[14][18] 이들은 서로 다른 관점에서 동일한 경로를 연구하고 있음을 알게 되었다.[26][27] 초기에는 효모 그룹과 다른 그룹이 발견한 유전자에 APG, AUT, CVT, GSA, PAG, PAZ, PDD 등 서로 다른 이름이 부여되었으나, 2003년 효모 연구자들은 자가포식 유전자를 ATG로 통일하여 사용하자고 제안했다.[28]
2016년 노벨 생리학·의학상은 오스미 요시노리에게 수여되었으나,[19] 일각에서는 상이 더 포괄적일 수 있었다는 지적이 있었다.[29]
21세기 초, 자가포식 연구 분야는 급성장했다. ATG 유전자에 대한 지식은 인간의 건강과 질병에서 자가포식의 기능을 연구하는 도구를 제공했다. 1999년, 베스 레빈(Beth Levine) 그룹은 자가포식과 암을 연결하는 획기적인 발견을 발표했고,[30] 암과 자가포식의 관계는 주요 연구 주제가 되었다. 신경 퇴행 및 면역 방어에서 자가포식의 역할도 주목받았다. 2003년, 워터빌에서 자가포식에 관한 첫 번째 고든 연구 회의가 개최되었다.[31] 2005년, 다니엘 J. 클리온스키는 ''자가포식''을 창간했다. 2007년 몬터레이에서 자가포식에 관한 첫 번째 키스톤 심포지아가 개최되었다.[32] 2008년, 캐롤 A. 머서(Carol A Mercer)는 세포주에서 기아 유도 부위 특이적 단편화를 보여주는 BHMT 융합 단백질(GST-BHMT)을 만들었다. 베타인 호모시스테인 메틸전달효소(BHMT)의 분해는 포유류 세포에서 자가포식 플럭스를 평가하는 데 사용될 수 있다.
오스미 요시노리 등은 출아 효모를 돌연변이 유발제로 처리하여 무작위로 유전자를 손상시키는 방식으로 오토파지 불능 변이체를 만들었다. 5000개의 돌연변이체 중 단 하나의 변이주가 발견되었으며, "''apg1'' 변이체"라고 명명했다[122][129]。자세한 분석 결과, 당시 역할이 알려지지 않은 유전자에 손상이 있는 것을 확인하고, "''APG1'' 유전자"라고 명명했다[122][130]。오스미 등은 ''APG1''을 포함하여 14종의 오토파지 불능 변이체를 동정하고, 이들 유전자 분석을 통해 오토파지에 필수적인 14종의 유전자를 확정하여 1993년 『FEBS Letters』에 논문을 발표했다[122][130]。
2003년에 여러 해외 연구 그룹이 ''APG''와 동일한 유전자를 다른 이름으로 연구하고 있었다는 사실이 밝혀지면서, 오토파지 관련 유전자 이름이 ''ATG'' ('''A'''u'''t'''opha'''g'''y)로 통일되었다. ''APG1''은 ''ATG1''으로, ''APG16''은 ''ATG16''으로 오스미가 부여한 번호가 그대로 이어졌다[131]。
현재(2016년 기준) 41종의 ''ATG'' 유전자가 동정되어 있다. 그중 총 18개(''Atg1'' - ''Atg10'', ''Atg12'' - ''Atg14'', ''Atg16'' - ''Atg18'', ''Atg29'', ''Atg31'')가 오토파고솜 형성에 필수적인 유전자로 여겨진다[122][132]。
오스미 요시노리 등이 효모에서 오토파지 유전자를 동정하던 당시, 사람과 생쥐의 전체 게놈 해독 DNA가 진행되었다. 이러한 성과를 바탕으로 ''ATG'' 유전자의 사람 및 생쥐 호모로그가 발견되었다. 1998년에는 최초의 포유류 Atg 호모로그인 Atg12와 Atg5가, 1999년에는 Atg6 호모로그인 Beclin1이 발견되었다. 2000년에는 Atg8의 포유류 호모로그인 LC3에 대한 논문이 발표되었다.3. 오토파지 메커니즘
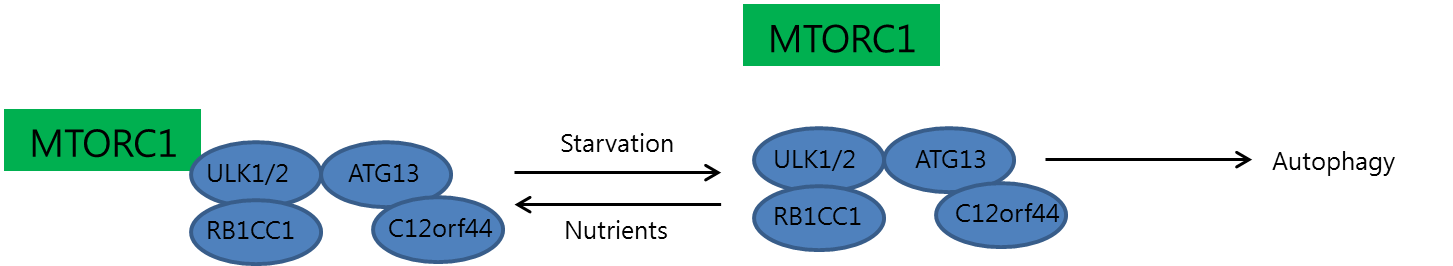
1. 인덕션(Induction, 유도)효모에서 자가포식소체(autophagosome) 형성은 Atg1-Atg13-Atg17-Atg31-Atg29 복합체에 의해 유도된다. 포유류 세포에서는 Atg1 homolog, Atg13 homolog, RB1-inducible coiled-coil 1로 구성된 복합체가 이 역할을 수행하며, 이는 거대자가포식 유도에 필요한 효모 Atg17의 ortholog일 수 있다. ATG13에 직접 결합하는 C12orf44 / ATG101은 거대자가포식에 필수적이지만, 알려진 homolog는 없다.
포유류 ULK1 / 2-ATG13-RB1CC1 복합체는 안정적이며 영양 상태와 상관없이 형성되지만, MTORC1은 영양 상태에 영향을 받는다. 영양이 풍부하면 MTORC1이 복합체와 결합하여 ULK1 / 2 및 ATG13을 인산화시켜 비활성화한다. 반면, 영양소가 부족하거나 세포에 라파마이신이 처리되면 MTORC1이 induction complex에서 해리되어 탈인산화가 일어나고, 이는 자가포식을 유도한다.[205]
2. 핵형성(Nucleation, 핵 생성)PtdIns3K complex는 파고포어(phagophore) 핵 형성에 관여하며, 거대자가포식 경로에 필수적인 BECN1과 상호 작용하여 조절된다. 항세포사멸(antiapoptotic) 단백질 BCL2는 BECN1에 결합하여 PIK3C3와의 상호 작용을 막아 거대자가포식을 억제한다. 또 다른 BECN1-결합 단백질 KIAA0226 / Rubicon은 UVRAG-associated PtdIns3K complexes에서 PIK3C3 활성을 억제한다. 반면, AMBRA1과 SH3GLB1 / Bif-1은 PtdIns3K 복합체의 활성을 촉진하는 두 가지 인자이다.[205]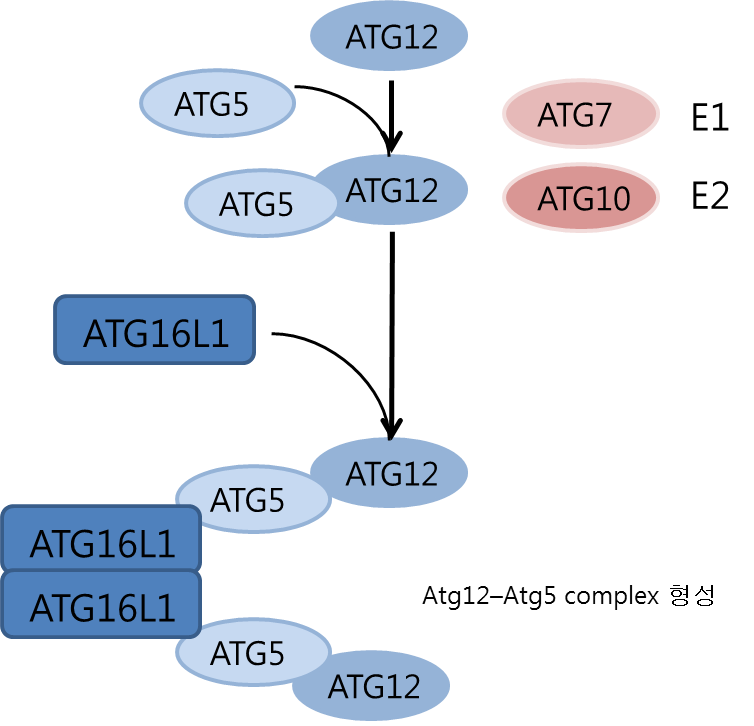
3. 연쇄(Elongation, 신장)효모와 포유류에는 파고포어 확장에 기여하는 두 가지 시스템이 존재한다.[205]
미세자가포식은 불필요하거나 기능하지 않는 세포소기관이 세포질에서 리소좀으로 직접적으로 함입되어 분해되는 과정이다. 대부분 비선택적 과정이지만, 이외에 3가지 선택적인 경우가 존재한다. 미세자가포식은 아래 4가지 단계로 일어난다.[206]
1. 막 함입과 오토파지 튜브 형성: 세포가 굶주렸을 때 막 함입 빈도가 증가하며 오토파지 튜브가 형성된다.
2. 소낭 형성: 막관통단백질을 제거하여 지질 비율이 높아지면서 막 구성이 바뀐다.[207]
3. 소낭 팽창과 분리: 아직 닫히지 않은 소낭에 효소와 결합하며 확장된다.
4. 소낭 분해와 재활용: 가수분해효소에 의해 리소좀 안에서 분해된다.
샤프론 매개 자가포식은 소낭 형성 없이 샤프론에 의해 세포질 단백질이 분해되는 과정이다. 세포질에 있는 샤프론인 heat shock 70kDa protein 8(HSPA8)이 단백질의 KFERQ 모티프를 인식한 후, 리소좀에 있는 막단백질 lysosomal-associated membrane protein 2A(LAMP2A)를 수용체로 하여 리소좀 내부로 들어간다.[208]
3. 1. 종류
오토파지는 크게 거대자가포식(macroautophagy), 미세자가포식(microautophagy), 샤프론 매개 자가포식(chaperone-mediated autophagy)의 세 가지로 나뉜다.[204] 단순히 오토파지라고 하면 보통 마크로오토파지를 가리킨다.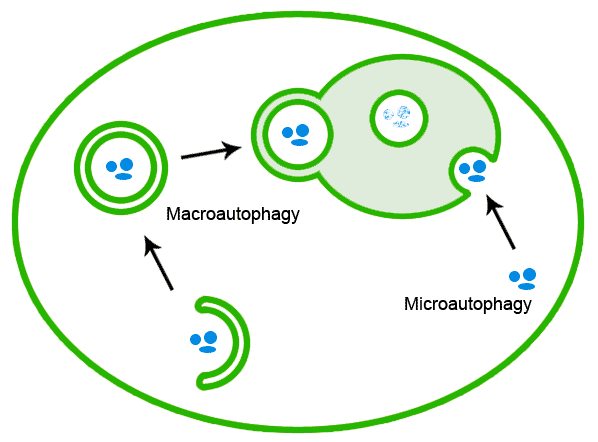
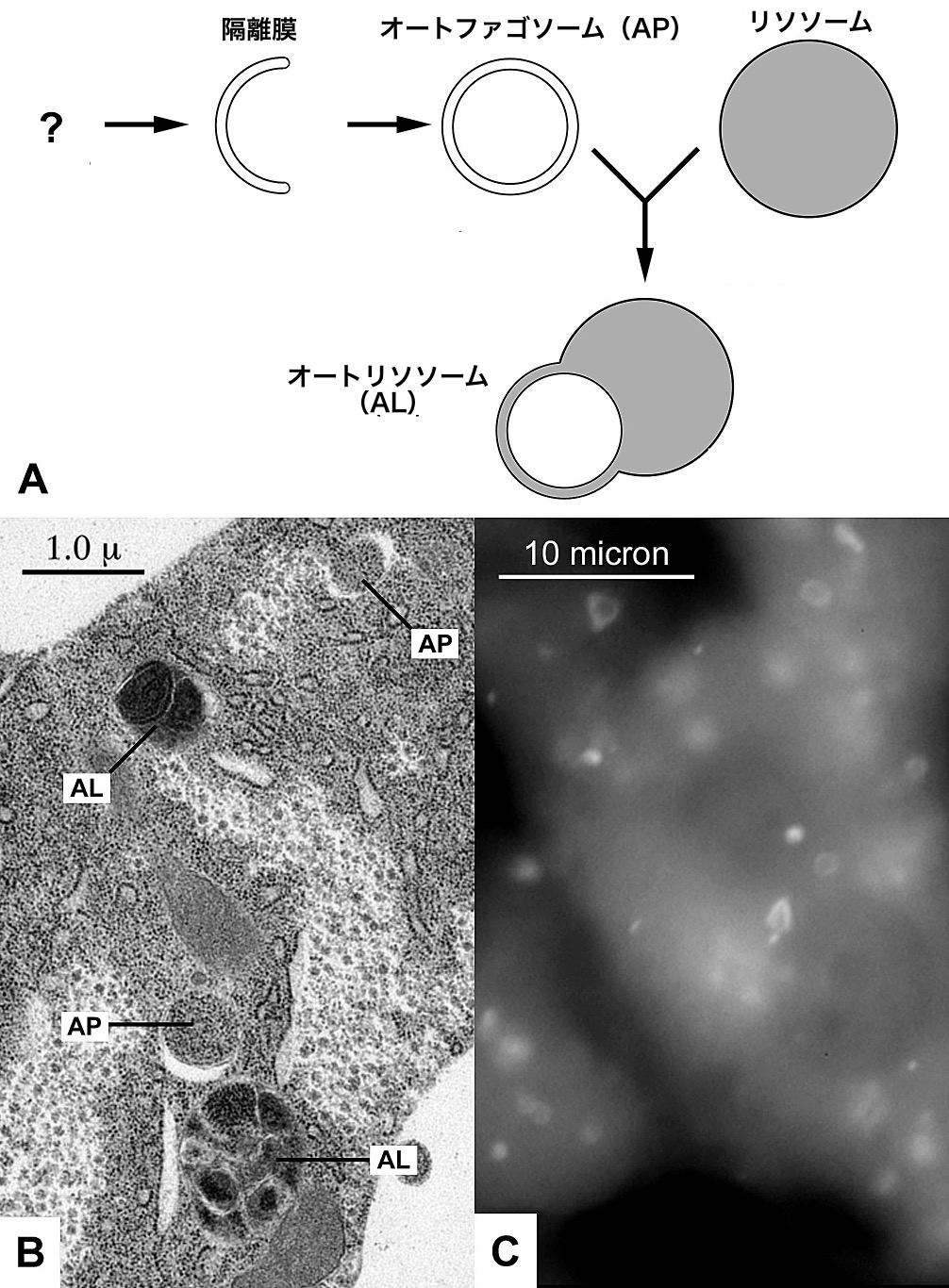
주로 손상된 세포 소기관이나 사용하지 않는 단백질을 제거하는 데 사용되는 주요 경로이다.[40] 세포가 아미노산 기아 상태나 이상 단백질 축적과 같은 스트레스에 노출되면, 세포질 일부에서 과도하게 생성된 단백질이나 이상 단백질과 함께 인지질이 모여 '''오토파고솜'''(Autophagosome, AP 또는 Autophagic vesicle)이라는 세포 내 구조 형성이 시작된다. 미토콘드리아에 접하는 소포체에서 축적된 인지질은 '''격리막'''(Isolation membrane, IM 또는 Phagophore)이라고 불리는 지질 이중막을 형성하고,[136] 이것이 성장하면서 세포질 성분이나 세포 소기관 등을 이중 인지질 막으로 둘러싼 소포가 형성된다.[137] 이 소포 형성에 '''Atg''' ('''a'''u'''t'''opha'''g'''y-related) 단백질이라고 불리는 일군의 단백질이 관여한다.[137]
# '''인덕션(Induction)'''
#* 효모에서의 오토파고솜 유도 형성은 Atg1-Atg13-Atg17-Atg31-Atg29 복합체에 의해 이루어진다. 포유류 세포에서는 Atg1 homolog, Atg13 homolog, RB1-inducible coiled-coil 1로 이루어져 있으며 이는 macroautophagy 유도에 필요한 yeast Atg17의 ortholog 일 수 있다. ATG13에 직접 결합하는 C12orf44 / ATG101은 macroautophagy에 필수적이며 알려진 homolog가 없다. 포유류 ULK1 / 2-ATG13-RB1CC1 복합체는 안정하고 영양 상태와 상관없이 형성되는 반면 MTORC1은 영양 상태에 영향을 받는다. 영양이 풍부한 조건 하에서, MTORC1은 복합체와 결합하지만, 영양 부족 상태에서는 결합하지 못한다. MTORC1이 결합되면 ULK1 / 2 및 ATG13을 인산화시켜 불활성화한다. 그러나 세포에 라파마이신이 처리되거나 영양소가 부족할 때는 MTORC1이 induction complex에서 해리되어 탈인산화가 일어난다.[205]
# '''핵형성(Nucleation)'''
#* PtdIns3K complex는 파고포어 핵 형성에 관여하며 macroautophagic 경로에 필수적인 BECN1과 상호 작용함으로써 조절된다. antiapoptotic 단백질 BCL2은 BECN1에 결합하고 PIK3C3와의 상호 작용을 방지하여 macroautophagy를 억제한다. 또 다른 BECN1-결합 단백질 KIAA0226 / Rubicon은 UVRAG-associated PtdIns3K complexes에서 PIK3C3 활성을 억제한다. AMBRA1과 SH3GLB1 / Bif-1은 PtdIns3K 복합체의 두 가지 양성 조절 인자이다.[205]
# '''연쇄(Elongation)'''
#* 효모와 포유류에는 파고포어 확장에 기여하는 두 가지 시스템이 있다.
#** Atg12–Atg5-Atg16 complex 형성: 효모에서 ubiquitin-like protein ATG12는 Atg7과 Atg10에 의해 Atg5에 공유 결합한다. ATG7, ATG10은 각각 E1 활성화 및 E2 접합 효소이다. 위 과정은 비가역적이며 E3 ligase를 필요로 하지 않는다. 이후 ATG16L1은 ATG5에 비공유 결합하고 이합체화하여 막의 확장을 촉진시킨다. 포유 동물에서의 ATG12-ATG5-ATG16L1 복합체는 phagophore membrane과 결합하나 autophagosome completion 후 해리한다. Golgi protein RAB33A은 ATG16L1에 붙어 이를 억제할 수 있으며 ATG5, ATG7, ATG12는 KAT2B / p300에 의한 acetylation으로 억제된다.[205]
#** Atg8/LC3 system: 효모에서 위 경로는 cysteine protease Atg4에 의해 Atg8의 C 말단 글리신 잔기가 노출되며 시작된다. E1-like enzyme Atg7은 Atg8을 활성화하고 이를 E2-like enzyme Atg3로 전달한다. Atg8의 C- 말단 글리신은 lipid phosphatidylethanolamine (PE)과 공유결합한다. E3 ligase로 기능하는 Atg12-Atg5 복합체는 이 최종단계를 촉진한다. Atg8-PE는 막에 결합되어 있지만 second Atg4-mediated cleavage를 통해 방출 될 수 있다. 포유류는 ATG4의 4 isoform과 Atg8 유사 protein인 LC3 subfamilies를 가진다. 또한 포유류에서 ATG4 처리된 LC3은 LC3-I, PE-conjugation 된 형태는 LC3-II라고 불린다.[205]
효모나 식물 세포에서는 형성된 오토파고솜은 액포와 막 융합하여,[137] 그 내부에 흡수된 이물질 등은 액포 내부의 분해 효소에 의해 분해된다. 동물 세포에서는 오토파고솜이 형성된 후 오토파고솜과 세포 내의 리소좀이 막 융합을 일으킨다.[137] 이렇게 리소좀과 융합한 것을 '''오토리소좀'''(Autolysosome)이라고 부르며, 오토파지 소포에 포함된다. 오토리소좀 내부에서 오토파고솜에서 유래하는 분해해야 할 단백질과 리소좀에서 유래하는 다양한 단백질 분해 효소가 반응하여 오토파고솜에 흡수되었던 단백질은 아미노산이나 펩타이드로 분해된다. 이때 오토파고솜의 이중막 중 안쪽 지질막도 동시에 분해된다.
리소좀 막의 일부가 안쪽으로 함몰되어 리소좀 내의 작은 주머니가 되거나 세포가 돌출함으로써, 세포질 성분을 직접 흡수하여 분해한다.[138] 마크로오토파지와는 달리, 오토파고솜을 거치지 않는다.
분해 표적이 되는 단백질이 Hsc70샤페론 단백질에 의해 식별되어 리소좀으로 인도된다. 단백질은 리소좀 표면에서 고차 구조를 풀고, 그 상태로 수송체를 통과한다. 이렇게 리소좀 내부에 들어간 단백질을 분해하는 오토파지이다. Hsc70 샤페론이 인식하는 아미노산 서열로서, 리신-페닐알라닌-글루탐산-아르기닌-글루타민 서열(KFERQ 유사 서열)이 알려져 있다.
세포질에 있는 샤프론, heat shock 70kDa protein 8(HSPA8)에 의해 단백질의 KFERQ 모티프를 인식한 후 리소좀에 있는 막단백질 lysosomal-associated membrane protein 2A(LAMP2A)를 수용체로 하여 리소좀 내부로 들어간다. 리소좀 안으로 단백질이 들어가면서 LAMP2A는 단량체(monomer)에서 중합체(polymer)가 되지만 단백질이 다 들어간 후 HSPA8에 의해 다시 monomer로 돌아간다. 이 반응의 rate-limiting step은 기질이 LAMP2A에 binding하는 단계이다. 따라서 LAMP2A의 분해와 합성을 조절하면서 CMA activity가 조절될 수 있다.[208]
분해하는 대상에 따라 다른 명칭으로 불리는 경우도 있다.3. 2. 거대자가포식의 단계
거대자가포식은 영양소 또는 에너지 결핍 등의 스트레스 조건에서 유도될 수 있으며, 세포 내 환경을 유지하기 위해 손상되거나 불필요한 세포소기관을 분해한다. 과도한 자가 분해는 해로울 수 있지만, 기본적으로 세포를 보호한다. 이 과정은 단백질 복합체나 소기관들이 들어있는 이중막의 세포질 소낭이 리소좀과 융합하면서 진행된다. 거대자가포식은 Induction(유도), Nucleation(핵형성), Elongation(연쇄), Closure(폐쇄), Maturation(성숙), Fusion(융합), Degradation(분해) 순서로 진행된다.[205]
1. 인덕션(Induction, 유도)효모에서 자가포식소체(autophagosome) 유도 형성은 Atg1-Atg13-Atg17-Atg31-Atg29 복합체에 의해 이루어진다. 포유류 세포에서는 Atg1 homolog, Atg13 homolog, RB1-inducible coiled-coil 1로 구성되며, 이는 거대자가포식(macroautophagy) 유도에 필요한 효모 Atg17의 ortholog일 수 있다. ATG13에 직접 결합하는 C12orf44 / ATG101은 거대자가포식에 필수적이며, 알려진 homolog는 없다. 포유류 ULK1 / 2-ATG13-RB1CC1 복합체는 안정적이며 영양 상태와 상관없이 형성되는 반면, MTORC1은 영양 상태에 영향을 받는다. 영양이 풍부한 조건에서 MTORC1은 복합체와 결합하지만, 영양 부족 상태에서는 결합하지 못한다. MTORC1이 결합되면 ULK1 / 2 및 ATG13을 인산화시켜 비활성화한다. 그러나 세포에 라파마이신이 처리되거나 영양소가 부족하면 MTORC1이 induction complex에서 해리되어 탈인산화가 일어난다.[205]
2. 핵형성(Nucleation, 핵 생성)PtdIns3K complex는 phagophore 핵 형성에 관여하며, 거대자가포식 경로에 필수적인 BECN1과 상호 작용함으로써 조절된다. 항세포사멸(antiapoptotic) 단백질 BCL2는 BECN1에 결합하고 PIK3C3와의 상호 작용을 방지하여 거대자가포식을 억제한다. 또 다른 BECN1-결합 단백질 KIAA0226 / Rubicon은 UVRAG-associated PtdIns3K complexes에서 PIK3C3 활성을 억제한다. AMBRA1과 SH3GLB1 / Bif-1은 PtdIns3K 복합체의 두 가지 양성 조절 인자이다.[205]
3. 연쇄(Elongation, 신장)효모와 포유류에는 phagophore expansion에 기여하는 두 가지 시스템이 있다.
효모에서 ubiquitin-like protein ATG12는 Atg7과 Atg10에 의해 Atg5에 공유 결합한다. ATG7, ATG10은 각각 E1 활성화 및 E2 접합 효소이다. 이 과정은 비가역적이며 E3 ligase를 필요로 하지 않는다. 이후 ATG16L1은 ATG5에 비공유 결합하고 이합체화(dimerize)하여 막의 확장을 촉진시킨다. 포유 동물에서의 ATG12-ATG5-ATG16L1 복합체는 phagophore membrane과 결합하나 autophagosome completion 후 해리한다. Golgi protein RAB33A은 ATG16L1에 붙어 이를 억제할 수 있으며 ATG5, ATG7, ATG12는 KAT2B / p300에 의한 acetylation으로 억제된다.[205]
효모에서 이 경로는 cysteine protease Atg4에 의해 Atg8의 C 말단 글리신 잔기가 노출되며 시작된다. E1-like enzyme Atg7은 Atg8을 활성화하고 이를 E2-like enzyme Atg3로 전달한다. Atg8의 C- 말단 글리신은 lipid phosphatidylethanolamine (PE)과 공유결합한다. E3 ligase로 기능하는 Atg12-Atg5 복합체는 이 최종단계를 촉진한다. Atg8-PE는 막에 결합되어 있지만 second Atg4-mediated cleavage를 통해 방출 될 수 있다. 포유류는 ATG4의 4 isoform과 Atg8 유사 protein인 LC3 subfamilies를 가진다. 또한 포유류에서 ATG4 처리된 LC3은 LC3-I, PE-conjugation 된 형태는 LC3-II라고 불린다.[205]
4. 추가 단계다양한 타입과 사이즈의 cargo를 수용해야하므로 높은 수준의 유연성이 필요하다. 따라서 소낭을 사용하지 않는다. 대부분의 경우와 달리 기존 기관에서 bud off되지 않고 소낭이 점점 확장되어 팽창하는 과정에서 cargo를 삼킨다.
아래 4가지 단계로 일어난다.
1. 막 함입과 오토파지 튜브 형성
세포가 굶주렸을 때 막 함입의 빈도가 증가하며 오토파지 튜브가 형성된다. 오토파지 튜브의 형성은 Atg7-dependent ubiquitin-like conjugation(Ublc)나 vacuolar transporter chaperone(VTC) molecular complex에 의해 calmodulin-dependent manner로 일어난다.[206]
2. 소낭 형성
막관통단백질을 제거하여 지질의 비율이 높아지면서 막 구성이 바뀐다.[207]
3. 소낭 팽창과 분리
아직 닫히지 않은 소낭에 효소와 결합하며 확장된다.
4. 소낭 분해와 재활용
가수분해효소에 의해 리소좀 안에서 분해된다.
3. 3. 선택적 오토파지
세포소기관이 세포질에서 리소좀으로 직접 함입되어 분해되는 과정은 대부분 비선택적이지만, 다음 세 가지는 선택적 오토파지에 해당한다.
4. 오토파지의 생리적 기능
오토파지는 세포가 영양 결핍에 적응하고, 세포 항상성을 유지하며, 감염을 막고, 발생과 분화에 관여하며, 노화를 억제하는 등 다양한 생리적 기능을 한다.
- 영양 결핍 적응: 세포는 영양소가 부족하면 오토파지를 활성화해 불필요한 단백질을 분해하고, 여기서 얻은 아미노산을 생존에 필수적인 단백질 합성에 쓴다.[79][80][81] 이는 효모뿐 아니라 포유류의 신생아나 영양 결핍 상태인 세포, 조직에서도 나타난다.[82][83] 1992년 오스미 요시노리는 출아 효모(''Saccharomyces cerevisiae'')에서 오토파지를 처음 발견했다.[122] 기아 상태에서는 영양 센서인 TORC1 활성이 낮아지고, Atg13이 탈인산화되어 Atg1 복합체를 만들어 오토파지를 시작한다.[132]
- 세포 내 항상성 유지: 오토파지는 손상된 세포 소기관, 세포막, 단백질을 분해해 세포를 깨끗하게 유지한다.[87] 오토파지에 문제 생기면 손상된 세포와 노화가 쌓인다. 손상된 DNA 복구 후 불필요한 효소도 오토파지로 제거된다.[88][89] 오토파지는 근육 항상성 유지에도 중요하다.[95][96]
- 감염 방어: 오토파지는 세포에 침입한 병원체를 제거해 감염을 막는다. 수포성 구내염 바이러스, 결핵균 등 다양한 병원체가 오토파지로 제거된다.[85][185][186] 갈렉틴-8은 손상된 액포에 결합해 자가포식 어댑터 NDP52를 모아 자가포식소체를 만들고 세균을 분해하는 "위험 수용체"다.[86]
- 발생 및 분화: 오토파지는 프로그램 세포 사멸에 관여하며, 난자 형성 과정에서 난모세포 생존에 중요하다.[94][1]
- 노화 억제: 오토파지는 손상된 세포 구성 요소를 제거해 노화를 억제한다.[87]
4. 1. 영양 결핍 적응
자가포식은 세포가 영양 결핍 상황에 적응하는 중요한 기전이다. 특히 효모에서 이 현상이 두드러지게 나타나는데, 영양소가 부족하면 자가포식이 활발해져 불필요한 단백질을 분해하고, 여기서 얻은 아미노산을 생존에 필수적인 단백질 합성에 재활용한다.[79][80][81] 고등 진핵생물에서도 자가포식은 제대 후 신생아의 일시적인 영양 고갈이나, 영양 결핍 상태의 세포 및 조직에서 유도된다.[82][83] 자가포식 능력이 떨어진 돌연변이 효모 세포는 영양 결핍 환경에서 생존율이 급격히 감소한다.[84]1992년 오스미 요시노리는 출아 효모(''Saccharomyces cerevisiae'')에서 오토파지 현상을 처음으로 관찰했다.[122] 그는 단백질 분해 효소가 결핍된 효모를 기아 상태에서 배양하여 액포 내에 작은 과립들이 축적되는 것을 확인했다.[122][124][127] 추가적인 전자 현미경 관찰을 통해 이 과립들이 단일막 구조체이며, '오토파지성 바디'라고 명명되었다.[122][128]
기아 상태에서 격리막이 나타나 세포질의 일부를 둘러싸 오토파고솜을 형성하고, 이는 액포와 융합하여 오토파고솜 내부 물질을 분해한다.[122] 이러한 일련의 과정은 드 듀브가 제안했던 오토파지 현상과 일치한다.[122]
세포는 생명 유지에 필요한 단백질을 합성하기 위해 필수 아미노산을 외부에서 섭취해야 한다. 하지만 기아 상태에서는 아미노산 공급이 중단되어 세포 생존에 위협이 된다. 이때 오토파지가 작동하여 세포 내 단백질을 분해하고, 생성된 아미노산을 이용하여 생존에 필요한 단백질을 합성한다. 이는 생쥐의 간세포에서도 관찰되는 현상이다.
포유류의 경우, 출생 직후 태반을 통한 영양 공급이 중단되고 모유 수유가 시작되기 전까지 일시적인 영양 기아 상태를 겪는다.[183] 이때 오토파지가 아미노산을 생성하여 영양 기아를 극복하도록 돕는다.[183]
하지만 오토파지에 의한 영양 기아 회피는 일시적인 해결책이며, 기아 상태가 장기화되면 오토파지가 과도하게 진행되어 세포가 프로그램 세포사에 이를 수 있다.
기아 상태에서는 영양 센서인 TORC1의 활성이 저하되고, Atg13이 탈인산화되어 Atg1 복합체를 형성하여 오토파지를 개시한다.[132]
4. 2. 세포 내 항상성 유지
오토파지는 손상된 세포 소기관, 세포막 및 단백질을 분해하며, 오토파지 부전은 손상된 세포와 노화 축적의 주요 원인 중 하나로 여겨진다.[87] 오토파지 및 오토파지 조절자는 갈렉틴-3, 갈렉틴-8과 같은 갈렉틴에 의해 종종 지시되는 리소좀 손상에 대한 반응에 관여한다.손상된 DNA 복구에는 손상 부위에 효소를 모집하는 과정이 포함되지만, 이 효소는 복구 과정이 완료되면 제거되어야 한다. 토포아이소머라제 I 절단 복합체는 척추동물에서 DNA 손상(예: DNA-단백질 가교)을 처리하는 데 사용되며, 이 복합체는 더 이상 필요하지 않을 때 오토파지에 의해 선택적으로 분해된다고 추정된다.[88][89]
오토파지는 기본적인 항상성에 필수적이며, 신체 운동 중 근육 항상성을 유지하는 데에도 매우 중요하다.[95][96] 오토파지는 분자 수준에서 부분적으로만 이해되고 있다. 쥐를 대상으로 한 연구에 따르면 오토파지는 특히 단백질 이화 작용의 대사 경로를 통해 변화하는 영양 및 에너지 요구에 중요하다는 것을 보여준다. 댈러스에 위치한 텍사스 대학교 사우스웨스턴 의학 센터에서 수행된 2012년 연구에서는 돌연변이 생쥐(기저 오토파지 수준은 정상적이지만 스트레스 유도 오토파지가 결핍된 자손을 생산하도록 BCL2 인산화 부위의 녹인 돌연변이를 가진 생쥐)를 대상으로 이 이론에 도전했다. 연구 결과, 대조군과 비교했을 때 이 생쥐들이 급성 운동 중 지구력 감소와 포도당 대사의 변화를 보였다.[97]
또 다른 연구에서는 결손 생쥐의 콜라겐 VI 골격근 섬유에서 오토파지 부족으로 인해 손상된 미토콘드리아 축적 및 과도한 세포 사멸이 발생하여 변성의 징후가 나타났다.[98] 운동 유도 오토파지는 성공하지 못했지만, 운동 후 인위적으로 오토파지를 유도했을 때 콜라겐 VI 결핍 근육 섬유에서 손상된 세포 소기관의 축적을 막고 세포 항상성을 유지할 수 있었다. 두 연구 모두 오토파지 유도가 운동의 유익한 대사 효과에 기여할 수 있으며, 특히 콜라겐 VI 섬유에서 운동 중 근육 항상성을 유지하는 데 필수적임을 보여준다.[97][96][98]
본 대학교 세포 생물학 연구소의 연구에 따르면, 특정 유형의 오토파지, 즉 샤페론 보조 선택적 오토파지(CASA)가 수축하는 근육에서 유도되며, 기계적 긴장 하에서 근육 근절을 유지하는 데 필요하다.[99] CASA 샤페론 복합체는 기계적으로 손상된 세포 골격 구성 요소를 인식하고, 이러한 구성 요소를 유비퀴틴 의존적 오토파지 분류 경로를 통해 제거를 위해 리소좀으로 보낸다. 이것은 근육 활동을 유지하는 데 필요하다.[99][100]
자가포식은 나이가 들면서 감소하고, 나이는 골관절염의 주요 위험 요소이므로, 이 질환의 발병에 자가포식이 하는 역할이 시사된다. 자가포식에 관련된 단백질은 인간과 쥐의 관절 연골 모두에서 나이가 들면서 감소한다.[101] 배양된 연골 절편에 대한 기계적 손상 또한 자가포식 단백질을 감소시켰다.[102] 자가포식은 정상 연골에서 지속적으로 활성화되지만, 나이가 들면서 손상되고 연골 세포 사멸과 구조적 손상을 앞선다.[103] 따라서 자가포식은 관절 내 정상적인 보호 과정(연골 보호)에 관여한다.
4. 3. 감염 방어
오토파지는 속(genus) 특이적인 단백질을 표적으로 삼아 서열 상동성을 공유하는 상동 단백질을 인식한다. 오토파지 표적 단백질 간의 상호 보완성은 돌연변이 발생 시 감염 위험을 증가시킬 수 있다. 오토파지는 다양한 세균 단백질을 표적으로 할 수 있으며, 동일 속(genus)을 표적으로 하는 중복성은 병원체 인식을 강화한다. 그러나 특정 세균 단백질의 상호 보완성은 오토파지 표적 단백질 유전자의 돌연변이나 오토파지 시스템 과부하 시 숙주를 만성 질환 및 감염에 취약하게 만들 수 있다.[51] 또한, 오토파지는 독성 인자를 표적으로 하며, CALCOCO2/NDP52 및 MAP1LC3/LC3와 같은 오토파지 단백질은 병원체 분해를 위해 특별히 진화했을 수 있다. SQSTM1/p62는 독성과 관련 없는 세균 단백질을 표적으로 한다.[51]병원성 세균 단백질은 오토파지를 조절할 수 있으며, 특정 병원체 그룹은 속(genus) 특이적인 패턴으로 오토파지 단계를 조절한다. 일부 세균 단백질은 인산화 및 유비퀴틴화를 통해 오토파지 단백질 활성을 방해한다.[51] 수포성 구내염 바이러스는 오토파고솜에 의해 섭취되어 내소체로 이동, 톨 유사 수용체 7에 의해 감지된다. 톨 유사 수용체 활성화는 인터페론 등 항바이러스 사이토카인 유도를 유발한다. 일부 바이러스 및 세균은 자가포식 경로를 회피하여 자체 복제를 촉진한다.[85] 갈렉틴-8은 세포 내 병원체에 대항하는 자가포식을 시작하는 "위험 수용체"로, 손상된 액포에 결합하여 자가포식 어댑터 NDP52를 모집, 자가포식소체 형성과 세균 분해를 유도한다.[86]
자가포식 조절 인자는 염증 조절 인자를 제어하며, 척추동물 세포는 감염 제거 및 조직 회복을 위해 염증을 활성화한다.[116][117] 자가포식은 리소좀을 통해 세포 구성 요소를 분해하여 필수 분자를 재활용하고 세포 반응을 돕는다.[118] 염증과 자가포식을 제어하는 단백질은 조직 기능에 중요한 네트워크를 형성하며, 암에서 조절 장애를 겪는다. 암세포는 단백질 분해 시스템에 대한 의존성을 증가시켜 자가포식 조절 인자에 대한 개입에 취약해진다.
세균이 숙주 세포에 침입하여 엔도솜에 손상을 주면, 숙주는 선택적 오토파지를 수행한다.[185] 결핵균은 유비퀴틴화되어 오토파지에 의해 살균된다.[185][186] 이질균은 오토파지를 회피하여 세포질로 탈출한다.[186] 레지오넬라는 오토파고솜과 리소좀의 막 융합을 늦추고 증식한다.[186]
대식세포나 호중구 등의 식세포는 식세포 작용(파고사이토시스)을 통해 이물질이나 병원체를 파고솜에 감싸 섭취한다. 파고솜은 리소좀과 융합하여 파고리소솜이 되어 이물질을 분해한다. 리스테리아는 파고솜을 파괴하여 세포질 내로 감염을 시도하지만, 오토파지는 세포질 내로 도망친 세균을 다시 포획하여 분해함으로써 생체를 보호한다.
4. 4. 발생 및 분화
프로그램 세포 사멸(PCD)의 한 가지 기전은 자가소포의 출현과 관련이 있으며 자가포식 단백질에 의존한다. 이러한 형태의 세포 사멸은 형태학적으로 자가포식 PCD로 정의된 과정에 해당될 가능성이 높다. 그러나 끊임없이 제기되는 질문은 죽어가는 세포에서 자가포식 활성이 죽음의 원인인지, 아니면 실제로 그것을 막으려는 시도인지 여부이다. 형태학적 및 조직화학적 연구는 지금까지 자가포식 과정과 세포 사멸 사이의 인과 관계를 입증하지 못했다. 실제로 최근에는 죽어가는 세포의 자가포식 활성이 실제로 생존 기전일 수 있다는 강력한 주장이 제기되었다.[90][91] 곤충의 변태에 대한 연구는 다른 형태와 구별되는 형태의 PCD를 겪는 세포를 보여주었다. 이것들은 자가포식 세포 사멸의 예로 제안되었다.[92] 최근 약리학적 및 생화학적 연구는 생존 자가포식과 치명적 자가포식이 스트레스, 특히 바이러스 감염 후 조절 신호의 유형과 정도에 따라 구별될 수 있다고 제안했다.[93]포유류 태아 난모세포는 감수 분열 제1 전기의 여러 단계를 거치는 동안 원시 난포 형성 전에 생존에 대한 여러 가지 도전에 직면한다.[94] 각 원시 난포는 미성숙한 1차 난모세포를 포함한다. 난모세포가 원시 난포에 갇히기 전에 영양소 또는 성장 인자의 결핍은 보호적 자가 소화 작용을 활성화할 수 있지만, 기아 상태가 오래 지속되면 난모세포의 죽음으로 이어질 수 있다.[1]
4. 5. 노화 억제
오토파지는 손상된 세포 소기관, 세포막, 단백질을 분해하는 역할을 한다. 오토파지 기능에 문제가 생기면 손상된 세포와 노화가 축적되는 주요 원인 중 하나로 여겨진다.[87] 오토파지 및 오토파지 조절자는 갈렉틴 중 갈렉틴-3 및 갈렉틴-8에 의해 종종 지시되는 리소좀 손상에 대한 반응에 관여한다.손상된 DNA 복구에는 손상 부위에 효소를 모으는 과정이 포함되지만, 복구 완료 후에는 이 효소들이 제거되어야 한다. 토포아이소머라제 I 절단 복합체는 척추동물에서 DNA 손상(예: DNA-단백질 가교)을 처리하는 데 사용되며, 이 복합체는 더 이상 필요하지 않을 때 오토파지에 의해 선택적으로 분해되는 것으로 추정된다.[88][89]
심한 스트레스를 받는 세포는 세포 자멸사나 괴사를 통해 세포가 죽게 된다. 오토파지가 장기간 활성화되면 단백질과 소기관의 회전율이 높아진다. 생존 임계값 이상으로 높은 비율은 높은 세포 자멸사 임계값을 가진 암세포를 죽일 수 있다.[114][110] 이 기술은 암 치료법으로 활용될 수 있다.[90]
5. 오토파지 관련 질병
오토파지는 다양한 질병과 관련되어 있다.
- 골관절염: 나이가 들면서 오토파지 기능이 감소하는데, 이는 골관절염의 주요 위험 요소 중 하나이다. 사람과 쥐의 관절 연골에서 오토파지 관련 단백질은 나이가 들면서 감소하며, 기계적 손상 또한 오토파지 단백질을 감소시킨다.[101][102] 오토파지는 정상 연골에서 지속적으로 활성화되지만, 나이가 들면서 손상되어 연골 세포 사멸과 구조적 손상을 일으킨다.[103] 따라서 오토파지는 관절 내 정상적인 보호 과정인 연골 보호에 관여한다.
- 2형 당뇨병: 췌장의 베타 세포에서 자가소화의 일종인 크리노파지가 과도하게 활성화되면 인슐린 분비량이 감소하여 2형 당뇨병을 유발할 수 있다.[8]
- 염증: 자가포식 조절 인자는 염증 조절 인자를 제어하며, 그 반대의 경우도 마찬가지이다.[116] 척추동물 세포는 감염을 제거하고 조직 구조와 기능을 회복하기 위해 염증을 활성화한다.[117] 리소좀에 의한 세포 구성 요소 분해는 필수 분자를 재활용하고 세포가 변화하는 환경에 반응하도록 돕는다.[118] 염증과 자가포식을 제어하는 단백질은 조직 기능에 중요한 네트워크를 형성하며, 이는 암에서 조절 장애를 겪는다.
5. 1. 암
오토파지는 손상된 세포를 분해하여 암세포 발생을 억제할 수 있지만, 암세포의 세포사멸 회피를 도와 성장 촉진에 기여할 수도 있다. 암의 종류와 세포사멸, 암 발달 관련 유전자에 따라 오토파지의 작용이 달라지기 때문에, 오토파지가 종양 촉진 인자인지 억제 인자인지 명확히 결론 내리기 어렵다.[209][210]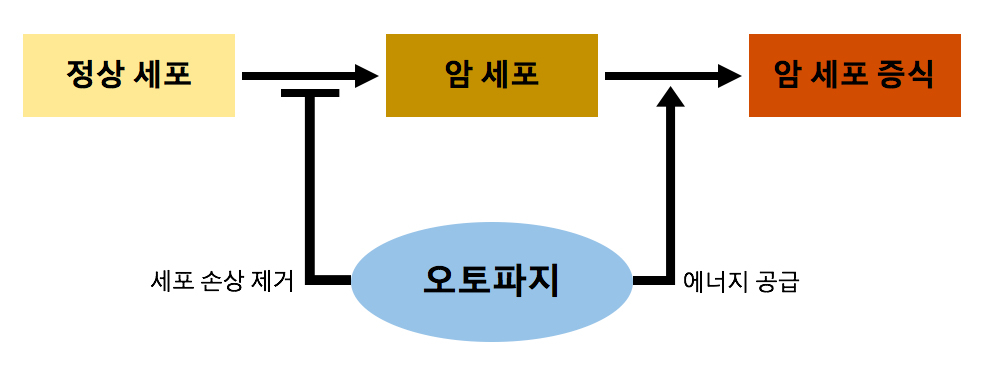
오토파지는 종양 형성 초기에 세포 생존에 기여하여 암 발달을 도울 수 있다. 정상 세포가 암세포로 분화되면서 겪는 저산소 및 영양분 부족 환경에서, 오토파지는 ATP 재생을 통해 에너지 공급을 유지하고 세포 생존 경로를 활성화하여 암 발달 안정성을 높인다. 이는 세포자살 억제를 통해 종양 생성을 촉진하는 결과를 낳는다.[210]
그러나 방광암종 등 일부 암에서는 자가소화포 형성에 필수적인 Atg5/7 유전자가 결여되면 암 성장이 감소한다.[209] 췌장암의 경우 오토파지 결함은 세포 스트레스와 손상을 증가시켜 P53 축적을 유도하고, 세포자살 경로를 촉진한다.[210]
세포 내 미토콘드리아 손상, 활성산소(ROS) 발생 등은 DNA 및 단백질 손상을 유발하여 종양 발생의 원인이 된다. 오토파지는 이러한 발암 물질을 제거하여 종양 생성을 억제할 수 있다. p53은 종양 억제에 중요한 유전자인데, p53 결함 시 오토파지가 세포 손상을 줄여 종양 억제 인자로 작용할 수 있다는 연구 결과가 있다.[210]
p53이 손상된 췌장 관세포암 세포에서 오토파지가 정상 작동할 때보다 망가졌을 때 암 발달 속도가 빨라진다는 연구 결과가 있다.[210] 2009년 Cell에 발표된 논문에 따르면, 물질대사 스트레스로 인해 축적되는 p62 단백질은 활성산소를 증가시켜 암세포를 생성하는데, 오토파지가 p62를 제거하여 종양 억제 역할을 할 수 있다.[211][212]
최근 연구들은 오토파지가 암 발달 시기에 따라 다른 작용을 한다는 것을 시사한다. 종양 형성 초기에는 종양 억제 인자로, 종양이 진행된 후에는 종양 촉진 인자로 작용하는 것으로 보인다.[210]
암 발달 초기에는 돌연변이, 세포 손상, 스트레스가 비교적 낮아 오토파지가 활성산소 등 단시간에 강력한 영향을 미치는 발암 요인을 제거하여 종양 억제에 기여한다. 또한, 오토파지는 p53과 caspase-3에 의한 세포자살 활성을 증진시킨다.[210]
종양이 악성화되고 전이 능력을 갖추는 단계에서는 세포 손상 제어 기능과 세포자살 경로가 차단되고, 세포 분열, 성장, 혈관 신생 반응이 극대화되어 많은 에너지 공급이 필요하다. 이때 오토파지는 암세포의 ATP와 생체 분자 합성을 위한 구성 요소 획득을 도와 종양 촉진 인자로 작용한다. 그러나 이는 p53 등 다른 암 조절 유전자에 따라 달라질 수 있으므로 다각적인 분석이 필요하다.[210]
최근 연구에 따르면, 적절히 유도된 오토파지는 암 치료에 사용될 수 있다. 오토파지의 종양 억제 및 촉진 특성을 활용하여, 오토파지 유도를 통한 종양 억제 강화 또는 오토파지 억제를 통한 세포사멸 유도 전략이 가능하다.[213] 오토파지 유도제 투여량에 따른 항암 효과 연구 결과, 오토파지 증가는 종양 세포 성장과 관련이 있어 오토파지 촉진 치료법 개발을 지지한다.[214][215] 오토파지 유도 관련 단백질 억제 또한 항암 치료 가능성이 있다.[213][215]
종양 억제 유전자 p53은 세포 내 위치와 활성 수준에 따라 오토파지를 촉진 또는 억제한다. 세포질에서는 오토파지를 억제하고, DNA 손상 등 스트레스 상황에서는 미토콘드리아로 이동하여 오토파지를 촉진하며, 스트레스 극대화 시 핵으로 이동하여 세포자살을 유발한다.
오토파지는 암세포의 생존을 촉진하여 암에 기여할 수 있다. 굶주린 종양 세포는 오토파지를 통해 세포 사멸 매개체를 분해하여 생존을 유지한다. 이러한 경우, 오토파지 후기 단계 억제제(예: 클로로퀸)를 사용하면 항종양 약물에 의한 암세포 사멸 효과를 높일 수 있다.[105]
자가포식을 조절하는 단백질 Beclin1을 대상으로 한 쥐 실험에서, Beclin1 유전자 이형 접합체(Beclin 1+/-) 변경 시 종양 발생이 쉬워졌고,[106] Beclin1 과발현 시 종양 발생이 억제되었다.[30]
자가포식은 괴사 및 만성 염증을 제한하여 종양 세포 형성을 막는 데 도움을 준다.[107]
대장암 발생은 고지방 식단과 관련 있으며, 이는 담즙산, 특히 데옥시콜산의 대장 내 수치 증가와 관련 있다.[108] 데옥시콜산은 비암성 대장 상피 세포에서 자가포식을 유도하며, 이는 세포 스트레스 시 세포 생존에 기여한다.[109] 자가포식은 세포 자멸사에 저항하는 대장암 세포에 지속적으로 존재하는 생존 경로이므로,[1] 대장암 세포에서 자가포식의 지속적인 활성화는 대장암 치료에서 극복해야 할 과제이다.[1]
극심한 스트레스를 받는 세포는 세포 자멸사 또는 괴사를 통해 세포 사멸을 겪는다. 장기간 활성화된 자가포식은 단백질과 소기관의 높은 회전율을 초래하며, 이는 높은 세포 자멸사 임계값을 가진 암세포를 죽일 수 있어 치료적 암 치료법으로 활용될 수 있다.[114][110][90]
암세포에서 오토파지는 세포 스트레스에 대처하는 방법으로 사용된다.[111] miRNA-4673에 의한 오토파지 유도는 암세포의 방사선 저항성을 향상시키는 생존 촉진 기전이다.[112] 오토파지 관련 유전자 억제는 세포 사멸을 촉진한다.[113] 오토파지는 대사 에너지 증가를 상쇄하며, 저산소증, 영양 결핍 등 대사 스트레스는 ATP 재활용 및 암세포 생존 유지를 위해 오토파지를 활성화시킨다.[114] 오토파지 유전자 억제는 종양 퇴행 및 생존 연장을 유도하고, 항암 치료 효과를 향상시킨다.[114]
5. 2. 감염병
오토파지는 속(genus) 특이적인 단백질을 표적으로 삼아, 서열 상 동성을 공유하는 상동 단백질이 특정 오토파지 표적 단백질에 의해 기질로 인식되도록 한다. 돌연변이가 발생하면 감염 위험을 높일 수 있는 오토파지 표적 단백질 간의 상호 보완성이 존재한다.[51] 오토파지는 독성 인자를 표적으로 하며, 영양 획득 및 운동성과 같은 일반적인 기능을 담당하는 독성 인자는 여러 오토파지 표적 단백질에 의해 인식된다. 자가용해소(autolysins) 및 철 격리 단백질과 같은 특수 독성 인자는 단일 오토파지 표적 단백질에 의해 고유하게 인식될 수 있다. CALCOCO2/NDP52 및 MAP1LC3/LC3와 같은 오토파지 단백질은 병원체나 병원성 단백질을 자가포식성 분해를 위해 표적으로 하도록 진화했을 수 있다. SQSTM1/p62는 독성과 관련이 없지만 표적 모티프를 포함하는 일반적인 세균 단백질을 표적으로 한다.[51]다양한 병원성 속(genera)의 세균 단백질 또한 오토파지를 조절할 수 있다. 특정 병원체 그룹에 의해 조절되는 오토파지 단계에는 속(genus) 특이적인 패턴이 존재한다. 일부 오토파지 단계는 특정 병원체에 의해서만, 혹은 여러 병원체 속(genera)에 의해 조절된다. 일부 세균 단백질은 인산화 및 유비퀴틴화와 같은 단백질 분해 및 번역 후 활성을 가지며 오토파지 단백질의 활성을 방해할 수 있다.[51]
수포성 구내염 바이러스는 오토파고솜에 의해 섭취되어 내소체로 이동하며, 톨 유사 수용체 7이라는 패턴 인식 수용체에 의해 감지되는 것으로 여겨진다. 톨 유사 수용체가 활성화되면 세포 내 신호 전달 연쇄 반응이 시작되어 인터페론 및 기타 항바이러스 사이토카인의 유도를 유발한다. 바이러스 및 세균의 일부는 자체 복제를 촉진하기 위해 자가포식 경로를 회피한다.[85] 갈렉틴-8은 세포 내 병원체에 대항하는 자가포식을 시작할 수 있는 세포 내 "위험 수용체"로 확인되었다. 갈렉틴-8이 손상된 액포에 결합하면 NDP52와 같은 자가포식 어댑터를 모집하여 자가포식소체 형성 및 세균 분해를 유도한다.[86]
자가포식 조절 인자는 염증 조절 인자를 제어하며, 그 반대의 경우도 마찬가지이다.[116] 척추동물 세포는 일반적으로 감염을 제거하고 조직 구조와 기능을 회복하기 위해 염증을 활성화한다.[117]
5. 3. 대사 질환
자가포식은 나이가 들면서 감소하고, 나이는 골관절염의 주요 위험 요소이므로, 이 질환의 발병에 자가포식이 하는 역할이 시사된다. 자가포식에 관련된 단백질은 인간과 쥐의 관절 연골 모두에서 나이가 들면서 감소한다.[101] 배양된 연골 절편에 대한 기계적 손상 또한 자가포식 단백질을 감소시켰다.[102] 자가포식은 정상 연골에서 지속적으로 활성화되지만, 나이가 들면서 손상되고 연골 세포 사멸과 구조적 손상을 앞선다.[103] 따라서 자가포식은 관절 내 정상적인 보호 과정(연골 보호)에 관여한다.췌장의 베타 세포에서 자가소화의 일종인 크리노파지 형태가 과도하게 활성화되면 분비될 수 있는 인슐린의 양이 감소하여 2형 당뇨병을 유발할 수 있다.[8]
5. 4. 심혈관 질환
자가포식은 나이가 들면서 감소하고, 나이는 골관절염의 주요 위험 요소이므로, 이 질환의 발병에 자가포식이 하는 역할이 시사된다. 자가포식에 관련된 단백질은 인간과 쥐의 관절 연골 모두에서 나이가 들면서 감소한다.[101] 배양된 연골 절편에 대한 기계적 손상 또한 자가포식 단백질을 감소시켰다.[102] 자가포식은 정상 연골에서 지속적으로 활성화되지만, 나이가 들면서 손상되고 연골 세포 사멸과 구조적 손상을 앞선다.[103] 따라서 자가포식은 관절 내 정상적인 보호 과정(연골 보호)에 관여한다.6. 오토파지 연구의 활용
노화에 따른 오토파지 감소를 억제하면 동물 실험에서 수명 연장이나 신장병, 파킨슨병 개선으로 이어질 가능성이 시사되고 있다. 반대로 오토파지가 지방 세포에서 과도하게 활성화되면 당뇨병, 지방간 등 생활 습관병의 위험이 높아진다.
이러한 오토파지의 양면성 때문에, 오토파지를 활용한 의약품, 건강 보조 식품, 화장품 개발이 활발히 연구되고 있다. 2019년 6월에는 오사카 대학 명예 교수 요시모리 야스시 등이 참여한 벤처 기업 'AutoPhagyGO'가 설립되었다[187].
도호쿠 대학 대학원 생명 과학 연구과는 질병의 원인이 되는 유해 단백질이나 기능 부전 미토콘드리아 등을 오토파지로 제거하는 작용을 이용하는 신약 개발 기법인 "AUTAC(오탁)"을 2019년에 발표했다[188].
6. 1. 암 치료제 개발
암은 세포 분화를 조절하는 여러 경로가 교란될 때 발생하는데, 오토파지는 암으로부터 보호하거나 암 성장에 기여하는 등 암에서 중요한 역할을 한다.[90][104] 오토파지는 굶주린 종양 세포의 생존을 돕거나, 오토파지를 통해 세포 사멸 매개체를 분해하여 암 성장에 기여하기도 한다. 따라서 클로로퀸과 같은 오토파지 후기 단계 억제제를 사용하면 항종양 약물에 의해 사멸되는 암세포 수를 늘릴 수 있다.[105]오토파지가 종양 억제와 종양 세포 생존에 모두 관여한다는 증거가 있지만, 최근 연구에서는 오토파지가 종양 억제제로 사용될 가능성이 더 높다는 것을 보여준다.[104] 예를 들어, 오토파지 조절 단백질인 Beclin1 유전자를 이형 접합체(Beclin 1+/-)로 변경한 생쥐는 종양 발생률이 높았지만,[106] Beclin1을 과발현시킨 경우에는 종양 발생이 억제되었다.[30] 그러나 Beclin1은 다른 세포 과정에도 영향을 미치기 때문에 주의해야 한다. Atg7 또는 Atg5와 같은 핵심 오토파지 인자는 유전자 제거 시 종양 형성과 관련 없는 다른 표현형을 보이며, Beclin1과 달리 완전 제거 시 배아 치사가 일어나지 않는다.
오토파지는 괴사 및 만성 염증을 제한하여 종양 세포 형성을 막는 데 도움을 준다.[107] 대장암 발생은 고지방 식단과 관련이 있으며, 이는 담즙산, 특히 데옥시콜산의 대장 내 수치 증가와 관련이 있다.[108] 데옥시콜산은 비암성 대장 상피 세포에서 오토파지를 유도하여 세포 생존에 기여한다.[109] 또한 오토파지는 세포 자멸사에 저항하는 대장암 세포에 존재하는 생존 경로이므로,[1] 대장암 세포에서 오토파지의 지속적인 활성화는 대장암 치료에서 극복해야 할 과제이다.[1]
극심한 스트레스를 받는 세포는 세포 자멸사 또는 괴사를 통해 세포 사멸을 경험하며, 장기간의 오토파지 활성화는 높은 세포 자멸사 임계값을 가진 암세포를 죽일 수 있어 치료적 암 치료법으로 활용될 수 있다.[114][110][90]
오토파지는 종양 세포 생존에도 중요한 역할을 한다. 암세포는 오토파지를 통해 저산소증, 영양 결핍 등 대사 스트레스에 대처하고, ATP를 재활용하여 생존을 유지한다.[114] 오토파지 유전자를 억제하면 종양 퇴행과 생존 연장이 나타났으며, 항암 치료 효과도 향상되었다.[114]
최근 연구에서는 표적 오토파지가 암 치료의 실행 가능한 해결책이 될 수 있음을 보여준다. 오토파지는 종양 억제와 종양 세포 생존 모두에 관여하므로, 오토파지 유도 및 종양 억제 속성 강화, 또는 오토파지 억제를 통한 세포 사멸 유도 등의 전략이 암 예방에 사용될 수 있다.[113] 오토파지 유도 치료는 용량 의존적으로 암세포 성장을 억제하며,[111][110] 오토파지를 유도하는 단백질 경로 억제 또한 항암 치료법으로 작용할 수 있다.[113][110] 그러나 오토파지 억제는 세포 생존으로 이어질 수 있어 주의가 필요하다.[111]
6. 2. 수명 연장 및 노화 억제
노화에 따른 오토파지 감소를 억제하면 수명 연장이나 신장병, 파킨슨병 개선으로 이어질 가능성이 동물 실험에서 시사되고 있다. 반대로 오토파지가 지방 세포에서 과도하게 활성화되면 당뇨병, 지방간 등 생활 습관병의 위험이 높아진다. 이 때문에 의약품이나 건강 보조 식품, 화장품 개발에 활용하기 위해 오토파지를 연구하는 벤처 기업 'AutoPhagyGO'가 오사카 대학 명예 교수 요시모리 야스시 등에 의해 2019년 6월에 설립되었다[187].도호쿠 대학 대학원 생명 과학 연구과는 질병의 원인이 되는 유해 단백질이나 기능 부전 미토콘드리아 등을 오토파지로 제거하는 작용을 이용하는 신약 개발 기법 "AUTAC(오탁)"을 2019년에 발표했다[188].
7. 오토파지와 세포 자살의 관계
오토파지가 'self-eating' 과정이라면, 세포자살은 'self-killing' 과정을 뜻한다. 세포자살은 괴사와는 구별되는 세포 죽음 중 하나로서, 세포가 외부 혹은 내부로부터의 신호 자극에 반응하여 스스로를 파괴하는 메커니즘이다.[216] 오토파지와 세포자살은 세포의 항상성 유지 및 정상적인 작용에 매우 중요하며, 문제가 생길 경우 여러 질병으로 발전할 수 있다. 두 과정은 다른 경로를 거치지만, 둘의 관계는 매우 긴밀하게 연결되어 있다. 일반적으로 오토파지는 세포자살을 억제하고, 세포자살 또한 오토파지를 억제한다. 하지만 특수한 경우에는 오토파지가 세포자살을 촉진하는데, 이에 대해서는 명확하게 밝혀지지 않은 상태이다.[217]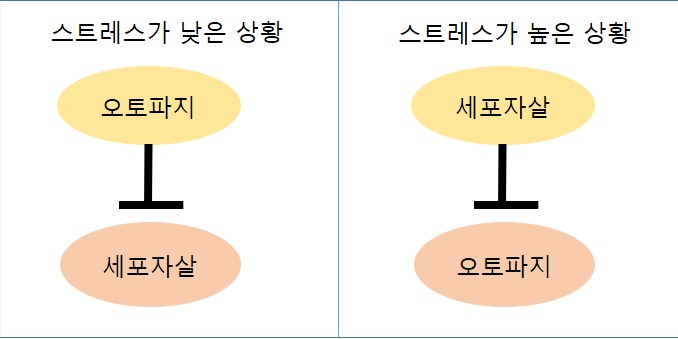
종양 억제 유전자로 알려진 P53은 상황에 따라 오토파지를 촉진 및 억제하는 기능을 가진다. p53이 오토파지에 미치는 영향은 p53의 세포 내 위치와 활성 수준에 따라 다르다. 보통 p53이 세포질에 있을 경우, 오토파지를 억제한다. 그러나 DNA 손상이나 영양분이 부족한 스트레스 상황에 처할 경우, p53은 미토콘드리아로 이동하여 미토콘드리아의 막 투과성을 증대시킨다. 이는 스트레스 초반에 작용함으로써 오토파지를 촉진시킨다. 하지만 스트레스 상황이 극대화될 경우 p53은 핵으로 이동하여 다양한 세포자살 관련 유전자들의 전사를 촉진하여 세포자살을 유발한다.
오토파지는 세포자살의 내인성 경로와 외인성 경로를 차단할 수 있다. 세포 내부에 스트레스가 가해질 경우 미토콘드리아의 투과성이 증대되어 시토크롬c 등의 여러 인자가 방출됨으로써 세포자살이 이루어진다. 이 때 오토파지는 손상된 미토콘드리아를 선택적으로 인식 및 제거함으로써 세포자살을 억제할 수 있으며, 이를 'mitophagy'라고 한다. 오토파지가 손상된 미토콘드리아를 선택적으로 분해하게 되면, 미토콘드리아에서 세포자살을 촉진하는 인자가 방출되지 않기 때문에 '내인성 세포자살'이 지연된다. 한편, 세포 외부에서 죽음 신호가 올 경우 외인성 세포 자살이 촉진된다. 이 때 가장 핵심적인 단계는 caspase-8의 활성화이다. 오토파지는 선택적으로 활성화된 caspase-8을 제거함으로써, 외인성 세포자살을 억제시킬 수 있다.
또한 오토파지는 세포사의 다른 형태인 아노이키스(anoikis)를 억제하기도 한다. 보통 세포는 세포외기질에 붙어서 살아가는데, 세포외기질로부터 떨어질 경우 세포자살이 유발된다. 이 때 암세포는 오토파지를 이용하여 아노이키스를 회피할 수 있다. 암세포는 세포외기질로부터 떨어지더라도 죽지 않고 생존하여 다른 기관에 침투할 수 있다. 오토파지는 아노이키스를 지연시키고, 세포가 다시 세포외기질에 붙을 수 있도록 기회를 제공한다.
세포 내에 스트레스가 극에 달할 경우, 세포자살이 일어난다. 세포자살은 주로 카스파아제(caspase)가 높은 수준으로 활성화됨으로써 일어난다. 카스파아제는 단백질분해효소로서, 이 때 오토파지에 중요한 역할을 하는 ATG3, Beclin1 등을 분해한다. 이 단백질들이 분해될 경우 오토파지 활성화가 더 이상 일어날 수 없고, 세포자살 쪽으로 반응이 진행하게 된다. 또한 카스파아제에 의해 오토파지 단백질들이 분해될 경우, 오토파지 단백질이 세포자살 촉진 기능을 획득하기도 한다. 예를 들어 Beclin1이 분해되면 미토콘드리아로 이동하여 미토콘드리아의 투과성을 증가시킴으로써, 내인성 세포자살을 촉진시킨다.
예외적인 경우로 오토파지가 세포자살을 촉진시킬 수도 있는데, 이를 autophagic cell death(ACD)라고 한다. 이 경우에는 자가소화포(autophagosome)는 caspase-8를 활성화시킴으로써 세포자살을 촉진시킨다. 하지만 오토파지가 어떤 상황에서 caspase-8의 활성화를 유발하는 지는 아직 밝혀지지 않았다. 또한 오토파지는 세포자살의 억제단백질(inhibitors of apoptosis proteins, IAPs)들을 고갈시킴으로써, 세포자살을 간접적으로 촉진시킬 수 있다.[218] 오토파지에 의해 세포자살 억제 단백질이 분해되면 세포자살이 촉진될 수 있다.
일반적으로 세포가 스트레스가 낮은 상황에서는 오토파지가 활성화되며, 스트레스가 매우 높은 상황에서는 세포자살이 활성화된다. 스트레스나 손상을 받았을 때, 오토파지는 동화 과정을 멈추어 세포가 회복할 수 있는 동력을 제공한다. 하지만 세포 손상이 너무 심해질 경우, 세포자살을 겪음으로써 조직의 항상성을 유지하도록 한다. 따라서 오토파지와 세포자살 모두 '세포가 죽느냐 혹은 사느냐'를 결정하는 중요한 요인이기 때문에, 서로 매우 정교하게 조절되는 것은 당연하다.[219]
프로그램 세포 사멸의 한 가지 기전은 자가소포의 출현과 관련이 있으며 자가포식 단백질에 의존한다. 이러한 형태의 세포 사멸은 형태학적으로 자가포식 PCD로 정의된 과정에 해당될 가능성이 높다. 그러나 끊임없이 제기되는 질문은 죽어가는 세포에서 자가포식 활성이 죽음의 원인인지, 아니면 실제로 그것을 막으려는 시도인지 여부이다. 형태학적 및 조직화학적 연구는 지금까지 자가포식 과정과 세포 사멸 사이의 인과 관계를 입증하지 못했다. 실제로 최근에는 죽어가는 세포의 자가포식 활성이 실제로 생존 기전일 수 있다는 강력한 주장이 제기되었다.[90][91] 곤충의 변태에 대한 연구는 다른 형태와 구별되는 형태의 PCD를 겪는 세포를 보여주었다. 이것들은 자가포식 세포 사멸의 예로 제안되었다.[92] 최근 약리학적 및 생화학적 연구는 생존 자가포식과 치명적 자가포식이 스트레스, 특히 바이러스 감염 후 조절 신호의 유형과 정도에 따라 구별될 수 있다고 제안했다.[93]
참조
[1]
웹사이트
αὐτό-φαγος
https://www.perseus.[...]
tufts.edu
2018-09-06
[2]
웹사이트
κύτος
https://www.perseus.[...]
tufts.edu
2018-09-06
[3]
논문
Autophagy revisited: a conversation with Christian de Duve
2008-08
[4]
논문
Autophagy: renovation of cells and tissues
2011-11
[5]
논문
Choose Delicately and Reuse Adequately: The Newly Revealed Process of Autophagy
2015
[6]
논문
Autophagy Induction as a Therapeutic Strategy for Neurodegenerative Diseases
https://www.reposito[...]
2020-04
[7]
논문
Targeting autophagy in cancer
2017-09
[8]
서적
Autophagy in health and disease
[9]
논문
An Overview of Autophagy: Morphology, Mechanism, and Regulation
2014-01-20
[10]
논문
The role of autophagy in hypoxia-induced radioresistance
2023-10-11
[11]
논문
The role of Atg proteins in autophagosome formation
2011-11-10
[12]
논문
Autophagosome formation: core machinery and adaptations
2007-10
[13]
논문
In praise of M. Anselmier who first used the term "autophagie" in 1859
[14]
논문
Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway
1992-10
[15]
논문
Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction
1992-10
[16]
논문
Isolation of autophagocytosis mutants of Saccharomyces cerevisiae
1994-08
[17]
논문
Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae
1993-10
[18]
논문
Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway
1995-11
[19]
웹사이트
The Nobel Prize in Physiology or Medicine 2016
https://www.nobelpri[...]
The Nobel Foundation
2016-10-03
[20]
논문
Cytoplasmic components in hepatic cell lysosomes
1962-01
[21]
논문
Focal cytoplasmic degradation
1963-06
[22]
논문
Participation of lysosomes in cellular autophagy induced in rat liver by glucagon
1967-11
[23]
논문
Influence of glucagon, an inducer of cellular autophagy, on some physical properties of rat liver lysosomes
1967-05
[24]
논문
Lysosomes revisited
1983-12
[25]
서적
Autophagy and Cancer
Springer
[26]
논문
Genetic and phenotypic overlap between autophagy and the cytoplasm to vacuole protein targeting pathway
1996-07
[27]
논문
Cytoplasm-to-vacuole targeting and autophagy employ the same machinery to deliver proteins to the yeast vacuole
1996-10
[28]
논문
A unified nomenclature for yeast autophagy-related genes
https://www.rug.nl/r[...]
2003-10
[29]
논문
Medicine Nobel for research on how cells 'eat themselves'
2016-10
[30]
논문
Induction of autophagy and inhibition of tumorigenesis by beclin 1
1999-12
[31]
웹사이트
Autophagy in Stress, Development & Disease
https://www.grc.org/[...]
2003
[32]
웹사이트
Autophagy in Health and Disease (Z3)
http://www.keystones[...]
2016-10-04
[33]
논문
Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling
2012-01
[34]
논문
Autophagosome formation in mammalian cells
2002-12
[35]
논문
Mechanisms of mitophagy
2011-01
[36]
논문
Mitophagy: mechanisms, pathophysiological roles, and analysis
2012-07
[37]
논문
Pexophagy: the selective degradation of peroxisomes
2012
[38]
논문
Chlorophagy: Preventing sunburn
2017-03
[39]
논문
Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy
2018-02
[40]
논문
Autophagy in immunity and inflammation
2011-01
[41]
논문
Lysosomal pathways to cell death and their therapeutic applications
2012-07
[42]
논문
Variations on a theme: plant autophagy in comparison to yeast and mammals
2012-04
[43]
논문
List of autophagy-related proteins and 3D structures
http://tp-apg.genes.[...]
2012-10-08
[44]
논문
The Discovery of Lysosomes and Autophagy
https://www.nature.c[...]
[45]
논문
The chaperone-mediated autophagy receptor organizes in dynamic protein complexes at the lysosomal membrane
2008-09
[46]
논문
Regulation of lipid stores and metabolism by lipophagy
2013-01
[47]
논문
Autophagy, lipophagy and lysosomal lipid storage disorders
2016-04
[48]
논문
Autophagy in turnover of lipid stores: trans-kingdom comparison
2018-03
[49]
논문
Lipid droplet autophagy in the yeast Saccharomyces cerevisiae
2014-01
[50]
논문
Autophagy regulates lipid metabolism
2009-04
[51]
논문
Targeted interplay between bacterial pathogens and host autophagy
2019-09
[52]
논문
Biological Functions of Autophagy Genes: A Disease Perspective
[53]
논문
Autophagy and innate immunity: Insights from invertebrate model organisms
[54]
논문
Regulation of autophagy gene expression and its implications in cancer
[55]
논문
Look people, "Atg" is an abbreviation for "autophagy-related." That's it
2012-09
[56]
논문
The autophagosome: origins unknown, biogenesis complex
2013-12
[57]
논문
Structural biology of the core autophagy machinery
2017-04
[58]
논문
Autophagy regulation by nutrient signaling
2014-01
[59]
논문
Regulation and function of uncoordinated-51 like kinase proteins
2012-09
[60]
논문
ULK1 induces autophagy by phosphorylating Beclin-1 and activating VPS34 lipid kinase
2013-07
[61]
논문
Beclin 1 forms two distinct phosphatidylinositol 3-kinase complexes with mammalian Atg14 and UVRAG
2008-12
[62]
논문
The Beclin 1 network regulates autophagy and apoptosis
2011-04
[63]
논문
The dynamic interaction of AMBRA1 with the dynein motor complex regulates mammalian autophagy
2010-10
[64]
논문
FIP200, a ULK-interacting protein, is required for autophagosome formation in mammalian cells
2008-05
[65]
논문
WIPI proteins: essential PtdIns3P effectors at the nascent autophagosome
2015-01
[66]
논문
Mammalian hybrid pre-autophagosomal structure HyPAS generates autophagosomes
2021-11
[67]
논문
WIPI2 links LC3 conjugation with PI3P, autophagosome formation, and pathogen clearance by recruiting Atg12-5-16L1
2014-07
[68]
논문
The Atg12-Atg5 conjugate has a novel E3-like activity for protein lipidation in autophagy
2007-12
[69]
논문
LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation
2004-06
[70]
논문
An Atg4B mutant hampers the lipidation of LC3 paralogues and causes defects in autophagosome closure
2008-11
[71]
논문
Choline dehydrogenase interacts with SQSTM1/p62 to recruit LC3 and stimulate mitophagy
2014
[72]
논문
TI-VAMP/VAMP7 and VAMP3/cellubrevin: two v-SNARE proteins involved in specific steps of the autophagy/multivesicular body pathways
2009-12
[73]
논문
Combinational soluble N-ethylmaleimide-sensitive factor attachment protein receptor proteins VAMP8 and Vti1b mediate fusion of antimicrobial and canonical autophagosomes with lysosomes
2010-03
[74]
논문
mTORC1 phosphorylates UVRAG to negatively regulate autophagosome and endosome maturation
2015-01
[75]
논문
The structure of Atg4B-LC3 complex reveals the mechanism of LC3 processing and delipidation during autophagy
2009-05
[76]
논문
Atg22 recycles amino acids to link the degradative and recycling functions of autophagy
2006-12
[77]
논문
Polyphenols as Caloric-Restriction Mimetics and Autophagy Inducers in Aging Research
[78]
논문
A role for the NAD-dependent deacetylase Sirt1 in the regulation of autophagy
2008-03
[79]
논문
Autophagy in the eukaryotic cell
2002-02
[80]
논문
Autophagy as a regulated pathway of cellular degradation
2000-12
[81]
논문
Development by self-digestion: molecular mechanisms and biological functions of autophagy
2004-04
[82]
논문
The role of autophagy during the early neonatal starvation period
2004-12
[83]
논문
In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker
2004-03
[84]
논문
Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae
1993-10
[85]
논문
Subversion of cellular autophagosomal machinery by RNA viruses
2005-05
[86]
논문
Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion
2012-01
[87]
논문
Autophagy and aging: the importance of maintaining "clean" cells
[88]
논문
TEX264 drives selective autophagy of DNA lesions to promote DNA repair and cell survival
2024-10
[89]
논문
Nucleophagy repairs toxic DNA lesions
2024-10
[90]
서적
Dynamics of Cell Fate Decision Mediated by the Interplay of Autophagy and Apoptosis in Cancer Cells
Springer International Publishing
2015
[91]
논문
Another way to die: autophagic programmed cell death
2005-11
[92]
논문
Do all programmed cell deaths occur via apoptosis?
1993-02
[93]
논문
mTOR/p70S6K signaling distinguishes routine, maintenance-level autophagy from autophagic cell death during influenza A infection
2014-03
[94]
논문
Multifaceted programmed cell death in the mammalian fetal ovary
2015
[95]
논문
Autophagy is essential to support skeletal muscle plasticity in response to endurance exercise
https://hal.archives[...]
2014-10
[96]
논문
Activation of autophagy is required for muscle homeostasis during physical exercise
2011-12
[97]
논문
Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis
2012-01
[98]
논문
Physical exercise stimulates autophagy in normal skeletal muscles but is detrimental for collagen VI-deficient muscles
2011-12
[99]
논문
Chaperone-assisted selective autophagy is essential for muscle maintenance
2010-01
[100]
논문
Cellular mechanotransduction relies on tension-induced and chaperone-assisted autophagy
2013-03
[101]
논문
Autophagy is a protective mechanism in normal cartilage, and its aging-related loss is linked with cell death and osteoarthritis
2010-03
[102]
논문
Mechanical injury suppresses autophagy regulators and pharmacologic activation of autophagy results in chondroprotection
2012-04
[103]
논문
The relationship of autophagy defects to cartilage damage during joint aging in a mouse model
2015-06
[104]
서적
Autophagy
Landes Bioscience
2004
[105]
논문
New use for old drugs? Prospective targets of chloroquines in cancer therapy
2014
[106]
논문
Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene
2003-12
[107]
논문
The signaling adaptor p62 is an important NF-kappaB mediator in tumorigenesis
2008-04
[108]
논문
Bile acids as carcinogens in the colon and at other sites in the gastrointestinal system
2023-01
[109]
논문
Deoxycholate, an endogenous cytotoxin/genotoxin, induces the autophagic stress-survival pathway: implications for colon carcinogenesis
2009
[110]
논문
Dynamic Modeling of the Interaction Between Autophagy and Apoptosis in Mammalian Cells
2015-04
[111]
논문
A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles
2001-01
[112]
논문
miR4673 improves fitness profile of neoplastic cells by induction of autophagy
2018-10
[113]
논문
Role of autophagy in cancer: management of metabolic stress
[114]
논문
The role of autophagy in cancer: therapeutic implications
2011-09
[115]
논문
Negative regulators of cell death pathways in cancer: perspective on biomarkers and targeted therapies
2018-02
[116]
논문
Crosstalk between autophagy and inflammatory signalling pathways: balancing defence and homeostasis
2016-11
[117]
논문
Origin and physiological roles of inflammation
2008-07
[118]
서적
Autophagy Regulation of Innate Immunity
2019
[119]
논문
Dissecting pharmacological effects of chloroquine in cancer treatment: interference with inflammatory signaling pathways
2020-03
[120]
웹사이트
“細胞の恒常性維持のカギ”ミトコンドリアの質・量管理システムの謎に迫る
https://laborify.net[...]
Laborify
2019-04-20
[121]
논문
Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway.
1992-10
[122]
논문
オートファジーを長き眠りからめざめさせた酵母
http://leading.lifes[...]
2012-09-19
[123]
웹사이트
あなたの生命を支える機能「オートファジー」細胞自らが栄養を供給!
https://gendai.media[...]
[[講談社]]
2022-02-05
[124]
논문
細胞内の”ゴミ捨て場”に隠されていたリサイクル機構
[125]
웹사이트
オートファジー研究が開く医学の新境地(2017年秋号)
https://www.kantei.g[...]
[[首相官邸]]
2022-06-17
[126]
문서
세포가 자신을 먹는 오토파지의 수수께끼
[127]
문서
세포가 자신을 먹는 오토파지의 수수께끼
[128]
문서
세포가 자신을 먹는 오토파지의 수수께끼
[129]
문서
세포가 자신을 먹는 오토파지의 수수께끼
[130]
문서
세포가 자신을 먹는 오토파지의 수수께끼
[131]
문서
세포가 자신을 먹는 오토파지의 수수께끼
[132]
논문
オートファゴソームの形成にかかわるタンパク質の構造と分子機能
http://leading.lifes[...]
2014-11-05
[133]
문서
세포가 자신을 먹는 오토파지의 수수께끼
[134]
웹사이트
オートファジー
http://www.fbs.osaka[...]
[[大阪大学]]大学院医学系研究科遺伝医学講座遺伝学教室
2016-12-05
[135]
웹사이트
Editorial board
http://tandfonline.c[...]
2016-12-09
[136]
논문
哺乳類マクロオートファジーの基礎と病態
일본농예화학회
[137]
논문
植物オートファジーの生理的意義 ~植物独自の機能の解明を目指して~
https://bsj.or.jp/jp[...]
[[일본식물학회]]
[138]
논문
Lysosomal pathways to cell death and their therapeutic applications
2012-07
[139]
웹사이트
Microautophagy in mammalian cells: Revisiting a 40-year-old conundrum
https://www.tandfonl[...]
Taylor and Francis Online
2022-06-17
[140]
문서
세포가 자신을 먹는 오토파지의 수수께끼
[141]
웹사이트
オートファジー
http://bsd.neuroinf.[...]
理化学研究所 脳科学総合研究センター
2017-05-26
[142]
서적
水島昇 (2011), p. 43-45
[143]
학술지
蛍光観察によるシャペロン介在性オートファジー活性の評価
https://doi.org/10.1[...]
日本薬理学会
2015
[144]
문서
小脳萎縮や[[失調|小脳性運動失調]]などを症状とする。
[145]
웹사이트
細胞の分解機構「シャペロン介在性オートファジー」の 活性低下が小脳性運動障害に繋がることを解明
https://www.kumamoto[...]
熊本大学
2022-06-17
[146]
학술지
哺乳類マクロオートファジーの基礎と病態
[147]
서적
水島昇 (2011), pp. 155-158
[148]
학술지
オートファジーによるミトコンドリア分解機構
http://www.jbsoc.or.[...]
[149]
학술지
Mechanisms of mitophagy
2011-01
[150]
학술지
オートファジーによる細胞内侵入性細菌の認識機構
https://doi.org/10.1[...]
日本農芸化学会
[151]
학술지
Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway
1992-10
[152]
학술지
Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction
1992-10
[153]
학술지
Isolation of autophagocytosis mutants of Saccharomyces cerevisiae
1994-08
[154]
학술지
Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae
1993-10
[155]
학술지
Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway
1995-11
[156]
학술지
The role of Atg proteins in autophagosome formation
2011-11-10
[157]
학술지
The autophagosome: origins unknown, biogenesis complex
2013-12
[158]
학술지
Structural biology of the core autophagy machinery
2017-04
[159]
웹사이트
オートファジーの構造生物学
https://www.jbsoc.or[...]
日本生化学会
2022-06-18
[160]
학술지
Autophagy regulation by nutrient signaling
2014-01
[161]
학술지
Regulation and function of uncoordinated-51 like kinase proteins
2012-09
[162]
학술지
ULK1 induces autophagy by phosphorylating Beclin-1 and activating VPS34 lipid kinase
2013-07
[163]
학술지
Beclin 1 forms two distinct phosphatidylinositol 3-kinase complexes with mammalian Atg14 and UVRAG
2008-12
[164]
학술지
The Beclin 1 network regulates autophagy and apoptosis
2011-04
[165]
학술지
The dynamic interaction of AMBRA1 with the dynein motor complex regulates mammalian autophagy
2010-10
[166]
학술지
FIP200, a ULK-interacting protein, is required for autophagosome formation in mammalian cells
2008-05
[167]
학술지
Wipi Proteins: Essential Ptdins3p Effectors at the Nascent Autophagosome
[168]
학술지
Mammalian hybrid pre-autophagosomal structure HyPAS generates autophagosomes
https://linkinghub.e[...]
2021-11
[169]
학술지
WIPI2 links LC3 conjugation with PI3P, autophagosome formation, and pathogen clearance by recruiting Atg12-5-16L1
2014-07
[170]
학술지
The Atg12-Atg5 conjugate has a novel E3-like activity for protein lipidation in autophagy
2007-12
[171]
학술지
LC3, GABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation
2004-06
[172]
학술지
An Atg4B mutant hampers the lipidation of LC3 paralogues and causes defects in autophagosome closure
2008-11
[173]
학술지
Choline dehydrogenase interacts with SQSTM1/p62 to recruit LC3 and stimulate mitophagy
2014
[174]
학술지
TI-VAMP/VAMP7 and VAMP3/cellubrevin: two v-SNARE proteins involved in specific steps of the autophagy/multivesicular body pathways
2009-12
[175]
학술지
Combinational soluble N-ethylmaleimide-sensitive factor attachment protein receptor proteins VAMP8 and Vti1b mediate fusion of antimicrobial and canonical autophagosomes with lysosomes
2010-03
[176]
논문
mTORC1 phosphorylates UVRAG to negatively regulate autophagosome and endosome maturation
2015-01
[177]
논문
The structure of Atg4B-LC3 complex reveals the mechanism of LC3 processing and delipidation during autophagy
2009-05
[178]
논문
Atg22 recycles amino acids to link the degradative and recycling functions of autophagy
2006-12
[179]
논문
Polyphenols as Caloric-Restriction Mimetics and Autophagy Inducers in Aging Research
[180]
논문
A role for the NAD-dependent deacetylase Sirt1 in the regulation of autophagy
2008-03
[181]
웹사이트
オートファジーとは
https://ruo.mbl.co.j[...]
医学生物学研究所
2022-06-18
[182]
뉴스
オートファジーが染色体を安定化するしくみの解明 〜栄養欠乏条件下での細胞分裂にはタンパク質の分解と再利用が重要〜
https://www.nibb.ac.[...]
2013-02-01
[183]
웹사이트
飢餓適応機構としての自己タンパク質分解の意義の解明
https://www.jst.go.j[...]
科学技術振興機構
2004-11-01
[184]
웹사이트
オートファジー?細胞はなぜ自分を食べるのか
https://www.natureas[...]
Nature Japan
2022-06-18
[185]
논문
病原細菌と宿主オートファジーとの攻防
https://doi.org/10.1[...]
日本農芸化学会
2015
[186]
논문
細菌感染とオートファジー
https://www.eiken.co[...]
栄研化学
[187]
뉴스
【科学の森】オートファジー 見え始めた全体像 応用目指す大学ベンチャーも
2020-09-10
[188]
웹사이트
細胞内有害物質を取り除く創薬手法開発に成功 選択的オートファジーを自在に制御できるAUTAC分子の発明
https://www.tohoku.a[...]
東北大学
2019-10-11
[189]
서적
水島昇 (2011), p.104
[190]
서적
水島昇 (2011), p.125
[191]
뉴스
ノーベル賞 大隅良典氏、単独で医学生理学賞 「細胞の自食」解明
https://web.archive.[...]
『毎日新聞』
2016-10-04
[192]
웹사이트
ブログ版 Prof. A. Hill Returns Prof.A.Hillの帰還とロジ裏生活〜Season 2, Episode 1〜
http://www.fbs.osaka[...]
[193]
뉴스
【ノーベル賞】大隅さん発見「オートファジー」 少年ジャンプ漫画・トリコの解説が「正確」と学者絶賛
https://www.buzzfeed[...]
BuzzFeedNews
2016-10-03
[194]
뉴스
トリコ:ノーベル賞「オートファジー」題材の3話分を緊急無料公開
https://mantan-web.j[...]
MANTANWEB
2016-10-05
[195]
뉴스
ノーベル賞受賞記念! 「トリコ」のオートファジー登場回が「ジャンプ+」で無料公開中
https://nlab.itmedia[...]
2016-10-05
[196]
뉴스
漫画「トリコ」の「オートファジー」登場回を無料公開 大隅教授ノーベル賞受賞記念
https://www.itmedia.[...]
ITmedia
2016-10-05
[197]
논문
Choose Delicately and Reuse Adequately: The Newly Revealed Process of Autophagy
[198]
논문
Choose Delicately and Reuse Adequately: The Newly Revealed Process of Autophagy
[199]
논문
http://dx.plos.org/1[...]
[200]
논문
http://www.ovarianre[...]
[201]
논문
http://dx.plos.org/1[...]
[202]
논문
[203]
웹인용
http://www.nobelpriz[...]
2016-10-03
[204]
논문
[205]
논문
[206]
논문
[207]
논문
[208]
논문
[209]
논문
https://www.ncbi.nlm[...]
[210]
논문
https://www.ncbi.nlm[...]
[211]
논문
The signaling adaptor p62 is an important NF-kappaB mediator in tumorigenesis
https://www.ncbi.nlm[...]
2008-04-01
[212]
논문
Autophagy suppresses tumorigenesis through elimination of p62
https://www.ncbi.nlm[...]
2009-06-12
[213]
논문
Role of autophagy in cancer: management of metabolic stress
https://www.ncbi.nlm[...]
2017-02-01
[214]
논문
A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles
https://www.ncbi.nlm[...]
2001-01-15
[215]
논문
Dynamic Modeling of the Interaction Between Autophagy and Apoptosis in Mammalian Cells
https://www.ncbi.nlm[...]
2015-04-01
[216]
논문
Apoptosis: A Review of Programmed Cell Death
http://www.ncbi.nlm.[...]
2007-01-01
[217]
논문
Self-consumption: the interplay of autophagy and apoptosis
https://www.ncbi.nlm[...]
2014-02-01
[218]
논문
Autophagy-mediated degradation of IAPs and c-FLIPL potentiates apoptosis induced by combination of TRAIL and Chal-24
http://www.ncbi.nlm.[...]
2016-12-03
[219]
논문
The cellular decision between apoptosis and autophagy
https://www.ncbi.nlm[...]
2013-03-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com