2,3-비스포스포글리세르산
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
2,3-비스포스포글리세르산(2,3-BPG)은 적혈구에서 생성되는 유기인산으로, 1,3-비스포스포글리세르산으로부터 합성되며 2,3-비스포스포글리세르산 인산가수분해효소에 의해 3-포스포글리세르산으로 분해된다. 2,3-BPG는 헤모글로빈과 결합하여 산소 친화도를 조절하며, 헤모글로빈의 탈산소화 상태를 안정화시켜 조직으로의 산소 공급을 돕는다. 임산부와 태아의 경우 2,3-BPG 농도 차이를 통해 모체에서 태아로의 산소 전달을 효율적으로 만든다. 갑상선 기능 항진증, 만성 빈혈, 저산소증을 동반한 만성 호흡기 질환 등 다양한 질환과 관련되며, 혈액 투석 과정에서도 그 농도가 변화한다.
더 읽어볼만한 페이지
- 호흡생리학 - 헤모글로빈
헤모글로빈은 척추동물 혈액에서 산소를 운반하는 주요 단백질로, 헴과 글로빈이 결합된 4개의 소단위체로 구성된 사량체 구조를 가지며, 헴의 철 성분이 산소와 결합하여 폐에서 조직으로 산소를, 조직에서 이산화탄소와 양성자를 운반하고, 산소 결합은 여러 요인에 의해 영향을 받으며, 유전자 돌연변이는 헤모글로빈병증을 유발하고, 농도와 기능은 질병 진단에 활용되며, 다양한 생물종에서 발견된다. - 호흡생리학 - 메트헤모글로빈
메트헤모글로빈은 헤모글로빈의 일종으로, 헴 철 이온이 산화된 Fe3+ 상태로 존재하여 산소 결합 능력을 상실한 상태를 말하며, 후천적으로는 환경적 요인이나 약물에 의해, 선천적으로는 유전적 결함으로 인해 발생할 수 있다. - 해당 - 유비퀴논
유비퀴논(CoQ10)은 미토콘드리아 전자 전달계의 주요 구성 요소인 지용성 유기 화합물로, 세포 호흡과 에너지 생산에 필수적이며 항산화 작용을 통해 세포를 보호하고 면역 반응에도 관여한다. - 해당 - 글루코스
글루코스는 6개의 탄소 원자를 가진 단당류로, D-글루코스 이성질체는 덱스트로스라고도 불리며 생물체의 에너지원, 식물의 광합성 생산물, 그리고 다양한 탄수화물의 구성 성분으로서 중요한 역할을 한다. - 유기 인산염 - 인산다이에스터 결합
DNA와 RNA 골격을 이루는 인산다이에스터 결합은 뉴클레오사이드 사이의 인산기를 매개하며 핵산 복제, 복구, 재조합에 중요한 역할을 하고 pH 7에서 음전하를 띠며 특정 조건 하에 분해될 수 있는 화학 결합이다. - 유기 인산염 - 실로시빈
실로시빈은 환각 작용을 일으키는 화합물로, 뇌의 세로토닌 수용체에 작용하여 시각적 환각, 시간 감각 변화 등을 유발하며, 우울증, 불안 등의 치료에 대한 연구가 진행되고 있다.
2. 물질대사
2,3-비스포스포글리세르산(2,3-BPG)은 해당과정에서 1,3-비스포스포글리세르산(1,3-BPG)이 비스포스포글리세르산 뮤테이스에 의해 이성질화되어 생성된다. 생성된 2,3-비스포스포글리세르산은 2,3-비스포스포글리세르산 인산가수분해효소에 의해 분해되어 3-포스포글리세르산이 된다.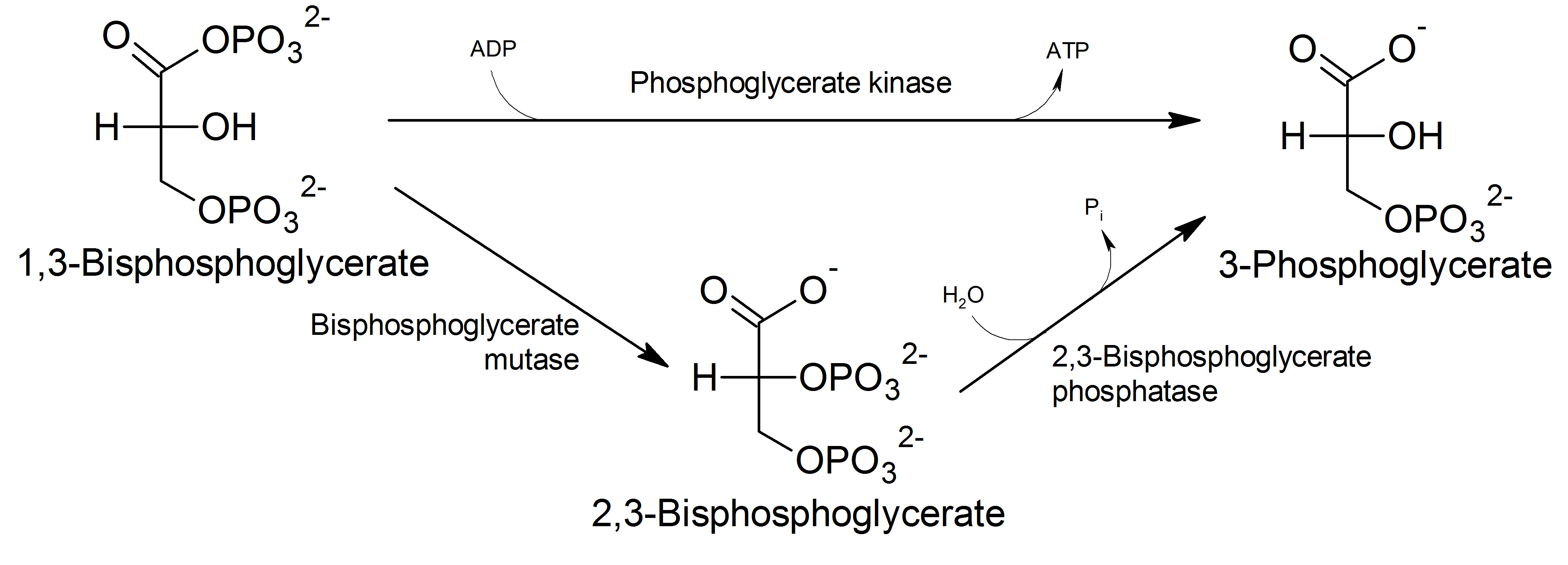
2. 1. 루베링-라포포트 경로
2,3-비스포스포글리세르산(2,3-BPG)은 비스포스포글리세르산 뮤테이스에 의해 1,3-비스포스포글리세르산(1,3-BPG)으로부터 생성된다. 그런 다음 2,3-비스포스포글리세르산은 2,3-비스포스포글리세르산 인산가수분해효소에 의해 분해되어 3-포스포글리세르산을 형성한다. 따라서 2,3-비스포스포글리세르산의 합성 및 분해는 해당과정의 단계를 우회하는 것이며, 비스포스포글리세르산 뮤테이스에 의해 고에너지 카복실산-인산 혼합 무수 결합이 절단될 때 생성되는 2,3-비스포스포글리세르산 분자당 순비용으로 1분자의 ATP가 소모된다.[1]정상적인 해당과정 경로는 포스포글리세르산 키네이스에 의해 1,3-비스포스포글리세르산과 ADP를 3-포스포글리세르산과 ATP로 전환될 수 있다. 또는 루베링-라포포트 경로로 전환될 수 있는데, 여기서 비스포스포글리세르산 뮤테이스는 1,3-비스포스포글리세르산(1,3-BPG)의 1번 탄소(C1)로부터 2번 탄소(C2)로 포스포릴기의 전이를 촉매하여 2,3-비스포스포글리세르산(2,3-BPG)을 생성한다. 적혈구에서 가장 농도가 높은 유기인산인 2,3-비스포스포글리세르산은 2,3-비스포스포글리세르산 인산가수분해효소의 작용에 의해 3-포스포글리세르산(3PG)으로 전환된다. 2,3-비스포스포글리세르산의 농도는 H+의 농도에 비례하여 변한다.[1]
세포의 물질대사에 필요한 에너지를 지원하기 위해 ATP를 생성해야 하는 필요성과 헤모글로빈의 적절한 산소화/탈산소화 상태를 유지해야 하는 필요성 사이에는 미묘한 균형이 있다. 이러한 균형은 1,3-비스포스포글리세르산(1,3-BPG)가 2,3-비스포스포글리세르산(2,3-BPG)로 이성질화되어 유지되며, 이는 헤모글로빈의 탈산소화를 향상시킨다.[1]
3. 헤모글로빈과의 결합 및 기능
2,3-비스포스포글리세르산(2,3-BPG)은 헤모글로빈의 β-사슬에 있는 라이신과 히스티딘 잔기와 염다리를 형성하여 분자 대칭성과 양성 전하를 이용, 탈산소 형태의 공간에 정확히 들어맞아 헤모글로빈의 탈산소화 상태(T 상태)를 안정화시킨다.[7] 산소가 헴 그룹에 결합된 R 상태는 다른 형태를 가지며, 이러한 상호작용을 허용하지 않는다.
2,3-BPG는 BPG 뮤테이스에 의해 1,3-BPG로부터 생성된다. 그런 다음 2,3-BPG 포스파테이스에 의해 분해되어 3-PG을 형성할 수 있다. 2,3-BPG의 합성 및 분해는 글리콜리시스의 한 단계를 우회하는 방법이며, 2,3-BPG 포스파테이스에 의해 고에너지 카르복실산-인산 혼합 무수물 결합이 절단됨에 따라 생성된 2,3-BPG 분자당 1개의 ATP가 소모된다.
세포 대사를 위한 에너지 요구 사항을 지원하기 위해 ATP를 생성해야 하는 필요성과 헤모글로빈의 적절한 산소화/탈산소화 상태를 유지해야 하는 필요성 사이에는 미묘한 균형이 있다. 이러한 균형은 1,3-BPG를 2,3-BPG로 이성화시켜 유지하며, 이는 헤모글로빈의 탈산소화를 향상시킨다. 정상적인 글리콜리시스 경로는 ATP를 생성하는 PGK에 의해 탈인산화될 수 있는 1,3-BPG를 생성하거나, Luebering-Rapoport 경로로 우회될 수 있으며, 여기서 비스포스포글리세르산 뮤테이스는 1,3-BPG의 C1에서 C2로의 인산기의 이동을 촉매하여 2,3-BPG를 생성한다. 적혈구에서 가장 농축된 유기 인산염인 2,3-BPG는 비스포스포글리세르산 포스파테이스의 작용에 의해 3-PG를 형성한다. 2,3-BPG의 농도는 [H+]에 비례하여 변화한다.
3. 1. 산소 해리 곡선
2,3-비스포스포글리세르산(2,3-BPG)은 디옥시헤모글로빈과 결합하여 산소 운반체의 낮은 산소 친화도 상태(T 상태)를 안정화시킨다. 이는 헤모글로빈의 β 소단위체에 있는 리신 및 히스티딘 잔기와 염다리를 형성하여 분자 대칭성과 양극성을 이용하여 탈산소 입체구조의 공동(cavity)에 깔끔하게 맞게 된다.[7] 헴기에 산소가 결합된 R 상태는 다른 입체구조를 가지며, 이러한 상호작용을 허용하지 않는다.헤모글로빈은 그 자체로 S자 모양의 해리 곡선을 가지고 있다. 2,3-비스포스포글리세르산은 디옥시헤모글로빈에 선택적으로 결합할 때 T 상태의 입체구조를 안정화시켜 산소가 헤모글로빈에 결합하는 것을 더 어렵게 만들고, 산소를 인접 조직 세포로 더 쉽게 방출되도록 한다.[7]
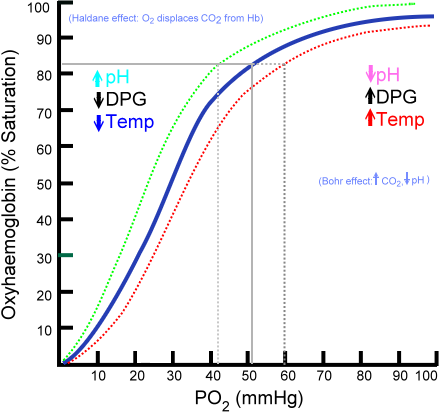
2,3-비스포스포글리세르산은 조직의 저산소증을 예방하는 데 도움이 될 수 있는 피드백 루프의 일부이다. 높은 고도(높은 고도에 순응한 사람들의 경우 2,3-비스포스포글리세르산의 수준이 더 높음), 기도 폐쇄 또는 울혈성 심부전과 같은 조직의 산소 농도가 낮은 조건은 적혈구가 2,3-비스포스포글리세르산을 더 많이 생성하도록 하는 경향이 있다. 이는 pH와 산소의 변화가 이를 만들고 분해하는 효소를 조절하기 때문이다.[7] 2,3-비스포스포글리세르산의 축적은 산소에 대한 헤모글로빈의 친화력을 감소시킨다. 이러한 메커니즘은 가장 필요한 상황에서 적혈구로부터 산소의 방출을 증가시킨다.[7]
이러한 방출은 보어 효과에 의해 강화되는데, 보어 효과는 산소에 대한 헤모글로빈의 결합 친화도가 낮은 pH와 고농도의 이산화 탄소에 의해 감소되는 현상이다. 에너지 요구량이 높은 조직에서는 산소가 빠르게 소모되어 H+와 이산화 탄소의 농도가 증가한다. 보어 효과에 의해 헤모글로빈은 산소를 필요로 하는 세포에 더 많은 산소를 공급하도록 유도된다. 2,3-비스포스포글리세르산은 관련 단백질인 미오글로빈에는 영향을 미치지 않는다.[7]
임산부의 경우 세포 내의 2,3-비스포스포글리세르산이 30% 증가한다. 이것은 산소에 대한 모체의 헤모글로빈의 친화력을 낮추기 때문에 모체의 자궁동맥에서 더 많은 산소가 태아에게 전달되도록 한다. 태아의 헤모글로빈은 2,3-비스포스포글리세르산에 대한 민감도가 낮기 때문에 산소에 대한 친화력이 더 높다. 따라서 자궁동맥의 pO2가 낮더라도 태아의 제동맥(탈산소화된 혈액을 운반하는)은 여전히 자궁동맥으로부터 산소를 얻을 수 있다.[7]
2,3-비스포스포글리세르산의 증가는 본질적으로 표적 조직에서 헤모글로빈으로부터 산소 전달을 촉진하며, 이는 또한 헤모글로빈이 폐에서 산소를 흡수하는 것을 다소 어렵게 만드는 대가와 함께 이루어진다. 이러한 기전은 모체-태아 산소 공급을 더 효율적으로 만든다. 태아의 2,3-BPG는 모체의 수준보다 낮기 때문에, 태반에서 태아 혈액의 산소 흡수가 더 높아진다.
2,3-BPG는 또한 산소-헤모글로빈 해리 곡선에 대한 특정 대사 장애에 생리적으로 대응하는 역할을 할 수 있다. 예를 들어, 고산지대에서 낮은 대기 중 산소 농도는 과호흡과 그에 따른 대사성 알칼리증을 유발할 수 있으며, 이는 산소-헤모글로빈 해리 곡선의 비정상적인 좌측 이동을 일으키며, 이는 2,3-BPG의 증가로 상쇄될 수 있다.[2]
3. 2. 생리적 의의
2,3-비스포스포글리세르산(2,3-BPG)은 디옥시헤모글로빈과 결합하여 산소 운반체의 낮은 산소 친화도 상태(T 상태)를 안정화시킨다. 이는 헤모글로빈의 β 소단위체에 있는 리신 및 히스티딘 잔기와 염다리를 형성하여 분자 대칭성과 양극성을 이용하여 탈산소 입체구조의 공동(cavity)에 깔끔하게 맞도록 한다.[7] 헴기에 산소가 결합된 R 상태는 다른 입체구조를 가지며, 이러한 상호작용을 허용하지 않는다.헤모글로빈은 그 자체로 S자 모양의 해리 곡선을 가지고 있다. 2,3-비스포스포글리세르산은 디옥시헤모글로빈에 선택적으로 결합하여 T 상태의 입체구조를 안정화시켜 산소가 헤모글로빈에 결합하는 것을 더 어렵게 만들고, 산소를 인접 조직 세포로 더 쉽게 방출되도록 한다. 2,3-비스포스포글리세르산은 조직의 저산소증을 예방하는 데 도움이 될 수 있는 피드백 루프의 일부이다.
높은 고도(높은 고도에 순응한 사람들의 경우 2,3-비스포스포글리세르산의 수준이 더 높음), 기도 폐쇄 또는 울혈성 심부전과 같은 조직의 산소 농도가 낮은 조건은 적혈구가 2,3-비스포스포글리세르산을 더 많이 생성하도록 하는 경향이 있다. 이는 pH와 산소의 변화가 이를 만들고 분해하는 효소를 조절하기 때문이다.[7] 2,3-비스포스포글리세르산의 축적은 산소에 대한 헤모글로빈의 친화력을 감소시킨다. 궁극적으로 이러한 메커니즘은 가장 필요한 상황에서 적혈구로부터 산소의 방출을 증가시킨다.
이러한 방출은 보어 효과에 의해 강화되는데, 보어 효과는 산소에 대한 헤모글로빈의 결합 친화도가 낮은 pH와 고농도의 이산화 탄소에 의해 감소되는 현상이다. 에너지 요구량이 높은 조직에서는 산소가 빠르게 소모되어 H+와 이산화 탄소의 농도가 증가한다. 보어 효과에 의해 헤모글로빈은 산소를 필요로 하는 세포에 더 많은 산소를 공급하도록 유도된다. 이에 반해 2,3-비스포스포글리세르산은 관련 단백질인 미오글로빈에는 영향을 미치지 않는다.
임산부의 경우 세포 내의 2,3-비스포스포글리세르산이 30% 증가한다. 이것은 산소에 대한 모체의 헤모글로빈의 친화력을 낮추기 때문에 모체의 자궁동맥에서 더 많은 산소가 태아에게 전달되도록 한다. 태아의 헤모글로빈은 2,3-비스포스포글리세르산에 대한 민감도가 낮기 때문에 산소에 대한 친화력이 더 높다. 따라서 자궁동맥의 pO2가 낮더라도 태아의 제동맥(탈산소화된 혈액을 운반하는)은 여전히 자궁동맥으로부터 산소를 얻을 수 있다.
2,3-비스포스포글리세르산(2,3-BPG)의 증가는 본질적으로 표적 조직에서 헤모글로빈으로부터 산소 전달을 촉진하며, 이는 또한 헤모글로빈이 폐에서 산소를 흡수하는 것을 다소 어렵게 만드는 대가와 함께 이루어진다. 이러한 기전은 모체-태아 산소 공급을 더 효율적으로 만든다. 태아의 2,3-BPG는 모체의 수준보다 낮기 때문에, 태반에서 태아 혈액의 산소 흡수가 더 높아지기 때문이다.
2,3-BPG는 또한 산소-헤모글로빈 해리 곡선에 대한 특정 대사 장애에 생리적으로 대응하는 역할을 할 수 있다. 예를 들어, 고산지대에서 낮은 대기 중 산소 농도는 과호흡과 그에 따른 대사성 알칼리증을 유발할 수 있으며, 이는 산소-헤모글로빈 해리 곡선의 비정상적인 좌측 이동을 일으키며, 이는 2,3-BPG의 증가로 상쇄될 수 있다.[2] 전통적인 가르침은 고산지대에서 관찰되는 생리적 2,3-BPG 증가는 단순히 표적 조직에서 산소 전달을 더 쉽게 만들기 위한 것이라고 주장해왔지만, 이 기전 자체는 감소된 산소 친화도가 또한 폐에서 산소 흡수를 억제하고, 결과적으로 표적 조직으로의 총 산소 전달이 순 감소할 수 있다는 추론에 의해 반박된다.[2]
4. 임신과 태아 헤모글로빈
2,3-비스포스포글리세르산(2,3-BPG)은 헤모글로빈의 산소 친화도를 조절하여 인체 내 산소 운반에 중요한 역할을 한다. 특히 임신 중에는 모체와 태아 사이의 효율적인 산소 교환을 위해 2,3-BPG의 농도와 헤모글로빈의 특성이 변화한다.
임산부의 경우 세포 내 2,3-BPG 농도가 약 30% 증가한다. 이는 모체 헤모글로빈의 산소 친화력을 낮춰, 더 많은 산소가 태아에게 전달되도록 돕는다. 반면 태아 헤모글로빈은 2,3-BPG에 대한 친화도가 낮아 산소 결합력이 높다. 이러한 차이 덕분에 자궁동맥의 산소 분압이 낮더라도 태아는 산소를 충분히 공급받을 수 있다.
2,3-BPG는 산모의 폐에서 헤모글로빈과 산소의 결합을 어렵게 만들지만, 임신 중에는 호흡률이 증가하여 이를 보상한다.[3]
4. 1. 태아 헤모글로빈과의 관계
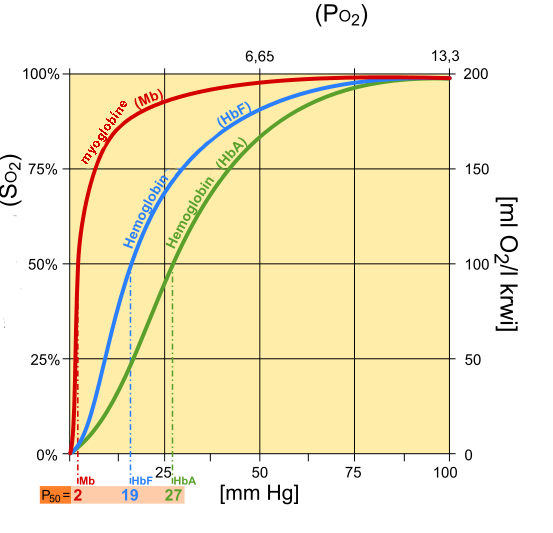
임산부의 경우 세포 내 2,3-비스포스포글리세르산(2,3-BPG)이 30% 증가한다. 이는 산소에 대한 모체의 헤모글로빈 친화력을 낮춰 모체의 자궁동맥에서 태아에게 더 많은 산소가 전달되도록 한다.[3] 태아의 헤모글로빈은 2,3-비스포스포글리세르산에 대한 민감도가 낮기 때문에 산소에 대한 친화력이 더 높다. 따라서 자궁동맥의 pO2가 낮더라도 태아의 제동맥(탈산소화된 혈액을 운반)은 여전히 자궁동맥으로부터 산소를 얻을 수 있다.
태아 헤모글로빈(HbF)은 2,3-비스포스포글리세르산(2,3-BPG)에 대해 낮은 친화도를 나타내기 때문에 산소에 대한 결합 친화도가 더 높다. 성인 헤모글로빈(HbA)에 비해 증가된 태아 헤모글로빈(HbF)의 산소 결합 친화도는 HbA의 2개의 α/β 이량체와는 대조적으로 2개의 α/γ 이량체를 가지고 있는 태아 헤모글로빈(HbF)에 기인한다. 2,3-비스포스포글리세르산(2,3-BPG) 결합 포켓을 형성하는 데 필수적인 성인 헤모글로빈(HbA)의 β 소단위체의 양으로 하전된 히스티딘 잔기는 태아 헤모글로빈(HbF)의 γ 소단위체에서 세린 잔기로 대체된다. 이처럼 히스티딘 nº143이 소실되어 2,3-비스포스포글리세르산(2,3-BPG)이 태아 헤모글로빈(HbF)과 결합하기 어려워져서 순수한 헤모글로빈처럼 보이게 된다. 성인 헤모글로빈(HbA)에 대한 태아 헤모글로빈(HbF)의 결합 친화력 증가는 태반을 가로질러 모체에서 태아로의 산소 운반을 촉진한다.
5. 2,3-BPG 관련 질환
2,3-비스포스포글리세르산(2,3-BPG)는 갑상샘 기능 항진증, 만성 빈혈, 저산소증을 동반한 만성 호흡기 질환, 혈액 투석 등 여러 질환과 관련이 있는 것으로 알려져 있다.
5. 1. 갑상샘 기능 항진증
2004년의 연구에서 갑상샘 호르몬이 2,3-비스포스포글리세르산(2,3-BPG) 수치에 미치는 영향이 확인되었다. 갑상샘 기능 항진증은 포스포글리세르산 뮤테이스(PGM) 및 비스포스포글리세르산 뮤테이스(BPGM)의 발현 변화를 통해 적혈구에서 2,3-비스포스포글리세르산 함량을 조절한다. 이러한 결과는 갑상샘 기능 항진증에서 관찰되는 적혈구의 2,3-비스포스포글리세르산 함량 증가가 순환하는 헤모글로빈의 속도 변화에 의존하지 않고, 적혈구의 해당과정 활성에 대한 갑상샘 호르몬의 자극 효과의 직접적인 결과라는 것을 보여준다.[8]
5. 2. 만성 빈혈
적혈구는 혈액의 산소 운반 능력이 감소하는 만성 빈혈 환자에서 1~2시간 내에 세포의 2,3-비스포스포글리세르산(2,3-BPG)의 농도를 5배까지 증가시킨다. 그 결과 산소 해리 곡선이 오른쪽으로 이동하고 더 많은 산소가 조직으로 방출된다.[4]
5. 3. 저산소증을 동반한 만성 호흡기 질환
최근 과학자들은 2,3-비스포스포글리세르산(2,3-BPG)의 낮은 양과 고산지대에서의 고산 폐부종 발생 사이의 유사점을 발견했다.[4]
5. 4. 혈액 투석
1998년에 진행된 연구에서는 혈액 투석 과정에서 적혈구의 2,3-비스포스포글리세르산(2,3-BPG) 농도를 분석했다. 2,3-BPG 농도는 헤모글로빈 사량체(Hb4) 농도에 대한 2,3-BPG/Hb4 비율로 나타냈다. 생리학적으로 2,3-BPG 수치가 증가하면 혈액 투석 과정에서 자주 나타나는 저산소증을 상쇄할 것으로 예상되었지만, 실제 결과는 2,3-BPG/Hb4 비율이 감소하는 것으로 나타났다.[9][5]이는 혈액 투석 시술 자체로 인한 것으로, 적혈구에 가해지는 기계적 스트레스가 2,3-BPG 방출을 유발하고, 방출된 2,3-BPG는 혈액 투석을 통해 제거되기 때문으로 보인다. 칼슘, 인산염, 크레아티닌, 요소, 알부민의 농도는 2,3-BPG/Hb4 비율의 총 변화와 유의미한 상관관계를 보이지 않았다. 그러나 투석 직전에 측정한 2,3-BPG/Hb4 비율은 환자에게 투여된 에리트로포이에틴 (적혈구 생성을 촉진하는 주요 호르몬)의 총 주간 투여량과 유의미한 양의 상관관계를 보였다.[9][5]
참조
[1]
논문
The effect of organic phosphates from the human erythrocyte on the allosteric properties of hemoglobin.
[2]
논문
Influence of High Hemoglobin-Oxygen Affinity on Humans During Hypoxia.
[3]
논문
Respiratory physiology of pregnancy: Physiology masterclass.
[4]
논문
Effects of thyroid hormone and hypoxia on 2,3-bisphosphoglycerate, bisphosphoglycerate synthase and phosphoglycerate mutase in rabbit erythroblasts and reticulocytes in vivo
2004-09
[5]
논문
Oxygen and 2,3 biphosphoglycerate (2,3-BPG) during haemodialysis
1998-10
[6]
논문
The effect of organic phosphates from the human erythrocyte on the allosteric properties of hemoglobin.
[7]
논문
Model of 2,3-bisphosphoglycerate metabolism in the human erythrocyte based on detailed enzyme kinetic equations: in vivo kinetic characterization of 2,3-bisphosphoglycerate synthase/phosphatase using 13C and 31P NMR
[8]
논문
Effects of thyroid hormone and hypoxia on 2,3-bisphosphoglycerate, bisphosphoglycerate synthase and phosphoglycerate mutase in rabbit erythroblasts and reticulocytes in vivo
2004-09
[9]
논문
Oxygen and 2,3 biphosphoglycerate (2,3-BPG) during haemodialysis
1998-10
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
