과염소산
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
과염소산은 1810년대 중반에 처음 합성된 무기산으로, 과염소산 이온을 포함하는 과염소산염 형태로 널리 사용된다. 과염소산은 과염소산나트륨 용액에 황산을 반응시켜 얻거나, 염산의 전해 산화로 얻을 수 있으며, 산업적으로는 주로 과염소산암모늄의 전구체로 사용된다. 과염소산은 강력한 산화력을 가지며, 로켓 연료, 식각, 분석 화학 등 다양한 분야에서 활용된다. 과염소산염은 화약 및 폭약의 산화제로도 사용되며, 탄소, 황, 유기물 등과 혼합 시 폭발의 위험이 있다. 과염소산은 폭발성이 있고 유해 물질로 분류되어 취급에 주의가 필요하며, 대한민국에서는 위험물로 지정되어 규제를 받는다.
더 읽어볼만한 페이지
- 과염소산염 - 과염소산 칼륨
과염소산 칼륨은 산화제 및 갑상선 기능 항진증 치료제로 사용되는 무색 결정 화합물로, 가열 시 산소를 발생시키며 폭죽, 뇌관 등의 제조에 사용되고 갑상선 기능 항진증 치료에 활용되지만 논란도 있다. - 과염소산염 - 과염소산 암모늄
과염소산 암모늄은 NH4ClO4 화학식을 가진 결정성 고체로, 고체 로켓 추진제의 산화제로 주로 사용되지만 가열, 충격, 마찰에 의해 폭발적으로 분해될 수 있고 연소 시 유독 물질을 배출하여 규제되는 강력한 산화제이다. - 무기산 - 인산
인산은 화학식 H₃PO₄를 가지며, 인광석을 이용한 습식 또는 건식 공정으로 생산되어 비료, 식품 첨가물, 세제, 의약품, 금속 처리 등 다양한 산업 분야에 사용되는 인 화합물이다. - 무기산 - 왕수
왕수는 진한 질산과 염산을 1:3 몰 비율로 혼합한 것으로, 금이나 백금 같은 귀금속을 녹일 수 있는 강력한 산화력을 가진 용액이며, 염화 금산 제조, 식각, 분석화학 등에 사용된다.
2. 역사
과염소산은 1810년대 중반 오스트리아 화학자 프리드리히 폰 스타디온이 과염소산칼륨과 함께 최초로 합성하였으며, "산소화된 염소산"이라고 불렀다. 프랑스 약사 조르주-시몽 세뤼라(Georges-Simon Serullas)는 고체 일수화물을 발견하면서(하지만 그는 이를 무수물로 잘못 판단했다)[5] 현대적인 명칭을 도입했다.
과염소산 소듐이나 과염소산칼륨 용액을 황산과 반응시켜 과염소산을 얻을 수 있다. 과염소산바륨에 황산을 처리하면 황산바륨 침전이 생기고 과염소산이 남는다. 질산과 과염소산암모늄을 섞고 염산을 넣어 끓이면 아산화질소와 과염소산이 생성된다. 이 반응은 암모늄 이온이 관여하는 동시 반응으로 진행되며, 이후 남은 질산과 염산을 끓여 농축 및 정제할 수 있다.[8]
3. 제법
3. 1. 산업적 생산
과염소산은 산업적으로 두 가지 방법으로 생산된다. 전통적인 방법은 과염소산나트륨의 높은 수용성을 이용한다. 과염소산나트륨 용액에 염산을 처리하면 과염소산이 생성되고 염화나트륨이 고체로 침전된다.[6]
:NaClO₄ + HCl → NaCl + HClO₄
농축된 산은 증류를 통해 정제할 수 있다. 염을 사용하지 않는 보다 직접적인 대안적인 방법은 백금 전극에서 수용액상의 염소를 양극 산화시키는 것이다.[6][7]
3. 2. 실험실 제법
과염소산 소듐 용액을 고농도의 황산과 반응시켜 얻는다.
:NaClO4 + H2SO4 → NaHSO4 + HClO4
과염소산칼륨 용액을 황산과 함께 증류하여 과염소산을 얻을 수 있다.[8] 과염소산바륨에 황산을 처리하면 황산바륨이 침전되고 과염소산이 남는다. 질산과 과염소산암모늄을 혼합하고 염산을 가하면서 끓이면 아산화질소와 과염소산이 생성된다. 이 반응은 암모늄 이온이 관여하는 동시 반응으로 진행되며, 이후 남아있는 질산과 염산을 끓여내어 농축 및 정제할 수 있다.
이산화염소(Cl₂O₇)와 물(H₂O)이 반응하여 생성된다.
:
과염소산칼륨(KClO₄)에 진한 황산(H₂SO₄)을 가하고 감압 증류하면 얻을 수 있다.
:
염산(HCl)의 전해 산화에 의해서도 수용액으로 얻을 수 있다.
:
4. 화학적 성질
무수 과염소산은 상온에서 불안정한 기름 같은 액체이다. 최소 다섯 가지의 결정수화물을 형성하며, 그 중 일부는 X선 결정학적으로 특성이 규명되었다. 예를 들어, 히드로늄 과염소산염이 있다. 과염소산은 물과 약 72.5% 과염소산으로 구성된 공비 혼합물을 형성한다. 이 형태의 산은 무기한으로 안정적이며 시판되고 있다. 이러한 용액은 흡습성이 있어서, 공기에 노출되면 진한 과염소산은 공기 중의 수분을 흡수하여 스스로 묽어진다.[9]
과염소산의 탈수는 무수물인 이염소칠산화물을 생성한다.[10]
:2 HClO₄ + P₄O₁₀ → Cl₂O₇ + H₂P₄O₁₁
과염소산은 초강산의 하나이며, 가장 강한 브뢴스테드-로우리 산 중 하나이다. pKa가 -9보다 낮다는 것은, 일수화물이 별개의 히드로늄 이온을 포함하고 있으며, [H₃O⁺][ClO₄⁻]로 나타낼 수 있는 안정한 결정성 고체로 분리될 수 있다는 사실로 입증된다.[13] 최근 수용액 pKa의 추정치는 -15.2 ± 2.0이다.[3] 과염소산 이온이 약한 친핵체이기 때문에 최소한의 간섭으로 강한 산도를 제공한다. 플루오로붕산과 육불화인산 같은 불배위 음이온의 다른 산들은 가수분해되기 쉽지만, 과염소산은 그렇지 않다. 염의 폭발성과 관련된 위험에도 불구하고, 이 산은 특정 합성에서 종종 선호된다.[14] 이와 유사한 이유로, 이온교환 크로마토그래피에서 유용한 용리액이며, 알루미늄, 몰리브덴 및 기타 금속의 전해 연마 또는 에칭에도 사용된다.
황산, 질산과 마찬가지로 강산이며, 원래는 산소 원자의 유도 효과에 의해 매우 강한 산이지만, 묽은 수용액에서는 수평화 효과에 의해 염산 및 질산과 전리도에 현저한 차이는 보이지 않는다.
염소의 옥소산 중 가장 안정적이며, 유일하게 순수한 산을 단리할 수 있다. 하지만 불안정하여 가열 및 유기물과의 접촉으로 폭발하기 쉽고, 상온에서 3~4일 방치해도 과염소산 일수화물과 이산화염소칠산화물로 불균화한다.[22]
:
순수한 산은 물에 발열하며 격렬하게 용해되고, 그 용해열은 88.75kJ mol-1로 매우 크다.[21]
과염소산의 첫 번째 수화 엔탈피 변화 및 용해 엔탈피 변화는 다음과 같다.
:
:
과염소산 일수화물 (
4. 1. 수용액의 성질
수용액은 안정적이며, 60%(d=1.54g cm⁻³, 9.2 mol dm⁻³) 또는 70%(d=1.67g cm⁻³, 11.6 mol dm⁻³) 수용액이 시판된다.[23] 라만 분광법에 따르면 70% 정도의 농도까지는 완전히 전리하며,[23] 전리된 과염소산 이온(과염소산 수용액은 묽은 황산과 유사한 성질을 가지며, 상온에서는 휘발성이 없다. 묽은 수용액도 방치하면 농축되고, 옷에 묻은 채 방치하면 구멍이 뚫리는 점 등은 묽은 황산과 같다.
70% 정도 이하의 수용액은 산화 작용을 거의 보이지 않고 이온화 경향이 수소보다 큰 금속과 반응하여 수소를 발생시키지만, 과염소산은 거의 환원되지 않는다. 70% 이상의 과염소산과 발연 질산의 혼합물은 강한 산화 작용을 나타내며, 분석 화학에서 유기물의 산화 분해에 사용된다.[23]
수용액 중에서의 산 해리 상수는 직접 측정하기 어렵지만, 비수용매 중에서의 몇 가지 산의 산 해리 상수를 수용액 중의 것과 비교하여 추정한다.[24]
:
4. 2. 비수용매에서의 산 해리 평형
아세토니트릴, 프로필렌 카보네이트, 니트로메탄, 디메틸설폭사이드, 피리딘, 아세트산 등 다양한 비수용매에서 과염소산의 산 해리 상수(pKa)가 측정되었다.[25] N,N-디메틸포름아마이드 및 N-메틸피롤리돈에서는 강산으로 작용한다.[25] 이러한 해리 상수는 트리플루오로메탄술폰산과 거의 동등하거나 약간 더 강한 산성을 나타낸다.[25]
5. 과염소산 이온
과염소산 이온(過塩素酸イオン, perchlorate, ClO₄⁻)은 과염소산의 이온화에 의해 생성되는 1가의 음이온이다. 과염소산염 결정에서도 존재하며, 정사면체형 구조를 취한다. 과염소산나트륨 결정에서 Cl-O 간 결합 거리는 142.0-143.1 pm이며, 유사한 구조의 황산 이온(149 pm)과 비교하여 짧고, 더 강한 이중 결합 성격을 갖는 것으로 여겨졌다. 그러나 이론 계산에서는 Cl³⁺에 4개의 O⁻가 단일 결합으로 연결되어 있다는 옥텟 규칙을 만족하는 모형이 실제 계에 가장 가깝다는 것을 시사하고 있다[26].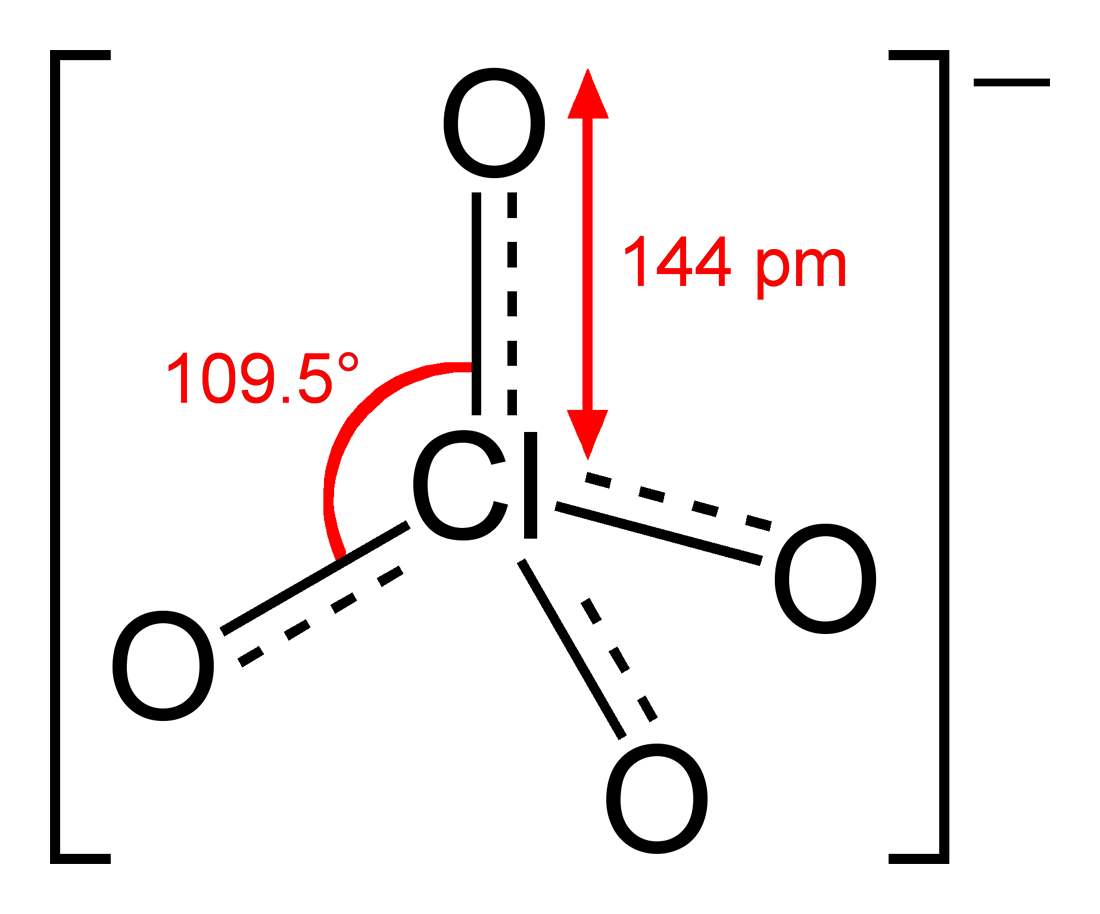
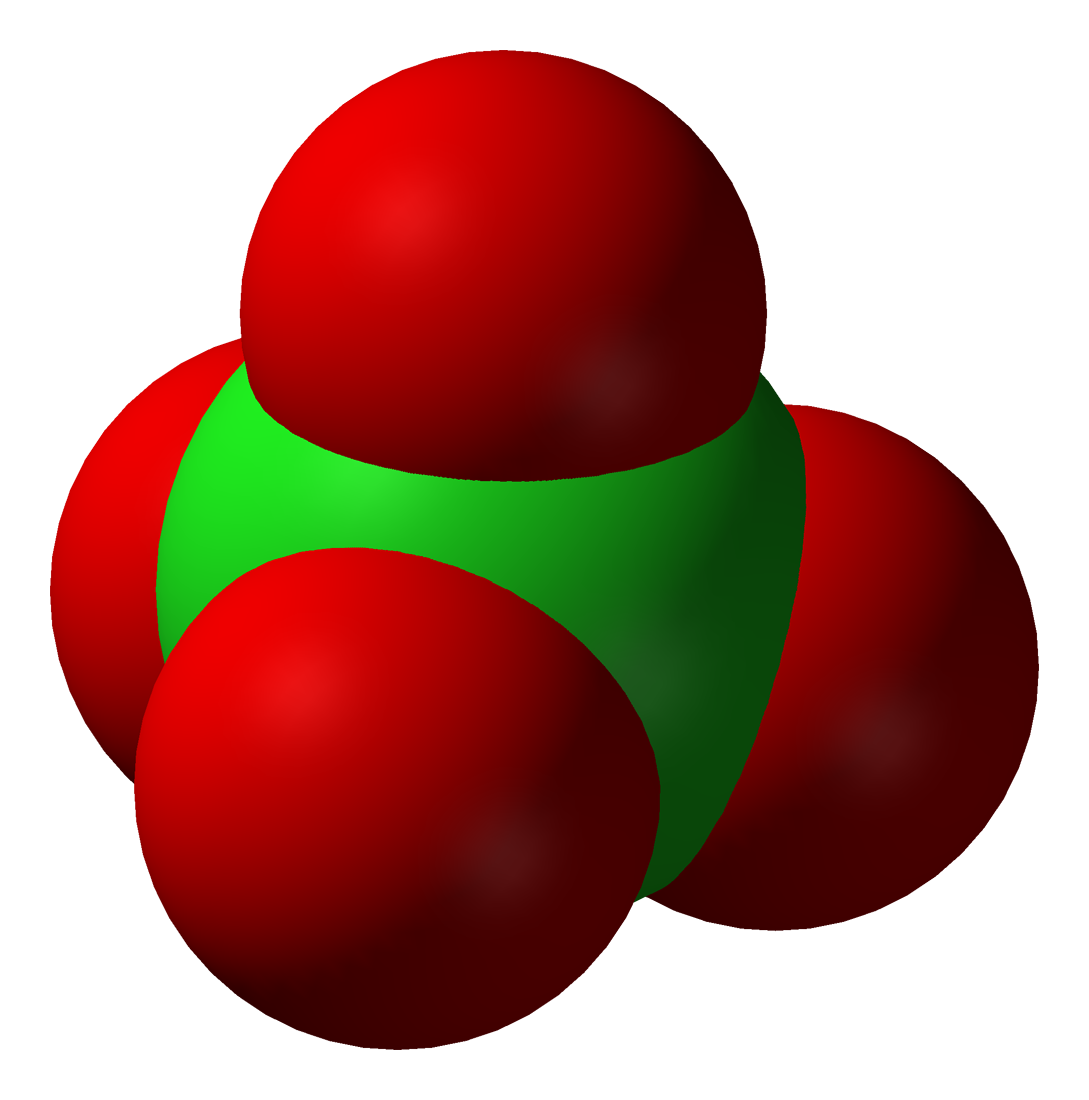
희석 수용액 중에서는 안정적이며 거의 산화 작용을 나타내지 않지만, 잠재적으로 높은 산화 작용을 가진다. 표준 산화 환원 전위는 다음과 같다.
:
:
수소, 황화수소, 아질산 및 요오드화수소 등에서는 환원되지 않고, 산성 조건에서 티타늄(III) 이온(Ti³⁺)에 의해 환원된다.
금속 이온에 대한 배위 결합이 약하고 착생성 상수가 작기 때문에, 금속 수화 이온의 연구에서 대응 이온으로, 그리고 과염소산염은 이온 세기 조절용 전해질로 사용된다.
6. 과염소산염
과염소산염(過塩素酸塩, perchlorate)은 과염소산 이온(ClO₄⁻)을 포함하는 이온 결정이며, 화약, 폭약에 자주 사용되는 강력한 산화제이다. 탄소, 황, 유기물 및 금속분 등과의 혼합물은 마찰, 충격 등에 의해 격렬하게 폭발한다. 대한민국 소방법에서는 위험물 제1류(산화성 고체)에 해당한다.
염소산염 수용액의 전기화학적 산화 및 과염소산에 금속 산화물을 용해시켜 제조된다.
많은 과염소산염은 흡습성으로 물에 잘 녹지만, 과염소산칼륨(KClO₄), 루비듐염 (RbClO₄), 세슘염 (CsClO₄) 및 테트라알킬암모늄염 (R₄NClO₄) 등은 물에 대한 용해도가 비교적 작다(물 100g에 대해 1~2g 정도).
주요 용도는 고체 로켓 추진제의 산화제이다. 과염소산칼륨이 처음 사용되기 시작했으며, 현재는 과염소산암모늄이 가장 중요한 염이 되고 있다. 과염소산리튬은 무게 당 산소량이 가장 많아 고체 추진제로서의 이용이 연구되고 있지만, 실용화되지는 않았다.
주요 과염소산염에는 다음이 있다.
- 과염소산암모늄
- 과염소산칼륨
- 과염소산칼슘(高氯酸钙)
- 과염소산은
- 과염소산나트륨
- 과염소산마그네슘
7. 용도
과염소산은 주로 로켓 연료에 사용되는 과염소산암모늄의 전구체로 생산된다. 로켓 기술의 발전으로 과염소산 생산량이 증가하여 매년 수백만 킬로그램이 생산된다.[6] 과염소산은 식각에서, 특히 액정 디스플레이 및 중요한 전자 응용 분야뿐만 아니라 광석 추출에도 가장 검증된 물질 중 하나이며, 분석 화학에서 독특한 특성을 지닌다.[11] 또한 크롬 식각에도 유용한 구성 요소이다.[12]
8. 안전성
과염소산은 폭발성이 있으며 상온에서 서서히 분해된다. 또한 매우 유독한 물질로 분류된다. 피부와 눈에 손상을 줄 수 있으며 유기물이 있으면 불붙거나 폭발할 수 있다. 과염소산의 염은 폭발성 반응에서 강한 산화제이다. 물과는 심하게 발열 반응을 한다.
강한 산화력 때문에 과염소산은 금속 및 목재, 플라스틱, 기름과 같은 가연성 물질과 격렬하게 반응할 수 있어 광범위한 규제를 받는다.[16] 과염소산을 취급하는 작업은 배기관에 산화제가 축적되는 것을 방지하기 위해 세척 기능이 있는 후드 내에서 수행되어야 한다.
1947년 2월 20일, 미국 캘리포니아주 로스앤젤레스에서 발생한 오코너 도금 공장 폭발 사고(O'Connor Plating Works disaster)로 17명이 사망하고 150명이 부상을 입었다. 알루미늄 가구의 전해 연마(electropolishing)에 사용되던 용액은 과염소산 75%, 무수 아세트산 35% (부피 비율)로 구성된 1000리터가 넘는 용액이었다. 과열된 용액에 철제 선반을 셀룰로오스 아세토부티레이트(Tenite-2 플라스틱) 코팅 선반으로 교체하는 과정에서 유기 화합물이 추가되었고, 몇 분 후 용액이 폭발했다.[17][18] 오코너 전기도금 공장과 다른 25개 건물, 40대의 자동차가 파괴되었고, 인근 250채의 주택이 피해를 입었다.
9. 한국의 규제
한국에서는 소방법 제2조 제7항 및 별표 제1에 따라 과염소산을 위험물 제6류(산화성 액체)로 지정하고 있다. 과염소산염은 위험물 제1류(산화성 고체)로 지정되어 관리된다.
참조
[1]
서적
Medicine and the Allied Sciences
https://books.google[...]
D. Appleton
[2]
웹사이트
Safety (MSDS) data for perchloric acid, 70%
http://msds.chem.ox.[...]
2022-02-24
[3]
학술지
Acidity of Strong Acids in Water and Dimethyl Sulfoxide
American Chemical Society (ACS)
2016-05-06
[4]
웹사이트
Perchloric Acid Environmental Health & Safety Michigan State University
https://ehs.msu.edu/[...]
2023-11-02
[5]
서적
Perchloric acid and perchlorates
The G. Frederick Smith Chemical Company
[6]
간행물
Chlorine Oxides and Chlorine Oxygen Acids
Wiley-VCH, Weinheim
[7]
학술지
Herstellung von Perchlorsäure durch anodische Oxydation von Chlor
[8]
서적
Handbook of Preparative Inorganic Chemistry
Academic Press
[9]
학술지
Hydrogen bond studies. XLV. The crystal structure of HClO4.2.5H2O
International Union of Crystallography (IUCr)
1971-05-15
[10]
서적
Inorganic chemistry
Academic Press
[11]
웹사이트
Perchloric Acid
http://www.gfschemic[...]
2014-01-14
[12]
웹사이트
Metal Etching
http://engineering.d[...]
[13]
서적
Perchlorate: environmental problems and solutions
CRC Press
[14]
간행물
2,4,6-Trimethylpyrilium Perchlorate
[15]
웹사이트
Perchloric Acid Environmental Health & Safety Michigan State University
https://ehs.msu.edu/[...]
2024-09-02
[16]
웹사이트
Materials Safety Data Sheet - Perchloric Acid, 60%, GR
http://www.setonreso[...]
2022-02-24
[17]
서적
Safety in the Metallographic Laboratory
ASTM Standardization News
[18]
뉴스
CALIFORNIA: The Amazing Brew
http://content.time.[...]
Time
1947-03-03
[19]
서적
Merck Index
[20]
서적
Merck Index
[21]
학술지
The NBS tables of chemical thermodynamics properties
[22]
서적
コットン・ウィルキンソン無機化学
培風館
[23]
서적
化学大辞典
共立出版
[24]
서적
溶液内の化学反応と平衡
丸善
[25]
서적
改訂4版化学便覧基礎編Ⅱ 無機化合物水溶液のモル伝導率
日本化学会
[26]
학술지
[27]
서적
Medicine and the Allied Sciences
[28]
웹사이트
Safety data for concentrated perchloric acid, ca. 70%
http://msds.chem.ox.[...]
[29]
웹사이트
Handling of Perchloric acid
https://www.ameslab.[...]
2018-03
[30]
학술지
Acidity of Strong Acids in Water and Dimethyl Sulfoxide
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

