동질효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
동질효소는 동일한 개체 내에서 동일한 기능을 수행하지만 유전적으로 다른 효소의 변이체를 의미한다. 유전자 중복, 배수체화, 핵산 혼성화 등의 과정을 통해 생성될 수 있으며, 알로자임과 같은 종류의 유전자에 기인하는 경우도 있다. 겔 전기영동과 같은 생화학적 분석을 통해 구별할 수 있으며, 질병 진단 및 유전자 마커로 활용되기도 한다. 과거 집단유전학 연구에 널리 사용되었으나, 현재는 DNA 기반 기술로 대체되는 추세이다.
더 읽어볼만한 페이지
- 효소 - 활성 부위
활성 부위는 효소 분자 내에서 기질과 결합하여 촉매 작용을 하는 특정 부위이며, 다양한 모델로 설명되고, 결합 부위, 촉매 부위, 보조인자를 포함하며, 저해제와 알로스테릭 부위와 관련되어 신약 개발에 활용된다. - 효소 - 제한 효소
제한 효소는 DNA의 특정 염기서열을 인식하여 절단하는 효소로, 유전체학과 생명공학 발전에 기여하여 노벨상을 수상했으며, 인식 서열 특이성 등에 따라 다양한 유형으로 분류되어 여러 연구 및 응용 분야에 활용된다. - 생화학 - 부패
부패는 미생물에 의한 유기체의 사후 분해 과정으로, 악취 물질 생성, 시신 외형 변화를 동반하며 환경적·내적 요인에 따라 속도가 달라지고 법의학 등에서 연구된다. - 생화학 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다.
2. 동질효소의 생성 기작 및 진화
동질효소는 1957년 R. L. 헌터와 클레멘트 마커트에 의해 처음 기술되었으며, 이들은 동질효소를 "동일한 기능을 가지고 동일 개체 내에 존재하는 동일 효소의 다른 변이체"로 정의했다.[8] 이 정의는 서로 다른 유전자 자리를 나타내는 효소 변이체(동질효소)와 동일한 유전자의 서로 다른 대립유전자의 산물인 효소(알로자임)를 포함한다.[9]
아이소자임은 엄밀히 말하면, 완전히 다른 유전자에 기인하는 협의의 아이소자임과, 같은 종류의 유전자 (단, 다른 개체의 유전자, 또는 동일 개체 내의 대립유전자로, 배열이 약간 다른)에 기인하는 알로자임(Allozyme)으로 나뉘지만, 어느 쪽이든 함께 아이소자임이라고 부르는 경우가 많다.
협의의 아이소자임에는 개체의 발달에 따라 비율이 변화하는 것(예를 들어 유아와 성인에서 종류가 다른)도 있다. 또한 혈액 속의 효소에는 질환에 따라 아이소자임의 비율이 변화하는 것(대표적인 것으로 이탈 효소의 젖산 탈수소 효소(LDH) 등)도 있으며, 아이소자임 분석은 질환의 종류나 부위를 특정하는 데 중요하다.
아이소자임 분석법으로는 효소 저해제에 의한 활성의 변화, 분자량이나 등전점(전기 영동을 사용), 항원-항체 반응에 의한 것 등이 사용된다.
아이소자임은 유전자형을 반영하므로, 간접적인 “유전자 마커”로 이용할 수 있다. 따라서 아이소자임 분석은 1960년대 이후, 생물의 분류나, 개체·개인의 유전적 성질에 관한 연구 등에 활발하게 사용되었다. 또한 다수의 개체를 모아서 전기 영동에 걸어 분석함으로써 유전자 빈도의 계산이 비교적 용이하므로, 집단 유전학의 도구로도 활발하게 이용되고 있다. 현재는 더 직접적으로 목적 유전자 DNA 또는 유전자 마커를 조사하는 방법 (분자 계통학, DNA 감식 등)으로 대체되어 가고 있다.
2. 1. 유전자 중복
동질효소는 일반적으로 유전자 중복의 결과이지만 배수체화 또는 핵산 혼성화에 의해서도 발생할 수 있다. 진화 시간이 지나면서 새로운 변이체의 기능이 원래의 기능과 동일하게 유지된다면 돌연변이가 축적됨에 따라 둘 중 하나가 소실되어 위유전자가 생성될 가능성이 높다.[10] 그러나 돌연변이가 효소의 기능을 즉시 방해하지 않고 대신 기능이나 발현 패턴을 수정하면 두 변이가 모두 자연선택에 의해 선호되고 다른 기능에 특화될 수 있다.[3] 예를 들어 다른 발현 단계 또는 다른 조직에서 발현될 수 있다.[11]2. 2. 배수체화 및 핵산 혼성화
동질효소는 일반적으로 유전자 중복의 결과이지만 배수체화 또는 핵산 혼성화에 의해서도 발생할 수 있다. 진화의 시간이 지나면서 새로운 변이체의 기능이 원래의 기능과 동일하게 유지된다면 돌연변이가 축적됨에 따라 둘 중 하나가 소실되어 위유전자가 생성될 가능성이 높아진다.[10] 그러나 돌연변이가 효소의 기능을 즉시 방해하지 않고 대신 기능이나 발현 패턴을 수정하면 두 변이가 모두 자연선택에 의해 선호되고 다른 기능에 특화될 수 있다.[10] 예를 들어 다른 발현 단계 또는 다른 조직에서 발현될 수 있다.[11]2. 3. 알로자임의 생성
알로자임은 점 돌연변이 또는 유전자의 암호화 서열에 영향을 미치는 삽입-결실(인델)로 인해 생성될 수 있다.[12] 새로운 알로자임에서 일어날 수 있는 세 가지 경우는 다음과 같다.- 새로운 대립유전자가 기능하지 않을 가능성이 가장 높다. 이 경우 적합도가 낮아지고 자연선택에 의해 개체군에서 제거될 것이다.[12]
- 변경된 아미노산 잔기가 효소의 비교적 중요하지 않은 부분(예: 활성 부위에서 멀리 떨어진 곳)에 있다면, 돌연변이는 선택적으로 중립이며 유전적 부동의 영향을 받을 수 있다.[13]
- 드물지만, 돌연변이로 인해 효소가 더 효율적이 되거나 약간 다른 화학 반응을 촉매할 수 있다. 이 경우 돌연변이는 적합도를 증가시키고 자연 선택에 의해 선호될 수 있다.[13]
3. 동질효소의 예
동질효소는 그 종류가 다양하며, 기능 및 특성에 따라 여러 가지 예시가 존재한다. 대표적인 동질효소는 다음과 같다.
- '''글루코키네이스''': 헥소키네이스의 변형으로, 특정 조건에서 다른 기능을 수행한다.
- '''젖산 탈수소효소(LDH)''': 조직에 따라 다른 조합으로 결합하는 사량체 효소이다.
- '''크레아틴 포스포키네이스(CPK)''': 포스포크레아틴과 크레아틴 간의 상호전환을 촉매하는 효소로, 3가지 동질효소가 존재한다.
- '''알칼리성 인산가수분해효소(ALP)''': 탄수화물 함량 차이에 따라 6가지 동질효소가 확인되었다.
- '''사이토크롬 P450''': 대사 및 스테로이드 생성에 중요한 역할을 한다.
- '''포스포다이에스터레이스''': 다양한 생물학적 과정에서 중요한 역할을 하며, 여러 형태로 존재한다.
이 외에도, 완전히 다른 유전자에 기인하는 협의의 동질효소와 같은 종류의 유전자에 기인하는 알로자임(Allozyme)이 있지만, 일반적으로 함께 동질효소라고 불린다. 개체의 발달에 따라 비율이 변화하는 동질효소도 존재한다.
동질효소 분석법으로는 효소 저해제에 의한 활성 변화, 분자량이나 등전점(전기 영동 사용), 항원-항체 반응에 의한 것 등이 사용된다.
동질효소는 유전자형을 반영하므로, 간접적인 “유전자 마커”로 이용될 수 있다. 1960년대 이후 생물의 분류나 개체의 유전적 성질에 관한 연구 등에 활발하게 사용되었으며, 집단 유전학의 도구로도 활용되었다. 현재는 DNA 또는 유전자 마커를 직접 조사하는 방법(분자 계통학, DNA 감식 등)으로 대체되어 가고 있다.
3. 1. 글루코키네이스
포도당 6-인산에 의해 저해되지 않는 헥소키네이스의 변형인 글루코키네이스는 동질효소의 한 예이다. 글루코키네이스의 다른 조절 기능과 포도당에 대한 낮은 친화도(다른 헥소키네이스에 비해)는 이자의 베타 세포에 의한 인슐린 방출 조절이나 간세포에 의한 글리코젠 합성 개시와 같은 특정 기관의 세포에서 다른 기능을 수행할 수 있도록 한다. 이 두 과정은 모두 포도당이 풍부한 경우에만 일어나야 한다.3. 2. 젖산 탈수소효소 (LDH)
젖산 탈수소효소는 H형과 M형의 두 가지 소단위체로 구성된 사량체이다. 이들은 조직에 따라 다른 조합으로 결합된다.[14]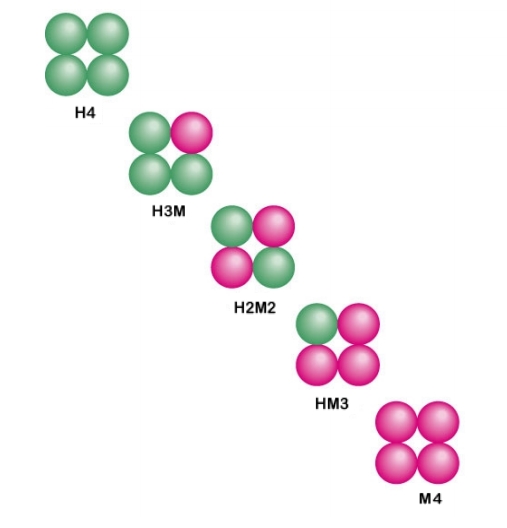

혈액 속의 효소에는 질환에 따라 동질효소의 비율이 변화하는 것이 있으며, 대표적인 예로 이탈 효소의 젖산 탈수소 효소(LDH)가 있다. 동질효소 분석은 질환의 종류나 부위를 특정하는 데 중요하다.[14]
3. 3. 크레아틴 포스포키네이스 (CPK)
크레아틴 키네이스(CK) 또는 크레아틴 포스포키네이스(CPK)는 포스포크레아틴의 크레아틴으로의 상호전환을 촉매한다.[14]CPK는 3가지 동질효소로 존재한다. 각 동질효소는 2개의 소단위체 M(근육), B(뇌) 또는 둘 다의 이량체이다.[14]
3. 4. 알칼리성 인산가수분해효소 (ALP)
알칼리성 인산가수분해효소(ALP)의 동질효소는 6가지가 확인되었다.[14] 이 효소는 단량체이며, 동질효소는 탄수화물 함량(시알산 잔기)의 차이 때문에 나타난다. 가장 중요한 알칼리성 인산가수분해효소는 α1-알칼리성 인산가수분해효소, α2-열 불안정성 알칼리성 인산가수분해효소, α2-열 안정성 알칼리성 인산가수분해효소, pre-β 알칼리성 인산가수분해효소 및 γ-알칼리성 인산가수분해효소이다. α2-열 불안정성 알칼리성 인산가수분해효소의 증가는 간염을 암시하는 반면, pre-β 알칼리성 인산가수분해효소는 뼈 질환을 나타낸다.3. 5. 사이토크롬 P450
사이토크롬 P450 동질효소는 대사와 스테로이드 생성에 중요한 역할을 한다.[1]3. 6. 포스포다이에스터레이스
다양한 형태의 포스포다이에스터레이스는 여러 생물학적 과정에서 중요한 역할을 한다. 이러한 효소의 한 가지 이상의 형태가 개별 세포에서 발견되었지만, 이러한 효소의 동질형은 생물체의 다양한 세포에 불균등하게 분포되어 있다. 임상적 관점에서 이들은 선택적으로 활성화 및 억제되는 것으로 밝혀져 치료에 사용하게 되었다.4. 동질효소의 구별
동질효소(동위효소)는 동일한 기능을 하는 효소의 변이체이다. 기질 및 효소 반응속도론과 같은 생화학적 특성이 동일하지 않은 경우 생화학적 분석으로 구별할 수 있다. 그러나 이러한 차이는 일반적으로 미묘하며, 특히 중성 변이체인 동위효소 사이에서는 더욱 그렇다. 기능이 크게 다른 두 효소가 동질효소로 확인되지 않았을 가능성이 높기 때문에 이러한 미묘함이 예상된다.[1]
동질효소는 효소 반응속도론에서 차이가 나는데, ''K''M과 Vmax 값이 서로 다르다.
아이소자임은 엄밀하게 말하면 서로 다른 유전자에서 비롯된 협의의 아이소자임과, 같은 종류의 유전자(단, 다른 개체의 유전자 또는 동일 개체 내의 대립유전자로 인해 배열이 약간 다른)에서 비롯된 알로자임(Allozyme)으로 나뉘지만, 어느 쪽이든 함께 아이소자임이라고 부르는 경우가 많다.
협의의 아이소자임에는 개체의 발달에 따라 비율이 변화하는 것(예: 유아와 성인에서 종류가 다른 것)도 있다.
혈액 속의 효소에는 질환에 따라 아이소자임의 비율이 변화하는 것(대표적으로 이탈 효소의 젖산 탈수소 효소(LDH) 등)도 있으며, 아이소자임 분석은 질환의 종류나 부위를 특정하는 데 중요하다.
아이소자임 분석법으로는 효소 저해제에 의한 활성 변화, 분자량이나 등전점(전기 영동 사용), 항원-항체 반응에 의한 것 등이 사용된다.
4. 1. 겔 전기영동
동질효소는 겔 전기영동을 통해 쉽게 확인할 수 있는데, 이는 효소의 전하를 변화시키는 아미노산 치환을 이용하는 방법이다. 이 방법은 동질효소를 분자 표지로 사용하는 기반이 된다.동질효소를 확인하기 위한 과정은 다음과 같다.
1. 동물 또는 식물 조직을 추출 완충액과 함께 갈아서 조단백질 추출물을 만든다.
2. 겔 전기영동을 통해 추출물의 성분을 전하에 따라 분리한다.
조직 내 모든 단백질이 겔에 존재하기 때문에, 개별 효소는 그 기능을 염색 반응과 연결하는 분석을 통해 식별해야 한다. 예를 들어, 효소 활성 영역에서 생성되는 NADH 또는 NADPH와 같은 보조 인자에 의해 환원될 때 불용성이 되는 테트라졸륨 염과 같은 가용성 지시약 염료의 국부적인 침전을 기반으로 검출할 수 있다.
이 분석 방법에서 중요한 점은 효소가 분리된 후에도 기능을 유지해야 한다는 것이다. 이러한 특징을 네이티브 겔 전기영동이라고 하며, 이는 실험 기술로서 동질효소를 사용하는 데 가장 큰 어려움을 제공한다.
4. 2. 기타 구별 방법
동질효소는 기능이 거의 동일하지만 다른 특징을 가질 수 있다. 특히 효소의 전하를 변화시키는 아미노산 치환은 젤 전기 영동으로 쉽게 확인할 수 있으며, 이는 동질효소를 분자 표지로 사용하는 기반이 된다.동질효소를 확인하기 위해 다음과 같은 과정을 거친다.
1. 동물 또는 식물 조직을 추출 완충액과 함께 갈아서 조단백질 추출물을 만든다.
2. 젤 전기 영동을 통해 추출물의 성분을 전하에 따라 분리한다.
- 과거에는 감자 전분으로 만든 젤을 사용했지만, 현재는 아크릴아마이드 젤이 더 나은 분해능을 제공한다.
조직의 모든 단백질이 젤에 존재하기 때문에, 효소의 기능을 염색 반응과 연결하는 분석법을 사용하여 개별 효소를 식별해야 한다. 예를 들어, 효소 활성 영역에서 생성되는 NADH 또는 NADPH와 같은 보조 인자에 의해 환원될 때 불용성이 되는 테트라졸륨 염과 같은 가용성 지시 염료의 국소적인 침전을 기반으로 검출할 수 있다. 이 분석 방법은 효소가 분리된 후에도 기능적이어야 하며(네이티브 젤 전기 영동), 실험 기술로서 동질효소를 사용하는 데 가장 큰 어려움을 제공한다.
동질효소는 효소 반응속도론에서 차이가 나는데, ''K''M과 Vmax 값이 서로 다르다.
아이소자임은 유전자형을 반영하므로, 간접적인 “유전자 마커”로 이용할 수 있다. 따라서 아이소자임 분석은 1960년대 이후, 생물의 분류나, 개체·개인의 유전적 성질에 관한 연구 등에 활발하게 사용되었다. 또한 다수의 개체를 모아서 전기 영동에 걸어 분석함으로써 유전자 빈도의 계산이 비교적 용이하므로, 집단 유전학의 도구로도 활발하게 이용되고 있다. 현재는 더 직접적으로 목적 유전자 DNA 또는 유전자 마커를 조사하는 방법 (분자 계통학, DNA 감식 등)으로 대체되어 가고 있다.
5. 동질효소의 활용
동질효소는 유전자형을 반영하므로 간접적인 "유전자 마커"로 이용될 수 있다. 1960년대 이후 생물의 분류나 개체, 개인의 유전적 성질에 관한 연구 등에 활발하게 사용되었다. 또한 여러 개체를 모아 전기 영동으로 분석하여 유전자 빈도를 비교적 쉽게 계산할 수 있어 집단 유전학의 도구로도 활용되었다. 현재는 분자 계통학, DNA 감식 등과 같이 더 직접적으로 목적 유전자 DNA 또는 유전자 마커를 조사하는 방법으로 대체되고 있다.
5. 1. 질병 진단
질환에 따라 혈액 속 효소에는 아이소자임 비율이 변화하는 것이 있다. 대표적인 예로 이탈 효소의 젖산 탈수소 효소(LDH) 등이 있으며, 아이소자임 분석은 질환의 종류나 부위를 특정하는 데 중요하다. 아이소자임 분석법으로는 효소 저해제에 의한 활성 변화, 분자량이나 등전점(전기 영동 사용), 항원-항체 반응에 의한 것 등이 사용된다.5. 2. 분자 표지자
과거에는 동질효소가 집단유전학에서 개체군 내 및 개체군 간의 유전적 변이의 원인과 영향을 연구하기 위한 분자 표지자로 널리 사용되었다. 지금은 DNA 시퀀싱, 단일염기 다형성, 미세부수체와 같은 DNA 기반 접근 방식이 더 유용한 정보를 제공하여 대체되었지만, 여전히 개발하기에 가장 빠르고 저렴한 표지자 시스템 중 하나이다. 특히 낮은 수준의 유전적 변이(예: 교배 방식 정량화)만 식별하면 되는 프로젝트에는 여전히 탁월한 선택이다.참조
[1]
논문
Multiple forms of enzymes: tissue, ontogenetic, and species specific patterns.
[2]
서적
Fundamental Genetics
McNaughton Publishing
2014
[3]
서적
The Biology Book: From the Origin of Life to Epigenetics, 250 Milestones in the History of Biology
Sterling
2015
[4]
서적
Genome
Grady-McPherson
2009
[5]
서적
Molecular Biology of the Cell
Garland Science
2017
[6]
논문
Models of genetics and natural selection: a current biomolecular understanding
2014
[7]
서적
Biochemistry
Books and Allied
2002
[8]
논문
Multiple forms of enzymes: tissue, ontogenetic, and species specific patterns.
[9]
서적
Fundamental Genetics
McNaughton Publishing
2014
[10]
서적
The Biology Book: From the Origin of Life to Epigenetics, 250 Milestones in the History of Biology
Sterling
2015
[11]
서적
Genome
Grady-McPherson
2009
[12]
서적
Molecular Biology of the Cell
Garland Science
2017
[13]
논문
Models of genetics and natural selection: a current biomolecular understanding
2014
[14]
서적
Biochemistry
Books and Allied
2002
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

