산–염기 적정
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
산-염기 적정은 산과 염기의 중화 반응을 이용하여 용액의 농도를 결정하는 부피 분석법이다. 19세기 후반 분석 화학의 발전과 함께 시작되었으며, 스반테 아레니우스의 아레니우스 이론이 이론적 토대를 제공했다. 알칼리 적정법과 산 적정법으로 나뉘며, 알려진 농도의 산 또는 염기를 미지 농도의 용액에 가하여 중화 반응이 완결되는 지점을 확인한다. 적정에는 뷰렛, 삼각 플라스크, 지시약 등이 사용되며, 지시약의 색 변화를 통해 종말점을 파악한다. 산-염기 적정은 제약, 환경 모니터링 등 다양한 분야에서 활용되며, 활성 의약품 성분의 농도 측정, 수질 시료의 산성도 평가 등에 기여한다.
더 읽어볼만한 페이지
| 산–염기 적정 | |
|---|---|
| 일반 정보 | |
| 정의 | 농도, 순도 또는 반응성을 결정하기 위해 분석 물질이 알려진 농도의 시약과 완전히 반응할 때까지 수행되는 정량적 화학 분석 방법 |
| 다른 이름 | 용량 분석 |
| 방법 | |
| 절차 | 적정의 일반적인 절차는 알려지지 않은 농도 또는 양의 분석 물질 샘플을 준비하고 적절한 농도와 정확한 농도를 아는 표준 시약인 적정제를 추가하는 것으로 시작한다. 적정제와 분석 물질 사이의 화학 반응은 알려져 있고 정량적이어야 한다. 반응은 알려진 양의 분석 물질이 적정제와 반응하는 지점인 당량점에 도달할 때까지 모니터링된다. 당량점은 종종 지시약을 사용하여 시각적으로 감지된다. 지시약은 반응 중에 눈에 띄는 색상 변화를 겪어 반응이 완료되었음을 나타낸다. |
| 적정 유형 | |
| 산-염기 적정 | 산과 염기 사이의 중화 반응을 기반으로 한다. |
| 산화 환원 적정 | 산화 환원 반응을 기반으로 한다. |
| 복합체 형성 적정 | 복합체 형성을 기반으로 한다. |
| 침전 적정 | 침전 반응을 기반으로 한다. |
| 응용 분야 | |
| 식품 산업 | 식품의 산도 결정 |
| 제약 산업 | 제약 화합물의 순도 분석 |
| 환경 모니터링 | 물 샘플의 오염 물질 농도 측정 |
| 장점 | |
| 정확성 | 정확하고 신뢰할 수 있는 결과를 제공한다. |
| 단순성 | 비교적 간단하고 저렴하다. |
| 다양성 | 다양한 화학 물질 분석에 사용될 수 있다. |
2. 역사
산-염기 적정은 중화 반응을 이용하는 부피 분석의 한 종류로,[7] 크게 두 가지로 나뉜다.
산-염기 적정의 역사는 19세기 후반, 분석 화학의 발전으로 정량 분석을 위한 체계적인 기술 개발이 이루어지면서 시작되었다.[5] 적정 방법의 기원은 1800년대 중반 카를 프리드리히 모어와 같은 화학자들의 연구와 관련이 있다.[5] 그의 연구는 산과 염기를 포함하는 적정에 대한 이해의 기초를 마련했다.
이론적인 발전은 19세기 후반 스웨덴 화학자 스반테 아레니우스의 연구와 함께 이루어졌다. 그는 아레니우스 이론을 도입하여 산-염기 반응에 대한 이론적 틀을 제공했다.[6] 이러한 이론적 토대와 지속적인 실험적 개선은 산-염기 적정을 정확하고 널리 적용 가능한 분석 방법으로 발전시키는 데 기여했다.[6]
시간이 지나면서 이 방법은 더욱 개선되고 다양한 분야에 적용되어, 오늘날 여러 과학 분야의 실험실에서 필수적인 도구로 자리 잡았다.
3. 종류
3. 1. 알칼리 적정법 (Alkalimetry)
알칼리 적정법은 산 적정법과 마찬가지로 중화 반응을 이용하는 부피 분석법의 한 종류이다.[7] 구체적으로, 농도를 아는 표준 염기 용액(적정액)을 사용하여 미지의 농도를 가진 산성 물질 용액(피적정액)의 농도를 결정하는 분석 방법이다.[8]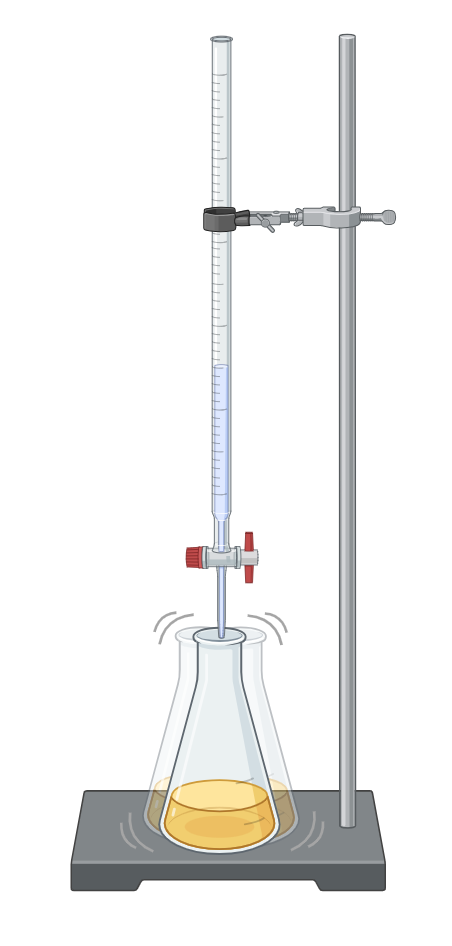
중화 반응의 일반적인 화학 반응식은 다음과 같다.
:산 + 염기 → 염 + 물
알칼리 적정 과정에서는 표준 용액인 염기(적정액)를 뷰렛에 넣고, 농도를 모르는 산 용액(분석물/피적정액)은 지시약과 함께 삼각 플라스크에 담아 뷰렛 아래에 둔다.[9] 뷰렛의 염기 용액을 삼각 플라스크의 산 용액에 조금씩 첨가하며 반응시킨다. 산과 염기가 정확히 반응하는 화학량론적 당량점에 도달하면 용액은 중성이 된다.[7]
강산(황산, H2SO4)을 표준 염기 용액으로 적정하는 알칼리 적정의 예시는 다음과 같다.
:H2SO4 + 2 OH− → SO42- + 2 H2O
이 반응에서 황산은 첨가된 염기에 의해 완전히 중화된다. 당량점까지 소비된 표준 염기 용액의 부피를 측정하면, 이를 통해 원래 산 용액의 농도를 계산할 수 있다.
3. 2. 산 적정법 (Acidimetry)
산 적정법은 산–염기 적정의 한 종류로, 농도를 정확히 아는 표준 산 용액을 사용하여 염기성 물질의 농도를 결정하는 분석 방법이다.[8] 이 방법은 기본적인 반응으로 중화 반응을 이용하며,[7] 약한 염기와 강한 염기 모두의 농도를 알아내는 데 사용할 수 있다.[8]
일반적으로 농도를 아는 표준 용액(적정액)은 뷰렛에 넣고, 농도를 모르는 용액(피적정액)은 지시약과 함께 삼각 플라스크에 담아 적정을 진행한다.[9]
산 적정법에서 강한 염기를 분석하는 예시는 다음과 같다.
:Ba(OH)2 + 2 H+ → Ba2+ + 2 H2O
이 반응에서는 강한 염기인 수산화 바륨(Ba(OH)2) 용액에 표준 산 용액을 조금씩 가하여, 용액 속의 염기가 모두 중화될 때까지 반응시킨다. 반응이 완결된 지점(당량점)까지 사용된 표준 산 용액의 부피를 측정하면, 원래 용액에 들어있던 염기의 농도를 계산할 수 있다.
4. 원리
알칼리 적정법과 산 적정법은 기본적인 반응이 중화 반응인 부피 분석의 한 유형이다. 이 방법들은 알려진 농도의 산 또는 염기(적정액)를 농도를 모르는 용액(피적정액)에 조절하여 첨가하며, 반응이 화학량론적 당량점에 도달할 때까지 진행한다. 이 지점에서는 산과 염기의 몰수가 같아지고 용액은 중성이 된다.[7]
일반적인 중화 반응식은 다음과 같다.
: 산 + 염기 → 염 + 물
예를 들어, 염산(HCl)과 수산화 나트륨(NaOH)의 반응은 다음과 같다.
: HCl + NaOH → NaCl + H2O
산 적정법은 표준 산 용액을 사용하여 염기성(알칼리성) 물질의 농도를 결정하는 산-염기 적정의 한 방법이다. 이는 약한 염기와 강한 염기 모두에 사용할 수 있다.[8] 강한 염기가 포함된 산 적정의 예는 다음과 같다.
: Ba(OH)2 + 2 H+ → Ba2+ + 2 H2O
이 경우, 강한 염기(Ba(OH)2)는 모든 염기가 반응할 때까지 산에 의해 중화된다. 이를 통해 사용된 표준 산 용액의 부피로부터 원래 염기의 농도를 계산할 수 있다.
알칼리 적정법은 동일한 개념을 따르지만, 표준 염기 용액을 사용하여 산성 물질의 농도를 결정한다.[8] 강산이 포함된 알칼리 적정의 예는 다음과 같다.
: H2SO4 + 2 OH− → SO42- + 2 H2O
이 경우, 강산(H2SO4)은 모든 산이 반응할 때까지 염기에 의해 중화된다. 이를 통해 사용된 표준 염기 용액의 부피로부터 원래 산의 농도를 계산할 수 있다.
실험 시, 표준 용액(적정액)은 뷰렛에 넣고, 농도를 알 수 없는 용액(분석물/피적정액)은 지시약과 함께 그 아래의 삼각 플라스크에 넣는다.[9]
5. 지시약
지시약은 산–염기 적정에서 종말점을 시각적으로 확인하기 위해 사용되는 물질이다.[10] 지시약은 특정 pH 범위에서 뚜렷한 색깔 변화를 나타내므로, 용액의 산성 또는 염기성 정도를 판단하는 데 도움을 준다.[10] 성공적인 적정을 위해서는 반응의 당량점 부근에서 색깔이 변하는 지시약을 신중하게 선택하는 것이 중요하다.[10] 지시약의 색깔이 변하는 지점을 종말점이라고 부르며,[10] 정확한 적정 결과를 얻으려면 이 종말점이 실제 당량점과 최대한 가까워야 한다. 지시약은 화학 및 생물학 분야에서 용액의 pH를 측정하고 반응의 진행 상황을 파악하는 데 필수적인 도구로 활용된다.[10]
5. 1. 지시약 선택
적절한 pH 지시약을 선택하는 것은 산–염기 적정의 종말점을 정확하게 감지하는 데 매우 중요하다.[10] 지시약의 색상 변화는 반응의 당량점 근처에서 일어나야 실험자가 반응이 완료된 시점을 정확히 알 수 있다.[10] 당량점에서의 pH는 반응하는 산과 염기의 종류에 따라 다음과 같이 대략적으로 예측할 수 있다.- 강산과 강염기가 반응하면 중성 (pH = 7) 용액이 된다.[10] 이 경우, 변색 범위가 중성 pH 근처인 브로모티몰 블루 (pH 6.0-7.6) 등이 적합하다.[11]
- 강산과 약염기가 반응하면 산성 (pH < 7) 용액이 된다.[10] 따라서 산성 범위에서 색이 변하는 메틸 오렌지 (pH 3.1-4.4) 등을 사용한다.[11]
- 약산과 강염기가 반응하면 염기성 (pH > 7) 용액이 된다.[10] 이때는 염기성 범위에서 변색되는 페놀프탈레인 (pH 8.3-10.0) 등이 주로 사용된다.[11]
약산과 약염기의 적정은 중화점 부근에서 지시약의 색 변화가 뚜렷하지 않고 빠르게 일어나 관찰하기 어렵기 때문에 자주 사용되지 않는다.[13] 이 경우 당량점의 pH는 산과 염기의 상대적인 세기에 따라 결정되며, 만약 두 물질의 해리 상수가 비슷하다면 당량점은 중성(pH ≈ 7) 부근이 된다.[13]

페놀프탈레인은 화학 실험에서 가장 널리 사용되는 산-염기 지시약 중 하나이다.[12] 넓은 pH 범위에서 효과적이며, 무색에서 분홍색으로 변하는 뚜렷하고 쉽게 감지할 수 있는 색상 변화 때문에 많이 사용된다.[12][11] 이러한 특징 덕분에 페놀프탈레인은 산-염기 적정의 종말점을 결정하는 데 매우 유용하다.[12]
지시약의 색상이 변하는 지점을 종말점이라고 부른다.[10] 이상적인 지시약은 종말점이 반응의 실제 당량점과 가능한 한 가까운 것을 선택해야 한다.[10]
다음 표는 다양한 지시약과 그 특성을 보여준다.
| 지시약 이름 | 지시약 색상 | 전환 간격(pH 범위) | 높은 pH 조건 이후의 색상 |
|---|---|---|---|
| 메틸 오렌지 | 오렌지/빨강 | 3.1 - 4.4 | 노란색 |
| 메틸 레드 | 빨강 | 4.4 - 6.3 | 노란색 |
| 콩고 레드 | 파란색 | 3.0 - 5.2 | 빨강 |
| 페놀프탈레인 | 무색 | 8.3 - 10.0 | 분홍색 |
| 티몰프탈레인 | 무색 | 9.3 - 10.5 | 파란색 |
| 브로모페놀 블루 | 노란색 | 3.0 - 4.6 | 파란색 |
| 브로모크레졸 그린 | 노란색 | 3.8 - 5.6 | 파란색 |
| 티몰 블루 | 빨강 | 1.2 - 2.8; 8.0 - 9.6 | 파란색 |
| 크레졸 레드 | 노란색 | 7.2 - 8.8 | 보라색 |
| 중성 레드 | 빨강 | 6.8 - 8.0 | 노란색 |
매우 강한 염기(pH > 13.5)와 상대적으로 약한 산(pH > 5.5)의 적정에는 알리자린 옐로우가 사용될 수 있으며, 반대로 매우 강한 산(pH < 0.5)과 상대적으로 약한 염기(pH < 8.5)의 적정에는 티몰 블루가 사용되기도 한다.
지시약 용액 외에도, 여러 지시약을 혼합하여 만든 pH 종이도 간편하게 사용될 수 있다.[13] pH 종이를 용액에 담가 색 변화를 관찰하고, 함께 제공된 색상 기준표와 비교하여 용액의 pH를 추정할 수 있다.[13]
5. 2. 주요 지시약
적정의 종말점을 알아내려면 적절한 pH 지시약을 선택해야 한다.[10] 지시약의 색상 변화나 다른 효과는 반응의 당량점 근처에서 나타나야 실험자가 반응이 완료된 시점을 정확하게 판단할 수 있다. 당량점의 pH는 다음과 같은 규칙을 사용하여 근사할 수 있다.- 강산은 강염기와 반응하여 중성(pH = 7) 용액을 형성한다.
- 강산은 약염기와 반응하여 산성(pH < 7) 용액을 형성한다.
- 약산은 강염기와 반응하여 염기성(pH > 7) 용액을 형성한다.
이러한 지시약은 화학 및 생물학에서 필수적인 도구로, 색상 변화를 관찰하여 용액의 산성 또는 염기성을 결정하는 데 도움을 준다.[10] 아래 표는 지시약 선택에 참고할 수 있는 자료로, 각 지시약의 pH 변화 범위와 색상 변화 정보를 제공한다.
| 지시약 이름 | 낮은 pH 조건에서의 색상 | 전환 간격(pH 범위) | 높은 pH 조건에서의 색상 |
|---|---|---|---|
| 메틸 오렌지 | 오렌지/빨강 | 3.1 - 4.4 | 노란색 |
| 메틸 레드 | 빨강 | 4.4 - 6.3 | 노란색 |
| 콩고 레드 | 파란색 | 3.0 - 5.2 | 빨강 |
| 페놀프탈레인 | 무색 | 8.3 - 10.0 | 분홍색 |
| 티몰프탈레인 | 무색 | 9.3 - 10.5 | 파란색 |
| 브로모페놀 블루 | 노란색 | 3.0 - 4.6 | 파란색 |
| 브로모크레졸 그린 | 노란색 | 3.8 - 5.6 | 파란색 |
| 티몰 블루 | 빨강 | 1.2 - 2.8; 8.0 - 9.6 | 파란색 |
| 크레졸 레드 | 노란색 | 7.2 - 8.8 | 보라색 |
| 중성 레드 | 빨강 | 6.8 - 8.0 | 노란색 |
페놀프탈레인은 화학에서 가장 흔하게 사용되는 산-염기 지시약 중 하나이다.[12] 넓은 pH 범위에서 효과적이고 색상 변화가 뚜렷하여 널리 쓰인다.[12] 선명하고 쉽게 감지할 수 있는 색상 변화 덕분에 페놀프탈레인은 산-염기 적정의 종말점을 결정하는 데 유용한 도구이며, 정확한 pH 변화는 반응의 완료를 의미한다.
약산이 약염기와 반응할 때는, 염기의 세기가 더 강하면 당량점 용액은 염기성이 되고, 산의 세기가 더 강하면 산성이 된다. 만약 두 물질의 세기가 같다면 당량점의 pH는 중성이다.[13] 그러나 약산과 약염기의 적정은 지시약의 색상 변화가 매우 빠르게 일어나 관찰하기 어렵기 때문에 자주 사용되지는 않는다.
지시약의 색상이 변하는 지점을 종말점이라고 한다.[10] 적절한 지시약을 선택해야 하며, 가급적 반응의 당량점 근처에서 색상 변화(종말점)가 나타나는 지시약을 고르는 것이 좋다.
다양한 지시약 용액 외에도, 여러 지시약을 혼합하여 만든 종이나 플라스틱 형태의 pH 종이도 실용적인 대안으로 사용된다.[13] pH 종이 조각을 용액에 담근 후 나타나는 색상을 용기에 표시된 기준 색상표와 비교하여 용액의 pH를 추정할 수 있다.[13]
6. 오버슛 적정 (Overshot titration)

오버슛 적정은 흔히 발생하는 현상으로, 화학적 적정 과정에서 첨가된 적정액의 부피가 당량점에 도달하는 데 필요한 양을 초과하는 상황을 말한다.[14] 이러한 적정액의 과량 첨가는 용액을 약간 더 알칼리성으로 만들거나 과도하게 산성화시키는 결과를 초래한다.[14]
당량점 초과는 뷰렛 판독 오류, 불완전한 반응 화학량론 또는 종말점 검출 문제 등 다양한 요인으로 인해 발생할 수 있다.[14] 오버슛 적정의 결과는 분석 결과의 정확도에 영향을 미칠 수 있으며, 특히 정량 분석에서 더욱 그렇다.[14]
연구자 및 분석가들은 오버슛의 영향을 완화하고 신뢰할 수 있고 정확한 측정을 얻기 위해 역적정[15] 및 보다 정밀한 적정 기술 사용과 같은 교정 조치를 자주 사용한다. 오버슛 적정과 관련된 원인, 결과 및 해결책을 이해하는 것은 화학 분야에서 정확하고 재현 가능한 결과를 얻는 데 매우 중요하다.
7. 수학적 분석 (약산의 적정)
농도를 계산하기 위해 ICE 표를 사용할 수 있다.[16][1]
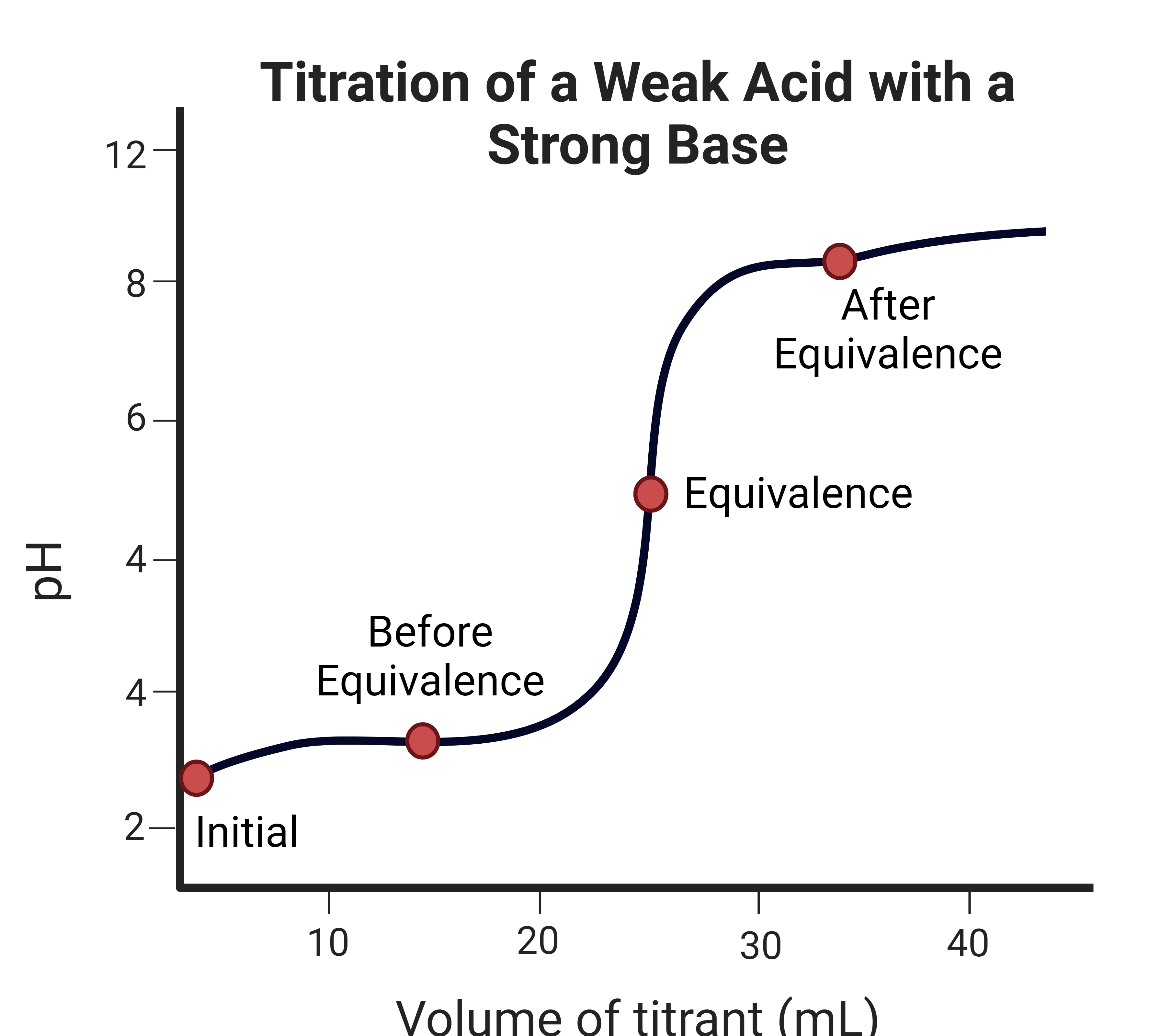
약산 용액을 강염기 용액으로 적정할 때 용액의 pH 변화는 과정의 여러 지점에서 계산할 수 있으며, 크게 다음 네 가지 범주로 나뉜다.[17][26]
# 초기 pH
# 당량점 전 pH (중화점까지의 pH)
# 당량점 pH (중화점에서의 pH)
# 당량점 후 pH (중화점 이후의 pH)
아래 설명된 계산 방법은 약산의 농도가 산 해리 상수 의 1000배 이상일 경우에 유효한 근사적인 방법이다. 만약 이 조건에 해당하지 않는다면, 근사를 사용하지 않고 ICE 표 등을 이용한 더 정확한 계산이 필요하다.
'''1. 초기 pH'''
적정을 시작하기 전, 물 속의 약산(HA) 용액의 초기 pH는 다음 식으로 근사적으로 계산할 수 있다.[1]
:
여기서 는 약산의 산 해리 상수이고, 는 약산 용액의 초기 농도이다. 이는 초기 히드로늄 이온 농도()를 이용하여 로 표현할 수도 있다.
'''2. 당량점 전 pH'''
당량점에 도달하기 전에는 용액 내에 아직 반응하지 않은 약산(HA)과 적정 과정에서 생성된 그것의 짝염기(A-)가 함께 존재한다. 이 영역에서의 pH는 헨더슨-하셀바흐 방정식을 이용하여 계산할 수 있다.[1]
:
여기서,
- 는 약산의 산 해리 상수()에 로그를 취하고 음의 부호를 붙인 값 (산 해리 지수)이다.
- 는 용액에 첨가된 강염기(OH-)의 몰수이다.
- 는 적정 시작 전 용액에 있던 약산(HA)의 초기 몰수이다.
특히, 첨가된 염기의 양이 초기 산의 양의 절반이 되는 지점(즉, )에서는 항의 진수가 1이 되어 이 되므로, 가 된다. 이 지점을 반당량점이라고 한다.
'''3. 당량점 pH'''
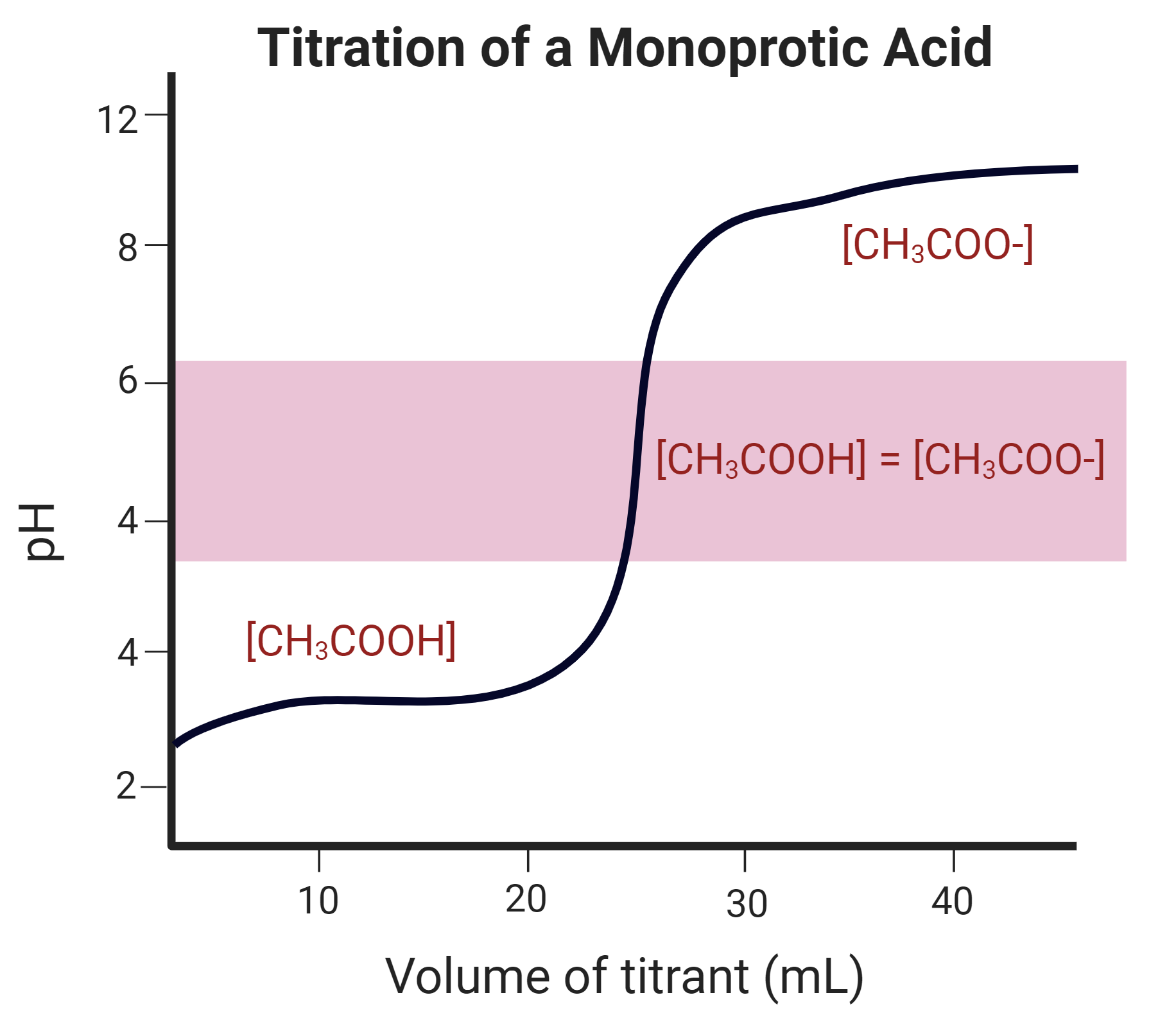
당량점에서는 초기 약산이 첨가된 강염기와 정확히 반응하여 모두 짝염기(A-)로 전환된다. 이 짝염기는 물과 반응하여 OH- 이온을 생성하므로 (가수분해), 약산과 강염기의 적정에서 당량점의 pH는 7보다 크다. 당량점에서의 pH는 다음 관계식들을 이용하여 계산할 수 있다.[1]
- 수용액에서 항상 성립하는 관계: (25°C 기준)
- 산과 그 짝염기의 해리 상수 관계: (여기서 는 짝염기의 염기 해리 상수, 는 물의 이온화 상수)
- 당량점에서의 조건: (여기서 는 농도, 는 부피, 아래첨자 는 산, 는 염기를 의미)
이 관계들을 이용하면 당량점에서의 pH는 다음과 같이 계산된다.
:
여기서 는 초기 산의 농도, 는 사용된 염기의 농도이다. 또는 수산화 이온 농도()를 먼저 계산한 뒤 를 이용하여 pH를 구할 수도 있다.
'''4. 당량점 후 pH'''
당량점을 지나 계속해서 강염기를 첨가하면, 용액에는 약산의 짝염기와 과량으로 첨가된 강염기가 함께 존재하게 된다. 하지만 강염기는 약산의 짝염기보다 훨씬 강한 염기이므로, 이 영역에서의 pH는 주로 과량의 강염기 농도에 의해 결정된다. 따라서 pH는 다음 식을 사용하여 계산할 수 있다.[1]
:
여기서 와 는 각각 초기 산의 농도와 부피이고, 와 는 각각 첨가된 염기의 농도와 현재까지 첨가된 총 부피이다. 분자()는 당량점을 지나 과량으로 첨가된 염기의 몰수를 나타내고, 분모()는 용액의 총 부피를 나타낸다.
'''단일 공식'''
약산과 강염기의 적정 과정 전체를 설명하는 단일 공식도 존재한다.[18][27]
:
또한, 약산의 이온화된 비율 는 다음과 같이 정의된다.
:
여기서 각 기호는 다음을 의미한다.
- : 적정 완료율 또는 진행도 (당량점 이전: φ < 1, 당량점: φ = 1, 당량점 이후: φ > 1)
- : 각각 산과 염기의 초기 농도
- : 각각 산과 염기 용액의 부피 (Va는 초기 산의 부피, Vb는 첨가된 염기의 부피)
- : 이온화된 약산(즉, 짝염기 A- 형태)의 비율
- : 약산의 산 해리 상수
- : 각각 수소 이온 (또는 히드로늄 이온)과 수산화 이온의 평형 농도
이 식은 다소 복잡하지만, 적정의 모든 단계에서 pH 변화를 하나의 식으로 나타낼 수 있게 해준다.
8. 그래프 방법
단일 양성자산 및 염기 적정 과정의 모든 단계와 관련된 pH를 식별하는 것은 비교적 간단하다. 단일 양성자산은 한 개의 양성자를 내놓는 산이며, 단일 양성자 염기는 한 개의 양성자를 받아들이는 염기이다. 단일 양성자산 또는 염기는 적정 곡선에서 하나의 당량점만 갖는다.[13][9]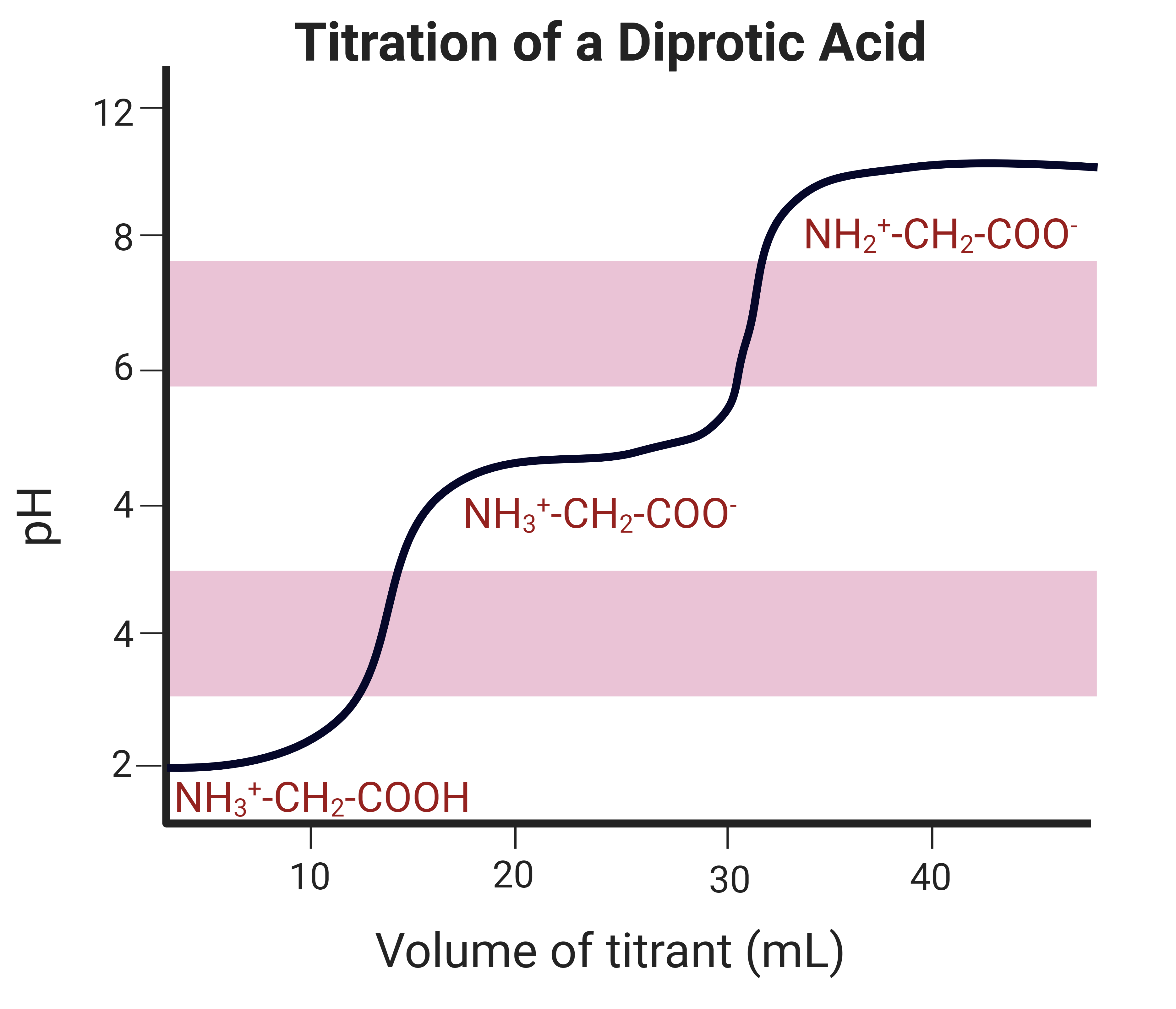
이양성자산은 두 개의 양성자를 내놓고 이양성자 염기는 두 개의 양성자를 받아들인다. 이양성자 용액에 대한 적정 곡선은 두 개의 당량점을 갖는다.[13][9] 다양성자 물질은 여러 개의 당량점을 갖는다.[9]
모든 적정 반응에는 그래프에서 수평으로 나타나는 작은 완충 영역이 포함되어 있다. 이러한 영역에는 비슷한 농도의 산과 염기가 포함되어 있어, 추가적인 산 또는 염기를 첨가할 때 pH가 급격하게 변하는 것을 방지한다.[19][9]
약산 용액을 강염기로 적정했을 때의 pH 변화는 다음의 4가지 단계로 나누어 볼 수 있다.[26]
# 최초 pH
# 중화점까지의 pH
# 중화점에서의 pH
# 중화점 이후의 pH
아래 설명하는 식들은 약산의 농도가 산 해리 상수 의 1000배 이상일 경우에만 대략적으로 성립한다. 만약 그렇지 않은 경우에는 근사를 사용하지 않고 더 정확하게 계산해야 한다.
'''1. 최초 pH'''
약산 용액의 경우 초기 pH는 대략 다음 식으로 나타낼 수 있다.
:
여기서 는 산 해리 상수, 는 산 용액의 초기 농도이다.
'''2. 중화점까지의 pH'''
이 구간의 pH는 존재하는 약산과 생성된 짝염기의 양에 따라 결정된다. 헨더슨-하셀바흐 방정식을 변형한 다음 식을 사용하여 임의 지점에서의 pH를 계산할 수 있다.
:
단,
- 는 약산의 산 해리 지수 (산 해리 상수에 로그를 취하고 음의 부호를 붙인 값)
- 는 용액에 첨가된 강염기의 몰수
- 는 적정 시작 전 초기 약산의 몰수
이다.
첨가된 염기의 양()이 초기 산의 양의 절반()이 되면, 로그 항의 분자와 분모가 같아져() 로그 값은 0이 된다. 이 지점에서 pH는 pKa와 같아지며, 이는 중화점까지의 절반 지점에 해당한다.
'''3. 중화점에서의 pH'''
중화점에서는 약산이 완전히 중화되어 모두 짝염기로 변한다. 따라서 용액은 염기성을 띠게 되어 pH는 7보다 크다. 중화점에서의 pH는 다음 관계식들을 이용하여 구할 수 있다.
# (물의 이온곱 상수 관련식)
# (산 해리 상수와 염기 해리 상수의 관계)
# 중화점에서 (산과 염기의 몰수가 같음)
위의 세 가지 관계를 이용하여 중화점에서의 pH를 구하는 식은 다음과 같다.
:
- 여기서 는 산의 초기 농도, 는 염기의 농도이다.
- 는 물의 이온화 상수, 는 산 해리 상수이다.
산이 염기에 의해 중화될 때의 pH는 산과 염기의 상대적인 강도에 따라 달라진다. 만약 강산과 강염기를 적정한다면 중화점의 pH는 정확히 7이 된다.
'''4. 중화점 이후의 pH'''
중화점을 지나면 용액에는 두 종류의 염기가 존재한다. 하나는 약산이 중화되어 생성된 짝염기이고, 다른 하나는 과량으로 첨가된 강염기이다. 하지만 첨가된 강염기가 짝염기보다 훨씬 강한 염기이므로, 용액의 pH는 주로 과량의 강염기에 의해 결정된다. 따라서 용액의 pH는 다음 식으로 계산할 수 있다.
:
이상의 pH 변화는 다음의 단일 식으로 더 정확하게 나타낼 수도 있다.[27]
:
:
- 는 적정의 진행도 (중화점 이전 φ < 1, 중화점 φ = 1, 중화점 이후 φ > 1)
- 는 각각 산과 염기의 농도
- 는 각각 산과 염기 용액의 부피
- 는 이온화된 약산의 비율
- 는 산의 이온화 상수
- 는 각각 수소 이온과 수산화 이온의 농도
이 식은 다소 복잡하지만, 중화 적정 과정 전체에서의 pH 변화를 하나의 식으로 표현한다.
적정 과정에서의 pH 계산은 순수한 산과 순수한 염기의 경우 비교적 간단하다. 특히 양성자를 하나만 내놓거나 받는 산과 염기의 중화 반응은 계산이 쉽다. 그러나 여러 개의 양성자를 내놓거나 받을 수 있는 다양성자 산이나 염기의 경우 계산이 훨씬 복잡해진다. 이러한 복잡한 평형계를 설명하기 위해 평형 그래프(equiligraph)[28]와 같은 이론적 방법들이[29] 사용되기도 했지만, 실제 활용도는 높지 않다.
9. 응용
산-염기 적정은 다양한 산업 및 연구 분야에서 널리 활용되는 기본적인 분석 기법이다. 대표적으로 제약 산업에서는 의약품의 품질 관리와 개발에 필수적인 역할을 수행하며, 환경 모니터링 분야에서는 수질 및 토양 분석 등을 통해 환경 상태를 평가하는 데 중요한 도구로 사용된다.
9. 1. 제약 분야

제약 산업에서 산-염기 적정은 다양한 분야에 적용되는 기본적인 분석 기법이다. 주요 용도 중 하나는 의약품 제제 내 활성 의약품 성분 (API)의 농도를 결정하여 제품 품질을 보장하고 규제 기준을 준수하는 것이다.[20]
산-염기 적정은 제약 화합물의 산성 또는 염기성 작용기를 정량화하는 데 특히 유용하다. 또한, 이 방법은 첨가제 또는 성분 분석에도 사용되어 제품 제조 방식을 조정하고 제어하는 것을 더 쉽게 만든다.[21] 품질 관리 실험실에서는 산-염기 적정을 사용하여 원자재의 순도를 평가하고 약물 제조 공정의 다양한 단계를 모니터링한다.[21]
이 기법의 신뢰성과 단순성은 제약 연구 및 개발에서 필수적인 도구로 만들어 안전하고 효과적인 의약품 생산에 기여한다.
9. 2. 환경 모니터링

산-염기 적정은 수질 시료의 산성 또는 알칼리성을 정량적으로 분석하여 환경 모니터링에서 중요한 역할을 수행한다.[22] pH, 총 알칼리도, 산도와 같은 지표를 측정하는 것은 산업 배출수, 농업 유출수 및 기타 수질 오염원이 환경에 미치는 영향을 평가하는 데 필수적이다.[22]
또한, 산-염기 적정은 자연 수계의 완충 능력을 파악하여 pH 변화에 대한 저항력을 평가하는 데 도움을 준다.[23] pH 수준을 지속적으로 모니터링하는 것은 수생태계를 보존하고 관련 환경 규정을 준수하는 데 중요하다.[23]
이 외에도 산-염기 적정은 토양 및 수체에 대한 산성비의 영향을 분석하는 데 활용되어, 환경 품질에 대한 전반적인 이해를 높이고 효과적인 관리에 기여한다.[24] 이 분석 방법의 정확성과 신뢰성은 생태계를 보호하고 인간의 활동이 자연 수자원에 미치는 영향을 평가하는 데 유용한 도구가 된다.[24]
참조
[1]
웹사이트
Acid-Base Titrations 14.7
https://psu.pb.unizi[...]
2023-12-07
[2]
웹사이트
Titration {{!}} Definition, Types, & Facts {{!}} Britannica
https://www.britanni[...]
2023-12-06
[3]
논문
Acid-base titrimetric assay of hydroxyzine dihydrochloride in pharmaceutical samples
https://doiserbia.nb[...]
2010
[4]
서적
Quantitative Chemical Analysis
https://books.google[...]
World Scientific Publishing Company
2013-04-26
[5]
논문
Carl Friedrich Mohr and analytical chemistry in Germany
https://dx.doi.org/1[...]
1979-08-01
[6]
논문
Instructional Misconceptions in Acid-Base Equilibria: An Analysis from a History and Philosophy of Science Perspective
https://doi.org/10.1[...]
2005-02-01
[7]
웹사이트
Lesson 6.9: Neutralizing Acids and Bases
https://www.acs.org/[...]
2023-12-07
[8]
서적
The Chemical Age – Chemical Dictionary – Chemical Terms
https://books.google[...]
Hesperides
2007-03-15
[9]
웹사이트
Titration Curves
https://groups.chem.[...]
2023-12-07
[10]
웹사이트
Acid-Base Indicators
https://groups.chem.[...]
2023-12-07
[11]
논문
Colour maps of acid–base titrations with colour indicators: how to choose the appropriate indicator and how to estimate the systematic titration errors
https://doi.org/10.1[...]
2016-04-29
[12]
웹사이트
Phenolphthalein {{!}} pH indicator, acid-base titration, indicator dye {{!}} Britannica
https://www.britanni[...]
2023-11-05
[13]
웹사이트
13.5: Acid/Base Titration
https://chem.librete[...]
2023-10-08
[14]
웹사이트
How to Save Overshot Titrations
https://www.research[...]
2009-10
[15]
웹사이트
What is Back Titration?
https://www.thoughtc[...]
2023-11-05
[16]
웹사이트
Using an ICE Table
https://chemistrytal[...]
2023-12-06
[17]
문서
Quantitative Chemical Analysis, 7Ed.
[18]
논문
Explicit expressions of the general form of the titration curve in terms of concentration: Writing a single closed-form expression for the titration curve for a variety of titrations without using approximations or segmentation
[19]
웹사이트
Titration pH Curves – HSC Chemistry
https://scienceready[...]
2023-12-06
[20]
웹사이트
Stability evaluation of Acetylsalicylic acid in commercial Aspirin tablets available in the Iraqi market
https://japer.in/sto[...]
2021-07
[21]
논문
Statistical Quality Control in College Analytical Laboratories
https://www.jstor.or[...]
1949
[22]
논문
Microfluidic devices for environmental monitoring
https://www.scienced[...]
2005-10-01
[23]
웹사이트
Urea production, acid–base regulation and their interactions in the lake magadi tilapia, a unique teleost adapted to a highly alkaline environment
https://journals.bio[...]
2023-12-06
[24]
웹사이트
Public Environmental Monitoring of the Quality of Water Bodies in Norilsk and Taimyr
https://www.academia[...]
2021-02-02
[25]
서적
The Chemical Age – Chemical Dictionary – Chemical Terms
https://books.google[...]
Hesperides
2007-03-15
[26]
문서
Quantitative Chemical Analysis, 7Ed.
[27]
논문
Explicit expressions of the general form of the 仮リンク滴定曲線 in terms of concentration: Writing a single closed-form expression for the titration curve for a variety of titrations without using approximations or segmentation
[28]
서적
Ionic Equilibria in Analytical Chemistry
Kreiger
[29]
웹사이트
The Equligraph: Revisiting an old tool
http://www.tahosa.us[...]
2015-10-04
[30]
서적
The Chemical Age – Chemical Dictionary – Chemical Terms
https://books.google[...]
Hesperides
2007-03-15
[31]
문서
Quantitative Chemical Analysis, 7Ed.
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com