진화발생생물학
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
진화발생생물학(이보디보)은 발생 과정을 진화적 관점에서 연구하는 생물학의 한 분야이다. 이보디보는 발생과 진화의 관계, 새로운 형질의 탄생, 생태학적 영향 등을 연구하며, 유전자, 형태, 발생의 변화가 어떻게 진화를 유발하는지 설명한다. 1970년대 후반 분자생물학의 발전과 호메오박스 유전자의 발견은 이보디보 연구의 중요한 계기가 되었으며, 20세기 현대 종합 이론과 결합하여 진화의 메커니즘을 밝히는 데 기여했다. 이보디보 연구는 툴킷 유전자와 발생적 편향, 생태 발생 진화 생물학을 포함하며, 캄브리아기 대폭발, 윌리스턴의 법칙, 절지동물의 부속지 진화, 나비 날개 무늬, 포유류의 흑색증 등 다양한 생물학적 현상을 설명하는 데 활용된다.
더 읽어볼만한 페이지
- 진화발생생물학 - 전사인자
전사 인자는 DNA 특정 서열에 결합하여 유전자 발현을 조절하는 단백질로서, RNA 중합효소와 함께 전사를 조절하여 유전 정보 전달에 핵심적인 역할을 하며, 발생, 신호 전달, 환경 반응, 세포 주기 조절 등 다양한 생물학적 과정에 관여한다. - 진화발생생물학 - 서열 정렬
서열 정렬은 유전체 연구 및 생명과학에서 서열 간 진화적 관계를 밝히는 방법으로, 전역, 지역, 쌍별 정렬 등의 방법을 통해 계통수 분석, 유의성 및 신뢰도 평가 등에 활용되며, ClustalW2, BLAST, FASTA3x 등의 소프트웨어 도구로 수행된다. - 발생생물학 - 내배엽
내배엽은 동물 배아 발생 시 가장 안쪽에 위치한 층으로 소화관, 간, 췌장, 폐 등 주요 기관을 형성하며, 낭배 형성 과정에서 다양한 신호 전달 경로를 통해 분화되고 줄기세포 연구에 활용되며, 식물에서는 뿌리의 피질 가장 안쪽 세포층을 의미한다. - 발생생물학 - 배엽
배엽은 동물의 초기 발생 과정에서 나타나는 외배엽, 중배엽, 내배엽의 세 가지 세포층으로, 각 층은 특정 기관과 조직으로 분화하며 동물의 발생과 진화를 이해하는 데 중요하다. - 진화생물학 - 살아있는 화석
살아있는 화석은 화석 기록에서 오랜 기간 동안 형태적 변화가 거의 없이 나타나는 생물을 의미하며, 진화와 종분화를 이해하는 데 중요한 역할을 한다. - 진화생물학 - 적응
적응은 생물이 환경에 더 잘 생존하고 번식하도록 돕는 진화 과정으로, 형태, 행동, 생리적 특징 등 다양한 측면에서 유전적 변화, 공진화, 의태 등의 방식으로 나타난다.
| 진화발생생물학 |
|---|
2. 개념 및 의의
20세기 이후 생물학의 연구 분야는 크게 보아 자연사, 유전학, 발생생물학으로 구분될 수 있다. 1980년대 후반 시작된 진화발생생물학은 그동안 세분화되어 연구되었던 생물학의 제반 연구 분야를 진화와 발생을 축으로 하여 융합한 학제간 연구이다. 진화발생생물학의 기반을 이루는 학문은 유전학, 세포생물학, 생리학, 생화학, 생물물리학, 내분비학 등이다.[117]
1850년 오웬은 생명의 역사가 목적을 가진 단계적인 계획에 따라서 자연적인 발생에 의하여 만들어진 종들에 의하여 새로운 종들이 만들어지며 운명적으로 쓰인 것이라고 주장하였다.[122][123] 찰스 다윈은 종의 기원에서 자연선택을 통한 진화를 주장하여 현대 생물학의 기둥을 세웠다. 그는 일찍이 진화를 연구하는 데 있어서 발생의 중요성을 인정하였다.[124]
다윈은 폰 베어의 분지형태이론과 그가 주장한 변화를 수반한 후손의 개념을 연결 지어서 왜 자연적 분류를 할 때, 배아로부터 유도된 특징들이 성체로부터 유도된 특징들과 동등한 중요성을 가지는지에 대한 해답을 내놓았다.
에른스트 헤켈은 라마르크 주의와 자연철학을 통합하여 다윈의 종합설을 만들어내려고 노력했다. 그는 ‘개체발생이 계통발생을 재연한다’라는 주장을 하였다.[125] 즉, 모든 종의 배아의 발생(개체발생)만으로 그 종의 진화적 발생과정(계통발생)을 설명할 수 있다는 것이다.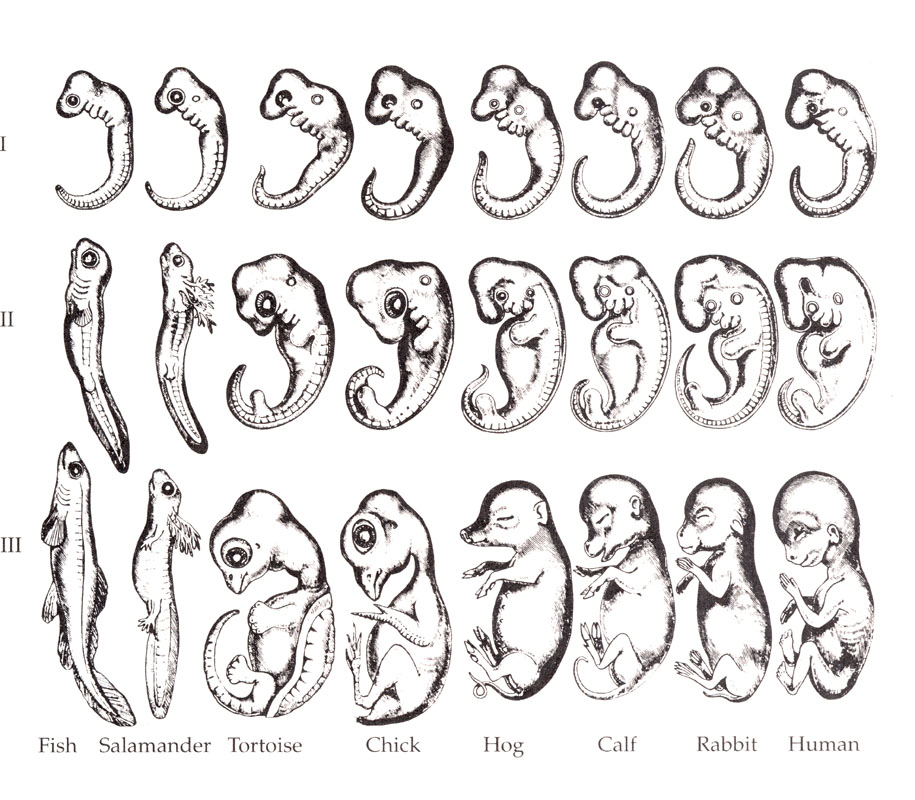
당시 그의 이론은 대부분 사람들의 신임을 얻지는 못했지만, 현대 진화론 종합설이 세워진 이래 발생에 대한 새로운 관심을 불러일으키는 계기가 되었다. 스티븐 제이 굴드는 이 접근을 종단부가로 진화를 설명하는 데 이용하였다. 종단부가란 개체 발생의 마지막 과정에 새로운 형질이 더해지는 것을 말한다. 그러나 종단부가 이론은 조상 생물에 비해 후손 생물의 개체 발생이 차츰 길어질 수 밖에 없다는 문제를 가지고 있었다. 반복론자들은 새로운 단계가 더해지며 진화적 발전이 일어나면, 항상 오래된 단계를 압축하거나 삭제하는 과정이 일어나 발생 시간이 길어지는 것을 막는다고 설명했다. 이 주장은 어느 순간 동물의 성장이 지연되고 생식기관이 성숙하여 번식하는 형상, 즉 유형성숙을 관찰한 것에 기반을 두고 있었다.[126] 유형성숙의 발견은 개체 발생에서 어떤 기관의 발생이 특히 촉진되거나 지연되는 이시성의 관점에서 확장되어, 진화적 변화의 메커니즘으로 받아들여지게 되었다.[127] 다아시 톰슨은 1917년에 출판한 그의 책 『성장과 형성』에서 성장 속도의 차이가 형태 상의 변이들을 만든다고 선언했다.
1970년대 후반 독일의 생물학자인 에드워드 루이스 등은 노랑초파리에서 180개의 염기서열로 구성된 특정 DNA 단편인 호메오박스를 발견하였다. 1980년대에 들어 동일한 염기서열을 갖는 호메오박스가 포유류에서도 발견되었으며 이들이 동일한 역할을 한다는 것이 밝혀졌다. 초파리 배아의 앞과 뒤를 결정하는 호메오박스 유전자는 포유류에서 척추 형성에 관여한다. 즉, 유사한 유전자는 계통적으로 멀리 떨어져 있는 생물에서도 유사한 역할을 한다는 점이 밝혀진 것이다. 초파리의 특정 호메오박스 유전자를 생쥐의 배아에 이식한 실험에서 초파리의 호메오박스 유전자는 정상적인 생쥐의 그것과 동일한 역할을 수행하였다. 호메오박스의 발견은 배의 발생과 진화에 대한 새로운 관심을 불러일으켰고 진화발생생물학이 시작되는 계기가 되었다. 1995년 루이스와 동료들은 호메오박스 발견의 공로로 노벨 생리학·의학상을 수상하였다.[117]
1988년 리보솜 RNA의 염기 서열을 비교하여 동물계 전체의 조상 후손 관계를 파악하는 연구가 진행된 이후 DNA의 염기 서열을 비교하여 생물의 계통을 밝히는 분자계통학 연구가 시작되었다. 분자계통학의 연구는 비교생물학의 상동성 연구에 많은 도움을 주고 있다.[116]
2. 1. 이보디보란 무엇인가
발생 과정은 유전적으로 프로그램화되어 있고 진화는 변이와 선택에 의한 결과이다. 진화생물학과 발생생물학은 서로 분리된 관계를 유지하여 오다가 20세기 초 융합되어 생물 종 사이의 발생 과정 비교가 진화의 증거로 이용되기 시작하였다. 이후 유전학의 발달로 두 학문 사이의 학제간 연구가 계속되어 왔으며 1980년대 진화발생생물학이 성립하게 되었다.[116]진화발생생물학을 가리키는 또 다른 말인 이보디보는 생물학의 한 분야로, 공통조상 관계를 결정짓기 위해 서로 다른 생물체의 발생 과정을 비교하고 발생 과정이 어떤 경로로 진화해왔는지에 대해 연구한다. 이보디보는 발생의 근원과 진화 과정, 발생에서의 변화가 일으킨 새로운 형질의 탄생, 발생의 유동성이 진화에서 가지는 역할, 생태학이 발생적•진화적 변화에 미치는 영향, 진화적 상동의 발생학적 배경에 대해 정의한다. 이보디보에서 진화란 발생학적 과정들이 얽혀있는 오래된 유전자 체계에서 새롭고 혁신적인 구조를 만들거나 다른 생물체들에서 유사한 운동을 하도록 보존하게끔 바꾸는 것이다.[118][119]
학자들의 초기 관심사는 몸의 체제와 조직의 발생을 조절하는 세포와 분자 수준의 메커니즘에서의 유사점을 발견하는 데에 쏠려있었지만, 현대에는 종 분화와 연관된 발생학적 변화들에까지 접근하고 있다.[120] 이보디보는 최근 20년 간 벌어진 생물학의 통섭 흐름을 대변해주는 학문이라 할 수 있다.[121]
이보디보는 다음과 같은 의의를 지닌다.
- 첫째, 이보디보는 진화 이론들이 통섭의 길을 걷게 한 장본인이다.
- 둘째, 이보디보는 진화의 기본원칙들을 효율적으로 설명한다.
- 셋째, 이보디보는 진화생물학 교육을 두고 빚어지는 사회적 논란에서 큰 도움이 될 수 있다.
- 마지막으로, 진화발생생물학의 중요성은 철학적인 수준을 넘어선다.
2. 2. 이보디보의 의의
발생 과정은 유전적으로 프로그램화되어 있고 진화는 변이와 선택에 의한 결과이다. 진화생물학과 발생생물학은 서로 분리된 관계를 유지하여 오다가 20세기 초 융합되어 생물 종 사이의 발생 과정 비교가 진화의 증거로 이용되기 시작하였다. 이후 유전학의 발달로 두 학문 사이의 학제간 연구가 계속되어 왔으며 1980년대 진화발생생물학이 성립하게 되었다.[116]20세기 이후 생물학의 연구 분야는 크게 보아 자연사, 유전학, 발생생물학으로 구분될 수 있다. 1980년대 후반 시작된 진화발생생물학은 그동안 세분화되어 연구되었던 생물학의 제반 연구 분야를 진화와 발생을 축으로 하여 융합한 학제간 연구이다. 진화발생생물학의 기반을 이루는 학문은 유전학, 세포생물학, 생리학, 생화학, 생물물리학, 내분비학 등이다.[117]
진화발생생물학을 가리키는 또 다른 말인 이보디보는 생물학의 한 분야로, 공통조상 관계를 결정짓기 위해 서로 다른 생물체의 발생과정을 비교하고 발생과정이 어떤 경로로 진화해왔는지에 대해 연구한다. 이보디보는 발생의 근원과 진화 과정, 발생에서의 변화가 일으킨 새로운 형질의 탄생, 발생의 유동성이 진화에서 가지는 역할, 생태학이 발생적•진화적 변화에 미치는 영향, 진화적 상동의 발생학적 배경에 대해 정의한다.[118][119]
학자들의 초기 관심사는 몸의 체제와 조직의 발생을 조절하는 세포와 분자수준의 메커니즘에서의 유사점을 발견하는 데에 쏠려있었지만, 현대에는 종 분화와 연관된 발생학적 변화들에까지 접근하고 있다.[120] 이보디보는 최근 20년 간 벌어진 생물학의 통섭 흐름을 대변해주는 학문이라 할 수 있다.[121]
이보디보는 진화 이론들이 통섭의 길을 걷게 한 장본인이다. 생물학은 1930~1940년대 신다윈주의나 근대적 종합을 한번 겪었으나, 당시의 발생학은 막 등장하기 시작한 유전학에 밀려 통합의 흐름에 함께 끼지 못했다. 1970년대 후반에 들어서야 분자생물학의 엄청난 성공에 힘입어 (분자)발생유전학자들이 호메오박스를 발견하는 극적인 성공을 거두면서 발생생물학 연구에도 햇빛이 들기 시작했다. 이보디보는 이전까지 정체된 채로 남아있었던 발생학을 눈뜨게 하고, 발생학을 고생물학 및 분자유전학과 결합시키면서 이때까지 풀리지 않았던 문제들을 혁명적으로 해결해나간다.
또한, 이보디보는 진화의 기본원칙들을 효율적으로 설명한다. 형태의 진화를 연구하고, 발생 및 유전자에서의 변화가 어떻게 진화를 불러일으키는지 연구하다 보면, 통일적이면서도 다양한 생물들 아래 숨어있던 원칙들이 속속히 드러난다.
이보디보는 진화생물학 교육을 두고 빚어지는 사회적 논란에서 큰 도움이 될 수 있다. 진화의 메커니즘과 원칙들을 실체적이고 구체적으로 설명하기 때문이다.
진화발생생물학의 중요성은 철학적인 수준을 넘어선다. 우리 주변의 생태계는 인간뿐만 아니라 무수히 다양한 생명체들로 이루어져 있으며, 모든 생명체들의 운명은 우리 인간이 진화에 어떤 영향을 미치는가를 먼저 이해할 때 보장받을 수 있다.
3. 이보디보의 역사 및 배경
20세기 이후 생물학의 연구 분야는 크게 자연사, 유전학, 발생생물학으로 구분될 수 있다. 1980년대 후반 시작된 진화발생생물학(이보디보)은 진화와 발생을 축으로 하여 생물학의 제반 연구 분야를 융합한 학제간 연구이다. 진화발생생물학의 기반을 이루는 학문은 유전학, 세포생물학, 생리학, 생화학, 생물물리학, 내분비학 등이다.[117] 이보디보는 최근 20년 간 벌어진 생물학의 통섭 흐름을 보여주는 학문이라 할 수 있다.[121]
이보디보는 진화 이론들이 통섭의 길을 걷게 한 장본인이다. 1930~1940년대 신다윈주의나 근대적 종합이 있었으나, 당시 발생학은 유전학에 밀려 통합되지 못했다. 발생학은 형태형성장과 같이 난해하고 추상적인 개념을 다루었기 때문이다. 근대적 종합은 다윈의 자연선택론과 집단유전학의 만남이었을 뿐, 발생학은 40년이 지나도록 진화론과 통합될 수 없었다.
1970년대 후반 분자생물학의 성공과 분자발생유전학자들의 호메오박스 발견으로 발생생물학 연구가 활기를 띠기 시작했다. 이보디보는 발생학을 고생물학 및 분자유전학과 결합시키면서 혁명적인 해결을 이끌어냈다.
이보디보는 진화의 기본 원칙들을 효율적으로 설명한다. 형태의 진화를 연구하고, 발생 및 유전자에서의 변화가 진화를 일으키는 방식을 연구하면서, 생물들 아래 숨어있던 원칙들이 드러난다. 또한, 배아에서 유전자가 발현하는 형태는 시각적으로 뚜렷하며, 서로 다른 종의 툴킷 유전자들을 통해 진화의 개념들을 설명할 수 있다.
이보디보는 진화생물학 교육 관련 사회적 논란에 도움이 될 수 있다. 진화의 메커니즘과 원칙들을 실체적이고 구체적으로 설명하기 때문이다. 진화발생생물학의 중요성은 철학적인 수준을 넘어선다. 우리 주변의 생태계는 다양한 생명체들로 이루어져 있으며, 우리는 모두 상호작용하며 서로에게 영향을 끼친다. 따라서, 모든 생명체들의 운명은 인간이 진화에 어떤 영향을 미치는가를 이해할 때 보장받을 수 있다.
1977년, 유전자학 분야에서 재조합 DNA 기술이 등장하고, 스티븐 제이 굴드의 저서 《발생과 계통》, 프랑수아 자코브의 논문 "진화와 손질"[26]이 발표되면서 진화와 발생 생물학에 대한 사고방식에 혁명이 시작되었다. 굴드는 진화적 발생학에 대한 헤켈의 해석을 종식시켰고, 자코브는 대안적 이론을 제시했다.[9]
이러한 변화는 발생학을 분자 유전학, 계통 발생, 진화 생물학과 통합하여 진화발생생물학을 형성하는 두 번째 종합으로 이어졌다.[27][28][29][30] 1978년, 에드워드 B. 루이스는 절지동물에 속하는 초파리의 배아 발달을 조절하는 동소성 유전자를 발견했다.[31]
빌 맥기니스는 개구리, 조류, 포유류와 같은 척추동물에서 동소성 유전자 서열, 홈박스를 발견했으며, 나중에는 효모와 같은 균류와 식물에서도 발견되었다.[36][32] 모든 진핵생물에 걸쳐 발달을 제어하는 유전자에서 강력한 유사성이 있음이 분명해졌다.[33]
1980년, 크리스티안 뉘슬라인-폴하르트와 에릭 위샤우스는 초파리 배아 발생에서 분절 패턴을 생성하는 데 도움을 주는 갭 유전자를 설명했으며,[34][35] 이들은 1995년 루이스와 함께 이 연구로 노벨 생리학·의학상을 수상했다.[36][37]
이후, distal-less 유전자가 초파리의 부속지, 물고기의 지느러미, 닭의 날개, 해양 환형동물의 측각, 멍게의 앰플과 사이펀, 성게의 관족 발달에 관여하는 것으로 밝혀졌다.[38] 이 유전자는 모든 동물의 몸이 발달하는 방식을 밝히기 시작한 진화발생생물학의 연구와 일치하며, 에디아카라기 이전의 양측대칭동물의 최후 공통 조상으로 거슬러 올라갈 정도로 오래된 것임이 분명했다.[39][40]
3. 1. 초기 이론
발생 과정은 유전적으로 프로그램화되어 있고 진화는 변이와 선택에 의한 결과라는 점에서 진화생물학과 발생생물학은 서로 분리되어 있었다. 20세기 초 두 학문은 융합되어 생물 종 사이의 발생 과정 비교가 진화의 증거로 이용되기 시작하였다. 이후 유전학의 발달로 두 학문 사이의 학제간 연구가 계속되었으며 1980년대 진화발생생물학이 성립하게 되었다.[116]1850년 오웬은 생명의 역사가 목적을 가진 단계적인 계획에 따라서 자연적인 발생에 의하여 만들어진 종들에 의해 새로운 종들이 만들어지며 운명적으로 쓰인 것이라고 주장하였다.[122][123] 찰스 다윈은 《종의 기원》에서 자연선택을 통한 진화를 주장하여 현대 생물학의 기둥을 세웠다. 그는 일찍이 진화를 연구하는 데 있어서 발생의 중요성을 인정하였다.[124]
다윈은 폰 베어의 분지형태이론과 그가 주장한 변화를 수반한 후손의 개념을 연결 지어서 왜 자연적 분류를 할 때, 배아로부터 유도된 특징들이 성체로부터 유도된 특징들과 동등한 중요성을 가지는지에 대한 해답을 내놓았다.
에른스트 헤켈은 라마르크 주의와 자연철학을 통합하여 다윈의 종합설을 만들려고 노력했다. 그는 ‘개체발생이 계통발생을 재연한다’라는 주장을 하였다.[125] 즉, 모든 종의 배아의 발생(개체발생)만으로 그 종의 진화적 발생과정(계통발생)을 설명할 수 있다는 것이다.
당시 그의 이론은 대부분의 사람들의 신임을 얻지는 못했지만, 현대 진화론 종합설이 세워진 이래 발생에 대한 새로운 관심을 불러 일으키는 계기가 되었다. 스티븐 제이 굴드는 이 접근을 종단부가로 진화를 설명하는 데 이용하였다. 종단부가란 개체 발생의 마지막 과정에 새로운 형질이 더해지는 것을 말하는데, 이는 개체발생이 계통발생을 재연한다는 헤켈의 주장을 뒷받침하기 위하여 헤켈주의자(혹은 반복론자라고 한다)들이 만들어낸 개념이다. 헤켈의 주장이 설명되기 위해서는 계통 발생의 과정에서 새로운 형질이 항상 조상 생물의 개체 발생 도중이 아닌 마지막에 더해져야 하기 때문이었다. 그러나 이러한 주장은 종단부가가 일어나면 조상 생물에 비해 후손 생물의 개체 발생이 차츰 길어질 수 밖에 없다는 문제를 가지고 있었다. 이를 설명하기 위하여 반복론자들은 새로운 단계가 더해지며 진화적 발전이 일어나면, 항상 오래된 단계를 압축하거나 삭제하는 과정이 일어나 발생 시간이 길어지는 것을 막는다고 설명했다. 이 주장은 어느 순간 동물의 성장이 지연되고 생식기관이 성숙하여 번식하는 형상, 즉 유형성숙을 관찰한 것에 기반을 두고 있었다.[126] 유형성숙의 발견은 개체 발생에서 어떤 기관의 발생이 특히 촉진되거나 지연되는 이시성의 관점에서 확장되어, 진화적 변화의 메커니즘으로 받아들여지게 되었다.[127] 다아시 톰슨은 1917년에 출판한 그의 책 《성장과 형성》에서 성장 속도의 차이가 형태 상의 변이들을 만든다고 선언했다. 그는 생물 개체의 체제에 있어서 근본적인 유사점들과 기하학적인 변이들이 생기는 과정이 변이들을 설명하는 데 있어서 이용될 수 있다고 보였다.
1970년대 후반 독일의 생물학자인 에드워드 루이스 등은 노랑초파리에서 180개의 염기서열로 구성된 특정 DNA 단편인 호메오박스를 발견하였다. 1980년대에 들어 동일한 염기서열을 갖는 호메오박스가 포유류에서도 발견되었으며 이들이 동일한 역할을 한다는 것이 밝혀졌다. 초파리 배아의 앞과 뒤를 결정하는 호메오박스 유전자는 포유류에서 척추 형성에 관여한다. 즉, 유사한 유전자는 계통적으로 멀리 떨어져 있는 생물에서도 유사한 역할을 한다는 점이 밝혀진 것이다. 초파리의 특정 호메오박스 유전자를 생쥐의 배아에 이식한 실험에서 초파리의 호메오박스 유전자는 정상적인 생쥐의 그것과 동일한 역할을 수행하였다. 호메오박스의 발견은 배의 발생과 진화에 대한 새로운 관심을 불러일으켰고 진화발생생물학이 시작되는 계기가 되었다. 1995년 루이스와 동료들은 호메오박스 발견의 공로로 노벨 생리학·의학상을 수상하였다.[117]
1988년 리보솜 RNA의 염기 서열을 비교하여 동물계 전체의 조상 후손 관계를 파악하는 연구가 진행된 이후 DNA의 염기 서열을 비교하여 생물의 계통을 밝히는 분자계통학 연구가 시작되었다. 현재 모든 동물 계통의 분지가 밝혀지지는 않았으나 분자계통학의 연구는 비교생물학의 상동성 연구에 많은 도움을 주고 있다.[116]
고대 철학자들은 동물이 어떻게 자궁에서 형태를 갖추는지 생각하기 시작했다. 아리스토텔레스는 그의 저서인 ''자연학''에서 엠페도클레스에 따르면 발달 중인 배아에서 질서가 "자발적으로" 나타난다고 주장한다. 그의 저서인 ''동물 부분론''에서 그는 엠페도클레스의 이론이 틀렸다고 주장한다. 아리스토텔레스의 설명에 따르면 엠페도클레스는 배아가 뒤틀리고 척추가 조각으로 부서지기 때문에 척주가 척추뼈로 나뉜다고 말했다. 아리스토텔레스는 대신 그 과정에는 미리 정의된 목표가 있다고 주장한다. 즉, 배아로 발달하는 "씨앗"은 척추뼈와 같은 특정 신체 부위가 될 수 있는 내장된 "잠재력"으로 시작되었다는 것이다. 또한 각 종류의 동물은 자신의 종의 동물을 낳는다. 즉, 인간은 인간 아기만 낳는다.[1]
3. 2. 반복설

생물 발생 반복설은 1824–26년 에티엔 세르가 제안했으며, 이는 1808년 요한 프리드리히 메켈의 아이디어를 반영한 것이다. 이들은 '고등' 동물의 배아가 일련의 단계를 거치며, 각 단계가 존재의 대사슬의 하위에 있는 동물을 닮는다고 주장했다. 예를 들어, 인간 배아의 뇌는 처음에 물고기의 뇌와 같고, 다음으로 파충류, 조류, 포유류의 뇌를 닮다가 명확하게 인간의 뇌를 갖게 된다.
칼 에른스트 폰 베어는 1828년에 이에 반대하여, 단일한 신체 구조에 기반한 존재의 대사슬과 같은 선형적 순서가 아니라, 구조가 분화되는 후성발생의 과정이 있다고 주장했다. 폰 베어는 대신 방사형(예: 불가사리), 연체동물형(예: 대합), 절지동물형(예: 바닷가재), 척추동물형(예: 물고기)의 네 가지 뚜렷한 동물 신체 구조를 제시했다. 그 후 동물학자들은 생물 발생 반복설을 대체로 포기했지만, 에른스트 헤켈은 1866년에 이를 부활시켰다.[3][4][5][6][7]
1824년에서 1826년에 에티엔느 세르는 아리스토텔레스에게서 착상을 얻은 요한 프리드리히 메켈의 1808년의 생각을 반영하여 진화 발생의 반복설을 제창했다. 그들은 "더 고등한" 동물의 배아의 각 단계는 "생물의 큰 연쇄" 아래 단계의 동물의 일련의 단계를 거친다고 주장했다. 예를 들어, 인간의 배아는 처음에는 물고기의 배아처럼 보이고, 다음에 파충류, 조류, 포유류와 매우 비슷한 단계를 거쳐 인간의 배아가 된다는 것이다.
카를 에른스트 폰 베어는 1828년에 단일한 신체 구성을 기반으로 "생물의 큰 연쇄"와 같은 선형적인 순서는 없다고 주장하며 이에 반대했다. 폰 베어는 대신 4가지 다른 동물의 신체 구성을 제창했다. 불가사리 같은 방사형 동물, 조개류 같은 연체 동물, 바닷가재 같은 갑각류 동물, 물고기 같은 척추 동물. 그 후 동물학자들은 1866년에 에른스트 헤켈이 반복설을 주장했음에도 불구하고, 대체로 이 이론을 포기했다.[81][82][83][84][85]
에른스트 헤켈은 라마르크 주의와 자연철학을 통합하여 다윈의 종합설을 만들려고 노력했다. 그는 ‘개체발생이 계통발생을 재연한다’라는 주장을 하였다.[125] 즉, 모든 종의 배아 발생(개체발생)만으로 그 종의 진화적 발생과정(계통발생)을 설명할 수 있다는 것이다.
당시 그의 이론은 대부분의 사람들의 신임을 얻지는 못했지만, 현대 진화론 종합설이 세워진 이래 발생에 대한 새로운 관심을 불러 일으키는 계기가 되었다. 스티븐 제이 굴드는 이 접근을 종단부가로 진화를 설명하는 데 이용하였다. 종단부가란 개체 발생의 마지막 과정에 새로운 형질이 더해지는 것을 말하는데, 이는 개체발생이 계통발생을 재연한다는 헤켈의 주장을 뒷받침하기 위하여 헤켈주의자(혹은 반복론자)들이 만들어낸 개념이다. 헤켈의 주장이 설명되기 위해서는 계통 발생의 과정에서 새로운 형질이 항상 조상 생물의 개체 발생 도중이 아닌 마지막에 더해져야 하기 때문이었다.
그러나 이러한 주장은 종단부가가 일어나면 조상 생물에 비해 후손 생물의 개체 발생이 차츰 길어질 수 밖에 없다는 문제를 가지고 있었다. 이를 설명하기 위하여 반복론자들은 새로운 단계가 더해지며 진화적 발전이 일어나면, 항상 오래된 단계를 압축하거나 삭제하는 과정이 일어나 발생 시간이 길어지는 것을 막는다고 설명했다. 이 주장은 어느 순간 동물의 성장이 지연되고 생식기관이 성숙하여 번식하는 형상, 즉 유형성숙을 관찰한 것에 기반을 두고 있었다.[126] 유형성숙의 발견은 개체 발생에서 어떤 기관의 발생이 특히 촉진되거나 지연되는 이시성의 관점에서 확장되어, 진화적 변화의 메커니즘으로 받아들여지게 되었다.[127]
3. 3. 진화 형태학

19세기 초부터 20세기까지, 발생학은 수수께끼에 직면해 있었다. 동물은 난자로부터 종종 유사한 단계를 거쳐, 매우 다른 체제를 가진 성체가 되는 것처럼 보이지만, 동물학자들은 배 발생이 분자 수준에서 어떻게 제어되는지에 대해 거의 알지 못했다[86].찰스 다윈은 공통된 배 구조가 공통 조상을 암시한다고 주장했다. 다윈은 1859년 저서 『종의 기원』에서 새우와 유사한 따개비의 유충을 인용하며, 그 성체가 다른 절지동물처럼 보이지 않는다고 지적했다. 린네와 퀴비에는 따개비를 연체동물로 분류했다[87][88][89]. 19세기의 동물학은 발생학을 진화 과학으로 바꾸어 배의 상동성을 계통 발생에 연결했다. 프리츠 뮐러를 포함한 동물학자들은 분류군 간의 계통 관계를 발견하기 위해 발생학을 제안했다[90][91][92][93][94]. 그러나 이후 100년 동안 분자적 증거가 없어 진전이 멈췄다.
3. 4. 20세기 현대 종합
20세기 초, 로널드 피셔는 다윈의 자연선택, 유전, 변이를 강조하는 진화 이론과 그레고어 멘델의 유전 법칙을 통합하여 진화생물학에 대한 일관된 구조를 제시하였다. 이를 통해 이른바 현대 종합이 이루어졌다. 당시 생물학자들은 유기체가 구성 유전자의 직접적인 반영이라고 가정했다. 즉, 유전자는 단백질을 코딩하고, 단백질은 유기체의 신체를 구성한다고 보았다. 그리고 생화학적 경로(그리고 새로운 종)는 이러한 유전자의 돌연변이를 통해 진화한다고 생각했다. 이것은 단순하고 명확하며 거의 포괄적인 그림이었지만, 발생학을 설명하지는 못했다.[9][18] 션 B. 캐롤은 만약 발생진화생물학의 통찰력이 있었다면 발생학이 분명히 종합의 중심적인 역할을 했을 것이라고 언급했다.[57]개빈 드 비어는 1930년 저서 《배아와 조상》[19]에서 이형시성과 같이 성체의 유아적 특징 유지를 통해 진화가 일어날 수 있음을 보여줌으로써 진화 발생생물학을 예견했다.[20][12] 드 비어는 이것이 배아가 화석화되기 어렵기 때문에 화석 기록에서 겉보기에 갑작스러운 변화를 일으킬 수 있다고 주장했다. 화석 기록의 틈새는 다윈의 점진적인 진화에 대한 반대 논거로 사용되었기 때문에, 드 비어의 설명은 다윈의 입장을 뒷받침했다.[21] 그러나 이러한 드 비어의 주장에도 불구하고, 현대 종합은 유기체의 형태를 설명하기 위해 배아 발생을 대체로 무시했다. 집단유전학이 형태가 어떻게 진화했는지에 대한 적절한 설명을 제공하는 것으로 보였기 때문이다.[22][23]
3. 5. lac 오페론
''1'': RNA 중합효소, ''2'': 억제자, ''3'': 프로모터, ''4'': 오퍼레이터, ''5'': 젖당, ''6–8'': 단백질 암호 유전자, 스위치에 의해 제어되며 젖당을 분해함]]1961년, 자크 모노, 장피에르 상죄와 프랑수아 자코브는 세균 ''대장균''에서 lac 오페론을 발견했다. lac 오페론은 피드백 제어 루프로 배열된 유전자 집합체였으며, 환경 자극에 의해 "켜질" 때만 생성물이 만들어지도록 했다. 이 생성물 중 하나는 설탕을 분해하는 효소인 젖당이었고, 젖당 자체가 유전자를 켜는 자극이었다. 이것은 세균과 같이 작은 유기체에서도 유전자가 정밀한 제어를 받는다는 것을 처음으로 보여준 획기적인 발견이었다. 이는 다른 많은 유전자들도 정교하게 조절될 수 있다는 것을 암시했다.[25]
3. 6. 이보디보의 탄생과 두 번째 종합
발생 과정은 유전적으로 프로그램화되어 있고 진화는 변이와 선택에 의한 결과이다. 진화생물학과 발생생물학은 서로 분리된 관계를 유지하여 오다가 20세기 초 융합되어 생물 종 사이의 발생 과정 비교가 진화의 증거로 이용되기 시작하였다. 이후 유전학의 발달로 두 학문 사이의 학제간 연구가 계속되어 왔으며 1980년대 진화발생생물학이 성립하게 되었다.[116]20세기 이후 생물학의 연구 분야는 크게 보아 자연사, 유전학, 발생생물학으로 구분될 수 있다. 1980년대 후반 시작된 진화발생생물학은 그동안 세분화되어 연구되었던 생물학의 제반 연구 분야를 진화와 발생을 축으로 하여 융합한 학제간 연구이다. 진화발생생물학의 기반을 이루는 학문은 유전학, 세포생물학, 생리학, 생화학, 생물물리학, 내분비학 등이다.[117] 이보디보는 최근 20년 간 벌어진 생물학의 통섭 흐름을 대변해주는 학문이라 할 수 있다.[121]
이보디보는 진화 이론들이 통섭의 길을 걷게 한 장본인이다. 1930~1940년대 신다윈주의나 근대적 종합이 있었으나, 당시 발생학은 유전학에 밀려 통합되지 못했다. 발생학은 형태형성장과 같이 난해하고 추상적인 개념을 다루었기 때문이다. 근대적 종합은 다윈의 자연선택론과 집단유전학의 만남이었을 뿐, 발생학은 40년이 지나도록 진화론과 통합될 수 없었다. 1970년대 후반 분자생물학의 성공과 분자발생유전학자들의 호메오박스 발견으로 발생생물학 연구가 활기를 띠기 시작했다. 이보디보는 발생학을 고생물학 및 분자유전학과 결합시키면서 혁명적인 해결을 이끌어냈다.
이보디보는 진화의 기본 원칙들을 효율적으로 설명한다. 형태의 진화를 연구하고, 발생 및 유전자에서의 변화가 진화를 일으키는 방식을 연구하면서, 생물들 아래 숨어있던 원칙들이 드러난다. 또한, 배아에서 유전자가 발현하는 형태는 시각적으로 뚜렷하며, 서로 다른 종의 툴킷 유전자들을 통해 진화의 개념들을 설명할 수 있다.
이보디보는 진화생물학 교육 관련 사회적 논란에 도움이 될 수 있다. 진화의 메커니즘과 원칙들을 실체적이고 구체적으로 설명하기 때문이다. 진화발생생물학의 중요성은 철학적인 수준을 넘어선다. 우리 주변의 생태계는 다양한 생명체들로 이루어져 있으며, 우리는 모두 상호작용하며 서로에게 영향을 끼친다. 따라서, 모든 생명체들의 운명은 인간이 진화에 어떤 영향을 미치는가를 이해할 때 보장받을 수 있다.
1850년 오웬은 생명의 역사가 목적을 가진 단계적인 계획에 따라 만들어진 종들에 의해 새로운 종들이 만들어지며 운명적으로 쓰인 것이라고 주장하였다.[122][123] 찰스 다윈은 《종의 기원》에서 자연선택을 통한 진화를 주장하여 현대 생물학의 기둥을 세웠다. 그는 진화를 연구하는 데 있어서 발생의 중요성을 인정하였다.[124]
다윈은 폰 베어의 분지형태이론과 변화를 수반한 후손의 개념을 연결하여, 배아로부터 유도된 특징들이 성체로부터 유도된 특징들과 동등한 중요성을 가지는지에 대한 해답을 제시했다.
에른스트 헤켈은 라마르크 주의와 자연철학을 통합하여 다윈의 종합설을 만들려고 했다. 그는 ‘개체발생이 계통발생을 재연한다’라는 주장을 하였다.[125] 즉, 모든 종의 배아의 발생(개체발생)만으로 그 종의 진화적 발생과정(계통발생)을 설명할 수 있다는 것이다.
그의 이론은 신임을 얻지 못했지만, 현대 진화론 종합설 이후 발생에 대한 새로운 관심을 불러일으켰다. 스티븐 제이 굴드는 이 접근을 종단부가로 진화를 설명하는 데 이용하였다. 종단부가는 개체 발생의 마지막 과정에 새로운 형질이 더해지는 것으로, 헤켈의 주장을 뒷받침하기 위해 만들어진 개념이다. 헤켈의 주장이 설명되기 위해서는 새로운 형질이 항상 조상 생물의 개체 발생 도중이 아닌 마지막에 더해져야 했다. 그러나 종단부가가 일어나면 후손 생물의 개체 발생이 길어질 수 밖에 없다는 문제가 있었다. 이를 설명하기 위해 반복론자들은 새로운 단계가 더해지며 진화적 발전이 일어나면, 오래된 단계를 압축하거나 삭제하여 발생 시간이 길어지는 것을 막는다고 설명했다. 이 주장은 유형성숙을 관찰한 것에 기반을 두고 있었다.[126] 유형성숙의 발견은 이시성의 관점에서 확장되어, 진화적 변화의 메커니즘으로 받아들여지게 되었다.[127] 다아시 톰슨은 『성장과 형성』에서 성장 속도의 차이가 형태 상의 변이들을 만든다고 선언했다. 그는 생물 개체의 체제에 있어서 근본적인 유사점들과 기하학적인 변이들이 생기는 과정이 변이들을 설명하는 데 이용될 수 있다고 보았다.
1970년대 후반 독일의 생물학자인 에드워드 루이스 등은 노랑초파리에서 180개의 염기서열로 구성된 DNA 단편인 호메오박스를 발견하였다. 1980년대에 들어 동일한 염기서열을 갖는 호메오박스가 포유류에서도 발견되었으며 이들이 동일한 역할을 한다는 것이 밝혀졌다. 초파리 배아의 앞과 뒤를 결정하는 호메오박스 유전자는 포유류에서 척추 형성에 관여한다. 즉, 유사한 유전자는 계통적으로 멀리 떨어져 있는 생물에서도 유사한 역할을 한다는 점이 밝혀진 것이다. 초파리의 특정 호메오박스 유전자를 생쥐의 배아에 이식한 실험에서 초파리의 호메오박스 유전자는 정상적인 생쥐의 그것과 동일한 역할을 수행하였다. 호메오박스의 발견은 배의 발생과 진화에 대한 새로운 관심을 불러일으켰고 진화발생생물학이 시작되는 계기가 되었다. 1995년 루이스와 동료들은 호메오박스 발견의 공로로 노벨 생리학·의학상을 수상하였다.[117]
1988년 리보솜 RNA의 염기 서열을 비교하여 동물계 전체의 조상 후손 관계를 파악하는 연구가 진행된 이후 DNA의 염기 서열을 비교하여 생물의 계통을 밝히는 분자계통학 연구가 시작되었다. 현재 모든 동물 계통의 분지가 밝혀지지는 않았으나 분자계통학의 연구는 비교생물학의 상동성 연구에 많은 도움을 주고 있다.[116]
1977년, 유전자학 분야에서 재조합 DNA 기술이 등장하고, 스티븐 제이 굴드의 저서 《발생과 계통》, 프랑수아 자코브의 논문 "진화와 손질"[26]이 발표되면서 진화와 발생 생물학에 대한 사고방식에 혁명이 시작되었다. 굴드는 진화적 발생학에 대한 헤켈의 해석을 종식시켰고, 자코브는 대안적 이론을 제시했다.[9]
이러한 변화는 발생학을 분자 유전학, 계통 발생, 진화 생물학과 통합하여 진화발생생물학을 형성하는 두 번째 종합으로 이어졌다.[27][28][29][30] 1978년, 에드워드 B. 루이스는 모든 곤충과 마찬가지로 절지동물에 속하는 초파리의 배아 발달을 조절하는 동소성 유전자를 발견했다.[31]
빌 맥기니스는 다른 문의 동물, 즉 개구리, 조류, 포유류와 같은 척추동물에서 동소성 유전자 서열, 홈박스를 빠르게 발견했으며, 나중에는 효모와 같은 균류와 식물에서도 발견되었다.[36][32] 모든 진핵생물에 걸쳐 발달을 제어하는 유전자에서 강력한 유사성이 있음이 분명해졌다.[33]
1980년, 크리스티안 뉘슬라인-폴하르트와 에릭 위샤우스는 초파리 배아 발생에서 분절 패턴을 생성하는 데 도움을 주는 갭 유전자를 설명했으며,[34][35] 이들은 1995년 루이스와 함께 이 연구로 노벨 생리학·의학상을 수상했다.[36][37]
이후, 더 구체적인 유사성이 발견되었다. 예를 들어, distal-less 유전자는 1989년에 초파리의 부속지 또는 사지, 물고기의 지느러미, 닭의 날개, 해양 환형동물의 측각, 멍게의 앰플과 사이펀, 성게의 관족 발달에 관여하는 것으로 밝혀졌다.[38] 이 유전자는 모든 동물의 몸이 발달하는 방식을 밝히기 시작한 진화발생생물학의 연구와 일치하며, 대략 6억 3천 5백만 년 전에 시작된 에디아카라기 이전의 양측대칭동물의 최후 공통 조상으로 거슬러 올라갈 정도로 오래된 것임이 분명했다.[39][40]
1977년, 유전학에서의 재조합 DNA 기술의 등장으로 진화와 발생생물학의 생각에 혁명이 시작되었고, 스티븐 제이 굴드의 존체발생에 관한 논문 『Ontogeny and Phylogeny|개체 발생과 계통 발생영어』과 프랑수아 자코브에 의해 발전이 시작되었다. 굴드는 헤켈의 진화론적 발생학의 해석을 물리치고, 자코브는 다른 이론을 세웠다. 이것은 최종적으로 발생학 및 분자 유전학, 계통 발생, 진화 생물학을 포함하여, evo-devo의 기초를 만들었다[95][96]。1978년, 에드워드 B. 루이스는 초파리의 배의 발육을 조절하는 호메오틱 유전자를 발견했다. 곤충이 포함된 무척추동물의 주요 문 중 하나인 절지동물에 속하지만, 빌 맥기니스(Bill McGinnis)는, 개구리, 조류, 포유류 등의 척추동물이나, 다른 문의 동물에서 호메오틱 유전자에 공통적인 배열, 호메오 박스를 발견했다. 호메오 박스는 후에 효모와 식물에서도 발견되었다. 모든 진핵생물에 걸쳐 발생을 제어하는 유전자에 명백히 강한 유사성이 있었다. 1980년, 크리스티아네 뉘슬라인-폴하르트와 에릭 위샤우스는 초파리 배에 분절 패턴을 만들어내는 데 도움이 되는 gap gene|갭 유전자영어를 발견했다. 그들과 루이스는 1995년에 노벨상을 수상했다. 그 후, 보다 특이적인 유사성이 발견되었다. 예를 들어, Distal-less 유전자는, 초파리의 부속지나 사지 발생에 관여하는 것이 1989년에 발견되었을 뿐만 아니라, 물고기의 지느러미, 닭의 깃털, 해양성 환형동물의 발(곁발), 멍게의 출수공, 성게의 관족 등의 발생에 관여하는 것이 밝혀졌다. 그 유전자를 동물이 획득한 것은 고대라고 생각해야 하고, 멀리 떨어진 동물의 공통 조상을 거슬러 올라가면, 에디아카라 시대 이전, 약 6억 3천 5백만 년 전에 획득된 것으로 생각해야 한다는 것은 명백했다. Evo-devo는 모든 동물의 몸이 발생 중에 어떻게 만들어지는지를 해명하기 시작했다[97][98]。
4. 연구
진화생물학 연구는 사람과 초파리 사이에 공통적인 유전자가 무엇인지, 그리고 사람만이 갖는 고유한 유전자는 무엇인지를 탐구한다. 호메오박스와 같은 유전자는 마치 레고 블록처럼 다양한 형태로 조합되어 생물의 유전체를 구성한다. 진화 과정에서 어떤 유전자는 보존되고, 어떤 유전자는 변형되거나 소실되는데, 이러한 조절 부위의 변화가 생물 종의 발생 특징을 결정한다.[115]
1970년대 말부터 1980년대 초, 크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스는 초파리 유충 발달에 필요한 거의 모든 유전자들을 밝혀냈다.[137] 이들은 초파리 연구를 확장하여 대부분의 척추동물과 다른 동물도 이와 유사한 유전자들을 가지고 있다는 것을 알아내면서, 진화발생생물학(이보디보) 발전의 토대를 닦았다.[138] 이들은 마스터 유전자 중 가장 유명한 호메오 유전자를 포함하여 눈, 부속지, 심장을 만드는 십여 개의 유전자들이 동물 발생에 관여하는 유전자 툴킷의 일부분임을 발견했다.
고생물학자 새뮤얼 윌리스턴은 1914년 고대 해양 파충류를 연구하던 중 초기 동물군에는 비슷한 부속들이 다수 반복되는 반면, 후대의 동물군에서는 부속의 수가 줄고 구조마다 한결 전문화된 형태가 나타난다는 사실을 알아차렸다. 그는 이 사실에서 ‘진화는 유기체 신체 부속들의 수가 줄어드는 방향으로, 줄어든 부위들이 기능 면에서는 훨씬 전문화되는 방향으로 진화한다’라는 윌리스턴의 법칙을 도출하였다.[142]
캄브리아기 대폭발은 화석 기록에서 나타나는 동물 다양성의 급격한 증가 현상이다. 발생학의 발전은 이 시기 동안 유전자가 어떤 역할을 했는지 밝혀냈다. 호메오 유전자의 수가 폭발적으로 늘어난 것이 원인이라는 가설이 제기되기도 했지만, 절지동물의 조상인 엽족동물과 가까운 유조동물과 절지동물의 호메오 유전자를 비교한 결과, 절지동물의 호메오 유전자들이 이미 공통 조상에 존재했다는 사실이 밝혀지면서 이 가설은 힘을 잃었다.[162][163] 대신, 호메오 유전자 발현 영역의 이동과 같은 조절 시스템의 변화가 동물 다양성 증가에 중요한 역할을 했다는 가설이 제시되었다.[164][165][166]
진화의 역사는 더 나은 부속지를 가지기 위한 ‘군비 확장 경쟁’과 같다. 이러한 부속지의 진화는 연속적으로 반복되는 신체 설계 덕분에 가능했다.[170] 이보디보는 이미 존재하는 구조가 변형되어 새롭게 진화된 구조가 형성된다는 진화적 혁신의 주요 원리를 제시한다. 또한, 다기능성과 중복성, 모듈성과 같은 개념을 통해 생물 다양성이 어떻게 나타날 수 있는지 설명한다.
4. 1. 유전자 툴킷
마스터 유전자 중 가장 유명한 것들인 호메오 유전자를 포함하여 눈, 부속지, 심장을 만드는 십여 개의 유전자들은 동물 발생에 관여하는 유전자 툴킷의 일부분이다.[136] 초파리 형성에 관련된 유전자만 해도 수백 개 정도이며, 나머지 많은 유전자들도 각자 초파리 세포들 안에서 특화된 기능을 수행한다. 동물 신체의 발생과 무늬 형성을 통제하는 동물 발생의 툴킷에는 호메오 단백질, 신체 형성 마스터 유전자들, 세포 형태조절인자들, 헤지호그 및 기타 신호전달 단백질들, 세포 수용체들, 호르몬들, 착색 단백질들, 기타 DNA 결합 단백질들이 있다.[136]유전학자들은 전체 툴킷 유전자를 밝혀내기 위해 기형 돌연변이체의 유전자들을 분리하여 분석하였다. 1970년대 말부터 1980년대 초에 크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스는 초파리 유충 발달에 필요한 거의 모든 유전자들을 밝혀냈다. 여기에는 적절한 체절을 만드는 데 필요한 수십 개의 유전자들, 세 겹의 조직층을 만드는 데 필요한 유전자들, 그리고 그 밖의 장식에 필요한 유전자들이 포함된다.[137] 초파리 연구를 확장하여 대부분의 척추동물과 다른 동물도 이와 유사한 유전자들을 가지고 있다는 것을 알아내면서, 진화발생생물학(이보디보) 발전의 토대를 닦았다.[138]
뉘슬라인-폴하르트와 위샤우스가 발견한 돌연변이들에게서 보인 충격적인 공통점은 유전자들이 곤충 구조의 기초 모듈이 되는 체절 단위 이상으로만 영향을 미쳤다는 점이다.[139][140] 유전자들은 기초가 되는 체절의 구조는 보존하지만, 체절의 배열에만 영향을 미쳤다. 발생이 마구잡이로 되지 않고, 특정 체절들이 전부 혹은 일부가 없어지거나 극성이 흐트러지는 패턴의 변화를 보였다. 또한 특정 기능이 비활성화되어도 다른 기능들은 정상적으로 작동했다.
이후 툴킷 유전자들에 대한 많은 연구를 통해, 오늘날 툴킷의 수많은 유전자들이 알려져 있다. 툴킷 유전자들은 대체로 다른 유전자들에 대한 스위치 역할을 해서 발생에 영향을 미친다. 툴킷의 큰 부분을 차지하는 것으로는 전사 요인과 신호전달경로에 속하는 단백질이 있다. 전사인자는, 마스터 유전자와 같이 DNA에 직접 결합해서 유전자의 전사를 조절한다. 한편, 한 세포가 다른 세포로 소통하기 위해 분비한 신호 단백질은 다른 세포의 수용체에 결합해서 그 세포의 모양과 분열 등에 관한 여러 변화를 일으킨다. 초파리 내에도 약 열 가지의 신호전달경로가 있는데, 세포와 세포를 넘나드는 신호, 수용체, 갖가지 중간물질 등의 신호전달 요소들 중 하나라도 돌연변이가 일어나면 전체 신호 체계가 무너지게 된다. 이후 생물학자들은 척추동물에서 초파리의 툴킷 유전자와 상동인 유전자를 찾아냈다.[141]
초파리와 사람처럼 확연하게 다른 신체 구조를 형성하는 유전자의 서열이 그토록 비슷할 수 있는 이유는 무엇일까? 초기의 과학자들은 초파리와 사람의 해부학적 구조 차이가 커서 초파리의 발생학적 과정 연구가 사람의 발생학적 과정의 연구에 도움이 되지 못할 것이라고 생각했다. 그러나 초파리의 눈을 형성하는데 관련하는 마스터 유전자인 '아이리스 유전자'와 대응되는 유전자 군이 다른 생물군에서도 발견되었고, 심지어 다른 생물군의 눈-형성 마스터 유전자를 초파리에 집어넣어도 정상적인 초파리의 눈이 형성되었다.[155] 또한 초파리의 말단부를 형성하는 유전자인 디스탈리스 유전자 또한 초파리와 유연관계가 적은 동물을 포함한 모든 동물의 몸에서 튀어나온 부속지들의 형성에 모두 관련됨을 보였다.[156]
크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스의 연구에 의하여 초파리 유충의 발달에 필요한 모든 유전자들이 알려지고[137], 대다수의 척추동물과 기타 동물들이 이에 대응하는 유전자들을 갖고 있다는 사실이 밝혀진 이후, 툴킷 유전자의 돌연변이는 모듈식 구조는 유지한 채 배열의 패턴에만 영향을 미친다는 사실이 밝혀졌다. 툴킷 유전자들은 다른 유전자들의 전사에 관한 스위치를 조절하며 발생에 영향을 주는데, 전사인자는 이러한 툴킷 유전자의 큰 부분을 차지한다.[158]
절지동물의 조상인 엽족동물과 가까운 유연관계에 있는 유조동물과 절지동물의 호메오 유전자를 비교한 결과, 절지동물의 호메오 유전자들이 유조동물과 절지동물의 공통 조상에 이미 존재하고 있었다는 사실이 밝혀졌다.[162][163] 이로써 호메오 유전자의 수가 폭발적으로 늘어난 것이 캄브리아기 대폭발의 원인이라는 가설이 깨어지게 되었고, 과학자들은 새로운 해답을 찾아야 했다. 이에 대한 대안으로 제시된 것이 스위치의 변화이다. 현생 절지동물의 설계들을 비교함으로써 과학자들은 호메오 유전자 발현 지역이 이동하면서 절지 동물 설계에서 주요한 차이들이 생겨났음을 알 수 있었다.[164][165][166] 따라서 부속지의 종류 및 기능이 다양해진 것은 체축을 따라 늘어선 서로 다른 영역에서 서로 다른 호메오 유전자들이 발현했기 때문이라고 할 수 있다. 초기 척추동물의 진화 과정은 캄브리아기 또는 그 이후 생물들의 진화과정과는 달리 호메오박스 또는 유전체를 복제하여 그 수 자체를 늘였다. 그러나 고등 척추동물의 진화 역사 후반에서는 유전자의 수가 중요한 요인이 아니었다. 척추동물의 신체 형태 진화는 절지동물과 비슷하게, 체축에서의 호메오 유전자의 발현 지역의 이동으로 이루어졌다.[167][168] 배아에서 호메오박스의 좌표를 통제하는 것은 바로 호메오 유전자의 스위치들이며, 이 스위치들의 DNA 서열이 변화함으로써 벌어지는 일이라는 것이 밝혀짐으로써 동물의 다양성 형성의 실마리가 풀렸다. 만약 호메오 단백질을 암호화하고 있는 서열 자체에 변화가 일어났다면 그 모든 기능들에 영향이 미쳤을 것이다. 그러나 실제로는 특정 스위치에만 변화가 일어났기 때문에 다른 신체 부속들에는 아무런 영향 없이 특정 모듈만 변화를 일으킬 수 있었다.
동물 형태 변화는 툴킷 유전자의 발명 그 자체에 있지 않다는 것이 알려지자, 최근에는 캄브리아기 대폭발의 원인이 생태적 현상이라는 의견이 지지를 얻고 있다. 툴킷 유전자들은 동물의 형태를 지시해주는 중요한 역할을 하나, 툴킷 자체는 가능성을 의미할 뿐, 운명을 지시하는 것은 아니다. 캄브리아기의 대폭발은 생태적 상호작용과 다양한 동물종이 증가함에 따라 경쟁의 압박이 갈수록 커져, 보다 복잡한 구조들이 쉴 새 없이 진화한 것으로 봐야 한다.[169]
기린은 긴 목을 위한 유전자를 가지고 있지 않으며, 코끼리는 큰 몸집을 위한 유전자를 가지고 있지 않다. 그들의 몸은 발달의 시작 시점을 조절하고, 배아의 특정 부분에서 발생하도록 하며, 지속 시간을 조절하는 스위칭 시스템에 의해 패턴화된다.[8]
배아 발달 조절의 수수께끼는 초파리 ''Drosophila melanogaster''를 모델 생물로 사용하여 해결되기 시작했다. 그 배아 발생의 단계별 제어는 배아에서 발현되는 유전자에 의해 생성된 특정 유형의 단백질에 서로 다른 색상의 형광 염료를 부착하여 시각화되었다.[8] 해파리에서 유래한 녹색 형광 단백질과 같은 염료는 초파리 단백질에 특정한 항체에 부착되어 살아있는 배아에서 해당 단백질이 나타나는 위치와 시점을 정확하게 나타내는 지표를 형성했다.[41]
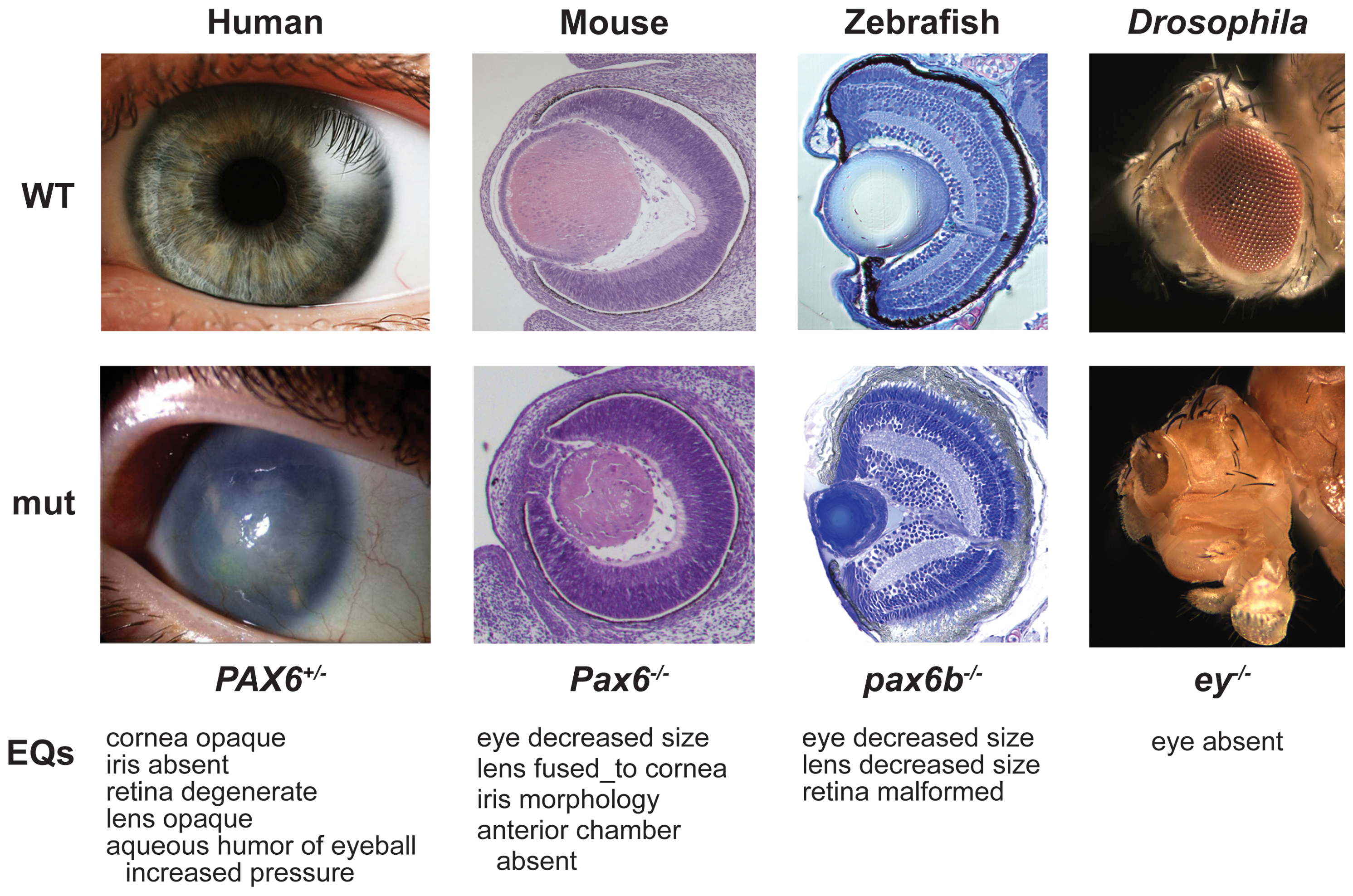
1994년, Walter Gehring은 초파리의 눈 형성에 필수적인 ''pax-6'' 유전자가 쥐와 인간의 눈 형성 유전자와 정확히 일치한다는 것을 발견했다. 동일한 유전자는 두족류 연체동물인 오징어와 같은 다른 많은 동물 그룹에서도 발견되었다. Ernst Mayr를 포함한 생물학자들은 서로 다른 유형의 눈의 해부학적 구조가 매우 다양하기 때문에 눈이 동물계에서 최소 40번 이상 나타났다고 믿었다.[8] 예를 들어, 초파리의 겹눈은 수백 개의 작은 렌즈 구조(ommatidia)로 구성되어 있으며, 인간의 눈은 맹점이 있어 시신경이 눈으로 들어가고 신경 섬유가 망막 표면을 지나기 때문에 빛이 망막의 감지 세포에 도달하기 전에 신경 섬유층을 통과해야 하므로 구조가 효과적으로 "거꾸로" 되어 있다. 반대로, 두족류의 눈은 망막, 신경 섬유층, 그리고 눈의 벽이 "올바른 방향"으로 되어 있다.[42] 그러나 ''pax-6''에 대한 증거는 동일한 유전자가 이 모든 동물의 눈의 발달을 제어하여 모두 공통 조상으로부터 진화했음을 시사한다는 것이었다.[8] 고대 유전자는 수백만 년의 진화를 통해 보존되어 유사한 기능을 위해 서로 다른 구조를 만들었으며, 한때 순전히 유사하다고 생각되었던 구조들 사이에 깊은 상동성을 보여주었다.[45][43] 이러한 개념은 나중에 배아 발생의 진화로 확장되었고[44] 진화 생물학에서 상동성의 의미를 근본적으로 수정하게 만들었다.[45][43][57]

생물체의 게놈에 있는 유전자 중 극히 일부가 생물체의 발생을 제어하며, 이를 발생-유전적 도구함이라고 한다. 이들은 문 사이에서 매우 잘 보존되어 있는데, 이는 이들이 매우 오래되었고 광범위하게 분리된 동물 그룹에서 매우 유사하다는 것을 의미한다. 도구함 유전자의 배포 차이는 체제와 신체 부위의 수, 정체성 및 패턴에 영향을 미친다. 대부분의 도구함 유전자는 신호 전달 경로의 일부이다. 즉, 전사 인자, 세포 접착 단백질, 세포 표면 수용체 단백질 및 이에 결합하는 신호 리간드, 배아를 통해 확산되는 분비 모포겐을 암호화한다. 이 모든 것은 배아에서 분화되지 않은 세포의 운명을 정의하는 데 도움이 된다. 이들은 함께 배아를 형성하고 궁극적으로 생물체의 체제를 형성하는 시간과 공간의 패턴을 생성한다. 가장 중요한 도구함 유전자 중에는 ''Hox'' 유전자가 있다. 이러한 전사 인자는 다른 도구함 유전자에서도 발견되는 홈박스 단백질 결합 DNA 모티프를 포함하며 앞뒤 축을 따라 신체의 기본 패턴을 만든다.[57]
Hox 유전자는 발달 중인 배아나 유충에서 뱀의 많은 척추와 같은 반복 부위가 어디에서 자랄지 결정한다.[8] 이미 언급한 ''Pax-6''는 전형적인 도구함 유전자이다.[46] 다른 도구함 유전자가 식물 체제를 확립하는 데 관여하지만,[47] 홈박스 유전자 역시 식물에서 발견되므로 이는 모든 진핵생물에 공통적임을 의미한다.[48][49][50]
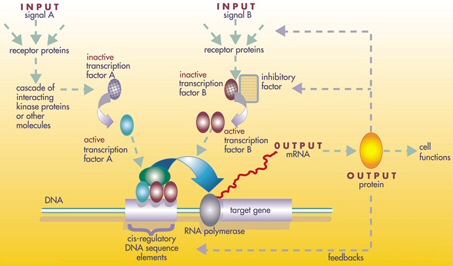
조절 도구 상자의 단백질 생성물은 중복 및 변형이 아닌, 여러 독립적인 발달 과정에 변경 없이 적용되는 다능성의 복잡한 모자이크를 통해 재사용되어, 여러 다른 신체 구조에 패턴을 부여한다.[57] 이러한 다능성 도구 상자 유전자의 위치는 크고 복잡하며 모듈식 시스-조절 요소를 갖는다. 예를 들어, 초파리의 비다능성 로돕신 유전자는 시스-조절 요소가 몇 백 염기쌍에 불과하지만, 다능성 eyeless 시스-조절 영역은 7000 염기쌍이 넘는 6개의 시스-조절 요소를 포함한다.[57] 관련 유전자 조절 네트워크는 종종 매우 크다. 각 조절 단백질은 "수십에서 수백" 개의 시스-조절 요소를 제어한다. 예를 들어, 67개의 초파리 전사 인자는 평균 124개의 표적 유전자를 각각 제어했다.[57] 이 모든 복잡성은 배아 발달에 관여하는 유전자가 정확히 올바른 시기와 장소에서 켜지고 꺼지도록 한다. 이러한 유전자 중 일부는 구조적이며, 배아의 효소, 조직 및 기관을 직접 형성한다. 그러나 다른 많은 유전자는 그 자체로 조절 유전자이므로, 켜지는 것은 종종 정확하게 시기를 맞춘 일련의 과정으로, 발달 중인 배아에서 하나씩 발달 과정을 켜는 것을 포함한다.[57]

이러한 계단식 조절 네트워크는 초파리 배아 발생에서 자세히 연구되었다. 어린 배아는 럭비공과 같은 타원형 모양이다. 소수의 유전자는 배아의 장축을 따라 농도 기울기를 설정하는 전령 RNA를 생성한다. 초기 배아에서 ''bicoid'' 및 ''hunchback'' 유전자는 앞쪽 끝 근처에서 고농도로 존재하며, 미래의 머리와 흉부에 패턴을 부여한다. ''caudal'' 및 ''nanos'' 유전자는 뒤쪽 끝 근처에서 고농도로 존재하며, 가장 뒤쪽의 복부 분절에 패턴을 부여한다. 이러한 유전자의 효과는 상호 작용한다. 예를 들어 Bicoid 단백질은 ''caudal''의 전사 번역을 차단하므로 Caudal 단백질 농도가 앞쪽 끝에서 낮아진다. Caudal은 나중에 초파리의 가장 뒤쪽 분절을 생성하는 유전자를 켜지만, 가장 농도가 높은 뒤쪽 끝에서만 발생한다.[51][52]

Bicoid, Hunchback 및 Caudal 단백질은 차례로 ''giant'', ''knirps'', ''Krüppel'', 및 ''tailless''와 같은 갭 유전자의 전사를 줄무늬 패턴으로 조절하여, 분절이 될 구조의 첫 번째 수준을 생성한다.[34] 이러한 단백질은 차례로 쌍 규칙 유전자를 제어하며, 다음 단계에서 배아의 장축을 따라 7개의 밴드를 설정한다. 마지막으로, ''engrailed''와 같은 분절 극성 유전자는 7개의 밴드를 각각 둘로 나누어, 14개의 미래 분절을 생성한다.[51][52]
이 과정은 도구 상자 유전자 서열의 정확한 보존을 설명하며, 이는 서로 다른 동물에서 도구 상자 단백질의 깊은 상동성과 기능적 등가성을 가져왔다(예를 들어, 마우스 단백질이 초파리 발달을 제어하는 경우). 전사 인자와 시스-조절 요소, 또는 신호 단백질과 수용체의 상호 작용은 여러 용도를 통해 고정되어, 거의 모든 돌연변이가 유해하며 자연 선택에 의해 제거된다.[57]
모든 동물의 앞뒤 축을 설정하는 메커니즘은 동일하며, 공통 조상을 암시한다. 양측 대칭 동물의 등배 축에도 유사한 메커니즘이 있지만, 절지동물과 척추동물 사이에서는 반전된다.[53] 또 다른 과정인 배아의 가스트룰라는 미오신 II 분자 모터에 의해 구동되며, 이는 종 사이에서 보존되지 않는다. 이 과정은 환경에서 바닷물의 움직임으로 시작되었을 수 있으며, 나중에 배아의 조직 움직임의 진화로 대체되었다.[54][55]
도구의 변이는 동물의 형태학적 진화의 상당 부분을 만들어냈을 수 있다. 도구는 두 가지 방식으로 진화를 이끌 수 있다. 도구 유전자는 다른 패턴으로 발현될 수 있는데, 예를 들어 다윈 핀치의 부리가 ''BMP'' 유전자에 의해 확대된 경우,[61] 또는 뱀이 ''distal-less''가 과소 발현되거나 다른 파충류가 사지를 계속 형성하는 곳에서 전혀 발현되지 않으면서 다리를 잃은 경우처럼 말이다.[62] 또는 도구 유전자는 새로운 기능을 얻을 수 있는데, 이는 척추동물의 턱,[63][64] 초파리의 다리와 더듬이,[65] 그리고 눈점 패턴과 같은 다양한 구조를 제어하는 동일한 유전자 ''distal-less''의 다양한 기능에서 볼 수 있다.[66] 도구 유전자의 작은 변화가 신체 구조의 상당한 변화를 일으킬 수 있다는 점을 감안할 때, 이는 종종 동일한 기능을 수렴적으로 또는 병렬적으로 가능하게 했다. ''distal-less''는 뮐러 의태인 나비 ''헬리코니우스 에라토''와 ''헬리코니우스 멜포메네''에서 날개 패턴을 생성한다. 소위 촉진된 변이에서,[67] 이들의 날개 패턴은 서로 다른 진화적 사건에서 발생했지만, 동일한 유전자에 의해 제어된다.[68] 발생적 변화는 종분화에 직접적으로 기여할 수 있다.[69]
4. 2. 윌리스턴의 법칙
고생물학자 새뮤얼 윌리스턴은 1914년 고대 해양 파충류를 연구하던 도중 초기 동물군에는 비슷한 부속들이 다수 반복되는 반면, 후대의 동물군에서는 부속의 수가 줄고 구조마다 한결 전문화된 형태가 나타난다는 사실을 알아차렸다. 그는 이 사실에서 ‘진화는 유기체 신체 부속들의 수가 줄어드는 방향으로, 줄어든 부위들이 기능 면에서는 훨씬 전문화되는 방향으로 진화한다’라는 윌리스턴의 법칙을 도출하였다. 쉽게 말해서 충분한 수를 확보한 연속 상동기관들은 기능의 전문화와 수의 감소를 향해 간다는 것이다.[142]4. 3. 초파리에서의 호메오 유전자
마스터 유전자 중 가장 유명한 호메오 유전자는 동물 발생의 툴킷 가운데 일부분이다. 초파리 형성에 관련된 유전자만 해도 수백 개 정도이고, 나머지 유전자들도 각자 초파리 세포 내에서 특화된 기능을 수행한다.[136] 1970년대 말부터 1980년대 초에 크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스는 초파리 유충이 발달하는데 필요한 거의 모든 유전자들을 낱낱이 밝혀냈다.[137] 이들은 초파리에 대한 연구를 확장시켜 대부분의 척추동물과 다른 동물도 이와 유사한 유전자들을 가지고 있다는 것을 알아내면서, 진화발생생물학(이보디보) 발전의 토대를 닦았다.[138]뉘슬라인-폴하르트와 위샤우스가 발견한 돌연변이들은 유전자들이 체절 단위 이상으로만 영향을 미쳤다는 공통점이 있었다.[139][140] 유전자들은 기초가 되는 체절의 구조는 보존했지만, 체절의 배열에만 영향을 미쳤다.
이후 툴킷 유전자들에 대한 많은 연구 끝에, 오늘날 툴킷의 수많은 유전자들이 알려져 있다. 툴킷 유전자들은 대체로 다른 유전자들에 대한 스위치 역할을 해서 발생에 영향을 미친다. 초파리 내에는 약 열 가지의 신호전달경로가 있는데, 이들 중 하나라도 돌연변이가 일어나면 전체 신호 체계가 무너지게 된다. 이후 생물학자들은 척추동물에서 초파리의 툴킷 유전자와 상동인 유전자를 찾아냈다.[141]
1915년, 유전학자 캘빈 브리지스가 작은 뒷날개가 앞날개의 크기만큼 큰 초파리 돌연변이체를 발견한 이후로[145], 다리가 머리에 달린 안테나페디아 돌연변이 등의 여러 호메오 돌연변이가 초파리에서 발견되면서 초파리에서의 이보디보 연구가 본격적으로 시작되었다.[146][147]
초파리에서의 호메오 돌연변이체들은 단 하나의 유전자의 문제로 몸 전체가 전혀 다르게 변했다는 특징이 있었다. 유전자 복제 기술이 보편화되면서, 몇몇 생물학자들이 초파리 돌연변이에 대한 연구에 뛰어들었다. 그들은 수년의 연구를 통해서 초파리의 호메오 유전자들이 두 개의 복합체로 나뉘어서, 초파리의 총 네 염색체 중 세 번째 염색체에 위치한다는 것을 알았다. 첫 번째 복합체는 세 개의 유전자로 이루어져 있고 초파리의 전체부를, 두 번째 복합체는 다섯 개의 유전자로 이루어져 있고 초파리의 후체부를 조절하고 있었다. 호메오 유전자들이 복합체 속에 배치된 순서가 유전자가 조절하는 몸 부위의 순서와 일치했다.[148]
1983년 이래 생물학자들은 두 복합체를 분석하면 초파리 형성의 규칙을 찾아낼 수 있다는 기대 아래에서 두 복합체의 DNA를 분석하기 시작했다. 연구 결과, 복합체 내 8개의 유전자로부터 다양한 호메오 단백질들이 발현되고, 이들은 각각 특정 신체부위에 독자적인 영향을 미치면서 공통적인 기능을 수행하고 있었다. 호메오 유전자들에 공통적으로 존재하는 180개 염기쌍 서열은 DNA 내에서 상자 모양으로 보였으므로 호메오박스 유전자라 불렸다.[149][150]
빌 맥기니스와 마이크 레빈은 초파리의 모든 호메오 유전자들에 호메오박스가 있다는 것을 확인하고, 주변에서 찾을 수 있는 여러 생물들에게서 DNA를 분리해 호메오박스를 찾기 시작했다. 두 사람은 초파리 이외의 동물에서도 호메오박스들을 발견하고 심지어 그것들이 매우 유사한 서열을 가지고 있음을 알아냈다.[151] 이를 통해, 학자들은 호메오 유전자들은 모든 생물의 발생에서 핵심적인 역할을 하므로, 잘 보전되어 왔음을 추정할 수 있었다.
몇 년 후, 쥐의 호메오 유전자 배열을 초파리와 비교해본 결과 마찬가지로 유전자들이 몇 개로 나뉜 복합체로 존재하였다. 각 복합체 속 유전자 배열은 초파리에서와 같이 유전자가 발현되어 영향을 미치는 쥐의 신체부위 순서와 일치했다.[152][153]
발터 게링 실험실에서는 초파리의 아이리스(눈 없음) 유전자를 발견하고 사람에게도 이와 대응되는 유전자 아니리디아(무홍채)가 있다는 것을 알았다.[154] 아니리디아 유전자는 또한 쥐의 스몰아이 유전자와 같았다. 아이리스 유전자가 초파리의 다른 신체부위에서 발현되도록 조작을 하면 그 부위들에서 눈 조직이 형성될 수 있음을 확인했다.[155] 이로써 아이리스 유전자가 눈 발생을 조절하는 마스터 유전자임을 알게 되었다. 쥐의 스몰아이 유전자를 초파리에 넣었을 때, 쥐가 아닌 초파리의 눈 조직이 유도되었다. 쥐 유전자가 파리의 눈 발생을 촉진한 것이었다. 이후, 아이리스, 아니리디아, 스몰아이 유전자를 묶어 팍스-6 유전자라 부르기 시작했고, 이들은 모든 종류의 동물에서 눈 형성과 연관되어 있다.
유전자에 손상을 입으면 초파리의 다리의 바깥쪽에 변이가 일어나는 디스탈리스 유전자가 모든 생물의 부속지를 만드는데 사용되고[156], 초파리의 심장 형성에 필수적인 틴먼 유전자들이 척추동물의 심장 형성에도 중요하게 작용한다고 밝혀졌다.[157]
초파리의 발생학적 과정 연구는 사람의 발생학적 과정 연구에 도움을 주었다. 초파리의 눈을 형성하는데 관련하는 마스터 유전자인 '아이리스 유전자'와 대응되는 유전자 군이 다른 생물군에서도 발견되었고, 심지어 다른 생물군의 눈-형성 마스터 유전자를 초파리에 집어넣어도 정상적인 초파리의 눈이 형성되었다.[155] 또한 초파리의 말단부를 형성하는 유전자인 디스탈리스 유전자 또한 초파리와 유연관계가 적은 동물을 포함한 모든 동물의 몸에서 튀어나온 부속지들의 형성에 모두 관련됨을 보였다.[156]
4. 4. 이보디보의 확장
이보디보(Evo-devo)는 진화와 발생 생물학을 결합한 분야로, 동물의 다양성이 어떻게 진화했는지 연구한다. 특히 1970년대 크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스의 초파리 연구를 통해 큰 발전을 이루었다. 이들은 초파리 발생에 필요한 유전자들을 발견하고, 이 유전자들이 다른 동물들에게도 유사하게 존재한다는 것을 밝혀냈다.[137][138]고생물학자 새뮤얼 윌리스턴은 1914년 고대 해양 파충류 연구에서 초기 동물군에는 비슷한 부속이 반복되지만, 후대 동물군에서는 부속 수가 줄고 전문화된다는 사실을 발견했다. 그는 이를 '유기체 신체 부속 수가 줄고 기능은 전문화되는 방향으로 진화한다'는 윌리스턴의 법칙으로 정리했다.[142]

분자생물학자들은 초파리에서 발견된 호메오 유전자를 탐침으로 사용하여 선충에서 코끼리까지 모든 동물에서 호메오 유전자의 존재와 염기 서열 유사성을 확인했다.[151] 이는 호메오박스가 진핵생물 진화 초기에 나타났음을 시사한다. 쥐의 호메오 유전자 배열 연구는 호메오박스 기능에 의문을 품던 학자들조차 그 중요성을 인정하게 했다. 쥐의 호메오 유전자는 파리처럼 복합체를 이루고, 배열 순서는 쥐 신체 부위 순서와 대응했다. 이는 동물 호메오 유전자 유사성이 서열뿐 아니라 복합체 조직, 배아 활용 방식까지 미침을 보여준다. 호메오 유전자 복합체가 동물 발생에 동일하게 영향을 미친다는 사실은 명백해졌다.[152]
이보디보는 진화적 혁신이 기존 구조 변형을 통해 이루어진다고 주장한다. 즉, A에서 B로 가는 것이지, 없는 곳에서 B로 가는 것이 아니다. 또한 다기능성과 중복성을 통해 여러 기능을 하는 구조가 중복되면, 노동 분업으로 다른 구조로 전문화되어 다양한 기관을 만들 수 있다. 모듈성 덕분에 익룡의 손가락, 뱀의 척추, 박쥐의 날개처럼 각 신체 부속이 독립적으로 변형, 전문화될 수 있었다. 이보디보 논리에 따르면, 생물 다양성은 새로운 생태지위 획득과 다양성 확장을 통해 이루어진다.[160]
진화 역사는 '군비 확장 경쟁'과 같다. 더 나은 부속지를 위한 경쟁은 반복되는 신체 설계 덕분에 가능했다. 기능 부담을 적은 수의 구조로 옮기고, 자유로워진 구조를 전문화시킬 수 있기 때문이다.[170]
4. 4. 1. 신체 형성 유전자 툴킷
마스터 유전자 중 가장 유명한 호메오 유전자와 눈, 부속지, 심장을 만드는 십여 개의 유전자들은 동물 발생에 관여하는 유전자 툴킷의 일부이다. 초파리 형성에 관련된 유전자만 해도 수백 개이며, 이 외에도 많은 유전자들이 초파리 세포 내에서 특화된 기능을 수행한다. 동물 신체 발생과 무늬 형성을 통제하는 툴킷에는 호메오 단백질, 신체 형성 마스터 유전자, 세포 형태조절인자, 헤지호그 및 기타 신호전달 단백질, 세포 수용체, 호르몬, 착색 단백질, DNA 결합 단백질 등이 포함된다.[136]유전학자들은 툴킷 유전자를 밝혀내기 위해 기형 돌연변이체의 유전자를 분리, 분석했다. 1970년대 말부터 1980년대 초, 크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스는 초파리 유충 발달에 필요한 거의 모든 유전자, 즉 적절한 체절 생성, 세 겹의 조직층 형성, 기타 장식에 필요한 유전자들을 밝혀냈다.[137] 초파리 연구를 확장하여 대부분의 척추동물과 다른 동물도 유사한 유전자를 가지고 있음을 알아내면서, 진화발생생물학 발전의 토대를 닦았다.[138]
뉘슬라인-폴하르트와 위샤우스가 발견한 돌연변이들은 유전자가 곤충 구조의 기초 모듈인 체절 단위 이상으로 영향을 미친다는 공통점을 보였다.[139][140] 유전자들은 기초 체절 구조는 보존했지만, 체절 배열에만 영향을 미쳐 발생이 특정 패턴의 변화(체절 소실, 극성 흐트러짐 등)를 나타냈다. 특정 기능 비활성화에도 다른 기능은 정상 작동했다.
이후 연구를 통해 많은 툴킷 유전자들이 밝혀졌다. 툴킷 유전자들은 대체로 다른 유전자에 대한 스위치 역할을 하여 발생에 영향을 미친다. 전사 요인과 신호전달경로에 속하는 단백질이 툴킷의 큰 부분을 차지한다. 마스터 유전자와 같은 전사 요인은 DNA에 직접 결합하여 유전자 전사를 조절한다. 한 세포가 다른 세포와 소통하기 위해 분비한 신호 단백질은 다른 세포의 수용체에 결합하여 모양과 분열 등 여러 변화를 일으킨다. 초파리 내에는 약 열 가지의 신호전달경로가 있으며, 신호전달 요소 중 하나라도 돌연변이가 일어나면 전체 신호 체계가 무너진다. 생물학자들은 척추동물에서 초파리의 툴킷 유전자와 상동인 유전자를 찾아냈다.[141]
초파리와 사람처럼 다른 신체 구조를 형성하는 유전자 서열이 비슷한 이유는, 초기에 과학자들이 생각했던 것과 달리 초파리 발생 연구가 사람 발생 연구에 도움을 줄 수 있음을 보여준다. 초파리의 눈 형성 마스터 유전자인 '아이리스 유전자'와 대응되는 유전자 군이 다른 생물군에서도 발견되었고, 다른 생물군의 눈 형성 마스터 유전자를 초파리에 넣어도 정상적인 초파리 눈이 형성되었다.[155] 초파리 말단부 형성 유전자인 디스탈리스 유전자 또한 모든 동물의 부속지 형성에 관련됨을 보였다.[156]
크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스의 연구로 초파리 유충 발달에 필요한 유전자들이 밝혀지고,[137] 척추동물과 기타 동물들이 대응 유전자를 가짐이 밝혀진 후, 툴킷 유전자 돌연변이는 모듈 구조는 유지한 채 배열 패턴에만 영향을 미친다는 사실이 밝혀졌다. 툴킷 유전자들은 다른 유전자 전사 스위치를 조절하며 발생에 영향을 주는데, 전사인자가 툴킷 유전자의 큰 부분을 차지한다.[158]
고생물학자들은 화석 연구를 통해 지구 역사상 짧은 기간 내에 동물의 복잡성이 급증한 캄브리아기의 대폭발 시점을 발견했다.[161] 발생학 발전으로 과학자들은 유전자가 캄브리아기 대폭발에서 어떤 역할을 했는지 밝혀낼 수 있었다.
캄브리아기 동물군들은 반복되는 신체부속 종류와 수의 다양성이 진화했음을 보여주는데, 이는 윌리스턴의 법칙을 드러내는 예이다.[142]
새로운 유전자 진화가 새로운 신체 설계와 구조 등장에 필수적이라는 통념과 달리, 절지동물 조상인 엽족동물과 가까운 유조동물과 절지동물의 호메오 유전자를 비교한 결과, 절지동물 호메오 유전자가 이미 공통 조상에 존재했음이 밝혀졌다.[162][163] 호메오 유전자 수 증가가 캄브리아기 대폭발 원인이라는 가설이 깨지고, 과학자들은 스위치 변화를 대안으로 제시했다. 현생 절지동물 설계를 비교하여 호메오 유전자 발현 지역 이동이 절지 동물 설계 차이를 유발했음을 알 수 있었다.[164][165][166] 부속지 다양성은 체축을 따라 다른 영역에서 다른 호메오 유전자가 발현했기 때문이다. 초기 척추동물 진화는 호메오 복합체 또는 유전체 복제로 수를 늘렸지만, 고등 척추동물 진화는 절지동물과 비슷하게 체축에서 호메오 유전자 발현 지역 이동으로 이루어졌다.[167][168] 배아에서 호메오박스 좌표를 통제하는 것은 호메오 유전자 스위치이며, 이 스위치 DNA 서열 변화가 동물군 다양성 형성 실마리이다. 호메오 단백질 암호화 서열 자체 변화는 모든 기능에 영향을 주지만, 실제로는 특정 스위치만 변화하여 특정 모듈만 변화를 일으켰다.
동물 형태 변화가 툴킷 유전자 발명 자체가 아닌 생태적 현상에 있다는 의견이 지지를 받고 있다. 툴킷 유전자는 형태 지시에 중요하지만, 가능성을 의미할 뿐 운명을 지시하는 것은 아니다. 캄브리아기 대폭발은 생태적 상호작용과 경쟁 압박 증가로 복잡한 구조들이 진화한 결과이다.[169]
다양한 동물의 구형 알은 해파리, 바닷가재, 나비, 코끼리 등 독특한 형태를 만든다. 이들은 콜라겐 등 신체 구성 단백질 구조 유전자를 공유하지만, 각 동물 그룹은 자체 발달 규칙을 가질 것으로 예상되었다. 그러나 신체 모양 조절 유전자는 매우 적고 모든 동물이 공유하는 오래된 유전자라는 것이 진화발생생물학의 놀라움이다. 기린은 긴 목 유전자, 코끼리는 큰 몸집 유전자를 가진 것이 아니다. 이들의 몸은 발생 시점, 부위, 지속 시간을 조절하는 스위칭 시스템에 의해 패턴화된다.[8]
배아 발달 조절 수수께끼는 초파리 ''Drosophila melanogaster''를 모델 생물로 사용하여 해결되기 시작했다. 배아 발생 단계별 제어는 형광 염료를 부착하여 시각화되었다.[8] 해파리 유래 녹색 형광 단백질 등 염료는 초파리 단백질 특정 항체에 부착되어 살아있는 배아에서 단백질 위치와 시점을 나타내는 지표를 형성했다.[41]
1994년, Walter Gehring은 초파리 눈 형성 필수 유전자 ''pax-6''가 쥐와 인간 눈 형성 유전자와 일치함을 발견했다. 동일 유전자는 오징어 등 다른 동물 그룹에서도 발견되었다. Ernst Mayr 등 생물학자들은 눈 해부학적 구조 다양성 때문에 눈이 동물계에서 최소 40번 이상 나타났다고 믿었다.[8] 초파리 겹눈은 수백 개 작은 렌즈 구조(ommatidia)로 구성, 인간의 눈은 맹점이 있어 구조가 "거꾸로" 되어 있다. 두족류 눈은 망막, 신경 섬유층, 눈 벽이 "올바른 방향"이다.[42] 그러나 ''pax-6'' 증거는 동일 유전자가 모든 동물 눈 발달을 제어하여 공통 조상으로부터 진화했음을 시사했다.[8] 고대 유전자는 수백만 년 진화 동안 보존되어 유사 기능 위해 다른 구조를 만들었고, 유사하다고 생각되었던 구조들 사이에 깊은 상동성을 보여주었다.[45][43] 이 개념은 배아 발생 진화로 확장되었고[44] 상동성 의미를 수정했다.[45][43][57]
생물 게놈 내 소수 유전자가 발생을 제어하며, 발생 관여 툴킷 유전자라고 불린다. 이들은 문(門) 사이에서 고도로 보존, 진화 초기 획득을 의미한다. 툴킷 유전자는 발생 과정에서 몸 기본 골격과 신체 부분 수, 동일성, 패턴 차이에 영향을 미친다. 대부분 툴킷 유전자는 신호 전달 경로 일부이며, 전사 인자, 세포 접착 단백질, 세포 표면 수용체 단백질 및 신호 전달 리간드, 분비된 형태 발생자를 코딩한다. 이들은 미분화 세포 운명 결정에 기여한다. 툴킷 유전자는 배아 형성 시간적, 공간적 패턴을 생성, 생물 기본 골격을 형성한다. Hox 유전자는 중요 툴킷 유전자이다. 이들 전사 인자는 홈박스 단백질 결합 DNA 모티프를 포함, 앞뒤 축 따라 신체 기본 패턴을 생성한다. Hox 유전자는 반복적 부분이 얼마나 성장할지 결정한다. Pax-6는 고전적 툴킷 유전자이다. 홈박스 유전자는 식물에도 발견, 모든 진핵생물에 공통적임을 시사한다.
툴킷 단백질 생성물은 중복 및 수정이 아닌 다면적 모자이크로 재사용, 많은 독립적 발생 과정에서 적응, 다른 신체 구조에 패턴을 부여한다. 툴킷 유전자는 크고 복잡한 조절 서열을 갖는다. 초파리 로돕신 유전자는 수백 염기쌍 길이 조절 서열, 아이레스시스 유전자 조절 영역은 7000 염기쌍 이상, 6개 시스 조절 엘리먼트를 포함한다. 조절 네트워크는 매우 크다. 각 조절 단백질은 수백 개 조절 서열을 제어한다. 초파리 67개 전사 인자는 평균 124개 표적 유전자를 제어한다. 이 복잡성은 배아 발생 관여 유전자 정확한 시기, 장소, 스위치 켜고 끔을 가능하게 한다. 스위치 켜고 꺼지는 유전자 일부는 구조 유전자, 효소 생성, 배아 조직 및 기관 형성한다. 다른 많은 유전자는 조절 유전자, 스위치 켜는 것은 전환 캐스케이드, 발생 과정 시작이다.
캐스케이드 조절 네트워크는 초파리 배아 발생에서 연구되었다. 어린 배아는 럭비공 모양 타원형이다. 소수 유전자가 배아 장축 따라 농도 기울기를 만든다. 초기 배아에서 비코이드 및 허치백 유전자는 전단 부근 고농도, 머리 및 흉부 패턴 부여한다. 코달 및 나노스 유전자는 후단 부근 고농도, 뒤쪽 복부 패턴 부여한다. 이들 유전자 작용은 상호 작용한다. 비코이드 단백질은 꼬리 부분 메신저 RNA 번역 차단, 꼬리 부분 단백질 농도 전단부 낮다. 코달은 뒷면 뒷다리 부분 생성 유전자 스위치, 후단부 집중이다.
비코이드, 허치백, 코달 단백질은 giant 유전자, knirps 유전자, Kruppel 유전자, tailless 유전자 등 갭 유전자 전사를 줄무늬 패턴 발현으로 제어, 분절 구조 첫 단계 만든다. 이들은 페어룰 유전자 제어, 다음 단계 배아 장축 7개 밴드 만든다. 마지막으로, 노치 등 세그먼트 폴라리티 유전자는 7개 밴드 각각 2개 분할, 14개 세그먼트 만든다.
이 과정은 다른 종 동물에서 툴킷 유전자 깊은 상동성 갖는다는 것 설명한다. 염기 서열 보존, 같은 기능 갖는다 (쥐 단백질 초파리 발육 제어, 상동성). 전사 인자와 시스 조절 엘리먼트, 신호 전달 단백질과 수용체 상호 작용은 여러 용도 사용, 변이 유해하여 보존된다.
4. 4. 2. 공통의 툴킷 유전자
마스터 유전자 중 가장 잘 알려진 것은 호메오 유전자인데, 이 유전자들은 눈, 부속지, 심장을 만드는 십여 개의 유전자들과 함께 동물 발생을 담당하는 유전자 툴킷의 일부이다. 초파리 형성에만 수백 개의 유전자가 관여하며, 나머지 많은 유전자들은 초파리 세포 내에서 특화된 기능을 수행한다. 동물 신체의 발생과 무늬 형성을 통제하는 툴킷에는 호메오 단백질, 신체 형성 마스터 유전자, 세포 형태조절인자, 헤지호그 및 기타 신호전달 단백질, 세포 수용체, 호르몬, 착색 단백질, 기타 DNA 결합 단백질 등이 있다.[136]유전학자들은 툴킷 유전자를 밝혀내기 위해 기형 돌연변이체의 유전자를 분리, 분석했다. 1970년대 말~1980년대 초, 크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스는 초파리 유충 발달에 필요한 거의 모든 유전자, 즉 적절한 체절 생성, 세 겹의 조직층 형성, 기타 장식에 필요한 유전자들을 밝혀냈다.[137] 이들은 초파리 연구를 확장하여 대부분의 척추동물과 다른 동물도 유사한 유전자를 가지고 있음을 알아내면서, 진화발생생물학 발전의 토대를 닦았다.[138]
뉘슬라인-폴하르트와 위샤우스가 발견한 돌연변이들은 유전자가 곤충 구조의 기초 모듈인 체절 단위 이상으로 영향을 미친다는 공통점을 보였다.[139][140] 유전자들은 기초 체절 구조는 보존하지만, 체절 배열에만 영향을 미쳐 특정 체절이 없어지거나 극성이 흐트러지는 패턴 변화를 일으켰다. 특정 기능이 비활성화되어도 다른 기능은 정상 작동했다.
이후 툴킷 유전자에 대한 많은 연구로, 오늘날 툴킷의 수많은 유전자들이 알려져 있다. 툴킷 유전자들은 대체로 다른 유전자에 대한 스위치 역할을 하여 발생에 영향을 미친다. 툴킷의 큰 부분을 차지하는 것은 전사 요인과 신호전달경로에 속하는 단백질이다. 전사 요인은 마스터 유전자처럼 DNA에 직접 결합해서 유전자의 전사를 조절한다. 한 세포가 다른 세포와 소통하기 위해 분비한 신호 단백질은 다른 세포의 수용체에 결합, 그 세포의 모양과 분열 등에 변화를 일으킨다. 초파리 내에는 약 열 가지의 신호전달경로가 있는데, 세포 간 신호, 수용체, 중간물질 등 신호전달 요소 중 하나라도 돌연변이가 일어나면 전체 신호 체계가 무너진다. 이후 생물학자들은 척추동물에서 초파리의 툴킷 유전자와 상동인 유전자를 찾아냈다.[141]
초파리와 사람처럼 확연히 다른 신체 구조를 형성하는 유전자 서열이 비슷한 이유는, 초기에 과학자들이 초파리와 사람의 해부학적 구조 차이가 커서 초파리 발생 연구가 사람 발생 연구에 도움이 되지 않을 것이라고 생각했기 때문이다. 그러나 초파리의 눈 형성 마스터 유전자인 '아이리스 유전자'와 대응되는 유전자 군이 다른 생물군에서 발견되었고, 다른 생물군의 눈 형성 마스터 유전자를 초파리에 넣어도 정상적인 초파리 눈이 형성되었다.[155] 초파리의 말단부 형성 유전자인 디스탈리스 유전자 또한 초파리와 유연관계가 적은 동물을 포함한 모든 동물의 몸에서 튀어나온 부속지 형성에 관련됨을 보였다.[156]
크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스의 연구로 초파리 유충 발달에 필요한 모든 유전자들이 알려지고,[137] 대다수의 척추동물과 기타 동물들이 대응 유전자를 갖고 있다는 사실이 밝혀졌다. 툴킷 유전자 돌연변이는 모듈식 구조는 유지한 채 배열 패턴에만 영향을 미친다는 사실이 밝혀졌다. 툴킷 유전자들은 다른 유전자들의 전사 스위치를 조절하며 발생에 영향을 주는데, 전사인자는 이러한 툴킷 유전자의 큰 부분을 차지한다.[158]
생물체의 게놈에 있는 유전자 중 극히 일부가 생물체의 발생을 제어한다. 이러한 유전자를 발생-유전적 도구함이라고 한다. 이들은 문 사이에서 매우 잘 보존되어 있는데, 이는 이들이 매우 오래되었고 광범위하게 분리된 동물 그룹에서 매우 유사하다는 것을 의미한다. 도구함 유전자의 배포 차이는 체제와 신체 부위의 수, 정체성 및 패턴에 영향을 미친다. 대부분의 도구함 유전자는 신호 전달 경로의 일부이다. 즉, 전사 인자, 세포 접착 단백질, 세포 표면 수용체 단백질 및 이에 결합하는 신호 리간드, 배아를 통해 확산되는 분비 모포겐을 암호화한다. 이 모든 것은 배아에서 분화되지 않은 세포의 운명을 정의하는 데 도움이 된다. 이들은 함께 배아를 형성하고 궁극적으로 생물체의 체제를 형성하는 시간과 공간의 패턴을 생성한다. 가장 중요한 도구함 유전자 중에는 Hox 유전자가 있다. 이러한 전사 인자는 다른 도구함 유전자에서도 발견되는 홈박스 단백질 결합 DNA 모티프를 포함하며 앞뒤 축을 따라 신체의 기본 패턴을 만든다.[57] Hox 유전자는 발달 중인 배아나 유충에서 뱀의 많은 척추와 같은 반복 부위가 어디에서 자랄지 결정한다.[8] 이미 언급한 Pax-6는 고전적인 도구함 유전자이다.[46] 다른 도구함 유전자가 식물 체제를 확립하는 데 관여하지만,[47] 홈박스 유전자 역시 식물에서 발견되므로 이는 모든 진핵생물에 공통적임을 의미한다.[48][49][50]
4. 4. 3. 툴킷 역설과 다양성의 기원
초파리와 사람처럼 확연하게 다른 신체 구조를 형성하는 유전자의 서열이 놀라울 정도로 유사하다는 사실은 초기 진화발생생물학 연구의 중요한 발견 중 하나이다. 과학자들은 초파리의 발생 과정을 연구하는 것이 사람의 발생 과정을 이해하는 데 도움이 되지 않을 것이라고 예상했지만, 이는 잘못된 생각이었다. 초파리의 눈 형성에 관여하는 '아이리스 유전자'에 대응하는 유전자군이 다른 생물군에서도 발견되었고, 심지어 다른 생물군의 눈 형성 마스터 유전자를 초파리에 이식해도 정상적인 초파리의 눈이 형성되었다.[155] 또한, 초파리의 말단부 형성에 관여하는 디스탈리스 유전자는 초파리와 유연관계가 먼 동물을 포함한 모든 동물의 부속지 형성에 관여하는 것으로 밝혀졌다.[156]크리스티안네 뉘슬라인-폴하르트와 에릭 위샤우스의 연구를 통해 초파리 유충 발달에 필요한 유전자들이 밝혀졌고,[137] 대부분의 척추동물과 기타 동물들이 이에 대응하는 유전자들을 가지고 있다는 사실이 밝혀졌다. 툴킷 유전자의 돌연변이는 모듈 구조는 유지한 채 배열 패턴에만 영향을 미친다는 사실이 밝혀졌으며, 전사인자는 이러한 툴킷 유전자의 큰 부분을 차지하며 다른 유전자들의 전사를 조절하는 스위치 역할을 한다.[158]
고생물학자들은 화석 연구를 통해 지구 역사상 비교적 짧은 기간 동안 동물의 복잡성이 급격하게 증가한 캄브리아기 대폭발 시기를 밝혀냈다.[161] 이 시기 동안 다양한 동물들이 폭발적으로 진화한 원인에 대한 여러 가설이 제시되었지만, 발생학의 발전을 통해 유전자의 역할을 밝혀낼 수 있게 되었다.
캄브리아기 동물군에서 반복되는 신체부속의 종류와 수가 다양하게 진화한 것은 윌리스턴의 법칙을 보여주는 대표적인 예이다.[142] 새로운 신체 구조가 등장하기 위해서는 새로운 유전자가 진화해야 한다는 일반적인 생각과 달리, 절지동물의 조상인 엽족동물과 가까운 유조동물과 절지동물의 호메오 유전자를 비교한 결과, 절지동물의 호메오 유전자들이 이미 공통 조상에 존재했다는 사실이 밝혀졌다.[162][163] 이는 호메오 유전자의 수 증가가 캄브리아기 대폭발의 원인이라는 가설을 반박하며, 과학자들은 새로운 해답을 찾게 되었다.
이에 대한 대안으로 제시된 것이 스위치의 변화이다. 현생 절지동물의 설계를 비교함으로써 과학자들은 호메오 유전자 발현 영역이 이동하면서 절지 동물 설계에서 주요한 차이들이 생겨났음을 알 수 있었다.[164][165][166] 즉, 부속지의 종류 및 기능 다양성은 체축을 따라 늘어선 서로 다른 영역에서 서로 다른 호메오 유전자들이 발현했기 때문이라고 할 수 있다. 척추동물의 진화 과정에서도 비슷한 현상이 발견되는데, 초기 척추동물은 호메오 복합체 또는 유전체를 복제하여 그 수를 늘렸지만, 고등 척추동물의 진화 후반에는 유전자 수가 중요한 요인이 아니었다. 척추동물의 신체 형태 진화는 절지동물과 비슷하게 체축에서 호메오 유전자 발현 영역의 이동으로 이루어졌다.[167][168]
배아에서 호메오박스의 좌표를 통제하는 것은 호메오 유전자의 스위치들이며, 이 스위치들의 DNA 서열 변화가 동물군 다양성 형성의 실마리를 제공한다. 호메오 단백질을 암호화하는 서열 자체에 변화가 일어났다면 모든 기능에 영향이 미쳤겠지만, 실제로는 특정 스위치에만 변화가 일어났기 때문에 다른 신체 부속에는 영향 없이 특정 모듈만 변화를 일으킬 수 있었다.
동물 형태 변화가 툴킷 유전자의 발명 자체가 아니라 조절 시스템의 변화에 있다는 것이 알려지면서, 최근에는 캄브리아기 대폭발의 원인이 생태적 현상이라는 의견이 지지를 받고 있다. 툴킷 유전자들은 동물의 형태를 지시하는 중요한 역할을 하지만, 툴킷 자체는 가능성을 의미할 뿐 운명을 결정하는 것은 아니다. 캄브리아기 대폭발은 생태적 상호작용과 다양한 동물 종 증가에 따른 경쟁 압박으로 인해 복잡한 구조들이 끊임없이 진화한 결과로 해석된다.[169]
5. 동물 다양성 형성
진화는 더 나은 생존을 위한 '군비 확장 경쟁'과 유사하며, 더 효율적인 부속지를 획득하기 위한 경쟁이었다. 이러한 부속지 진화는 반복되는 신체 설계 덕분에 가능했다. 즉, 여러 구조에 분산된 기능을 소수의 구조로 집중시키고, 나머지 구조는 새로운 목적에 맞게 전문화할 수 있었다.[170]
절지동물의 진화에서 부속지 형태학은 중요한 주제였다. 핵심은 공통 조상의 이분지(二分枝)형 부속지인데,[161] 모든 부속지가 이분지형 부속지에서 변형되었기 때문이다. 과거에는 외형적 형태에만 의존하여 다리가 단순한 곤충류, 지네류, 노래기류, 유조류와 갈라진 부속지를 가진 갑각류, 삼엽충류, 전갈류, 투구게류를 서로 다른 종류로 분류했다.
그러나 최근 연구는 이분지형 다리가 단순한 관 모양이었던 엽족동물의 엽상족으로부터 진화했을 가능성을 제시한다.[171][172] 이를 뒷받침하는 진화발생생물학적 증거로, 유조동물의 엽상족과 절지동물의 다리 분지에서 공통으로 부속지 형성을 돕는 디스탈리스 유전자가 발현되는 것이 확인되었다.[173][174] 이는 갈라진 다리나 갈라지지 않은 다리나 모든 절지동물 부속지 형태가 독립적으로 발명된 것이 아니라 공통의 고대 엽상족에서 진화했음을 보여준다.
5. 1. 캄브리아기 대폭발
고생물학자들은 화석을 연구하던 도중 지구 역사상 비교적 짧은 기간 내에 동물의 복잡성이 급격하게 증가한 시점이 있음을 밝혀내었다.[161] 이를 캄브리아기의 대폭발이라고 부르는데, 이를 둘러싸고 여러 의문들이 제기되었다. 폭발을 점화시킨 요인은 무엇인가? 캄브리아기의 기묘한 화석 구조들, 현생 동물군들과는 다른 이런 구조들이 현생 동물군들과는 어떠한 관계가 있을까? 이렇게 복잡한 동물들이 하필 이때 처음 등장한 까닭은 무엇인가? 이에 대하여 다양한 가설이 제시되었지만, 발생학의 극적인 발전으로 캄브리아기의 대폭발에서 과학자들은 유전자가 어떠한 역할을 맡았는지 밝혀낼 수 있게 되었다.캄브리아기 동물군들을 보고 제일 먼저 지적하게 되는 점은 반복되는 신체부속의 종류와 수가 다양하게 진화했다는 사실인데, 이는 윌리스턴의 법칙을 극적으로 드러내는 예이다.[142]
동물의 형태 변화는 툴킷 유전자의 발명 그 자체에 있지 않다는 것이 알려지자, 최근에는 캄브리아기 대폭발의 원인이 생태적 현상이라는 의견이 지지를 얻고 있다. 툴킷 유전자들은 동물의 형태를 지시해주는 중요한 역할을 하나, 툴킷 자체는 가능성을 의미할 뿐, 운명을 지시하는 것은 아니다. 캄브리아기의 대폭발은 생태적 상호작용과 다양한 동물종이 증가함에 따라 경쟁의 압박이 갈수록 커져, 보다 복잡한 구조들이 쉴 새 없이 진화한 것으로 봐야 한다.[169]
곤충의 날개의 유래는 오래전부터 논란이 되어온 풀리지 않는 미스터리였다. 날개 없는 곤충의 흉부 외피가 바깥으로 자라서 날개를 만든 것이라는 주장과 조상동물의 아가미로부터 날개가 생겨났을 것이라는 주장이 팽팽히 맞서 좀처럼 합의를 이루지 못했다. 이보디보는 이에 대하여 강력하고 확실한 증거를 제시하였다. 미할리스 아베로프와 스티븐 코언은 초파리의 날개 발생 과정을 연구하여 날개를 형성하는데 필요한 툴킷 단백질들을 밝히고, 이 단백질들이 다른 절지동물의 부속지에도 발현되는지 조사해보았는데, 놀랍게도 갑각류 부속지의 외분지, 즉 호흡 분지에서 선택적으로 발현하였다. 이 연구 결과는 호흡 분지와 곤충의 날개가 상동기관이라는 결론을 낳았다. 이는 곤충의 날개가 조상 생물의 아가미에서 나왔다는 이론을 뒷받침하기에 충분했다.[175]
5. 2. 공통의 툴킷 유전자와 스위치의 변화
캄브리아기 동물군들을 보면 반복되는 신체부속의 종류와 수가 다양하게 진화했다는 사실을 알 수 있는데, 이는 윌리스턴의 법칙을 극적으로 보여주는 예이다.[142]곤충 날개의 기원은 오랫동안 논란거리였다. 날개 없는 곤충의 흉부 외피가 바깥으로 자라 날개가 되었다는 주장과 조상 동물의 아가미에서 날개가 생겨났다는 주장이 맞섰다. 미할리스 아베로프와 스티븐 코언은 초파리의 날개 발생 과정을 연구하여 날개 형성에 필요한 툴킷 단백질을 밝히고, 이 단백질들이 다른 절지동물의 부속지에도 발현되는지 조사했다. 놀랍게도 갑각류 부속지의 외분지(호흡 분지)에서 선택적으로 발현되었다. 이는 호흡 분지와 곤충 날개가 상동기관임을 보여주며, 곤충 날개가 조상 생물의 아가미에서 나왔다는 이론을 뒷받침한다.[175]
이보디보 연구의 예로는 나비 날개무늬와 포유류 흑색증 진화 등이 있다.
영국 박물학자 헨리 월터 베이츠는 그의 책 『아마존 강의 박물학자』에서 나비를 언급한 후, 나비는 진화적, 생태학적으로 흥미로운 주제가 되었다.[176] 이보디보는 나비가 어떻게 다양하고 아름다운 무늬를 가질 수 있는지 설명한다. 1920년대와 1930년대에 몇몇 비교생물학자들이 이상적인 나비 무늬 설계도를 작성했다.[177]
각 나비 종은 이 기본 설계에서 다양한 수준으로 벗어난 변이이다. 현실의 나비 날개 무늬는 특정 요소들이 강조되거나 생략, 변형된다. 서로 다른 무늬 요소들이 독자적으로 형태, 색, 크기를 바꾸는 방향으로 진화할 수 있다는 것이다. 척추동물이나 절지동물에서 보이는 모듈 구조가 나비 날개 구조 진화에서도 나타난다.

과학자들은 나비 날개무늬 중 눈꼴무늬에 주목했다. 눈꼴무늬는 점박이 형태로, 색이 다른 인편들이 동심원을 이루어 만들어진다. 눈꼴무늬는 포식자의 시선을 몸통에서 분산시켜 날개 가장자리로 향하게 하여 나비를 방어한다.
1980년 듀트 대학의 프레드 네이하우트는 미래의 눈꼴무늬 위치가 유충 단계에서 결정된다는 것을 밝혔다.[177] 션 캐럴 연구팀은 초파리 날개를 형성하는 호메오 유전자가 나비에도 존재하며, 눈꼴무늬 형성에 관여하는 유전자는 초파리 및 절지동물 부속지 형성에 관여하는 디스탈리스임을 알아냈다.[178][179] 디스탈리스는 나비에서도 부속지 형성에 관여하며, 날개 무늬에서의 작업은 나비만의 무늬 형성 스위치를 진화시킨 결과이다. 즉, 유전자에 새로운 스위치들이 진화하여 나비에서 새로운 임무를 수행하게 된 것이다.
동물 신체 일부나 몸 전체가 어둡게 착색되는 현상은 흔한 진화적 변화이다. 연구자들은 포유류의 색, 특히 검은색 진화에 대해 더 많은 것을 밝힐 수 있었다.
흑색증은 개체나 종이 원래 색 대신 검은 계통 색깔로 착색되는 현상이다. 흑색증의 원인은 멜라닌 색소이다. 흑색증 기원에 대해 자외선 손상 보호, 체온 조절, 의태, 성간선택 등 여러 설이 있지만, 정확한 이유는 밝혀지지 않았다.[180]
흑색증과 자연선택의 유명한 사례로 산업혁명 이후 변화한 영국 및 미국 북부 산업지구 얼룩나방 분포가 있다. 얼룩나방은 티피카 형태(흰 바탕에 검은 얼룩)와 카르보나리아 형태(전체가 새카만)가 있다. 산업화 지역 나무들은 검기 때문에 카르보나리아 형태가 몸을 숨기기에 유리했고, 티피카 형태는 밝은 곳, 이끼가 있는 나무에서 더 살아남기 유리했다.[181][182][183]
재규어 같은 큰 고양이과 동물 흑색증도 잘 알려져 있다.[184] 포유류는 피부 및 모낭 색소 세포에서 두 가지 멜라닌 색소를 만든다. 유멜라닌은 흑갈색, 페오멜라닌은 단홍색 또는 노란색을 입힌다. 멜라닌 색소 양은 여러 단백질, 특히 멜라노코르틴-1 수용체(MC1R) 단백질이 조절한다. MC1R 수용체는 알파-멜라닌 세포 자극 호르몬(MSH)과 결합하면 유멜라닌 합성 신호를 전달한다. 아구티 단백질이 억제자로 작용하면 페오멜라닌이 생성된다. 흑색증 재규어는 MC1R 유전자 우성 돌연변이로 MC1R 단백질 아미노산 서열에 문제가 생겨 유멜라닌 합성이 지속되었다. MC1R 수용체가 호르몬족들과 반응함에도 수용체 변화가 가능했던 것은 색소 조절에만 사용되기 때문이었다.[185]
MC1R 돌연변이는 재규어 외 종들에서도 흑색증 원인이 된다.[186][187][188] 이들이 만드는 아미노산이 모두 동일하다. 야생 고양이류와 조류가 동일 단백질에 독립적으로 돌연변이를 일으켜 비슷한 진화적 변화를 낳았다. 유전자 수준뿐 아니라 단백질 아미노산 수준에서까지 진화가 반복될 수 있음을 보여준다.
자연에서는 몸 전체에 한 색보다는 둘 이상 색들이 공간적으로 복잡하게 분포한 경우가 더 많다. 이는 발생에서 유전자 조절이 모듈 단위로 일어나기 때문이다. 유전자가 한 장소에서는 발현하고 다른 장소에서는 발현하지 않으려면, 색소 유전자 발현 및 색깔 패턴을 통제하는 스위치가 있어야 한다.
포유류 무늬 연구 중 흥미로운 문제는 얼룩말 무늬이다.[189] 조너선 바드는 현생 얼룩말 종들 사이 줄무늬 개수 차이에 관심을 가졌다. 바드는 각 종 발생 과정에서 멜라닌 세포 이동 시작 시점이 다르기 때문에 줄무늬 개수가 다르다고 주장했다. 줄무늬 개수가 적으면 무늬 폭이 넓고, 많으면 좁다. 바드는 초기 배아에서 줄무늬 발생 간격은 일정하지만, 종마다 발생 시작 시점이 다르기 때문이라고 추측했다. 발생이 일찍 시작될수록 무늬 폭은 넓어지고 개수는 줄어든다. 늦게 시작되면 무늬 폭이 좁아지고, 더 많은 수가 그려진다.[190]
다양한 동물의 알은 해파리, 바닷가재, 나비, 코끼리 등 독특한 형태를 만든다. 많은 유기체가 콜라겐 및 효소 등 신체 구성 단백질에 대한 동일 구조 유전자를 공유하지만, 각 동물 그룹은 자체 발달 규칙을 가질 것으로 예상되었다. 진화발생생물학의 놀라움은 신체 모양 조절 유전자가 매우 적고, 이 조절 유전자가 모든 동물이 공유하는 오래된 유전자라는 것이다. 기린은 긴 목 유전자가 없고, 코끼리는 큰 몸집 유전자가 없다. 몸은 발생 시작 시점 조절, 배아 특정 부분 발생, 지속 시간 조절 등 스위칭 시스템에 의해 패턴화된다.[8]
배아 발달 조절 수수께끼는 초파리 ''Drosophila melanogaster''를 모델 생물로 사용하여 해결되기 시작했다. 배아 발생 단계별 제어는 배아에서 발현되는 유전자 생성 특정 유형 단백질에 다른 색 형광 염료를 부착하여 시각화되었다.[8] 해파리 유래 녹색 형광 단백질 등 염료는 초파리 단백질 특정 항체에 부착되어 살아있는 배아에서 해당 단백질 위치와 시점을 나타내는 지표를 형성했다.[41]
1994년, Walter Gehring은 이 기술로 초파리 눈 형성에 필수적인 ''pax-6'' 유전자가 쥐와 인간 눈 형성 유전자와 일치함을 발견했다. 동일 유전자는 두족류 연체동물 오징어 등 다른 동물 그룹에서도 발견되었다. Ernst Mayr 등 생물학자들은 눈 해부학적 구조가 다양하여 눈이 동물계에서 최소 40번 이상 나타났다고 믿었다.[8] 예를 들어, 초파리 겹눈은 수백 개 작은 렌즈 구조(ommatidia)로 구성, 인간의 눈은 맹점이 있어 시신경이 눈으로 들어가고 신경 섬유가 망막 표면을 지나 빛이 망막 감지 세포에 도달하기 전 신경 섬유층을 통과해야 하므로 구조가 "거꾸로"다. 반면, 두족류 눈은 망막, 신경 섬유층, 눈 벽이 "올바른 방향"이다.[42] 그러나 ''pax-6'' 증거는 동일 유전자가 이 모든 동물 눈 발달을 제어하여 모두 공통 조상으로부터 진화했음을 시사한다.[8] 고대 유전자는 수백만 년 진화를 통해 보존되어 유사 기능을 위해 다른 구조를 만들었으며, 한때 유사하다고 생각되었던 구조들 사이에 깊은 상동성을 보여주었다.[45][43] 이 개념은 배아 발생 진화로 확장되었고[44] 진화 생물학에서 상동성 의미를 수정하게 만들었다.[45][43][57]
도구 변이는 동물 형태학적 진화 상당 부분을 만들어냈을 수 있다. 도구는 두 가지 방식으로 진화를 이끌 수 있다. 도구 유전자는 다른 패턴으로 발현될 수 있는데, 다윈 핀치 부리가 ''BMP'' 유전자에 의해 확대된 경우,[61] 뱀이 ''distal-less'' 과소 발현, 다른 파충류가 사지 형성하는 곳에서 전혀 발현되지 않아 다리 잃은 경우처럼 말이다.[62] 또는 도구 유전자는 새로운 기능을 얻을 수 있는데, 척추동물 턱,[63][64] 초파리 다리와 더듬이,[65] 눈점 패턴 등 다양한 구조를 제어하는 ''distal-less'' 다양한 기능에서 볼 수 있다.[66] 도구 유전자 작은 변화가 신체 구조 상당한 변화를 일으킬 수 있어, 종종 동일 기능을 수렴적, 병렬적으로 가능하게 했다. ''distal-less''는 뮐러 의태 나비 ''헬리코니우스 에라토''와 ''헬리코니우스 멜포메네''에서 날개 패턴을 생성한다. 촉진된 변이에서,[67] 이들 날개 패턴은 다른 진화적 사건에서 발생했지만, 동일 유전자에 의해 제어된다.[68] 발생적 변화는 종분화에 직접 기여할 수 있다.[69]
동물 알은 해파리, 바닷가재, 나비, 코끼리 등 매우 다른 몸을 만든다. 이들 대부분은 콜라겐, 효소 등 신체 구성 단백질 동일 유전자를 공유하지만, 각 동물군 고유 발생 규칙이 있을 것으로 예상했다. 에보-데보(진화발생생물학)의 놀라운 점은 다양한 동물 종 신체 차이에 기여하는 것은 유전자 차이가 아니라, 조절 유전자조차 모든 동물 고대부터 공유했다는 것이다. 기린은 긴 목 유전자가 없다. 코끼리는 큰 몸 유전자가 없다. 몸 발생은 시작 시기, 배아 부분 발생, 발현 시간 조절 등 스위칭 시스템에 따라 달라 특징이 발생에서 나타난다.
배아 발생 제어 수수께끼는 초파리를 모델 생물로 하여 해결되기 시작했다. 배아 발생 제어는 형광 색소 배아 발현 단백질 결합시켜 시각화했다. 목표 단백질 살아있는 배아 어디, 언제 나타나는지 조사했다.
이 기술로 1994년 발터 게링은 초파리 눈 형성 필수 pax-6 유전자 마우스, 인간 눈 형성 유전자와 정확히 일치함을 발견했다. 동일 유전자는 오징어 등 연체동물 두족류 등 다른 많은 동물군에서 즉시 발견되었다. 에른스트 마이어 포함 생물학자들은 서로 다른 종류 눈 해부학적 구조 차이가 커, 최소 40번 동물계에서 눈 별도 진화했다고 믿었다. 초파리 겹눈은 수백 개 작은 렌즈 구조(개안)로 만들어져 있다. 인간 눈에는 시신경 눈으로 들어가는 맹점, 신경 섬유 망막 표면 뻗어 있어, 망막 시신경 도달 전 빛 신경 섬유 층 통과해야 하므로 구조적 양자 "거꾸로"다. 반대로 연체동물 두족류 눈에는 망막, 신경 섬유 층, 눈 벽 있어 "똑바로"다. 즉, 두 눈 구조는 완전히 반대다. 그러나 pax-6 공통적인 것은 동일 유전자 모든 동물 눈 발생 제어, 모두 공통 조상으로부터 진화했다는 것 시사한다. 고대 유전자 수백만 년 진화 거쳐 보존되어 유사 기능 가지며, 이종 간 구조 만들어낸다는 것, 한때 기능 비슷하다고만 생각되었던 구조 사이 깊은 상동성 보여주고 있다[99]。 이것은 진화 생물학에서 상동성 의미 근본적 개정하고 있다[100]。
생물 게놈 내 소수 유전자 생물 발생 제어. 이 유전자 발생 관여 툴킷 유전자라고 불린다. 문(門, phylum) 사이 고도 보존, 진화 초기 획득되었음을 의미. 툴킷 유전자 발생 과정에서 몸 기본 골격(body plan), 신체 부분 수, 동일성, 패턴 차이에 영향. 대부분 툴킷 유전자 신호 전달 경로 일부이며, 전사 인자, 세포 접착 단백질, 세포 표면 수용체 단백질 및 이에 결합하는 신호 전달 리간드, 배아 통해 확산되는 분비된 형태 발생자(모르포겐) 코딩. 모두 배아 미분화 세포 운명 결정 기여. 이와 동시 툴킷 유전자 배아 형성 시간적, 공간적 패턴 생성, 최종적 생물 기본 골격 형성. 중요 툴킷 유전자 중 Hox 유전자 있다. 이들 전사 인자 다른 툴킷 유전자에서도 발견되는 홈(homeo)박스 단백질 결합 DNA 모티프 포함, 앞뒤 축 따라 신체 기본 패턴 생성. Hox 유전자 뱀 많은 척추 등 반복적 부분 발육 중인 배아 또는 유충에서 얼마나 성장할지 결정. 이미 언급한 Pax-6 고전적 툴킷 유전자이다. 홈박스 유전자 식물에서도 발견되며, 모든 진핵생물 공통적임을 시사.
툴킷 단백질 생성물 중복, 수정 아닌 다면적 모자이크 재사용되어 많은 독립적 발생 과정에서 불변적 적응, 많은 다른 신체 구조에 패턴 부여한다. 툴킷 유전자 크고 복잡한 조절 서열 갖는다. 초파리 로돕신 유전자 불과 수백 염기쌍 길이 조절 서열 갖지만, 아이레스시스 유전자 조절 영역 7000 염기쌍 이상 6개 시스 조절 엘리먼트 포함한다. 관여 조절 네트워크 종종 매우 크다. 각 조절 단백질 수백 개 조절 서열 제어. 초파리 67개 전사 인자 각각 평균 124개 표적 유전자 제어한다. 이 복잡성 모두 배아 발생 관여 유전자 정확한 시기, 정확한 장소, 정확하게 스위치 켜고 끄는 것 가능하게 한다. 스위치 켜고 꺼지는 유전자 중 일부 구조 유전자이며, 효소 만들거나 배아 조직, 기관 직접 형성. 그러나 다른 많은 유전자 그 자체 조절 유전자이기 때문에 스위치 켜는 것 종종 정확하게 시기 맞춘 전환 캐스케이드이며, 발생 중인 배아에서 다른 발생 과정 시작하게 된다.
이 캐스케이드 조절 네트워크 초파리 배아 발생에서 상세 연구되었다. 어린 배아 럭비공 모양 타원형. 소수 유전자 배아 장축 따라 농도 기울기 만든다. 초기 배아에서 비코이드(bicoid), 허치백(hunchback) 유전자 전단 부근 고농도이며, 미래 머리, 흉부 패턴 부여. 코달(caudal), 나노스(nanos) 유전자 후단 부근 고농도이며, 뒤쪽 복부 패턴 부여. 이 유전자 작용 상호 작용. 비코이드(Bicoid) 단백질 꼬리 부분 메신저 RNA 번역 차단, 꼬리 부분 단백질 농도 전단부에서 낮아진다. 코달(Caudal) 뒷면 파리 뒷다리 부분 생성 유전자 스위치지만, 후단부에서 가장 집중되어 있다.
비코이드(Bicoid), 허치백(Hunchback), 코달(Caudal) 단백질 giant 유전자, knirps 유전자, Kruppel 유전자, tailless 유전자 등 갭 유전자 전사 줄무늬 패턴 발현 제어하여 분절 되는 구조 첫 번째 단계 만든다. 이 단백질 다음 페어룰(pair-rule) 유전자 제어하여 다음 단계에서 배아 장축 7개 밴드 만든다. 마지막으로, 노치(notch) 등 세그먼트 폴라리티(segment polarity) 유전자 7개 밴드 각각 2개 분할하여 14개 세그먼트 만든다.
이 프로세스 서로 다른 종 동물에서 툴킷 유전자 깊은 상동성 갖는다는 것 설명. 즉, 염기 서열 정확하게 보존, 같은 기능 갖는다는 것 설명 (쥐 단백질 초파리 발육 제어, 그 상동성 알 수 있다). 전사 인자와 시스 조절 엘리먼트, 또는 신호 전달 단백질과 수용체 상호 작용 여러 용도 사용되기 때문에, 거의 모든 변이 유해하기 때문에 변하지 않고 보존된다.
더욱 놀라운, 그리고 아마도 (신 다윈 관점) 직관적이지 않은 진화 발생 생물학 최근 연구 결과, 많은 문 초월 생물 형태 다양성 발생 관련 고도 보존된 툴킷 유전자나 기타 유전자에 기인하며, 이들 유전자 염기 서열 다양성에 기인하지 않는다는 것이다. 실제로, Gerhart와 Kirschner가 지적했듯이, 명백한 모순 있다. "변화 가장 기대되는 곳에서는 변화 없고, 보존 확인될 뿐"[101]。 서로 다른 동물 사이에서 관찰된 형태학적 신규성 (변이 등에 의한) 유전자 서열 변화에서 기인하지 않는다면, 무엇에서 기인하는 것일까?
그것은 신규성 유전자 조절 돌연변이에 의해 변화함으로써 생길 수 있다는 것이다[102][103][104][105]。
5. 3. 유전적 가능성과 생태적 기회의 만남
고생물학자들은 화석을 연구하던 도중 지구 역사상 비교적 짧은 기간 내에 동물의 복잡성이 급격하게 증가한 시점인 캄브리아기의 대폭발이 있음을 밝혀내었다.[161] 이 현상을 설명하기 위해 여러 가설이 제시되었지만, 발생학의 발전으로 캄브리아기의 대폭발에서 유전자가 어떤 역할을 했는지 알 수 있게 되었다.캄브리아기 동물군에서 반복되는 신체부속의 종류와 수가 다양하게 진화했다는 사실은 윌리스턴의 법칙을 극적으로 보여준다.[142] 최근에는 캄브리아기 대폭발의 원인이 생태적 현상이라는 의견이 지지를 얻고 있다. 툴킷 유전자는 동물의 형태를 지시하는 중요한 역할을 하지만, 툴킷 자체는 가능성을 의미할 뿐 운명을 지시하는 것은 아니다. 캄브리아기의 대폭발은 생태적 상호작용과 다양한 동물종의 증가에 따른 경쟁 압박이 커져, 보다 복잡한 구조들이 쉴 새 없이 진화한 결과로 해석된다.[169]
곤충 날개의 유래는 오랫동안 논란거리였다. 날개 없는 곤충의 흉부 외피가 바깥으로 자라서 날개를 만들었다는 주장과 조상 동물의 아가미에서 날개가 생겨났을 것이라는 주장이 대립했다. 미할리스 아베로프와 스티븐 코언은 초파리의 날개 발생 과정을 연구하여 날개를 형성하는데 필요한 툴킷 단백질들을 밝히고, 이 단백질들이 다른 절지동물의 부속지에도 발현되는지 조사했다. 놀랍게도 갑각류 부속지의 외분지(호흡 분지)에서 선택적으로 발현되었다. 이는 호흡 분지와 곤충의 날개가 상동기관이며, 곤충의 날개가 조상 생물의 아가미에서 나왔다는 이론을 뒷받침한다.[175]
5. 4. 원시 부속지의 전문화
고생물학자들은 화석 연구를 통해 캄브리아기의 대폭발이라는, 지구 역사상 비교적 짧은 기간에 동물의 복잡성이 급격히 증가한 시기를 발견했다.[161] 이 시기에는 반복되는 신체부속의 종류와 수가 다양하게 진화했는데, 이는 윌리스턴의 법칙의 대표적인 예시이다.[142]진화는 더 나은 생존을 위한 '군비 확장 경쟁'과 유사하며, 더 효율적인 부속지를 획득하기 위한 경쟁이었다. 이러한 부속지 진화는 반복되는 신체 설계 덕분에 가능했다. 즉, 여러 구조에 분산된 기능을 소수의 구조로 집중시키고, 나머지 구조는 새로운 목적에 맞게 전문화할 수 있었다.[170]
5. 4. 1. 절지동물의 부속지 진화
고생물학자들이 화석을 연구하면서 캄브리아기의 대폭발이라 불리는, 지구 역사상 짧은 기간 내에 동물의 복잡성이 급격하게 증가한 시점이 있음을 발견했다.[161] 이 시기 동물들은 반복되는 신체부속의 종류와 수가 다양하게 진화했는데, 이는 윌리스턴의 법칙을 잘 보여주는 예이다.[142]진화는 일종의 ‘군비 확장 경쟁’으로, 더 잘 생존하기 위해 더 뛰어나고, 빠르고, 가볍고, 강하고, 민첩한 부속지를 가지기 위한 경쟁이었다. 이러한 부속지의 진화는 연속적으로 반복되는 신체 설계 덕분에 가능했다. 즉, 여러 구조에 분산되었던 기능을 적은 수의 구조로 집중시키고, 나머지 구조들을 새로운 목적에 맞게 특화시킬 수 있었기 때문이다.[170]
절지동물의 진화에서 부속지 형태학은 중요한 주제였다. 핵심은 공통 조상의 이분지(二分枝)형 부속지인데,[161] 모든 부속지가 이분지형 부속지에서 변형되었기 때문이다. 과거에는 외형적 형태에만 의존하여 다리가 단순한 곤충류, 지네류, 노래기류, 유조류와 갈라진 부속지를 가진 갑각류, 삼엽충류, 전갈류, 투구게류를 서로 다른 종류로 분류했다.
그러나 최근 연구는 이분지형 다리가 단순한 관 모양이었던 엽족동물의 엽상족으로부터 진화했을 가능성을 제시한다.[171][172] 진화발생생물학적 증거로, 유조동물의 엽상족과 절지동물의 다리 분지에서 공통으로 부속지 형성을 돕는 디스탈리스 유전자가 발현되는 것이 확인되었다.[173][174] 이는 갈라진 다리나 갈라지지 않은 다리나 모든 절지동물 부속지 형태가 독립적으로 발명된 것이 아니라 공통의 고대 엽상족에서 진화했음을 뒷받침한다.
5. 4. 2. 날개의 기원
고생물학자들은 화석을 연구하던 도중 지구 역사상 비교적 짧은 기간 내에 동물의 복잡성이 급격하게 증가한 시점이 있음을 밝혀내었다. 이를 캄브리아기의 대폭발이라고 부른다. 진화의 역사는 일종의 ‘군비 확장 경쟁’이라고 할 수 있다. 더 잘 살아남을 수 있게 수영하고, 걷고, 달리고, 뛰어오르고, 숨 쉬고, 땅을 파고, 날고, 음식을 잡고, 으깨고, 삼키고, 찌르고, 거르고, 빨아들이는 데 필요한 더 뛰어나고, 빠르고, 가볍고, 강하고, 민첩한 부속지들을 가지기 위해 경쟁하는 것이었다. 이러한 부속지의 진화는 연속적으로 반복되는 신체 설계 덕분에 일어날 수 있었다. 두 쌍 이상의 구조에 지워져 있던 어떤 기능의 짐을 적은 수의 구조로 옮기고, 그로써 자유롭게 된 구조들을 새 목적에 맞게 전문화시킬 수 있기 때문이다.[170]절지동물의 진화를 논할 때 부속지 형태학은 늘 중요한 주제였다. 그 중심에는 공통 조상의 이분지(二分枝)형 부속지가 있다.[161] 모든 부속지들이 이분지형 부속지에서 출발하여 변형된 것이기 때문이다. 과거의 생물학자들은 외형적 형태학에 전적으로 의존하여 단순한 다리를 가진 곤충류, 지네류, 노래기류, 유조류를 한 동물군으로 묶고, 보다 신기하게 갈라진 부속지를 가진 갑각류, 삼엽충류, 전갈류, 투구게류를 다른 동물군으로 묶어 두 가지가 다른 종류라고 믿곤 했다.
그러나 갈라진 다리와 갈라지지 않은 다리의 기원이 다를 것이라는 전통적인 견해와는 달리, 최근의 연구 결과들은 이분지형 다리는 단순한 관 모양이었던 엽족동물의 엽상족으로부터 진화한 것 같다는 사실을 지지하고 있다.[171][172] 이를 지지하는 진화발생생물학적 증거도 있다. 유조동물의 엽상족과 절지동물의 다리 분지에서 공통으로 부속지의 형성을 돕는 디스탈리스 유전자가 발현되는 것을 확인한 것이다.[173][174] 갈라진 다리나 갈라지지 않은 다리나 모든 절지동물 부속지 형태들은 독립적으로 발명된 것이 아니라 공통의 고대 엽상족에서 진화한 것임을 지지하는 사실이다.
6. 이보디보의 예시
이보디보 연구는 나비의 날개 무늬와 포유류의 흑색증 진화와 같은 다양한 생물학적 현상을 설명하는 데 중요한 역할을 한다.
나비의 날개 무늬와 포유류의 흑색증은 이보디보 연구의 대표적인 예시이다. 특히, 포유류의 경우 흑색증에 대한 연구는 오랜 기간 진행되어 왔으며, 산업혁명 이후 영국 및 미국 북부 산업지구에 사는 얼룩나방의 분포 변화와 재규어와 같은 큰 고양이과 동물의 흑색증이 대표적인 예로 알려져 있다.[184]
포유류의 무늬 중 얼룩말의 무늬는 가장 흥미로우면서도 아직 완전히 밝혀지지 않은 문제이다.[189] 조너선 바드는 현생 얼룩말 종들 사이에서 줄무늬 개수가 다른 이유에 대해 각 종의 발생 과정에서 멜라닌 세포의 이동 시작 시점이 다르기 때문이라고 주장했다. 그는 줄무늬 개수가 적으면 무늬 폭이 넓고, 개수가 많으면 무늬 폭이 좁다는 점에 주목하면서, 모든 초기 배아에서 줄무늬가 발생하는 간격은 일정하지만, 종마다 발생 시작 시점이 다르기 때문에 이러한 현상이 나타난다고 추측했다. 즉, 무늬 발생이 일찍 시작될수록 무늬 폭은 넓어지고 몸에 그려질 무늬의 개수는 줄어들며, 반대로 늦게 시작되면 무늬 폭이 좁아지고 더 많은 수가 그려진다는 것이다.[190]
6. 1. 나비의 날개
영국의 박물학자 헨리 월터 베이츠는 자신의 저서 《아마존 강의 박물학자》에서 나비를 언급한 이후, 나비는 진화 및 생태학적으로 흥미로운 주제가 되었다.[176] 이보디보는 나비가 어떻게 다양하고 아름다운 무늬를 가질 수 있게 되었는지 설명한다. 흔히 나비 날개에 규칙성이 없다고 생각하지만, 1920년대와 1930년대에 몇몇 비교생물학자들이 이상적인 나비 무늬 설계도를 작성하였다.[177]각 나비 종은 이 기본 설계 계획에서 다양한 수준으로 벗어난 변이라고 할 수 있다. 현실의 나비 날개 무늬는 각 무늬 요소를 최대로 포함하는 기본 설계와 달리 특정 요소가 강조되거나 생략, 변형되기도 한다. 이러한 나비 날개를 관찰하면 서로 다른 무늬 요소가 다른 무늬 요소와 상관없이 독자적으로 형태, 색, 크기를 바꾸는 방향으로 진화할 수 있다는 것을 알 수 있다. 척추동물이나 절지동물에서 나타나는 모듈 구조가 나비 날개 구조 진화에서도 나타나는 것이다.
과학자들이 주목한 나비 날개 무늬 구성 요소는 눈꼴무늬였다. 눈꼴무늬는 점박이 형태로, 색이 다른 인편들이 여러 겹의 동심원을 이루어 만들어진다. 눈꼴무늬는 포식자의 시선을 몸통에서 날개 가장자리로 분산시켜 포식자로부터 나비를 보호하는 핵심 역할을 한다.
1980년 듀트 대학의 프레드 네이하우트는 미래의 눈꼴무늬 위치가 유충 단계에서 이미 결정된다는 사실을 밝혀냈다.[177] 이후 션 캐럴과 그의 연구팀은 초파리의 날개를 형성하는 호메오 유전자가 나비에도 존재하며, 눈꼴무늬 형성에 관여하는 유전자는 초파리 및 절지동물의 부속지 형성에 관여하는 디스탈리스임을 알아냈다.[178][179] 디스탈리스가 초파리와 나비에서 각각 다른 역할을 한다는 오해가 있을 수 있으나, 디스탈리스는 나비에서도 여전히 부속지 형성에 관여한다. 디스탈리스는 특정 위치와 시기에 사지를 형성하는 역할을 수행하며, 날개 무늬에서의 작업은 별도의 위치와 시기에, 다른 형태로 통제되는 나비만의 무늬 형성 스위치를 진화시킨 결과이다. 즉, 본래 유전자에 새로운 스위치가 진화하면서 나비에서 새로운 임무를 수행하게 된 것이다.
도구 유전자의 작은 변화가 신체 구조의 큰 변화를 일으킬 수 있다는 점을 고려하면, 이는 동일한 기능을 수렴적으로 또는 병렬적으로 가능하게 한다. ''distal-less''는 뮐러 의태인 나비 ''헬리코니우스 에라토''와 ''헬리코니우스 멜포메네''에서 날개 패턴을 생성한다. 촉진된 변이에서,[67] 이들의 날개 패턴은 서로 다른 진화적 사건에서 발생했지만, 동일한 유전자에 의해 제어된다.[68]
6. 2. 포유류의 흑색증 진화
이보디보 연구의 대표적인 예시로 포유류의 흑색증 진화 등이 있다. 동물의 신체 일부나 몸 전체가 어둡게 착색되는 현상은 자연에서 흔히 나타나는 진화적 변화이다. 이러한 색소 변화에 어떤 선택압이 작용했는지, 형질 진화의 분자생물학적 기원은 무엇인지에 대한 연구가 오래전부터 진행되어 왔다. 이보디보의 발전으로 연구자들은 포유류의 색, 특히 검은색의 진화에 대해 더 많은 것을 밝혀낼 수 있었다.흑색증은 어떤 개체나 종이 원래의 색 대신 검은 계통의 색깔로 착색되는 현상이다. 흑색증의 원인은 멜라닌 색소이며, 멜라닌은 황갈색부터 검은색에 이르기까지 다양한 어두운 색을 띤다. 흑색증의 기원에 대해서는 자외선 손상으로부터의 보호, 체온 조절, 의태, 혹은 이성에게 선택받는 데 (성간선택) 유리하다는 여러 설이 있지만, 정확한 이유는 밝혀지지 않았다.[180]
흑색증과 자연선택에 대한 유명한 사례로 산업혁명 이후 영국 및 미국 북부 산업지구에 사는 얼룩나방의 분포 변화가 있다. 얼룩나방은 티피카 형태(흰 바탕에 검은 얼룩)와 카르보나리아 형태(전체가 새카만) 두 가지가 존재한다. 산업화 지역의 나무는 그을려 검기 때문에 카르보나리아 형태가 몸을 숨기기에 유리했던 반면, 티피카 형태는 밝은 곳, 이끼가 있는 나무에서 생존에 유리했다.[181][182][183]
재규어와 같은 큰 고양이과 동물의 흑색증도 잘 알려진 예이다.[184] 포유류는 피부 및 모낭의 색소 세포에서 두 가지 멜라닌 색소를 만든다. 유멜라닌은 흑갈색, 페오멜라닌은 단홍색 또는 노란색을 털에 입힌다. 멜라닌 색소의 양은 여러 단백질, 특히 멜라노코르틴-1 수용체(MC1R) 단백질에 의해 조절된다. MC1R 수용체는 알파-멜라닌 세포 자극 호르몬(MSH)과 결합하면 유멜라닌 합성 신호를 전달한다. 반대로, 아구티 단백질이 억제자로 작용하면 페오멜라닌이 생성된다. 흑색증 재규어의 MC1R 유전자에 생긴 우성 돌연변이는 MC1R 단백질의 아미노산 서열에 문제를 일으켜 유멜라닌 합성이 지속되도록 한다. MC1R 수용체가 주로 색소 조절에만 사용되기 때문에, 다른 호르몬족과의 반응에도 불구하고 수용체의 변화가 가능했다.[185]
MC1R 돌연변이는 재규어 외 다른 종에서도 흑색증의 원인이 된다.[186][187][188] 놀랍게도, MC1R 유전자에 돌연변이가 생겨 흑색증이 나타나는 종들이 만드는 아미노산은 모두 동일하다. 즉, 야생 고양이류와 조류가 동일한 단백질에 독립적으로 돌연변이를 일으켜 비슷한 진화적 변화를 낳았다는 것이다. 이는 유전자 수준뿐만 아니라 단백질의 아미노산 수준에서도 진화가 반복될 수 있음을 보여준다.
자연에서는 몸 전체가 한 가지 색으로만 이루어진 경우보다 둘 이상의 색이 복잡하게 분포하는 경우가 더 많다. 이는 발생 과정에서 유전자의 조절이 모듈 단위로 일어나기 때문이다. 색소 유전자의 발현과 색깔 패턴을 통제하는 스위치가 존재하여 유전자가 특정 장소에서만 선택적으로 발현될 수 있다.
참조
[1]
서적
The Lagoon: How Aristotle Invented Science
Bloomsbury
2014
[2]
논문
Haeckel's ABC of evolution and development
[3]
웹사이트
The Meckel-Serres Conception of Recapitulation
https://embryo.asu.e[...]
2013-07-10
[4]
서적
The politics of evolution: morphology, medicine, and reform in radical London
https://archive.org/[...]
University of Chicago Press
[5]
문서
[6]
서적
Evolution: the history of an idea
https://archive.org/[...]
University of California Press
[7]
문서
[8]
웹사이트
The Origins of Form
http://www.naturalhi[...]
[9]
논문
The morphogenesis of evolutionary developmental biology
http://www.chd.ucsd.[...]
2003
[10]
서적
On the Origin of Species
http://darwin-online[...]
John Murray
[11]
웹사이트
Darwin's Study of the Cirripedia
http://darwin-online[...]
Darwin Online
2007-01
[12]
논문
Evo-Devo: evolutionary developmental mechanisms
2003
[13]
서적
Evolution
http://www.blackwell[...]
Wiley-Blackwell
[14]
논문
In retrospect: On Growth and Form
2013-02-07
[15]
웹사이트
Review: The Self-Made Tapestry by Philip Ball
http://bactra.org/re[...]
University of Michigan
[16]
논문
The Chemical Basis of Morphogenesis
1952-08-14
[17]
서적
Deep Simplicity
Random House
[18]
논문
Reviewed Work: ''The Evolutionary Synthesis. Perspectives on the Unification of Biology''
1981-07
[19]
서적
How the Snake Lost its Legs. Curious Tales from the Frontier of Evo-Devo
Cambridge University Press
2014
[20]
문서
[21]
논문
Homology and heterochrony: the evolutionary embryologist Gavin Rylands de Beer (1899-1972)
https://www.ualberta[...]
[22]
논문
Resynthesizing evolutionary and developmental biology
1996
[23]
서적
New Perspectives in Evolution
Liss/Wiley
1991
[24]
문서
[25]
논문
Allosteric proteins and cellular control systems
[26]
논문
Evolution and Tinkering
1977-06-10
[27]
논문
Resynthesizing Evolutionary and Developmental Biology
1996
[28]
논문
Evo–devo: extending the evolutionary synthesis
2007
[29]
논문
Special feature: The evolution of evo-devo biology
[30]
논문
Special issue: Evolutionary Innovation and Morphological Novelty
http://www3.intersci[...]
[31]
논문
Symmetry breaking and the evolution of development
[32]
웹사이트
The Homeobox Page
http://homeobox.bios[...]
Karolinska Institutet
[33]
논문
Evolution of homeobox genes
2013
[34]
논문
Mutations affecting segment number and polarity in ''Drosophila''
1980-10
[35]
논문
The emerging conceptual framework of evolutionary developmental biology
2002-02-14
[36]
논문
Edward B. Lewis 1918-2004
http://www.cell.com/[...]
2004-09-21
[37]
웹사이트
Eric Wieschaus and Christiane Nüsslein-Volhard: Collaborating to Find Developmental Genes
https://www.ibiology[...]
iBiology
2016-10-13
[38]
논문
Proximal-distal pattern formation in Drosophila: cell autonomous requirement for Distal-less activity in limb development
1989
[39]
서적
Endless Forms Most Beautiful: The New Science of Evo Devo and the Making of the Animal Kingdom
Weidenfeld & Nicolson [Norton]
2006
[40]
논문
The origin and evolution of animal appendages
[41]
웹사이트
Fluorescent Probes
https://www.thermofi[...]
ThermoFisher Scientific
2015
[42]
논문
The evolution of eyes
[43]
논문
Pax genes and eye organogenesis
2002-08
[44]
논문
Cross-kingdom comparison of the developmental hourglass
[45]
논문
Squid Pax-6 and eye development
[46]
논문
Mouse Eya homologues of the Drosophila eyes absent gene require Pax6 for expression in lens and nasal placode
[47]
논문
A transcriptomic hourglass in plant embryogenesis
2012-10-04
[48]
논문
A comprehensive classification and evolutionary analysis of plant homeobox genes
2009-12
[49]
논문
Analysis of TALE superclass homeobox genes (MEIS, PBC, KNOX, Iroquois, TGIF) reveals a novel domain conserved between plants and animals
1997-11
[50]
논문
Homeodomain proteins belong to the ancestral molecular toolkit of eukaryotes
[51]
서적
iGenetics: a molecular approach
Pearson Education
[52]
논문
From gradients to stripes in Drosophila embryogenesis: Filling in the gaps
[53]
논문
A common plan for dorsoventral patterning in Bilateria
[54]
논문
Mechanical induction of twist in the Drosophila foregut/stomodeal primordium
[55]
논문
Mechano-biochemical marine stimulation of inversion, gastrulation, and endomesoderm specification in multicellular Eukaryota
[56]
서적
Cells, Embryos and Evolution
Blackwell Science
[57]
논문
Evo-Devo and an Expanding Evolutionary Synthesis: A Genetic Theory of Morphological Evolution
2008
[58]
서적
From DNA to Diversity: Molecular Genetics and the Evolution of Animal Design — Second Edition
Blackwell Publishing
[59]
논문
Endless forms: the evolution of gene regulation and morphological diversity
[60]
논문
The Significance and Scope of Evolutionary Developmental Biology: A Vision for the 21st Century
http://www.extavourl[...]
2015
[61]
논문
Bmp4 and Morphological Variation of Beaks in Darwin's Finches
[62]
논문
Developmental basis of limblessness and axial patterning in snakes
[63]
논문
Jaw Transformation With Gain of Symmetry After DLX5/DLX6 Inactivation: Mirror of the Past?
https://iris.unito.i[...]
2002-08
[64]
논문
Specification of jaw subdivisions by DLX genes
2002-10
[65]
논문
Developmental functions of the Distal-less/Dlx homeobox genes
http://dev.biologist[...]
2002
[66]
논문
Contribution of Distal-less to quantitative variation in butterfly eyespots
[67]
논문
The theory of facilitated variation
[68]
논문
Convergent Evolution in the Genetic Basis of Mullerian Mimicry in Heliconius Butterflies
[69]
논문
Evolutionary Biology:Evo-Devo Enthusiasts Get Down to Details
[70]
서적
Epigenetic Inheritance and Evolution: The Lamarckian Dimension
Oxford University Press
[71]
서적
Developmental plasticity and evolution
Oxford University Press
[72]
서적
Origination of Organismal Form: Beyond the Gene in Developmental and Evolutionary Biology
MIT Press
[73]
간행물
Cross-kingdom comparison of the developmental hourglass
[74]
간행물
Developmental drive: an important determinant of the direction of phenotypic evolution
2001-07
[75]
간행물
The interaction between developmental bias and natural selection: from centipede segments to a general hypothesis
2002-10
[76]
간행물
A Double Segment Periodicity Underlies Segment Generation in Centipede Development
2004-07
[77]
간행물
Eco-Evo-Devo: The Time Has Come
2014
[78]
간행물
An Uneven Guide to Eco-Devo
2009
[79]
간행물
Eco-Evo-Devo: developmental symbiosis and developmental plasticity as evolutionary agents
2015
[80]
문서
Haeckel's ABC of evolution and development
[81]
웹사이트
The Meckel-Serres Conception of Recapitulation
https://embryo.asu.e[...]
2016-10-10
[82]
서적
The politics of evolution: morphology, medicine, and reform in radical London
University of Chicago Press
[83]
문서
[84]
서적
Evolution: the history of an idea
University of California Press
[85]
문서
[86]
웹사이트
The Origins of Form
http://www.naturalhi[...]
Natural History
2017-02-17
[87]
간행물
The morphogenesis of evolutionary developmental biology
http://www.ijdb.ehu.[...]
[88]
서적
On the Origin of Species
John Murray
[89]
웹사이트
Darwin's Study of the Cirripedia
http://darwin-online[...]
2017-02-17
[90]
간행물
Evo-Devo: evolutionary developmental mechanisms
[91]
서적
Evolution
http://www.blackwell[...]
Wiley-Blackwell
[92]
서적
Ontogeny and Phylogeny
Harvard University Press
[93]
간행물
In retrospect: On Growth and Form
[94]
웹사이트
Review: The Self-Made Tapestry by Philip Ball
http://bactra.org/re[...]
University of Michigan
2017-02-17
[95]
간행물
Resynthesizing Evolutionary and Developmental Biology
1996
[96]
간행물
Evo–devo: extending the evolutionary synthesis
2007
[97]
서적
Endless Forms Most Beautiful: The New Science of Evo Devo and the Making of the Animal Kingdom
Weidenfeld & Nicolson [Norton]
2006
[98]
간행물
The origin and evolution of animal appendages
[99]
간행물
Pax genes and eye organogenesis
2002-08
[100]
간행물
Squid Pax-6 and eye development
http://www.pnas.org/[...]
[101]
서적
Cells, Embryos and Evolution
Blackwell Science
[102]
간행물
Evo-Devo and an Expanding Evolutionary Synthesis: A Genetic Theory of Morphological Evolution
http://www.cell.com/[...]
2008
[103]
서적
From DNA to Diversity: Molecular Genetics and the Evolution of Animal Design — Second Edition
Blackwell Publishing
[104]
간행물
Endless forms: the evolution of gene regulation and morphological diversity
[105]
간행물
The Significance and Scope of Evolutionary Developmental Biology: A Vision for the 21st Century
http://www.extavourl[...]
2015
[106]
논문
Bmp4 and Morphological Variation of Beaks in Darwin's Finches
[107]
논문
Developmental basis of limblessness and axial patterning in snakes
[108]
논문
Jaw Transformation With Gain of Symmetry After DLX5/DLX6 Inactivation: Mirror of the Past?
2002-08
[109]
논문
Specification of jaw subdivisions by DLX genes
2002-10
[110]
서적
Developmental plasticity and evolution
Oxford University Press
[111]
서적
Origination of Organismal Form: Beyond the Gene in Developmental and Evolutionary Biology
MIT Press
[112]
encyclopedia
Eco-Evo-Devo: The Time Has Come
2014
[113]
논문
An Uneven Guide to Eco-Devo
2009
[114]
논문
Eco-Evo-Devo: developmental symbiosis and developmental plasticity as evolutionary agents
2015
[115]
간행물
유전자에서 찾는 21세기판 진화법칙
동아사이언스
2009-01
[116]
서적
진화발생생물학
2003
[117]
간행물
분자생물학 만능 시대 극복하는 통합 생물학 - 진화와 발생으로 아우르는 이보-디보의 첫걸음
동아사이언스
2003-04
[118]
저널
Squid Pax-6 and eye development
http://www.pnas.org/[...]
[119]
저널
Pax genes and eye organogenesis
[120]
저널
EVOLUTIONARY BIOLOGY:Evo-Devo Enthusiasts Get Down to Details
[121]
서적
이보디보 : 생명의 블랙박스를 열다
지호
[122]
harvnb
[123]
harvnb
[124]
서적
On the Origin of Species
John Murray
[125]
harvnb
[126]
서적
Evolution
http://www.blackwell[...]
Wiley-Blackwell
[127]
서적
Ontogeny and Phylogeny
Harvard University Press
[128]
문서
고급생명과학
서울특별시교육청
[129]
URL
http://www.csb.ki.se[...]
[130]
저널
The structure and function of the homeodomain
[131]
저널
The homeobox in perspective
[132]
저널
Patterns, puzzles and paradigms - The riddle of the homeobox
[133]
저널
Hox proteins: sculpting body parts by activating localized cell death
[134]
문서
[135]
저널
Pre-Bilaterian Origins of the Hox Cluster and the Hox Code: Evidence from the Sea Anemone, Nematostella vectensis
http://www.plosone.o[...]
2007-01
[136]
문서
[137]
문서
[138]
문서
[139]
문서
[140]
문서
[141]
논문
R. Quiring et al, 『Science』 265(1994), pp.785~789
[142]
서적
Water Reptiles of the Past and Present
University of Chicago Press
1914
[143]
서적
Embryonic Development and Induction
Yale University Press
1938
[144]
서적
Epithelial Mesenchymal Interactions
Williams and Wilkins
1968
[145]
서적
Thomas Hunt Morgan: the man and his science
Princeton University Press
1978
[146]
논문
E.Lewis, 『Nature』 276 (1978) pp. 565~570
[147]
논문
B. Wakimoto and T.Kaufamn, 『Developmental Biology』 81 (1981), pp.51~64
[148]
논문
A. S. Laughon and M. P. Scott, 『Nature』 310 (1984) pp.25~31
[149]
서적
The Making of the Fly
Blackwell Science
1922
[150]
서적
Master control genes in the development and Evolution: The Homeobox Story
Yale University Press
1999
[151]
저널
The Molecular Architects of Body Design
1994-02
[152]
논문
D.Duboule and P. Dolle 『EMBO Journal』 8(1989), pp. 1497~1505
[153]
논문
A. Graham, N. Papalapov, N. Papalapov, and R.Krumlauf, 『Cell』 57 (1989) pp. 367~378
[154]
논문
R.Quiting et al, 『Science』 265 (1994) pp. 785~789
[155]
논문
G. Halder, P. Callaerts, and W. Gehring 『Science』 267 (1994) pp. 1788~1792
[156]
논문
G. Panganiban et al. 『Proceedings of the National Academy of Science, USA』 94 (1997) pp. 5162 ~ 5166
[157]
논문
R. Bodmer and T.V. Venkatregh, 『Developmental Genetics』 22(1998) pp. 181~186
[158]
서적
Materials for the Study of Variation
Macmilan
1894
[159]
서적
이보디보 : 생명의 블랙박스를 열다
지호
[160]
서적
이보디보 : 생명의 블랙박스를 열다
지호
[161]
서적
Wonderful Life: The Burgess Shale and the Nature of History
W. W. Norton
1989
[162]
논문
E.B.Lewis 『Nature』 276(1978) pp.565~570
[163]
논문
J. K. Grenier et al 『Current Biology』 7 (1997) pp.547~553
[164]
논문
M.Averof and M. Akam 『Nature』 376(1995) pp. 547~553
[165]
논문
M. Averof and N.H. Patel 『Nature』 338 (1997) pp. 682~687
[166]
논문
S. B. Carroll 『Nature』 376(1995) pp.479~485
[167]
논문
S.M. Shimeld and P. W. Holland 『Proceeding of the National Academy of Science, USA』 97 pp.4449~4452
2000
[168]
논문
H. G. Belting, C. Shashikant, and F. H. Ruddle 『Proceedings of the National Academy of Science, USA』 95 (1998) pp. 2355~2360
[169]
서적
Life on a Young Planet : The First Three Billion Years of Evolution on Earth
Princeton University Press
2003
[170]
서적
이보디보 : 생명의 블랙박스를 열다
지호
[171]
논문
G. E. Budd 『Lethaia』 29 (1996) pp.1~14
[172]
논문
N. Shubin, C. Tabin, and S. Carroll, 『Nature』 388(1997) pp. 639~648
[173]
논문
G. Panganiban et al 『Science』 270(1995) pp.1363~1366
[174]
논문
Panganiban et al 『Proceedings sof the National Academy of Sciences, USA』 94 (1997) pp. 5162~5166
[175]
논문
M. Averof and S. M. Cohen 『Nature』 385 (1997) pp. 627~630
[176]
서적
Naturalist on the River Amazons
John Murray
1863
[177]
서적
The Development and Evolution of Butterfly Wind Patterns
Smithsonian Instituion Press
1991
[178]
논문
Science 265
1994
[179]
간행물
Natural History
1997-02
[180]
서적
Melanism : Evolution in Action
Oxford University Press
1988
[181]
논문
Evolution 53
1999
[182]
간행물
Genetics Society News 50
2003
[183]
서적
Of Moths and Men : Intrugue, Tragedyand the Peppered Moth
Fourth Estate
2002
[184]
논문
Trends in Genetics 19
2003
[185]
논문
Current Biology 13
2003
[186]
논문
Current Biology 11
2011
[187]
논문
Proceedings of the National Academy of Science, USA 100
2003
[188]
논문
Current Biology 11
2011
[189]
서적
Hen’s Teeth and Horse’s Toes
W. W. Norton
1983
[190]
논문
Journal of Zoology
London
1997
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com