붕사
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
붕사는 [B₄O₅(OH)₄]²⁻ 이온을 포함하는 붕산염으로, 다양한 용도로 사용되는 무기 화합물이다. 티베트에서 처음 발견되었으며, 19세기 후반부터 상업적으로 생산되어 세탁, 청소, 해충 방제, 금속 제련, 슬라임 제조 등 다양한 분야에서 활용된다. 붕사는 식품 첨가물로도 사용되지만, 일부 국가에서는 사용이 금지되어 있으며, 과다 노출 시 호흡기 자극, 위장 장애, 생식 및 발달 건강에 영향을 미칠 수 있어 유럽 연합 등에서 규제를 받고 있다.
더 읽어볼만한 페이지
- 붕소 - 붕소 동위 원소
붕소 동위 원소는 질량수 6에서 21 사이의 다양한 형태로 존재하며 핵물리학 연구와 붕소 중성자 포획 치료법 같은 의학적 응용에 활용되고, 일부는 안정하지만 대부분 방사성 붕괴를 겪는다. - 감미료 - 당밀
당밀은 사탕수수나 사탕무에서 설탕을 추출하는 과정에서 생기는 짙은 갈색의 시럽 부산물로, 끓이는 횟수에 따라 종류가 나뉘며 식품 및 산업 원료로 다양하게 활용된다. - 감미료 - 시럽
시럽은 설탕과 물을 섞어 만든 감미료로, 다양한 원료에서 추출하거나 농축하여 만들며, 요리, 음료, 제과 제빵 등에서 단맛과 풍미를 더하는 데 사용되지만, 최근 소비자 안전 관련 문제도 발생하고 있다. - 나트륨 화합물 - 몬모릴로나이트
몬모릴로나이트는 층상구조 점토광물로 이온 교환 능력과 높은 수분 흡수력을 가지며, 토목공학, 유화 작용, 티크소트로피 등의 특징을 보이고, 알칼리성 토양 및 열수 변질 작용으로 생성되어 다양한 산업 분야와 환경 정화에 활용되며 인체 건강 및 환경 영향에 대한 연구가 진행 중이다. - 나트륨 화합물 - 염화 나트륨
염화 나트륨은 염화물 이온과 나트륨 이온으로 구성된 백색 고체 이온 결정으로, 짠맛을 내며 융점은 800.4℃이고, 다양한 용도로 사용되며 겨울철 제설에도 활용되는 정염의 일종이다.
| 붕사 | |
|---|---|
| 기본 정보 | |
 | |
| 다른 이름 | 붕사 십수화물 사붕산나트륨 십수화물 사붕산나트륨 사수산화물 팔수화물 |
| IUPAC 이름 | 다이소듐;3,7-다이옥시도-2,4,6,8,9-펜타옥사-1,3,5,7-테트라보라바이시클로[3.3.1]노네인;십수화물 |
| 화학식 | Na2B4O5(OH)4*8H2O 또는 Na2B4O7·10H2O |
| 분자량 | 381.37 (십수화물) 또는 201.22 (무수물) |
| 겉모습 | 흰색 또는 무색의 결정성 고체 |
| 밀도 | 1.73 g/cm³ (십수화물, 고체) 또는 2.4 g/cm³ (무수물, 고체) |
| 용해도 | 31.7 g/L |
| 녹는점 | 743 °C (무수물) 또는 75 °C (십수화물, 분해) |
| 끓는점 | 1575 °C (무수물) |
| 자기 감수율 | -85.0·10⁻⁶ cm³/mol (무수물) |
| 굴절률 | n₁=1.447, n₂=1.469, n₃=1.472 (십수화물) |
| 식별자 | |
| CAS 등록번호 | 1303-96-4 (십수화물) 또는 1330-43-4 (무수물) |
| ChemSpider ID | 17339255 |
| ChEMBL | 3833375 또는 1076681 |
| ChEBI | 86222 |
| KEGG | D03243 |
| PubChem | 16211214 또는 11954323 |
| RTECS | VZ2275000 |
| UNII | 91MBZ8H3QO |
| EC 번호 | 603-411-9 |
| InChI | 1/B4O7.2Na.10H2O/c5-1-7-3-9-2(6)10-4(8-1)11-3;;;;;;;;;;;;/h;;;10*1H2/q-2;2*+1;;;;;;;;;; |
| SMILES | [Na+].[Na+].O0B(O)O[B-]1(O)OB(O)O[B-]0(O)O1.O.O.O.O.O.O.O.O |
| InChIKey | CDMADVZSLOHIFP-UHFFFAOYAP |
| 표준 InChI | 1S/B4O7.2Na.10H2O/c5-1-7-3-9-2(6)10-4(8-1)11-3;;;;;;;;;;;;/h;;;10*1H2/q-2;2*+1;;;;;;;;;; |
| 표준 InChIKey | CDMADVZSLOHIFP-UHFFFAOYSA-N |
| 구조 | |
| 결정 구조 | 단사정계, mS92, No. 15 |
| 공간군 | C2/c |
| 점군 | 2/m |
| 격자 상수 a | 1.1885 nm |
| 격자 상수 b | 1.0654 nm |
| 격자 상수 c | 1.2206 nm |
| 단위 세포당 분자 수 | 4 |
| 단위 세포 부피 | 1.4810 nm³ |
| 격자 상수 β | 106.623° |
| 약리학 | |
| ATC 코드 | S01AX07 |
| 위험성 | |
| NFPA 704 | 건강: 1 화재: 0 반응성: 0 |
| 즉시 생명 및 건강에 위험한 농도 | 정보 없음 |
| 허용 노출 기준 (REL) | TWA 1 mg/m³ (무수물 및 오수화물) 또는 TWA 5 mg/m³ (십수화물) |
| 허용 노출 한계 (PEL) | 없음 |
| 관련 화합물 | |
| 다른 음이온 | 알루민산 나트륨 |
| 다른 양이온 | 테트라붕산 리튬 |
| 관련 화합물 | 붕산 과붕산 나트륨 |
2. 역사
(내용 없음)
2. 1. 발견과 초기 이용
붕사는 처음으로 티베트의 건조한 호수 바닥에서 발견되었다. 티베트, 페르시아 및 아시아의 다른 지역에서 채취한 천연 붕사는 8세기경 실크로드를 통해 아라비아 반도로 거래되었다.붕사는 19세기 후반에 이르러 널리 사용되기 시작했는데, 이는 프랜시스 매리온 스미스의 퍼시픽 코스트 붕사 회사가 '20마리 노새 팀 붕사'라는 상표명으로 다양한 용도를 시장에 알리고 대중화하면서부터였다. 이 상표명은 과거 캘리포니아와 네바다 사막에서 붕사를 운반하던 방식에서 유래한 것이다.
2. 2. 상업적 생산과 대중화
붕사는 처음 티베트의 건조한 호수 바닥에서 발견되었다. 티베트, 페르시아 및 아시아의 다른 지역에서 채취한 천연 붕사는 8세기경 실크로드를 통해 아라비아 반도로 거래되었다.이후 붕사는 19세기 후반, 프랜시스 매리온 스미스가 설립한 퍼시픽 코스트 붕사 회사가 '20마리 노새 팀 붕사'라는 상표명으로 다양한 용도를 개발하여 시장에 내놓으면서 널리 사용되기 시작했다. 이 상표명은 초기에 캘리포니아와 네바다 사막에서 20마리 노새를 이용한 운반 방식에서 유래한 것이다.
3. 어원
영어 단어 'borax'는 라틴어화된 단어이다. 중세 영어 형태는 borasenm였으며, 이는 고대 프랑스어 boras, bourrasfro에서 유래했다.[1] 이는 9세기에 중세 라틴어 baurachlat (또 다른 영어 철자), borac(-/um/em), boraxlat, 스페인어 borraxspa (> borrajspa) 및 이탈리아어 borraceita와 함께 아랍어 bawraq, būraq, bōraqara[1] (بورقara)[2] 에서 유래했을 수 있다.
'tincal'과 'tincar'라는 단어는 17세기에 말레이어 tingkalmsa과 우르두어/페르시아어/아랍어 تنکارurd (tinkār/tankār)에서 영어로 들어왔다. 따라서 영어에는 두 가지 형태가 존재한다. 이 단어들은 모두 산스크리트어 टांकणsan (ṭānkaṇa)와 관련이 있는 것으로 보인다.
4. 화학적 성질
붕사는 화학적으로 사붕산나트륨의 수화물이며, 대표적으로 십수화물(Na2B4O7·10H2O) 형태가 알려져 있다. 하지만 실제 구조는 더 복잡하여 Na2[B4O5(OH)4]·8H2O 형태를 가진다. 붕사는 산과 반응하여 붕산(H3BO3)을 생성하며, 녹은 상태에서는 여러 금속 산화물을 녹여 유리 상태로 만드는 성질이 있다. 이러한 성질은 붕사 구슬 시험 등에 이용된다. 또한 물에 녹으면 약 알칼리성을 띤다. 붕사는 다양한 수화물 형태로 존재하며, 온도에 따라 구조가 변한다.
4. 1. 구조
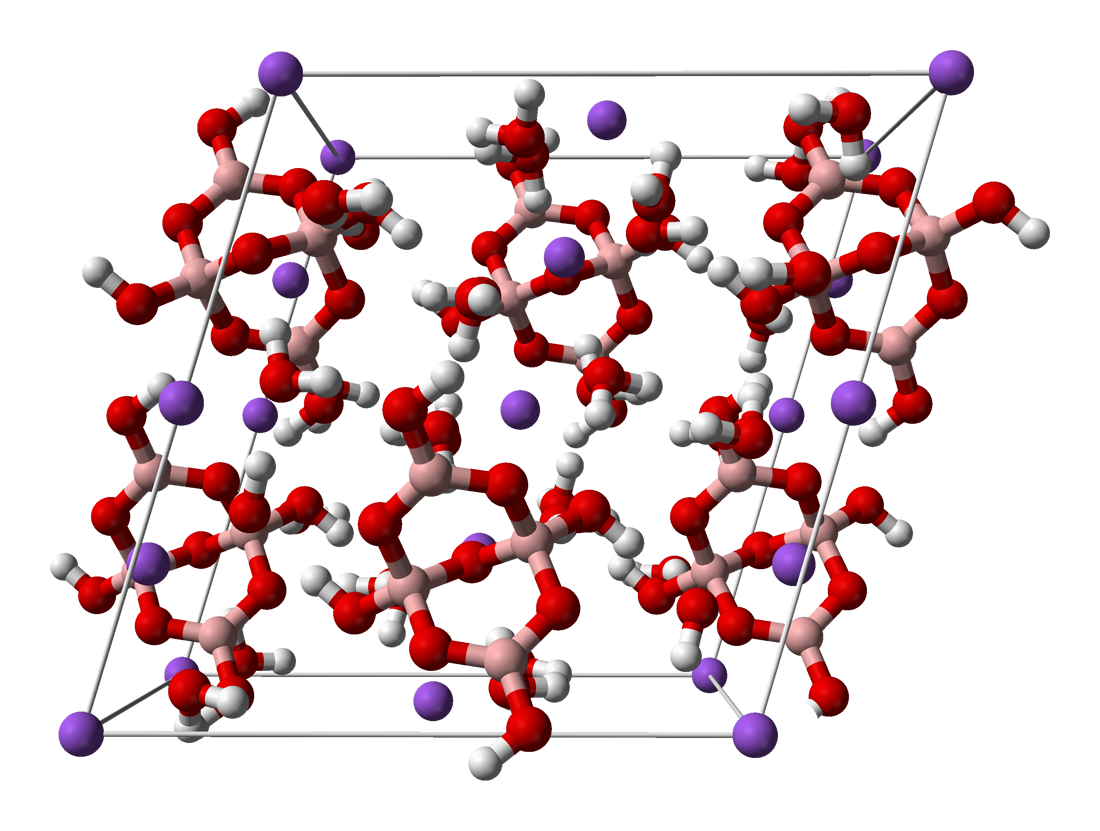
화학적으로 붕사는 [B4O5(OH)4]2− 이온을 포함한다. 이 구조 안에는 네 개의 다른 원자와 결합한 붕소 원자 두 개와 세 개의 다른 원자와 결합한 붕소 원자 두 개가 있다. 흔히 "붕사"라고 하면 십수화물(Na2B4O7·10H2O)을 가리키지만, 이 화학식은 실제 구조와는 차이가 있다. 실제 붕사의 구조는 팔수화물이며, 음이온은 사붕산염 [B4O7]2−이 아니라 테트라하이드록시테트라보레이트 [B4O5(OH)4]2−이다. 따라서 더 정확한 화학식은 Na2[B4O5(OH)4]·8H2O로 나타낼 수 있다.
붕사는 21°C 이상의 온도에서 양성자 전도체가 되는 특성을 보인다. 전도성은 결정의 ''b''축 방향에서 가장 높다.
붕사는 쉽게 붕산 및 다른 붕산염으로 전환될 수 있으며, 이 화합물들은 다양한 용도로 사용된다. 예를 들어, 붕사를 염산과 반응시키면 붕산이 만들어진다. 반응식은 다음과 같다.
:Na2B4O7·10H2O + 2 HCl → 4 H3BO3 + 2 NaCl + 5 H2O
붕사는 매우 안정적이어서 산-염기 적정 실험에서 일차 표준물질로 사용될 수 있다.
녹은 상태의 붕사는 여러 금속 산화물을 녹여 유리처럼 만드는 성질이 있다. 이 성질은 야금술이나 붕사 구슬 시험과 같은 화학 분석에서 중요하게 활용된다.
붕사는 다양한 용매에 녹지만, 에탄올에는 거의 녹지 않는다.
| 유기 용매 | 온도 (°C) | 포화 용액 중 붕사 무게 % |
|---|---|---|
| 글리세롤 98.5% | 20°C | 52.60 |
| 글리세롤 86.5% | 20°C | 47.19 |
| 에틸렌 글리콜 | 25°C | 41.60 |
| 디에틸렌 글리콜 | 25°C | 18.60 |
| 메탄올 | 25°C | 19.90 |
| 수용액 에탄올 46.5% | 15.5°C | 2.48 |
| 아세톤 | 25°C | 0.60 |
| 초산에틸 | 25°C | 0.14 |
| 온도 (°C) | 포화 용액 중 붕사 무게 % |
|---|---|
| 0°C | 1.99 |
| 5°C | 2.46 |
| 10°C | 3.09 |
| 15°C | 3.79 |
| 20°C | 4.70 |
| 25°C | 5.80 |
| 30°C | 7.20 |
| 35°C | 9.02 |
| 40°C | 11.22 |
| 45°C | 14.21 |
| 50°C | 17.91 |
| 55°C | 23.22 |
| 60°C | 30.32 |
| 65°C | 33.89 |
| 70°C | 36.94 |
| 75°C | 40.18 |
| 80°C | 44.31 |
| 85°C | 48.52 |
| 90°C | 53.18 |
| 95°C | 58.94 |
| 100°C | 65.63 |
붕사라는 이름은 다음과 같은 다른 관련 화합물에도 사용된다.
- '''붕사 오수화물''': 화학식은 Na2B4O7·5H2O이지만, 실제 구조는 삼수화물인 Na2[B4O5(OH)4]·3H2O이다. 밀도는 1.880 kg/m3이며 무색 고체이다. 60.8°C 이상의 수용액에서 삼방정계 결정으로 만들어지며, 틴카나이트라는 광물 형태로 자연에서 발견된다. 십수화물을 61°C 이상으로 가열하여 얻을 수도 있다.
- '''붕사 이수화물''': 화학식은 Na2B4O7·2H2O이지만, 실제로는 물 분자가 없는 Na2[B4O5(OH)4] 구조이다. 십수화물이나 오수화물을 116°C~120°C 이상으로 가열하면 얻을 수 있다.
- '''무수 붕사''': 화학식은 Na2B4O7이며, 진정한 의미의 사붕산나트륨이다. 어떤 형태의 수화물이든 300°C로 가열하면 만들어진다. 무수 붕사는 비정질(유리 상태) 형태와 세 가지 결정 형태(α, β, γ)가 존재한다. 각 결정 형태의 녹는점은 각각 1015 K, 993 K, 936 K이다. 이 중 α-Na2B4O7 형태가 가장 안정적이다.
4. 2. 반응성
붕사는 쉽게 붕산 및 다른 붕산염으로 전환될 수 있으며, 이들은 다양한 용도로 활용된다. 예를 들어, 염산과 반응하면 다음과 같은 반응식에 따라 붕산이 생성된다.
Na2B4O7·10H2O + 2 HCl → 4 H3BO3 + 2 NaCl + 5 H2O
붕사는 산-염기 적정에서 일차 표준물질로 사용될 만큼 안정적인 화합물이다.
녹은 상태의 붕사는 여러 금속 산화물을 녹여 유리를 형성하는 성질이 있다. 이 특성은 야금술에서 융제로 사용되거나, 화학 분석에서 특정 금속 이온을 검출하는 붕사 구슬 시험(붕사구 반응)에 활용된다. 붕사 구슬 시험에서는 녹인 붕사에 소량의 금속 화합물을 묻혀 불꽃에 가열했을 때 나타나는 고유한 색깔로 금속의 종류를 알아낸다. 이러한 성질 때문에 도예용 유약의 용해제로도 사용된다.
붕사를 350°C~400°C로 가열하면 결정수를 잃고 무수물(Na2B4O7)이 된다. 더 높은 온도인 878°C까지 가열하면 녹아서 무색 투명한 유리 상태가 된다.
수용액 상태에서 붕사는 약 알칼리성을 띠며, 이로 인해 세척 작용과 소독 작용을 나타낸다. 이러한 성질 때문에 세제나 방부제의 성분으로 사용되며, 붕산처럼 눈 세척 및 소독 용도로도 쓰인다. 또한, 은염 사진의 현상액에서는 알칼리 농도를 조절하는 역할을 한다.
붕소는 폴리머 사슬을 연결하는 가교 역할을 하여 겔 상태로 만드는 반응을 일으킬 수 있다. 이 원리를 이용하여 과학 실험 등에서 폴리비닐 알코올(PVA)과 붕사를 섞어 슬라임을 만드는 데 흔히 사용된다.
4. 3. 용해도
붕사는 다양한 용매에 용해되지만, 에탄올에는 현저하게 불용성이다.| 유기 용매 | 온도 0°C (°F) | 포화 용액 중 붕사 무게 % |
|---|---|---|
| 글리세롤 98.5% | 20°C (68) | 52.60 |
| 글리세롤 86.5% | 20°C (68) | 47.19 |
| 에틸렌 글리콜 | 25°C (77) | 41.60 |
| 디에틸렌 글리콜 | 25°C (77) | 18.60 |
| 메탄올 | 25°C (77) | 19.90 |
| 수용액 에탄올 46.5% | 15.5°C (60) | 2.48 |
| 아세톤 | 25°C (77) | 0.60 |
| 초산에틸 | 25°C (77) | 0.14 |
| 온도 0°C (°F) | 포화 용액 중 붕사 무게 % |
|---|---|
| 0°C (32) | 1.99 |
| 5°C (41) | 2.46 |
| 10°C (50) | 3.09 |
| 15°C (59) | 3.79 |
| 20°C (68) | 4.70 |
| 25°C (77) | 5.80 |
| 30°C (86) | 7.20 |
| 35°C (95) | 9.02 |
| 40°C (104) | 11.22 |
| 45°C (113) | 14.21 |
| 50°C (122) | 17.91 |
| 55°C (131) | 23.22 |
| 60°C (140) | 30.32 |
| 65°C (149) | 33.89 |
| 70°C (158) | 36.94 |
| 75°C (167) | 40.18 |
| 80°C (176) | 44.31 |
| 85°C (185) | 48.52 |
| 90°C (194) | 53.18 |
| 95°C (203) | 58.94 |
| 100°C (212) | 65.63 |
4. 4. 다양한 형태
화학적 관점에서 붕사는 [B4O5(OH)4]2− 음이온을 포함한다. 이 구조에는 네 개의 배위 자리를 가진 붕소 중심 두 개와 세 개의 배위 자리를 가진 붕소 중심 두 개가 있다.
21°C 이상의 온도에서 양성자 전도체이다. 전도도는 ''b''축을 따라 최대가 된다.
붕사는 또한 쉽게 붕산 및 기타 붕산염으로 전환될 수 있으며, 이들은 많은 용도를 가지고 있다. 염산과의 반응으로 붕산이 생성되는데, 그 반응식은 다음과 같다.
:Na2B4O7·10H2O + 2 HCl → 4 H3BO3 + 2 NaCl + 5 H2O
붕사는 산-염기 적정을 위한 일차 표준물질로 사용될 만큼 충분히 안정적이다.
녹은 붕사는 많은 금속 산화물을 용해시켜 유리를 형성한다. 이러한 특성은 야금술 및 정성 화학 분석의 붕사 구슬 시험에서 중요하다.
붕사는 다양한 용매에 용해되지만, 에탄올에는 현저하게 불용성이다.
| 유기 용매 | 온도 °C (°F) | 포화 용액 중 붕사 무게 % |
|---|---|---|
| 글리세롤 98.5% | 20 (68) | 52.60 |
| 글리세롤 86.5% | 20 (68) | 47.19 |
| 에틸렌 글리콜 | 25 (77) | 41.60 |
| 디에틸렌 글리콜 | 25 (77) | 18.60 |
| 메탄올 | 25 (77) | 19.90 |
| 수용액 에탄올 46.5% | 15.5 (60) | 2.48 |
| 아세톤 | 25 (77) | 0.60 |
| 초산에틸 | 25 (77) | 0.14 |
| 온도 °C (°F) | 포화 용액 중 붕사 무게 % |
|---|---|
| 0 (32) | 1.99 |
| 5 (41) | 2.46 |
| 10 (50) | 3.09 |
| 15 (59) | 3.79 |
| 20 (68) | 4.70 |
| 25 (77) | 5.80 |
| 30 (86) | 7.20 |
| 35 (95) | 9.02 |
| 40 (104) | 11.22 |
| 45 (113) | 14.21 |
| 50 (122) | 17.91 |
| 55 (131) | 23.22 |
| 60 (140) | 30.32 |
| 65 (149) | 33.89 |
| 70 (158) | 36.94 |
| 75 (167) | 40.18 |
| 80 (176) | 44.31 |
| 85 (185) | 48.52 |
| 90 (194) | 53.18 |
| 95 (203) | 58.94 |
| 100 (212) | 65.63 |
"붕사"라는 용어는 일반적으로 십수화물(Na2B4O7·10H2O)을 가리키지만, 이는 실제 구조와는 다르다. 실제 음이온은 사붕산염 [B4O7]2−이 아니라 테트라하이드록시테트라보레이트 [B4O5(OH)4]2−이며, 따라서 십수화물의 더 정확한 화학식은 Na2[B4O5(OH)4]·8H2O (팔수화물)이다.
그러나 "붕사"라는 용어는 다음과 같은 관련 화합물에도 적용될 수 있다.
- 붕사 오수화물: 화학식은 Na2B4O7·5H2O이지만, 실제로는 삼수화물 Na2[B4O5(OH)4]·3H2O이다. 밀도 의 무색 고체이며, 60.8°C 이상의 수용액에서 삼방정계로 결정화된다. 틴카나이트 광물로 자연적으로 산출된다. 61°C 이상에서 십수화물을 가열하여 얻을 수 있다.
- 붕사 이수화물: 화학식은 Na2B4O7·2H2O이지만, 실제로는 무수물이며, 정확한 화학식은 Na2[B4O5(OH)4]이다. 십수화물 또는 오수화물을 116°C~120°C 이상으로 가열하여 얻을 수 있다.
- 무수 붕사: 사붕산나트륨이며, 화학식은 Na2B4O7이다. 임의의 수화물을 300°C로 가열하여 얻을 수 있다. 비정질(유리질) 형태 하나와 세 가지 결정 형태(α, β, γ)가 있으며, 각각의 녹는점은 1015 K, 993 K, 936 K이다. α-Na2B4O7이 안정적인 형태이다.
5. 천연 산출

붕사는 계절적으로 생겼다가 마르는 호수가 반복적으로 증발하면서 생성된 증발암 지대에서 자연적으로 발생한다. 염호가 건조된 흔적에서도 많이 산출된다. 과거에는 티베트의 건조된 호수에서 채취되어 유럽으로 전해졌으며, 특수 유리나 에나멜 도료의 원료로 사용되었다.
19세기부터 20세기에 걸쳐서는 미국 서부의 데스밸리 등에서 산출지가 잇달아 발견되었다. 오늘날 상업적으로 중요한 주요 매장지는 터키, 미국 보론 및 시어리스 호 등이다. 이 외에도 미국 남서부의 다른 여러 지역, 칠레의 아타카마 사막, 볼리비아에서 새로 발견된 매장지, 그리고 티베트와 루마니아에서도 발견된다. 현재 주요 산출 국가는 미국, 러시아, 터키, 아르헨티나 등이며, 이탈리아의 토스카나 지방이나 독일 등에서도 산출된다. 반면, 일본에서는 거의 산출되지 않는다.
천연에서 산출된 붕사(미국 등에서는 Rasorite–46이라는 상품명으로 알려져 있음)는 재결정 과정을 통해 정제된다. 또한, 붕사는 다른 붕소 화합물로부터 합성하여 생산할 수도 있다.[3]
6. 용도
붕소의 주요 광석일 뿐만 아니라, 붕사 자체의 고유한 특성을 활용한 다양한 용도가 있다.
붕사는 가정용 세제나 해충 방제 용품에서부터 실험실의 완충 용액 제조, 금속 제련 시 용융제 역할에 이르기까지 폭넓게 사용된다. 특히 고온에서 금속 산화물을 녹이며 고유한 색을 나타내는 성질(붕사구 반응)은 정성 분석이나 도예용 유약 제조에 응용된다. 또한 물속의 칼슘이나 마그네슘 이온과 반응하여 침전물을 형성하므로 경수를 연수로 만드는 데 사용되기도 한다.
유리에 첨가하면 내열성과 내화학성이 강한 붕규산 유리를 만들 수 있으며, 에나멜 유약의 성분으로도 쓰인다. 폴리머를 가교 결합시키는 성질을 이용해 슬라임과 같은 장난감을 만드는 데도 쓰이며, 카제인, 녹말 기반 접착제의 성능을 높이는 데도 첨가된다.
과거에는 식품 첨가물(E 번호 E285)이나 햄과 같은 식품 보존에 사용되기도 했으나, 현재는 안전성 문제로 많은 국가에서 사용이 제한되거나 금지되었다.
이 외에도 난연제, 방부제 및 항진균제, 방충제, 식물용 미량 영양소 비료, 원자로의 중성자 흡수제 및 방사선 차폐재,[7] 박제 보존, 불꽃의 색을 내는 용도, 입자 물리학 실험 등 다양한 산업 및 과학 분야에서 활용된다. 최근에는 바이올린 명기 스트라디바리우스 제작 당시 니스의 방부제로 사용된 붕사가 악기 소리의 비밀과 관련이 있을 수 있다는 연구 결과도 제시되었다.[8]
6. 1. 세제 및 청소 용품

붕사는 20 뮬 팀 붕사 세탁 부스터, 보락소 분말 손 비누 및 일부 치아 미백 제제를 포함한 다양한 가정용 세탁 및 청소 제품에 사용된다. 붕사의 수용액은 약 알칼리성을 띠어 세척 작용과 소독 작용을 하므로 세제나 방부제 등으로 사용된다. 또한 붕산과 마찬가지로 눈의 세척 및 소독에도 사용된다.
6. 2. 해충 방제
붕사는 개미와 쥐에게 독성이 있기 때문에 해충 방제 용액에 사용된다. 붕사의 독성은 천천히 작용하는 특징이 있는데, 이 때문에 일개미가 붕사를 먹이로 착각하고 둥지로 가져가면 둥지 안의 다른 개미들에게도 독성이 퍼져 군체 전체를 제거하는 효과를 낸다.
또한, 붕사 가루를 잘 사라지지 않는 해충(예: 독일 바퀴벌레)을 막기 위해 옷장, 파이프 및 케이블이 들어오는 틈새, 벽 패널링 틈새 등 일반 살충제를 사용하기 어려운 접근하기 힘든 장소에 뿌려두기도 한다. 물에 희석하여 좀을 처리하는 데에도 사용된다.
6. 3. 완충 용액
붕산염 이온(일반적으로 붕산으로 공급됨)은 생화학 및 화학 실험실에서 완충 용액을 만드는 데 사용된다. 예를 들어 DNA와 RNA의 폴리아크릴아마이드 겔 전기영동을 위한 TBE 완충액(붕산 완충 트리스-하이드록시메틸아미노메탄) 또는 코팅 절차에서 사용되는 SB 완충액이나 BBS 완충액(붕산 완충 식염수) 등이 있다. 붕산염 완충액(일반적으로 pH 8)은 디메틸 피멜리미데이트(DMP) 기반 가교 반응에서 우선적 평형 용액으로도 사용된다.붕산염의 원천인 붕사는 물 속에서 다른 물질과 함께 붕산염의 공동 착화 능력을 이용하여 다양한 물질과 복합 이온을 형성하는 데 사용되어 왔다. 붕산염과 적절한 폴리머 베드를 사용하여 비당화 헤모글로빈을 당화 헤모글로빈(주로 HbA1c)과 차별적으로 크로마토그래피하는데, 이는 당뇨병의 장기간 고혈당증 지표로 활용된다.
붕사의 수용액은 약 알칼리성을 띠므로 pH를 조절하는 데 사용될 수 있다. 예를 들어 수영장의 pH를 조절하는 완충제로 사용되거나, 은염 사진의 현상액에 알칼리 조정제로 첨가되기도 한다. 일본산 사진용 붕사(10수화염)와 미국산 붕사(7수화염)는 결정수의 수가 다르기 때문에, 같은 양으로 현상액을 조제하는 경우 pH 값이 약간 달라 현상감도에 차이가 생길 수 있어 주의가 필요하다.
6. 4. 의학적 용도
붕산염 이온(일반적으로 붕산으로 공급됨)은 생화학 및 화학 실험실에서 완충 용액을 만드는 데 사용된다. 예를 들어 DNA와 RNA의 폴리아크릴아마이드 겔 전기영동을 위한 TBE 완충액(붕산 완충 트리스-하이드록시메틸아미노메탄) 또는 코팅 절차에서 더 새로운 SB 완충액이나 BBS 완충액(붕산 완충 식염수) 등이 있다. 붕산염 완충액(일반적으로 pH 8)은 디메틸 피멜리미데이트(DMP) 기반 가교 반응에서도 우선적 평형 용액으로 사용된다.붕산염의 원천인 붕사는 물 속에서 다른 물질과 함께 붕산염의 공동 착화 능력을 이용하여 다양한 물질과 복합 이온을 형성하는 데 사용되어 왔다. 붕산염과 적절한 폴리머 베드를 사용하여 비당화 헤모글로빈을 당화 헤모글로빈(주로 HbA1c)과 차별적으로 크로마토그래피하는데, 이는 당뇨병의 장기간 고혈당증의 지표이다.
E 번호 ''E285''로 표시된 붕사는 식품 첨가물로 사용되지만, 오스트레일리아, 중국, 태국 및 미국과 같은 일부 국가에서는 사용이 금지되어 있다. 붕산과 함께 섭취하면 여러 연구에서 붕사와 여러 유형의 암 사이에 부정적 연관성을 보여주었다.[4] 붕산과 붕사는 급성 경구 노출에 대해 소금과 거의 같은 급성 독성을 나타내며 독성이 낮다. 무증상 섭취 사례(모든 섭취의 88%를 차지함)의 평균 용량은 약 0.9g이다. 그러나 보고된 무증상 용량의 범위는 0.01g~88.8g으로 넓다.[5]
붕사의 수용액은 약 알칼리성이 되어 세척 작용·소독 작용이 있으므로, 붕산과 마찬가지로 눈의 세척·소독에 사용된다.
6. 5. 금속 제련
붕사와 염화암모늄의 혼합물은 철과 강철을 용접할 때 용융제로 사용된다. 이는 원하지 않는 산화철(밀 스케일)의 녹는점을 낮춰 흘러내리게 한다. 또한 납땜으로 보석 금속(예: 금 또는 은)을 접합할 때 물과 섞어 용융제로 사용하는데, 이는 용융된 납땜이 금속 표면을 잘 적시게 하고 이음매에 고르게 흘러들어가도록 돕는다. 붕사는 텅스텐을 아연으로 "사전 주석 도금"하는 데에도 좋은 용융제이며, 이를 통해 텅스텐을 연질 납땜이 가능하게 만든다. 붕사는 단조 용접에도 자주 사용된다. 주조 시 금속과 합금을 녹일 때 불순물을 제거하고 산화를 방지하기 위한 용융제로도 쓰인다.소규모 금광산에서는 붕사가 '붕사법'이라는 공정의 일부로 사용되어, 금 추출 과정에서 독성이 있는 수은의 필요성을 줄인다. 다만, 수은을 직접 대체하는 것은 아니다. 이 방법은 1900년대 필리핀 일부 지역의 금광부들이 사용했다고 알려져 있다. 붕사법은 환경 영향을 줄이는 것 외에도, 적합한 광석에 대해 더 나은 금 회수율을 보이고 비용이 적게 든다는 증거가 있다. 이 방법은 필리핀 북부 루손에서 사용되며, 볼리비아와 탄자니아에서도 홍보되었다.
붕사를 350°C~400°C로 가열하면 무수물이 되고, 더 높은 온도인 878°C에서 융해하여 무색 투명한 유리 상태가 된다. 이 유리 상태의 붕사는 여러 금속 산화물을 녹이는 성질이 있어 융제로 사용될 뿐만 아니라, 이때 녹아든 금속의 종류에 따라 고유한 색을 나타내므로 정성 분석(붕사구 반응)이나 도예용 유약의 용해제로도 활용된다.
6. 6. 소규모 금광
소규모 금광산에서는 붕사가 붕사법(용융제로서)이라는 공정의 일부로 사용되어, 독성이 있는 수은을 금 추출 과정에서 사용하지 않아도 되도록 돕는다. 다만 수은을 직접 대체하는 것은 아니다. 이 방법은 1900년대 필리핀 일부 지역의 금광 노동자들이 사용했던 것으로 알려져 있다.붕사법은 환경에 미치는 영향을 줄일 뿐만 아니라, 적합한 광석의 경우 더 높은 금 회수율을 보이고 비용도 적게 든다는 장점이 있다. 현재 이 방법은 필리핀 북부 루손 지역에서 사용되고 있지만, 다른 지역의 광부들은 아직 명확하지 않은 이유로 이 방법의 도입을 주저하고 있다. 붕사법은 볼리비아와 탄자니아에서도 그 사용이 장려되고 있다.
6. 7. 슬라임 제조
슬라임, 플러버, '글루프' 또는 '글러치' 등으로 불리는 고무 같은 폴리머는 붕사를 이용하여 만들 수 있다. 붕사는 폴리비닐알코올이나 엘머스 접착제와 같은 폴리비닐 아세테이트 기반 접착제 속의 폴리머를 가교 결합시켜 겔 상태로 만드는 반응을 일으킨다. 이러한 원리를 이용해 슬라임을 만드는 것은 일반적인 초등 과학 실험이나 자유 연구 주제로 자주 활용된다.6. 8. 기타 용도


붕사는 다양한 분야에서 활용된다.
해충 방제:개미와 쥐에게 독성이 있어 해충 방제 용액에 사용된다. 작용이 느려 일개미가 둥지로 가져가 다른 개체들에게 독을 퍼뜨리는 방식으로 군체 전체에 영향을 미친다. 또한, 독일 바퀴벌레나 좀과 같은 해충을 퇴치하기 위해 분말 형태로 옷장, 파이프 및 케이블 입구, 벽 틈새 등 접근하기 어려운 곳에 뿌려 사용하기도 한다. 양모의 방충 처리에도 10% 용액이 사용된다.
세척, 세제 및 정수:20 뮬 팀 붕사 세탁 부스터, 보락소 분말 손 비누, 일부 치아 미백 제품 등 다양한 가정용 세탁 및 청소 용품에 포함되어 있다. 수용액은 약 알칼리성을 띠며 세척 및 소독 작용이 있어 세제나 방부제로도 활용된다. 과붕산나트륨의 전구체로서 세제에 사용되기도 한다. 붕산과 마찬가지로 눈 세척 및 소독에도 사용되며, 은염 사진의 현상액에 알칼리 조절제로 첨가된다. 다만, 결정수의 함량이 다른 붕사(예: 일본산 10수화염, 미국산 7수화염)를 사용하면 pH 값이 달라져 현상 감도에 영향을 줄 수 있으므로 주의가 필요하다.
붕사 자체는 경도 유발 양이온에 대한 친화력이 높지는 않지만, 물을 부드럽게 하는 정수 과정에 사용되어 왔다. 물속의 칼슘이나 마그네슘 이온과 반응하여 침전물을 형성함으로써 일시적 및 영구적 경도를 제거한다. 이 과정에서 생성되는 나트륨 이온은 물을 경수로 만들지 않는다. 수영장의 pH를 조절하는 완충제로도 사용된다.
실험실 및 분석:붕산염 이온(주로 붕산 형태로 공급)을 이용하여 생화학 및 화학 실험실에서 완충 용액을 만든다. 예를 들어, DNA와 RNA의 폴리아크릴아마이드 겔 전기영동에 사용되는 TBE 완충액이나 코팅 절차에 쓰이는 SB 완충액, BBS 완충액 등이 있다. 붕산염 완충액(주로 pH 8)은 디메틸 피멜리미데이트(DMP) 기반 가교 결합 반응에서도 사용된다. 또한, 붕산염이 다른 물질과 복합 이온을 형성하는 성질을 이용하여 당뇨병의 장기 고혈당증 지표인 당화 헤모글로빈(주로 HbA1c)을 비당화 헤모글로빈과 분리하는 크로마토그래피에도 활용된다.
350°C~400°C로 가열하면 무수물이 되고, 더 가열하면 878°C에서 융해하여 무색 투명한 유리 상태가 된다. 이때 여러 금속 산화물을 녹이는 성질이 있어, 금속 종류에 따라 고유한 색을 나타내는 '''붕사구 반응'''은 정성 분석에 활용된다.
야금 및 용접 (용융제):철과 강철을 용접할 때 염화암모늄과 혼합하여 용융제로 사용된다. 이는 원하지 않는 산화철(스케일)의 녹는점을 낮춰 제거를 용이하게 한다. 금이나 은과 같은 보석 금속을 납땜할 때도 물과 섞어 용융제로 사용하면, 녹은 납땜이 금속 표면을 잘 적시고 접합부에 고르게 퍼지도록 돕는다. 텅스텐을 아연으로 "사전 주석 도금"하여 연납땜이 가능하게 할 때도 좋은 용융제이며, 단조 용접에도 널리 사용된다. 금속 주조 시에도 불순물을 제거하고 산화를 방지하는 용융제로 쓰인다.
금 채굴:소규모 금광업에서는 독성 수은 사용을 대체할 수 있는 '붕사법'이라는 공정의 일부로 사용된다. 이 방법은 1900년대 필리핀 일부 지역의 금 광부들이 사용했다고 알려져 있으며, 환경 영향을 줄일 뿐만 아니라 특정 광석에 대해서는 더 높은 금 회수율을 보이고 비용도 저렴하다는 장점이 있다. 필리핀 북부 루손 지역에서는 사용되지만, 다른 지역에서는 채택이 더딘 편이다. 이 방법은 볼리비아와 탄자니아에서도 장려되고 있다.
폴리머 및 접착제:슬라임, 플러버와 같은 고무 질감의 폴리머 장난감은 붕사를 이용하여 폴리비닐알코올을 가교 결합시켜 만들 수 있다. 엘머스 접착제와 같은 폴리비닐 아세테이트 기반 접착제와 붕사를 이용한 슬라임 만들기는 흔한 초등 과학 실험 중 하나이다. 카제인, 녹말, 덱스트린 기반 접착제 및 폴리비닐 아세테이트, 폴리비닐알코올 기반 접착제의 접착력 증진제 성분으로도 사용된다(주로 붕산의 전구체 형태).
식품 첨가물 및 보존:E 번호 ''E285''로 지정된 붕사는 식품 첨가물로 사용되기도 하지만, 오스트레일리아, 중국, 태국, 미국 등 일부 국가에서는 사용이 금지되어 있다. 이 때문에 미국에서 판매되는 캐비어 등 일부 식품은 보존성을 높이기 위해 더 많은 소금을 함유하기도 한다. 붕사는 식품에 단단하고 고무 같은 질감을 부여하는 효과도 있다. 중국에서는 라면, 사하 펀, 차르 쿠에이 테우, 치 치옹 펀 등 일부 면류 식품에서 발견된 사례가 있다. 인도네시아에서는 국수, 박소(미트볼), 찐쌀 등에 흔히 사용되었으나 현재는 금지된 첨가물이다. 붕산과 함께 섭취 시 여러 유형의 암 발생과 연관성이 있다는 연구 결과가 있다.[4] 급성 경구 독성은 소금과 비슷한 수준으로 낮은 편이다.[5] 전통적으로 햄과 같은 건조 숙성 고기에 발라 외관을 개선하고 파리를 막는 데 사용되기도 했다.
유리, 도자기 및 에나멜:에나멜 유약의 성분이며, 유리, 도자기, 세라믹의 구성 요소이다. 유리에 섞으면 내열 충격과 화학적 부식에 강한 붕규산 유리가 되므로, 내열 유리 등의 원료가 된다. 젖은 그린웨어(greenware) 및 비스킷의 적합성을 개선하기 위해 세라믹 슬립(slip)과 유약에 첨가제로 사용되기도 한다. 도예용 유약 용해제로도 쓰인다.
핵 및 입자 물리학:중성자 흡수제로서 원자로 및 사용 후 핵연료 저장조에서 반응도를 제어하고 핵 연쇄 반응을 중단하는 데 사용된다. 원자로의 방사선 차폐재로도 활용된다. 원자력선무쓰의 방사선 누출 사고 당시, 누출 부위를 특정하기 위해 붕사를 섞은 쌀을 이용한 즉석 차폐재가 사용된 사례가 있다.[7] 입자 물리학에서는 핵 유제에 첨가되어 하전 입자 트랙의 잠재 이미지 수명을 연장하는 데 기여했다. 1950년 노벨상 수상으로 이어진 파이온의 최초 관측에 이러한 유형의 유제가 사용되었다.
기타 용도:
7. 독성
붕사는 일반적으로 급성 독성이 낮은 물질로 알려져 있다. 쥐를 대상으로 한 실험에서 LD50(반수치사량)은 2.66g/kg으로 측정되었는데, 이는 상당한 양을 섭취해야 심각한 영향을 미칠 수 있음을 시사한다. 그러나 이 수치가 사람에게 반드시 동일하게 적용되는 것은 아니다.
미국에서는 1946년부터 붕사를 살충제로 사용해왔으며, EPA는 1986년 독성이 낮다는 이유로 관련 제한 조치를 해제한 바 있다. EPA는 붕산과 그 나트륨염이 자연적으로 발생하고 독성이 낮아 농작물에 대한 잔류 허용 기준 설정이 불필요하다고 판단했다. 2006년 재평가에서도 심각한 독성 징후는 발견되지 않았다고 보고되었다.
하지만 붕사 분진에 과다 노출될 경우 호흡기 자극이 발생할 수 있으며, 섭취 시에는 메스꺼움, 구토, 복통, 설사 등 위장 관계 증상이 나타날 수 있다. 드물게 두통, 무기력증이나 피부 발진이 보고되기도 한다. 장기간 과다 섭취 시 간암 위험이 증가할 수 있다는 경고도 있다.
최근에는 붕사의 잠재적 독성, 특히 생식 독성에 대한 우려가 제기되면서 규제 움직임이 나타나고 있다. EU에서는 2010년 붕사를 매우 우려되는 물질(SVHC) 후보 목록에 포함시켰으며, 캐나다 보건부는 2016년 붕산 과다 노출이 발달 및 생식 건강에 영향을 줄 수 있다는 평가를 내놓고 일부 제품의 사용 제한을 권고했다. 이는 특정 제품 자체의 위험성보다는 다양한 경로를 통한 총 노출량을 관리해야 한다는 관점에서 비롯된 조치이다. 다만, 일상적인 노출 수준에서는 생식 기능에 악영향을 미치기 어렵다는 연구 결과도 있다.
7. 1. 과다 노출의 영향
한 연구에 따르면 붕사는 급성 독성이 없는 것으로 나타났다. 쥐를 대상으로 한 실험에서 LD50(반수치사량)은 2.66 g/kg으로 측정되었는데, 이는 심각한 증상이나 사망을 유발하기 위해서는 상당한 양의 화학물질이 필요하다는 것을 의미한다. 그러나 사람에게 치사량이 반드시 같지는 않다. 농약 정보 웹사이트에서는 비치사성 화합물로서 위험성이 없다고 언급되기도 한다.붕사는 1946년부터 미국에서 여러 제한 조치와 함께 살충제로 사용되어 왔다. 미국 환경보호청(EPA)은 붕산과 붕사의 독성이 낮다는 이유로 1986년 2월 모든 사용 제한을 해제했다. EPA는 "붕산과 그 나트륨염이 독성이 낮고 자연적으로 발생하기 때문에 모든 원재료 농산물에 대한 허용량(최대 잔류 한계) 요건에서 면제되어야 한다"고 결정했다.
2006년 EPA의 재평가에서는 명확한 결론을 내릴 데이터는 제시되지 않았지만, "연구 중에 독성 징후가 관찰되지 않았고 표적 기관에 대한 세포독성의 증거가 없었다"고 밝혔다. 재평가에서는 과다 노출로 인한 독성 연구를 검토한 결과, "붕산과 그 나트륨염을 활성 성분으로 하는 제품을 다루는 주거 환경에서의 흡입 위험은 우려할 수준이 아니다"라고 결론지었다. 다만, 러그 청소용 분말로 사용할 경우 어린이가 흡입하여 자극을 받을 가능성은 있다고 언급했다.
붕사 분진에 과다 노출되면 호흡기 자극이 발생할 수 있지만, 피부에 직접 닿았을 때 자극이 발생한다는 보고는 없다. 섭취 시에는 메스꺼움, 지속적인 구토, 복통 및 설사와 같은 위장 장애가 발생할 수 있다. 드물게 혈관계와 인간의 뇌에 영향을 미쳐 두통과 무기력증을 유발하기도 한다. 심한 경우 손바닥, 발바닥, 엉덩이 및 음낭 등에 붉은 발진이 나타날 수 있다.
인도네시아 소비자 보호국은 5년에서 10년에 걸쳐 붕사를 과다 섭취할 경우 간암 발병 위험이 있다고 경고한다.
붕사는 2010년 12월 16일 유럽 연합(EU)의 REACH 규정에 따라 매우 우려되는 물질(SVHC) 후보 목록에 추가되었다. 이는 붕사가 CLP 규정에 따라 "생식 독성" 1B 등급으로 분류되었기 때문이다. 이에 따라 붕사를 포함하는 물질이나 혼합물을 EU로 수입할 때는 "생식능력 손상을 일으킬 수 있음"과 "태아에게 손상을 줄 수 있음"이라는 경고 표시를 해야 한다. 유럽 화학물질청(ECHA)은 2015년 7월 1일 붕사를 REACH 부록 XIV(허가 대상 물질 목록)에 추가할 것을 제안했다. 이 제안이 승인되면 EU 내에서 붕사의 모든 수입과 사용은 ECHA의 사전 허가를 받아야 한다.
2012년 독성학 및 환경 보건 저널에 발표된 붕소 독성(붕산 및 붕산염 형태)에 대한 검토에서는 "가장 많이 노출된 집단에서도 인간의 붕소 노출 수준은 생식 기능에 악영향을 미치는 데 필요한 혈중 농도(및 표적 조직 농도)에 도달하기에는 현저히 낮다"고 결론 내렸다. 그러나 2016년 7월 캐나다 보건부(Health Canada)에서 발표한 초안 위험 평가에서는 붕산에 과다 노출될 경우 발달 및 생식 건강에 영향을 미칠 가능성이 있다고 밝혔다. 사람들은 이미 음식과 물을 통해 자연적으로 붕산에 노출되고 있으므로, 캐나다 보건부는 다른 출처로부터의 추가 노출을 최대한 줄여야 하며, 특히 어린이와 임산부에게 주의를 권고했다. 이에 따라 캐나다 보건부는 가정에서 흔히 사용되는 특정 붕산 함유 살충제의 등록을 취소하고 시장에서 단계적으로 퇴출할 것이라고 발표했다. 또한, 캐나다에서 계속 등록되는 다른 붕산 살충제(예: 밀폐형 미끼 통, 젤 형태 국소 처리제)에 대해서는 더욱 강화된 안전 라벨 지침을 도입하고 있다.
7. 2. 규제 현황
한 연구에 따르면 붕사는 급성 독성이 낮은 것으로 나타났다. 쥐를 대상으로 한 실험에서 LD50은 2.66g/kg으로 측정되었는데, 이는 심각한 독성을 유발하기 위해서는 상당한 양이 필요함을 시사한다. 다만, 이 수치가 사람에게 동일하게 적용되지는 않는다.미국에서는 1946년부터 붕사를 살충제로 사용해왔으나, 초기에는 몇 가지 제한 조치가 있었다. 그러나 1986년 2월, EPA는 붕산과 붕사의 독성이 낮다고 판단하여 모든 제한을 해제했다. EPA는 붕산과 그 나트륨염이 자연적으로 발생하며 독성이 낮기 때문에 모든 농산물 원료에 대한 잔류 허용 기준(최대 잔류 한계) 설정 요건에서 면제되어야 한다고 결정했다. 2006년 EPA의 재평가에서는 명확한 결론을 내리지는 않았지만, "연구 중 독성 징후가 관찰되지 않았고 표적 기관에 대한 세포독성의 증거가 없었다"고 언급했다. 다만, 과다 노출 시 독성 연구 결과를 검토한 결과, 일반적인 주거 환경에서의 흡입 위험은 우려할 수준이 아니지만, 러그 청소용 분말 형태로 사용할 경우 어린이가 흡입하여 자극을 받을 가능성이 있다고 밝혔다.
붕사 분진에 과도하게 노출되면 호흡기 자극을 유발할 수 있으나, 피부에 직접 닿았을 때 자극이 발생한다는 보고는 없다. 섭취 시에는 메스꺼움, 지속적인 구토, 복통, 설사 등 위장 장애가 발생할 수 있다. 드물게는 혈관계와 인간의 뇌에 영향을 미쳐 두통이나 무기력증을 유발하기도 하며, 심한 경우 손바닥, 발바닥, 엉덩이, 음낭 등에 붉은 발진이 나타날 수 있다. 인도네시아 소비자 보호국은 5년에서 10년에 걸쳐 붕사를 과다 섭취할 경우 간암 발병 위험이 있다고 경고했다.
EU에서는 붕사에 대한 규제가 강화되는 추세이다. 2010년 12월 16일, 붕사는 매우 우려되는 물질(SVHC) 후보 목록에 포함되었다. 이는 EU의 REACH 규정에 따른 조치로, 붕사가 CLP 규정에 따라 '생식 독성' 1B 등급으로 분류되었기 때문이다. 이에 따라 EU로 수입되는 붕사 함유 물질이나 혼합물에는 "생식능력 손상을 일으킬 수 있음"과 "태아에게 손상을 줄 수 있음"이라는 경고 문구를 표시해야 한다. 2015년 7월 1일, ECHA는 붕사를 REACH 부록 XIV에 추가할 것을 제안했다. 이 제안이 승인되면 EU 내에서 붕사를 수입하거나 사용하기 위해서는 ECHA의 사전 승인이 필요하게 된다.
2012년 ''Toxicology and Environmental Health'' 저널에 발표된 붕소(붕산 및 붕산염 형태) 독성 검토 연구에서는 "가장 많이 노출된 집단에서도 인간의 붕소 노출 수준은 생식 기능에 부정적인 영향을 미치기에는 너무 낮다"고 결론지었다. 그러나 2016년 7월 Health Canada가 발표한 초안 위험 평가에서는 붕산에 과다 노출될 경우 발달 및 생식 건강에 영향을 미칠 가능성이 있다고 밝혔다. 캐나다 보건부는 사람들이 이미 음식과 물을 통해 자연적으로 붕산에 노출되고 있으므로, 다른 경로를 통한 추가 노출은 최대한 줄여야 하며, 특히 어린이와 임산부의 주의가 필요하다고 권고했다. 이에 따라 캐나다 보건부는 가정에서 흔히 사용되는 특정 붕산 함유 살충제의 등록을 취소하고 시장에서 퇴출할 계획을 발표했으며, 계속 등록되는 다른 붕산 살충제(밀폐형 미끼 통, 국소 처리용 젤 제형 등)에 대해서는 더 강화된 라벨 지침을 도입하기로 했다.
참조
[1]
OED
borax
[2]
사전
بورق
https://ejtaal.net/a[...]
Spoken Language Services
[3]
웹사이트
Borax - The Chemical Company
https://thechemco.co[...]
2024-04-08
[4]
저널
Gene expression alterations of human liver cancer cells following borax exposure
2019-07-01
[5]
웹사이트
Boric Acid Technical Fact Sheet
http://npic.orst.edu[...]
2022-12-13
[6]
SDS
ホウ砂 (四ホウ酸二ナトリウム・十水和物) SDS
https://www.merckmil[...]
[7]
서적
悲劇の原子力船「むつ」―いま明かす漂流事件の真相
実業之日本社
1994-10-01
[8]
방송
ストラディバリウス~響きあう奇跡と幻想
BSジャパン
2006-01-01
[9]
서적
Haynes
[10]
서적
Haynes
[11]
서적
Haynes
[12]
저널
Crystal structures of sodium sulfate decahydrate (Glauber's salt) and sodium tetraborate decahydrate (borax). Redetermination by neutron diffraction
[13]
웹인용
Potential Commodities NFPA 704
http://tlsoakland.co[...]
2018-12-09
[14]
PGCH
[15]
PGCH
[16]
PGCH
[17]
웹인용
보관된 사본
http://www.blacksmit[...]
2016-08-07
[18]
웹인용
Borax ( Na2B4O7. 10H2O ) – Sodium Borate – Occurrence, Discovery and Applications
http://www.azom.com/[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com