수소화 탈황
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
수소화 탈황(HDS)은 유기 화합물에서 황을 제거하는 화학 공정으로, 주로 정유 공장에서 사용된다. 1897년 폴 사바티에의 연구를 통해 촉매 수소화 반응이 발견되었고, 1950년대 중반 상업화되었다. HDS는 나프타, 등유, 경유 등 다양한 석유 제품에서 황 화합물을 제거하여 귀금속 촉매의 피독을 방지하고, 환경 규제를 준수하는 데 기여한다. 공정은 고온 및 고압 하에서 코발트와 몰리브덴이 함침된 알루미나 촉매를 사용하여 진행되며, 수소화 탈질소 및 올레핀 포화와 같은 다른 용도로도 활용된다.
더 읽어볼만한 페이지
- 화학공학 - 석유화학
석유화학은 석유나 천연가스를 원료로 합성수지, 합성섬유 원료, 합성고무 등을 생산하는 산업으로, 석유 자원 고갈 및 환경 문제에 따라 대체 연료 및 원료 개발과 탄소 중립 정책에 따른 지속 가능한 발전 노력이 요구된다. - 화학공학 - 석영유리
석영유리는 고순도 실리카를 고온에서 용융하여 제조된 비결정질 유리로, 뛰어난 내열성, 내화학성, 높은 광투과율 등의 특성으로 광섬유, 반도체, 광학 기기 등 첨단 산업 분야에서 핵심 소재로 사용되지만 불화수소에 취약하고 고가인 단점이 있다. - 화학공학 공정 - 디카페인
디카페인은 커피나 차에서 카페인을 제거한 제품을 의미하며, 유기 용매, 물, 초임계 이산화탄소 등을 이용한 탈카페인 기술로 제조되거나 카페인 없는 커피나무를 재배하는 방법으로 생산된다. - 화학공학 공정 - 건조
건조는 물질 속 수분을 증발시켜 고체나 반고체 상태로 만드는 과정으로, 식품 보존, 화학 실험, 산업 공정, 방송 공학, 생물학 연구 등 다양한 분야에서 활용되며 DNA 손상을 유발하거나 미생물의 저항성을 진화시키기도 한다.
2. 역사
유기 물질의 촉매 수소화 반응은 이미 알려져 있었지만, 미세하게 분할된 니켈이 탄화수소(에틸렌, 벤젠) 이중 결합에 수소를 고정하는 것을 촉매하는 성질은 1897년 프랑스 화학자 폴 사바티에에 의해 발견되었다.[6][7] 이 연구를 통해 그는 기체 상태의 불포화 탄화수소가 수소와 촉매 금속을 사용하여 포화 탄화수소로 변환될 수 있음을 발견했으며, 이는 현대 촉매 수소화 공정의 기초를 다졌다.
사바티에의 연구 직후, 독일 화학자 빌헬름 노르만은 액체 상태의 불포화 지방산 또는 글리세라이드를 포화된 것으로 변환하는 데 촉매 수소화 반응을 사용할 수 있음을 발견했다. 그는 1902년 독일에서[8], 1903년 영국에서[9] 특허를 받았으며, 이는 현재 세계적인 산업의 시작이었다.
1950년대 중반, 최초의 귀금속 촉매 개질 공정(플래트포머 공정)이 상업화되었다. 동시에 이러한 개질기의 나프타 공급원료에 대한 촉매 수소화 탈황도 상업화되었다. 그 후 수십 년 동안, 아래의 흐름도에 묘사된 것과 같은 다양한 독점 촉매 수소화 탈황 공정이 상업화되었다. 현재 전 세계의 거의 모든 정유 공장에 하나 이상의 HDS 장치가 있다.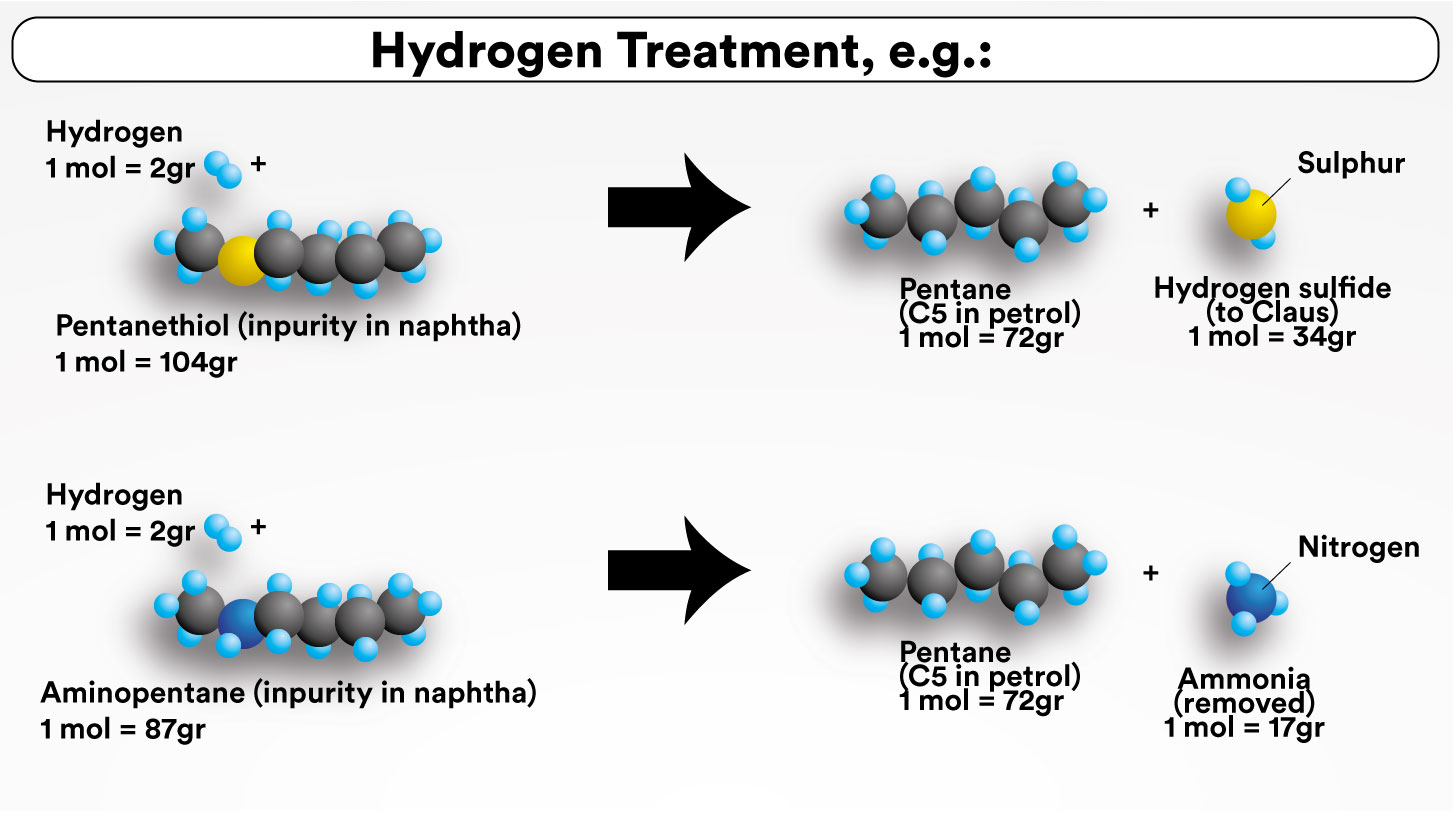
2006년까지, JP-8 제트 연료를 처리하여 연료 전지 수소 개질기를 위한 깨끗한 원료를 생산하기 위해 소형 미세 유체 HDS 장치가 구현되었다.[10] 2007년까지 이는 작동하는 5 kW 연료 전지 발전 시스템에 통합되었다.[11]
2. 1. 초기 연구
유기 물질의 촉매 수소화 반응은 이미 알려져 있었지만, 미세하게 분할된 니켈이 탄화수소(에틸렌, 벤젠) 이중 결합에 수소를 고정하는 것을 촉매하는 성질은 1897년 프랑스 화학자 폴 사바티에에 의해 발견되었다.[6][7] 이 연구를 통해 그는 기체 상태의 불포화 탄화수소가 수소와 촉매 금속을 사용하여 포화 탄화수소로 변환될 수 있음을 발견했으며, 이는 현대 촉매 수소화 공정의 기초를 다졌다.사바티에의 연구 직후, 독일 화학자 빌헬름 노르만은 액체 상태의 불포화 지방산 또는 글리세라이드를 포화된 것으로 변환하는 데 촉매 수소화 반응을 사용할 수 있음을 발견했다. 그는 1902년 독일에서[8], 1903년 영국에서[9] 특허를 받았으며, 이는 현재 세계적인 산업의 시작이었다.
1950년대 중반, 최초의 귀금속 촉매 개질 공정(플래트포머 공정)이 상업화되었다. 동시에 이러한 개질기의 나프타 공급원료에 대한 촉매 수소화 탈황도 상업화되었다. 그 후 수십 년 동안, 다양한 독점 촉매 수소화 탈황 공정이 상업화되었다. 현재 전 세계의 거의 모든 정유 공장에 하나 이상의 HDS 장치가 있다.
2006년까지, JP-8 제트 연료를 처리하여 연료 전지 수소 개질기를 위한 깨끗한 원료를 생산하기 위해 소형 미세 유체 HDS 장치가 구현되었다.[10] 2007년까지 이는 작동하는 5 kW 연료 전지 발전 시스템에 통합되었다.[11]
2. 2. 산업화
유기 물질의 촉매 수소화 반응은 이미 알려져 있었지만, 1897년 프랑스의 화학자 폴 사바티에는 미세하게 분할된 니켈이 탄화수소(에틸렌, 벤젠) 이중 결합에 수소를 고정하는 것을 촉매하는 성질을 발견하였다.[6][7] 이를 통해 그는 기체 상태의 불포화 탄화수소가 수소와 촉매 금속을 사용하여 포화 탄화수소로 변환될 수 있음을 발견했으며, 이는 현대 촉매 수소화 공정의 기초가 되었다.사바티에의 연구 직후, 독일 화학자 빌헬름 노르만은 액체 상태의 불포화 지방산 또는 글리세라이드를 포화된 것으로 변환하는 데 촉매 수소화 반응을 사용할 수 있음을 발견하고, 1902년 독일에서[8], 1903년 영국에서[9] 특허를 획득하였으며, 이는 현재 세계적인 산업의 시작이었다.
1950년대 중반, 최초의 귀금속 촉매 개질 공정(플래트포머 공정)이 상업화되었고, 이와 동시에 이러한 개질기의 나프타 공급원료에 대한 촉매 수소화 탈황도 상업화되었다. 그 후 수십 년 동안, 다양한 독점 촉매 수소화 탈황 공정이 상업화되어 현재 전 세계의 거의 모든 정유 공장에 하나 이상의 HDS 장치가 있다.
2000년대에는 소형 미세 유체 HDS 장치가 구현되어 JP-8 제트 연료를 처리하여 연료 전지 수소 개질기를 위한 깨끗한 원료를 생산하는데 사용되었고,[10] 2007년까지 이는 작동하는 5 kW 연료 전지 발전 시스템에 통합되었다.[11]
2. 3. 상업화
1897년 프랑스 화학자 폴 사바티에는 미세하게 분할된 니켈이 탄화수소(에틸렌, 벤젠) 이중 결합에 수소를 고정하는 것을 촉매하는 성질을 발견했다.[6][7] 이를 통해 기체 상태의 불포화 탄화수소가 수소와 촉매 금속을 사용하여 포화 탄화수소로 변환될 수 있음을 발견했으며, 이는 현대 촉매 수소화 공정의 기초가 되었다.사바티에의 연구 직후, 독일 화학자 빌헬름 노르만은 액체 상태의 불포화 지방산 또는 글리세라이드를 포화된 것으로 변환하는 데 촉매 수소화 반응을 사용할 수 있음을 발견하고, 1902년 독일에서[8], 1903년 영국에서[9] 특허를 획득했다.
1950년대 중반, 최초의 귀금속 촉매 개질 공정(플래트포머 공정)이 상업화되었고, 동시에 이러한 개질기의 나프타 공급원료에 대한 촉매 수소화 탈황도 상업화되었다. 그 후 수십 년 동안, 다양한 독점 촉매 수소화 탈황 공정이 상업화되어 현재 전 세계의 거의 모든 정유 공장에 하나 이상의 HDS 장치가 있다.
2006년에는 JP-8 제트 연료를 처리하여 연료 전지 수소 개질기를 위한 깨끗한 원료를 생산하기 위해 소형 미세 유체 HDS 장치가 구현되었고,[10] 2007년까지 이는 작동하는 5kW 연료 전지 발전 시스템에 통합되었다.[11]
2. 4. 최근 동향
유기 물질의 촉매 수소화 반응은 이미 알려져 있었지만, 1897년 프랑스의 화학자 폴 사바티에가 미세하게 분할된 니켈이 탄화수소(에틸렌, 벤젠)의 이중 결합에 수소를 고정하는 성질을 발견했다.[6][7] 이를 통해 기체 상태의 불포화 탄화수소가 수소와 촉매 금속을 사용하여 포화 탄화수소로 변환될 수 있음을 발견했고, 이는 현대 촉매 수소화 공정의 기초가 되었다.사바티에의 연구 직후, 독일 화학자 빌헬름 노르만은 액체 상태의 불포화 지방산 또는 글리세라이드를 포화시키는 데 촉매 수소화 반응을 사용할 수 있음을 발견, 1902년 독일[8]과 1903년 영국에서[9] 특허를 받았다.
1950년대 중반, 최초의 귀금속 촉매 개질 공정(플래트포머 공정)이 상업화되면서, 이러한 개질기의 나프타 공급원료에 대한 촉매 수소화 탈황도 상업화되었다. 이후 수십 년 동안 다양한 독점 촉매 수소화 탈황 공정이 상업화되었으며, 현재 전 세계의 거의 모든 정유 공장에 하나 이상의 HDS 장치가 있다.
2006년에는 JP-8 제트 연료를 처리하여 연료 전지 수소 개질기를 위한 깨끗한 원료를 생산하기 위해 소형 미세 유체 HDS 장치가 구현되었고,[10] 2007년까지 5kW 연료 전지 발전 시스템에 통합되었다.[11]
3. 공정
3. 1. 공정 화학
수소 첨가 반응은 순수한 결과가 수소 (H)의 첨가인 화학 반응의 한 종류이다. 수소 분해 반응은 수소 첨가 반응의 한 유형으로, C가 탄소 원자이고 X가 황 (S), 질소 (N) 또는 산소 (O) 원자인 C-X 화학 결합의 절단을 유발한다. 수소 분해 반응의 순수한 결과는 C-H 및 H-X 화학 결합의 형성이다. 따라서, 수소화 탈황은 수소 분해 반응이다. 일부 석유 제품에 존재하는 황 화합물인 에탄티올 (에테인싸이올/Ethanethiol영어)을 예로 사용하면, 수소화 탈황 반응은 다음과 같이 간단하게 표현할 수 있다.:
- >
\overset{에탄}{C2H6} + \overset{황화 수소}{H2S}
3. 2. 공정 설명
정유 공장과 같은 곳에서 산업용 수소화 탈황 장치는 반응기에서 이루어지는데, 고정층 반응기에서 300~400 °C의 높은 온도와 30~130 기압의 높은 압력에서 반응이 일어난다. 일반적으로 코발트와 몰리브덴이 함침된 알루미나 기반의 촉매(CoMo 촉매)가 사용된다.액체 공급원료는 펌핑되어 높은 압력에서 수소 함량이 높은 재순환 가스 흐름과 합쳐진다. 액체-가스 혼합물은 열 교환기를 통해 예열된 후, 가열로를 통과하며 완전히 증발하여 필요한 높은 온도로 가열된다. 이후 반응기에 들어가 촉매의 고정층을 통과하며 수소화 탈황 반응이 일어난다.
뜨거운 반응 생성물은 부분적으로 냉각된 후 압력 조절기를 거쳐 압력이 낮아진다. 결과물인 액체와 가스의 혼합물은 약 35 °C 및 3~5기압에서 가스 분리기 압력 용기에 들어간다.
가스 분리 용기에서 나오는 수소 함량이 높은 가스 대부분은 재순환 가스로, 아민 접촉기를 통해 반응 생성물인 를 제거한다. 가 제거된 수소 함량이 높은 가스는 반응기에서 재사용하기 위해 다시 재순환된다. 가스 분리 용기에서 나오는 과잉 가스는 반응 생성물 액체의 스트리핑에서 나오는 산성 가스와 합쳐진다.
가스 분리 용기에서 나오는 액체는 재비된 스트리퍼 증류 탑을 통과한다. 스트리퍼의 바닥 생성물은 수소화 탈황 장치에서 나오는 최종 탈황 액체 생성물이다.
스트리퍼에서 나오는 오버헤드 산성 가스에는 수소, 메탄, 에탄, 황화 수소, 프로판 및 일부 부탄 등이 포함될 수 있다. 이 산성 가스는 정유소의 주요 아민 가스 처리 장치에서 황화 수소를 제거하고, 프로판, 부탄 등을 회수하기 위해 일련의 증류탑을 통해 정유소의 중앙 가스 처리 공장으로 보내진다. 잔류 수소, 메탄, 에탄 및 일부 프로판은 정유 연료 가스로 사용된다. 아민 가스 처리 장치에 의해 제거 및 회수된 황화 수소는 클라우스 공정에서 원소 황으로, 또는 습식 황산 공정이나 접촉 공정에서 황산으로 변환된다.
3. 3. 촉매 및 메커니즘
주요 수소화 탈황(HDS) 촉매는 이황화 몰리브덴(MoS2)을 기반으로 하며, 소량의 다른 금속을 포함한다.[13] 촉매 활성 부위의 특성은 활발히 연구되는 분야이지만, 일반적으로 MoS2 구조의 기저면은 촉매 작용과 관련이 없고, 시트의 가장자리 또는 가장자리가 관련이 있는 것으로 추정된다.[14] MoS2 결정체의 가장자리에서 몰리브덴 중심은 배위 불포화 부위(CUS)를 안정화할 수 있다. 티오펜과 같은 기질은 이 부위에 결합하여 C-S 절단과 C=C 수소화 반응을 모두 일으킨다. 수소는 황화물 제거에 의한 음이온 공석 생성, 수소화, 수소 분해 등 여러 역할을 한다.대부분의 금속이 HDS를 촉매하지만, 가장 활성이 높은 금속은 전이 금속 계열의 중간에 있는 금속이다. 황화 루테늄이 가장 활성이 높은 단일 촉매로 보이며, 코발트와 몰리브덴의 이원 조합도 활성이 매우 높다.[15] 기본적인 코발트 변형 MoS2 촉매 외에도, 공급 원료의 특성에 따라 니켈과 텅스텐도 사용된다. 예를 들어, Ni-W 촉매는 수소화 탈질소에 더 효과적이다.[16]
금속 황화물은 높은 표면적을 가진 γ-알루미나와 같은 물질 위에 지지된다. 담체는 촉매 활성을 나타내는 MoS2의 더 큰 부분을 생성하며, 담체와 촉매 간의 상호 작용은 촉매 작용에 참여하는 중요한 연구 분야이다.
4. 정유 공장 원료의 황 화합물
정유 공장의 HDS 원료(나프타, 등유, 경유, 중질유)에는 티올, 티오펜, 유기 황화물 및 이황화물 등 다양한 종류의 유기 황 화합물이 광범위하게 포함되어 있다. 이러한 유기 황 화합물은 화석 연료인 석유 원유의 자연적인 생성 과정에서 존재했던 황 함유 생물학적 성분의 분해 산물이다.
HDS 공정을 사용하여 정유 나프타를 탈황할 때는, 후속적인 나프타의 촉매 개질에서 귀금속 촉매의 피독을 방지하기 위해 총 황을 ppm 단위 이하로 제거해야 한다.
이 공정을 경유 탈황에 사용하는 경우, 미국과 유럽의 최신 환경 규제에 따라 ''초저유황 경유''(ULSD)가 요구되며, 이는 매우 깊은 수소화 탈황이 필요함을 의미한다. 2000년대 초반 고속도로 차량용 경유에 대한 정부 규제 한도는 총 황 함량 300~500 ppm(중량 기준) 범위였다. 2006년 기준으로 고속도로 경유의 총 황 한도는 15~30 ppm(중량 기준) 범위이다.[12]
==== 티오펜류 ====
석유에는 티오펜이라고 불리는 방향족 황 함유 헤테로고리 화합물이 흔하게 존재한다. 티오펜 자체에서부터 더욱 응축된 유도체인 벤조티오펜과 디벤조티오펜에 이르기까지 다양한 종류의 티오펜이 석유에 존재한다. 티오펜 자체와 알킬 유도체는 수소화 분해 반응이 더 쉽지만, 4,6-디메틸디벤조티오펜을 포함한 디벤조티오펜은 가장 까다로운 기질로 간주된다. 벤조티오펜은 수소화 탈황(HDS)에 대한 민감도 측면에서 단순한 티오펜과 디벤조티오펜의 중간에 위치한다.
4. 1. 티오펜류
석유에는 티오펜이라고 불리는 방향족 황 함유 헤테로고리 화합물이 흔하게 존재한다. 티오펜 자체에서부터 더욱 응축된 유도체인 벤조티오펜과 디벤조티오펜에 이르기까지 다양한 종류의 티오펜이 석유에 존재한다. 티오펜 자체와 알킬 유도체는 수소화 분해 반응이 더 쉽지만, 4,6-디메틸디벤조티오펜을 포함한 디벤조티오펜은 가장 까다로운 기질로 간주된다. 벤조티오펜은 수소화 탈황(HDS)에 대한 민감도 측면에서 단순한 티오펜과 디벤조티오펜의 중간에 위치한다.5. 환경 문제와 규제
에너지 가운데의 유황 또는 유황 화합물이 연소에 의하여 아황산가스 및 무수황산(無水黃酸:H2SO4)이 생성되고, 이것이 연소가스에 혼합되어 대기 중에 배출되므로 공해의 대상물질이 된다. 기체연료 중의 유황 화합물은 분자의 크기가 작기 때문에 정제(精製)과정에서 제거가 용이하고 공해 문제가 되지 않지만, 석유와 석탄 중에는 유황이 함유되어 있어 이것이 배출가스에 혼합된다. 특히 석유의 수요는 해마다 증가하고 있고, 한국은 유황의 함유량이 많은 중동지역의 원유를 이용하므로 공해문제는 더욱 심각해진다.
탈황법에는 연소가스로부터 유황화합물을 제거하는 방식과, 석유의 정제과정에서 유황분을 제거하는 중유탈황(重油脫黃)방식이 있다. 제지공업·비료공업·염색공업·피혁공업의 공장 폐수와 석유정제·석유화학·제철·유지공업 등의 공장배수 중에는 유황화합물이 포함되고 있는데, 이는 화학약품 처리·생물화학적 처리 등의 방법에 의하여 제거시킨다.
6. 탈황 기술
에너지 가운데의 유황 또는 유황 화합물이 연소에 의하여 아황산가스 및 무수황산(無水黃酸:H2SO4)이 생성되고, 이것이 연소가스에 혼합되어 대기 중에 배출되므로 공해의 대상물질이 된다. 기체연료 중의 유황 화합물은 분자의 크기가 작기 때문에 정제(精製)과정에서 제거가 용이하고 공해 문제가 되지 않지만, 석유와 석탄 중에는 유황이 함유되어 있어 이것이 배출가스에 혼합된다. 특히 석유의 수요는 해마다 증가하고 있고, 한국은 유황의 함유량이 많은 중동지역의 원유를 이용하므로 공해문제는 더욱 심각해진다.
탈황법에는 연소가스로부터 유황화합물을 제거하는 방식과, 석유의 정제과정에서 유황분을 제거하는 중유탈황(重油脫黃)방식이 있다. 제지공업·비료공업·염색공업·피혁공업의 공장 폐수와 석유정제·석유화학·제철·유지공업 등의 공장배수 중에는 유황화합물이 포함되고 있는데, 이는 화학약품 처리·생물화학적 처리 등의 방법에 의하여 제거시킨다.
7. 한국의 탈황 기술 현황
8. 다른 활용
기본적인 수소화 분해 반응은 수소화 탈황 외에도 여러 용도로 사용된다.
==== 수소화 탈질소 ====
수소화 분해 반응은 수소화 탈질소(HDN)로 알려진 공정에서 석유 스트림의 질소 함량을 줄이는 데 사용된다.[17][18] 공정 흐름은 수소화 탈황(HDS) 장치와 동일하다.
일부 석유 분별 제품에 존재하는 질소 화합물인 피리딘(피리딘/pyridine영어, )을 예로 들어, 수소화 탈질소 반응은 다음의 세 단계로 발생하는 것으로 추정된다.
:
전체 반응은 다음과 같이 간단하게 표현할 수 있다.
:
석유 정제소 내에서 나프타를 탈황하는 많은 HDS 장치는 실제로 어느 정도 동시에 탈질소화도 수행한다.
==== 올레핀 포화 ====
수소화 반응은 알켄을 알칸으로 전환하는 데 사용될 수 있으며, 사용되는 공정은 수소화 탈황(HDS) 장치와 동일하다.
예를 들어, 올레핀 펜텐의 포화는 다음과 같이 나타낼 수 있다.
:
정유 공장 또는 석유화학 공장 내의 일부 수소화 장치는 올레핀의 포화만을 위해 사용되거나, 탈황뿐만 아니라 탈질소 및 올레핀 포화를 어느 정도 동시에 수행하는 데 사용될 수 있다.
8. 1. 수소화 탈질소
수소화 분해 반응은 수소화 탈질소(HDN)로 알려진 공정에서 석유 스트림의 질소 함량을 줄이는 데 사용된다.[17][18] 공정 흐름은 수소화 탈황(HDS) 장치와 동일하다.일부 석유 분별 제품에 존재하는 질소 화합물인 피리딘(피리딘/pyridine영어, )을 예로 들어, 수소화 탈질소 반응은 다음의 세 단계로 발생하는 것으로 추정된다.
:
전체 반응은 다음과 같이 간단하게 표현할 수 있다.
:
석유 정제소 내에서 나프타를 탈황하는 많은 HDS 장치는 실제로 어느 정도 동시에 탈질소화도 수행한다.
8. 2. 올레핀 포화
수소화 반응은 알켄을 알칸으로 전환하는 데 사용될 수 있으며, 사용되는 공정은 수소화 탈황(HDS) 장치와 동일하다.예를 들어, 올레핀 펜텐의 포화는 다음과 같이 나타낼 수 있다.
:
정유 공장 또는 석유화학 공장 내의 일부 수소화 장치는 올레핀의 포화만을 위해 사용되거나, 탈황뿐만 아니라 탈질소 및 올레핀 포화를 어느 정도 동시에 수행하는 데 사용될 수 있다.
참조
[1]
학술지
Recent developments in alumina supported hydrodesulfurization catalysts for the production of sulfur-free refinery products: A technical review
2020-06-23
[2]
서적
Petroleum Refining Technology and Economics
Marcel Dekker, Inc
[3]
웹사이트
Hydrodesulfurization Technologies and Costs
http://www.theicct.o[...]
Trans Energy Associates
2003-05-29
[4]
보고서
Sulfur production report
http://minerals.usgs[...]
United States Geological Survey
[5]
웹사이트
Discussion of recovered byproduct sulfur
http://www.agiweb.or[...]
[6]
문서
C.R.Acad.Sci. 1897, 132, 210
[7]
문서
C.R.Acad.Sci. 1901, 132, 210
[8]
특허
DE Patent DE141029 (Espacenet, record not available)
http://v3.espacenet.[...]
[9]
특허
UK Patent GB190301515 GB190301515 (Espacenet)
http://v3.espacenet.[...]
[10]
웹사이트
Microchannel HDS (March 2006)
http://www.greencarc[...]
[11]
웹사이트
Fuel cells help make noisy, hot generators a thing of the past
http://www.pnl.gov/t[...]
Pacific Northwest National Laboratory
[12]
웹사이트
"Diesel Sulfur"
http://www.npradc.or[...]
National Petrochemical & Refiners Association (NPRA)
[13]
서적
Hydrotreating Catalysis, Science and Technology
Springer-Verlag: Berlin
[14]
학술지
Structure-Function Relations in Molybdenum Sulfide Catalysts - the Rim-Edge Model
[15]
학술지
Periodic trends in hydrodesulfurization: in support of the Sabatier principle
[16]
학술지
Recent developments in alumina supported hydrodesulfurization catalysts for the production of sulfur-free refinery products: A technical review
2020-06-23
[17]
학위논문
Kinetics and Interactions of the Simultaneous Catalytic Hydrodenitrogenation of Pyridine and Hydrodesulfurization of Thiophene
https://dspace.mit.e[...]
MIT
[18]
학술지
Simultaneous Catalytic Hydrodenitrogenation of Pyridine and Hydrodesulfurization of Thiophene
[19]
서적
Petroleum Refining Technology and Economics
Marcel Dekker, Inc
[20]
웹사이트
Hydrodesulfurization Technologies and Costs
http://www.theicct.o[...]
2003-05-29
[21]
웹사이트
석유 정제의 연구 개발
https://coc.cosmo-oi[...]
코스모 석유
2020-08-11
[22]
서적
Petroleum Refining Technology and Economics
https://archive.org/[...]
Marcel Dekker, Inc
[23]
웹사이트
"Hydrodesulfurization Technologies and Costs"
http://www.theicct.o[...]
2003-05-29
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

