신호전달
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
신호전달은 세포 외부의 자극을 생화학적 신호로 변환하는 과정이다. 자극은 세포 외부 신호부터 세포 내부의 DNA 손상까지 다양하며, 대부분의 신호전달 경로는 리간드라고 불리는 신호전달 분자가 수용체에 결합하는 것을 포함한다. 세포는 외부 자극 외에도 다양한 내부적 요인에 의해 자극을 받으며, 기계적 힘, 삼투압, 온도, 빛 등 다양한 자극에 반응한다. 신호전달은 세포 내 반응을 유발하며, 유전자 활성화 및 대사 변화와 같은 세포 반응을 일으킨다. 주요 신호전달 경로에는 MAPK/ERK 경로, cAMP 의존성 경로, IP3/DAG 경로 등이 있으며, 면역학 연구에서도 중요한 역할을 한다.
더 읽어볼만한 페이지
- 신경화학 - 세로토닌
세로토닌은 트립토판에서 유래하는 신경전달물질로, 뇌, 혈소판, 소화기관 등에 존재하며 수면, 체온 조절, 학습 등 다양한 생리 과정에 관여하고, 세로토닌 수용체를 통해 작용하며 여러 약물의 표적이 되기도 한다. - 신경화학 - 옥시토신
옥시토신은 9개의 아미노산으로 구성된 펩타이드 호르몬으로, 자궁 수축 유도, 유즙 분비 촉진, 사회적 유대감 형성, 불안 감소, 뇌 기능 보호 등 생리적, 정신의학적 기능에 관여한다. - 신호 전달 - 수용체 길항제
수용체 길항제는 수용체에 결합하여 작용제의 효과를 억제하는 물질로, 결합 부위 및 방식에 따라 다양한 유형으로 분류되며, 질병 치료 및 중독 해독 등에 활용된다. - 신호 전달 - 호르몬
호르몬은 특정 기관의 기능을 조절하는 정보 전달 물질로, 다양한 화학적 구조와 신호 전달 방식을 가지며, 척추동물의 성장, 발달, 생식, 신진대사 등 생리 과정에 관여하고, 의약품으로도 사용되지만 부작용의 위험이 있다. - 세포 신호 - 수용체
수용체는 세포 내외의 신호 분자를 인식하여 세포 반응을 유발하는 단백질로, 이온 채널형, G 단백질 연결형, 효소 연결형, 핵 수용체의 네 가지 유형으로 나뉘며, 리간드 결합 친화도와 효능에 따라 다양한 종류로 분류되고 질병과 관련되어 구조와 기능 연구가 활발히 진행되고 있다. - 세포 신호 - 호르몬
호르몬은 특정 기관의 기능을 조절하는 정보 전달 물질로, 다양한 화학적 구조와 신호 전달 방식을 가지며, 척추동물의 성장, 발달, 생식, 신진대사 등 생리 과정에 관여하고, 의약품으로도 사용되지만 부작용의 위험이 있다.
2. 자극
신호전달의 기본은 특정 자극을 생화학적 신호로 변환하는 것이다. 이러한 자극의 성격은 상피 성장인자(EGF)의 존재와 같은 세포외 단서부터 복제성 텔로미어의 마모로 인한 DNA 손상과 같은 세포내 사건에 이르기까지 매우 다양하다.[89] 전통적으로 중추신경계에 도달하는 신호는 감각으로 분류되며, 시냅스 전달이라는 과정을 통해 뉴런에서 뉴런으로 전달된다. 다세포 생물에는 배아 발생을 관장하는 것과 같은 많은 다른 세포간 신호전달 메커니즘이 존재한다.[90]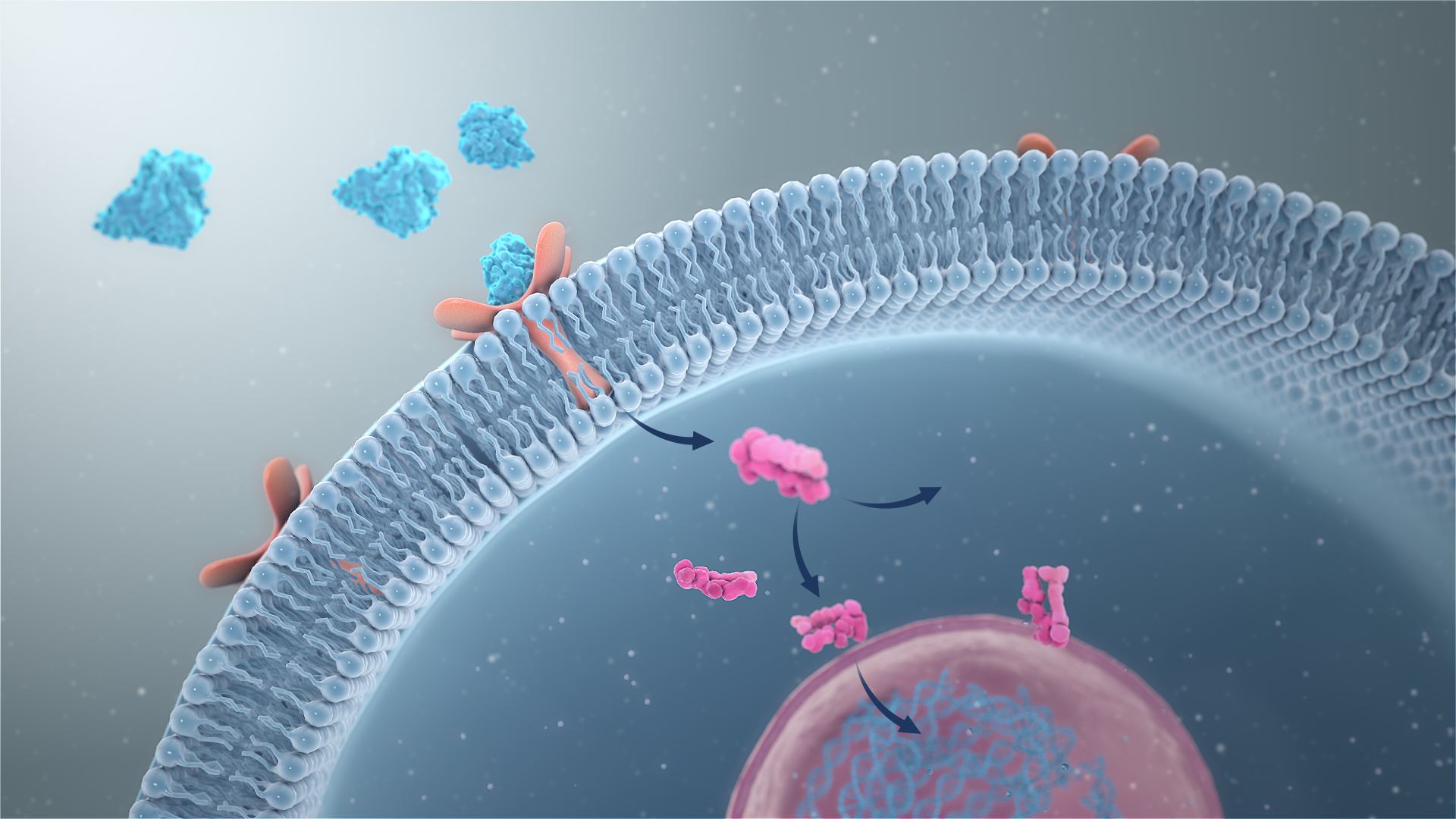
2. 1. 리간드
대부분의 신호전달 경로는 리간드(신호전달 분자)가 수용체에 결합하여 세포 내부에서 특정 반응을 유발하는 것을 포함한다. 신호전달 분자가 수용체와 결합하면 수용체 활성화(receptor activation)라고 알려진 수용체의 입체구조 변화가 일어난다.[91] 대부분의 리간드는 세포 표면 수용체에 결합하는 세포 바깥의 가용성 분자이다. 이러한 리간드에는 성장인자, 사이토카인, 신경전달물질이 포함된다. 피브로넥틴 및 히알루로난과 같은 세포외 기질 성분도 각각 인테그린 및 CD44 수용체에 결합할 수 있다. 스테로이드 호르몬과 같은 일부 분자는 지용성이므로 원형질막을 통과하여 세포질 수용체 또는 핵 수용체에 도달한다.[91] 스테로이드 호르몬 수용체의 경우, 자극을 받으면 스테로이드 반응 유전자의 프로모터 영역에 결합한다.[92]신호전달 분자의 모든 분류가 각 부류 구성원의 분자적 특성을 고려하는 것은 아니다. 예를 들어, 냄새 물질은 도파민[93]과 같은 작은 분자로부터 엔돌핀과 같은 신경펩타이드[94]에 이르기까지 크기가 다양한 신경전달물질과 마찬가지로 광범위한 분자 부류에 속한다.[95] 또한 일부 분자는 두 가지 이상의 부류에 속할 수 있는데, 에피네프린은 중추신경계에서 분비되는 신경전달물질이면서 부신속질에서 분비되는 호르몬이다.
HER2와 같은 일부 수용체는 과발현되거나 돌연변이가 발생하면 리간드 없이도 활성화(ligand-independent activation)될 수 있다. 이는 보상 메커니즘에 의해 뒤집힐 수도 있고, 그렇지 않을 수도 있는 경로의 구성적 활성화로 이어진다. 다른 상피 성장인자 수용체(EGFR)의 이량체화 파트너 역할을 하는 HER2의 경우, 구성적 활성화는 과다 증식 및 암을 유발한다.[96]
2. 2. 기계적 힘
진정후생동물 조직에 기저막이 널리 퍼져 있다는 것은 대부분의 세포 유형이 생존하려면 세포 접착이 필요하다는 것을 의미한다. 이러한 요구 사항 때문에 복잡한 기계적 변환 경로가 개발되어 세포가 기층의 강성을 감지할 수 있게 되었다. 이러한 신호전달은 인테그린에 결합된 액틴 세포골격이 변화를 감지하고 이를 YAP1을 통해 하류로 전달하는 영역인 국소 접착에서 주로 조정된다.[97] 카드헤린 및 셀렉틴과 같은 칼슘 의존성 세포 접착 분자도 기계적 변환을 매개할 수 있다.[98] 신경계 내의 특수한 형태의 기계적 변환은 청각, 촉각, 고유 감각 및 균형 감각 등의 기계적 감각을 담당한다.[99]2. 3. 삼투압
세포질과 세포외 환경 사이의 삼투질 농도 차이인 삼투압의 세포 및 전신 조절은 항상성에 매우 중요하다. 세포가 삼투성 자극을 감지할 수 있는 세 가지 방법은 거대분자 군집의 변화, 이온 강도, 세포막 또는 세포 골격의 특성 변화(후자는 기계적 변환의 한 형태)이다.[100] 이러한 변화는 삼투 센서 또는 삼투 수용체로 알려진 단백질에 의해 감지된다. 사람에서 가장 특징적인 삼투 센서는 사람 세포의 일차 섬모에 존재하는 일시적 수용체 전위 통로이다.[100][101]2. 4. 온도
세포의 온도 감지는 열감각으로 알려져 있으며, 주로 일시적 수용체 전위 통로에 의해 매개된다.[103] 또한 동물 세포에는 고온으로 인한 세포 손상을 방지하는 보존된 메커니즘인 열충격 반응이 있다. 이러한 반응은 고온으로 인해 열충격 단백질인 Hsp40/Hsp70 및 Hsp90과의 복합체에서 비활성 HSF1이 분리될 때 촉발된다. 비번역 RNA(ncRNA)인 hsr1의 도움으로 HSF1은 삼량체화되어 활성화되고 표적 유전자의 발현을 상향 조절한다.[104] 원핵생물과 진핵생물 모두에는 다른 많은 열감각 메커니즘이 존재한다.[103]2. 5. 빛
포유류에서 빛은 눈의 망막에 있는 광수용체 세포의 빛에 민감한 단백질을 활성화하여 시각과 생체 시계를 제어한다. 시각의 경우 간상세포와 원추세포에 있는 로돕신에 의해 빛이 감지된다.[105] 생체 시계의 경우 다른 광색소인 멜라놉신이 본질적 감광성 망막 신경절 세포에서 빛을 감지하는 역할을 한다.[106]3. 수용체
수용체는 크게 세포내 수용체와 세포외 수용체의 두 가지 주요 부류로 나눌 수 있다.[107] 세포 간 신호 전달은 내분비형, 방출 분비형(파라크린형), 신경형, 자기 분비형(자가 분비형), 접촉형으로 분류할 수 있다. 신호 전달에서 가장 중요한 것은 정보의 변환 과정이다. 체내에서 정보 발신 세포에서 발신된 신호 분자 중 세포 내로 침투하지 않는 신호 분자는 표적 세포가 가진 수용체 단백질과 결합하여 새로운 자극으로 변환되며, 이것이 세포 내 신호가 되어 세포 내의 유전자 발현이나 효소 활성의 변화 등 다양한 응답을 반환한다. 이때의 세포 외 신호 분자는 수용체 단백질과 특이적으로 결합하므로 리간드로서 작용한다.[91]
세포 외 신호 분자는 크게 두 가지로 분류할 수 있다.
- 소수성이 높은 것: 쉽게 세포막을 투과하여 세포 내 효소를 활성화 또는 불활성화하거나, 유전자 발현을 조절하는 세포 내 수용체(핵 내 수용체) 단백질과 결합한다. 스테로이드 호르몬이나 갑상샘 호르몬 등이 이에 해당한다.
- 친수성인 것: 신호 분자가 세포막을 투과할 수 없으므로, 신호 전달은 표적 세포의 세포막상에 있는 수용체에 의존한다.
세포막 상의 수용체는 이온 채널 연결형 수용체, G 단백질 연결 수용체, 효소 연결형 수용체의 세 종류로 크게 분류된다. 세포 내 수용체는 리간드와 결합한 수용체가 호모 이량체를 형성하는 스테로이드 호르몬 수용체, 리간드와 결합한 수용체가 헤테로 이량체를 형성하는 갑상샘 호르몬 수용체(TR), 레티노산 수용체(RAR), 비타민 D 수용체(VDR), 레티노이드 X 수용체(RXR), 내인성 리간드가 불분명한 오르판 수용체의 3가지 계통으로 분류된다.
3. 1. 세포외 수용체
세포외 수용체는 내재성 막 단백질로, 대부분의 수용체를 구성한다. 이들은 세포의 세포막에 걸쳐 있으며 수용체의 한 부분은 세포 외부에, 다른 부분은 세포 내부에 있다. 신호전달은 리간드가 수용체의 외부 영역에 결합하면서 일어난다(리간드는 막을 통과하지 않음). 리간드-수용체 결합은 "수용체 활성화"라고 불리는, 수용체 내부의 입체구조적 변화를 유도한다.[107] 이로 인해 수용체의 효소 도메인이 활성화되거나, 세포 내 다른 신호전달 단백질에 대한 결합 부위가 노출되어 신호가 세포질을 통해 전파된다.진핵세포에서 리간드/수용체 상호작용으로 활성화된 대부분의 세포내 단백질은 티로신 키네이스, 인산가수분해효소와 같은 효소 활성을 가진다. 이러한 효소는 종종 수용체에 공유결합으로 연결된다. 이들 중 일부는 cAMP, IP3 같은 2차 전달자를 생성하며, IP3는 세포 내 칼슘 저장고에서 세포질로 칼슘 방출을 조절한다. 다른 활성화된 단백질은 어댑터 단백질과 상호작용하여 신호전달 단백질 상호작용과 특정 자극에 반응하는 신호전달 복합체 조정을 촉진한다. 효소와 어댑터 단백질은 모두 다양한 2차 전달자 분자에 반응한다.
많은 어댑터 단백질과 효소는 특정 2차 전달자 분자에 결합하는 특별한 단백질 도메인을 가지고 있다. 예를 들어 칼슘 이온은 칼모둘린의 EF 핸드 도메인에 결합하여 Ca2+/칼모둘린 의존성 단백질 키네이스를 활성화한다. PIP3 및 다른 포스포이노시타이드는 단백질 키네이스 B(Akt)의 플렉스트린 상동성 도메인에 결합하여 같은 작용을 한다.
세포막 상의 수용체는 크게 세 종류로 분류된다.
- 이온 채널 연결형 수용체
- G 단백질 연결 수용체
- 효소 연결형 수용체
3. 1. 1. G 단백질 연결 수용체
G 단백질 연결 수용체(GPCR)는 7개의 막횡단 도메인을 가지고 있으며 이종삼합체 G 단백질에 연결된 내재성 막관통 단백질 패밀리이다.[108] 거의 800가지의 구성원으로 이루어진 G 단백질 연결 수용체는 포유류의 막 단백질 및 수용체 중 가장 규모가 큰 패밀리이다. 모든 동물 종을 합하면 G 단백질 연결 수용체는 5,000가지가 넘는다.[108]G 단백질 연결 수용체에 의한 신호전달은 수용체에 결합된 비활성 G 단백질로 시작된다. G 단백질은 Gα, Gβ, Gγ 소단위체로 구성된 이종삼량체로 존재한다.[109] G 단백질 연결 수용체가 리간드를 인식하면 수용체의 입체구조가 변경되어 G 단백질을 활성화하고 Gα가 GTP와 결합하고 다른 두 G 단백질 소단위체로부터 분리된다. 분리는 다른 분자와 상호작용할 수 있는 소단위체의 위치를 노출시킨다.[110] 활성화된 G 단백질 소단위체는 수용체에서 분리되어 인지질가수분해효소 및 이온 통로와 같은 많은 하류 효과기 단백질로부터 신호전달을 시작하며, 이온 통로는 2차 전달자 분자의 방출을 허용한다.[111] G 단백질 연결 수용체에 의한 신호 증폭의 전체 강도는 리간드-수용체 복합체 및 수용체-효과기 단백질 복합체의 수명과 고유한 효소 활성을 통한(예를 들어, 단백질 키네이스의 인산화 또는 β-어레스틴 의존성 내재화를 통해) 활성화된 수용체 및 효과기의 비활성화 시간에 의해 결정된다.
케모카인 수용체 CXCR2를 암호화하는 유전자에 점 돌연변이가 삽입된 연구가 수행되었다. 돌연변이 세포는 케모카인 결합이 없음에도 불구하고 활성 입체구조의 CXCR2의 발현으로 인해 악성 형질전환을 겪었다. 이는 케모카인 수용체가 암 발병에 기여할 수 있음을 의미한다.[112]
3. 1. 2. 티로신 특이적 단백질 키네이스, 세린/트레오닌 특이적 단백질 키네이스, 히스티딘 특이적 단백질 키네이스
수용체 티로신 키네이스(RTK)는 세포 내 키네이스 도메인 및 리간드와 결합하는 세포 외 도메인을 가지고 있는 막관통 단백질이다. 인슐린 수용체와 같은 성장인자 수용체가 그 예이다.[113] 신호전달을 수행하려면 수용체 티로신 키네이스가 원형질막에 이량체를 형성해야 한다.[114] 이량체는 수용체에 결합하는 리간드에 의해 안정화된다. 세포질 도메인 사이의 상호작용은 수용체 티로신 키네이스의 세포 내 키네이스 도메인 내 티로신 잔기의 자가인산화를 자극하여 입체구조적 변화를 일으킨다. 이에 따라 수용체의 키네이스 도메인이 활성화되어 세포 분화 및 물질대사와 같은 다양한 세포 과정을 촉진하는 하류 세포질 분자의 인산화 신호전달 케스케이드가 시작된다.[113]많은 세린/트레오닌 특이적 단백질 키네이스 및 이중 특이성 단백질 키네이스는 수용체 티로신 키네이스의 하류에서 작용하거나 그 자체로 막에 내장된 상태 또는 세포에 용해된 상태로 작용하여 신호전달에 중요하다. 신호전달 과정에는 사람의 키놈에 의해 암호화되는 약 560가지의 알려진 단백질 키네이스 및 슈도키네이스가 포함된다.[115][116]
히스티딘 특이적 단백질 키네이스는 다른 단백질 키네이스와 구조적으로 구별되며 원핵생물, 균류 및 식물에서 2성분 신호전달 메커니즘의 일부로 발견된다. ATP의 인산기는 먼저 키네이스 내의 히스티딘 잔기에 첨가된 다음 다른 단백질 또는 키네이스 자체의 수용체 도메인에 있는 아스파르트산 잔기로 옮겨져 아스파르트산 잔기를 활성화시킨다.[118]
3. 1. 3. 인테그린
인테그린은 다양한 세포에서 생성되며, 다른 세포 및 세포외 기질에 대한 세포 부착과 피브로넥틴, 콜라겐과 같은 세포외 기질 성분으로부터 신호를 전달하는 역할을 한다. 인테그린의 세포외 도메인에 리간드가 결합하면 단백질의 입체 구조가 변하고 세포막에 모여 신호 전달을 시작한다. 인테그린은 키네이스 활성이 없으므로, 인테그린 연결 키네이스를 주요 조정자로 하여 다양한 세포 내 단백질 키네이스와 어댑터 분자를 통해 신호 전달이 이루어진다.[119] 협력적인 인테그린-RTK 신호 전달은 세포 생존, 세포사멸, 증식, 분화의 시기를 결정한다.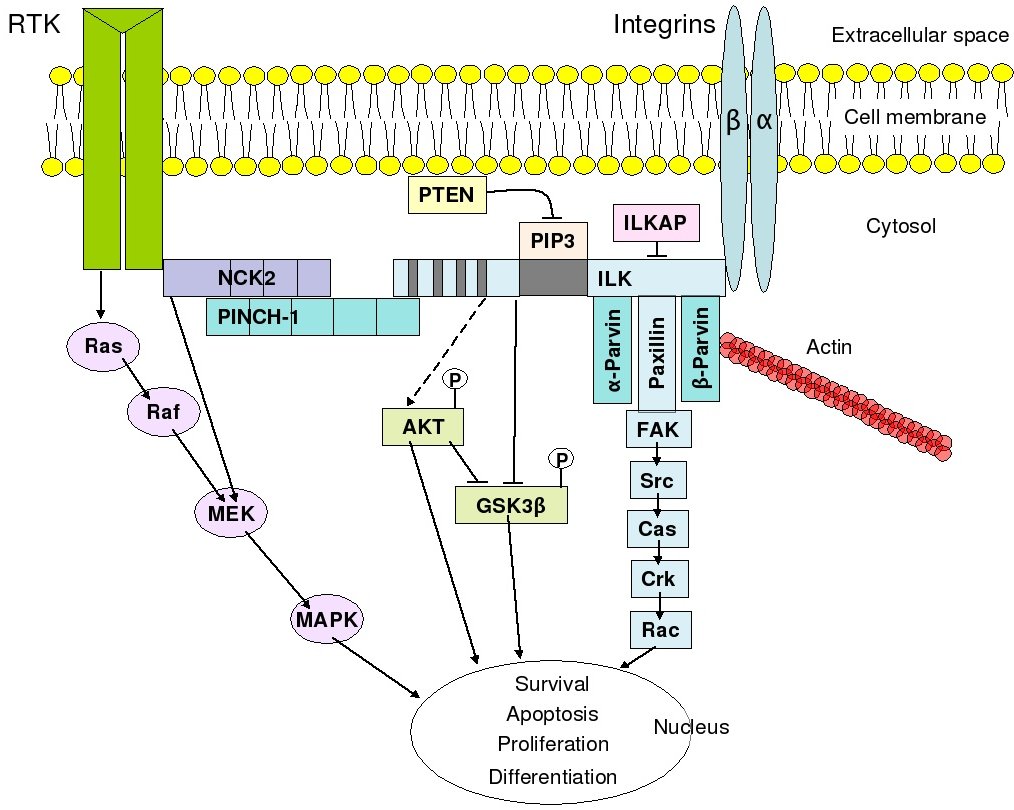
순환하는 혈액 세포와 상피 세포와 같이 순환하지 않는 세포의 인테그린 신호 전달에는 중요한 차이점이 있다. 순환 세포의 인테그린은 일반적으로 비활성 상태이다. 예를 들어, 순환하는 백혈구의 세포막 인테그린은 상피 세포와의 부착을 피하기 위해 비활성 상태로 유지되며, 염증 반응 부위에서 받는 자극과 같이 특정 자극에만 반응하여 활성화된다. 마찬가지로, 순환하는 혈소판의 세포막 인테그린은 혈전증을 피하기 위해 일반적으로 비활성 상태로 유지된다. 반면, 상피 세포는 세포막에 활성 인테그린을 가지고 있어 기질 세포에 안정적으로 부착하여 정상적인 기능을 유지하는 신호를 받는다.[120]
식물에서는 현재까지 진정한 인테그린 수용체가 확인되지 않았다. 그러나, 후생동물 수용체와의 구조적 유사성을 바탕으로 여러 인테그린 유사 단백질이 제안되었다.[121] 식물은 동물의 인테그린 연결 키네이스(ILK)와 1차 구조가 매우 유사한 인테그린 연결 키네이스를 포함한다. 실험 모델 식물인 애기장대(''Arabidopsis thaliana'')에서 인테그린 연결 키네이스 유전자 중 하나인 ''ILK1''은 세균 병원체로부터의 신호 분자에 대한 식물 면역 반응과 염분 및 삼투압 스트레스에 대한 식물의 민감성에 중요한 요소인 것으로 밝혀졌다.[122] ILK1 단백질은 고친화성 칼륨 수송체인 HAK5 및 칼슘 센서인 CML9와 상호작용한다.[122][123]
3. 1. 4. 톨 유사 수용체
톨 유사 수용체(TLR)가 활성화되면 신호를 전파하기 위해 세포질 내 어댑터 분자를 사용한다. 신호 전달에는 MYD88, TIRAP, TRIF, TRAM 4가지 어댑터 분자가 관여하는 것으로 알려져 있다.[124][125][126] 이 어댑터들은 IRAK1, IRAK4, TBK1, IKKi와 같은 다른 세포 내 분자를 활성화시켜 신호를 증폭시킨다. 이는 결국 특정 반응을 유발하는 유전자의 유도 또는 억제로 이어진다. 톨 유사 수용체 신호에 의해 수천 개의 유전자가 활성화되는데, 이는 이 방법이 유전자 조절을 위한 중요한 관문임을 의미한다.3. 1. 5. 리간드 개폐 이온 통로
리간드 개폐 이온 통로는 리간드가 결합하면 입체구조를 변화시켜 이온 전달 신호가 통과할 수 있는 세포막의 통로를 여는 단백질이다. 이러한 메커니즘의 예는 신경 시냅스의 수용기 세포에서 발견된다. 리간드 개폐 이온 통로가 열리면서 일어나는 이온의 유입은 시냅스 후 세포막을 탈분극시켜 신경을 따라 이동하는 활동 전위를 유도하고, 이에 따라 전압 개폐 이온 통로가 열리게 된다.[1]리간드 개폐 이온 통로가 열리는 동안 세포 안으로 유입되는 이온의 예로는 Ca2+가 있다. Ca2+는 신호전달 캐스케이드를 시작하고 반응하는 세포의 생리를 변경하는 2차 전달자 역할을 한다. 이는 시냅스에 관여하는 가지돌기 가시를 리모델링함으로써 시냅스 사이의 시냅스 반응을 증폭시키는 결과를 낳는다.[1]
3. 2. 세포내 수용체
핵 수용체 및 세포질 수용체와 같은 세포내 수용체는 해당 영역 내에 국한된 가용성 단백질이다. 핵 수용체의 전형적인 리간드는 스테로이드 호르몬인 테스토스테론, 프로게스테론과 같은 비극성 호르몬과 비타민 A와 D 유도체이다.[91] 신호전달을 시작하려면 리간드가 단순 확산을 통해 세포막을 통과해야 한다. 리간드가 핵막을 통과하여 핵으로 들어가 수용체와 결합하면 유전자 발현을 변경한다.활성화된 핵 수용체는 호르몬-수용체 복합체에 의해 활성화된 유전자의 프로모터 영역에 위치한 수용체 특이적 호르몬 반응요소(HRE) 서열에서 DNA에 부착된다. 이는 유전자 전사를 가능하게 하기 때문에 유전자 발현 유도자라고도 한다. 유전자 발현의 조절을 통해 작용하는 모든 호르몬은 그 작용 메커니즘에 의해 두 가지 결과를 나타낸다.
- 그 효과는 특징적으로 오랜 시간이 지난 후에 나타난다.
- 수용체에 대한 리간드의 결합을 비활성화하거나 종결시키는 대부분의 효소와 단백질의 상대적으로 느린 전환으로 인해 농도가 0으로 감소된 후에도 그 효과는 장기간 지속된다.
핵 수용체에는 아연 핑거와 리간드 결합 도메인을 포함하는 DNA 결합 도메인이 있다. 아연 핑거는 인산 골격을 잡아 DNA 결합을 안정화시킨다. 수용체와 매칭되는 DNA 서열은 일반적으로 모든 종류에서 육량체 반복이다. 서열은 유사하지만 방향과 거리가 서로 다르다. 리간드 결합 도메인은 결합하기 전에 핵 수용체의 이량체화를 담당하고 번역 기구와의 통신에 사용되는 전사활성화를 위한 구조를 제공한다.
스테로이드 호르몬 수용체는 주로 세포질 내에 위치하는 핵 수용체의 하위 부류이다. 스테로이드 호르몬 수용체는 스테로이드가 없으면 샤페론이나 열충격 단백질(HSP)을 포함하는 아포수용체(aporeceptor) 복합체와 결합한다. 열충격 단백질은 핵으로의 통과를 가능하게 하는 신호 서열이 접근 가능하도록 단백질이 접히는 것을 도와 수용체를 활성화하는 데 필요하다. 반면에 스테로이드 호르몬 수용체는 전사활성화 도메인이 숨겨져 있을 때 유전자 발현을 억제할 수 있다. 수용체 활성은 혼선이라고 불리는 과정인 또 다른 신호전달 경로의 결과로 N-말단에 있는 세린 잔기의 인산화에 의해 향상될 수 있다.
레티노산 수용체는 핵 수용체의 또 다른 하위 부류이다. 레티노산 수용체는 확산을 통해 세포로 들어가는 내분비 합성 리간드, 혈류를 통해 세포로 전달된 레티놀과 같은 전구체로부터 합성된 리간드 또는 프로스타글란딘과 같은 완전히 세포 내에서 합성된 리간드에 의해 활성화될 수 있다. 레티노산 수용체는 핵에 위치하며 열충격 단백질을 동반하지 않는다. 레티노산 수용체는 리간드가 결합하지 않을 때 특정 DNA 서열에 결합하여 유전자 발현을 억제하며 그 반대의 경우도 마찬가지이다.
면역계의 특정 세포내 수용체는 세포질 수용체이다. 최근에 확인된 NOD 유사 수용체(NLR)는 일부 진핵세포의 세포질에 존재하며 톨 유사 수용체(TLR)과 유사한 류신 풍부 반복(LRR) 모티프를 사용하여 리간드와 상호작용한다. NOD2와 같은 분자 중 일부는 NF-κB 신호전달을 활성화하는 RIP2 키네이스와 상호작용하는 반면, NALP3와 같은 다른 분자는 염증성 캐스페이스와 상호작용하고 인터루킨-1β와 같은 특정 사이토카인의 처리를 시작한다.[127][83]
4. 2차 전달자
1차 전달자는 세포외액에서 세포로 도달하여 특정 수용체에 결합하는 신호 분자(호르몬, 신경전달물질 및 주변분비물질/자가분비물질)이다. 2차 전달자는 세포질로 들어가 세포 내에서 작용하여 반응을 유발하는 물질이다. 2차 전달자는 원형질막으로부터 세포질로의 화학적 중계 역할을 하여 세포 내 신호전달을 수행한다.[25]
진핵생물 세포에서 리간드/수용체 상호 작용에 의해 활성화된 대부분의 세포 내 단백질은 효소 활성을 갖는다. 티로신 인산화 효소와 포스파타아제 등이 이에 해당한다. 이 효소들 중 일부는 세컨드 메신저인 사이클릭 AMP 및 IP3를 생성하며, IP3는 세포질 내 칼슘 저장소의 방출을 제어한다. 활성화된 다른 단백질은 신호 전달 어댑터 단백질과 상호 작용하며, 효소와 어댑터 단백질은 모두 다양한 세컨드 메신저 분자에 반응한다.
신호 전달 과정에서 활성화되는 많은 어댑터 단백질과 효소는 특정 세컨드 메신저 분자에 결합하는 특수 단백질 도메인을 가지고 있다. 예를 들어, 칼슘 이온은 EF 핸드 도메인에 결합하여 칼모듈린을 활성화한다. PIP3 및 기타 포스파티딜이노시톨은 AKT와 같은 단백질의 플렉스트린 상동성 도메인에 작용한다.
세포막 상의 수용체가 받은 신호는 세컨드 메신저를 사용한 정교한 신호 전달 시스템으로 전달된다. 세컨드 메신저에는 cGMP, cAMP, 칼슘 이온 등의 작은 분자도 있지만, 대부분은 단백질이다.
신호 전달 단계별 주요 요소는 다음과 같다.
- 세컨드 메신저: cAMP, cGMP, 칼슘, 이노시톨 삼인산, 다이아실글리세롤 등의 저분자 화합물. 이들은 특정 단백질에 결합하여 활성을 변화시켜 신호를 전달한다.
- 세컨드 메신저 합성 효소: cAMP를 합성하는 아데닐산 시클라제(아데닐레이트 사이클레이스)나 포스포리파제(포스포라이페이스) 등, 그리고 칼슘 이온을 세포질로 투과시키는 이온 채널.
4. 1. 칼슘
소포체로부터 세포질로 칼슘 이온이 방출되면 칼슘이 신호전달 단백질에 결합하여 신호전달 단백질을 활성화시킨다.[128] 그런 다음 칼슘 이온은 매끈면 소포체와 미토콘드리아에 격리된다.[128] 칼슘의 운반은 두 가지 결합된 수용체/이온 통로 단백질이 조절한다.[128] 하나는 세포질 쪽에서 이노시톨 삼중인산과 상호작용하여 칼슘을 운반하는 이노시톨 삼중인산 수용체(IP3 수용체)이다.[128] 다른 하나는 알칼로이드인 리아노딘에서 이름을 딴 리아노딘 수용체로 이는 이노시톨 삼중인산 수용체(IP3 수용체)와 유사하지만 결합 시 더 많은 칼슘을 방출하는 피드백 메커니즘을 가지고 있다.[128] 세포질 내 칼슘의 특성은 매우 짧은 시간 동안만 수용체를 활성화시킨다는 것을 의미한다.[128] 즉, 유리 상태의 칼슘의 농도가 매우 낮은 비활성 상태에서는 칼슘이 대부분 칼레티쿨린과 같은 세포소기관 분자에 결합되어 있음을 의미한다.[128]칼슘은 근육 수축, 신경 말단으로부터 신경전달물질의 방출, 세포 이동 등 다양한 과정에 사용된다.[128] 칼슘 활성화로 이어지는 세 가지 주요 경로는 G 단백질 연결 수용체(GPCR) 경로, 수용체 티로신 키네이스(RTK) 경로, 개폐 이온 통로이다.[128] 칼슘은 직접적으로 또는 효소에 결합하여 단백질을 조절한다.[128]
4. 2. 지질 전달자
친유성 2차 전달자 분자는 세포막에 존재하는 지질로부터 유래된다. 활성화된 수용체에 의해 자극된 효소는 지질을 변형하여 활성화한다. 다이아실글리세롤과 세라마이드가 그 예시이며, 다이아실글리세롤은 단백질 키나아제 C 활성화에 필요하다.4. 3. 산화 질소
산화 질소 생성효소에 의해 아르기닌과 산소로부터 생성되는 산화 질소(NO)는 자유 라디칼이기 때문에 원형질막을 통해 확산되어 인근 세포에 영향을 미칠 수 있는 2차 전달자 역할을 한다. 산화 질소는 활성화되면 또 다른 2차 전달자인 cGMP를 생성하는 수용성 구아닐산 고리화효소의 활성화를 통해 작용한다. 산화 질소는 단백질이나 금속 보조 인자의 공유결합성 변형을 통해 작용할 수 있으며, 일부는 산화환원 메커니즘을 가지고 있으며 가역적이다. 산화 질소는 고농도에서 독성이 있으며 뇌졸중 중에 손상을 일으키지만 혈관 이완, 세포사멸, 음경 발기와 같은 다른 많은 기능을 수행하기도 한다.4. 4. 산화환원 신호전달
산화 질소 외에도 초과산화물, 과산화 수소, 일산화 탄소, 황화 수소와 같이 전자가 활성화된 다른 화학 종들은 산화 환원 신호 전달 과정에서 신호전달 물질로 작용한다. 산화환원 신호전달에는 유기 반도체 생물학적 거대분자 내 전자의 흐름을 활발하게 조절하는 것도 포함된다.[129][47]5. 세포 반응
유전자 활성화[130] 및 대사 변화[131]는 세포외 자극에 대한 세포 반응의 예이다. 유전자 활성화는 반응 유전자의 산물이 활성화 촉진자를 포함하기 때문에 추가적인 세포 효과로 이어진다. 신호전달 단계의 결과로 생성된 전사인자는 훨씬 더 많은 유전자를 활성화시킬 수 있다. 따라서 초기 자극은 수많은 유전자 발현을 촉발할 수 있으며, 이는 혈류로부터 포도당의 흡수 증가[131] 및 호중구가 감염 부위로 이동하는 것과 같은 생리학적 사건으로 이어질 수 있다. 특정 자극에 대한 유전자 세트와 활성화 순서를 유전적 프로그램이라고 한다.[132]
포유류 세포는 세포 분열과 생존을 위해 자극을 필요로 한다. 성장인자가 없으면 세포사멸이 일어난다. 세포 외 자극에 대한 이러한 요구는 단세포 생물 및 다세포 생물의 세포 행동을 제어하는 데 필요하다. 신호전달 경로는 생물학적 과정의 핵심이기 때문에 많은 질병들이 조절 장애에 기인한다고 인식된다.
세포 생장을 결정하는 세 가지 기본적인 신호는 다음과 같다.
- 자극성 (성장인자)
- 전사 의존적 반응: 예를 들어, 스테로이드는 전사인자로 직접 작용한다. 전사 인자가 DNA에 결합해야 하므로 반응이 느리다. 생성된 mRNA는 번역되어야 하며, 생성된 단백질/펩타이드는 번역 후 변형을 거칠 수 있다.
- 전사 비의존적 반응: 예를 들어, 상피 성장인자(EGF)는 상피 성장인자 수용체(EGFR)에 결합하여 EGFR의 이량체화 및 자가인산화를 유발하고, 이는 차례로 세포내 신호전달 경로를 활성화한다.[133]
- 억제성 (세포-세포 접촉)
- 허용성 (세포-기질 상호작용)
이러한 신호의 조합은 변경된 세포질 기구에 통합되어 세포 행동 변화를 유발한다.
6. 주요 경로
다음은 수용체에 결합하는 리간드가 어떻게 2차 전달자에 영향을 미치고 결국 세포 반응이 변경될 수 있는지를 보여주는 몇 가지 주요 신호전달 경로이다.
- MAPK/ERK 경로: 성장인자가 세포 표면 수용체에 결합하는 것과 세포내 반응을 연결하는 경로이다. 이 경로는 매우 복잡하며 많은 단백질 구성 요소를 포함한다.[134] 많은 세포 유형에서 이 경로의 활성화는 세포 분열을 촉진하며, 많은 형태의 암이 이 경로의 이상과 관련되어 있다.[135]
- cAMP 의존성 경로: 사람에서 cAMP는 단백질 키네이스 A (PKA, cAMP 의존성 단백질 키네이스)를 활성화함으로써 작동하며, 따라서 추가적인 효과는 주로 세포 유형에 따라 달라지는 cAMP 의존성 단백질 키네이스에 따라 달라진다.
- IP3/DAG 경로: 인지질가수분해효소 C (PLC)는 인지질인 포스파티딜이노시톨 4,5-이중인산 (PIP2)를 절단하여 다이아실글리세롤 (DAG)과 이노시톨 1,4,5-삼중인산 (IP3)을 생성한다. 다이아실글리세롤은 막에 결합된 상태로 유지되고, 이노시톨 1,4,5-삼중인산은 용해성 구조로 세포질로 방출된다. 그런 다음 이노시톨 1,4,5-삼중인산 (IP3)은 세포질을 통해 확산되어 IP3 수용체, 특히 소포체의 칼슘 통로에 결합한다. 이 통로는 칼슘에만 국한되며 칼슘만 통과할 수 있도록 한다. 이로 인해 세포질의 칼슘 농도가 증가하여 세포 내 변화와 활성이 연쇄적으로 발생한다.[136] 또한 칼슘과 다이아실글리세롤은 함께 단백질 키네이스 C (PKC)를 활성화하여 다른 분자를 인산화시켜 세포 활성을 변화시킨다. 최종 효과에는 미각, 조울증, 종양 촉진 등이 포함된다.[136]
7. 역사
클로드 베르나르는 1855년에 지라, 갑상샘, 부신과 같은 관이 없는 샘이 생리학적 효과를 갖는 "내부 분비물"을 방출한다고 제안했는데, 이것이 신호전달에 대한 최초의 개념이다.[137] 1905년에 어니스트 스탈링은 베르나르의 "분비물"을 "호르몬"으로 명명했다.[138] 스탈링은 윌리엄 베일리스와 함께 1902년에 세크레틴을 발견했다.[137] 이후 인슐린과 같은 많은 다른 호르몬들이 발견되었지만, 그 메커니즘은 거의 알려지지 않았다.
1954년 리타 레비몬탈치니가 신경 성장인자를 발견하고, 1962년 스탠리 코헨이 상피 성장인자를 발견하면서 세포 신호전달, 특히 성장인자의 분자적 기초에 대한 보다 자세한 통찰력을 얻게 되었다.[139] 1956년 얼 윌버 서덜랜드의 cAMP 발견은 내분비 신호전달의 재정의를 촉발하여, 자가분비 및 주변분비라는 용어가 사용되기 시작했다.[140] 서덜랜드는 1971년에 노벨 생리학·의학상을 수상했고, 레비몬탈치니와 코헨은 1986년에 노벨 생리학·의학상을 공동 수상했다.
1970년에 마틴 로드벨은 쥐의 간세포 막 수용체에 대한 글루카곤의 영향을 조사했고, 구아노신 삼인산(GTP)이 이 수용체로부터 글루카곤을 분리하고 G 단백질을 자극하여 세포의 물질대사에 큰 영향을 미친다는 것을 발견했다. 그는 G 단백질이 글루카곤 분자를 받아들이고 세포에 영향을 미치는 변환기라고 추론했다.[141] 로드벨은 1994년에 알프레드 G. 길먼과 함께 노벨 생리학·의학상을 공동 수상했다. 수용체 티로신 키네이스(RTK)와 G 단백질 연결 수용체(GPCR)의 특성화는 "신호전달(signal transduction)"이라는 개념의 공식화로 이어졌다.[142] 1972년에 처음 사용된 이 용어는[142] 1979년 한 논문의 제목에 처음 등장했고,[145][146] 로드벨의 1980년 리뷰 논문에서 광범위하게 사용되기 시작했다.[141][147] 신호전달에 초점을 맞춘 연구 논문은 1980년대 후반과 1990년대 초반에 많이 등장했다.[148]
7. 1. 면역학에서의 신호전달
면역학에서 신호 전달은 다발성 골수종 환자의 소변에서 발견되는 골수종 단백질 경쇄 서열 분석으로 시작되었다. 이 벤스 존스 단백질은 두 개의 도메인으로 구성되는데, 분자마다 변하는 V 도메인과 변하지 않는 Fc 도메인(단편 결정화 가능 영역)이다.[149] 우(Wu)와 카벳(Kabat)은 V 영역 내 초가변성 위치를 확인했고, 이것이 항원 인식 부위를 형성한다고 가정했다.[150] 면역글로불린 G(IgG) 분자 결정화는[151] 이러한 추론을 확인했다.B 세포는 항원을 만나면 세포가 분비하는 항체와 동일한 항원 결합 부위를 갖는 표면 면역글로불린 수용체를 가진다는 클론 선택 이론으로 요약된다.[152] 유동 모자이크 모델은 수용체 이량체화라는 신호전달 모델을 제시했다.
베커(Becker) 등은[153] 사람 호염기구가 항 IgE 항체 농도에 따라 탈과립 정도가 달라지며, 표면 분자 재분포를 초래한다는 것을 입증했다. 이는 팽거(Fanger) 등의 연구 결과와 일치한다.[154] 수용체 이합체화가 B 세포 등 다양한 세포 유형에서 반응을 시작한다는 증거가 나타났다.[155]
벨(Bell)은[156] 클러스터링은 안정적 네트워크를 형성하지만, B 세포 항체 친화성은 면역 반응이 진행됨에 따라 증가한다는 모순을 해결하는 모델을 제시했다. 델리시(DeLisi)와 페렐슨(Perelson)은[157] 클러스터 크기 분포, 리간드 친화도 및 원자가 의존성을 발견했다. 골트슈타인(Goldstein)과 소보트카(Sobotka) 등은[158][159] 면역 세포 용량-반응 패턴과 생물학적 상관관계를 분석했다.[160] 면역 시스템 클러스터링에 대한 최근 리뷰가 있다.[161]
8. 시그널 전달 시스템의 각 단계 (일본어 문서 기반)
신호 전달의 기본적인 흐름은 세포막과 세포질 내의 인자들이 순차적으로 신호를 주고받으며, 다른 경로와도 상호작용(크로스토크)하는 것이다. 최종적으로는 핵 내의 전사 인자가 특정 유전자의 전사를 조절하거나, 세포자멸사를 통해 세포를 죽게 하는 등의 효과를 낸다.[1]
이러한 흐름은 세포 간에 일어나는 것과 세포 내에서 일어나는 것으로 나눌 수 있다. 세포막에 있는 수용체는 세포 외부의 신호를 세포 내부의 신호로 바꾸는 역할을 한다. 호르몬과 같은 세포 외부 신호는 '''신호 분자'''라고 불리며, 세포 내부 신호 분자는 '''세컨드 메신저'''라고 불린다. 스테로이드 호르몬과 같이 세포막을 통과할 수 있는 신호 분자는 세포 내 신호 분자로 직접 작용하여 세포질 내 수용체와 결합하고, 전사를 조절하기도 한다. 이러한 반응은 1밀리초 정도의 짧은 시간에 일어난다.[1]
대부분의 경우, 초기 자극에서 과정이 진행됨에 따라 관련된 효소나 분자의 수가 증가한다. 이러한 반응의 연쇄를 '''생화학적 캐스케이드'''라고 부르며, 약한 자극으로도 큰 반응을 유도할 수 있다(증폭 작용). 효율에 따라서는 단 하나의 자극만으로도 수백만 개의 신호 분자를 반응시킬 수 있다. 이러한 반응의 결과는 생명체에게 무시할 수 있는 수준부터 질병을 일으키는 수준까지 다양하게 나타날 수 있다.[1]
8. 1. 세포 간 시그널 전달
세포 간 신호 전달 방법은 대략 4가지로 분류된다.- '''내분비형'''
: 신호를 가장 넓게 전달하는 방법으로, 신호 분자를 혈류(식물의 경우 도관액 또는 사관액)에 방출하여 전신에 전달한다. 이때의 신호 분자를 호르몬이라고 한다.
- '''방출 분비형'''
: '파라크린형'이라고도 한다. 내분비형보다 좁은 범위의 신호 전달에 사용되며, 이때의 신호 분자는 혈류가 아닌 세포 외액으로 확산되기 때문에 분비된 세포 주변에만 머물러 인접 세포의 국소 중개 물질로 기능한다.
:: 신경형 신호 전달
::: 시냅스에서 이루어지는 신호 전달 자체는 방출 분비형이지만, 전기 신호가 개입하기 때문에 신호 분자만으로 이루어지는 신호 전달보다 장거리를 고속으로 전달할 수 있다. 이 경우의 신호 분자를 신경 전달 물질이라고 한다.
- '''자기 분비형'''
: '자가 분비형'이라고도 한다. 기본적으로 방출 분비형과 유사하지만, 이 경우 신호를 받는 것은 분비한 세포 자신이다.
- '''접촉형'''
: 가장 직접적인 단거리 신호 전달로, 분비성 분자는 방출되지 않고 신호 세포의 세포막에 결합된 신호 분자가 표적 세포의 세포막에 결합된 수용체 분자에 결합하여 정보를 전달한다.
8. 2. 세포 간 시그널 전달에서 세포 내 시그널 전달로의 변환
신호 전달에서 가장 중요한 것은 정보의 변환 과정이다. 체내에서는 정보 발신 세포에서 발신된 신호 분자 중 세포 내로 침투하지 않는 신호 분자는 표적 세포가 가진 '''수용체 단백질'''과 결합하여 새로운 자극으로 변환되며, 이것이 세포 내 신호가 되어 세포 내의 유전자 발현이나 효소 활성의 변화 등 다양한 응답을 반환한다. 이때의 세포 외 신호 분자는 수용체 단백질과 특이적으로 결합하므로 리간드로서 작용하고 있는 셈이다.세포 외 신호 분자는 크게 두 가지로 분류할 수 있다.
- 소수성이 높은 것: 쉽게 세포막을 투과할 수 있으므로, 직접 내부로 들어가 세포 내 효소를 활성화 또는 불활성화하거나, 유전자 발현을 조절하는 세포 내 수용체 (핵 내 수용체라고도 함) 단백질과 결합한다. 스테로이드 호르몬이나 갑상선 호르몬 등이 이에 해당한다. 세포 내 수용체의 유전자 (NR 유전자)는 동물계에서만 인정된다. 이들은 특이적으로 결합하므로, 리간드로서 기능하고 있다. 이들 호르몬의 세포 내 수용체는 호르몬과의 결합에 의해 활성화되어 핵 내로 이동하여 직접 표적 유전자의 전사를 조절한다.
- 친수성인 것: 신호 분자가 세포막을 투과할 수 없으므로, 신호 전달은 표적 세포의 세포막상에 있는 수용체에 의존한다. 수용체 단백질은 신호 분자의 수용에 의해 활성화되어 새로운 세포 내 신호를 생성한다. 세포 내 신호는 일련의 반응을 유발하며, 그 최종적인 결과가 세포의 응답이 된다.
8. 3. 세포 내 시그널 전달
세포막 상의 수용체는 다음 세 종류로 크게 분류된다. 이러한 차이점은 세포 외 신호 분자가 결합했을 때 발생하는 세포 내 신호에 있다.- '''이온 채널 연결형 수용체''': 막을 가로질러 이온의 흐름이 일어나 막 안팎의 전위차에 변화가 생겨 전류를 생성한다.
- '''G 단백질 연결 수용체''': G 단백질을 활성화하여 해당 서브 유닛을 방출하고, 이를 통해 세포막 안의 표적이 되는 효소나 이온 채널에 작용한다.
- '''효소 연결형 수용체''': 신호 분자와의 결합으로 활성화되어 효소로 작용하거나 세포 내 효소와 공동 작업을 수행한다.
세포막 상의 수용체가 받은 신호는 세포 내 신호 분자인 세컨드 메신저를 사용한 정교한 신호 전달 시스템으로 전달된다. 이 전달 시스템(세포 내 신호 전달 시스템)에는 다음과 같은 중요한 기능이 있다.
# 신호를 변형 또는 변환하여 신호 전달에 적합한, 응답을 이끌어낼 수 있는 형태의 분자로 만든다.
# 신호를 수신한 곳에서 응답이 발생하는 곳까지 신호를 전달한다.
# 종종 신호를 증폭하여 큰 응답을 일으킨다.
# 신호를 배분하여 여러 반응계에 동시에 영향을 미친다.
# 신호의 효과를 세포 안팎의 조건에 맞춰 조절할 수 있다.
이 세컨드 메신저에는 cGMP, cAMP, 칼슘 이온 등의 작은 분자도 있지만, 그 대부분은 단백질이다. 이러한 단백질의 대부분은 분자 스위치로 기능한다. 즉, 신호를 받으면 활성화되어 신호 전달 경로의 다른 단백질을 자극한다. 스위치 단백질의 상당 부분은 인산화에 의해 활성이 전환된다.
세포 내 수용체는 3가지 계통으로 분류된다.
- 리간드와 결합한 수용체가 호모 이량체를 형성하여 표적 유전자와 결합하는 것: 스테로이드 호르몬 수용체
- 리간드와 결합한 수용체가 헤테로 이량체를 형성하여 표적 유전자와 결합하는 것
- * Thyroid hormone receptor|갑상선 호르몬 수용체영어(TR)
- * 레티노산 수용체 (RAR)
- * Vitamin D receptor|비타민 D 수용체영어(VDR)
- * Retinoid X receptor|레티노이드 X 수용체영어(RXR)
- 내인성 리간드가 불분명한 것: 오르판 수용체
9. 시그널 전달 경로의 요소와 양식 (일본어 문서 기반)
신호 전달의 각 단계를 담당하는 요소(분자)는 다양하지만, 대략 다음과 같이 분류할 수 있다.
- 세컨드 메신저: cAMP, cGMP, 칼슘, 이노시톨 삼인산, 다이아실글리세롤 등의 저분자 화합물. 각각 특이적인 단백질에 결합하여 그 활성을 변화시킴으로써 신호를 전달한다.
- 세컨드 메신저를 합성하는 효소 (cAMP를 합성하는 아데닐산 시클라제나 포스포리파제 등) 및 칼슘 이온을 세포질로 투과시키는 이온 채널.
- 단백질 인산화 효소 (프로테인 키나아제): 특정 단백질을 인산화하여 그 활성을 변화시킴으로써 신호를 전달한다. 인산화하는 위치에 따라 티로신 키나아제나 세린 키나아제/트레오닌 키나아제 등으로 나뉘지만, 기질 특이성은 매우 다양하다. 경로상의 위치도 세포막 상의 수용체 그 자체부터, 경로의 중간, 전사 인자를 활성화하는 것 등이 있다. 세포 증식 인자나 인슐린의 수용체 자체 또는 수용체와 결합하는 이펙터 단백질 (티로신 키나아제), 당 대사 등의 조절에 관련된 A 키나아제 (cAMP에 의해 활성화됨), 다양한 경로에 관여하는 C 키나아제 (칼슘 이온과 다이아실글리세롤에 의해 활성화됨) 및 세포 증식 제어에 관련된 MAP 키나아제 캐스케이드 등이 잘 알려져 있다.
- 단백질 탈인산화 효소 (프로테인 포스파타아제): 키나아제와 반대로, 인산 제거 반응을 수행한다.
- G 단백질: GTP와 그 가수 분해 산물 GDP를 결합한 상태에서 각각 온/오프 상태로 작동하는 분자 스위치. G 단백질 연결 수용체 (GPCR)에 결합하여 작용하는 G 단백질과 암 유전자 ''ras''의 산물 (Ras 단백질)에 대표되는 저분자형 GTP 결합 단백질로 나뉜다. 아데닐산 시클라제와 프로테인 키나아제에 신호를 전달한다.
- 단백질 간의 특이적 결합: 일부 사이토카인의 수용체는 수용체끼리, 또는 하류의 단백질 (이펙터)과 결합하여 복합체를 만듦으로써 활성을 변화시켜 신호를 전달한다.
- 카스파제: 프로테아제의 일종으로, 아폽토시스를 제어하는 신호 전달 시스템에서 캐스케이드를 구성하며, 하류의 단백질을 절단함으로써 활성화된다.
10. 시그널 전달 경로의 도시 (일본어 문서 기반)
신호 전달 경로(경로) 또는 이들로 구성된 네트워크는 대사 지도와 유사한 유향 그래프로 도식화된다. 노드는 신호 전달에 관여하는 분자를, 엣지는 이들 간의 반응, 즉 개별적인 신호를 나타낸다.
참조
[1]
서적
Handbook of Cell Signaling
Academic Press
2010
[2]
논문
Reconstruction of cellular signalling networks and analysis of their properties
2005-02
[3]
서적
Biochemistry of Signal Transduction and Regulation
https://archive.org/[...]
Wiley-VCH
2008
[4]
서적
Biology
https://archive.org/[...]
Benjamin Cummings
[5]
논문
The dynamic control of signal transduction networks in cancer cells
2015-09
[6]
논문
The hVps34-SGK3 pathway alleviates sustained PI3K/Akt inhibition by stimulating mTORC1 and tumour growth
[7]
논문
Different telomere damage signaling pathways in human and mouse cells
2002-08
[8]
논문
Mosaic and regulative development: two faces of one coin
2006-04
[9]
논문
Transcriptional regulation by steroid hormones
1996-04
[10]
논문
The further redefining of steroid-mediated signaling
2003-03
[11]
논문
G proteins and olfactory signal transduction
[12]
논문
Dopamine receptors: from structure to function
1998-01
[13]
논문
Opioid peptides endorphins in pituitary and brain
1976-09
[14]
논문
Comprehensive molecular portraits of human breast tumours
2012-10
[15]
논문
Role of YAP/TAZ in mechanotransduction
2011-06
[16]
논문
Cellular mechanotransduction: putting all the pieces together again
2006-05
[17]
논문
A possible unifying principle for mechanosensation
2005-08
[18]
논문
Osmosensory mechanisms in cellular and systemic volume regulation
2011-09
[19]
논문
How does the brain sense osmolality?
2007-12
[20]
논문
Osmotic stress signaling and osmoadaptation in yeasts
2002-06
[21]
논문
Sensing temperature
2013-04
[22]
논문
RNA-mediated response to heat shock in mammalian cells
2006-03
[23]
논문
Beyond counting photons: trials and trends in vertebrate visual transduction
2005-11
[24]
논문
Phototransduction in ganglion-cell photoreceptors
2007-08
[25]
웹사이트
A molecular model for receptor activation
http://www.bio-balan[...]
[26]
논문
The repertoire of G-protein-coupled receptors in fully sequenced genomes
2005-05
[27]
논문
Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers
2011-08
[28]
서적
Biochemistry
https://archive.org/[...]
W.H. Freeman
[29]
논문
Mechanisms of regulation and function of G-protein-coupled receptor kinases
[30]
논문
Point mutation causing constitutive signaling of CXCR2 leads to transforming activity similar to Kaposi's sarcoma herpesvirus-G protein-coupled receptor
1999-08
[31]
논문
Role of receptor tyrosine kinase transmembrane domains in cell signaling and human pathologies
2006-05
[32]
논문
Signal transduction by allosteric receptor oligomerization
1988-11
[33]
논문
The protein kinase complement of the human genome
2002-12
[34]
논문
Day of the dead: pseudokinases and pseudophosphatases in physiology and disease
2014-09
[35]
논문
The ErbB/HER receptor protein-tyrosine kinases and cancer
2004-06
[36]
논문
Histidine protein kinases: key signal transducers outside the animal kingdom
2002-09
[37]
논문
Signalling via integrins: implications for cell survival and anticancer strategies
2007-01
[38]
논문
Integrin signaling in epithelial cells
2007-03
[39]
논문
Arabidopsis NDR1 is an integrin-like protein with a role in fluid loss and plasma membrane-cell wall adhesion
2011-05
[40]
논문
The Raf-like Kinase ILK1 and the High Affinity K+ Transporter HAK5 Are Required for Innate Immunity and Abiotic Stress Response
2016-06
[41]
논문
Differential binding of calmodulin-related proteins to their targets revealed through high-density Arabidopsis protein microarrays
2007-03
[42]
논문
Role of adaptor TRIF in the MyD88-independent toll-like receptor signaling pathway
2003-08
[43]
논문
TRAM is specifically involved in the Toll-like receptor 4-mediated MyD88-independent signaling pathway
2003-11
[44]
논문
Essential role for TIRAP in activation of the signalling cascade shared by TLR2 and TLR4
2002-11
[45]
논문
Innate recognition of intracellular bacteria
2007-02
[46]
논문
Steatosis inhibits liver cell store-operated Ca²⁺ entry and reduces ER Ca²⁺ through a protein kinase C-dependent mechanism
2015-03
[47]
논문
Signal transduction and reactive species
2009-11
[48]
논문
Signal transduction and gene regulation: the nuclear response to cAMP
1994-07
[49]
논문
After insulin binds
1987-09
[50]
논문
The logic of TGFbeta signaling
2006-05
[51]
논문
Single-molecule imaging of EGFR signalling on the surface of living cells
2000-03
[52]
논문
Computational modelling of the receptor-tyrosine-kinase-activated MAPK pathway
2005-12
[53]
논문
Cancer genes and the pathways they control
2004-08
[54]
서적
Molecular biology of the cell
https://archive.org/[...]
Garland Science
[55]
문서
Bradshaw & Dennis (2010) p. 1.
[56]
논문
One hundred years of hormones
2005-06
[57]
논문
Viktor Hamburger and Rita Levi-Montalcini: the path to the discovery of nerve growth factor
2001-03
[58]
문서
Bradshaw & Dennis (2010) p. 2.
[59]
논문
The role of hormone receptors and GTP-regulatory proteins in membrane transduction
1980-03
[60]
논문
Periodic geophysical and biological signals as Zeitgeber and exogenous inducers in animal organisms
[61]
논문
Davis-1961 revisited. Signal transmission in the cochlear hair cell-nerve junction
1975-09
[62]
논문
The effect of N-acylglucosamines on the biosynthesis and secretion of insulin in the rat
1976-03
[63]
논문
What does Halobacterium tell us about photoreception?
1977-04
[64]
논문
Lipid synthesis: an indicator of antigen-induced signal transduction in antigen-binding cells
1979-04
[65]
서적
Signal transduction
Academic Press
[66]
서적
Human Physiology
McGraw-Hill
[67]
간행물
Immunoglobulin evolution, 30 years on.
[68]
간행물
An analysis of the sequences of the variable regions of Bence Jones proteins and myeloma light chains and their implications for antibody complementarity.
[69]
간행물
The three-dimensional structure at 6 A resolution of a human gamma G1 immunoglobulin molecule
[70]
간행물
A modification of Jerne's theory of antibody production using the concept of clonal selection.
[71]
논문
Surface IgE on Human Basophils during histamine release
1973
[72]
논문
Requirement for cross-linkage in the stimulation of transformation of rabbit peripheral lymphocytes by antiglobulin reagents
1970
[73]
논문
Dimerization as a regulatory mechanism in signal transduction
1998
[74]
논문
Model for the binding of multivalent antigens to cells
1974
[75]
논문
The kinetics of aggregation phenomena
1976
[76]
논문
Theory of equilibrium binding of symmetric bivalent haptens to cell surface antibody: application to histamine release from basophils
1978
[77]
논문
Antigen-specific desensitization of human basophils
1979
[78]
논문
Qualitative characteristics of histamine release from human basophils by covalently cross-linked IgE
1981
[79]
논문
How does T cell receptor clustering impact signal transduction?
2019-02-11
[80]
논문
The gradient-sensing mechanism in bacterial chemotaxis
1972
[81]
논문
Physics of chemoreception
1977
[82]
논문
Bacterial transmembrane signaling systems and their engineering for biosensing
2018-04
[83]
서적
Handbook of Cell Signaling
Academic Press
2010
[84]
저널
Reconstruction of cellular signalling networks and analysis of their properties
2005-02
[85]
서적
Biochemistry of Signal Transduction and Regulation
https://archive.org/[...]
Wiley-VCH
2008
[86]
서적
Biology
https://archive.org/[...]
Benjamin Cummings
[87]
저널
The dynamic control of signal transduction networks in cancer cells
2015-09
[88]
논문
The hVps34-SGK3 pathway alleviates sustained PI3K/Akt inhibition by stimulating mTORC1 and tumour growth
2016
[89]
저널
Different telomere damage signaling pathways in human and mouse cells
2002-08
[90]
저널
Mosaic and regulative development: two faces of one coin
2006-04
[91]
저널
Transcriptional regulation by steroid hormones
1996-04
[92]
저널
The further redefining of steroid-mediated signaling
2003-03
[93]
저널
Dopamine receptors: from structure to function
1998-01
[94]
저널
Opioid peptides endorphins in pituitary and brain
1976-09
[95]
저널
G proteins and olfactory signal transduction
[96]
저널
Comprehensive molecular portraits of human breast tumours
2012-10
[97]
저널
Role of YAP/TAZ in mechanotransduction
2011-06
[98]
저널
Cellular mechanotransduction: putting all the pieces together again
2006-05
[99]
저널
A possible unifying principle for mechanosensation
2005-08
[100]
저널
Osmosensory mechanisms in cellular and systemic volume regulation
2011-09
[101]
저널
How does the brain sense osmolality?
2007-12
[102]
저널
Osmotic stress signaling and osmoadaptation in yeasts
2002-06
[103]
저널
Sensing temperature
2013-04
[104]
저널
RNA-mediated response to heat shock in mammalian cells
2006-03
[105]
저널
Beyond counting photons: trials and trends in vertebrate visual transduction
2005-11
[106]
논문
Phototransduction in ganglion-cell photoreceptors
2007-08
[107]
웹인용
A molecular model for receptor activation
http://www.bio-balan[...]
[108]
논문
The repertoire of G-protein-coupled receptors in fully sequenced genomes
2005-05
[109]
논문
Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers
2011-08
[110]
서적
Biochemistry
https://archive.org/[...]
W.H. Freeman
[111]
논문
Mechanisms of regulation and function of G-protein-coupled receptor kinases
[112]
논문
Point mutation causing constitutive signaling of CXCR2 leads to transforming activity similar to Kaposi's sarcoma herpesvirus-G protein-coupled receptor
1999-08
[113]
논문
Role of receptor tyrosine kinase transmembrane domains in cell signaling and human pathologies
2006-05
[114]
논문
Signal transduction by allosteric receptor oligomerization
1988-11
[115]
논문
The protein kinase complement of the human genome
2002-12
[116]
논문
Day of the dead: pseudokinases and pseudophosphatases in physiology and disease
2014-09
[117]
논문
The ErbB/HER receptor protein-tyrosine kinases and cancer
2004-06
[118]
논문
Histidine protein kinases: key signal transducers outside the animal kingdom
2002-09
[119]
논문
Signalling via integrins: implications for cell survival and anticancer strategies
2007-01
[120]
논문
Integrin signaling in epithelial cells
2007-03
[121]
논문
Arabidopsis NDR1 is an integrin-like protein with a role in fluid loss and plasma membrane-cell wall adhesion
2011-05
[122]
논문
The Raf-like Kinase ILK1 and the High Affinity K+ Transporter HAK5 Are Required for Innate Immunity and Abiotic Stress Response
2016-06
[123]
논문
Differential binding of calmodulin-related proteins to their targets revealed through high-density Arabidopsis protein microarrays
2007-03
[124]
논문
Role of adaptor TRIF in the MyD88-independent toll-like receptor signaling pathway
2003-08
[125]
논문
TRAM is specifically involved in the Toll-like receptor 4-mediated MyD88-independent signaling pathway
2003-11
[126]
논문
Essential role for TIRAP in activation of the signalling cascade shared by TLR2 and TLR4
2002-11
[127]
논문
Innate recognition of intracellular bacteria
2007-02
[128]
논문
Steatosis inhibits liver cell store-operated Ca²⁺ entry and reduces ER Ca²⁺ through a protein kinase C-dependent mechanism
2015-03
[129]
논문
Signal transduction and reactive species
2009-11
[130]
논문
Signal transduction and gene regulation: the nuclear response to cAMP
1994-07
[131]
논문
After insulin binds
1987-09
[132]
논문
The logic of TGFbeta signaling
2006-05
[133]
논문
Single-molecule imaging of EGFR signalling on the surface of living cells
2000-03
[134]
논문
Computational modelling of the receptor-tyrosine-kinase-activated MAPK pathway
2005-12
[135]
논문
Cancer genes and the pathways they control
2004-08
[136]
서적
Molecular biology of the cell
https://archive.org/[...]
Garland Science
[137]
문서
Bradshaw & Dennis (2010) p. 1.
[138]
논문
One hundred years of hormones
2005-06
[139]
논문
Viktor Hamburger and Rita Levi-Montalcini: the path to the discovery of nerve growth factor
2001-03
[140]
문서
Bradshaw & Dennis (2010) p. 2.
[141]
저널
The role of hormone receptors and GTP-regulatory proteins in membrane transduction
1980-03
[142]
저널
Periodic geophysical and biological signals as Zeitgeber and exogenous inducers in animal organisms
[143]
저널
Davis-1961 revisited. Signal transmission in the cochlear hair cell-nerve junction
1975-09
[144]
저널
The effect of N-acylglucosamines on the biosynthesis and secretion of insulin in the rat
1976-03
[145]
저널
What does Halobacterium tell us about photoreception?
1977-04
[146]
저널
Lipid synthesis: an indicator of antigen-induced signal transduction in antigen-binding cells
1979-04
[147]
서적
Signal transduction
https://archive.org/[...]
Academic Press
[148]
서적
Human Physiology
https://archive.org/[...]
McGraw-Hill
[149]
간행물
Immunoglobulin evolution, 30 years on
1996
[150]
간행물
An analysis of the sequences of the variable regions of Bence Jones proteins and myeloma light chains and their implications for antibody complementarity
1970
[151]
간행물
The three-dimensional structure at 6 A resolution of a human gamma G1 immunoglobulin molecule
1971
[152]
간행물
A modification of Jerne's theory of antibody production using the concept of clonal selection
1976
[153]
간행물
Surface IgE on Human Basophils during histamine release
1973
[154]
간행물
Requirement for cross-linkage in the stimulation of transformation of rabbit peripheral lymphocytes by antiglobulin reagents
1970
[155]
간행물
Dimerization as a regulatory mechanism in signal transduction 16: 569-592
1998
[156]
간행물
Model for the binding of multivalent antigens to cells
1974
[157]
간행물
The kinetics of aggregation phenomena
1976
[158]
간행물
Theory of equilibrium binding of symmetric bivalent haptens to cell surface antibody: application to histamine release from basophils
1978
[159]
간행물
Antigen-specific desensitization of human basophils
1979
[160]
간행물
Qualitative characteristics of histamine release from human basophils by covalently cross-linked IgE
1981
[161]
저널
How does T cell receptor clustering impact signal transduction?
2019-02-11
[162]
저널
The gradient-sensing mechanism in bacterial chemotaxis
1972
[163]
저널
Physics of chemoreception
1977
[164]
저널
Bacterial transmembrane signaling systems and their engineering for biosensing
2018-04
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
