리보자임
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
리보자임은 효소 역할을 하는 RNA 분자 또는 RNA와 단백질로 구성된 복합체이다. 1980년대 토머스 체흐와 시드니 올트먼은 RNA가 촉매 역할을 할 수 있음을 발견하여 1989년 노벨 화학상을 공동 수상했다. 리보자임은 자기 절단, 다른 RNA나 DNA 분자 절단, 펩타이드 결합 형성 등 다양한 기능을 수행하며, 세포 내 단백질 합성, 유전자 발현 조절, 그리고 RNA 세계 가설과 같은 생명 기원 연구에 중요한 역할을 한다. 리보자임 공학을 통해 질병 치료, 유전자 치료 등 다양한 분야에 응용하려는 연구가 진행되고 있다.
더 읽어볼만한 페이지
- 리보자임 - 리보솜
리보솜은 rRNA와 단백질로 구성된 두 개의 소단위체로 이루어진 세포 내 단백질 합성 복합체로서, 세포질 내에서 mRNA의 코돈을 해독하여 폴리펩타이드 사슬을 합성하는 번역 과정을 수행하며, 원핵세포와 진핵세포의 구조적 차이로 인해 항생제 개발의 표적이 되고, RNA 세계에서 기원한 자기 복제 복합체로 추정된다. - 리보자임 - 리보솜 RNA
리보솜 RNA(rRNA)는 리보솜의 주요 구성 성분으로, 리보솜 단백질과 함께 리보솜의 대형 소단위(LSU)와 소형 소단위(SSU)를 구성하며, mRNA 번역의 촉매 역할을 담당하는 비암호화 RNA이다. - RNA 스플라이싱 - 엑손
엑손은 유전자 내 발현되는 영역으로, 단백질 코딩 유전자에서 단백질 코딩 서열과 비번역 영역을 포함하며, 선택적 스플라이싱을 통해 다양한 단백질 이성질체 생성에 기여하고 새로운 유전자 발견에 활용된다. - RNA 스플라이싱 - 인트론
진핵생물 유전자에서 엑손 사이에 존재하는 비코딩 DNA 서열인 인트론은 스플라이싱 과정을 거쳐 제거되며 유전자 발현 조절, 선택적 스플라이싱 등 다양한 기능에 관여하는 것으로 여겨진다. - RNA - RNA 간섭
RNA 간섭은 이중가닥 RNA에 의해 유전자 발현이 억제되는 과정으로, 다이서 효소에 의해 생성된 작은 간섭 RNA가 RNA 유도 침묵 복합체와 결합하여 표적 mRNA를 분해하거나 번역을 억제하며, 바이러스 방어, 발생 조절, 유전체 안정성 유지 등 다양한 기능과 응용 분야를 가진다. - RNA - 방향성 (분자생물학)
DNA 또는 RNA 가닥의 방향성은 5' 말단(5번 탄소에 인산기)과 3' 말단(3번 탄소에 수산기)로 구별되며, 이는 유전자 발현 조절, 폴리아데닐화, DNA 염기서열 분석 등 DNA와 RNA의 합성, 안정성, 번역 과정에 필수적이다.
2. 발견 과정
1981년 리보자임이 발견되기 이전에는, 화학반응을 촉매하는 효소는 모두 단백질이라는 것이 정설이었다. 1967년, 칼 우즈, 프랜시스 크릭, 레슬리 오겔은 RNA가 복잡한 2차 구조를 형성할 수 있다는 점에 착안하여 RNA가 효소로 기능할 수 있다는 가설을 처음 제안했다. 그러나 실제로 이러한 RNA 분자가 발견된 것은 1980년대에 이르러서였다.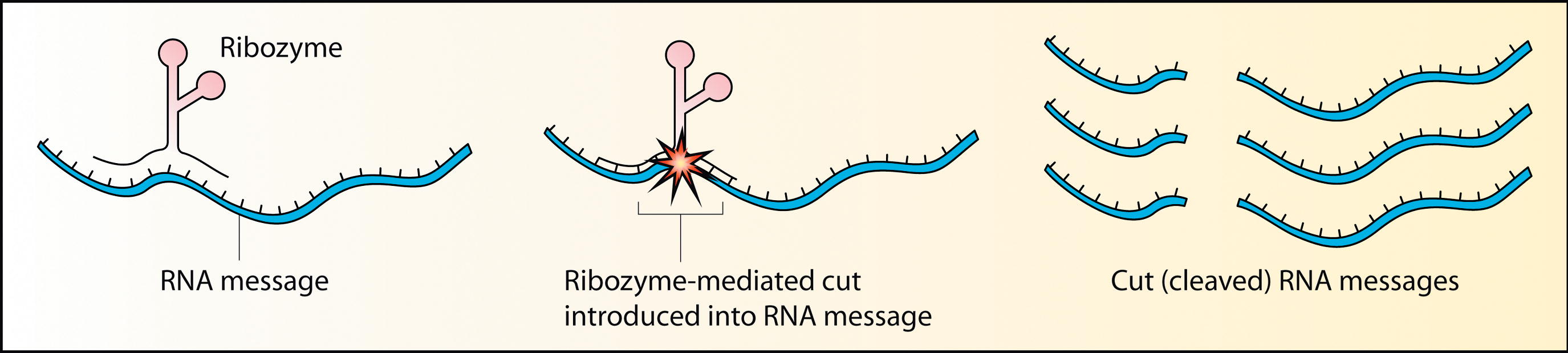
토머스 체크와 시드니 올트먼은 1980년대에 리보자임을 발견했다. 체크는 테트라히메나의 rRNA 유전자에서 인트론이 삭제되는 현상을 연구하던 중, RNA가 단백질 촉매 없이 스스로를 분해하고 이어 맞추는 자가이어맞추기(self-splicing)를 한다는 것을 발견했다. 올트먼은 리보핵산가수분해효소P(RNase-P)가 tRNA 전구체를 활성화된 tRNA로 변화시키는 과정에서 RNA 부위가 핵심적인 역할을 한다는 것을 발견했다.
2. 1. 토머스 체크의 발견
1980년대 초, 콜로라도 대학교 볼더의 토머스 체크는 테트라히메나라는 원생동물의 rRNA 유전자에서 인트론이 스스로 잘려나가는 현상(자가이어맞추기, self-splicing)을 발견했다.[5] RNA에서 필요 없는 부분은 잘리고 필요한 부분만 남기는 자가이어맞추기 반응에 대한 효소를 정제하려는 시도 중에, 그는 다른 어떤 추가된 세포 추출물 없이도 인트론이 이어붙여질 수 있음을 발견했다. 체크와 그의 동료들은 이어맞추기 반응과 관련된 어떤 단백질도 찾을 수가 없었다.[6] 많은 연구 끝에, 체크는 rRNA가 되기 전 물질인 rRNA 전구체에서 단백질 촉매의 도움 없이 인트론(비암호화서열)이 절단되고 나머지 엑손의 양단이 결합되는 것을 발견하였다. 즉 RNA는 단백질 촉매의 도움 없이 스스로를 분해하고 이어 맞춘 자가이어맞추기를 한 것이다. 이러한 자가이어맞추기를 하는 RNA를 자가이어맞춤 RNA 인트론이라 하였다. RNA가 스스로를 변형시킨다는 발견은 이전에 촉매는 단백질뿐이라는 정설을 뒤집는 새로운 발견이었다. 뿐만 아니라 rRNA에서 절단되어 나온 인트론은 후에 변형되어 ‘L-19IVS’라 불리는 RNA 분자로서 이것은 자기 자신이 아닌 다른 RNA 분자, DNA 분자, 그리고 다른 생체분자에서의 반응을 촉매하는 것으로 밝혀졌다. 즉, 자기 자신의 반응을 촉매하는 RNA 분자와 자신 외의 다른 물질의 반응을 촉매하는 RNA 분자가 모두 발견되었다.[7]2. 2. 시드니 올트먼의 발견
예일 대학교의 교수 시드니 올트먼은 동료들과 함께 리보핵산가수분해효소P(RNase-P)라는 효소를 연구했다. RNase-P는 tRNA 전구체를 활성화된 tRNA로 변화시키는 역할을 한다. 연구 결과, RNase-P가 단백질뿐만 아니라 RNA도 포함하고 있으며, RNA 부위가 활성화된 효소의 핵심적인 부분이라는 것을 발견했다.[5] 이는 당시의 정설과는 다른 연구 결과여서 발표에 어려움을 겪었다.이듬해, 올트먼은 분리된 성분을 이용한 연구에서 RNase-P RNA 소단위가 다른 단백질 구성 요소 없이 마그네슘 이온 존재 하에 RNA 단위체만으로 tRNA 전구체를 가수분해할 수 있음을 발견하여, RNA가 촉매로 기능할 수 있음을 증명했다.[6]
2. 3. 노벨상 수상
1989년, 토머스 R. 체흐와 시드니 올트먼은 "RNA의 촉매 특성 발견"으로 노벨 화학상을 공동 수상했다.[6] 토머스 체크는 ''Tetrahymena thermophila''의 리보솜 RNA 유전자에서 인트론의 절단을 연구하던 중, 세포 추출물을 추가하지 않아도 인트론이 잘려나갈 수 있다는 것을 발견했다. 시드니 올트먼은 RNase-P라는 효소를 연구하던 중, RNase-P가 단백질 외에 RNA를 포함하고 있으며 RNA가 활성 효소의 필수 구성 요소라는 사실을 발견했다. 이후 올트먼은 RNase-P RNA 소단위체가 단백질 성분 없이 전구체 tRNA를 활성 tRNA로 절단하는 것을 촉매할 수 있음을 보여주면서 RNA가 촉매로 작용할 수 있음을 증명했다.2. 4. 발견 이후의 동향
토머스 체크와 시드니 올트먼의 발견 이후, 다른 연구자들도 자가 절개 RNA나 촉매적 RNA 분자의 다른 예들을 발견하였다. 많은 리보자임은 헤어핀(Hairpin)이나 망치머리(Hammerhead) 모양의 활성 중심을 가지고 있고, 특정 서열에서 다른 RNA 분자를 절개하게 하는 독특한 이차적 구조를 가지고 있다. 현재 기술로 특정한 다른 RNA 분자를 절개하는 리보자임을 만드는 것이 가능하다. 이 RNA 촉매들은 약학적으로 응용될 수 있다. 예를 들면, 현재 HIV의 RNA를 절개하도록 설계된 리보자임이 존재한다.[6] 만약 세포가 이런 리보자임을 만드는 게 가능하다면, 리보자임은 감염을 방지할 수 있는 RNA 유전자를 절개하여 이것을 침투하는 바이러스에게 넣을 수 있을 것이다.3. 구조 및 메커니즘
리보자임은 단백질 효소와 마찬가지로 특정한 3차원 구조를 형성하여 촉매 활성을 나타낸다. 많은 경우 단백질에서 사용되는 메커니즘을 모방한다. 예를 들어, 자체 절단 리보자임 RNA에서 2'-OH (히드록실기)를 친핵체로 사용하여 브릿지 인산염을 공격하고 N+1 염기의 5' 산소가 이탈기로 작용하는 in-line SN2 반응이 수행된다.[54] 반면, 동일한 반응을 촉매하는 단백질인 췌장 리보뉴클레아제 A는 코디네이팅 히스티딘과 라이신을 사용하여 인산 골격을 공격하는 염기로 작용한다.[54]
금속 이온(주로 마그네슘 이온)은 촉매 반응에 중요한 역할을 하는 경우가 많다.[54] 많은 단백질 효소와 마찬가지로, 금속 결합 또한 많은 리보자임의 기능에 중요하다. 종종 이러한 상호 작용은 뉴클레오티드의 인산 골격과 염기를 모두 사용하여 극심한 구조 변화를 일으킨다. 금속이 존재할 때 포스포디에스터 골격의 절단을 위한 두 가지 메커니즘 클래스가 있다. 첫 번째 메커니즘에서 내부 2'-OH 기는 SN2 메커니즘에서 인 원자를 공격한다. 금속 이온은 먼저 인산염 산소를 배위하고 나중에 옥시음이온을 안정화시켜 이 반응을 촉진한다. 두 번째 메커니즘 또한 SN2 치환을 따르지만, 친핵체는 RNA 자체가 아니라 물 또는 외부 히드록실기에서 나온다. 가장 작은 리보자임은 UUU이며, Mn2+가 존재할 때 첫 번째 메커니즘을 통해 GAAA 사핵산의 G와 A 사이의 절단을 촉진할 수 있다. 이 삼핵산(보완 사합체가 아닌)이 이 반응을 촉매하는 이유는 UUU-AAA 쌍이 64가지 컨포메이션 중 가장 약하고 유연한 삼핵산으로, Mn2+에 대한 결합 부위를 제공하기 때문일 수 있다.[54]
RNA의 2'-OH기가 친핵체로 작용하여 인산디에스테르 결합을 절단하는 메커니즘이 일반적이다. 인산 전이는 금속 이온 없이도 촉매될 수 있다. 예를 들어, 췌장 리보뉴클레아제 A 및 B형 간염 델타 바이러스(HDV) 리보자임은 금속 이온 없이 산-염기 촉매 작용을 통해 RNA 골격의 절단을 촉매할 수 있다.[54] 헤어핀 리보자임 또한 금속 이온 없이 RNA의 자체 절단을 촉매할 수 있지만, 이에 대한 메커니즘은 아직 불분명하다.[54]
리보자임은 활성화 엔트로피를 낮춤으로써 인접한 아미노산 사이의 펩타이드 결합 형성을 촉매할 수도 있다.[54]
4. 역할
리보자임은 효소 역할을 하는 RNA 분자, 또는 그 RNA 분자와 단백질로 구성된다. 1981년 리보자임이 발견되기 전에는, 효소는 단백질만이 유일한 생체 촉매로 알려져 있었다. 그러나 1980년대에 토머스 체크와 시드니 올트먼이 각각 테트라히메나의 rRNA와 리보핵산가수분해효소P(RNase-P)를 연구하면서 RNA도 촉매 기능을 할 수 있음을 발견했다.[16][17]
체크는 테트라히메나의 rRNA 유전자에서 인트론이 제거되는 자가이어맞추기(self-splicing) 과정에서, 단백질 없이 RNA 스스로 인트론을 자르고 엑손을 연결하는 것을 발견했다. 올트먼은 RNase-P가 tRNA 전구체를 활성화된 tRNA로 변화시키는 과정에서 RNA 부분이 핵심적인 촉매 역할을 한다는 것을 발견했다. 이들은 1989년 노벨 화학상을 수상했다.
리보자임은 자기이어맞추기를 하는 유형과 다른 분자의 반응을 촉매하는 유형으로 나눌 수 있다. 자기이어맞추기를 하는 리보자임에는 그룹 '''Ⅰ''' 인트론, 그룹 '''Ⅱ''' 인트론, 망치머리 리보자임 등이 있다.
4. 1. 세포 내 기능
리보자임은 대부분의 세포에서 매우 드물지만, 그 역할은 때때로 생명 유지에 필수적이다. 예를 들어 RNA를 단백질로 번역하는 생물학적 기계인 리보솜의 기능적 부분은 근본적으로 리보자임이며, RNA 삼차 구조 모티프로 구성되어 있고, 이는 종종 Mg2+와 같은 금속 이온을 보조 인자로 활용한다.[14]thumb은 리보자임을 활용하여 RNA를 번역하여 단백질을 만드는 생물학적 기계이다.]]
리보자임의 주요 기능은 다음과 같다.[54]
- 올리고뉴클레오타이드 기질의 분해와 연결
- DNA 포스포디에스테르결합의 분해
- RNA의 서열 특이적 분해, 에스테르 가수분해
- 아미노산 사이의 펩타이드결합 형성
- 대사물질의 존재에 따른 RNA의 절단 및 이를 통한 유전자 발현 조절
4. 2. 유전 물질로서의 기능
리보자임은 촉매 기능과 함께 유전 정보를 저장하고 전달하는 기능도 수행할 수 있다. RNA는 정보 분자와 촉매, 두 가지 기능을 갖는 최초의 거대 생체분자 중 하나이며 진화 초기 단계에서 주된 역할을 하였을 것이라는 예상이 있다. 이러한 가설은 생명의 기원에 관한 RNA 세계 가설로 알려져 있다.[20] RNA는 유전 물질로도 작용할 수 있으며, 월터 길버트는 오래전 세포가 오늘날처럼 DNA와 단백질로 이러한 기능을 나누는 대신 RNA를 유전 물질이자 구조적, 촉매적 분자로 사용했을 것이라고 제안했다. 뉴클레오타이드와 RNA (그리고 리보자임)는 무기 화학 물질에 의해 발생할 수 있으므로, 최초의 효소 후보이며, 실제로 최초의 "복제자"(즉, 정보를 포함하고 스스로 복제하는 거대 분자)이다. 2002년에는 두 개의 기질을 결합하여 자체의 정확한 복사본을 생성하는 자기 복제 리보자임의 예가 기술되었다.[21]RNA의 촉매 활성 발견은 생명의 기원의 "닭과 달걀" 역설을 해결하여 펩타이드와 핵산 중심 원리의 기원 문제를 해결했다. 이 시나리오에 따르면, 생명의 기원에서는 모든 효소 활성과 유전 정보 암호화가 하나의 분자, 즉 RNA에 의해 수행되었다.
실험실에서 다른 RNA 분자를 활성화된 단량체로부터 매우 특정한 조건 하에서 합성하는 것을 촉매할 수 있는 리보자임이 생성되었으며, 이러한 분자는 RNA 중합효소 리보자임으로 알려져 있다.[22] 최초의 RNA 중합효소 리보자임은 1996년에 보고되었으며, 최대 6개의 뉴클레오타이드 길이의 RNA 중합체를 합성할 수 있었다.[23] 돌연변이 유발과 선택이 무작위 RNA 염기서열의 큰 풀에서 RNA 연결효소 리보자임에 대해 수행되었으며,[24] 2001년에는 최대 14개의 뉴클레오타이드 길이의 RNA 중합체를 촉매할 수 있는 개선된 "Round-18" 중합효소 리보자임이 분리되었다.[25] Round-18 리보자임에 추가적인 선택을 적용한 결과, B6.61 리보자임이 생성되었으며 24시간 동안 프라이머 주형에 최대 20개의 뉴클레오타이드를 추가할 수 있었지만, 포스포디에스터 결합의 절단에 의해 분해되었다.[26]
리보자임이 미셀 내에서 일어날 때 RNA 염기서열을 중합하는 속도가 실질적으로 증가한다.[27]
이후 발견된 리보자임은 "tC19Z" 리보자임으로, 0.0083 돌연변이/뉴클레오타이드의 정확도로 최대 95개의 뉴클레오타이드를 추가할 수 있다.[28] 다음으로, 연구자들은 "tC9Y" 리보자임을 발견했으며, 영하 온도에서의 공융상 조건에서 최대 206개의 뉴클레오티드 길이의 RNA 가닥을 합성할 수 있었다.[29] 이는 이전에 리보자임 중합효소 활성을 촉진하는 것으로 나타났다.[30]
tC9-4M이라고 하는 RNA 중합효소 리보자임(RPR)은 생리적 수준에 가까운 마그네슘 이온 농도에서 자체보다 긴 RNA 사슬(즉, 177 nt보다 긴)을 중합할 수 있었지만, 이전 RPR은 최대 200 mM의 생물학적으로 있을 수 없는 농도를 필요로 했다. 이것을 달성하는 데 필요한 유일한 요인은 라이신 데카펩타이드라고 하는 매우 간단한 아미노산 중합체의 존재였다.[31]
당시 합성된 가장 복잡한 RPR은 24-3이라고 불렸으며, 실질적으로 다양한 뉴클레오타이드 염기서열을 중합하고 이전 리보자임으로는 접근할 수 없는 RNA 기질의 복잡한 2차 구조를 탐색할 수 있었다. 이 실험은 리보자임을 사용하여 tRNA 분자를 합성한 최초의 실험이었다.[32] 24-3 리보자임으로 시작하여 Tjhung 등은[33] ''in vitro'' 진화에 의해 RNA 중합효소 리보자임을 얻기 위해 다른 14번의 선택을 적용했으며, 이는 복잡한 RNA 분자를 복사하는 데 전례 없는 수준의 활성을 보였다. '38-6'으로 명명되었다. 그러나 이 리보자임은 자체를 복사할 수 없으며 RNA 생성물은 높은 돌연변이율을 보인다. 후속 연구에서 연구자들은 38-6 리보자임으로 시작하여 다른 14번의 선택을 적용하여 '52-2' 리보자임을 생성했으며, 이는 38-6에 비해 다시 여러 배 더 활성이 높았고 클래스 I 연결효소의 감지 가능하고 기능적인 수준을 생성하기 시작할 수 있었지만, T7 RNA 중합효소와 같은 단백질에 의한 동일한 주형 복사에 비해 정확도와 기능성에는 여전히 제한이 있었다.[34]
t5(+1)이라고 하는 RPR은 한 번에 뉴클레오타이드 하나가 아닌 세 개의 뉴클레오타이드를 추가한다. 이 이종이량체 RPR은 헤어핀을 포함하여 24-3에서 접근할 수 없는 2차 구조를 탐색할 수 있다. Z RPR로 알려진 이전에 합성된 RPR에서 파생된 RNA 변이체의 초기 풀에서 두 개의 염기서열이 개별적으로 나타나 서로 상호 의존하게 되었다. 유형 1 RNA는 촉매적으로 비활성이 되도록 진화했지만, 유형 5 RNA와의 복합체화는 중합 능력을 향상시키고 RNA 주형 기질과의 분자간 상호 작용을 가능하게 하여 이전 연구의 한계였던 RPR의 RNA 염기서열에 주형을 직접 고정해야 할 필요성을 없앴다. t5(+1)은 주형에 고정될 필요가 없을 뿐만 아니라, t5(+1)이 3' → 5' 및 5' → 3' 방향으로 주형을 중합할 수 있었기 때문에 프라이머도 필요하지 않았다.[35]
고도로 진화된 RNA 중합효소 리보자임은 역전사 효소로 기능할 수 있었으며, 즉 RNA 주형을 사용하여 DNA 사본을 합성할 수 있다.[36] 이러한 활성은 지구 생명체의 초기 역사 동안 RNA에서 DNA 게놈으로의 전환에 결정적인 역할을 한 것으로 간주된다. 역전사 능력은 초기 RNA 의존적 RNA 중합효소 리보자임의 2차 기능으로 나타났을 수 있다.
리보자임으로 접히는 RNA 염기서열은 이중 나선 RNA를 침입하여 열린 홀로중합효소 복합체로 재배열한 다음 특정 RNA 프로모터 염기서열을 검색할 수 있으며, 인식 시 다시 공정 형태로 재배열하여 염기서열의 상보적 가닥을 중합한다. 이 리보자임은 중합되는 염기서열을 고정할 필요 없이 이중 나선 RNA를 최대 107개의 뉴클레오타이드까지 확장할 수 있다.[37]
5. RNA 세계 가설
RNA가 촉매 기능과 유전 정보를 저장하는 기능을 모두 가질 수 있다는 점은 초기 생명체에서 RNA가 중심적인 역할을 했을 것이라는 RNA 세계 가설을 뒷받침한다. 1986년 미국의 생화학자 월터 길버트가 'RNA 세계'라는 용어를 처음 사용했다.[20]
이 가설은 생명의 중심 원리에서 닭과 달걀의 문제, 즉 DNA와 단백질 중 어느 것이 먼저 생겨났는지에 대한 질문을 해결한다. RNA가 효소 활성과 유전 정보 저장을 모두 담당했다면, 이 문제가 해결되기 때문이다.[8]
1967년 칼 우즈, 프랜시스 크릭, 레슬리 오겔은 RNA가 복잡한 2차 구조를 형성할 수 있다는 점에 주목하여 RNA가 촉매 역할을 할 수 있다고 제안했다.[5] 1980년대 토머스 체크는 ''테트라히메나''의 리보솜 RNA 유전자에서 인트론이 스스로 잘려나가는 현상(자가이어맞추기, self-splicing)을 발견했고, 시드니 올트먼은 RNase-P라는 효소 복합체의 RNA 부분이 촉매 활성을 가진다는 것을 발견했다. 이들은 1989년 노벨 화학상을 공동 수상했다.[6]
실험실에서는 RNA 중합효소 기능을 하는 리보자임이 만들어지기도 했다.[22] 초기에는 짧은 뉴클레오타이드만 중합할 수 있었지만, 돌연변이 유발과 선택 과정을 통해 점차 긴 RNA 사슬을 합성할 수 있는 리보자임이 개발되었다.[25][26] 최근에는 역전사 효소처럼 RNA 주형을 바탕으로 DNA를 합성할 수 있는 리보자임도 개발되었다.[36]
6. 리보자임 공학
리보자임 공학은 자연에 존재하는 리보자임을 변형하거나 새로운 리보자임을 개발하여 다양한 응용 분야에 활용하는 기술이다. 리보자임 공학은 크게 두 가지 영역으로 확장될 수 있다. 첫 번째는 자연에 존재하는 리보자임의 종을 직접 변경하여 더 우수하거나 심지어는 새로운 촉매를 만들어 내는 것이다. 다른 하나는 50개~100개 뉴클레오타이드 정도의 비교적 짧은 RNA 분자 사슬을 사용하여 반복적인 선택과정을 거치게 하고 원하는 기능을 가진 RNA 분자의 농도를 높이는 기술이다. 이렇게 선택된 RNA 분자들은 중합효소 연쇄반응(PCR)을 통해 수 백만 배 이상 증폭되어 활성화된 뉴클레오타이드 전구체나 효소로 사용된다. 이러한 방법을 Irrational design방법이라고 한다.
생명체에 존재하는 리보자임이 발견된 이후, 실험실에서 만들어진 새로운 인공 리보자임 연구에 대한 관심이 높아졌다. Tang과 Breaker는[38] 무작위 염기 서열 RNA에서 유래된 RNA의 ''in vitro'' 선택을 통해 자기 절단 RNA를 분리했다. 이와 같이 생산된 인공 리보자임 중 일부는 새로운 구조를 가졌으며, 일부는 자연적으로 발생하는 해머헤드 리보자임과 유사했다.
2015년, 노스웨스턴 대학교와 일리노이 대학교 시카고의 연구자들은 세포 내 모든 단백질과 효소를 생산하는 실제 세포 구성 요소만큼이나 효과적으로 작동하는 테더형 리보솜을 설계했다. Ribo-T라고 불리는 인공 리보솜은 Michael Jewett와 Alexander Mankin에 의해 만들어졌다.[39] 인공 리보자임을 만드는 데 사용되는 기술에는 지향적 진화가 포함된다.
Lincoln과 Joyce는 ''in vitro'' 진화를 사용하여 미리 합성된 고도로 상보적인 올리고뉴클레오타이드의 결합을 통해 약 한 시간에 자기 복제가 가능한 리보자임 리가제를 개발했다.[40]
''aptazymes''라고 불리는 인공 자기 절단 리보스위치의 생성 또한 활발한 연구 분야이다. ''glmS''라는 리보스위치를 기반으로 하는 리보자임은 단 하나만 설명되었다.[41] 더 최근의 연구에서는 리보자임 리보스위치에서 사용되는 리간드를 티민 피로인산으로 확장했다. 형광 활성화 세포 분류 또한 aptazymes를 엔지니어링하는 데 사용되었다.[42]
7. 응용
리보자임은 유전자 치료를 통해 질병을 치료하는 데 사용될 수 있다고 제안되었고, 개발되어 왔다. RNA 기반 효소를 치료제로 사용할 때 가장 큰 문제점 중 하나는 체내에서 촉매 RNA 분자의 반감기가 짧다는 것이다. 이를 해결하기 위해 리보오스의 2' 위치를 변형하여 RNA 안정성을 향상시킨다. 리보자임 유전자 치료의 한 분야는 RNA 기반 바이러스 억제이다.
''유전자 시어(gene shears)''라고 불리는 HIV RNA를 표적으로 하는 일종의 합성 리보자임이 개발되어 HIV 감염에 대한 임상 시험에 들어갔다.[43][44]
마찬가지로, 리보자임은 C형 간염 바이러스 RNA, 사스 코로나바이러스(SARS-CoV),[45] 아데노바이러스[45], A형 인플루엔자 및 B형 인플루엔자 바이러스 RNA를 표적으로 하도록 설계되었다.[46][47][48][45] 리보자임은 바이러스 게놈의 보존된 부분을 절단할 수 있으며, 이는 포유류 세포 배양에서 바이러스를 감소시키는 것으로 나타났다.[49] 이러한 연구자들의 노력에도 불구하고, 이 프로젝트들은 전임상 단계에 머물러 있다.
현재 기술로 특정한 다른 RNA 분자를 절개하는 리보자임을 만드는 것이 가능하다. 이 RNA 촉매들은 약학적으로 응용될 수 있다. 예를 들어, HIV의 RNA를 절개하도록 설계된 리보자임이 존재한다. 만약 세포가 이런 리보자임을 만드는 것이 가능하다면, 리보자임은 감염을 방지할 수 있는 RNA 유전자를 절개하여 이것을 침투하는 바이러스에게 넣을 수 있을 것이다.
8. 알려진 리보자임
- Peptidyl transferase 23S rRNA
- RNase P
- Group I 및 Group II introns
- GIR1 분지 리보자임[55]
- Leadzyme
- 헤어핀 리보자임
- 해머헤드 리보자임
- HDV 리보자임
- Mammalian CPEB3 ribozyme
- VS 리보자임
- glmS 리보자임
- CoTC 리보자임
- 트위스터 리보자임
- 트위스터 시스터 리보자임
- VS 리보자임
- 피스톨 리보자임
- 해치 리보자임
- 비로이드
잘 알려진 자연 발생 리보자임 종류는 다음과 같다.
참조
[1]
논문
The catalytic diversity of RNAs
2005-05-00
[2]
논문
The meaning of a minuscule ribozyme
2011-10-00
[3]
논문
RNA synthesis by in vitro selected ribozymes for recreating an RNA world
2015-01-00
[4]
서적
RNA and the Regulation of Gene Expression: A Hidden Layer of Complexity
Caister Academic Press
[5]
서적
The Genetic Code
Harper and Row
1967-00-00
[6]
웹사이트
The Nobel Prize in Chemistry 1989
https://www.nobelpri[...]
[7]
논문
Self-splicing RNA: autoexcision and autocyclization of the ribosomal RNA intervening sequence of Tetrahymena
1982-11-00
[8]
논문
Evolution of biocatalysis 1. Possible pre-genetic-code RNA catalysts which are their own replicase
[9]
논문
Ribozymes: a distinct class of metalloenzymes
1993-08-00
[10]
논문
From nucleotides to ribozymes—A comparison of their metal ion binding properties
https://www.zora.uzh[...]
[11]
논문
Ribozymes: a distinct class of metalloenzymes
1993-08-00
[12]
논문
Mechanisms of RNA catalysis
2011-10-00
[13]
논문
The chemical repertoire of natural ribozymes
2002-07-00
[14]
논문
The complete atomic structure of the large ribosomal subunit at 2.4 A resolution
2000-08-00
[15]
논문
Multiple translational products from a five-nucleotide ribozyme
2010-03-00
[16]
논문
Structural biology. The ribosome is a ribozyme
2000-08-00
[17]
논문
Nobel lecture. Enzymatic cleavage of RNA by RNA
1990-08-00
[18]
논문
Ribozymes: catalytic RNAs that cut things, make things, and do odd and useful jobs
2002-10-00
[19]
논문
Prion protein conversion in vitro
2004-06-00
[20]
논문
Origin of life: The RNA world
1986-00-00
[21]
논문
A self-replicating ligase ribozyme
2002-10-00
[22]
논문
RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension
2001-05-00
[23]
논문
RNA-catalysed RNA polymerization using nucleoside triphosphates
1996-07-00
[24]
논문
Isolation of new ribozymes from a large pool of random sequences [see comment]
1993-09-00
[25]
논문
RNA-catalyzed RNA polymerization: accurate and general RNA-templated primer extension
2001-05-00
[26]
논문
Selection of an improved RNA polymerase ribozyme with superior extension and fidelity
2007-07-00
[27]
논문
Improved polymerase ribozyme efficiency on hydrophobic assemblies
2008-03-00
[28]
논문
Ribozyme-catalyzed transcription of an active ribozyme
2011-04-00
[29]
논문
In-ice evolution of RNA polymerase ribozyme activity
2013-12-00
[30]
논문
Ice as a protocellular medium for RNA replication
2010-09-00
[31]
논문
Simple peptides derived from the ribosomal core potentiate RNA polymerase ribozyme function
2017-04-00
[32]
논문
Amplification of RNA by an RNA polymerase ribozyme
2016-08-00
[33]
논문
An RNA polymerase ribozyme that synthesizes its own ancestor
2020-02-00
[34]
논문
Witnessing the structural evolution of an RNA enzyme.
2021-00-00
[35]
논문
Ribozyme-catalysed RNA synthesis using triplet building blocks
2018-05-00
[36]
저널
A reverse transcriptase ribozyme
2017-09-00
[37]
저널
Processive RNA polymerization and promoter recognition in an RNA World
2021-03-00
[38]
저널
Structural diversity of self-cleaving ribozymes
2000-05-00
[39]
뉴스
Engineer and Biologist Design First Artificial Ribosome - Designer ribosome could lead to new drugs and next-generation biomaterials
http://www.northwest[...]
Northwestern University
2015-07-31
[40]
저널
Self-sustained replication of an RNA enzyme
2009-02-00
[41]
저널
Control of gene expression by a natural metabolite-responsive ribozyme
2004-03-00
[42]
저널
A flow cytometry-based screen for synthetic riboswitches
2009-01-00
[43]
저널
Technology evaluation: HIV ribozyme gene therapy, Gene Shears Pty Ltd
2000-06-00
[44]
저널
Ribozyme: a clinical tool
2006-05-00
[45]
저널
Advancements in Nucleic Acid Based Therapeutics against Respiratory Viral Infections
2018-12-00
[46]
저널
Gene silencing: a therapeutic approach to combat influenza virus infections
2015-00-00
[47]
저널
Nucleic acid-mediated cleavage of M1 gene of influenza A virus is significantly augmented by antisense molecules targeted to hybridize close to the cleavage site
2012-05-00
[48]
저널
The emerging influenza virus threat: status and new prospects for its therapy and control
2018-04-00
[49]
저널
Elimination of hepatitis C virus RNA in infected human hepatocytes by adenovirus-mediated expression of ribozymes
1996-12-00
[50]
저널
An mRNA is capped by a 2', 5' lariat catalyzed by a group I-like ribozyme
2005-09-00
[51]
저널
RNA catalyses nuclear pre-mRNA splicing
2013-11-00
[52]
저널
RNA酵素
日本醸造協会
1988-00-00
[53]
저널
RNA 이야기 : 생명의 시작에서 리보자임, 에이즈까지
[54]
서적
생화학의 이해
월드사이언스
2007-00-00
[55]
저널
An mRNA is capped by a 2', 5' lariat catalyzed by a group I-like ribozyme
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
