지질산소화효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
지질산소화효소는 생화학 반응을 촉매하는 효소의 한 종류로, 다불포화 지방산에 산소를 첨가하여 과산화수소를 생성한다. 이 효소는 식물, 포유류 등 다양한 생물체에 존재하며, 세포 내에서 다양한 생리 활성 물질의 생성에 관여한다. 인간의 경우, 5-리폭시게나아제(ALOX5), 12-리폭시게나아제(ALOX12), 15-리폭시게나아제(ALOX15) 등 6개의 주요 효소가 있으며, 아라키돈산과 같은 다불포화 지방산을 대사하여 류코트리엔, 리폭신 등의 물질을 생성한다. 식물에서는 성장, 발달, 해충 저항성 등에 관여하며, 포유류에서는 에이코사노이드 대사에 중요한 역할을 한다.
더 읽어볼만한 페이지
- 에이코사노이드 - 류코트리엔
류코트리엔은 백혈구와 트리엔의 결합으로 명명된 아라키돈산 유래 생체 활성 지질 매개체로, 염증 반응과 천식 및 알레르기 반응에 관여하며, 류코트리엔 길항제는 기관지 천식 치료에 사용된다. - 에이코사노이드 - 비전형적 에이코사노이드
비전형적 에이코사노이드는 20개의 탄소를 가진 필수 지방산의 산소화된 유도체로, 류코트라이엔, 프로스타노이드와 구분되며, 에옥신, 헤폭실린, 레졸빈 등이 이에 속한다. - EC 1.13.11 - 인돌아민 2,3-이산소화효소
인돌아민 2,3-이산소화효소(IDO)는 트립토판 이화작용의 속도 제한 단계를 촉매하는 효소로서, 면역관용 기전, 미생물 방어, 면역 조절 세포 기능에 관여하며, 종양의 면역 회피 전략에 활용되어 암 치료 연구의 대상이 된다. - EC 1.13.11 - 이산소화효소
이산소화효소는 이산소 분자를 기질에 첨가하는 효소의 총칭으로, 단핵 철, Rieske, 헴 함유 형태로 분류되며, 생체 내 대사 과정에 관여하고 기능 이상 시 질병과 관련될 수 있다. - 표재성 막 단백질 - 알파-시누클레인
알파-시누클레인은 신경 조직에서 발견되는 시누클레인 단백질로, 시냅스 소포 조절, 도파민 조절 등 다양한 기능을 수행하지만 응집되어 레비 소체를 형성하면 파킨슨병과 같은 시누클레인병증을 유발하며, 장-뇌 축을 통해 파킨슨병 발병에 영향을 미치고 유전자 돌연변이는 가족성 파킨슨병의 원인이 될 수 있다. - 표재성 막 단백질 - 신경독
신경독은 신경계에 손상을 일으키는 다양한 종류의 물질로, 중금속, 유기용매, 살충제, 생물 유래 독소 등이 있으며, 이들은 다양한 작용 메커니즘을 통해 신경계에 손상을 유발하여 신경퇴행성 질환, 인지 기능 저하, 정신 질환, 발달 장애 등 다양한 건강 문제를 야기하므로 예방과 치료를 위한 노력이 필요하고 신경과학 연구에도 활용된다.
2. 생화학
지질산소화효소는 일반적으로 15 킬로달톤 크기의 N-말단 베타 배럴 도메인과 효소 활성에 필수적인 비-헴 철을 포함하는 비교적 큰 C-말단 촉매 도메인으로 구성된다.[3] 이 효소들은 기본적으로 ''다불포화 지방산 + O2 → 지방산 과산화수소'' 반응을 촉매한다.[3]
지질산소화효소는 국제생화학·분자생물학 연합(IUBMB)의 효소 위원회 번호(EC number) 시스템에 따라 다음과 같이 분류된다.
대두 리폭시게네이스 1은 실온 근처에서 kcat (kH/kD) 값이 81로, 생물학적 시스템에서 보고된 가장 큰 수소/중수소 동위원소 효과(KIE) 중 하나를 나타낸다. 최근에는 이중 돌연변이 대두 리폭시게네이스 1에서 540에서 730에 달하는 극도로 높은 KIE가 발견되기도 했다.[26] 이처럼 큰 KIE 값 때문에, 대두 리폭시게네이스 1은 효소 촉매 반응에서의 수소 터널링 현상을 연구하는 데 중요한 모델 시스템으로 사용되어 왔다.
인간의 경우, 지질산소화효소 계열에 속하는 단백질로는 ALOX12, ALOX12B, ALOX15, ALOX15B, ALOX5, ALOXE3 등이 있다. 또한 인간 게놈에는 쥐에서 잘 발현되는 ''Alox12P'' 유전자의 상동 유전자인 ''ALOX12P2'' 유전자가 존재하지만, 이 유전자는 기능하지 않는 유사유전자이다. 따라서 ALOX12P2 단백질은 인간에게서는 검출되지 않는다.[27]
2. 1. 반응 메커니즘
15-리폭시게네이스 1과 안정화된 5-리폭시게네이스의 상세한 분석에 따르면, 리폭시게네이스의 구조는 15 킬로달톤 N-말단 베타 배럴 도메인, 작은 링커 도메인(0.6 킬로달톤), 그리고 효소의 촉매 활성에 필수적인 비-헴 철을 포함하는 비교적 큰 C-말단 촉매 도메인으로 구성된다.[3] 대부분의 리폭시게네이스(ALOXE3 등 일부 예외 존재)는 다음과 같은 4단계 과정을 통해 ''다불포화 지방산 + O2 → 지방산 과산화수소'' 반응을 촉매한다.- 비스알릴 메틸렌 탄소로부터 수소를 추출하는 속도 결정 단계. 이 과정에서 해당 탄소에 지방산 라디칼이 형성된다.
- 형성된 라디칼을 다른 탄소 중심으로 재배열한다.
- 분자 산소(O2)를 재배열된 탄소 라디칼 중심에 첨가하여 해당 탄소에 과산화 라디칼(—OO·) 결합을 형성한다.
- 과산화 라디칼을 해당 음이온(—OO−)으로 환원시킨다.
이후 음이온(—OO−) 잔기는 양성자와 결합하여 과산화수소 그룹(—OOH)을 형성한다. 이 과산화수소 그룹은 리폭시게네이스에 의해 류코트리엔, 헤폭실린 및 다양한 특수 프로-해결 중재자 등으로 더 대사될 수 있다. 또는 세포 내에 널리 분포하는 글루타티온 과산화효소에 의해 수산기(—OH)로 환원되어 하이드록시에이코사테트라에노산(HETE) 및 HODE(즉, 하이드록시옥타데카다이에노산)과 같은 수산화된 다불포화 지방산을 형성할 수도 있다.[3]
하나 이상의 리폭시게네이스의 기질로 작용하는 다불포화 지방산에는 오메가 6 지방산인 아라키돈산, 리놀레산, 디호모-γ-리놀렌산, 아드레산 등이 있다. 또한 오메가-3 지방산인 에이코사펜타에노산, 도코사헥사엔산, 알파-리놀렌산과 오메가-9 지방산인 미드산도 기질이 될 수 있다.[4] 특정 유형의 리폭시게네이스, 예를 들어 인간 및 생쥐의 15-리폭시게네이스 1, 12-리폭시게네이스 B, ALOXE3는 인지질, 콜레스테롤 에스테르 또는 피부의 복합 지질 구성 성분인 지방산 기질을 대사하는 능력을 가지고 있다.[3] 대부분의 리폭시게네이스는 초기에 형성되는 과산화수소 생성물이 ''S'' 키랄성을 갖도록 촉매한다. 이 규칙의 예외로는 인간 및 다른 포유류의 12R-리폭시게네이스 등이 있다.[3][4][5]
리폭시게네이스의 활성은 기질인 다불포화 지방산의 가용성에 크게 의존하는데, 이들 지방산은 포유류 세포에서 일반적으로 매우 낮은 농도로 유지된다. 세포가 자극을 받으면 다양한 포스포리파아제 A2 및 디아실글리세롤 리파아제가 활성화되어 저장 부위로부터 이러한 지방산을 방출시킨다. 따라서 이 효소들은 리폭시게네이스 의존성 대사산물 형성에 있어 핵심적인 조절자 역할을 한다.[3] 또한, 활성화된 세포는 방출된 다불포화 지방산을 인접 또는 인근 세포로 전달할 수 있다. 전달받은 세포는 이 지방산을 리폭시게네이스 경로를 통해 대사하는데, 이 과정을 트랜스셀룰러 대사 또는 트랜스셀룰러 생합성이라고 한다.[6]
2. 2. 기질
하나 이상의 리폭시게네이스의 기질 역할을 하는 다불포화 지방산에는 다음과 같은 종류가 있다.[4]
특정 유형의 리폭시게네이스, 예를 들어 인간 및 생쥐 15-리폭시게네이스 1, 12-리폭시게네이스 B, ALOXE3는 인지질, 콜레스테롤 에스테르 또는 피부의 복합 지질에 포함된 지방산 기질을 직접 대사할 수 있다.[3] 대부분의 리폭시게네이스는 초기에 형성되는 과산화수소 생성물이 ''S'' 키랄성을 갖도록 촉매한다. 그러나 인간 및 다른 포유류의 12R-리폭시게네이스와 같은 예외도 존재한다.[3][4][5]
리폭시게네이스의 활성은 기질인 다불포화 지방산의 가용성에 크게 의존하는데, 이들 지방산은 일반적으로 포유류 세포 내에서 매우 낮은 농도로 유지된다. 세포가 자극을 받으면 다양한 포스포리파아제 A2 및 디아실글리세롤 리파아제가 활성화되어 저장된 지방산을 방출시킨다. 이 과정은 리폭시게네이스 의존성 대사산물 형성을 조절하는 핵심 단계이다.[3] 또한, 이렇게 활성화된 세포는 방출된 다불포화 지방산을 인접 세포로 전달할 수 있으며, 전달받은 세포는 이 지방산을 리폭시게네이스 경로를 통해 대사한다. 이 과정을 트랜스셀룰러 대사 또는 트랜스셀룰러 생합성이라고 부른다.[6]
2. 3. 생성물
지질산소화효소는 기본적으로 ''다불포화 지방산 + O2 → 지방산 과산화수소'' 반응을 촉매한다.[3] 이 과정에서 생성되는 초기 생성물인 지방산 과산화수소(hydroperoxide, —OOH)는 대부분 ''S'' 키랄성을 가진다. 그러나 인간 및 다른 포유류의 12R-리폭시게네이스와 같이 ''R'' 형태의 생성물을 만드는 예외적인 경우도 존재한다.[3][4][5]이렇게 처음 생성된 지방산 과산화수소는 불안정하여 세포 내에서 다양한 경로를 통해 추가적으로 대사된다.
- 지질산소화효소 자체에 의해 더 복잡한 생리 활성 물질인 류코트리엔, 헤폭실린, 다양한 특수 프로-해결 중재자(SPM, specialized pro-resolving mediators) 등으로 전환될 수 있다.[3]
- 또는 세포 내에 널리 분포하는 글루타티온 과산화효소에 의해 과산화수소 그룹(—OOH)이 수산기(—OH)로 환원되어, 하이드록시에이코사테트라에노산(HETE) 및 HODE(하이드록시옥타데카다이에노산)과 같은 비교적 안정한 수산화된 다불포화 지방산 형태가 될 수 있다.[3]
일부 특정 지질산소화효소, 예를 들어 인간 및 생쥐의 15-리폭시게네이스 1, 12-리폭시게네이스 B, ALOXE3 등은 인지질, 콜레스테롤 에스테르 또는 피부의 복합 지질과 같은 더 큰 분자의 일부로 결합되어 있는 지방산을 직접 기질로 사용하여 대사할 수 있는 능력을 가진다.[3]
3. 생물학적 기능 및 분류
이 효소들은 식물에서 가장 흔하게 발견되며, 식물의 성장 및 발달, 해충 저항성, 노화 또는 상처에 대한 반응 등 다양한 생리적 과정에 관여한다.[7] 포유류에서는 여러 리폭시게나제 동형 효소가 에이코사노이드(예: 프로스타글란딘, 류코트리엔) 대사에 중요한 역할을 한다.[8]
3. 1. 식물 리폭시게나아제
식물은 다양한 세포질 지질산소화효소를 발현하며, 엽록체 동위효소로 보이는 것도 발현한다.[9] 식물 지질산소화효소는 과산화수소 분해효소와 함께 많은 향기와 다른 신호 화합물을 생성하는 역할을 한다. 한 예로 시스-3-헥세날은 신선하게 깎은 잔디 냄새를 낸다.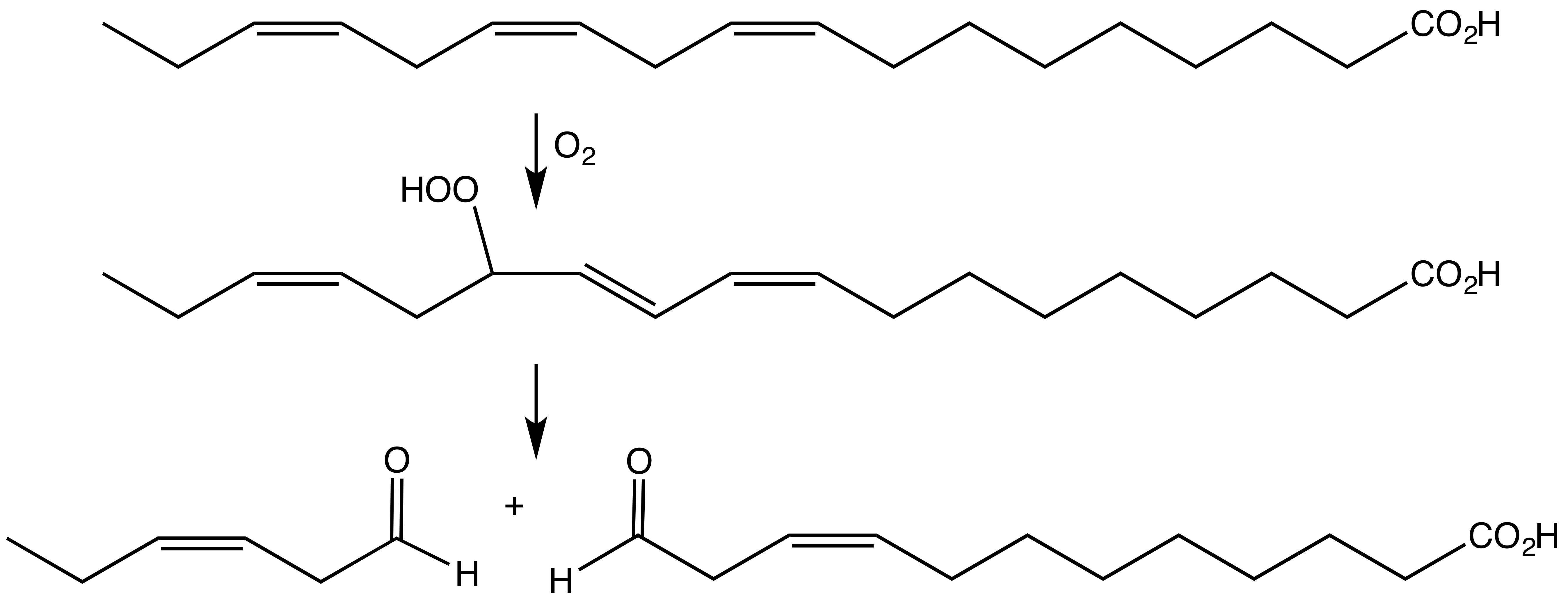
3. 2. 인간 리폭시게나아제
5-LOX(ALOX5) 유전자는 10q11.2 염색체에 위치하고 있으며, 나머지 6개의 인간 ''LOX'' 유전자는 모두 17p13 염색체에 위치한다. 이 유전자들은 662~711개의 아미노산으로 구성된 75~81 킬로달톤(kDa) 크기의 단일 사슬 단백질을 암호화한다. 포유류 ''LOX'' 유전자는 14개(''ALOX5'', ''ALOX12'', ''ALOX15'', ''ALOX15B'') 또는 15개(''ALOX12B'', ''ALOXE3'')의 엑손을 포함하며, 엑손/인트론 경계는 매우 유사한 위치에 있다.[11][12]6가지 인간 지질산소화효소와 주요 생성물, 그리고 유전 질환과의 연관성은 다음과 같다.[11][13][14][15][16]
두 개의 리폭시게나아제가 순차적으로 작용하여, 각각의 효소만으로는 만들 수 없는 새로운 활성을 가진 디-하이드록시 또는 트리-하이드록시 생성물을 만들 수 있다. 이러한 연속 대사는 서로 다른 세포에 존재하는 효소들 사이에서도 일어날 수 있으며, 이를 세포간 대사(transcellular metabolism)라고 부른다. 예를 들어, ALOX5와 ALOX15 또는 ALOX5와 ALOX12가 함께 작용하여 아라키돈산으로부터 리폭신을 생성할 수 있다. 또한, ALOX15(및 가능하게는 ALOX15B)는 ALOX5와 협력하여 에이코사펜타에노산을 레졸빈 D로 대사할 수 있다.
3. 3. 마우스 리폭시게나아제
마우스는 지질산소화효소 기능을 연구하는 데 흔히 사용되는 모델 동물이다. 그러나 마우스와 인간의 지질산소화효소 사이에는 몇 가지 중요한 차이점이 존재하여, 마우스 연구 결과를 인간에게 그대로 적용하기에는 어려움이 따른다. 인간에게는 6개의 기능적 지질산소화효소가 있는 반면, 마우스는 7개의 기능적 지질산소화효소를 가지고 있으며, 이 중 일부는 인간의 동종 유전자와 다른 대사 활동을 보인다.[11][19][21] 예를 들어, 마우스의 Alox15는 인간 ALOX15와 달리 아라키돈산을 주로 12-하이드로퍼옥시에이코사테트라엔산(12-HpETE)으로 대사시키며, 마우스 Alox15b는 인간 ALOX15B와 달리 주로 8-지질산소화효소로서 아라키돈산을 8-하이드로퍼옥시에이코사테트라엔산(8-HpETE)으로 대사시킨다. 인간에게는 8-HpETE를 생성하는 유사한 지질산소화효소가 없다.[22]각 마우스 지질산소화효소와 인간 효소 간의 주요 특징은 다음과 같다.
- Alox5: 인간 ALOX5와 기능적으로 유사한 것으로 보인다.
- Alox12: 인간 ALOX12와 차이가 있다. 인간 ALOX12는 아라키돈산을 12-HpETE로 우선적으로 대사시키지만 상당량의 15-HpETE도 생성하는 반면, 마우스 Alox12는 아라키돈산을 거의 12-HpETE로만 대사시킨다.
- Alox15 (백혈구형 12-Lox, 12-Lox-l, 12/15-Lox라고도 함): 인간 ALOX15는 표준 분석 조건에서 아라키돈산을 15-HpETE와 12-HpETE로 약 89:11 비율로 대사시키는 것과 달리, 마우스 Alox15는 아라키돈산을 15-HpETE와 12-HpETE로 약 1:6 비율로 대사시켜 12-HpETE를 주요 대사 산물로 생성한다. 또한, 인간 ALOX15는 아라키돈산보다 리놀레산을 기질로 더 선호하여 13-하이드로퍼옥시옥타데카디에노산(13-HpODE)으로 대사시키는 반면, 마우스 Alox15는 리놀레산에 거의 또는 전혀 활성을 보이지 않는다. Alox15는 인지질 및 콜레스테롤 에스테르에 결합된 다불포화 지방산을 대사시킬 수 있다. 이러한 특성과 아라키돈산을 12-HpETE와 15-HpETE로 모두 대사시키는 이중 특성은 인간 ALOX15와 유사하여 두 효소 모두 12/15-지질산소화효소로 불린다.
- Alox15b (8-지질산소화효소, 8-lox, 15-지질산소화효소 II형이라고도 함): 인간 ALOX15B는 아라키돈산을 주로 15-HpETE로 대사시키고, 리놀레산을 13-HpODE로 덜 대사시키는 반면, 마우스 Alox15b는 아라키돈산을 주로 8''S''-HpETE로, 리놀레산을 9-하이드로퍼옥시옥타데카디에노산(9-HpODE)으로 대사시킨다. Alox15b는 5-HpETE를 류코트리엔으로 대사시키는 데 있어 ALOX5만큼 효과적이다.
- Alox12e (12-Lox-e, 표피형 12-Lox): 인간 ALOX12P 유전자의 동종 유전자이다. 인간 ALOX12P 유전자는 손상된 돌연변이로 인해 발현되지 않는다. 마우스 ALox12e는 비에스테르화된 다불포화 지방산 기질보다 메틸 에스테르 형태를 선호하며, 리놀레산 에스테르를 13-과산화물로, 아라키돈산 에스테르를 12-과산화물로 (더 적은 정도로) 대사시킨다.
- Alox12b (e-LOX2, 표피형 Lox-12): 인간 ALOX12B와 유사하게 작용하는 것으로 보인다. 인간 ALOX12B는 에스테르화된 오메가-하이드록시 지방산(EOS)의 리놀레산 부분을 9''R''-과산화물로 대사시켜 피부의 온전함과 불침투성에 기여한다. Alox12b가 결핍된 마우스는 선천성 어루러기 적색 피부증과 유사한 심각한 피부 결함을 보인다. 인간 ALOX12B는 아라키돈산을 낮은 속도로 12''R''-하이드록시에이코사테트라엔산(12''R''-HETE)으로 대사시킬 수 있지만, 마우스 Alox12b는 유리산 형태의 아라키돈산을 대사시키지 못하고, 아라키돈산 메틸 에스테르만을 12''R''-과산화물로 대사시킨다.
- Aloxe3 (표피형 Lox-3, eLox3): 인간 ALOXE3와 유사하게 작용하는 것으로 보인다. Aloxe3는 EOS의 9''R''-과산화-리놀레산 유도체를 에폭시 및 케토 유도체로 대사시키며 피부의 온전함과 불침투성을 유지하는 데 관여한다. AloxE3 결핍은 선천성 어루러기 적색 피부증과 유사한 결함을 유발한다.
4. 3차원 구조
15-리폭시게네이스 1과 안정화된 5-리폭시게네이스의 상세한 분석을 통해 밝혀진 리폭시게네이스의 3차원 구조는 크게 세 부분으로 나뉜다. 약 15 킬로달톤(kDa) 크기의 N-말단 베타 배럴 도메인, 작은 링커 도메인(약 0.6 kDa), 그리고 효소 활성에 필수적인 비-헴 철을 포함하는 큰 C-말단 촉매 도메인으로 구성된다.[3]
현재까지 여러 종류의 리폭시게네이스 구조가 밝혀졌는데, 여기에는 대두 리폭시게네이스 L1 및 L3, 산호 8-리폭시게네이스, 인간 5-리폭시게네이스, 토끼 15-리폭시게네이스, 돼지 백혈구 12-리폭시게네이스의 촉매 도메인 등이 포함된다. 일반적으로 리폭시게네이스 단백질은 작은 N-말단 PLAT 도메인과 활성 부위를 포함하는 주요 C-말단 촉매 도메인(Pfam 데이터베이스 참조)으로 구성된다.
식물과 포유류 효소 모두 N-말단 도메인은 8개의 가닥으로 이루어진 역평행 베타 배럴 구조를 가지지만, 그 크기는 다를 수 있다. 예를 들어, 대두 리폭시게네이스의 N-말단 도메인은 토끼 효소의 것보다 상당히 크다. 식물 리폭시게네이스의 경우, 효소가 활성을 유지하는 동안 N-말단과 C-말단 도메인이 효소적으로 절단될 수 있으며, 이 두 도메인이 분리되면 촉매 활성을 잃게 된다. C-말단 촉매 도메인은 18개에서 22개의 헬릭스와, N-말단 베타 배럴의 반대쪽 끝에 위치한 1개(토끼 효소) 또는 2개(대두 효소)의 역평행 베타 시트로 구성된다.
참조
[1]
논문
Conformational flexibility in mammalian 15S-lipoxygenase: Reinterpretation of the crystallographic data
2008-02
[2]
논문
Biosynthesis, biological effects, and receptors of hydroxyeicosatetraenoic acids (HETEs) and oxoeicosatetraenoic acids (oxo-ETEs) derived from arachidonic acid
[3]
논문
Mammalian lipoxygenases and their biological relevance
[4]
논문
Advances in Our Understanding of Oxylipins Derived from Dietary PUFAs
[5]
논문
The role of lipoxygenases in pathophysiology; new insights and future perspectives
[6]
논문
Transcellular biosynthesis of eicosanoid lipid mediators
[7]
서적
Oxidative systems for the modification of fatty acids: The Lipoxygenase Pathway
[8]
논문
Arachidonic acid metabolism
[9]
논문
A novel lipoxygenase from rice. Primary structure and specific expression upon incompatible infection with rice blast fungus
[10]
논문
Green leaf volatiles: hydroperoxide lyase pathway of oxylipin metabolism
[11]
논문
The role of lipoxygenases in epidermis
[12]
웹사이트
ALOX5 arachidonate 5-lipoxygenase [Homo sapiens (human)] - Gene - NCBI
https://www.ncbi.nlm[...]
[13]
논문
Lipoxygenase and leukotriene pathways: Biochemistry, biology, and roles in disease
[14]
논문
n-3 Fatty acid supplementation and proresolving mediators of inflammation
http://research-repo[...]
[15]
논문
Roles of resolvins in the resolution of acute inflammation
[16]
논문
Lipoxins and aspirin-triggered lipoxins in resolution of inflammation
[17]
웹사이트
WikiGenes - Collaborative Publishing
https://www.wikigene[...]
2018-04-17
[18]
웹사이트
WikiGenes - Collaborative Publishing
https://www.wikigene[...]
2018-04-17
[19]
논문
The importance of the lipoxygenase-hepoxilin pathway in the mammalian epidermal barrier
[20]
웹사이트
WikiGenes - Collaborative Publishing
https://www.wikigene[...]
2018-04-17
[21]
논문
Development of myeloproliferative disease in 12/15-lipoxygenase deficiency
[22]
논문
12- and 15-lipoxygenases in adipose tissue inflammation
[23]
논문
The three-dimensional structure of an arachidonic acid 15-lipoxygenase
[24]
논문
Conserved histidine residues in soybean lipoxygenase: functional consequences of their replacement
[25]
논문
Crystal structure of 12-lipoxygenase catalytic-domain-inhibitor complex identifies a substrate-binding channel for catalysis.
[26]
논문
Extremely elevated room-temperature kinetic isotope effects quantify the critical role of barrier width in enzymatic C-H activation
[27]
웹사이트
WikiGenes - Collaborative Publishing
https://www.wikigene[...]
2018-04-17
[28]
논문
Conformational flexibility in mammalian 15S-lipoxygenase: Reinterpretation of the crystallographic data
2008-02
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

