히스톤 탈아세틸화효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
히스톤 탈아세틸화효소(HDAC)는 아세틸화된 히스톤에서 아세틸기를 제거하여 유전자 발현을 조절하는 효소이다. HDAC는 서열 상동성 및 도메인 구성에 따라 4개의 클래스로 분류되며, 각 클래스는 다양한 세포 내 위치, 조직 분포, 기질 및 결합 파트너를 갖는다. HDAC는 히스톤 뿐만 아니라 비히스톤 단백질의 아세틸화도 조절하며, 다양한 생물학적 과정에 관여한다. HDAC 억제제는 HDAC의 활성을 억제하여 히스톤 및 비히스톤 단백질의 아세틸화를 증가시키며, 암, 신경퇴행성 질환, 심혈관 질환 등 다양한 질병 치료에 대한 연구가 진행되고 있다.
더 읽어볼만한 페이지
- EC 3.5.1 - 아미도기가수분해효소
아미도기가수분해효소는 효소 활성을 억제하는 효소 억제제에 대한 내용으로, 가역적 및 비가역적 억제제로 구분되며, 의약품 개발 등에 응용된다. - EC 3.5.1 - 유레이스
유레이스는 요소를 암모니아와 이산화탄소로 분해하는 효소로서, 질병 발병과 요소 비료 효율 증진 등에 관여하며, 최초 활성 확인 후 결정화 성공으로 효소가 단백질임이 밝혀졌고, 억제제 연구 및 검출법이 개발되어 농업과 의학 분야에 활용된다.
2. HDAC의 분류
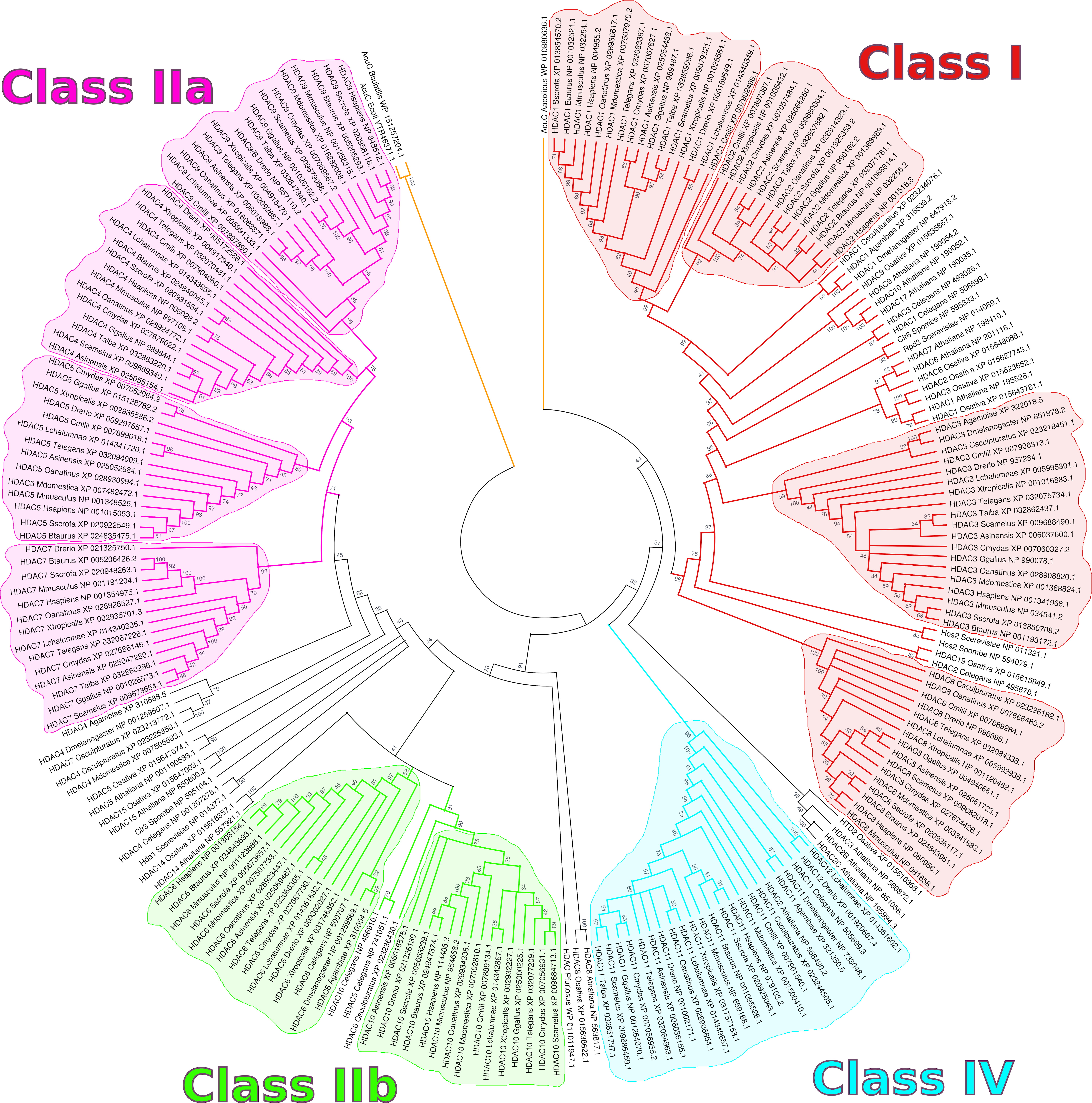
HDAC는 아세틸폴리아민 아미도하이드롤레이스 및 아세토인 활용 단백질과 함께 히스톤 탈아세틸화효소 슈퍼패밀리를 구성한다.[6]
HDAC는 효소의 서열 상동성, 세포 내 위치, 기능 등에 따라 4개의 클래스로 분류된다.[7]
클래스 I, II, IV는 트리코스타틴 A(TSA)에 의해 활성이 억제되는 아연 의존적 활성 부위를 갖는 "고전적인" HDAC로 간주되는 반면, 클래스 III 효소는 사이투인으로 알려진 NAD+ 의존성 단백질 계열이며 TSA의 영향을 받지 않는다.[11]
클래스 I, II, IV HDAC는 아연을 함유하고 있으며 Zn2+ 의존적 히스톤 탈아세틸화효소로 알려져 있다.[9] 이들은 고전적인 아르기나제 폴드를 특징으로 하며 Rossmann 구조로 접히고 NAD+에 의존적인 sirtuins(클래스 III)와 구조적 및 기계적으로 구별된다.[10]
HDAC는 진화 과정에서 보존되어 있으며, 모든 진핵생물과 심지어 고세균에서도 상동성을 보인다. 척추동물, 식물, 절지동물을 포함한 모든 상위 진핵생물은 각 클래스당 최소 하나의 HDAC를 가지고 있으며, 대부분의 척추동물은 11개의 전형적인 HDAC를 가지고 있다. 단, 뼈 물고기는 HDAC2가 없지만 HDAC11의 추가 사본을 가지고 있는 것으로 보이며, 이를 HDAC12라고 한다. 식물은 동물에 비해 추가적인 HDAC를 가지고 있는데, 이는 고착성 생물에 의해 요구되는 보다 복잡한 전사 조절을 수행하기 위한 것으로 추정된다. HDAC는 조상 아세틸 결합 도메인에서 유래한 것으로 보이며, HDAC 상동체는 세균에서 아세토인 활용 단백질(AcuC) 단백질의 형태로 발견되었다.[3]
2. 1. 클래스 I HDAC
HDAC1, HDAC2, HDAC3, HDAC8은 출아 효모의 Rpd3와 상동성을 갖는 히스톤 탈아세틸화효소이다.[47] 이들은 주로 핵에 존재하며, 세포 증식 및 분화 조절에 관여하고 암 발생과도 관련이 깊다.[48] 클래스 I HDAC는 아연(Zn2+) 의존적 효소이다.[9]
2. 2. 클래스 II HDAC
HDAC4, HDAC5, HDAC7, HDAC9, HDAC10을 포함하는 클래스 II 히스톤 탈아세틸화효소(HDAC)는 핵과 세포질을 오가며 특정 신호에 반응하여 유전자 발현을 조절한다.[7] 클래스 II는 IIA와 IIB로 나뉜다. HDAC4, HDAC5, HDAC7, HDAC9는 클래스 IIA에 속하며, HDAC6와 HDAC10은 클래스 IIB에 속한다. 이들은 아연(Zn2+) 의존적 효소이다.[9]클래스 II HDAC는 출아 효모의 Hda1, 분열 효모의 Clr3과 상동성을 갖는다.[47] 핵과 세포질에 존재하며,[47] HDAC4, 5는 골격근, HDAC7은 T세포, HDAC9는 심근의 증식과 분화에 관여한다.[48]
2. 3. 클래스 III HDAC (시르투인)
클래스 III HDAC는 포유류의 SIRT1, SIRT2, SIRT3, SIRT4, SIRT5, SIRT6, SIRT7로 구성되며, 효모의 Sir2와 상동성을 갖는 효소군이다.[47] 이들은 NAD+ 의존적인 sirtuins(클래스 III)와 구조적 및 기계적으로 구별된다.[10] 클래스 III 효소는 NAD+를 조효소로 사용하는 반면, 다른 클래스의 HDAC는 보조 인자로서 Zn2+를 필요로 한다.[13] 아세틸리신의 아세틸기를 NAD의 리보스로 전이시킨다.[47]
2. 4. 클래스 IV HDAC
HDAC11만이 이 클래스에 속하며, 핵과 세포질 모두에 존재한다.[47] 다른 HDAC와의 상동성은 낮지만, 아연(Zn2+) 의존적 효소이다.[47]
HDAC는 I형과 II형으로 나뉜다. I형 HDAC 중 HDAC1, 2, 3은 주로 세포핵에서 발견되는 반면, HDAC8은 세포핵과 세포질 모두에서 발견되며 막과 연관되어 있기도 하다. II형 HDAC(HDAC4, 5, 6, 7, 9, 10)는 다양한 신호에 따라 세포핵 안팎으로 이동할 수 있다.[14][15] HDAC6은 세포질에서 미세소관과 관련된 효소로, 튜불린, Hsp90, 코르탁틴을 탈아세틸화하며, 다른 파트너 단백질과 복합체를 형성하여 다양한 생물학적 과정에 관여한다.[16]
3. HDAC의 기능
HDAC는 교토 유전자 및 게놈 백과사전(KEGG)에 따르면 생체 내에서 다음과 같은 경로에 관여한다.
쥐에 대한 연구에서 HDAC1이 없을 때 특정 마우스 유전자 세트(7%)가 조절되지 않는다는 것이 밝혀졌다.[17] 이 연구는 또한 HDAC1과 HDAC2 사이의 조절 교차 작용을 발견했으며, 전사 보조 활성화 인자로서 HDAC1의 새로운 기능을 시사했다. HDAC1 발현은 조현병 환자의 전전두피질에서 증가하는 것으로 나타났으며, GAD67 mRNA의 발현과 음의 상관관계를 보였다.[18]
HDAC는 세포 내 정보 전달 및 세포 주기 조절에도 관여하며, 최근 암 치료의 표적 분자로 주목받고 있다.[46]
3. 1. 히스톤 변형
히스톤 꼬리는 아민 그룹이 라이신과 아르기닌 아미노산에 존재하기 때문에 일반적으로 양전하를 띤다. 이러한 양전하는 히스톤 꼬리가 DNA 골격의 음전하를 띤 인산기와 상호작용하고 결합하도록 돕는다. 아세틸화는 아민을 아미드로 변경하여 히스톤의 양전하를 중화시키고 히스톤이 DNA에 결합하는 능력을 감소시킨다. 이렇게 감소된 결합은 크로마틴 확장을 허용하여 유전자 전사가 일어나도록 한다. 히스톤 탈아세틸화효소는 이러한 아세틸 그룹을 제거하여 히스톤 꼬리의 양전하를 증가시키고 히스톤과 DNA 골격 사이의 높은 친화도 결합을 촉진한다. 증가된 DNA 결합은 DNA 구조를 응축시켜 전사를 방지한다.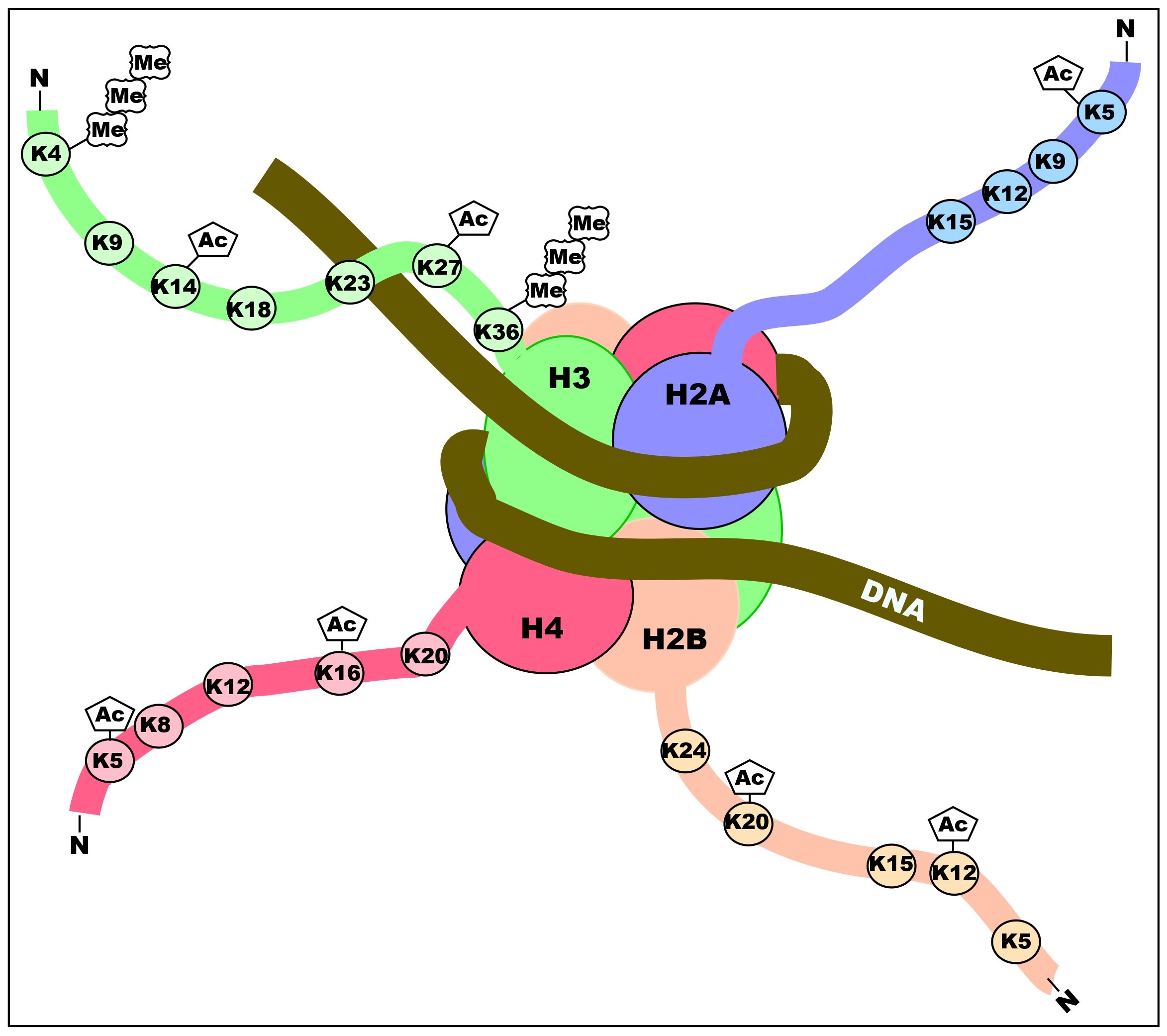
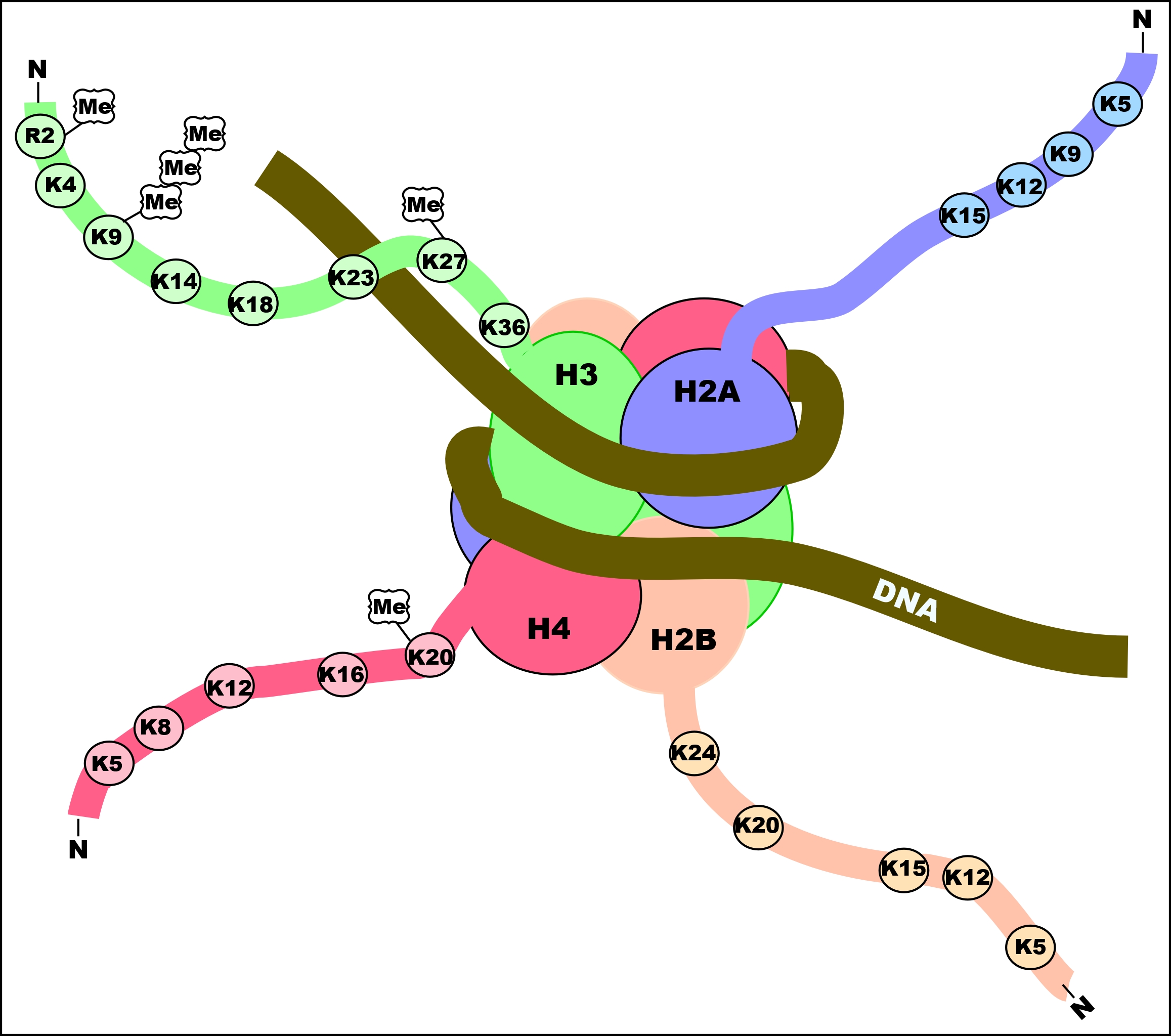
히스톤 아세틸화는 유전자 발현 조절에 중요한 역할을 한다. 과아세틸화된 크로마틴은 전사적으로 활성화되어 있고, 저아세틸화된 크로마틴은 비활성 상태이다. 히스톤은 그 아미노산 배열 중에 리신이나 아르기닌과 같은 염기성 아미노산을 많이 포함하고 있어 보통 양전하를 띠고 있으며, 음전하를 띠고 있는 DNA와의 결합이 용이하다. 세포 내의 히스톤 아세틸기 전이 효소(HAT)에 의해 이루어지는 히스톤 아세틸화는 히스톤 중 특정 리신 잔기의 아미노기 (-NH2)를 아미드 (-NHCOCH3)로 변환함으로써 전하를 중화시켜, 히스톤-DNA 간의 결합을 부분적으로 약화시킨다. 이는 히스톤에 대한 DNA의 감김이 약해진다는 것을 의미하며, 인접한 히스톤-DNA 복합체 (뉴클레오솜)끼리 연결하고 있는 DNA 사슬 (링커 DNA)에 대해 전사 인자나 RNA 중합 효소가 더욱 결합하기 쉬운 상태가 된다. 히스톤 탈아세틸화는 이 아세틸화된 부위를 가수 분해에 의해 제거하고, 원래의 아미노기로 되돌림으로써 히스톤에 대한 DNA의 감김을 강화하고 전사를 억제하는 반응이며, 히스톤 아세틸화와는 반대되는 기전이다.
히스톤에서는 N말단의 리신 잔기가 아세틸화, 탈아세틸화되며, 이것이 유전자 발현의 조절에 관여하고 있다. 히스톤이 다수 아세틸화되어 있는 염색체 영역은 유전자의 전사가 활발하게 이루어지고 있으며, 히스톤의 아세틸화는 유전자 발현을 활성화시키고, 탈아세틸화는 유전자 발현을 억제하는 것으로 생각된다.[44][45] 히스톤은 아세틸화 외에도 인산화나 메틸화에 의한 조절을 받는다.
3. 2. 비히스톤 단백질 변형
HDAC는 히스톤 뿐만 아니라 다양한 비히스톤 단백질의 아세틸화도 조절한다. 전사 인자, 세포 골격 단백질, 신호 전달 단백질 등 다양한 단백질이 HDAC의 기질이 될 수 있다.[19] 비히스톤 단백질의 탈아세틸화는 단백질의 활성, 안정성, 세포 내 위치 등을 변화시켜 세포 기능에 영향을 미친다.
다음은 HDAC의 비히스톤 단백질 변형의 몇 가지 예시이다.
4. HDAC 억제제
히스톤 탈아세틸화효소 억제제(HDIs)는 정신과 및 신경과에서 기분 안정제 및 항간질제로 오랫동안 사용되어 왔으며, 그 예로 '''발프로산'''이 있다. 최근에는 HDIs가 신경퇴행성 질환의 완화 또는 치료제로 연구되고 있다.[27][28][29] 또한 최근 몇 년 동안 암 치료를 위한 HDIs 개발 노력이 있어왔다.[30][31] '''보리노스타트''' (SAHA)는 피부 T세포 림프종 (CTCL) 환자의 피부 증상 치료를 위해 2006년 FDA의 승인을 받았다. 두 번째 HDI인 이스토닥스(로미데프신)는 2009년 CTCL 환자에게 승인되었다. 이 화합물이 작용하는 정확한 메커니즘은 불분명하지만, 후성 유전 경로가 제안된다.[32] 임상 시험에서는 감염된 사람의 잠복 HIV 풀에 대한 발프로산의 효과를 연구하고 있다.[33] HDIs는 현재 시험관 내 시너지 효과를 기반으로 세포 독성 화학 요법 또는 방사선 요법에 대한 화학 감작제 또는 DNA 메틸화 억제제와 연관되어 연구되고 있다.[34] 동형 선택적 HDIs가 개발되었다.[35][36][37][29]
HDAC 억제제는 아세틸화와 관련된 비히스톤 단백질에도 영향을 미친다. HDIs는 이러한 분자의 아세틸화 정도를 변경하여 활성을 증가시키거나 억제할 수 있다. 트리코스타틴 A (TSA)는 비히스톤 단백질에 작용하는 HDAC 효과를 차단한다. HDIs는 ACTR, cMyb, E2F1, EKLF, FEN 1, GATA, HNF-4, HSP90, Ku70, NFκB, PCNA, p53, RB, Runx, SF1 Sp3, STAT, TFIIE, TCF, YY1을 포함한 많은 전사 인자의 활성을 변경하는 것으로 나타났다.[38][39]
케톤체 β-하이드록시부티르산은 생쥐에서 히스톤 탈아세틸화효소 억제를 통해 FOXO3a의 유전자 발현을 증가시키는 것으로 나타났다.[40]
히스톤 탈아세틸화효소 억제제는 일부 바이러스의 잠복기를 조절하여 재활성화를 유발할 수 있다.[41] 이는 예를 들어 잠복 ''사람 헤르페스 바이러스-6'' 감염에서 발생한 것으로 나타났다.
히스톤 탈아세틸화효소 억제제는 특정 ''Plasmodium'' 종 및 단계에 대해 활성을 보여 말라리아 치료에 잠재력이 있을 수 있음을 나타낸다. HDIs가 클래스 I HDAC의 하위 표적인 아세틸화된 H3K9/H3K14를 축적하는 것으로 나타났다.[42]
- - HDAC 저해제는 HAT에 영향을 미치지 않고 HDAC만을 저해한다. 후성 유전적으로 작용하는 약물이다. HDAC 저해제는 히스톤의 아세틸화 항진을 통해 염색질 구조를 이완시키고, 발현이 억제된 유전자의 발현을 촉진시킨다.
- 트리코스타틴 A(Trichostatin A, TSA)
- 낙산(n-Butyrate)
- [https://www.sigmaaldrich.com/JP/ja/product/sigma/a8851 아피시딘](Apicidin)
- 발프로산(valproic acid)
- OBP-801(개발 중)
- 보리노스타트(Vorinostat)
- [https://labchem-wako.fujifilm.com/jp/product/detail/W01MAS122734.html 투바스타틴 A](TubastatinA, TubA)
- 로미뎁신(romidepsin)
- [https://jglobal.jst.go.jp/detail?JGLOBAL_ID=200907097349419630 트라폭신](Trapoxin, TPX)
- 파노비노스타트(Panobinostat)
5. HDAC와 질병
히스톤 탈아세틸화효소(HDAC)는 암, 신경퇴행성 질환(알츠하이머병, 파킨슨병 등), 심혈관 질환, 염증성 질환 등 다양한 질병의 발병 및 진행에 관여한다.
참조
[1]
논문
Structural and functional analysis of the human HDAC4 catalytic domain reveals a regulatory structural zinc-binding domain
2008-09
[2]
논문
Erasers of histone acetylation: the histone deacetylase enzymes
2014-04-01
[3]
논문
Histone Deacetylases (HDACs): Evolution, Specificity, Role in Transcriptional Complexes, and Pharmacological Actionability
2020-05
[4]
논문
Lysine acetylation targets protein complexes and co-regulates major cellular functions
2009-08
[5]
논문
Histone Deacetylases and Mechanisms of Regulation of Gene Expression (Histone deacetylases in cancer)
2015
[6]
논문
Histone deacetylases, acetoin utilization proteins and acetylpolyamine amidohydrolases are members of an ancient protein superfamily
1997-09
[7]
논문
Histone deacetylase inhibitors: overview and perspectives
2007-10
[8]
논문
Nuclear receptor co-repressors are required for the histone-deacetylase activity of HDAC3 in vivo
2013-02
[9]
논문
Histone deacetylase inhibitors: Potential in cancer therapy
2009-07
[10]
논문
Structural and chemical biology of deacetylases for carbohydrates, proteins, small molecules and histones
2018
[11]
논문
Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase
2000-02
[12]
논문
The Rpd3/Hda1 family of lysine deacetylases: from bacteria and yeast to mice and men
2008-03
[13]
논문
Histone deacetylases and cancer
2012-12
[14]
논문
Histone deacetylases (HDACs): characterization of the classical HDAC family
2003-03
[15]
논문
Histone deacetylase 3 localizes to the plasma membrane and is a substrate of Src
2006-07
[16]
논문
HDAC6: a key regulator of cytoskeleton, cell migration and cell-cell interactions
2008-06
[17]
논문
Negative and positive regulation of gene expression by mouse histone deacetylase 1
2006-11
[18]
논문
Histone deactylase 1 expression is increased in the prefrontal cortex of schizophrenia subjects: analysis of the National Brain Databank microarray collection
2008-01
[19]
논문
Acetylation and deacetylation of non-histone proteins
2005-12
[20]
논문
Role of the aggresome pathway in cancer: targeting histone deacetylase 6-dependent protein degradation
2008-04
[21]
논문
Comment on: Winkler et al. Histone deacetylase 6 (HDAC6) is an essential modifier of glucocorticoid-induced hepatic gluconeogenesis. Diabetes 2012;61:513-523
2012-07
[22]
논문
PTEN acetylation modulates its interaction with PDZ domain
2008-09
[23]
논문
Hepatic insulin resistance induced by prenatal alcohol exposure is associated with reduced PTEN and TRB3 acetylation in adult rat offspring
2008-06
[24]
논문
Role of acetylated human AP-endonuclease (APE1/Ref-1) in regulation of the parathyroid hormone gene
2003-12
[25]
논문
APE1/Ref-1 regulates PTEN expression mediated by Egr-1
2008-01
[26]
논문
Ubiquitination, phosphorylation, and acetylation--triple threat in muscle wasting
2007-12
[27]
논문
Histone deacetylase inhibitors: possible implications for neurodegenerative disorders
2008-02
[28]
웹사이트
Scientists 'reverse' memory loss
http://news.bbc.co.u[...]
2007-07-08
[29]
논문
Identification of mercaptoacetamide-based HDAC6 inhibitors ''via'' a lean inhibitor strategy: screening, synthesis, and biological evaluation
https://biblio.ugent[...]
2022-05
[30]
논문
Macrocyclic histone deacetylase inhibitors
[31]
논문
Histone deacetylase inhibitors
2003-11
[32]
논문
Histone deacetylase inhibitors for epigenetic therapy of cancer
2007-04
[33]
웹사이트
Depletion of Latent HIV in CD4 Cells - Full Text View - ClinicalTrials.gov
http://www.clinicalt[...]
[34]
논문
Histone deacetylase inhibitors as anti-neoplastic agents
2009-08
[35]
논문
3-Hydroxypyridin-2-thione as novel zinc binding group for selective histone deacetylase inhibition
2013-05
[36]
논문
Non-peptide macrocyclic histone deacetylase inhibitors derived from tricyclic ketolide skeleton
2010-08
[37]
논문
Rational design and simple chemistry yield a superior, neuroprotective HDAC6 inhibitor, tubastatin A
2010-08
[38]
논문
Clinical development of histone deacetylase inhibitors as anticancer agents
[39]
논문
HATs and HDACs: from structure, function and regulation to novel strategies for therapy and prevention
2007-08
[40]
논문
Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor
2013-01
[41]
논문
The molecular biology of human herpesvirus-6 latency and telomere integration
2011-08
[42]
논문
SAHAquines, Novel Hybrids Based on SAHA and Primaquine Motifs, as Potential Cytostatic and Antiplasmodial Agents
2018-08
[43]
간행물
Cancer genetics of epigenetic genes.
[44]
웹사이트
アーカイブされたコピー
http://www.cyclex.co[...]
2011-06-14
[45]
웹사이트
アーカイブされたコピー
http://pharm.life-bi[...]
2011-06-14
[46]
간행물
Epigenetic control using natural products and synthetic molecules.
[47]
논문
抗がん剤のmolecular targeting
[48]
논문
がんの分子標的治療
[49]
논문
Structural and functional analysis of the human HDAC4 catalytic domain reveals a regulatory structural zinc-binding domain
2008-09
[50]
논문
Histone Deacetylases (HDACs): Evolution, Specificity, Role in Transcriptional Complexes, and Pharmacological Actionability
2020-05
[51]
논문
Lysine acetylation targets protein complexes and co-regulates major cellular functions
2009-08
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com