크립톤
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
크립톤은 1898년 윌리엄 램지와 모리스 트래버스에 의해 발견된 무색, 무취의 비활성 기체이다. 크립톤은 액체 공기에서 분리하여 얻으며, 1960년부터 1983년까지 미터의 정의에 사용되기도 했다. 현재는 조명, 레이저, 의료 영상 등 다양한 분야에서 활용되며, 특히 크립톤 플루오르화물 레이저는 핵융합 연구에 중요한 역할을 한다.
더 읽어볼만한 페이지
- 비활성 기체 - 라돈
라돈은 무색, 무미, 무취의 방사성 기체로, 폐암의 주요 원인이며, 토양, 암석, 건축 자재에서 발생하여 건물 내부에 축적될 수 있다. - 비활성 기체 - 오가네손
오가네손은 2002년 유리 오가네시안 연구팀이 합성하여 2015년 공식적으로 발견이 인정된 원자 번호 118번의 초중원소로, 불안정하며 짧은 반감기를 가지고 주기율표상 라돈 아래에 위치하는 비활성 기체로 예측되지만 상대론적 효과로 높은 반응성을 가질 가능성도 있다. - 전형 원소 - 칼륨
칼륨은 은백색의 무른 알칼리 금속으로 반응성이 매우 높고 생물학적으로 중요한 전해질이며, 비료 생산을 비롯한 다양한 산업 분야에서 활용되지만 물과의 격렬한 반응 및 폭발성 과산화물 생성 가능성으로 취급 시 주의가 필요하며, 자연계에 세 가지 동위원소로 존재한다. - 전형 원소 - 인듐
인듐은 은백색의 무른 금속 원소로, 낮은 경도와 뛰어난 전연성을 가지며, LCD 투명 전극, 반도체, 태양전지 등 다양한 산업 분야에서 사용되는 아연 광석의 부산물이다. - 원소 정보 - 토륨
토륨은 은백색의 방사성 악티늄족 금속 원소로, 높은 녹는점과 끓는점을 가지며 지구 지각에 풍부하게 존재하고 핵연료로서의 잠재력을 지니지만, 방사능으로 인해 사용이 감소하고 있다. - 원소 정보 - 아연
아연은 청회색 금속으로, 적당한 반응성을 지닌 환원제이며, 내식성이 뛰어나 도금에 사용되고, 합금의 주요 성분이며, 인체 필수 미량 원소이지만 과다 섭취 시 독성을 나타낸다.
2. 역사
크립톤은 1898년 윌리엄 램지와 모리스 트래버스가 액체 공기에서 거의 모든 성분을 증발시키고 남은 잔류물을 조사하던 중 발견하였다. 몇 주 후에는 같은 방법으로 네온도 발견하였다.[1] 램지는 크립톤을 포함한 희귀 기체를 발견한 공로로 1904년 노벨 화학상을 수상하였다.[2]
1960년 국제도량형국은 미터를 크립톤-86의 동위 원소에서 방출되는 빛의 파장 1,650,763.73개로 정의했다.[3][4] 이는 세브르에 있는 금속 막대였던 1889년 국제 미터 원기를 대체했다. 크립톤-86 정의는 1983년 10월 회의까지 유지되었으며, 이 회의에서 미터는 진공에서 빛이 1/299,792,458초 동안 이동하는 거리로 재정의되었다.[6][7][8]
2. 1. 발견
윌리엄 램지와 모리스 트래버스는 1898년 영국에서 액화된 공기의 거의 모든 성분을 증류시키고 남은 잔류물을 조사하던 중 크립톤을 발견하였다. 몇 주 후에는 같은 방법으로 네온도 발견하였다.[1] 램지는 크립톤을 포함해 비활성 기체들을 발견한 공로로 1904년 노벨 화학상을 수상하였다.[2]
1960년 국제도량형국은 크립톤-86 동위 원소에서 나오는 빛의 파장(605.78nm)을 기준으로 1미터의 길이를 정의하는 국제적인 합의를 하였다.[3][4] 그 결과 이전까지 사용되던 백금과 이리듐의 합금으로 만든 국제 미터 원기는 더 이상 사용되지 않게 되었다. 이후 광속을 기준으로 미터를 다시 정의하면서 이 방법은 1983년 10월 이후로 더 이상 사용하지 않는다.[6][7][8]
2. 2. 명칭 유래
아르곤에 가려 발견되지 않아 그리스어로 "숨겨진"(κρυπτός|크립토스grc)에서 이름이 유래되었다.2. 3. 미터법 정의
1960년, 국제도량형국은 1미터를 크립톤-86 동위 원소에서 2p10과 5d5 준위 사이의 전이에 해당하는 진공 상태에서 방출되는 빛의 파장 1,650,763.73개로 정의했다.[3][4] 이 합의는 세브르에 있는 금속 막대였던 1889년 국제 미터 원기를 대체했다. 이는 또한 빨간 카드뮴 스펙트럼 선을 기반으로 한 1927년 옹스트롬의 정의를 폐기하고 1 Å = 10−10 m으로 대체했다.[5] 크립톤-86 정의는 1983년 10월 회의까지 유지되었으며, 이 회의에서 미터는 진공에서 빛이 1/299,792,458초 동안 이동하는 거리로 재정의되었다.[6][7][8]3. 특성
크립톤은 다른 비활성 기체들처럼 화학 반응성이 매우 낮다. 그러나 1962년 인공적으로 제논 화합물이 생성되었고, 1963년에는 극한 조건에서 이플루오린화 크립톤(KrF2)이 합성되었다. 같은 해 사플루오린화 크립톤이 보고되었으나 이는 착각으로 드러났다. 현재는 이 화합물 이외에도 극저온에서 각종 크립톤 화합물을 생성하려는 시도가 이어지고 있다.
극저온에서 만들어지는 고체 크립톤은 흰색이며, 헬륨을 제외한 모든 비활성 기체들처럼 면심 입방정계 구조를 가진다.[11] 대기 중에는 1.14 ppm의 비율로 포함되어 있으며, 공기를 액화, 분별 증류하여 얻을 수 있다. 비활성이지만 플루오린과는 산화수 +2의 불안정한 화합물을 만든다. 또한, 물, 히드로퀴논과는 포접화합물을 만든다.
3. 1. 물리적 특성
크립톤은 여러 개의 선 스펙트럼 띠를 나타내며 그 중 녹색과 노란색 계열에서 가장 선명하다.[9] 크립톤은 우라늄 핵분열의 생성물 중 하나이다.[10]상온, 상압에서는 무색, 무취의 기체이다. 녹는점은 -157.2 ℃, 끓는점은 -152.9 ℃(-153.4 ℃)이며, 비중은 2.82(-157 ℃)이다. 무거운 기체이기 때문에 흡입하면 목소리가 낮아진다.
극저온에서 만들어지는 고체 크립톤은 흰색으로, 헬륨을 제외한 모든 비활성 기체들처럼 면심 입방정계 구조를 가진다.[11]
3. 2. 화학적 특성
크립톤은 다른 비활성 기체들처럼 화학 반응성이 매우 낮다. 그러나 1962년 인공적으로 제논 화합물이 생성된 후, 1963년에는 극한 조건에서 이플루오린화 크립톤(KrF2)이 합성되었다.[16] 같은 해 사플루오린화 크립톤이 보고되었으나 이는 착각으로 드러났다.[17][18] 현재는 이 화합물 이외에도 극저온에서 다양한 크립톤 화합물을 생성하려는 시도가 이어지고 있다.+2 산화 상태의 크립톤의 제한적인 화학적 성질은 인접 원소인 브롬(Bromine)의 +1 산화 상태와 유사하다.[16] 스칸듐 수축(Scandide contraction)으로 인해 4p 원소를 그룹 산화 상태로 산화시키기 어렵다.
극한 조건에서 크립톤은 불소와 반응하여 KrF2를 형성한다. 반응식은 다음과 같다.
:
크립톤 플루오라이드 레이저(Krypton fluoride laser)의 크립톤 기체는 에너지원으로부터 에너지를 흡수하여 크립톤이 불소 기체와 반응하여 여기 상태의 일시적인 착물인 크립톤 플루오라이드 엑시플렉스(exciplex)를 생성한다.[19]
:
이 착물은 자발적 또는 유도 방출을 일으켜 에너지 상태를 준안정하지만 높은 반발성 기저 상태로 감소시킨다. 기저 상태의 착물은 빠르게 비결합 원자로 해리된다.
:
결과적으로 엑시플렉스 레이저가 생성되어 248 nm의 파장에서 자외선(Ultraviolet) 영역에 가까운 스펙트럼(Spectrum)의 에너지를 방출하며, 이는 착물의 기저 상태와 여기 상태 사이의 에너지 차이에 해당한다.[20]

불소(Fluorine) 이외의 원자에 결합된 크립톤 화합물도 발견되었다. 크립톤 옥소산(oxoacid)의 바륨(Barium) 염에 대한 검증되지 않은 보고서도 있다.[21] ArKr+ 및 KrH+ 다원자 이온(polyatomic ions)이 연구되었으며 KrXe 또는 KrXe+에 대한 증거가 있다.[22]
와 의 반응은 크립톤-산소(Oxygen) 결합을 포함하는 불안정한 화합물 를 생성한다. 크립톤-질소(Nitrogen) 결합은 -50 °C 이하에서 와 [HC≡NH]+[AsF6]−의 반응에 의해 생성된 양이온(Cation) [HC≡N–Kr–F]+에서 발견된다.[23][24] HKrCN과 HKrC≡CH(크립톤 수소화물-시아나이드 및 하이드로크립토아세틸렌)는 40 K까지 안정한 것으로 보고되었다.[16]
크립톤 수소화물(Hydride) (Kr(H2)4) 결정은 5 GPa 이상의 압력에서 성장할 수 있다. 이들은 크립톤 팔면체가 무작위로 배향된 수소 분자로 둘러싸인 면심입방 구조를 가지고 있다.[25]
3. 3. 스펙트럼
크립톤은 여러 개의 선 스펙트럼 띠를 나타내며 그 중 녹색과 노란색 계열에서 가장 선명하다.[9]4. 동위 원소
자연에 존재하는 크립톤에는 여섯 종류의 동위 원소가 존재하고 30여 개의 불안정한 방사성 동위 원소와 핵 이성질체가 존재한다. 크립톤-81은 액체 공기를 분별 증류하여 크립톤을 얻는 과정에서 함께 얻어지는 방사성 동위 원소로 반감기가 약 23만 년이다. 5만~80만 년 정도 된 지하수의 연대를 측정하는데 사용된다.[14] 크립톤-85는 반감기가 10.76년인 방사성 비활성 기체이다. 핵실험이나 원자로 등에서 우라늄과 플루토늄의 핵분열로 인해 생성되는 부산물이다. 원자로 제어봉을 재처리하는 과정에서 발생된다.[15]
지구 대기 중에는 5가지 안정된 동위원소와 매우 긴 반감기(9.2×1021년)를 가지고 있어 안정적인 것으로 간주될 수 있는 하나의 동위원소(78Kr)가 존재한다. 이 동위원소는 붕괴가 관측된 모든 동위원소 중 세 번째로 긴 반감기를 가지고 있으며, 이중전자포획을 통해 78Se로 붕괴된다.[12] 또한 약 30가지의 불안정한 동위원소와 핵이성체가 알려져 있다.[13] 81Kr은 80Kr의 우주선 조사에 의해 생성되는 우주선 생성 핵종으로, 자연적으로 미량 존재한다. 이 동위원소는 23만 년의 반감기를 가진 방사성 동위원소이다. 크립톤은 휘발성이 매우 높아 지표면 근처의 물에 용해되어 있지 않지만, 81Kr은 오래된 (5만 년~80만 년) 지하수의 연대 측정에 사용되었다.[14]
5. 존재
지구는 생성 당시 존재했던 모든 비활성 기체를 헬륨을 제외하고는 보유하고 있다. 지구 대기 중 크립톤의 농도는 약 1 ppm이다. 크립톤은 분별 증류를 통해 액체 공기에서 추출할 수 있다.[26] 우주 공간의 크립톤 양은 불확실한데, 그 이유는 측정이 유성 활동과 태양풍에 의존하기 때문이다. 초기 측정 결과에 따르면 우주 공간에 크립톤이 풍부한 것으로 나타났다.[27]
6. 화합물
크립톤은 다른 비활성 기체들처럼 화학 반응성이 매우 낮다. 그러나 1962년 인공적으로 제논 화합물이 생성된 후, 1963년에는 극한 조건에서 이플루오르화크립톤(KrF2)이 합성되었다.[16] 같은 해 사플루오린화 크립톤이 보고되었으나[17] 이는 착각으로 드러났다.[18]
극한 조건에서 크립톤은 불소와 반응하여 다음 반응식에 따라 KrF2를 형성한다.
:
크립톤 플루오라이드 레이저에서 크립톤 기체는 에너지원으로부터 에너지를 흡수하여, 불소 기체와 반응해 여기 상태의 일시적인 착물인 크립톤 플루오라이드 엑시플렉스(exciplex)를 생성한다.[19]
:
이 착물은 자발적 또는 유도 방출을 일으켜 에너지 상태를 준안정하지만 높은 반발성 기저 상태로 감소시킨다. 기저 상태의 착물은 빠르게 비결합 원자로 해리된다.
:
결과적으로 엑시플렉스 레이저가 생성되어 248 nm의 파장에서 자외선 영역에 가까운 스펙트럼의 에너지를 방출하며, 이는 착물의 기저 상태와 여기 상태 사이의 에너지 차이에 해당한다.[20]
불소 이외의 원자에 결합된 크립톤 화합물도 발견되었다. 크립톤 옥소산의 바륨 염에 대한 검증되지 않은 보고서도 있다.[21] ArKr+ 및 KrH+ 다원자 이온이 연구되었으며 KrXe 또는 KrXe+에 대한 증거가 있다.[22]
와 의 반응은 크립톤-산소 결합을 포함하는 불안정한 화합물 를 생성한다. 크립톤-질소 결합은 -50 °C 이하에서 와 [HC≡NH]+[AsF6]−의 반응에 의해 생성된 양이온 [HC≡N–Kr–F]+에서 발견된다.[23][24] HKrCN과 HKrC≡CH(크립톤 수소화물-시아나이드 및 하이드로크립토아세틸렌)는 40 K까지 안정한 것으로 보고되었다.[16]
크립톤 수소화물(Kr(H2)4) 결정은 5 GPa 이상의 압력에서 성장할 수 있다. 이들은 크립톤 팔면체가 무작위로 배향된 수소 분자로 둘러싸인 면심 입방정계 구조를 가지고 있다.[25]
7. 용도
크립톤은 다양한 분야에서 활용된다.
- 조명 및 레이저: 형광등, 백열등, 네온사인, 레이저 등에 사용된다. 자세한 내용은 #조명 및 #레이저 하위 섹션을 참조.
- 핵융합 연구: 크립톤 플루오르화물 레이저는 핵융합 에너지 연구에 사용된다.[32]
- 입자 물리학: 액체 크립톤은 칼로리미터를 구성하는 데 사용된다. CERN의 NA48 실험이 대표적인 예시이다.
- 의학: 크립톤-83은 자기 공명 영상(MRI) 촬영에, 준안정 동위원소인 크립톤-81m은 폐 환기/관류 스캔에 사용된다.[33][35]
- 핵연료 재처리 시설 탐지: 대기 중 크립톤-85는 북한[36]과 파키스탄[37]의 비밀 핵연료 재처리 시설을 탐지하는 데 사용되었다.
- 기타: 크립톤은 창유리 사이의 절연 가스나 스페이스X 스타링크의 전기 추진 시스템의 추진제로 사용된다.[39][40] 비활성 기체인 크립톤은 백열전구에 넣어 필라멘트의 승화를 방지하는 크립톤 램프로도 활용된다. 1960년부터 1983년까지는 크립톤의 스펙트럼을 미터의 기준으로 사용했다.[46] 크립톤 가스를 들이마신 후 소리를 내면 헬륨 가스와 반대로 목소리가 낮아지지만, 순수한 크립톤 가스를 흡입하면 저산소증을 유발할 수 있으므로 주의해야 한다. 크립톤을 방전으로 여기시키면 독특한 푸른빛의 스펙트럼 광이 방출된다.
7. 1. 조명
크립톤은 여러 개의 선 스펙트럼을 가지고 있어 이온화되면 흰 빛을 낸다. 이러한 성질은 밝은 백색 조명이 필요한 사진술에서 크립톤 전구를 활용하는데 사용된다.[28] 크립톤을 다른 기체와 혼합하면 황록색 빛을 낼 수 있다.아르곤과 크립톤 혼합 기체는 형광등에 사용되어 에너지 효율을 높이지만, 빛의 밝기가 약하고 가격이 비싸다는 단점이 있다.[29] 제논과 크립톤 혼합 기체는 백열등에 넣어 필라멘트 증발을 억제하고, 더 밝고 파란색 계열의 빛을 내도록 한다.[30]
크립톤의 백색광은 네온사인에서 원하는 색을 만드는 데 유용하며, 붉은색 영역에서는 네온보다 강한 빛을 내 강력한 붉은색 레이저가 필요한 경우 헬륨-네온 레이저 대신 크립톤 레이저를 사용한다.[31]
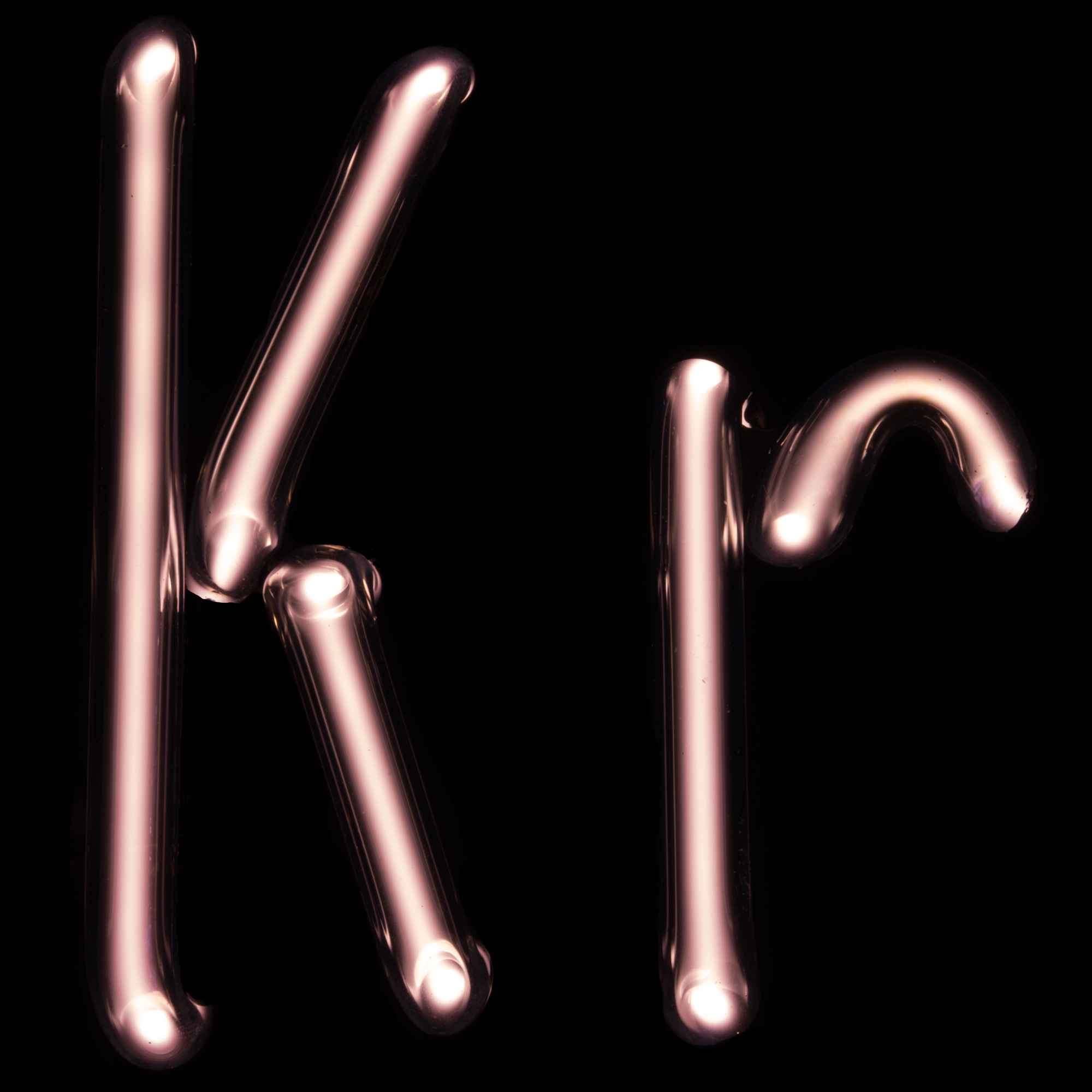
7. 2. 레이저
크립톤은 여러 개의 선 스펙트럼을 가지고 있어 이온화되면 흰 빛을 낸다. 이러한 성질은 크립톤 전구에 응용되어 밝은 백색 조명을 제공하며, 주로 사진술에 사용된다. 크립톤을 다른 기체와 혼합하여 전등에 사용하면 황록색 빛을 낼 수 있다. 크립톤은 스펙트럼의 붉은색 영역에서 네온보다 강한 붉은 빛을 내기 때문에, 강력한 붉은색 레이저가 필요할 때는 헬륨-네온 레이저 대신 크립톤 레이저를 사용한다.[31]7. 3. 기타
크립톤은 여러 개의 선 스펙트럼을 가지고 있어 이온화되면 흰 빛을 낸다. 이러한 성질은 밝은 백색 조명이 필요한 사진술에 사용되는 크립톤 전구에 응용된다. 크립톤을 다른 기체와 혼합하여 전등에 사용하면 황록색 빛을 낼 수도 있다.[28]아르곤과 크립톤을 혼합한 기체는 에너지 효율이 좋은 형광등의 충전재로 사용된다. 이는 전력 소모가 적다는 장점이 있지만, 빛의 방출량이 적고 가격이 비싸다는 단점이 있다.[29] 크립톤과 제논을 혼합한 기체는 백열등에 넣어 필라멘트의 증발을 억제하기도 한다.[30] 이 경우 일반적인 백열등보다 더 밝고 파란색 계통의 빛을 더 많이 방출한다.
크립톤의 백색광은 네온사인 등에 사용되어 원하는 색을 만드는 데 유용하다. 또한 스펙트럼의 붉은색 영역에서는 네온보다 더 강한 붉은 빛을 내기 때문에 강력한 붉은색 레이저가 필요할 때는 헬륨-네온 레이저 대신 크립톤 레이저를 사용한다.[31]
크립톤 플루오르화물 레이저는 핵융합 에너지 연구에서 밀폐 실험에 중요한 역할을 한다. 이 레이저는 빔 균일성이 높고 파장이 짧으며, 스팟 크기를 조절하여 내폭 펠릿을 추적할 수 있다.[32]
실험 입자 물리학에서는 액체 크립톤을 사용하여 준균질 전자기 칼로리미터를 구성한다. 대표적인 예로 약 27톤의 액체 크립톤을 포함하는 CERN의 NA48 실험의 칼로리미터가 있다.
크립톤-83은 자기 공명 영상(MRI)을 이용한 기도 영상화에 활용된다. 특히 방사선과에서 기도의 소수성 표면과 친수성 표면을 구별하는 데 도움을 준다.[33]
준안정 동위원소인 크립톤-81m은 흡입 후 감마 카메라로 촬영하는 폐 환기/관류 스캔에 사용되는 핵의학 물질이다.[35] 대기 중 크립톤-85는 북한[36]과 파키스탄[37]의 비밀 핵연료 재처리 시설을 탐지하는 데 사용되었다.
크립톤은 창유리 사이의 절연 가스로 사용되기도 한다.[39] 스페이스X의 스타링크는 전기 추진 시스템의 추진제로 크립톤을 사용한다.[40]
비활성 기체인 크립톤은 백열전구에 넣어 필라멘트의 승화를 방지하는 데 사용되며, 이를 크립톤 램프라고 부른다.
1960년부터 1983년까지는 크립톤의 스펙트럼을 미터의 기준으로 사용했다.[46]
크립톤 가스를 들이마신 후 소리를 내면 헬륨 가스와 반대로 목소리가 낮아진다. 하지만 순수한 크립톤 가스를 들이마시는 것은 산소 부족을 유발할 수 있으므로 주의해야 한다.
크립톤을 방전시켜 여기시키면 독특한 푸른빛의 스펙트럼 광이 방출된다. 이 빛은 사진 플래시에 이용되거나 필터를 통해 다양한 색으로 분리되어 사용되기도 한다.
8. 주의사항
크립톤은 인체에 무해하나 공기 중에 다량 있으면 질식을 일으킬 수 있으므로 주의해야 한다. 크립톤은 무독성 질식성 기체로 간주된다.[41] 지용성인 크립톤은 상당한 마취 효과를 가지고 있다. 마취력은 공기보다 7배 더 크며, 50% 크립톤과 50%의 자연 공기를 혼합하여 흡입하면 대기압의 4배에서 공기를 흡입하는 것과 유사한 마취가 발생한다. 이는 30m 깊이의 스쿠버 다이빙과 비슷하며, 크립톤을 흡입하는 사람에게 영향을 미칠 수 있다.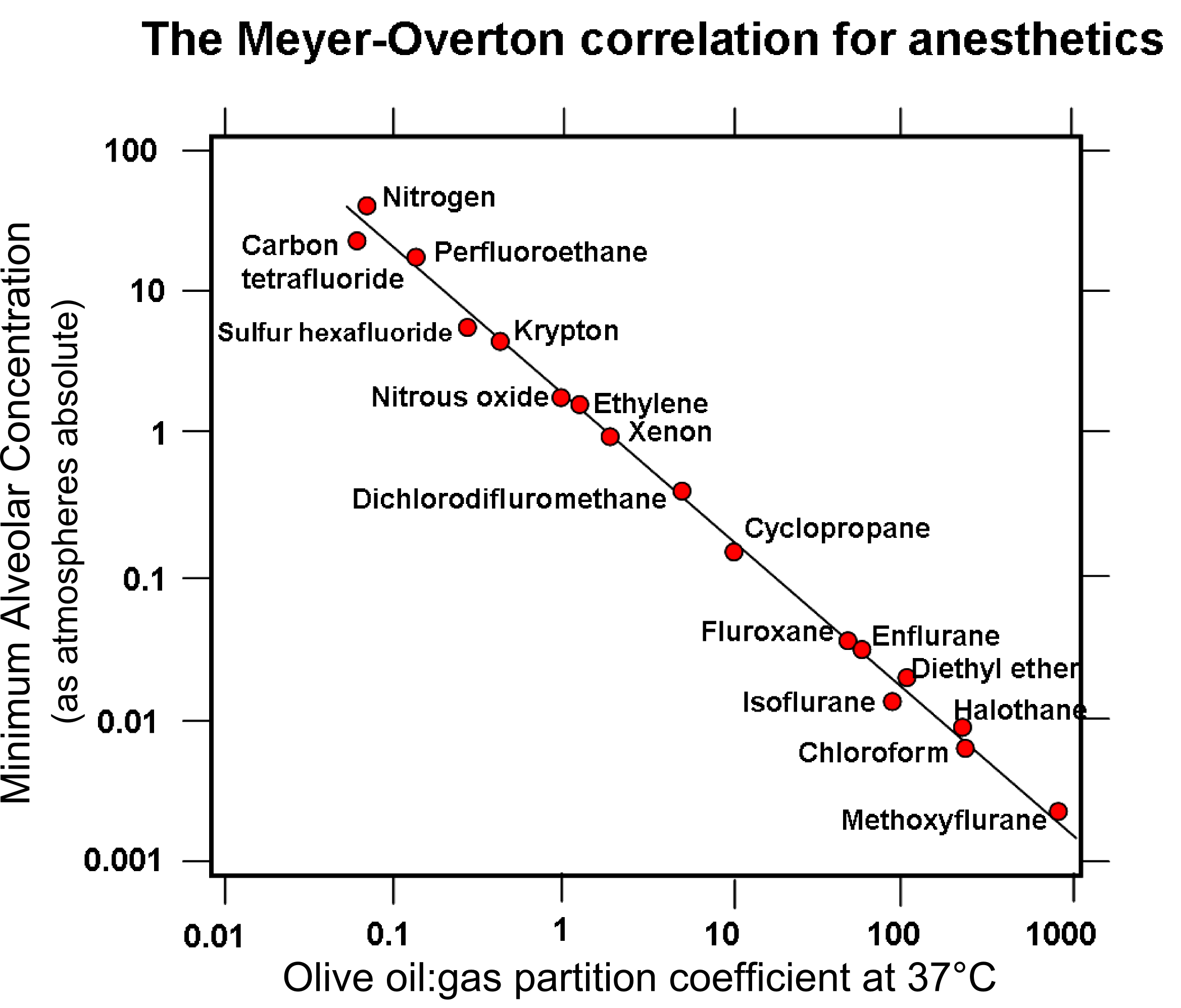
참조
[1]
논문
On a New Constituent of Atmospheric Air
1898-01-01
[2]
논문
Sir William Ramsay and the Noble Gases
2012-03-01
[3]
웹사이트
The BIPM and the evolution of the definition of the metre
http://www.bipm.org/[...]
Bureau International des Poids et Mesures
2014-07-26
[4]
웹사이트
Time Line for the Definition of the Meter
https://www.nist.gov[...]
National Institute of Standards and Technology
2009-01-08
[5]
논문
On the new determination of the meter
1958-01-01
[6]
서적
The uncertainty of measurements: physical and chemical metrology: impact and analysis
https://books.google[...]
American Society for Quality
2002-01-01
[7]
웹사이트
How is the speed of light measured?
http://math.ucr.edu/[...]
Department of Mathematics, University of California
1997-01-01
[8]
웹사이트
Unit of length (meter)
http://physics.nist.[...]
NIST
[9]
웹사이트
Spectra of Gas Discharges
http://astro.u-stras[...]
[10]
웹사이트
Krypton
http://www.ead.anl.g[...]
Argonne National Laboratory, EVS
2005-01-01
[11]
논문
The crystal structure of the noble gases
https://aip.scitatio[...]
1981-08-15
[12]
논문
Indications of 2ν2K capture in 78Kr
2013-03-04
[13]
서적
CRC Handbook of Chemistry and Physics
CRC Press
[14]
웹사이트
Development of Laser-Based Resonance Ionization Techniques for 81-Kr and 85-Kr Measurements in the Geosciences
https://digital.libr[...]
University of Tennessee, Institute for Rare Isotope Measurements
2001-02-05
[15]
웹사이트
Resources on Isotopes
http://wwwrcamnl.wr.[...]
U.S. Geological Survey
[16]
웹사이트
The Noble Gases
http://pubs.acs.org/[...]
Chemical & Engineering News
2003-01-01
[17]
논문
Krypton Tetrafluoride: Preparation and Some Properties
[18]
논문
Krypton difluoride
[19]
논문
Physics of the krypton fluoride laser
1980-05-01
[20]
논문
High-order harmonics of 248.6-nm KrF laser from helium and neon ions
https://link.aps.org[...]
1996-01-01
[21]
논문
Acid of Krypton and Its Barium Salt
[22]
웹사이트
Periodic Table of the Elements
http://www.bu.edu/eh[...]
Los Alamos National Laboratory's Chemistry Division
[23]
서적
Advances in Inorganic Chemistry
https://archive.org/[...]
Academic Press
1998-01-01
[24]
서적
Modeling Marvels: Computational Anticipation of Novel Molecules
https://books.google[...]
Springer
2008-01-01
[25]
논문
New high-pressure van der Waals compound Kr(H2)4 discovered in the krypton-hydrogen binary system
[26]
웹사이트
How Products are Made: Krypton
http://www.madehow.c[...]
[27]
논문
The Abundance of Interstellar Krypton
[28]
웹사이트
Mercury in Lighting
http://www.capecodex[...]
Cape Cod Cooperative Extension
[29]
웹사이트
Lighting: Full-Size Fluorescent Lamps
https://web.archive.[...]
McGraw-Hill Companies, Inc.
2002-01-01
[30]
웹사이트
Properties, Applications and Uses of the "Rare Gases" Neon, Krypton and Xenon
http://www.uigi.com/[...]
Uigi.com
2015-11-30
[31]
웹사이트
Laser Devices, Laser Shows and Effect
http://www.gameops.c[...]
[32]
웹사이트
Krypton Fluoride Laser Development for Inertial Fusion Energy
http://aries.ucsd.ed[...]
Plasma Physics Division, Naval Research Laboratory
[33]
논문
Hyperpolarized krypton-83 as a contrast agent for magnetic resonance imaging
2005-01-01
[34]
논문
Effect of low-xenon and krypton supplementation on signal/noise of regional CT-based ventilation measurements
2007-01-01
[35]
논문
EANM guidelines for ventilation/perfusion scintigraphy
2009-06-27
[36]
뉴스
N. Korea may be hiding new nuclear site
http://www.highbeam.[...]
2003-07-20
[37]
뉴스
U.S. Intelligence Find Evidence of Pakistan Producing Nuclear Weapons, CBS
http://www.highbeam.[...]
2000-03-16
[38]
논문
Krypton-85 in the atmosphere 1950–1977: a data review
https://dx.doi.org/1[...]
1979-01-01
[39]
웹사이트
Insulated Windows 101 — Double Glazing, Triple Glazing, Thermal Performance, & Potential Problems
https://cleantechnic[...]
2018-04-28
[40]
웹사이트
Starlink Mission
https://www.youtube.[...]
2019-05-23
[41]
웹사이트
Properties of Krypton
http://pt.chemicalst[...]
[42]
논문
Anaesthesia and the 'Inert' Gases with Special Reference to Xenon
1992-02-01
[43]
웹사이트
http://encyclopedia.[...]
[44]
서적
CRC Handbook of Chemistry and Physics
CRC Press
2005
[45]
서적
Magnetic susceptibility of the elements and inorganic compounds
http://www-d0.fnal.g[...]
CRC press
[46]
서적
最新図解元素のすべてがわかる本
ナツメ社
2011-12-06
[47]
서적
元素111の新知識
講談社
1998
[48]
서적
Magnetic susceptibility of the elements and inorganic compounds
http://www-d0.fnal.g[...]
CRC press
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

