사이클로알케인
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
사이클로알케인은 탄소 원자가 고리를 이루는 포화 탄화수소로, 알케인과 유사한 명명법을 따르며, 고리 구조의 탄소 수에 따라 이름이 정해진다. 사이클로알케인은 석유 산업에서 나프텐이라고도 불리며, 알케인보다 높은 끓는점, 녹는점, 밀도를 갖는다. 고리 변형으로 인해 안정성에 차이가 있으며, 특히 작은 고리일수록 반응성이 높다. 사이클로알케인의 합성은 다양한 유기 반응을 통해 이루어지며, 석유에서 얻거나 불포화 화합물의 수소화 반응으로 생성하기도 한다. 주요 사이클로알케인으로는 사이클로프로페인, 사이클로뷰테인, 사이클로펜테인, 사이클로헥세인 등이 있다.
더 읽어볼만한 페이지
- 사이클로알케인 - 사이클로펜테인
사이클로펜테인은 촉매 개질을 통해 생성되는 사이클로알케인으로, 폴리우레탄 폼 발포제, 냉장고 단열재, 화학 합성 등에 사용되며, 인화성이 매우 높고 흡입 시 호흡 정지를 유발할 수 있다. - 사이클로알케인 - 사이클로헥세인
사이클로헥세인은 6개의 탄소 원자가 고리 모양으로 결합된 사이클로알케인(분자식 C6H12)으로, 벤젠 수소화 반응을 통해 생산되며 나일론 원료인 아디프산, 카프로락탐 제조 중간체, 유기 용매, 세척액, 접착제 등으로 활용되고 특유의 입체 구조와 관련된 화학적, 물리적 성질을 지닌다. - 탄화수소 - 아세틸렌
아세틸렌은 두 개의 탄소 원자가 삼중 결합으로 연결된 가장 간단한 알킨으로, 높은 연소 온도 덕분에 용접과 절단에 사용되지만 폭발 위험성 때문에 아세톤에 용해된 상태로 보관 및 운반되며, 화학 물질의 전구체나 생물학적, 천문학적 환경에서도 발견된다. - 탄화수소 - 알켄
알켄은 분자 내 탄소-탄소 이중 결합을 포함하는 탄화수소 화합물로, 탄소 수에 따라 구조 이성질체를 형성하며, 이중 결합으로 인해 알케인보다 반응성이 커 다양한 첨가 반응에 참여하고, 산업적으로 탄화수소 분해 등을 통해 생산되며 폴리에틸렌 등 화학 제품의 원료로 사용된다.
2. 명명법
사이클로알케인의 명명법은 (IUPAC)의 규칙을 따른다. 이 규칙은 고리의 크기, 치환기의 종류 및 위치에 따라 결정된다.
화합물 명명법에는 여러 가지 규칙이 있어서, 처음 배우는 사람들에게는 혼란스러울 수 있다. IUPAC 명명법은 지속적으로 수정되고 있으므로, 최신 자료에서 배우는 것이 가장 좋다.[3] 예를 들어 [4.2.0]-바이사이클로옥탄은 IUPAC 규칙에 맞게 바이사이클로[4.2.0]옥탄으로 작성된다. 분자에 염소나 메틸기 같은 다른 부착물이 있는 경우, 추가 숫자 접두사를 사용한다. '일반명'은 화합물에 대한 정보를 덜 제공하는 더 짧은 이름이다. 예를 들어 테르피네올은 알코올의 일종으로 수산기(–OH)가 부착되어 있다는 것만 알려준다.[3]
2. 1. 단일 고리 사이클로알케인
분자 구조에 단일 고리를 포함하는 치환되지 않은 사이클로알케인은 일반적으로 사이클로알케인이 고리에 가지고 있는 것과 같은 수의 탄소 원자를 사슬에 가진 해당 선형 알케인의 이름에 "사이클로" 접두사를 추가하여 명명한다. 예를 들어, 3원 고리를 포함하는 사이클로프로페인(C3H6)의 이름은 주 사슬에 3개의 탄소 원자를 가진 알케인인 프로페인(C3H8)에서 파생된다.[3]사이클로알케인은 집단적으로 석유 산업에서 주로 사용되는 용어인 '''나프텐'''이라고도 한다.[4]
2. 2. 다환식 사이클로알케인
이환식 알케인 및 스피로 알케인과 같은 다환식 알케인의 명명법은 더 복잡하다. 기본 이름은 고리 시스템의 탄소 수를 나타내고, 접두사는 고리 수를 나타내며("''바이사이클로''-" 또는 "''스피로''-"), 그 앞의 숫자 접두사는 접합부를 제외하고 각 고리의 각 부분의 탄소 수를 나타낸다. 예를 들어, 두 개의 인접한 탄소 원자를 공유하여 공유 모서리를 형성하는 6원 고리와 4원 고리로 구성된 바이사이클로옥탄은 [4.2.0]-바이사이클로옥탄이다. 공유 모서리를 제외한 6원 고리 부분에는 4개의 탄소가 있고, 공유 모서리를 제외한 4원 고리 부분에는 2개의 탄소가 있으며, 두 개의 꼭짓점을 제외한 모서리 자체에는 0개의 탄소가 있다.[3]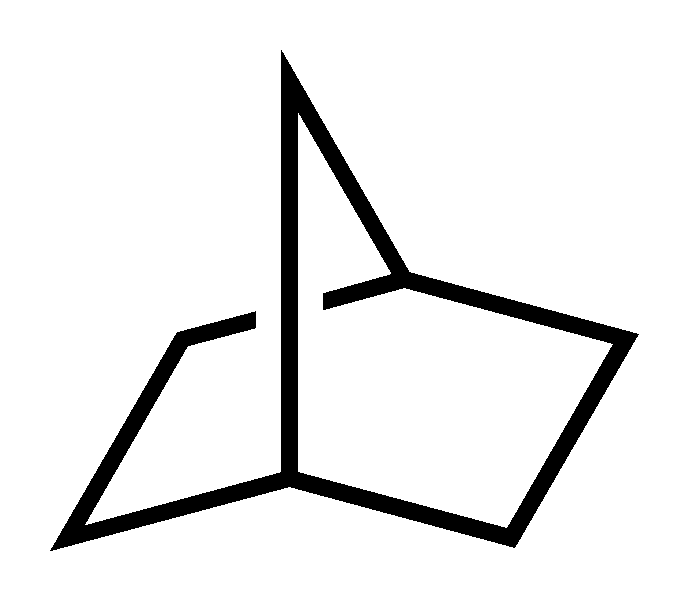
유기 화합물에 대한 IUPAC 명명법은 위에 주어진 노르보르난(''바이사이클로[2.2.1]헵테인'')의 예시를 사용하여 설명할 수 있다. 두 고리(공유 모서리 포함)의 총 탄소 수를 나타내는 화합물의 기본 이름이 먼저 나열된다. 예를 들어 "헵테인"은 7개의 탄소를 나타내는 "헵타-"를 나타내고, "-ane"은 탄소 간의 단일 결합을 나타낸다. 다음으로, 각 고리의 탄소 수(공유 탄소 제외)와 고리 사이의 다리에 존재하는 탄소 수를 나타내는 숫자 접두사가 기본 이름 앞에 추가된다. 위에 주어진 예시에서는 각각 2개의 탄소가 있는 두 개의 고리와 두 고리 모두에서 공유되는 탄소를 제외하고 1개의 탄소가 있는 단일 다리가 있다. 접두사는 점으로 구분된 세 개의 숫자로 구성된다([2.2.1]). 숫자 접두사 앞에는 고리의 수를 나타내는 또 다른 접두사("바이사이클로+")가 온다. 따라서 이름은 바이사이클로[2.2.1]헵테인이다.
2. 3. 나프텐
사이클로알케인은 석유 산업에서 주로 사용되는 '''나프텐'''이라고도 불린다.[4]3. 성질
사이클로알케인은 알케인과 비슷한 물리적 성질을 갖지만, 고리 구조로 인해 끓는점, 녹는점, 밀도가 더 높다. 이는 고리 형태가 더 넓은 접촉 면적을 허용하여 더 강한 런던 분산력을 유발하기 때문이다. C-C 및 C-H 결합만 포함하고 고리 변형이 거의 또는 전혀 없는 사이클로알케인은 비고리 알케인과 유사한 비활성을 가진다.[1]
3. 1. 끓는점, 녹는점, 밀도
사이클로알케인은 일반적인 물리적 특성에서 알케인과 유사하지만, 알케인보다 더 높은 끓는점, 녹는점, 그리고 밀도를 갖는다. 이는 고리 형태가 더 넓은 접촉 면적을 허용하기 때문에 더 강한 런던 분산력 때문이다.
3. 2. 안정성 및 반응성
C-C 및 C-H 결합만 포함하고, 고리 변형이 거의 또는 전혀 없는 사이클로알케인은 비고리 알케인과 유사한 비활성을 가진다.[1]4. 형태 및 고리 변형
사이클로알케인은 탄소 원자들이 사면체 결합각(109.5°)에 가까운 ''sp''3 궤도 혼성화를 이루며 고리 모양을 형성한다.[5] 이러한 구조적 특징으로 인해 발생하는 에너지 증가를 변형 에너지라고 하며, 사이클로알케인의 실험적 표준 연소 엔탈피 변화와 평균 결합 에너지로 계산한 값을 비교하여 측정한다. 분자 역학 계산은 특히 중간 크기 고리에서 나타나는 다양한 형태를 분석하는 데 유용하다.
4. 1. 각 변형 (Angle Strain)
사이클로알케인에서 탄소 원자는 가능한 경우 이상적인 사면체 결합각인 109° 28′를 갖는 ''sp''3 궤도 혼성화를 한다. 그러나 기하학적 이유로 3, 4, 5개의 원자를 가진 고리는 더 좁은 각도만 허용할 수 있다. 이상적인 사면체 결합각에서 벗어나면 잠재적 에너지가 증가하고 전반적인 불안정화 효과가 발생한다. 수소 원자의 가림 현상 또한 불안정화에 영향을 준다.[5]고리 변형은 탄소 원자가 삼각형을 형성하여 60° C-C-C 결합각을 갖는 사이클로프로페인에서 가장 크다. 가려진 수소 쌍도 세 쌍이 있다. 고리 변형은 약 120kJ/mol로 계산된다.
사이클로부테인은 탄소 원자가 약 90° 결합각을 가진 찌그러진 사각형을 가지고 있다. "찌그러짐"은 수소 원자 사이의 가림 상호 작용을 줄인다. 따라서 고리 변형은 약 110kJ/mol로 약간 더 적다.
이론적 평면 사이클로펜테인의 경우 C-C-C 결합각은 108°로 사면체 각도와 매우 가깝다. 실제 사이클로펜테인 분자는 찌그러져 있지만, 이는 결합각을 약간만 변경하므로 각 변형이 비교적 작다. 가림 상호 작용도 감소하여 약 25kJ/mol의 고리 변형이 남는다.[6]
4. 2. 가림 변형 (Eclipsing Strain)
수소 원자의 가림 현상은 사이클로알케인의 불안정화에 중요한 영향을 준다.[5] 사이클로프로페인에는 세 쌍의 가려진 수소 원자가 존재한다. 사이클로부테인은 찌그러진 형태를 통해 수소 원자 사이의 가림 상호작용을 줄인다.4. 3. 사이클로헥세인
사이클로헥세인은 고리의 찌그러짐으로 인해 이상적인 사면체 결합각을 얻을 수 있어 고리 변형 및 가림 상호 작용이 무시할 수 있다. 사이클로헥세인의 가장 안정적인 ''의자 형태''에서 인접한 탄소 원자의 축 방향 수소는 반대 방향을 가리키며 가림 변형을 사실상 제거한다.[5]4. 4. 중간 크기 고리
중간 크기 고리(탄소 원자 7~13개)는 각 변형을 최소화하기 위해 가로 고리 변형 또는 피처 변형이 발생한다.[5] 이러한 고리 크기에서는 변형 원인 중 하나 이상이 존재해야 하며, 이로 인해 변형 에너지가 증가하여 탄소 원자가 9개일 때 최대(약 50kJ/mol)에 이른다. 그 후 변형 에너지는 탄소 원자가 12개일 때까지 천천히 감소하다가 크게 감소한다. 탄소 원자가 14개일 때 또 다른 상당한 감소가 발생하며 변형은 10kJ/mol과 유사한 수준이다. 고리 크기가 더 커지면 다이아몬드 격자에 해당하는 접근 가능한 형태가 많기 때문에 변형이 거의 또는 전혀 없다.[5]4. 5. 이중 고리 시스템
이중 고리 시스템에서 고리 변형은 상당히 높을 수 있다. 예를 들어 바이사이클로부테인(C4H6)은 대규모로 분리할 수 있는 가장 변형된 화합물 중 하나로 알려져 있으며, 그 변형 에너지는 267kJ/mol로 추정된다.[7][8]5. 반응
사이클로알케인은 나프텐이라고도 하며, 촉매 개질 공정의 주요 기질이다.[9] 촉매가 존재하고 495°C~525°C의 온도에서 나프텐은 탈수소화 반응을 거쳐 방향족 유도체를 생성한다. 이 공정은 고옥탄 휘발유를 생산하는 방법을 제공한다.
또 다른 주요 산업 공정에서 사이클로헥산의 공기 중 산화 반응을 통해 사이클로헥산올이 생성되며, 일반적으로 코발트 촉매를 사용한다.[10]
:2 C6H12 + O2 → 2 C6H11OH
이 공정은 사이클로헥사논을 함께 생성하며, 이 혼합물(케톤-알코올 오일, "KA 오일")은 나일론 제조에 사용되는 아디프산 생산의 주요 원료이다.
작은 사이클로알케인, 특히 사이클로프로페인은 베이어 변형 이론 및 고리 변형으로 인해 안정성이 낮다. 이들은 알켄과 유사하게 반응하지만, 친전자성 첨가 반응에서는 반응하지 않고, 친핵성 지방족 치환 반응에서 반응한다. 이러한 반응은 알킬 사이클로알케인의 고리 열림 반응 또는 고리 절단 반응이다.
6. 합성법
많은 단순한 사이클로알케인은 석유에서 얻어진다. 불포화된, 심지어 방향족 전구체의 수소화 반응을 통해 생성될 수 있다.
6. 1. 고리 닫힘 반응
이관능성 전구체의 고리 닫힘 반응을 통해 사이클로알케인을 제조하는 다양한 방법이 존재한다. 예를 들어, 디에스터는 디크만 축합 반응에서 고리화된다.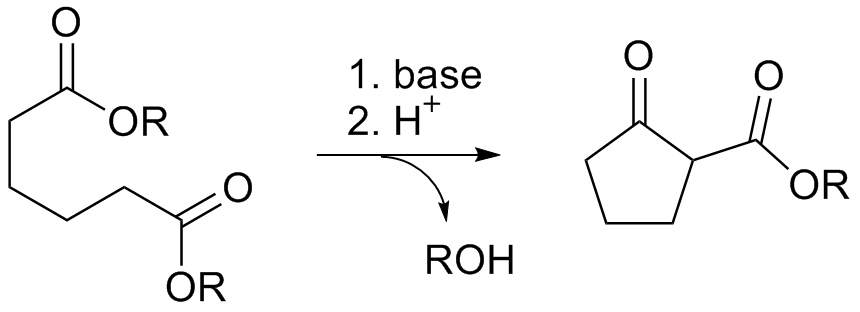
아실로인 축합 반응도 유사하게 이용될 수 있다.
더 큰 고리 (매크로고리화 반응)의 경우, 분자 내 고리 닫힘 반응이 분자 간 반응과 경쟁하기 때문에 더 정교한 방법이 필요하다.
- -|]]
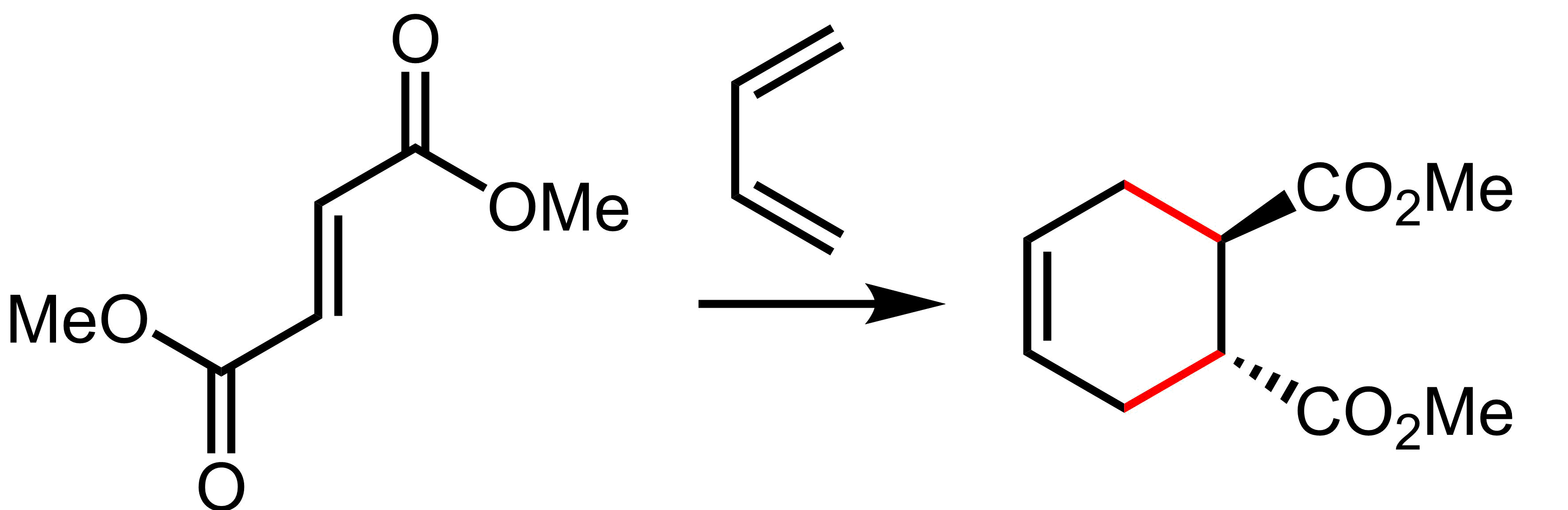
딜스-알더 반응은 [4+2] 고리 첨가 반응으로, 사이클로헥센으로 가는 경로를 제공한다.
이에 해당하는 [2+2] 고리 첨가 반응은 일반적으로 광화학적 활성화를 필요로 하며, 사이클로부탄을 생성한다.
유기 합성은 다양한 방법으로 사이클로알케인 또는 그 유도체를 합성할 수 있지만, 3원환(사이클로프로페인)은 고리의 뒤틀림이 커서 일반적인 고리 구축 반응으로는 구축할 수 없어 사이클로프로페인 고유의 합성법을 사용하는 경우가 많다. 또한, 중간 고리에서 큰 고리로 크기가 커짐에 따라 반응 분자의 입체 배좌의 자유도가 커지면서 반응점끼리 가까워질 기회가 줄어들고, 분자 내 반응이 아닌 여러 반응 분자 간의 반응이 협력적으로 진행된다. 따라서 일반적으로 중간 고리에서 큰 고리 합성은 고도로 희석된 조건에서 분자 간 반응을 억제할 필요가 있다.
다음은 다이할로게노알케인과 말론산 에스테르의 고리화 반응을 이용한 사이클로알케인의 일반적인 합성법의 예시이다.
일반적으로 말론산 에스테르의 에놀레이트를 사용한 알킬화는 모노알킬체에서 멈추기 어렵고, 빠르게 두 번째 단계의 알킬화가 진행된다. 고리화 반응에서 생성된 사이클로알케인 다이카르복실산 에스테르를 가수분해하면, ''gem''-다이카르복실산은 쉽게 탈탄산 반응하므로 사이클로알케인 카르복실산을 얻을 수 있다. 또는 추가로 탈탄산하여 사이클로알케인으로 유도할 수도 있다.
6. 2. 딜스-알더 반응
딜스-알더 반응은 [4+2] 고리 첨가 반응으로, 사이클로헥센을 생성하는 데 사용된다.이에 대응하는 [2+2] 고리 첨가 반응은 일반적으로 광화학적 활성화를 필요로 하며, 사이클로부탄을 생성한다.
6. 3. [2+2] 고리 첨가 반응
이에 해당하는 [2+2] 고리 첨가 반응은 일반적으로 광화학적 활성화를 필요로 하며, 사이클로부탄을 생성한다.6. 4. 큰 고리 합성
더 큰 고리 (매크로고리화 반응)의 경우, 분자 내 고리 닫힘 반응이 분자 간 반응과 경쟁하기 때문에 더 정교한 방법이 필요하다.
6. 5. 기타
다이할로게노알케인과 말론산 에스테르의 고리화 반응을 통해 사이클로알케인 카르복실산을 얻을 수 있으며, 추가적인 탈탄산 반응을 통해 사이클로알케인을 얻을 수 있다. 3원환(사이클로프로페인)은 고리의 뒤틀림이 커서 일반적인 고리 구축 반응으로는 합성하기 어렵고, 사이클로프로페인 고유의 합성법을 사용해야 한다. 중간 고리에서 큰 고리로 갈수록 반응 분자의 입체 배좌 자유도가 커져 반응점끼리 가까워지기 어렵기 때문에, 고도로 희석된 조건에서 분자 간 반응을 억제해야 한다.[1]일반적으로 말론산 에스테르의 에놀레이트를 사용한 알킬화는 모노알킬체에서 멈추기 어렵고, 빠르게 두 번째 단계의 알킬화가 진행된다. 고리화 반응에서 생성된 사이클로알케인 다이카르복실산 에스테르를 가수분해하면, ''gem''-다이카르복실산은 쉽게 탈탄산 반응하므로 사이클로알케인 카르복실산을 얻을 수 있다. 또는 추가로 탈탄산하여 사이클로알케인으로 유도할 수도 있다.[1]
7. 주요 사이클로알케인
다음은 주요 사이클로알케인 목록이다.
8. 바이어의 변형 이론 (Strain Theory)
일반적으로 작은 고리 또는 중간 크기의 고리 사이클로알케인은 해당 사슬형 탄화수소와 비교하여 다른 반응성을 보이며, 이는 사이클로알케인의 입체 화학(입체 배좌)에서 기인한다. 예를 들어 사이클로프로페인은 쉽게 열분해되어 프로펜(propene|프로펜영어)으로 고리 절단되는 성질을 나타낸다. 과거에는 사이클로알케인이 평면 구조를 가진다고 생각했기 때문에 아돌프 폰 바이어는 "바이어의 변형 이론"(strain theory)을 제창(1895년)하여, sp3혼성 궤도의 정사면체 구조 결합각과 정다각형의 결합각 차이로 인해 발생하는 변형이 결합 에너지를 불안정하게 한다고 생각했다. 그러나 실제로는 사이클로프로페인을 제외한 사이클로알케인은 단일 평면에 메틸렌 탄소가 배치되지 않으며, 그 결과 결합각은 정사면체 구조와 크게 다르지 않다는 것이 밝혀졌다. 즉, 바이어의 변형 이론은 반드시 옳지는 않았지만, 입체 배좌와 내부 에너지와의 관계를 밝히는 원동력이 되었으며, 입체 화학 또는 배좌 분석의 선구자가 되었다.[1]
참조
[1]
간행물
Cycloalkane
[2]
웹사이트
Alkanes & Cycloalkanes
https://www2.chemist[...]
2022-02-20
[3]
웹사이트
Blue Book
https://iupac.qmul.a[...]
2023-04-01
[4]
서적
Fundamentals of Petroleum Refining
https://books.google[...]
2010
[5]
논문
Conformational analysis of cycloalkanes
https://link.springe[...]
[6]
서적
Organic chemistry
Brooks/Cole
2000
[7]
서적
Advances in Alicyclic Chemistry
Academic Press
[8]
논문
Bicyclo[1.1.0]butane
[9]
서적
Ullmann's Encyclopedia of Industrial Chemistry
2000
[10]
간행물
Cyclohexanol and Cyclohexanone
Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

