산-염기 반응
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
산-염기 반응은 산과 염기의 상호 작용을 다루는 화학 반응이다. 산-염기 반응에 대한 정의는 아레니우스, 브뢴스테드-로우리, 루이스, 우사노비치, 용매계, 럭스-플루드 등 다양한 이론으로 발전해 왔다. 산-염기 반응의 예시로는 중화 반응, 베이킹 파우더 반응 등이 있으며, 산과 염기의 세기는 물질 고유의 세기, 농도를 포함한 세기 등으로 평가된다. 또한 HSAB 이론과 ECW 모델은 산-염기 상호 작용을 설명하고 예측하는 데 사용된다.
더 읽어볼만한 페이지
- 산염기화학 - 산 무수물
산 무수물은 두 분자의 산에서 물 분자가 제거되어 생성된 화합물로, 카르복실산 무수물과 무기산 무수물로 나뉘며 폴리에스터 합성 및 의약품 제조 등에 사용되는 다양한 종류가 존재하고, 가수분해 반응, 에스터 및 아미드 형성 반응 등 높은 반응성을 지닌다. - 산염기화학 - 중화 반응
중화 반응은 산과 염기가 반응하여 염과 물을 만드는 화학 반응으로, 넓게는 양성자 교환 반응을, 좁게는 수소 이온과 수산화 이온이 물을 생성하는 반응을 뜻하며, 다양한 종류와 응용 분야를 가진다. - 염기 - 수산화물
수산화물은 수산화 이온을 포함하는 화합물로, 브뢴스테드-로우리 염기 및 루이스 염기로 작용하며, 다양한 무기 및 유기 반응에서 중요한 역할을 한다. - 염기 - 강염기
강염기는 수용액에서 수산화 이온을 많이 생성하는 염기로, 알칼리 금속, 알칼리 토류 금속 등의 수산화물과 초염기를 포함한다. - 산 (화학) - 왕수
왕수는 진한 질산과 염산을 1:3 몰 비율로 혼합한 것으로, 금이나 백금 같은 귀금속을 녹일 수 있는 강력한 산화력을 가진 용액이며, 염화 금산 제조, 식각, 분석화학 등에 사용된다. - 산 (화학) - 질산
질산은 강산이자 강력한 산화력을 지닌 무색 액체로, 비료, 폭발물, 나일론 생산 등 산업에 널리 쓰이지만 부식성과 테러 악용 위험성도 있으며, 현재는 주로 암모니아 산화법으로 생산된다.
2. 산-염기 정의의 변화
현대 화학에서는 주로 아레니우스의 정의, 브뢴스테드-로우리의 정의, 루이스의 정의, 우사노비치의 정의라는 네 가지 정의 방법이 있다. 아레니우스의 정의가 가장 엄격하며, 이 순서대로 산 또는 염기로 분류되는 화학 물질의 종류가 증가하고, 산에도 염기에도 분류되지 않는 화학 물질의 종류가 감소한다.
때때로 목적에 따라 가장 적절한 정의를 채택하는 것이 중요하다.
아레니우스의 정의와 달리, 브뢴스테드-로우리에 의한 산과 염기의 정의는 반응 상대가 되는 “다른 물질”의 존재가 있어야 비로소 의미를 갖는 것이다. 따라서 어떤 물질이 “다른 물질” X에 대해서는 산으로 작용하지만, X와 다른 “다른 물질” Y에 대해서는 염기로 작용하는 경우도 있을 수 있다.
예를 들어, 물은 염산에 대해서는 염기로 작용하지만 암모니아에 대해서는 산으로 작용한다.
2. 1. 역사적 발전
산-염기 반응에 대한 개념은 1754년 기욤프랑수아 루엘에 의해 처음 구상되었다. 그는 화학에서 산과 반응하여 고체 물질(염)을 생성하는 물질을 설명하기 위해 "염기"라는 개념을 도입하였다.[3] 염기는 대부분 쓴맛이 난다.[3]2. 1. 1. 라부아지에의 산 산소 이론
라부아지에는 1776년경 산과 염기에 대한 최초의 과학적 개념을 제시하였다. 라부아지에의 강산에 대한 지식은 주로 질산(HNO₃)과 황산(H₂SO₄)과 같은 옥소산에 국한되었는데, 이러한 산들은 중심 원자가 높은 산화 상태에 있으며 산소로 둘러싸여 있는 경향이 있었다. 또한 그는 할로젠화수소산(HF, HCl, HBr, HI)의 실제 조성을 알지 못했기 때문에, 산을 산소를 포함하고 있다는 점으로 정의하였다. 사실 그는 산소라는 이름을 그리스어로 "산을 생성하는 것"(옥시스/ὀξύς (oxys)grc - 산, 신맛, 게이노마이/γεῖνομαι (geinomai)grc - 낳다)을 의미하는 단어에서 따왔다. 라부아지에의 정의는 험프리 데이비 경이 황화 수소(H₂S), 텔루르화수소(H₂Te) 및 할로젠화수소산에 산소가 없다는 것을 증명한 1810년 논문과 그 이후 강의가 나올 때까지 30년 이상 유지되었다. 그러나 데이비는 새로운 이론을 개발하지 못하고 "산성은 특정한 원소에 의존하는 것이 아니라 다양한 물질의 특이한 배열에 의존한다"고 결론지었다.[4]2. 1. 2. 리비히의 산 수소 이론
1838년, 유스투스 폰 리비히는 산이 금속으로 치환될 수 있는 수소를 포함하는 화합물이라고 제안했다.[5][6][7] 이 재정의는 그가 유기산의 화학적 조성에 대해 수행한 광범위한 연구에 기초한 것으로, 험프리 데이비가 제안한 산소 기반 산에서 수소 기반 산으로의 전환을 완료한 것이다. 리비히의 정의는 완전히 경험적인 것이었지만, 아레니우스 정의가 채택될 때까지 거의 50년 동안 사용되었다.[8]2. 2. 아레니우스 정의
스반테 아레니우스는 프레드릭 빌헬름 오스트발트와 함께 수용액에서의 이온 존재를 확립한 이전 연구를 바탕으로, 1884년에 산과 염기에 대한 최초의 현대적 정의를 제시했다.[9][10] 아레니우스는 물에 녹아 수소 이온(H⁺)을 생성하는 물질을 산, 물에 녹아 수산화 이온(OH⁻)을 생성하는 물질을 염기로 정의했다. [11] 즉, 산은 수용액에서 H⁺ 이온의 농도를 증가시키고, 염기는 수용액에서 OH⁻ 이온의 농도를 증가시킨다.
현대에는 H⁺ 기호가 히드로늄 이온(H₃O⁺)의 약어로 해석되는데, 이는 순수한 양성자가 수용액에서 유리기로 존재하지 않는다는 것이 알려졌기 때문이다.[14] 아레니우스의 정의에 따르면, 톨루엔에 용해된 순수한 H₂SO₄영어와 HCl은 산성이 아니며, 녹은 NaOH와 액체 암모니아에서 칼슘 아마이드 용액은 알칼리성이 아니다. 이러한 비수용액 예외는 브뢴스테드-로우리 이론과 루이스 이론으로 이어졌다.[15]
산과 염기가 반응하여 염과 물을 생성하고 그 각각의 특성을 잃는 반응을 중화 반응이라 한다. 예를 들어 염산(HCl)과 수산화 나트륨(NaOH) 용액이 반응하면 염화 나트륨(NaCl)과 물 분자가 생성된다.
:
이때 (aq)는 명시적으로 포함되지 않고, 반응식 내에 함축적으로 존재한다. 이는 물질들이 물에 용해되었음을 나타낸다.[11] 아레니우스의 정의는 수용액 상태만으로 조건이 제한되어 대부분의 비 수용액에서는 유효하지 않다는 한계가 있다.
2. 3. 브뢴스테드-로우리 정의
1923년 덴마크의 요하네스 니콜라우스 브뢴스테드와 영국의 토마스 마틴 로우리는 각각 독립적으로 산-염기 반응을 양성자(H+)의 이동으로 정의하였다.[18][19] 즉, 산은 양성자를 다른 물질에 주는 물질(양성자 주개)이며, 염기는 양성자를 다른 물질로부터 받는 물질(양성자 받개)이다.[20][21]

브뢴스테드-로우리 정의에 따른 산-염기 반응의 일반 공식은 다음과 같다.
:HA + B ⇌ BH+ + A-
여기서 HA는 산, B는 염기, BH+는 B의 공액산, A-는 HA의 공액 염기를 나타낸다.
예를 들어, 염산(HCl)이 수용액에서 해리되는 반응은 다음과 같다.
:HCl + H2O ⇌ H3O+ + Cl-
이 반응에서 HCl은 물(H2O)에게 양성자를 주어 히드로늄 이온(H3O+)을 생성하므로 산이고, H2O는 HCl로부터 양성자를 받아 H3O+를 생성하므로 염기이다. 이때 Cl-는 HCl의 공액 염기, H3O+는 H2O의 공액산이다.
데바이, 온사거등의 이론에 따라, 브뢴스테드-로우리 정의에서 산과 염기는 전해질로 간주되는 염과 근본적으로 다르다.[4] 산과 염기는 염과 용매를 생성하기 위해 반응하는 것이 아니라 새로운 산과 새로운 염기를 형성하기 위해 반응하며, 중화의 개념은 존재하지 않는다.[4]
브뢴스테드-로우리 정의는 용매와는 무관하며, 아레니우스 모델보다 포괄적이다. 아레니우스 모델에서 pH 계산은 알칼리(염기)가 물에 녹는 것(수용액)에 의존했지만, 브뢴스테드-로우리 모델은 불용성 및 용해성 용액(기체, 액체, 고체)을 사용하여 pH를 측정할 수 있도록 확장했다.
물은 양쪽성 물질이므로, 산과 염기 모두로 작용할 수 있다. 브뢴스테드-로우리 모델은 다음 반응을 통해 이를 설명한다.
:H2O + H2O ⇌ H3O+ + OH-
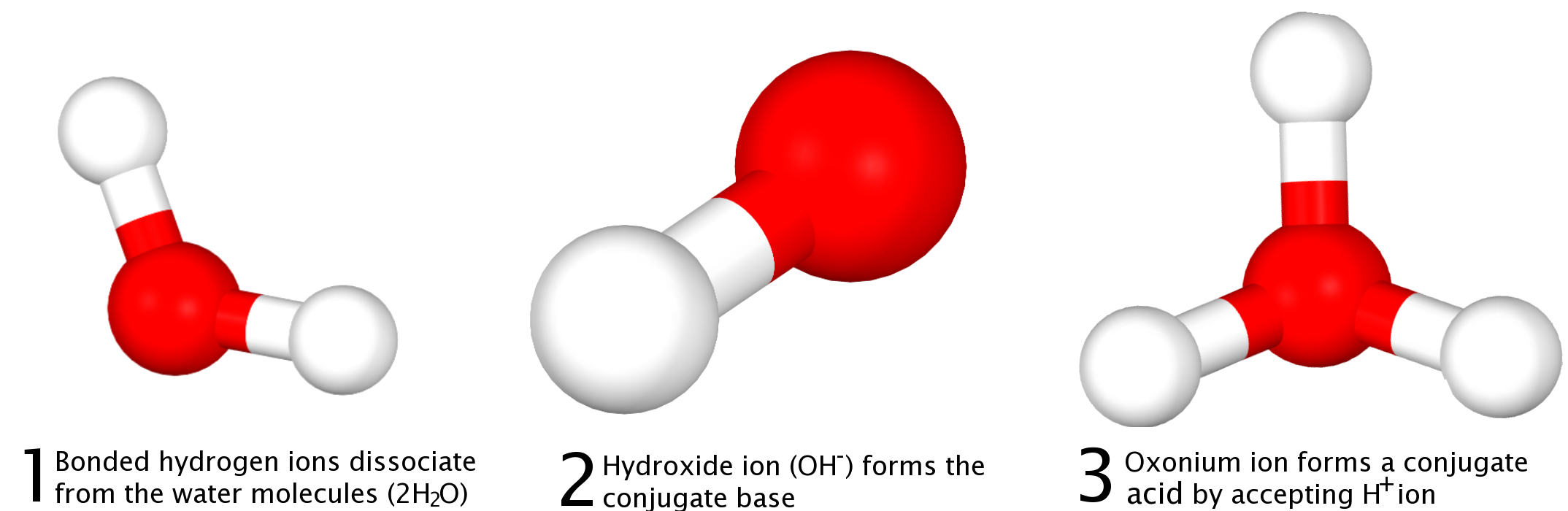
위 반응에서 한 물 분자는 산으로 작용하여 H+를 주고 수산화 이온(OH-)을 형성하고, 다른 물 분자는 염기로 작용하여 H+를 받아 H3O+를 형성한다.
물이 산으로 작용하는 예시는 피리딘(C5H5N)의 수용액에서 다음과 같다.
:C5H5N + H2O ⇌ [C5H5NH]+ + OH-
이 예에서 물 분자는 수소 이온을 피리딘 분자에 주고 수산화 이온이 생성된다.
아세트산(CH3COOH)이 액체 암모니아에 녹을 때, 다음과 같은 반응이 일어난다.
:CH3COOH + NH3 ⇌ NH4+ + CH3COO-
H+ 이온이 아세트산에서 제거되어 아세트산염 이온(CH3COO-)을 형성한다. 용매의 암모니아 분자에 H+ 이온이 첨가되면 암모늄 이온(NH4+)이 생성된다.
브뢴스테드-로우리 모델은 수소를 포함하는 물질(HCl과 같은)을 산이라고 부른다. 따라서 길버트 N. 루이스는 1938년에 "산 그룹을 수소를 포함하는 물질로 제한하는 것은 화학에 대한 체계적인 이해를 심각하게 방해하는 것과 마찬가지로 산화제라는 용어를 산소를 포함하는 물질로 제한하는 것과 같다"라고 썼다.[4] 또한 KOH와 KNH2는 브뢴스테드 염기로 간주되지 않고, 오히려 OH-와 NH2- 염기를 포함하는 염으로 간주된다.
브뢴스테드-로우리 정의는 수용액으로 한정하지 않으므로, 아레니우스 정의에 있던 "수용액에만 정의할 수 있다"는 결점이 해소되었다.
2. 3. 1. 아레니우스 정의와의 관계
브뢴스테드-로우리 산-염기 정의는 아레니우스 정의를 포함하는 더 일반적인 정의이다. 아레니우스 산은 브뢴스테드-로우리 산이면서 동시에 물 분자에게 양성자를 주는 물질이다. 아레니우스 염기는 수산화물 이온(2. 3. 2. 공액 염기와 공액 산
산(acid)을 HA, 염기(base)를 B라 하면, 브뢴스테드-로우리 산-염기 반응은 일반적으로 다음과 같은 화학 반응식으로 나타낼 수 있다.:
& HA & + & B & \overrightarrow\longleftarrow \ & A^- & + & HB^+ \\
& ^{acid} & & ^{base} & & ^{conjugate \ base} \ & & ^{conjugate \ acid} \\
이 식은 왼쪽에서 오른쪽으로의 반응과 오른쪽에서 왼쪽으로의 반응이 모두 일어나는 반응(가역반응)임을 의미한다. (이 화학 평형의 평형 상수에서 산 해리 상수를 정의한다).
그래서 반대로, 오른쪽에서 왼쪽으로의 반응 과정을 살펴보면, (브뢴스테드-로우리의 정의에서) 염기 A^- 와 산 HB^+ 이 반응하여 HA와 B를 생성한다고 해석할 수 있다.
이러한 이유로, A^- 를 산 HA의 '''공액 염기'''(conjugate base)라고 하고, HB^+ 를 염기 B의 '''공액 산'''이라고 부른다.
2. 4. 루이스 정의
1923년, 길버트 뉴턴 루이스는 산을 전자쌍 받개, 염기를 전자쌍 주개로 정의하는 산-염기 반응 이론을 제시하였다.[23] 이는 브뢴스테드-로우리 정의와 같은 해에 제시되었지만, 1938년에 더 자세히 설명되었다.[4] 루이스 정의는 염기를 전자쌍을 줄 수 있는 화합물, 산을 이 전자쌍을 받을 수 있는 화합물로 정의한다.[24]예를 들어, 삼불화붕소()는 옥텟에 공간이 있어 전자쌍을 받아들일 수 있는 전형적인 루이스 산이다. 플루오르화물 이온은 완전한 옥텟을 가지고 있으며 전자쌍을 기증할 수 있다. 따라서
는 전형적인 루이스 산-루이스 염기 반응이다. 13족 원소의 화학식이 인 모든 화합물은 루이스 산으로 작용할 수 있다. 마찬가지로, 아민()과 유기인()과 같이 15족 원소의 화학식이 인 화합물은 루이스 염기로 작용할 수 있다. 이들 사이의 첨가화합물은 화학식이 이며, 원자 A(수용체)와 D(주개) 사이의 배위 공유 결합을 기호 ←로 나타낸다. 에테르()나 티오에테르()와 같이 화학식이 인 16족 원소의 화합물도 루이스 염기로 작용할 수 있다. 일산화탄소는 삼불화붕소와 화학식 의 첨가화합물을 형성할 때 루이스 염기로 작용한다.
금속 이온을 포함하는 첨가화합물은 배위화합물이라고 하며, 각 리간드는 금속 이온에 전자쌍을 기증한다.[24]
:
위 반응은 H₂O가 전자쌍을 제공하고 Al³⁺가 그 전자쌍을 받아들이기 때문에, Al³⁺는 루이스 산이며, H₂O는 루이스 염기이다.
다음 반응
은 루이스 정의와 브뢴스테드-로우리 정의 모두에서 산-염기 반응이다. 브뢴스테드-로우리 정의에서 염기 B는 히드로늄 이온(H⁺)을 받아들일 때, B 내에 있는 전자쌍을 히드로늄 이온(H⁺)에 제공함으로써 HB⁺를 만든다. 따라서 루이스의 염기 정의는 브뢴스테드-로우리의 염기 정의를 포함하며, 동일한 이유로 루이스의 산 정의는 브뢴스테드-로우리의 산 정의를 포함한다.
2. 5. 우사노비치 정의
미하일 우사노비치는 1939년에 산-염기 반응에 대한 일반적인 이론을 제시했다.[4] 우사노비치는 산을 음이온을 받아들이거나 양이온을 내놓는 모든 것으로, 염기를 그 반대로 정의했다. 이는 산화환원의 개념을 산-염기 반응의 특수한 경우로 정의한 것이다.몇 가지 우사노비치 산-염기 반응의 예는 다음과 같다.
우사노비치의 정의에 따르면, 산은 수소 이온 및 기타 양이온을 방출하거나, 전자 및 음이온과 결합할 수 있는 모든 것을 포함한다.
: Na + H2O → Na+ + OH- + 1/2 H2
: base acid acid base base
이 정의는 전자의 수수와 같은 산화환원반응까지 산염기반응으로 해석하여, 궁극적으로 모든 화학반응을 포함하게 되므로 해석이 지나치게 확장되어 오늘날에는 거의 사용되지 않는다. 그러나 이 정의는 ‘어디까지 해석을 확장해도 좋은가’라는 논의를 불러일으키는 계기가 되었기 때문에, 그 점에서 우사노비치의 공적은 크다고 할 수 있다.
2. 6. 용매계 정의
용매계 정의는 특정 용매에서의 산-염기 반응을 설명하는 데 사용된다. 에드워드 커티스 프랭클린은 1905년 액체 암모니아에서 산-염기 반응을 연구하고, 이것이 물 기반 아레니우스 이론과 유사하다는 점을 지적했다. 알버트 프레드릭 오토마르 게르만은 액체 포스겐(COCl₂)을 이용한 연구를 통해 1925년 용매 기반 이론을 제시하여 아레니우스 정의를 비양성자성 용매로 확장했다.[25]게르만은 많은 용액에서 중성 용매 분자와 평형 상태에 있는 이온이 존재한다고 지적했다. 용매의 자동 이온화 반응을 기반으로, 용매 양이온 (솔보늄 이온)을 증가시키는 물질을 산, 용매 음이온 (솔베이트 이온)을 증가시키는 물질을 염기로 정의한다.[26] 예를 들어, 물과 암모니아는 각각 히드로늄과 수산화물, 암모늄과 아마이드로 해리된다.[26]
일부 비양성자성 계도 이러한 해리를 겪는데, 예를 들어 이산화질소는 니트로소늄과 질산염으로,
삼염화안티몬은 디클로로안티몬과 테트라클로로안티몬산염으로, 그리고 포스겐은 클로로카르복소늄과 염화물로 해리된다.
액체 암모니아에서 ( 공급)는 강염기이고, ( 공급)는 강산이다. 액체 이산화황()에서 티오닐 화합물 ( 공급)은 산으로 작용하고, 아황산염 ( 공급)은 염기로 작용한다.
용매계 정의는 용매뿐만 아니라 용질에도 의존하기 때문에, 특정 용질은 용매의 선택에 따라 산 또는 염기가 될 수 있다. 이 이론의 특징은 강점이자 약점으로 여겨져 왔는데, 그 이유는 와 와 같은 일부 물질이 자체적으로 산성 또는 염기성을 띠는 것으로 여겨지기 때문이다. 반면에 용매계 이론은 너무 일반적이어서 유용하지 않다는 비판을 받아왔다. 또한 수소 화합물에는 본질적으로 산성인 특성이 있으며, 비수소계 솔보늄 염에는 이러한 특성이 없다는 점이 지적되어 왔다.[4]
2. 7. 럭스-플루드 정의
럭스-플루드 정의는 1939년 독일 화학자 헤르만 럭스(Hermann Lux)[28][29]가 제안하고, 하콘 플루드(Håkon Flood)가 1947년경에[30] 개선한 산-염기 이론이다. 이 정의는 산을 산화물 이온() 받개, 염기를 산화물 이온 주개로 설명한다.[31]예를 들어, 아래 반응식에서 MgO는 염기로, CO₂는 산으로 작용한다.[31]
: \ce{MgO} + \ce{CO2} → \ce{MgCO3}
: \ce{CaO} + \ce{SiO2} → \ce{CaSiO3}
: \ce{NO3-} + \ce{S2O7^2-} → \ce{NO2+ + 2 SO4^2-}
이 이론은 현대 지구화학 및 용융염의 전기화학에서 여전히 사용되고 있으며, 특히 크세논 산화물, 플루오르화물 및 산화플루오르화물을 포함한 비활성 기체 화합물의 반응을 체계화하는 데 유용하다.[32]
3. 산-염기 반응의 예시
3. 1. 중화 반응
중화 반응은 산과 염기가 반응하여 염과 물을 생성하는 반응이다. 산-알칼리 반응은 산-염기 반응의 특수한 경우로, 사용되는 염기가 알칼리이기도 한 경우이다. 산이 알칼리 염(금속 수산화물)과 반응하면 금속 염과 물이 생성된다.일반적으로 산-알칼리 반응은 구경꾼 이온을 생략하여 다음과 같이 간소화할 수 있다.
:
산은 일반적으로 수소 양이온()을 포함하거나 용액에서 수소 양이온이 생성되도록 하는 순수 물질이다. 염산()과 황산()이 일반적인 예이다. 물 속에서 이들은 이온으로 분리된다.
:
알칼리는 물에서 분리되어 녹은 수산화물 이온을 생성한다.
:
예시: 염산(HCl)과 수산화나트륨(NaOH)의 반응: HCl + NaOH → NaCl + H₂O
3. 2. 베이킹 파우더
베이킹파우더는 빵, 케이크 반죽에 수많은 이산화탄소 기포를 생성하여 부풀어 오르게 하는 데 사용된다.[16] 베이킹파우더는 베이킹소다(중탄산나트륨)와 산성염의 혼합물이다.[16] 베이킹파우더가 물과 결합하면 중탄산나트륨과 산성염이 반응하여 기체인 이산화탄소를 생성하기 때문에 기포가 생성된다.[16]산-염기 반응은 일반적으로 다음과 같이 나타낼 수 있다.[16]
:
산이 복잡하기 때문에 실제 반응은 더 복잡하다. 예를 들어, 중탄산나트륨과 인산일칼슘(Ca(H₂PO₄)₂)으로 시작하면 다음과 같은 화학량론에 따라 이산화탄소가 생성된다.[17]
:
전형적인 조성(중량 기준)은 중탄산나트륨 30%, 인산일칼슘 5~12%, 황산알루미늄나트륨 21~26%일 수 있다. 또는 시판 베이킹파우더는 황산알루미늄나트륨 대신 피로인산이수소나트륨을 두 가지 산성 성분 중 하나로 사용할 수 있다. 이러한 제제의 또 다른 일반적인 산은 타르타르산의 유도체인 크림 오브 타르타르(KC₄H₅O₆)이다.[17]
4. 산-염기 세기
어떤 용액의 산성(염기성)의 세기는, 그 용액에 녹아있는 산(염기) 고유의 "세기"와 용액 중 그 물질의 "농도"에 의존한다. 예를 들어, 황산은 물질 자체로는 강산이지만, 만약 농도가 낮다면 용액 전체의 산성은 약하다.
각 물질 고유의 (농도에 의존하지 않는) 세기의 지표로는 산해리상수()가 있다. 또, 농도를 고려한 용액 자체의 성질의 지표로 수소이온농도지수(pH), 산도함수(''H''0) 및 규정도가 있다. 이들은 경우에 따라 사용이 달라진다. 산성도를 나타내기 위해 묽은 수용액에서는 pH를 사용하는 것이 일반적이지만, 진한 용액 및 비수용매 중에서는 산도함수를 사용한다.
또 유기용매 중에서의 반응을 자주 논하는 유기화학에서는, 반응물의 수소이온의 해리 정도를 에 의해 논하는 경우가 많다.
=== 물질 고유의 세기 ===
수용액에서 이온화하는 화합물의 산성(염기성)의 세기는 그 물질의 '''전리도'''에 따라 대략적으로 분류된다. 전리도는 전해질이 용액에서 해리(전리)하고 있는 몰비를 나타내는 값으로, 전리도가 거의 1인 산(염기)을 '''강산'''('''강염기'''), 전리도가 작은 것을 '''약산'''('''약염기''')이라고 한다. 또한, 순수한 황산보다 강한 산성 매질을 초강산이라고 부르기도 한다.
좀 더 정량적으로 산(염기)의 세기를 나타내는 경우에는 해리 평형을 고려하여, 그 '''평형상수''' ''K''a의 로그에 음의 부호를 붙인 '''산해리상수''' pKa로 나타내는 경우가 많다. 염기에 대해서는 공액산의 pKa 또는 특히 수용액의 경우 '''염기해리상수''' p''K''b = 14 − pKa가 사용된다.
예를 들어, 아세트산의 pKa는 4.76, 포름산의 pKa는 3.77이다.[37] pKa는 정의로부터 수치가 작을수록 수소 이온을 해리하기 쉽다는 것을, 즉 강산임을 나타낸다. 따라서, 같은 약산이라도 포름산이 아세트산보다 10배 강하다는 것을 알 수 있다.
또한, 이 표기법을 사용하면 유기물 등 일반적으로 이온화한다고 생각하지 않는 화합물에 대해서도 산·염기의 세기, 즉 프로톤 해리의 지표로 사용할 수 있다. 예를 들어, 수용액에서 메탄의 pKa는 48, 벤젠은 43이며, 벤젠의 수소가 훨씬 산성이 강하다는 것(즉, 프로톤으로 쉽게 떨어져 나온다는 것)을 알 수 있다.[38]
염기의 세기는 공액산의 pKa로 판단할 수 있다. 예를 들어, 양성자화된 암모니아(암모늄)의 pKa는 9.2, 트리에틸아민은 10.75이다. 즉, 트리에틸아민에 배위된 프로톤은 암모니아의 경우에 비해 1자릿수 정도 해리하기 어렵다. 이것은 트리에틸아민이 암모니아보다 10배 강한 염기임을 나타낸다.
산해리상수를 지표로 사용함으로써, 클라이젠 축합 등 수소 이탈이 관여하는 반응에 필요한 염기를 추정할 수 있다.
또한 산과 염기에는 "딱딱한", "무른"이라는 표현으로 나타내는 정성적인 성질이 있다. 자세한 내용은 HSAB 원리를 참조한다.
=== 농도를 포함한 세기 ===
수소이온농도(pH)는 일반적으로 수용액 중에서 수소 이온의 농도를 로그로 나타낸 것이다. 수소이온농도는 현실적인 산·염기의 강도에 맞는 지표이지만, 단순히 산·염기의 농도에 비례하는 것이 아니므로, 값을 알고 싶을 때는 산염기 지시약 등으로 조사할 필요가 있다. 또, 수용액 이외에 적용하는 경우에는, 자체 해리나 수평화 효과를 고려할 필요가 있다. 상온에서는, pH가 7일 때 중성, 7보다 작을 때 산성, 7보다 클 때 염기성이다.
어떤 물질의 용액의 산·염기를 논할 때는, 그 물질의 농도도 중요한 요소가 된다. 농도를 포함한 산·염기의 지표로는, 규정도와 수소이온농도가 있다. 규정도는 산·염기의 가수와 몰농도의 곱으로 표현되는 값으로, 단위 '''N'''으로 나타낸다. 단, IUPAC[39] 및 일본의 계량법에서는 사용이 권장되지 않는다.[40]
4. 1. 물질 고유의 세기
수용액에서 이온화하는 화합물의 산성(염기성)의 세기는 그 물질의 '''전리도'''에 따라 대략적으로 분류된다. 전리도는 전해질이 용액에서 해리(전리)하고 있는 몰비를 나타내는 값으로, 전리도가 거의 1인 산(염기)을 '''강산'''('''강염기'''), 전리도가 작은 것을 '''약산'''('''약염기'''이라고 한다. 또한, 순수한 황산보다 강한 산성 매질을 초강산이라고 부르기도 한다.좀 더 정량적으로 산(염기)의 세기를 나타내는 경우에는 해리 평형을 고려하여, 그 '''평형상수''' ''K''a의 로그에 음의 부호를 붙인 '''산해리상수''' pKa로 나타내는 경우가 많다. 염기에 대해서는 공액산의 pKa 또는 특히 수용액의 경우 '''염기해리상수''' p''K''b = 14 − pKa가 사용된다.
예를 들어, 아세트산의 pKa는 4.76, 포름산의 pKa는 3.77이다.[37] pKa는 정의로부터 수치가 작을수록 수소 이온을 해리하기 쉽다는 것을, 즉 강산임을 나타낸다. 따라서, 같은 약산이라도 포름산이 아세트산보다 10배 강하다는 것을 알 수 있다.
또한, 이 표기법을 사용하면 유기물 등 일반적으로 이온화한다고 생각하지 않는 화합물에 대해서도 산·염기의 세기, 즉 프로톤 해리의 지표로 사용할 수 있다. 예를 들어, 수용액에서 메탄의 pKa는 48, 벤젠은 43이며, 벤젠의 수소가 훨씬 산성이 강하다는 것(즉, 프로톤으로 쉽게 떨어져 나온다는 것)을 알 수 있다.[38]
염기의 세기는 공액산의 pKa로 판단할 수 있다. 예를 들어, 양성자화된 암모니아(암모늄)의 pKa는 9.2, 트리에틸아민은 10.75이다. 즉, 트리에틸아민에 배위된 프로톤은 암모니아의 경우에 비해 1자릿수 정도 해리하기 어렵다. 이것은 트리에틸아민이 암모니아보다 10배 강한 염기임을 나타낸다.
산해리상수를 지표로 사용함으로써, 클라이젠 축합 등 수소 이탈이 관여하는 반응에 필요한 염기를 추정할 수 있다.
또한 산과 염기에는 "딱딱한", "무른"이라는 표현으로 나타내는 정성적인 성질이 있다. 자세한 내용은 HSAB 원리를 참조한다.
4. 2. 농도를 포함한 세기
수소이온농도(pH)는 일반적으로 수용액 중에서 수소 이온의 농도를 로그로 나타낸 것이다. 수소이온농도는 현실적인 산·염기의 강도에 맞는 지표이지만, 단순히 산·염기의 농도에 비례하는 것이 아니므로, 값을 알고 싶을 때는 산염기 지시약 등으로 조사할 필요가 있다. 또, 수용액 이외에 적용하는 경우에는, 자체 해리나 수평화 효과를 고려할 필요가 있다. 상온에서는, pH가 7일 때 중성, 7보다 작을 때 산성, 7보다 클 때 염기성이다.어떤 물질의 용액의 산·염기를 논할 때는, 그 물질의 농도도 중요한 요소가 된다. 농도를 포함한 산·염기의 지표로는, 규정도와 수소이온농도가 있다. 규정도는 산·염기의 가수와 몰농도의 곱으로 표현되는 값으로, 단위 '''N'''으로 나타낸다. 단, IUPAC[39] 및 일본의 계량법에서는 사용이 권장되지 않는다.[40]
5. HSAB 이론
랄프 피어슨은 1963년에 경산과 연산의 원리로 알려진 정성적 개념을 제안했고[33], 이는 1984년 로버트 파에 의해 정량화되었다.[34][35] '경산'은 크기가 작고, 높은 전하 상태를 가지며, 분극률이 약한 종에 적용된다. '연산'은 크기가 크고, 낮은 전하 상태를 가지며, 분극률이 강한 종에 적용된다. 산과 염기는 상호 작용하며, 가장 안정적인 상호 작용은 경산-경산 및 연산-연산이다. 이 이론은 유기화학 및 무기화학에서 활용되고 있다.
6. ECW 모델
ECW 모델은 루이스 산-염기 상호작용의 세기(–Δ''H'')를 기술하고 예측하는 정량적 모델이다.[36] 러셀 S. 드라고(Russell S. Drago)가 이 모델을 고안했으며, 많은 루이스 산과 염기에 ''E''와 ''C'' 매개변수를 할당했다. 각 산은 ''E''A와 ''C''A로 특징지어지며, 각 염기도 마찬가지로 ''E''B와 ''C''B로 특징지어진다. ''E''와 ''C'' 매개변수는 각각 산과 염기가 형성할 결합의 세기에 대한 정전기적 기여와 공유결합적 기여를 나타낸다. 다음 방정식으로 산-염기 상호작용의 세기를 예측할 수 있다.[36]
: -ΔH = EAEB + CACB + W
''W'' 항은 이량체 산 또는 염기의 절단과 같은 산-염기 반응에 대한 일정한 에너지 기여를 나타낸다. 이 방정식은 산과 염기의 세기 역전을 예측하며, 그래픽 표현은 루이스 염기 세기 또는 루이스 산 세기에 대한 단일 순서가 없음을 보여준다.[36]
참조
[1]
harvnb
Table of discoveries attributes Antoine Lavoisier as the first to posit a scientific theory in relation to oxyacids.
[2]
journal
Understanding the Relationship Among Arrhenius, Brønsted–Lowry, and Lewis Theories
[3]
journal
The origin of the term "base"
[4]
journal
Systems of Acids and Bases
1940-03-01
[5]
harvnb
[6]
harvnb
[7]
harvnb
table of discoveries attributes Justus von Liebig's publication as 1838
[8]
harvnb
[9]
book
Inorganic Chemistry
Prentice-Hall
[10]
book
General Chemistry
Saunders
[11]
harvnb
[12]
journal
Standard definition of terms relating to mass spectrometry recommendations
https://www.degruyte[...]
2013-06-01
[13]
book
IUPAC Compendium of Chemical Terminology (interactive version)
http://goldbook.iupa[...]
International Union of Pure and Applied Chemistry
2007-05-09
[14]
book
Chemistry
Prentice-Hall
[15]
website
Theories of acids and bases
https://www.chemguid[...]
2018-04-18
[16]
book
The Technology of Cake Making
https://books.google[...]
Springer
2009-08-12
[17]
book
Bakery Processes, Chemical Leavening Agents
John Wiley & Sons
[18]
journal
Einige Bemerkungen über den Begriff der Säuren und Basen
1923
[19]
journal
The uniqueness of hydrogen
https://archive.org/[...]
1923
[20]
harvnb
According to this page, the original definition was that "acids have a tendency to lose a proton"
[21]
document
Removal and addition of a proton from the nucleus of an atom does not occur it would require very much more energy than is involved in the dissociation of acids.
[22]
harvnb
[23]
harvnb
Table of discoveries attributes the date of publication/release for the Lewis theory as 1924.
[24]
harvnb
[25]
journal
A General Theory of Solvent Systems
1925-10-06
[26]
book
Greenwood&Earnshaw1st
[27]
book
Greenwood&Earnshaw1st
[28]
journal
Solubility of Water Vapor in Alkali Borate Melts
[29]
journal
"Säuren" und "Basen" im Schmelzfluss: die Bestimmung. der Sauerstoffionen-Konzentration
[30]
journal
The Acidic and Basic Properties of Oxides
[31]
journal
The Synthesis of Oxyhalides Utilizing Fused-Salt Media
[32]
book
Greenwood&Earnshaw1st
[33]
journal
Hard and Soft Acids and Bases.
[34]
journal
Absolute hardness: companion parameter to absolute electronegativity
[35]
journal
Chemical hardness and density functional theory
http://www.ias.ac.in[...]
[36]
논문
The ECW Model
[37]
웹사이트
http://daecr1.harvar[...]
[38]
웹사이트
http://www.chem.wisc[...]
[39]
웹사이트
Compendium on Analytical Nomenclature (''The Orange Book'') #6.3 The use of the equivalence concept
http://www.iupac.org[...]
[40]
웹사이트
計量法 附則第3条第2項 附則別表第2
https://laws.e-gov.g[...]
e-Gov
2019-12-29
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com