적정 (과학)
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
적정(Titration)은 부피를 정밀하게 측정한 분석 대상 용액에 적정제를 조금씩 가하여 반응시켜 분석 대상 용액의 농도를 결정하는 분석 방법이다. 1828년 프랑스 화학자 조제프 루이 게이뤼삭에 의해 "주어진 시료 내 물질의 농도를 결정하다"는 의미로 처음 사용되었다. 적정에는 산염기 적정, 산화환원 적정, 침전 적정, 착물 생성 적정 등이 있으며, 반응의 생성물이 한 가지이고, 평형 상수가 크며, 당량점을 결정하기 위한 지시약이나 측정 방법이 존재해야 하는 등의 조건을 만족해야 한다. 종말점을 결정하기 위해 지시약, pH 미터, 전위차계, 열량계, 분광기 등 다양한 방법이 사용된다. 적정은 바이오디젤 연료, 켈달법, 산가 측정 등 다양한 분야에서 활용된다.
더 읽어볼만한 페이지
2. 역사
"적정"이라는 단어는 1543년 금화나 은화 또는 금은 세공품에 함유된 금이나 은의 비율, 즉 순도의 척도를 의미하는 프랑스어 'titrer'에서 유래했다. 'Tiltre'는 'titre'가 되었는데,[4] 이는 "합금된 금의 순도"[5]를 의미하게 되었고, 그 후 "주어진 시료 내 물질의 농도"[6]를 의미하게 되었다. 1828년, 프랑스 화학자 조제프 루이 게이뤼삭이 처음으로 'titre'를 동사('titrer')로 사용하여 "주어진 시료 내 물질의 농도를 결정하다"라는 의미를 부여했다.[7]
용량 분석은 18세기 후반 프랑스에서 시작되었다. 프랑스 화학자 프랑수아 앙투안 앙리 데크루아질는 1791년에 최초의 뷰렛(눈금 실린더와 유사함)을 개발했다.[8][9][10] 조제프 루이 게이뤼삭은 측면 팔이 있는 뷰렛의 개선된 버전을 개발하고, 1824년 인디고 용액 표준화에 관한 논문에서 "피펫"과 "뷰렛"이라는 용어를 만들었다.[11] 최초의 진정한 뷰렛은 1845년 프랑스 화학자 에티엔 오시앙 앙리에 의해 발명되었다.[12][13][14][15] 칼 프리드리히 모어는 뷰렛을 간단하고 편리한 형태로 재설계하고, 1855년에 이 주제에 관한 최초의 교과서인 ''Lehrbuch der chemisch-analytischen Titrirmethode''(''화학 분석 적정 방법 교과서'')를 출판하여 방법의 주요 개선과 용량 분석의 대중화에 기여했다.[16][17]
3. 적정의 과정
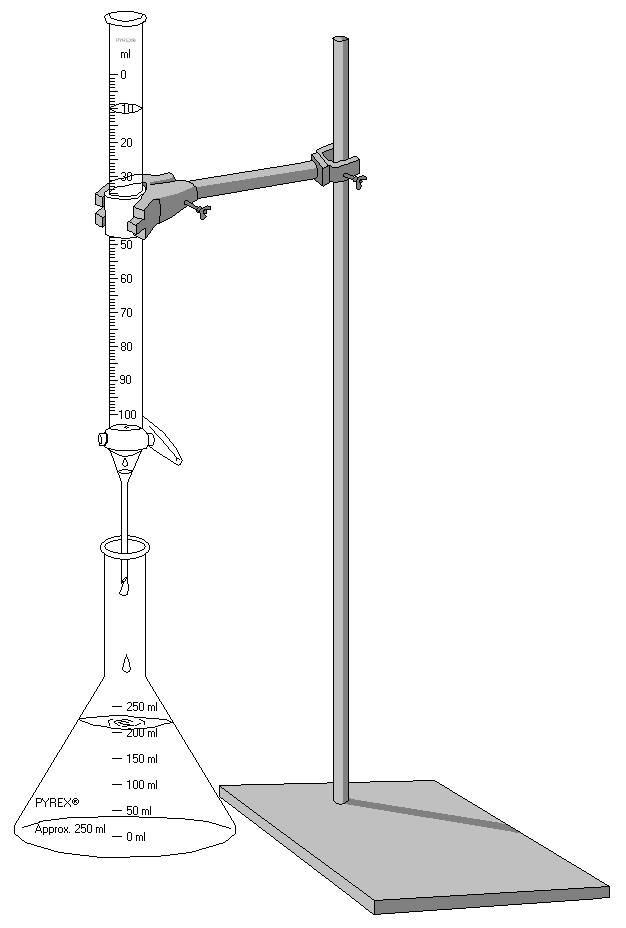
일반적인 적정 실험은 부피를 정밀하게 측정한 분석 대상 용액과 페놀프탈레인과 같은 약간의 pH 지시약이 담긴 비커나 에를렌마이어 플라스크를 적정제가 담긴 뷰렛 밑에 놓고 시작한다.[18] 적정제를 조금씩 분석 대상 용액에 투여하며, 투여할 때마다 플라스크를 흔들어 두 용액이 잘 섞이게 한다.
반응물이 종말점에 이르면 분석 대상 용액의 농도를 측정한다.[55] 이때, 단 한 방울의 적정제로 인해 비커 속 반응물의 농도가 변하여 지시약의 색이 확연하게 변할 수 있으므로 주의해야 한다.
표준 용액을 뷰렛을 사용하여 피적정 물질에 적가하여 반응을 진행시키고, 모든 피적정 물질이 반응을 완료한 시점을 당량점이라고 한다. 당량점은 지시약을 사용한 비색법이나, pH 또는 산화 환원 전위 등 물리량 변화 측정을 통해 결정한다. 당량점에 도달하는 데 필요한 표준 용액의 부피는 뷰렛 눈금으로 구하고, 화학량론적 계산으로 피적정 물질의 양을 결정한다.
:
:는 분석대상 용액의 몰 농도, 는 적정제의 몰 농도, 는 실험에 사용된 적정제의 부피 (리터), 은 분석 대상 용액의 몰수 / 적정제의 몰수 (균형 화학 반응식으로 구한다), 는 실험에 사용된 분석 대상 용액의 부피 (리터)이다.
3. 1. 적정에서 유용한 테크닉
일반적인 적정 실험에서는 적정제와 분석 대상 모두 액체 상태로 존재해야 한다. 고체 상태의 물질을 적정하기 위해서는 보통 수용액으로 만드는데, 에탄올이나 빙초산 같은 용매에 용해시키는 경우도 있다(석유화학).[56] 만약 분석 대상 용액이 고농도라면 실험의 정확도를 위해서 일반적으로 희석시켜 사용한다.
산-염기 적정 이외에 많은 적정 실험들은 반응하는 과정에서 일정한 pH 상태를 요하기도 한다. 이를 위해서 완충 용액을 사용하여 pH를 유지하는데에 도움을 주기도 한다.[20]
몇몇 산화환원 적정 실험에서는 용액을 가열하고 적정하는 동안에도 가열하는 경우가 있다. 이는 그냥 실험을 진행할 경우에 반응 속도를 증가시켜 주기 위함이다. 옥살산염 용액들은 60°C 정도의 온도를 유지하면서 실험을 진행해야 적당한 반응의 속도가 유지된다.[22]
4. 적정의 종류
적정에는 다양한 종류, 과정과 목표가 있다. 가장 흔하게 접할 수 있는 정량 분석 적정은 산-염기 적정과 산화환원 적정이다.
4. 1. 산-염기 적정
산()의 수소 이온과 염기()의 수산화이온은 1:1로 반응하여 물()을 생성하는데, 이를 중화반응이라고 한다. 산-염기 적정은 농도를 알고 있는 산이나 염기를 이용하여 농도를 모르는 염기나 산의 농도를 구하는 방법이다.[57] 중화반응은 매우 빠르게 일어나기 때문에, 보통 산-염기 지시약을 사용하여 색 변화를 통해 눈으로 종말점을 확인한다. 하지만 종말점은 정확한 당량점이 아니므로, 정밀한 측정을 위해 pH 미터를 사용하기도 한다.강산과 강염기가 반응하면 중화점의 pH는 7에 가깝지만, 약산과 강염기, 또는 강산과 약염기가 반응하면 중화점의 pH는 7보다 크거나 작다.

산-염기 적정은 산과 염기가 섞였을 때 일어나는 중화를 이용한다. 적정 용기에 시료와 함께 적절한 pH 지시약을 넣어 당량점의 pH 범위를 알 수 있다. 산-염기 지시약은 색 변화를 통해 적정의 종말점을 나타낸다. 종말점과 당량점은 정확히 같지 않으므로, 지시약을 신중하게 선택해야 지시약 오차를 줄일 수 있다. 예를 들어 당량점이 pH 8.4라면, 알리자린 옐로우 대신 페놀프탈레인을 사용해야 오차가 적다. 일반적인 지시약, 색상, pH 범위는 위 표에 나와 있다.[25] 더 정확한 결과가 필요하거나 약산과 약염기를 사용하는 경우에는 pH 미터나 전도도계를 사용한다.
유기리튬 시약, 금속 아마이드, 수소화물과 같이 매우 강한 염기를 사용할 때는 물 대신 THF와 같은 무수 용매를 사용하고, pKa 값이 수용액 pH 변화 범위에 있는 지시약은 거의 사용하지 않는다.[26][27]
4. 2. 산화환원 적정
산화환원 적정은 적정제와 분석 대상 용액의 산화환원 반응에 기초한다. 산화환원 적정의 종말점은 산화환원 지시약 또는 전위차계를 이용해 구할 수 있다.[58] 과망간산칼륨을 이용한 적정 실험에서는 산화제인 과망간산칼륨(KMnO4)이 과량 존재할 때 과망간산 이온(MnO4-)이 당량점을 넘어 붉은 적색에서 자주색으로 변하기 때문에 지시약 없이도 육안으로 종말점을 확인할 수 있다.[60]실험에 따라서는 지시약이 필요한 경우도 있다.
- 실험 구성 요소 중 산화제가 중크롬산칼륨 (potassium dichromate)일 때, 주황색에서 초록색으로의 용액의 색깔 변화가 명확하지 않기 때문에 디페닐아민 지시약 (sodium diphenylamine)을 사용한다.[58]
- 와인에 첨가되는 이산화황(sulfur dioxide)은 산화제로써 아이오딘(iodine)을 필요로 한다. 이 때 녹말가루가 지시약으로 사용될 수 있는데, 녹말과 아이오딘이 반응하여 생기는 푸른 물질은 아이오딘의 과잉으로 생성되어 종말점을 알려준다.[59]

4. 3. 기타 적정
기체상 적정은 기체 상에서 수행되는 적정으로, 다른 기체(적정제 역할)를 과량으로 반응시켜 반응성 종을 결정하는 방법이다. 일반적인 기체상 적정의 한 예로, 다음 반응에 따라 기체 오존을 산화질소로 적정하는 방법이 있다.[34][35]:O₃ + NO → O₂ + NO₂.
반응이 완료된 후, 남은 적정제와 생성물을 푸리에 변환 분광법(FT-IR)등을 사용하여 정량한다. 이를 통해 원래 시료에 있는 분석물질의 양을 결정한다. 기체상 적정은 단순 분광광도법에 비해 측정이 경로 길이에 의존하지 않고, 비어-람베르트 법칙에 정의된 대로 분석물질 농도의 함수로 흡광도의 선형적 변화에 의존하지 않으며, 일반적으로 분석물질에 사용되는 파장에서 간섭하는 종을 포함하는 시료에 유용하다는 장점이 있다.[36]
착염 적정법은 분석물과 적정액 사이에 착물이 형성되는 것을 기반으로 한다. 일반적으로 분석물과 약한 착물을 형성하는 특수한 착염 지시약이 필요하다. 가장 일반적인 예는 요오드 적정의 민감도를 높이기 위해 녹말 지시약을 사용하는 것으로, 요오드와 요오드화물과 녹말이 형성하는 진한 파란색 착물은 요오드 단독보다 더 잘 보인다. 다른 착염 지시약으로는 칼슘과 마그네슘 이온의 적정에 사용되는 에리오크롬 블랙 T와 용액 중 금속 이온을 적정하는 데 사용되는 킬레이트제 EDTA가 있다.[37]
제타 전위 적정은 콜로이드와 같은 불균일계를 특성화하기 위해 지시약이 아닌 제타 전위를 통해 완료 여부를 모니터링하는 적정법이다.[38] 용도 중 하나는 pH를 변경하거나 계면활성제를 첨가하여 표면 전하가 0이 되는 등전점을 결정하는 것이다. 또 다른 용도는 플록큘레이션 또는 안정화에 대한 최적 용량을 결정하는 것이다.[39]
검정법(assay)은 바이러스 또는 세균의 농도를 결정하는 데 사용되는 일종의 생물학적 적정법이다. 시료를 일정 비율(예: 1:1, 1:2, 1:4, 1:8 등)로 연속 희석하여 마지막 희석액에서 바이러스 존재에 대한 양성 반응이 나타나지 않을 때까지 진행한다. 양성 또는 음성 값은 현미경으로 감염된 세포를 시각적으로 검사하거나 효소결합면역흡착측정법(ELISA)과 같은 면역효소측정법으로 결정할 수 있다. 이 값을 역가라고 한다.[40]
5. 종말점 측정
적정 실험에서 종말점을 결정하는 방법은 다음과 같다.[61]

- 전위차계 (potentiometer): 산화환원 적정에서 전극 전위를 측정한다.
- pH 미터 (pH meter): 반응물에 있는 H+ 이온 양을 pH로 나타낸다. pH가 갑자기 변하면 종말점에 도달한 것이다.

- 전도율 (conductivity): 용액 속 이온을 측정한다.
- 색 변화 (color change): 지시약 없이 용액 색깔이 변하는 경우도 있다.
- 침전 (precipitation): 고체 침전물이 생기기 시작할 때 당량점이나 종말점에 도달했다고 판단한다. 은 이온(Ag+) 포함 실험에서 주로 나타난다.
- 등온선 열량계 (isothermal titration calorimeter): 반응으로 생성되거나 소모된 열을 측정한다. 기질과 효소 반응 같은 생화학 적정에 쓰인다.
- Thermometric titrimetry: 등온선 열량계와 달리 온도 변화율로 종말점을 결정한다.[62]
- 분광기 (spectroscopy)
- Amperometry: 용액이 산화, 환원되며 나오는 전류를 측정한다. 전류 변화로 종말점을 찾는다.
5. 1. 종말점과 당량점
종말점과 당량점은 보통 혼용되지만 약간 다른 의미를 가지고 있다. 당량점은 몰수, 부피, 농도가 완벽하게 일치하는 이론적인 지점이다. 하지만 종말점은 실험자가 실험을 통해 결정하는 것으로, 보통 육안으로 확인하기 때문에 당량점과 비교했을 때 오차가 생긴다.[63]당량점과 종말점은 종종 같은 의미로 사용되지만, 사실은 다른 용어이다. ''당량점''은 적정제의 몰수가 분석 물질의 몰수와 같거나(예: 일양성자산), 그 배수가 되는(예: 다양성자산) 시점에 첨가된 적정제의 부피로, 반응의 이론적인 완결점을 의미한다. 반면 ''종말점''은 지시약이나 기기가 결정하는 용액의 물리적 변화로, 실제로 측정되는 값이다.[42]
적정의 종말점과 당량점 사이에는 약간의 차이가 있으며, 이 오차는 지시약 오차라고 하며 불확정적이다.[43]
5. 2. 역적정 (Back Titration)
역적정은 적정 실험을 반대로 수행하는 것이다. 원래 용액을 적정하는 대신 과량의 표준용액을 반응시키고 남은 것을 적정하는 것이다. 역적정은 일반 적정실험보다 역적정의 종말점을 찾기 수월할 때 행해지는데, 일반적으로 침전 반응에서 사용된다.[64] 또한 역적정은 적정제와 분석 대상 용액의 반응속도가 매우 느리거나 분석 대상 물질이 난용성 고체일 때 유용하게 사용된다.[64][44]
6. 적정에 이용되는 반응
적정에는 다음과 같은 반응들이 이용될 수 있다.
- 산염기 반응
- 산화환원 반응
- 침전 반응
- 착물 생성 반응
그러나 모든 반응이 적정에 사용되는 것은 아니며, 반응에는 다음과 같은 조건이 충족되어야 한다.
1. 반응의 생성물은 한 가지이며, 부반응이 발생해서는 안 된다.
2. 반응의 평형 상수가 매우 크고, 당량점에서 반응이 완결되어 미반응의 피적정 물질이나 적정제가 남아 있지 않아야 한다.
3. 당량점을 결정하기 위한 지시약이나 측정 방법이 존재해야 한다.
4. 적가한 적정제는 신속하게 반응이 진행되어야 한다.
7. 지시약
- 산염기 지시약
- 산화환원 지시약
- 흡착 지시약
대표적인 지시약 명칭은 지시약 목록에서 확인할 수 있다.
8. 활용
적정은 다음과 같이 다양한 분야에서 활용된다.
- 바이오디젤 연료: 폐식용유(WVO)는 배치 처리 전에 중화해야 한다. 폐식용유의 일부를 염기로 적정하여 산도를 측정하여 나머지 배치를 적절히 중화할 수 있다. 이렇게 하면 바이오디젤 연료 대신 비누를 만드는 데 사용되는 유리 지방산을 폐식용유에서 제거한다.[47]
- 켈달법: 시료 내 질소 함량 측정법. 유기 질소는 황산과 황산칼륨으로 암모니아로 분해된다. 마지막으로 암모니아는 붕산으로 역적정한 다음 탄산나트륨으로 적정한다.[8]
- 산가: 시료 1g당 산을 완전히 적정하는 데 필요한 수산화칼륨(KOH)의 질량(mg). 예를 들어 유리 지방산 함량을 결정하는 데 사용된다.
- 비누화가: 시료 1g당 지방산을 비누화하는 데 필요한 KOH의 질량(mg). 비누화는 지방 내 지방산의 평균 사슬 길이를 결정하는 데 사용된다.
- 에스터가(또는 에스터 지수): 계산된 지수. 에스터가 = 비누화가 – 산가.
- 아민가: 시료 1g당 아민 함량과 같은 KOH의 질량(mg).
- 수산가: 시료 1g당 수산기에 해당하는 KOH의 질량(mg). 분석물은 초산무수물을 사용하여 아세틸화한 다음 KOH로 적정한다.
- 윙클러법: 물 속의 산소 농도를 측정하는 데 사용된다. 물 샘플 속의 산소는 황산망간(II)를 사용하여 환원되는데, 이는 요오드화칼륨과 반응하여 요오드를 생성한다. 생성된 요오드의 양은 시료 내 산소량에 비례하므로, 전분 지시약을 사용하여 티오황산염으로 요오드를 적정하여 산소 농도를 결정한다.[49]
- 비타민 C: 아스코르브산으로도 알려진 비타민 C는 강력한 환원제이다. 비타민 C의 농도는 청색 염료인 DCPIP로 적정할 때 쉽게 확인할 수 있다. 비타민 C에 의해 환원되면 무색으로 변하기 때문.[50]
- 베네딕트 용액: 소변 내 과량의 포도당은 환자의 당뇨병을 나타낼 수 있다. 베네딕트 방법은 준비된 시약을 사용하여 소변 내 포도당을 정량하는 일반적인 방법이다. 이러한 적정 과정에서 포도당은 구리(II) 이온을 구리(I) 이온으로 환원하고, 이는 티오시안산칼륨과 반응하여 흰색 침전물을 생성하여 종말점을 나타낸다.[51]
- 브롬 지수: 분석물의 불포화도를 측정한 값으로, 시료 100g당 흡수된 브롬의 밀리그램으로 표시한다.
- 요오드 지수: 분석물의 불포화도를 측정한 값으로, 시료 100g당 흡수된 요오드의 그램으로 표시한다.
- 칼 피셔 적정법: 물질 내 미량의 수분을 분석하는 전위차 적정법이다. 시료를 메탄올에 녹이고, 칼 피셔 시약( 요오드, 이산화황, 염기 및 알코올과 같은 용매로 구성됨)으로 적정한다. 시약에는 요오드가 포함되어 있으며, 이는 물과 비례적으로 반응한다. 따라서 과량의 요오드의 전위를 모니터링하여 수분 함량을 결정할 수 있다.[52]
참조
[1]
백과사전
Titrimetry
The Century Co.
1911
[2]
서적
Compendium for Basal Practice in Biochemistry
Aarhus University
2008
[3]
웹사이트
Titrand
http://www.answers.c[...]
McGraw-Hill
2011-09-30
[4]
웹사이트
titre (in French)
http://www.cnrtl.fr/[...]
[5]
웹사이트
Etymology On Line: titrate
http://www.etymonlin[...]
[6]
웹사이트
WordReference: titre and titer
http://www.wordrefer[...]
[7]
학술지
Essai des potasses du commerce
https://babel.hathit[...]
1828
[8]
서적
History of Analytical Chemistry
Taylor & Francis
1993
[9]
학술지
Description et usages du Berthollimêtre, ...
http://gallica.bnf.f[...]
1795
[10]
학술지
François Antoine Henri Descroizilles
http://revista.cnic.[...]
2014
[11]
학술지
Instruction sur l'essai du chlorure de chaux
https://babel.hathit[...]
1824
[12]
학술지
Nouvelles expériences sur l'essai des potasses du commerce et appareil dit potassimètre pour l'effectuer
https://babel.hathit[...]
1845
[13]
학술지
The history of chemical laboratory equipment
https://pp.bme.hu/ch[...]
1986
[14]
서적
History of Analytical Chemistry
https://books.google[...]
Permagon Press
1966
[15]
학술지
L'analyse volumétrique de 1790 à 1860. Caractéristiques et importance industrielle. Evolution des instruments.
1971
[16]
서적
Four Centuries of Clinical Chemistry
CRC Press
1999
[17]
서적
Lehrbuch der chemisch-analytischen Titrirmethode ... , part 1
https://babel.hathit[...]
Friederich Vieweg und Sohn
1855
[18]
학술지
Digital image-based titrations
2006
[19]
서적
Chemistry of Petrochemical Processes
Gulf Professional Publishing
2001
[20]
서적
Comprehensive Chemistry XI
Laxmi Publications
[21]
서적
Dean's Analytical Chemistry Handbook
McGraw-Hill Prof Med/Tech
2004
[22]
서적
Essentials of Geochemistry
Jones & Bartlett Learning
2005
[23]
서적
Chemistry: Principles and Practice
Cengage Learning
2009
[24]
서적
CK12 Chemistry
CK-12 Foundation
2009
[25]
웹사이트
pH measurements with indicators
http://www.ph-meter.[...]
2011-09-29
[26]
웹사이트
Titrating Soluble RM, R2NM and ROM Reagents
https://www.shenvila[...]
[27]
웹사이트
Methods for Standardizing Alkyllithium Reagents (literature through 2006)
https://www.chem.tam[...]
2014-06-04
[28]
서적
Quantitative Chemical Analysis
https://www.academia[...]
Freeman and Company
2007
[29]
서적
Analytical Chemistry: An Introduction, seventh edition
https://archive.org/[...]
Emily Barrosse
2000
[30]
서적
The Henderson-Hasselbalch Equation: Its History and Limitations
Journal of Chermical Education
2001
[31]
서적
Vogel's textbook of quantitative chemical analysis
Prentice Hall
2000
[32]
서적
Table wines: the technology of their production
University of California Press
1970
[33]
서적
Fresenius' Journal of Analytical Chemistry
J.F. Bergmann
1959
[34]
서적
Metrology and Fundamental Constants
IOS Press
2007
[35]
웹사이트
Gas phase titration
http://www.bipm.fr/e[...]
Bureau International des Poids et Mesures
2001-09-29
[36]
저널
Comparison of Ozone Determinations by Ultraviolet Photometry and Gas-Phase Titration
1976-09-01
[37]
서적
Basic Concepts of Analytical Chemistry
New Age International
[38]
저널
Calculation of Zeta-Potentials from Electrokinetic Data
CRC Press
[39]
서적
Characterization of liquids, nano- and micro- particulates and porous bodies using Ultrasound
Elsevier
[40]
서적
Introduction to immunology
Wiley-Blackwell
[41]
백과사전
Titration
http://www.answers.c[...]
McGraw-Hill
2011-09-30
[42]
서적
Quantitative Chemical Analysis
Macmillan
[43]
서적
Technician's Formulation Handbook for Industrial and Household Cleaning Products
Lulu.com
[44]
서적
Analytical Chemistry for Technicians
CRC Press
[45]
웹사이트
The Equligraph: Revisiting an old tool
http://www.tahosa.us[...]
2015-01-01
[46]
서적
Ionic Equilibria in Analytical Chemistry
Kreiger
[47]
서적
Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet
https://archive.org/[...]
Ulysses Press
[48]
서적
Remington: the science and practice of pharmacy
Lippincott Williams & Wilkins
[49]
서적
Handbook of Water and Wastewater Treatment Plant Operations
https://archive.org/[...]
CRC Press
[50]
서적
Biology
Taylor & Francis
[51]
서적
Lab Manual Of Biochemistry
Tata McGraw-Hill Education
[52]
서적
Soil Chemical Analysis: Advanced Course
UW-Madison Libraries Parallel Press
[53]
서적
과학용어사전
뉴턴코리아
2010-04-14
[54]
저널
Compendium for Basal Practice in Biochemistry
Aarhus University
[55]
서적
Quantitative Chemical Analysis (7th) pg. 12
https://archive.org/[...]
W.H. Freeman and Company
[56]
서적
Chemistry of Petrochemical Processes (2 ed.)
Gulf Professional
[57]
저널
약산과 강염기의 중화적정반응을 통한 pH값 결정하기
[58]
서적
Vogel's textbook of quantitative chemical analysis (6 ed.)
https://archive.org/[...]
Prentice Hall
[59]
서적
Table wines: the technology of their production 2
https://archive.org/[...]
University of California Press
[60]
서적
German Chemical Society: Division of Analytical Chemistry
University of Michigan
[61]
저널
Science & Technology Encyclopedia
McGraw-Hill
2011-09-30
[62]
저널
Thermometric Titrimetry
Royal College of Advanced Technology, Salford, Lancashive
1965-09-15
[63]
서적
Quantitavie Chemical Analysis (6 ed.)
Macmillan
[64]
서적
Analytical Chemistry for Technicians 1 (3 ed.)
CRC Press
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com