바이러스
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
바이러스는 DNA 또는 RNA를 유전 물질로 사용하며, 단백질 껍질인 캡시드로 둘러싸인 비세포성 감염체이다. 바이러스는 숙주 세포 내에서만 증식할 수 있으며, 생물과 무생물의 특징을 모두 가지고 있다. 바이러스는 역사적으로 질병의 원인으로 인식되었으며, 현재는 생명 과학 연구, 의학, 재료 과학 등 다양한 분야에서 활용된다. 바이러스는 숙주 범위, 유전 물질 종류, 구조 등에 따라 다양한 종류로 분류되며, 생물체에 미치는 영향과 방어 기전, 치료 및 예방 방법, 그리고 생태계에서의 역할과 진화에서의 역할 또한 다양하다.
더 읽어볼만한 페이지
- 바이러스 - 바이러스 복제
바이러스 복제는 바이러스가 숙주 세포 내에서 자신의 유전 물질을 복제하여 새로운 바이러스 입자를 생성하는 과정으로, 숙주 세포의 자원을 이용해 부착, 침투, 탈피, 복제, 조립, 성숙, 방출의 단계를 거치며, 유전체 종류에 따라 다양한 복제 전략을 가진다. - 바이러스 - 종양바이러스
종양바이러스는 숙주에게 암을 유발할 수 있으며, 암유전자 삽입이나 원종양유전자 활성 증가를 통해 종양을 발생시키고, 인간 유두종 바이러스, B형 간염 바이러스 등이 대표적이며, 백신 개발 및 예방 노력이 이루어지고 있다. - 바이러스학 - 코로나19 백신
코로나19 백신은 코로나19 감염을 예방하기 위해 개발되었으며, 다양한 기술 플랫폼을 기반으로 전 세계적으로 사용되었으나, 백신 접근성 불평등, 허위 정보, 법적 책임 문제 등 논란과 변이 바이러스 출현으로 인한 효과 감소, 부작용 등의 문제도 존재한다. - 바이러스학 - 백신
백신은 약화된 병원체나 일부를 활용하여 인체의 면역계를 활성화, 특정 질병에 대한 항체 생성을 유도하는 의약품으로 감염병 예방에 효과적이지만, 부작용 발생 가능성과 효과의 다양성, 백신 거부와 오해로 인한 접종률 저하 및 감염병 확산의 위험이 존재하며, 지속적인 연구개발을 통해 안전성과 효능이 향상되고 새로운 기술을 이용한 백신들이 개발되고 있다. - 독일어 낱말 - 존더베크
존더베크 이론은 독일 근대화가 다른 유럽 국가들과 달리 늦은 산업화, 반민주적 엘리트, 바이마르 공화국 불안정, 나치즘 등장 등의 특수성을 보이며 전개되었다는 이론으로, 초기에는 긍정적으로 평가되었으나 나치즘 이후 부정적 의미를 갖게 되었고, 현재는 독일 역사 복잡성을 단순화한다는 비판과 유럽 근대화 과정에서 독일 경험의 특수성에 대한 반박이 제기되고 있다. - 독일어 낱말 - 나의 투쟁
《나의 투쟁》은 아돌프 히틀러가 집필한 자서전이자 나치즘의 핵심 이념을 담은 책으로, 히틀러의 유년 시절, 나치당 창당 과정, 인종주의, 반유대주의, 레벤스라움 등의 정치적 신념을 상세히 묘사하고 있다.
| 바이러스 - [생물]에 관한 문서 | |
|---|---|
| 바이러스 | |
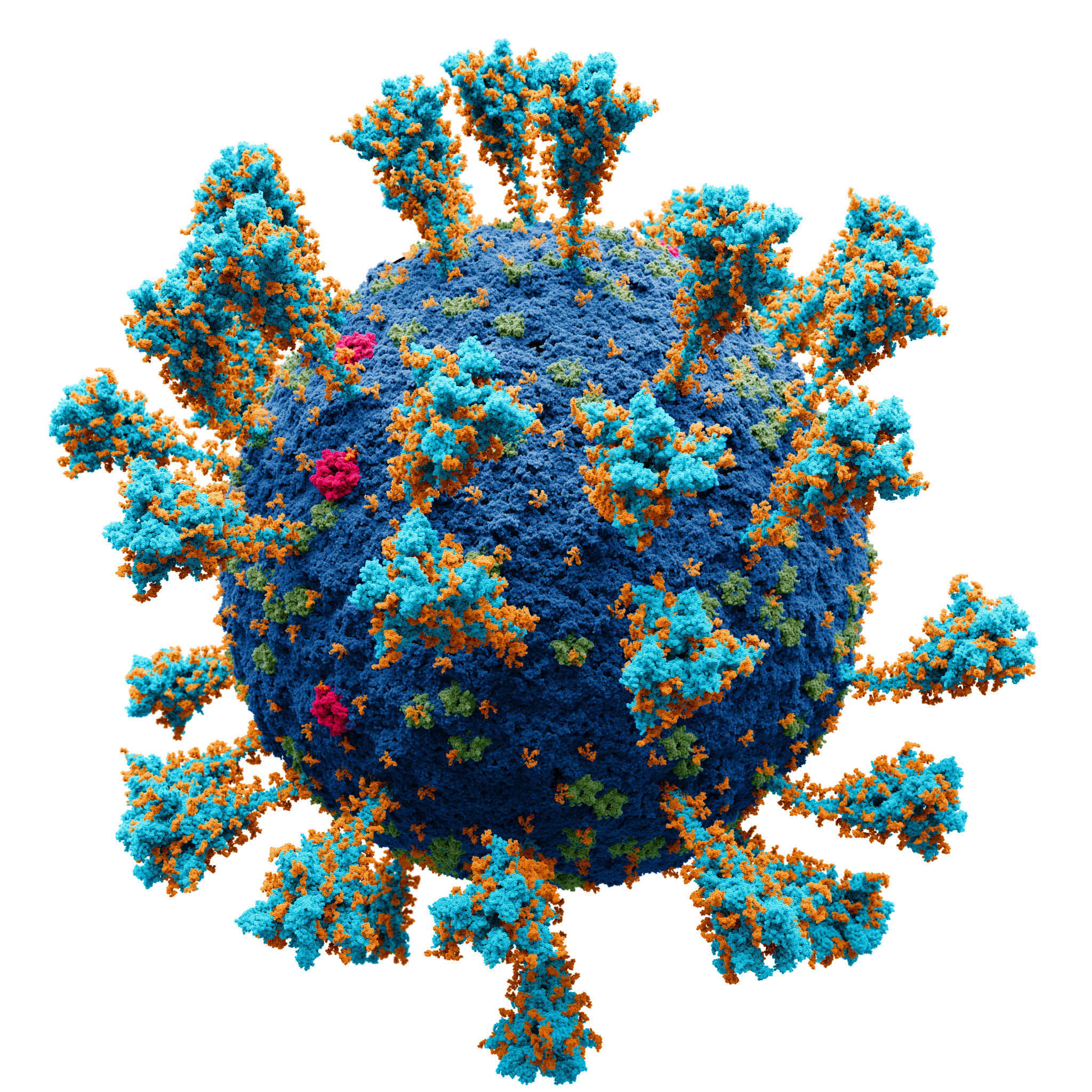 | |
| 분류 | |
| 하위 분류 | (Adnaviria) 듀플로드나바이러스역 모노드나바이러스역 리보바이러스역 (리보지비리아) 바리드나바이러스역 |
| 개요 | |
| 정의 | 세포 내에서 복제하는 감염성 물질 |
| 특징 | 우주에는 별보다 많은 바이러스가 존재한다. 대부분은 인간에게 감염되지 않는다. |
| 생물 여부 논쟁 | 과학자들 사이에서 생물로 봐야 할지 논쟁이 있다. |
| 어원 | |
| 어원 | 라틴어 "virus"(독, 해로운 액체)에서 유래 |
| 다른 언어 표기 | 영어: virus 라틴어: virus 중국어: 病毒 일본어: ウイルス (우이루스) 북한어: 비루스 |
| 기타 | |
| 참고 | 바이러스 소개 미생물학 분류학 |
2. 역사
루이 파스퇴르는 광견병의 병원체를 찾지 못해, 현미경으로 매우 작은 병원균을 발견하는 방법을 연구했다.[259] 1884년, 프랑스의 미생물학자 샤를 샹베르랑은 세균보다 작은 구멍을 가진 필터를 발명하여, 이 필터로 세균을 걸러낼 수 있었다.[260]
1892년, 러시아의 생물학자 드미트리 이바놉스키는 이 필터를 이용하여 담배 모자이크 바이러스를 연구하면서, 감염된 담배 잎 추출물이 필터를 통과해도 감염성이 유지됨을 확인했다. 이바놉스키는 이 감염이 세균의 독성 때문이라고 추측했지만, 더 깊이 연구하지는 않았다.[263] 당시에는 모든 감염체가 필터로 걸러지지 않고 영양 배지에서 증식할 수 있다고 여겨졌으며, 이는 질병의 배종설(매균설)의 일부였다.[261]
1898년, 네덜란드의 미생물학자 마르티뉘스 베이예링크는 이바놉스키의 실험을 반복하여 필터 처리된 용액에 새로운 감염체가 있음을 확인했다. 그는 이 감염체가 분리된 세포에서만 증식하며, 'contagium vivum fluidum'(살아있는 액체 병원체)라고 불렀고, 이를 "바이러스(''virus'')"라고 명명했다.[262]웬들 스탠리가 바이러스의 미립자성을 증명하면서 이 주장은 받아들여지지 않았다.[263] 같은 해, 프리드리히 뢰플러와 파울 프로슈는 최초의 동물성 바이러스인 구제역 바이러스 (아프타바이러스)를 필터로 걸러냈다.[264]
2. 1. 바이러스의 발견
루이 파스퇴르는 광견병의 병원체를 찾을 수 없어, 현미경으로 매우 작은 병원균을 발견하는 것에 대해 고민하였다.[259] 1884년, 프랑스의 미생물학자 샤를 샹베르랑은 세균보다 작은 구멍을 가진 필터를 발명하였다. 그는 이 필터를 통해 세균을 포함한 용액을 통과시켜 용액에서 세균을 걸러낼 수 있었다.[260]1892년, 러시아의 생물학자 드미트리 이바놉스키는 이 필터를 이용하여 담배 모자이크 바이러스를 연구하였다. 그는 감염된 담배 잎에서 으깬 잎 추출물이 필터 과정을 거쳤더라도 감염성이 유지됨을 입증하였다. 이바놉스키는 이 감염이 세균이 만들어낸 독성 때문이라고 생각했지만, 더 깊이 연구하지는 않았다.[263] 당시에는 모든 감염체가 필터를 통해 걸러지지 않고 영양 배지에서 증식할 수 있다고 여겨졌으며, 이는 질병의 배종설(매균설)의 일부였다.[261]
1898년, 네덜란드의 미생물학자 마르티뉘스 베이예링크는 이바놉스키의 실험을 재현하였고, 필터 처리된 용액에 새로운 형태의 감염체가 포함되어 있음을 확인하였다.[262] 그는 이 감염체가 분리된 세포에서만 증식하는 것을 발견했지만, 실험을 통해 그것이 입자로 이루어졌다는 것을 증명하지는 못했다. 그는 이를 'contagium vivum fluidum'이라고 불렀으며, 이 단어를 "바이러스(''virus'')"라고 하였다.[263] 베이예링크는 바이러스가 자연 상태에서 액체라고 주장했으나, 이 이론은 나중에 웬들 스탠리가 바이러스가 미립자성을 띠는 것을 증명하면서 사실이 아님이 밝혀졌다.[263] 같은 해, 프리드리히 뢰플러와 파울 프로슈는 최초의 동물성 바이러스(구제역을 일으키는 아프타바이러스)를 비슷한 필터를 통해 걸러내는 데 성공했다.[264]
2. 2. 초기 연구와 발전
루이 파스퇴르는 광견병의 병원체를 찾을 수 없어 현미경으로 매우 작은 병원균을 발견하는 것을 연구했다.[259] 1884년, 프랑스의 미생물학자 찰스 챔버랜드는 박테리아보다 작은 구멍을 가진 필터를 발명했다. 그는 이 필터를 통해 박테리아를 포함한 용액을 통과시켜 용액에서 박테리아를 걸러낼 수 있었다.[260] 1892년, 러시아의 생물학자 드미트리 이바놉스키는 이 필터를 이용하여 담배모자이크바이러스를 연구했다. 감염된 담배잎에서 으깬 잎 추출물은 필터 과정을 거쳤더라도 감염성이 유지되었다. 이바놉스키는 감염이 박테리아가 만들어낸 독성 때문이라고 생각했지만, 더 연구하지는 않았다.[263] 당시에는 모든 감염체가 필터를 통해 걸러지고 영양배지에서 증식될 수 있다고 여겨졌으며, 이는 질병의 배종설(매균설)의 일부였다.[261] 1898년, 네덜란드의 미생물학자 마루티누스 베이제린크는 이 실험을 반복했고 필터 처리된 용액에 새로운 형태의 감염체가 있다는 것을 입증했다.[262] 그는 이 감염체가 분리된 세포에서만 증식되는 것을 발견했지만, 실험을 통해 입자로 이루어졌다는 것을 증명하지는 못했다. 그는 이것을 ''contagium vivum fluidum''이라 불렀고, '바이러스(''virus'')'라는 낱말을 사용했다.[263] 베이젠리크는 바이러스가 자연 상태에서 액체라고 주장했지만, 웬들 스탠리가 바이러스가 미립자성을 띠는 것을 증명하면서 이 이론은 사실이 아닌 것으로 밝혀졌다.[263] 같은 해에 프리드리히 뢰플러와 프로시는 최초의 동물성 바이러스(구제역을 일으키는 아프타바이러스)를 비슷한 필터를 통해 걸러냈다.[264]이후 프레데릭 트워트와 펠릭스 데렐이 박테리오파지를 발견하고 부분적으로 특성을 규명하면서 바이러스 연구가 더욱 활발해졌다. 1926년, 토마스 밀턴 리버스는 바이러스를 기생성 의무 기생체로 정의했다. 웬델 머디스 스탠리는 바이러스가 유체가 아닌 입자임을 증명했고, 1931년 전자 현미경의 발명으로 바이러스의 복잡한 구조를 볼 수 있게 되었다.[25]
3. 명칭
vīrus|la는 라틴어로 '독' 또는 '유해한 액체'를 의미한다.[8] 영어 단어 "virus"(바이러스)는 이 vīrus|la에서 유래했다.[8][9]
일본어 표기는 라틴어 발음에 가까운 "위일루스"나 "바이러스", 또는 독일어 발음에 가까운 "비이루스"나 "비루스" 등 다양하게 사용되었다.[233] 1953년 일본 바이러스 학회가 설립되면서 "바이러스"라는 표기가 채택되었다.[233]
다음은 유럽 주요 언어에서의 바이러스 철자와 발음을 나타낸 표이다.[234]
| 언어 | 문법적 성 | 단수형 철자 | 단수형 발음(국제 음성 기호) | 복수형 철자 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 라틴어 | 중성 | {{lang|la|vīrus|} | }||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 음차 ("vi"의 음차 차이로 분류) | 의역 | |||||
|---|---|---|---|---|---|---|
| "v"\"vi" | 1음절 | 2음절 | ||||
| 1모라 | 2모라 (장음 포함) | 3모라 (장음 포함) | 2모라 | |||
| 자음 | 빌스 | 비이루스 | 비이루스 | 바이라스 | 병독[245][246] 여과성 병원체 | |
| ヴ일스 | 비일루스 | 뷰일루스 뷰ヰ루스 | 바이라스 ヷ이라스 | |||
| () | 위루스 | 위일루스 | 와이라스 | |||
| 모음 | / | 우일루스 | 바이러스 | |||
4. 특징
바이러스는 세포 구조가 없고, 숙주 세포 내에서만 증식할 수 있는 등 일반적인 생물과는 다른 특징을 가진다. 바이러스는 생물적 특성과 무생물적 특성을 모두 가지고 있어, 생물과 무생물의 중간 단계로 분류된다.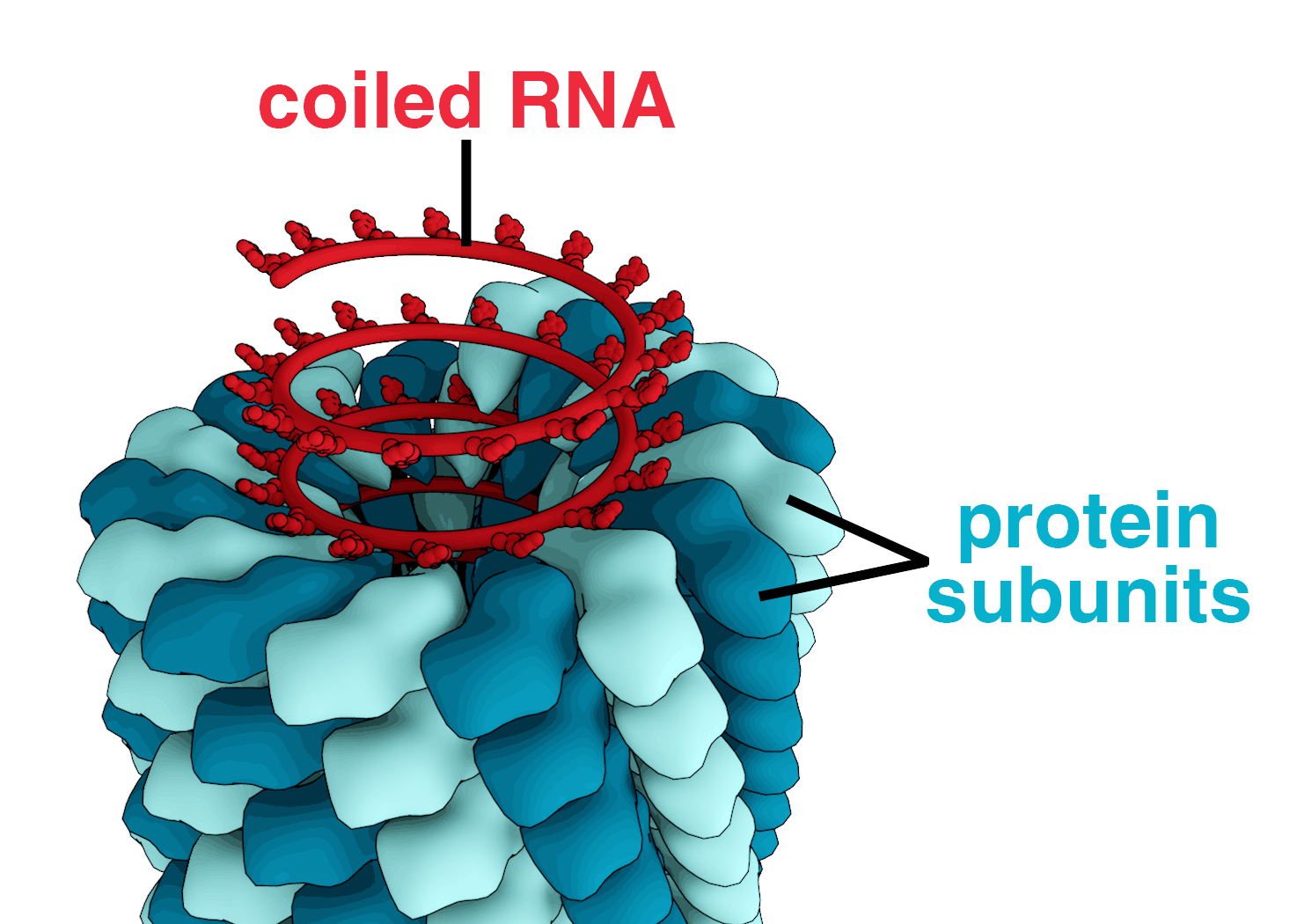

바이러스는 다양한 크기와 모양을 보이며, 이를 '형태'라고 한다. 일반적으로 바이러스는 박테리아보다 훨씬 작다. 예를 들어, ''대장균'' 박테리아 세포 내부에는 천 개가 넘는 박테리오파지 바이러스가 들어갈 수 있다.[4] 연구된 많은 바이러스는 구형이며 직경이 20~300 나노미터이다. 일부 필로바이러스는 필라멘트 형태로 총 길이가 최대 1400nm에 달하지만, 직경은 약 80nm에 불과하다.[4] 대부분의 바이러스는 광학 현미경으로 볼 수 없어 전자 현미경을 사용해야 한다.[4]
비리온(virion)이라고 불리는 완전한 바이러스 입자는 캡시드라는 보호 단백질 코트로 둘러싸인 핵산으로 구성된다. 캡시드는 캡소머라고 하는 단백질 소단위로 형성된다.[4] 바이러스는 숙주 세포막에서 유래한 지질 "봉투"를 가질 수도 있다. 캡시드는 바이러스 게놈에 의해 암호화된 단백질로 만들어지며, 그 모양은 형태학적 구분의 기초가 된다.[34][35]
일반적으로 다섯 가지 주요 형태학적 바이러스 유형이 있다.
- 나선형: 중심 축 주위에 쌓인 단일 유형의 캡소머로 구성되어 나선 구조를 형성한다. 담배 모자이크 바이러스[4]와 이노바이러스[38]가 대표적인 예이다.
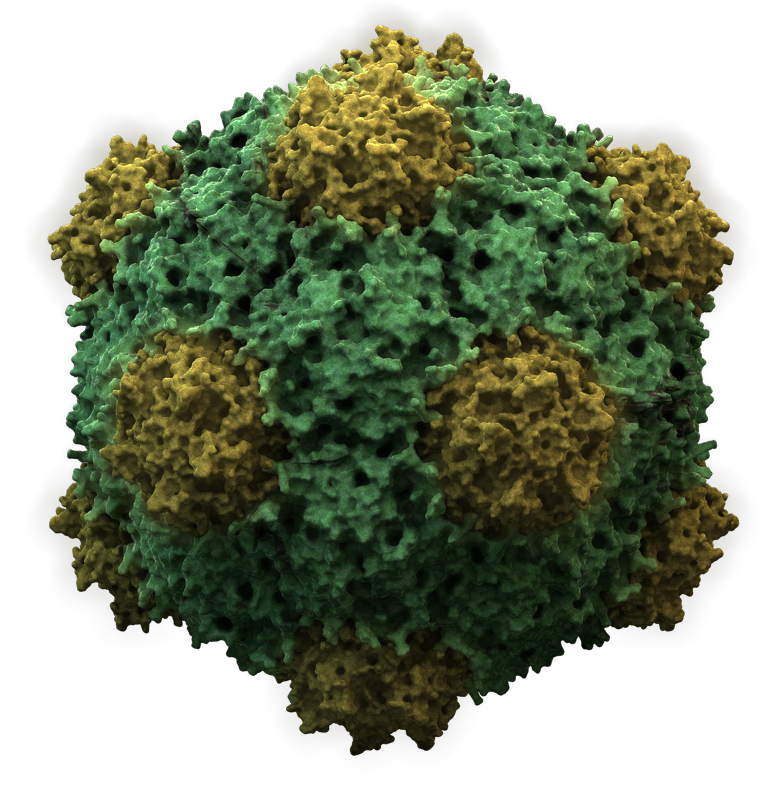
- 이십면체: 대부분의 동물 바이러스는 정이십면체 또는 거의 구형이다.
- 장방형: 5중 축을 따라 길어진 이십면체이며, 박테리오파지의 머리 부분에 일반적인 배열이다.
- 봉투형: 일부 바이러스는 감염된 숙주 세포를 둘러싼 막의 변형된 형태로 자신을 감싸 바이러스 봉투를 얻는다. 인플루엔자 바이러스, HIV, 사스 코로나바이러스-2 등이 이에 해당한다.[41]
- 복합형: 순수하게 나선형 또는 이십면체가 아니며 추가 구조를 가질 수 있는 캡시드를 가진다.
4. 1. 일반적인 생물과의 차이점
바이러스는 다음과 같은 점에서 일반적인 생물과 크게 다르다.- 비세포성으로 세포질 등은 가지고 있지 않다. 기본적으로는 단백질과 핵산으로 이루어진 입자이다(→바이러스의 구조).
- 대부분의 생물은 세포 내부에 DNA와 RNA 두 종류의 핵산을 모두 가지지만, 바이러스 입자 내에는 기본적으로 둘 중 하나만 존재한다.
- 다른 대부분 생물의 세포는 2n으로 지수 함수적으로 증식하는 데 반해, 바이러스는 일단계 증식을 한다. 또한, 바이러스 입자가 외관상 사라지는 “암흑기”가 존재한다.
- 대사계를 가지지 않고, 스스로 증식할 수 없다. 다른 생물의 세포에 기생함으로써만 증식할 수 있다.[250]
- 스스로 에너지를 생산하지 않고, 숙주 세포가 만든 것을 이용한다.[250]
4번 특징은 바이러스에게만 나타나는 것이 아니고, 리케차나 클라미디아, 파이토플라스마 등 일부 세균이나 진핵생물에도 유사한 특징을 보이는 것이 있다.
세포는 살아가는 데 필요한 에너지를 만드는 생산 라인을 가지고 있지만, 바이러스는 그러한 대사를 하지 않고, 숙주 세포에 완전히 의존하며, 숙주 내에서만 증식이 가능하다. 바이러스가 유일하게 할 수 있는 것은 다른 생물의 유전자 속에 자신의 유전자를 넣는 것이다. 엄밀히 말하면 스스로를 넣는 능력도 가지고 있지 않고, 세포가 정상적인 물질과 구별하지 못하고 바이러스의 단백질을 과잉 생산하는 것을 이용하고 있을 뿐이다.
4. 2. 생물적 특성 및 무생물적 특성
바이러스는 세포 구조를 갖지 않아 고전적인 생물학에서는 무생물로 분류되기도 하지만, 생물과 무생물의 특징을 모두 가지고 있어 생물과 무생물의 중간 단계로 분류하는 것이 일반적이다.[17]; 생물적 특성
; 무생물적 특성
바이러스는 다른 생물의 세포에 기생해야만 증식할 수 있으며, 스스로 에너지를 생산하지 않고 숙주 세포가 만든 것을 이용한다.[250] 이러한 특징 때문에 바이러스를 생물로 보지 않는 주장도 있지만, 세균에 가까운 구조를 가진 바이러스도 발견되면서 바이러스가 기생에 특화된 생물에서 유래했을 가능성도 제기되고 있다.
| 구분 | 일반적인 원핵생물 (예: 대장균) | 마이코플라스마 | 나노알카에움 에퀴탄스 | 리케차 | 클라미디아 | 파이토플라스마 | 바이러스 |
|---|---|---|---|---|---|---|---|
| 구성 단위 | 세포 | 바이러스 입자 | |||||
| 유전 정보 담체 | DNA | DNA 또는 RNA | |||||
| 증식 양식 | 로그 증식(분열이나 출아) | 일단계 증식 암흑기 존재 | |||||
| ATP 합성 | 가능 | 불가능 | 가능 | 불가능 | |||
| 단백질 합성 | 가능 | 불가능 | |||||
| 세포벽 | 있음 | 없음 | 있음 | 없음 | |||
| 단독 증식 | 가능 | 불가능 (다른 생물에 부착) | 불가능(편성 세포내 기생성) | ||||
4. 3. 바이러스의 계통
바이러스는 숙주의 종류에 따라 식물 바이러스, 동물 바이러스, 세균 바이러스(파지)로 나눌 수 있다. 그러나 생물 증식의 근원이 핵산에 있기 때문에 핵산의 종류에 따라 분류하기도 한다. 바이러스는 DNA 또는 RNA 중 하나를 가지며, 이에 따라 DNA 바이러스 아문과 RNA 바이러스 아문으로 나뉜다. 이들은 다시 강, 목, 과 등으로 세분화된다. 천연두나 수두를 일으키는 바이러스, 대장균에 기생하는 T 파지는 DNA 바이러스이다. 반면 유행성 이하선염(볼거리), 홍역, 광견병, 소아마비, 일본뇌염 등을 일으키는 바이러스는 RNA 바이러스이다.노벨 생리학·의학상 수상자인 데이비드 볼티모어는 바이러스를 다음과 같이 분류했다.[266]
- I: dsDNA 바이러스 - 아데노바이러스, 헤르페스바이러스, 마마바이러스 등
- II: ssDNA 바이러스 - 파르보바이러스 등
- III: dsRNA 바이러스 - 레오바이러스 등
- IV: (+)ssRNA 바이러스 - 코로나바이러스, 피코르나바이러스, 토가바이러스 등
- V: (−)ssRNA 바이러스 - 오르토믹소바이러스, 라브도바이러스 등
- VI: ssRNA-RT 바이러스 - 레트로바이러스 등
- VII: dsDNA-RT 바이러스 - 헤파드나바이러스 등
바이러스는 유전 물질(게놈)의 다양성이 매우 크다. 바이러스는 식물, 동물, 고세균, 세균보다 더 다양한 구조적 게놈 다양성을 가진다. 수백만 종류의 바이러스가 존재하지만, 자세히 설명된 종류는 7,000종 미만이다.[4] 2021년 1월 기준, NCBI 바이러스 게놈 데이터베이스에는 193,000개가 넘는 완전한 게놈 서열이 있지만, 아직 발견되지 않은 바이러스가 훨씬 더 많을 것이다.[49][50][51]
| 특징 | 매개변수 |
|---|---|
| 핵산 | |
| 형태 | |
| 가닥 수 | |
| 의미(센스) |
바이러스 게놈은 DNA 또는 RNA로 구성되며, 각각 DNA 바이러스 또는 RNA 바이러스라고 한다. 대부분의 바이러스는 RNA 게놈을 가진다. 식물 바이러스는 주로 단일 가닥 RNA 게놈을 가지는 반면, 박테리오파지는 주로 이중 가닥 DNA 게놈을 가진다.[4]
바이러스 게놈은 폴리오마바이러스처럼 환형이거나, 아데노바이러스처럼 선형일 수 있다. RNA 바이러스와 특정 DNA 바이러스의 게놈은 종종 여러 부분으로 나뉘는데, 이를 분절형이라고 한다. RNA 바이러스의 경우 각 분절은 주로 하나의 단백질만 암호화하며, 보통 하나의 캡시드에 함께 들어있다. 브롬 모자이크 바이러스와 같은 일부 식물 바이러스는 모든 분절이 동일한 바이러스 입자(비리온)에 없어도 감염성을 가질 수 있다.[4]
바이러스 게놈은 단일 가닥(ss) 또는 이중 가닥(ds)이다. 일부 바이러스(예: ''헤파드나바이러스과'')는 부분적으로 이중 가닥이고 부분적으로 단일 가닥인 게놈을 가지기도 한다.[4]
RNA 게놈 또는 단일 가닥 DNA 게놈을 가진 바이러스의 경우, 단일 가닥은 바이러스 메신저 RNA(mRNA)와의 관계에 따라 양성 가닥(플러스 가닥) 또는 음성 가닥(마이너스 가닥)으로 구분된다. 양성 가닥 바이러스 RNA는 바이러스 mRNA와 동일하므로 숙주 세포에서 즉시 번역될 수 있다. 음성 가닥 바이러스 RNA는 mRNA에 상보적이므로, 번역 전에 RNA 의존성 RNA 중합효소에 의해 양성 가닥 RNA로 전환되어야 한다. ssDNA 바이러스의 경우, 양성 가닥은 바이러스 mRNA와 서열이 동일(코딩 가닥)하고, 음성 가닥은 mRNA에 상보적(주형 가닥)이다.[4] 게미니바이러스(ssDNA 식물 바이러스)나 아레나바이러스(ssRNA 동물 바이러스)처럼 양의미 게놈을 가진 바이러스도 존재한다.[52]
게놈 크기는 종에 따라 크게 다르다. 가장 작은 ssDNA 순환 바이러스(Circoviridae)는 단 두 개의 단백질만 암호화하며 게놈 크기는 2kb(킬로베이스)에 불과하다.[53] 가장 큰 판도라바이러스는 약 2Mb(메가베이스)의 게놈 크기를 가지며 약 2500개의 단백질을 암호화한다.[46] 바이러스 유전자는 인트론을 거의 포함하지 않으며, 유전자 중첩이 일어나도록 배열되는 경우가 많다.[54]
일반적으로 RNA 바이러스는 DNA 바이러스보다 게놈 크기가 작다. RNA 바이러스는 복제 시 오류율이 높아 최대 크기 제한이 있기 때문이다.[18] RNA 바이러스는 이러한 한계를 보완하기 위해 분절된 게놈을 가지는 경우가 많다. 반면 DNA 바이러스는 복제 효소의 높은 정확성 덕분에 일반적으로 게놈이 더 크다.[55] 단일 가닥 DNA 바이러스는 예외적으로 ssRNA 바이러스와 유사한 높은 돌연변이율을 보이기도 한다.[56]
바이러스 분류는 바이러스의 다양성을 설명하기 위해 유사성을 기반으로 바이러스에 이름을 붙이고 그룹화한다. 1962년 앙드레 르보프, 로버트 혼, 폴 투르니에는 린네 계층 시스템을 기반으로 한 바이러스 분류법을 개발했다.[86] 이 시스템은 문, 강, 목, 과, 속, 종을 기반으로 바이러스를 분류했다.[87] 1966년 국제 바이러스 분류 위원회(ICTV)가 설립되었다. ICTV는 초기에는 르보프, 혼, 투르니에의 시스템을 완전히 받아들이지 않았는데, 바이러스의 작은 게놈 크기와 높은 돌연변이율 때문에 목 이상의 상위 분류군을 결정하기 어려웠기 때문이다. 그래서 볼티모어 분류 시스템이 전통적인 계층 구조를 보완하는 데 사용되어 왔다.[88] 2018년부터 ICTV는 바이러스 간의 더 깊은 진화적 관계를 반영하여 계(realm)에서 종까지 15단계의 분류 시스템을 채택했다.[89] 또한, 같은 속 내의 일부 종은 '''유전형군'''으로 그룹화된다.[90][91]
ICTV는 현재 분류 시스템을 개발하고 바이러스 특성에 따라 과의 균일성을 유지하는 지침을 작성했다.[92] 연구된 바이러스는 전체 다양성의 극히 일부에 불과하다.[93] 2022년 기준 ICTV는 6개의 역(Realm), 10개의 계(Kingdom), 17개의 문(Phylum), 2개의 아문(Subphylum), 40개의 강(Class), 72개의 목(Order), 8개의 아목(Suborder), 264개의 과(Family), 182개의 아과(Subfamily), 2,818개의 속(Genus), 84개의 아속(Subgenus), 11,273개의 종(Species)을 정의했다.[94]
분류군의 일반적인 분류 구조와 분류명에 사용되는 접미사는 다음과 같다. (2022년 기준 아역, 아계, 아강 계급은 사용되지 않음)[4]
:역 (''-viria'')
::아역 (''-vira'')
:::계 (''-virae'')
::::아계 (''-virites'')
:::::문 (''-viricota'')
::::::아문 (''-viricotina'')
:::::::강 (''-viricetes'')
::::::::아강 (''-viricetidae'')
:::::::::목 (''-virales'')
::::::::::아목 (''-virineae'')
:::::::::::과 (''-viridae'')
::::::::::::아과 (''-virinae'')
:::::::::::::속 (''-virus'')
::::::::::::::아속 (''-virus'')
:::::::::::::::종
데이비드 볼티모어는 Baltimore 분류 시스템을 고안했다.[95][96] 현대 바이러스 분류에서는 Baltimore 분류 시스템과 ICTV 분류 시스템을 함께 사용한다.[97][98][99]
Baltimore 분류는 mRNA 생성 메커니즘을 기반으로 한다. 바이러스는 단백질을 생성하고 자신을 복제하기 위해 mRNA를 생성해야 하는데, 각 바이러스 과는 서로 다른 메커니즘을 사용한다. 바이러스 게놈은 단일 가닥(ss) 또는 이중 가닥(ds), RNA 또는 DNA일 수 있으며, 역전사 효소(RT)를 사용하거나 사용하지 않을 수 있다. 또한 ssRNA 바이러스는 센스(+) 또는 안티센스(−)일 수 있다. 이 분류는 바이러스를 7개 그룹으로 분류한다.
- I: dsDNA 바이러스 (예: 아데노바이러스, 헤르페스바이러스, 포क्स바이러스)
- II: ssDNA 바이러스 (+ 가닥 또는 "센스") DNA (예: 파르보바이러스)
- III: dsRNA 바이러스 (예: 레오바이러스)
- IV: +(+)ssRNA 바이러스 (+ 가닥 또는 센스) RNA (예: 코로나바이러스, 피코르나바이러스, 토가바이러스)
- V: (−)ssRNA 바이러스 (− 가닥 또는 안티센스) RNA (예: 오르토믹소바이러스, 라브도바이러스)
- VI: ssRNA-RT 바이러스 (+ 가닥 또는 센스) RNA, 생활 주기에서 DNA 중간체를 가짐 (예: 레트로바이러스)
- VII: dsDNA-RT 바이러스 RNA 중간체를 가진 DNA (예: 헤파드나바이러스)
바이러스는 단백질 껍질 안에 있는 유전 물질의 차이에 따라 크게 DNA 바이러스와 RNA 바이러스로 나뉜다.[233]
국제 바이러스 분류 위원회(ICTV)는 바이러스의 명명을 관리하며, 유전 물질, 가닥 형태, 숙주 종류 등을 기준으로 과, 속, 종으로 분류하여 명명한다.[233]
5. 구조
바이러스는 RNA나 DNA 유전물질과 이를 둘러싸는 단백질 껍질인 캡시드(capsid)로 구성된 매우 간단한 구조를 가진다. 캡시드는 캡소머(capsomere)라는 구슬 모양 단백질이 모여 이루어진다. 일부 바이러스는 캡시드 외에 지질로 이루어진 막, 즉 외피(envelope)를 가지기도 하는데, 이는 숙주 세포의 세포막에서 유래한다.[233]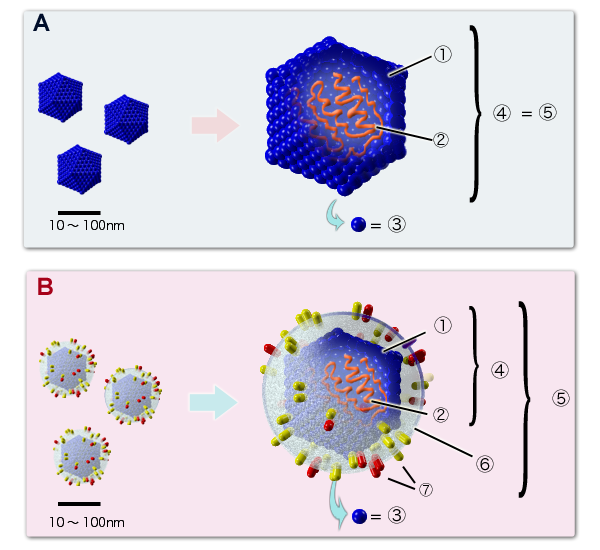
(A) 봉입체가 없는 바이러스, (B) 봉입체가 있는 바이러스, 1. 캡시드, 2. 바이러스 핵산, 3. 캡소머, 4. 뉴클레오캡시드, 5. 바이리온, 6. 봉입체, 7. 스파이크 단백질
바이러스 기본 구조는 입자 중심의 '''바이러스 핵산'''과 이를 둘러싸는 '''캡시드'''로 구성된다. 바이러스 핵산과 캡시드를 합쳐 '''뉴클레오캡시드'''(nucleocapsid)라고 부른다. 바이러스 형태는 캡시드 형태에 따라 정이십면체형(입방 대칭형)과 나선 대칭형으로 나뉜다.[233] 일부 바이러스는 봉입체(envelope)를 포함하기도 한다. 숙주에 감염 가능한 "완전한 바이러스 입자"를 '''바이리온'''이라고 부른다.
바이러스 크기는 작은 것은 20~40nm이고, 큰 것을 포함하여 평균 100nm 정도이다.[233] 가장 큰 천연두 바이러스는 장경이 300nm로 마이코플라스마(200~300nm)보다 크다.[233] 바이러스는 전자 현미경으로만 관찰 가능하며, 전자선 조사 때문에 살아있는 세포 내 바이러스를 관찰할 수는 없다.[233]
5. 1. 바이러스 핵산
바이러스 핵산은 일반적으로 DNA 또는 RNA 중 하나이다. 다른 생물은 하나의 세포 내에 DNA (유전자)와 RNA (mRNA, rRNA, tRNA 등) 분자를 모두 포함하지만, 바이러스 입자에는 그 중 하나만 들어 있다 (DNA와 함께 RNA를 일부 포함하는 B형 간염 바이러스와 같은 예외도 드물게 존재한다).[233] 바이러스 핵산 종류에 따라 바이러스는 DNA 바이러스와 RNA 바이러스로 크게 나뉜다. 핵산이 단일 가닥인지 이중 가닥인지, 단일 가닥 RNA라면 mRNA로서 활성을 가지는지 (플러스 가닥 RNA인지 마이너스 가닥 RNA인지), 환형인지 선형인지 등에 따라서도 세분화된다. 바이러스의 게놈은 다른 생물에 비해 크기가 훨씬 작고, 코딩하는 유전자 수도 매우 적다. 예를 들어, 사람의 유전자가 수만 개인데 비해, 바이러스는 3~100개 정도이다.[233]5. 2. 캡시드
'''캡시드'''(capsid|캡시드영어)는 바이러스 핵산을 둘러싸고 있는 단백질이며, 바이러스 입자가 세포 밖에 있을 때 내부의 핵산을 다양한 손상으로부터 보호하는 "껍질" 역할을 한다. 바이러스가 숙주 세포에 침입한 후에는 캡시드가 파괴되어(탈각) 내부의 바이러스 핵산이 방출되고 바이러스의 복제가 시작된다.캡시드는 같은 구조를 가진 작은 단백질인 '''캡소머'''가 다수 결합하여 구성되어 있다. 이 방식은 바이러스의 제한된 유전 정보량을 효율적으로 활용하는 데 도움이 된다고 생각된다. 작은 단백질은 그것을 만드는 데 필요한 유전자 배열의 길이가 짧기 때문에, 큰 단백질을 소수 조합하여 만드는 것보다 이와 같이 작은 단백질을 다수 조합하는 것이 더 효율적이라고 생각된다.[233]
5. 3. 뉴클레오캡시드
바이러스 핵산과 캡시드(단백질 껍질)를 합쳐 '''뉴클레오캡시드'''(nucleocapsid)라고 한다. 봉입체(envelope)가 없는 바이러스에서 뉴클레오캡시드는 바이리온과 같다. 다시 말해 뉴클레오캡시드는 모든 바이러스에서 공통적으로 볼 수 있는 가장 기본적인 구성 요소이다.
뉴클레오캡시드의 형태는 바이러스마다 정해져 있다. 기본적으로 정이십면체형(입방 대칭형)과 나선 대칭형으로 나뉜다.[233] 그러나 천연두의 원인인 포کس바이러스나 박테리오파지 등에서는 뉴클레오캡시드 구조가 매우 복잡하여 단순한 대칭성을 갖지 않는다.
5. 4. 외피 (Envelope)
'''외피'''(envelope|인벨로프영어)는 단순포진바이러스, 인플루엔자 바이러스, 인간 면역결핍 바이러스 등 일부 바이러스 입자에서 볼 수 있는 막 형태의 구조이다. 이러한 바이러스에서 외피는 바이러스 입자(바이리온)의 가장 바깥쪽에 위치하며, 바이러스의 기본 구조인 바이러스 게놈과 캡시드 단백질을 덮고 있다. 외피의 유무는 바이러스의 종류에 따라 결정되며, 분리된 바이러스가 어떤 종류인지를 판별하는 지표 중 하나이다.외피는 바이러스가 감염된 세포 내에서 증식하여 세포 밖으로 나올 때 세포막 또는 핵막과 같은 생체막을 덮은 채 출아함으로써 얻어진다. 따라서 기본적으로는 숙주 세포의 인지질 이중층에서 유래하지만, 이 외에도 바이러스 유전자에 의해 암호화된 막단백질의 일부를 세포막 등에 발현시킨 후 막과 함께 바이러스 입자에 넣어 '''외피 단백질'''로서 바이리온 표면에 발현시킨다. 이러한 외피 단백질에는 그 바이러스가 숙주 세포에 흡착·침입할 때 세포 쪽이 가지는 수용체에 결합하거나, 면역 등의 생체 방어 기능을 회피하는 등 다양한 기능을 가진 것이 알려져 있으며, 바이러스의 감염에 중요한 역할을 하고 있다.
세포막에 유래하는 외피를 가진 바이러스에서는, 외피 단백질이 세포 쪽의 수용체에 결합한 후, 바이러스의 외피와 세포막이 막융합을 일으킴으로써, 외피 내부에 싸여 있던 바이러스의 유전자나 단백질을 세포 내로 보내는 메커니즘을 가진 것이 많다.
외피는 대부분이 지질로 구성되기 때문에 에탄올이나 유기 용매, 비누 등으로 처리하면 쉽게 파괴할 수 있다. 따라서 일반적으로 외피를 가진 바이러스는 소독용 알코올에 의한 불활성화가 외피를 가지지 않은 바이러스에 비해 용이하다.
6. 증식
바이러스는 스스로 증식할 수 없으며, 다른 생물의 세포 내에 감염되어야만 증식이 가능하다.[250] 이러한 성질을 '''편성 세포내 기생성'''이라고 부른다. 일반적인 생물 세포가 2분열을 통해 2의 n승으로 수를 늘리는 것과 달리, 바이러스는 하나의 입자가 감염된 숙주 세포 내에서 한꺼번에 많은 수의 복제본을 만들어 방출한다. 또한 감염된 바이러스는 세포 내에서 일시적으로 분해되기 때문에, 외견상 바이러스 입자가 존재하지 않는 기간(''암흑기'')이 있다.
바이러스의 증식은 세포 표면에의 '''흡착''', 세포 내로의 '''침입''', '''탈각''', 부품 합성, 조립, 방출 순서로 이루어진다.[267]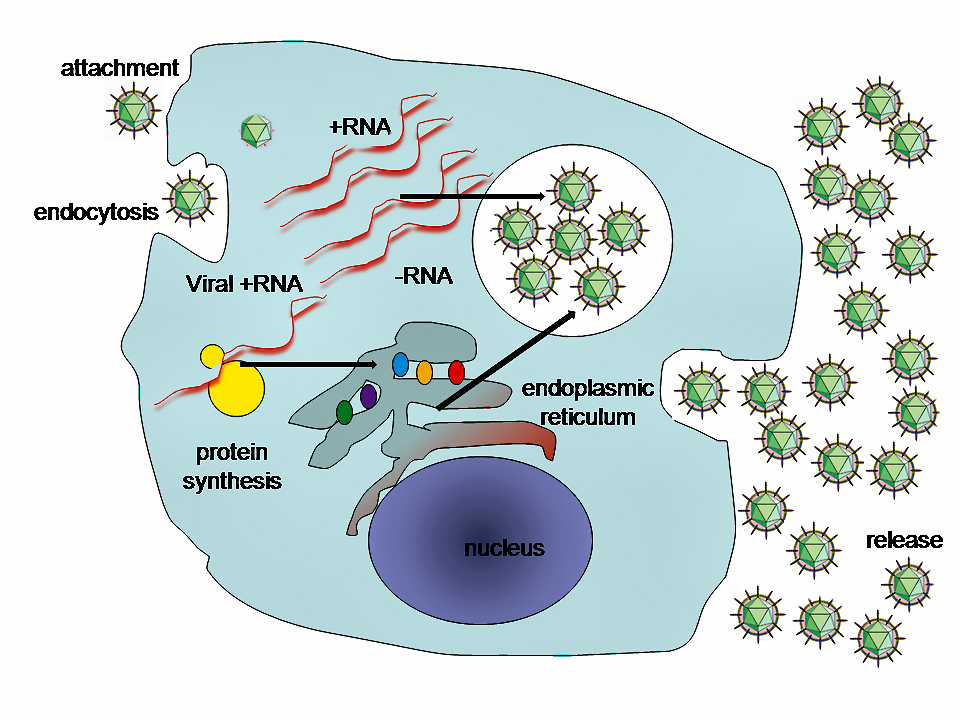
바이러스는 숙주 세포의 기구와 물질대사를 이용하여 자신들의 복제본을 여러 개 만들고 세포 내에서 조립된다.[67] 감염되면 숙주 세포는 원래 바이러스의 복제본 수천 개를 빠르게 생성하도록 강제된다.[68]
6. 1. 세포 표면에의 흡착
바이러스 감염의 첫 단계는 세포 표면에 흡착하는 것이다. 바이러스가 숙주 세포와 접촉하면, 바이러스 표면의 단백질이 숙주 세포 표면에 있는 특정 분자를 표적으로 하여 결합한다. 이때 세포 쪽에 있는 표적 분자를 그 바이러스에 대한 레세프터라고 한다. 바이러스가 감염될 수 있는지는 세포가 그 바이러스에 대한 레세프터를 가지고 있는지에 달려 있다.[267] 대표적인 바이러스 레세프터로는 인플루엔자 바이러스에 대한 기도 상피세포의 시알산 당쇄나, 인간 면역결핍 바이러스에 대한 헬퍼 T세포 표면의 CD4 분자 등이 있다.6. 2. 세포 내로의 침입
바이러스 입자는 세포 표면에 부착된 후, 실제 증식이 일어나는 세포 내부로 침입한다. 침입 방식은 바이러스 종류에 따라 다양한데, 대표적인 방식은 다음과 같다.- '''세포내이입'''(endocytosis): 세포가 원래 가지고 있는 세포내이입 작용을 통해 바이러스가 세포 안으로 들어온다. 바이러스는 엔도솜 소포 형태로 세포 내에 들어온 후, 세포질로 빠져나온다. 봉입체가 없는 바이러스 대부분과 인플루엔자 바이러스 등에서 이 방식을 볼 수 있다.
- '''막 융합'''(membrane fusion): 바이러스의 봉입체가 세포막과 융합하여, 입자 내부의 뉴클레오캡시드가 세포질 안으로 들어간다. 봉입체를 가진 많은 바이러스에서 이 방식을 볼 수 있다.
- '''능동적인 유전자 주입''': T 파지 등에서 볼 수 있는 방식으로, 바이러스 입자가 꼬리 부분의 관을 통해 바이러스 핵산을 세포질에 주입한다. 주입이라고는 하지만, 바이러스 입자의 꼬리 부분이 세균의 세포벽을 통과한 후의 유전자 이동은 세균 세포가 살아있어야만 일어난다. 따라서 세균 세포 자체의 작용으로 바이러스 유전자가 빨려 들어가는 것으로 추정된다.[4]
6. 3. 탈각
숙주 세포 내에 침입한 바이러스는 캡시드가 분해되고, 핵산이 방출된다. 이 과정을 탈각(uncoating)이라고 한다.[267]6. 4. 부품의 합성
바이러스는 숙주 세포의 효소와 단백질 합성 기구를 이용하여 자신의 핵산과 단백질을 대량으로 합성한다.[67] 감염된 숙주 세포는 원래 바이러스의 복제본 수천 개를 빠르게 생성하도록 강제된다.[68]바이러스 핵산은 숙주 세포의 핵산과 성질이 다른 점이 많기 때문에, 그 복제는 숙주의 효소만으로는 감당할 수 없다. 따라서 각 바이러스는 독자적으로 가지고 있는 DNA 중합효소, RNA 중합효소 등 전사·복제에 관여하는 효소를 사용한다. 역전사 효소를 가지는 레트로바이러스의 경우, 숙주 DNA에 자신의 유전자를 삽입함으로써 숙주의 DNA 복제 기구도 이용한다.[4]
단백질 합성에는, 그 단백질을 코딩하는 mRNA를 생성하기 위해 바이러스 고유의 효소가 필요한 경우가 있다. mRNA에서 단백질로의 번역은 숙주 세포가 가지고 있는 리보솜 등 단백질 합성계를 이용하여 이루어진다.
6. 5. 부품의 조립과 바이러스 입자의 방출
합성된 바이러스 핵산과 단백질은 세포 내에서 조립되어 새로운 바이러스 입자(바이리온)를 형성한다. 최종적으로는 캡소머가 바이러스 핵산을 감싸 뉴클레오캡시드가 형성된다. 이 기전은 바이러스에 따라 다양하며, 아직 연구가 미진한 것도 많다. 세포 내에서 조립된 바이러스는 용균 또는 출아를 통해 세포 밖으로 방출된다. 이때 외피(엔벨로프)를 가진 바이러스의 일부는 출아할 때 덮고 있던 숙주 세포막의 일부를 외피로 획득한다.[256]7. 숙주에 미치는 영향
바이러스는 병원체로서 숙주에게 피해를 주기도 하지만, 때로는 파지(phage)나 레트로바이러스와 같이 외래 유전자의 운반체로 작용하여 숙주의 생존에 유리하게 작용하기도 한다.[249] 바이러스 감염은 숙주 생물에 세포 및 개체 수준에서 다양한 영향을 미친다.
7. 1. 세포 수준에서의 영향
바이러스가 숙주 세포에 감염되면, 숙주 세포는 원래 자신을 위해 사용하던 에너지나 아미노산 등을 바이러스 복제에 빼앗기게 된다. 숙주 세포는 이에 저항하여 단백질과 유전자 합성을 억제하려 하고, 바이러스는 자신의 복제를 위해 숙주 세포의 기능을 제어하려고 한다. 이러한 과정에서 세포에 다양한 생리적, 형태적 변화가 나타난다.[4]특히 형태적 변화를 세포병변 효과(cytopathic effect, CPE)라고 부르며,[4] 바이러스 감별의 중요한 단서가 된다. 대표적인 세포 변성 효과는 다음과 같다.
- 세포의 원형화: 배양 세포가 둥글게 변형되어 플라스크에서 떨어져 플라크(공극)를 형성한다.
- --
- 다핵체(syncytium) 형성: 세포막이 융합되어 세포핵이 중앙에 응집, 다핵 거대 세포와 같은 형태가 된다.
- --
- 봉입체 형성
바이러스에 감염된 세포는 다음 중 하나의 운명을 맞는다.
- 세포 사멸: 바이러스가 대량 증식하면 세포 기능이 파괴되거나 세포막, 세포벽이 파괴되어 세포가 죽는다. 다세포 생물에서는 아포토시스를 통해 주변 세포로 바이러스가 퍼지는 것을 막는다.[75] 세포 독성 T 세포가 활성화되어 아포토시스가 유도되기도 한다.
- 지속 감염: 소량의 바이러스를 장기간 지속적으로 생산하는 경우이다. 숙주 세포 증식 속도와 바이러스 복제에 의한 세포 사멸 속도가 균형을 이루면 성립한다.
- 잠복감염: 바이러스 복제가 느리고, 입자 복제가 거의 일어나지 않는 상태이다. 헤르페스 바이러스가 대표적인 예시이다.[80][81]
- 세포의 불멸화와 암화: 종양 바이러스는 감염된 세포를 불멸화시키거나 암화시킨다. 유두종바이러스가 대표적인 예시이다.[78]
7. 2. 개체 수준에서의 영향
바이러스는 세포를 구성 단위로 하지 않고, 스스로 증식할 수 없지만, 유전자를 가지고 있다는 점에서 비생물과 생물의 특성을 모두 가지고 있다. 바이러스 감염은 숙주 생물에 세포 수준 및 개체 수준에서 다양한 영향을 미친다. 대부분의 경우 바이러스는 병원체로 작용하여 숙주에 손상을 입히지만, 일부 파지(phage)나 레트로바이러스와 같이 바이러스가 외래 유전자의 운반체로 작용하여 숙주의 생존에 유리하게 작용하는 예도 알려져 있다.[249]바이러스가 감염되어 증식하면, 숙주 세포는 원래 자신을 위해 생산·이용하던 에너지나 아미노산과 같은 영양원을 바이러스 입자 복제를 위해 빼앗기게 된다. 이에 대해 숙주 세포는 단백질과 유전자의 합성을 전반적으로 억제함으로써 저항하려고 하며, 한편 바이러스는 자신의 복제를 더욱 효율적으로 수행하기 위해 다양한 바이러스 유전자 산물을 이용하여 숙주 세포의 생리 기능을 제어하려고 한다. 또한 바이러스가 자신의 단백질을 한꺼번에 대량으로 합성하는 것은 세포에 있어 생리적인 스트레스가 되며, 완성된 입자를 방출할 때는 숙주의 세포막이나 세포벽을 파괴하는 경우도 있다. 이러한 원인으로 바이러스에 감염된 세포에서는 다양한 생리적·형태적인 변화가 나타난다.[249]
이 현상 중 특히 형태적인 변화를 나타내는 것을 '''세포 변성 효과'''(cytopathic effect, CPE)라고 부른다. 바이러스에 따라 특정 숙주 세포에 형태적으로 특징적인 세포 변성 효과를 일으키는 것이 있으며, 이것이 바이러스를 감별하는 데 중요한 단서가 되고 있다. 대표적인 세포 변성 효과로는 세포의 원형화·세포끼리의 융합에 의한 다핵체(synsitium) 형성·봉입체 형성 등이 알려져 있다.[249]
다양한 생리 기능의 변화에 의해 바이러스에 감염된 세포는 최종적으로 다음 중 어느 하나의 운명을 택한다.[249]
- 바이러스 감염에 의한 세포 사멸: 바이러스가 세포 내에서 대량으로 증식하면 세포 본래의 생리 기능이 파괴되거나 세포막이나 세포벽이 파괴되는 결과로 대부분 숙주 세포는 죽음에 이른다. 파지 감염에 의한 용균 현상도 이에 해당한다. 다세포 생물의 세포에서는 바이러스 감염 시 세포 주기를 정지시키거나 MHC 클래스 I과 같은 항원 제시 분자를 매개로 세포 독성 T 세포를 활성화시켜 아포토시스를 일으키는 것도 알려져 있다. 감염된 세포가 스스로 죽음으로써 주변 세포로 바이러스가 퍼지는 것을 방지한다고 생각된다. 암세포에 바이러스를 인위적으로 투여하여 감염시켜 파괴하는 바이러스 요법이 시행·연구되고 있다.[257]
- 지속 감염: 바이러스에 따라서는 단기간에 대량의 바이러스를 만들어 즉시 숙주를 죽이는 것이 아니라, 오히려 숙주에 대한 손상이 적어지도록 소량의 바이러스를 장기간에 걸쳐 지속적으로 생산(지속 감염)하는 것이 있다. 숙주 세포가 증식하는 속도와 바이러스 복제에 의한 세포 사멸의 속도가 균형을 이루면 지속 감염이 성립한다. 온화 파지에 의한 용원화도 이에 해당한다. 지속 감염 중에서도 특히 바이러스 복제가 느리고, 거의 입자의 복제가 일어나지 않는 상태를 '''잠복 감염'''이라고 부른다.
- 세포의 불멸화와 암화: 다세포 생물에 감염되는 바이러스 중에는 감염된 세포를 불멸화시키거나 암화시키는 것이 존재한다. 이러한 바이러스를 '''종양 바이러스''' 또는 '''암 바이러스'''라고 부른다. 바이러스가 숙주 세포를 불멸화 또는 암화시키는 메커니즘은 제각각이지만, 숙주 세포가 감염에 저항하여 일으키는 세포 주기 정지나 아포토시스에 대항하여 세포 주기를 진행시키거나 아포토시스를 억제하는 유전자 산물을 만드는 경우(DNA 암 바이러스)나 세포의 증식을 활성화시키는 경우, 또 레트로바이러스에서는 숙주 세포의 게놈에 바이러스 유전자를 삽입할 때 암 억제 유전자를 손상시킴으로써 숙주 세포를 암화시키는 것도 알려져 있다.
8. 분류
바이러스는 숙주의 종류에 따라 식물 바이러스, 동물 바이러스, 세균 바이러스(파지)로 나누기도 한다. 그러나 생물 증식의 근원이 핵산에 있으므로 핵산의 종류에 따라 분류한다. 즉, DNA나 RNA 중 어느 것을 가졌는지에 따라 DNA 바이러스와 RNA 바이러스로 나눈다.[266]
데이비드 볼티모어는 노벨상 수상자로, 바이러스를 유전 물질의 종류와 복제 방식에 따라 7개의 군으로 분류하는 볼티모어 분류를 제시했다.
1962년 앙드레 르보프, 로버트 혼, 폴 투르니에는 린네 계층 시스템을 기반으로 한 바이러스 분류 방법을 처음 개발했다.[86] 이들은 바이러스를 공유하는 특성과 핵산 유형에 따라 문, 강, 목, 과, 속, 종으로 분류했다.[87]
8. 1. ICTV 분류
국제 바이러스 분류 위원회(ICTV)는 바이러스 분류의 국제 표준을 개발하고 유지한다.[92] 1966년 설립된 ICTV는 바이러스 간의 진화적 관계를 반영하여 2018년부터 계(realm)에서 종까지 15단계의 분류 체계를 채택했다.[89]ICTV가 개발한 현재 분류 체계는 다음과 같다. (2022년 기준 아역, 아계, 아강 계급은 사용되지 않음):[4]
- 역 (''-viria'')
- 계 (''-virae'')
- 문 (''-viricota'')
- 아문 (''-viricotina'')
- 강 (''-viricetes'')
- 목 (''-virales'')
- 아목 (''-virineae'')
- 과 (''-viridae'')
- 아과 (''-virinae'')
- 속 (''-virus'')
- 아속 (''-virus'')
- 종
2022년 기준으로 ICTV는 6개의 역, 10개의 계, 17개의 문, 2개의 아문, 40개의 강, 72개의 목, 8개의 아목, 264개의 과, 182개의 아과, 2,818개의 속, 84개의 아속, 11,273개의 종을 정의했다.[94]
8. 2. 볼티모어 분류
데이비드 볼티모어가 제안한 바이러스 분류 시스템으로, mRNA 생성 방식에 따라 바이러스를 7개의 그룹으로 분류한다.[266] 국제 바이러스 분류 위원회(ICTV) 분류와 함께 사용된다.[97][98][99]바이러스는 단백질을 만들고 자신을 복제하기 위해 mRNA를 생성해야 하는데, 볼티모어 분류는 이 mRNA 생성 기전을 기준으로 한다. 바이러스 게놈은 외가닥(ss) 또는 겹가닥(ds), RNA 또는 DNA 형태일 수 있으며, 역전사 효소를 사용하거나 사용하지 않을 수 있다. 또한, 외가닥 RNA(ssRNA) 바이러스는 (+)센스 또는 (-)안티센스일 수 있다.
볼티모어 분류에 따른 7가지 그룹은 다음과 같다.
- I: dsDNA 바이러스 (예: 아데노바이러스, 헤르페스바이러스, 포кс바이러스)
- II: ssDNA 바이러스 (+ 가닥 또는 "센스") DNA (예: 파르보바이러스)
- III: dsRNA 바이러스 (예: 레오바이러스)
- IV: +(+)ssRNA 바이러스 (+ 가닥 또는 센스) RNA (예: 코로나바이러스, 피코르나바이러스, 토가바이러스)
- V: (−)ssRNA 바이러스 (− 가닥 또는 안티센스) RNA (예: 오르토믹소바이러스, 라브도바이러스)
- VI: ssRNA-RT 바이러스 (+ 가닥 또는 센스) RNA, 생활 주기에서 DNA 중간체를 가짐 (예: 레트로바이러스)
- VII: dsDNA-RT 바이러스 RNA 중간체를 가진 DNA (예: 헤파드나바이러스)
9. 인간 질병에서의 역할
바이러스는 감기, 인플루엔자(독감), 수두, 입술포진과 같은 흔한 질병부터 광견병, 에볼라 바이러스병, 에이즈, 조류 인플루엔자, 사스와 같이 심각한 질병까지 다양한 질병의 원인이 된다.[100] 인간 헤르페스바이러스 6형(HHV6)과 다발성 경화증, 만성피로증후군 등 신경 질환의 연관성에 대한 연구도 진행 중이며,[101] 보르나 바이러스가 인간의 정신의학적 질병을 유발할 수 있다는 주장도 제기되었으나 논란이 있다.[102]
바이러스는 주로 세포를 파괴하거나(세포 용해) 변형시켜 질병을 일으킨다. 다세포 생물에서 충분한 수의 세포가 손상되면 전체 생명체에 영향을 미친다. 바이러스는 항상성을 교란시켜 질병을 유발하지만, 헤르페스 심플렉스 바이러스처럼 잠복 상태로 존재하며 별다른 증상을 일으키지 않는 경우도 있다.[103] 잠복 바이러스는 때때로 예르시니아 페스티스와 같은 세균에 대한 면역력을 높이는 등 긍정적인 영향을 주기도 한다.[105]
B형 간염 바이러스나 C형 간염 바이러스처럼 만성 감염을 일으키는 바이러스도 있다.[106] 만성 감염자는 바이러스 보균자 역할을 하며, 이들이 많은 집단에서는 질병이 풍토병으로 자리잡을 수 있다.[107][108]
신종 바이러스는 이전에 알려지지 않았던 새로운 바이러스를 의미한다. 코로나바이러스-19는 신종 바이러스의 예시이다.[129]
9. 1. 바이러스성 질병
바이러스는 감기, 인플루엔자(독감), 수두, 입술포진과 같은 흔한 질병부터 광견병, 에볼라 출혈열, 에이즈, 조류 인플루엔자, 사스와 같은 심각한 질병까지 다양한 질병을 일으킨다.[100] 바이러스가 질병을 일으키는 능력을 독성이라고 한다.
바이러스는 주로 세포를 파괴하고(세포 용해) 사멸시키는 방식으로 질병을 유발한다. 다세포 생물에서는 많은 세포가 죽으면 전체 생명체에 영향을 미치게 된다. 바이러스는 항상성을 파괴하여 질병을 일으키기도 하지만, 헤르페스 심플렉스 바이러스처럼 몸 안에 잠복 상태로 존재하면서 별다른 해를 끼치지 않는 경우도 있다.[103] 이러한 잠복 바이러스는 때로는 예르시니아 페스티스와 같은 세균에 대한 면역력을 높여주는 등 유익한 역할을 하기도 한다.[105]
일부 바이러스는 만성 감염을 일으켜 몸 안에서 계속 증식하며, B형 간염 바이러스나 C형 간염 바이러스 감염이 대표적이다.[106] 만성 감염자는 바이러스의 보균자 역할을 하며, 보균자가 많은 집단에서는 질병이 풍토병으로 자리잡게 된다.[107][108]
다음은 바이러스로 인해 발생하는 질병의 일부 예시이다.
| 질병 | 원인 바이러스 |
|---|---|
| 독감 | 인플루엔자 바이러스 |
| 감기 | 리노 바이러스 또는 아데노 바이러스 |
| 에이즈 | 인간 면역 결핍 바이러스(HIV) |
| 담배 모자이크 병 | 담배 모자이크 바이러스(TMV) |
| 천연두 | 천연두 바이러스 |
| 소아마비 | 소아마비 바이러스 |
| 구제역 | 구제역 바이러스 |
| 에볼라 출혈열 | 에볼라 바이러스 |
| 상추 모자이크 병 | 상추 모자이크 바이러스 |
| 메르스 | 메르스 바이러스 |
| 지카 바이러스 감염증 | 지카 바이러스 |
| 코로나바이러스 감염증-19 | 코로나바이러스-19 |
9. 2. 역학
바이러스 역학은 바이러스 감염의 전파와 통제를 연구하는 의학 분야이다. 바이러스 전파는 수직 전파(어머니에서 자녀로) 또는 수평 전파(사람 간) 방식으로 이루어진다. B형 간염 바이러스나 인간 면역결핍 바이러스(HIV)는 수직 전파의 예시인데, 아기가 태어날 때부터 바이러스에 감염된 상태로 태어난다.[109] 수두대상포진 바이러스는 어린이와 성인에게는 비교적 가벼운 감염을 일으키지만, 태아와 신생아에게는 치명적일 수 있어 수직 감염의 드문 예시에 속한다.[110]수평 전파는 인구 집단에서 바이러스가 퍼지는 가장 일반적인 방식이다.[111] 수평 전파는 성행위 중 체액 교환, 타액 교환, 오염된 음식이나 물 섭취, 바이러스를 포함하는 에어로졸 흡입, 감염된 모기가 숙주의 피부를 뚫는 경우 등 다양한 경로를 통해 발생할 수 있다.[111] 대부분의 바이러스는 이러한 전파 방식 중 한두 가지에만 국한되며, "호흡기 바이러스" 또는 "장 바이러스" 등으로 불린다. 바이러스 감염의 전파율은 인구 밀도, 감수성 개체 수(면역이 없는 사람),[112] 의료 서비스의 질, 날씨 등의 요인에 따라 달라진다.[113]
역학은 바이러스 질환 발생 시 감염 사슬을 차단하는 데 사용된다.[4] 바이러스 전파 방식에 대한 지식을 바탕으로 통제 조치가 이루어진다. 발생 원인을 찾고 바이러스를 확인하는 것이 중요하며, 확인된 바이러스에 대한 백신이 있다면 전파 사슬을 차단할 수 있다. 백신이 없는 경우에는 위생 및 소독이 효과적일 수 있다. 감염된 사람들은 지역 사회와 격리되고, 바이러스에 노출된 사람들은 격리된다.[4] 2001년 영국에서 발생한 소의 구제역 발생을 통제하기 위해 수천 마리의 소가 도살되었다.[114]
대부분의 바이러스 감염에는 잠복기가 있으며, 이 기간에는 징후나 증상이 나타나지 않는다.[4] 잠복기는 수일에서 수주까지 다양하지만, 대부분의 감염에 대해 알려져 있다.[4] 잠복기 이후에는 전파 가능 기간이 있는데, 이 기간 동안 감염된 개체가 다른 사람이나 동물을 감염시킬 수 있다.[4] 잠복기와 전파 가능 기간에 대한 지식은 바이러스 발생 통제에 중요하다.[4] 발생이 인구, 지역 사회 또는 지역에서 비정상적으로 높은 비율의 사례를 발생시키는 경우 유행이라고 하며, 전 세계적으로 확산되는 경우 팬데믹이라고 한다.[4]
9. 3. 유행병과 범유행
유행병(epidemic)은 특정 지역 사회나 집단 내에서 바이러스 감염이 비정상적으로 많이 발생하는 상황을 말한다. 반면, 범유행(pandemic)은 바이러스 감염이 전 세계적으로 확산되어 통제가 어려운 상황을 의미한다.[4]1918년 스페인 독감은 인플루엔자 A 바이러스에 의해 발생했으며, 전 세계적으로 4천만~5천만 명, 최대 1억 명(당시 세계 인구의 5%)의 사망자를 낸 심각한 범유행이었다.[115][116] 대부분의 독감 유행이 어린이, 노인, 허약자에게 주로 영향을 주는 것과 달리, 스페인 독감은 건강한 젊은 성인들에게도 치명적이었다.[4]
인간 면역 결핍 바이러스(HIV)는 원숭이와 침팬지에게서 발견되는 바이러스에서 진화하였으며, 1980년대 이후 범유행을 일으키고 있다.[117] 2018년 기준 전 세계적으로 약 3,790만 명이 HIV에 감염되었으며, 같은 해 약 77만 명이 AIDS로 사망했다.[120][121] 유엔 에이즈 합동계획(UNAIDS)과 세계보건기구(WHO)는 AIDS가 1981년 처음 발견된 이후 2,500만 명 이상의 목숨을 앗아간, 역사상 가장 파괴적인 유행병 중 하나로 추정한다.[122]
에볼라 바이러스와 마르부르크 바이러스는 출혈열을 일으키는 필로바이러스과에 속하는 매우 치명적인 바이러스이다. 마르부르크 바이러스는 1967년에 처음 발견되었으며, 에볼라 바이러스병은 1976년 이후 간헐적으로 발생하여 높은 사망률을 보였다. 가장 심각한 에볼라 유행은 2013~2016년 서아프리카 에볼라 바이러스 유행이다.[125]
중증급성호흡기증후군(SARS)과 중동호흡기증후군(MERS)은 코로나바이러스의 새로운 유형에 의해 발생한다. 특히 2003년 SARS 유행은 빠른 확산과 높은 치사율로 인해 전 세계적인 경각심을 불러일으켰다.[128]
중증급성호흡기증후군 코로나바이러스 2(SARS-CoV-2)는 2019년 11월 중국 우한에서 발생하여 코로나19 범유행을 일으켰다.[129][130][131] 이로 인해 전례 없는 국제 여행 제한과 통행금지 조치가 시행되었다.[132][133]
9. 4. 암
일부 바이러스는 인간과 다른 종에서 암을 유발한다. 암을 유발하는 바이러스를 종양바이러스라고도 한다. 사람에게 암을 유발하는 대표적인 바이러스는 인유두종바이러스(HPV), B형 간염 바이러스, 엡스타인-바 바이러스(EBV) 등이 있다.[104]10. 숙주 방어 기전
인체는 선천 면역과 후천 면역을 통해 바이러스 감염에 대항한다. 선천 면역은 바이러스에 대한 신체의 첫 번째 방어선이며, 비특이적인 방식으로 숙주를 감염으로부터 보호한다. 획득 면역은 바이러스에 결합하는 특정 항체를 생성하여 바이러스를 무력화시키거나, T 세포를 통해 감염된 세포를 파괴한다.[143][147][150]
인터페론 생성은 바이러스 감염에 대한 중요한 방어 기전 중 하나이다. 인터페론은 바이러스가 존재할 때 신체에서 생성되는 호르몬으로, 감염된 세포와 그 주변 세포를 죽여 바이러스 복제를 막는다.[151]
하지만 모든 바이러스 감염이 이러한 면역 반응을 유발하는 것은 아니다. 예를 들어, HIV는 바이러스 표면 단백질을 지속적으로 변화시켜 면역계의 감시를 피한다. 또한, 신경친화성 바이러스는 면역계가 도달하기 어려운 신경계를 통해 전파되기도 한다.[152][153]
10. 1. 선천 면역
선천 면역계는 바이러스에 대한 신체의 첫 번째 방어선이다. 선천 면역계의 세포는 일반적인 방식으로 병원체를 인식하고 반응하지만, 획득 면역계와 달리 장기간 지속되는 면역을 부여하지 않는다.[143]RNA 간섭은 바이러스에 대한 중요한 선천적 방어 기전이다.[144] 많은 바이러스는 이중 가닥 RNA(dsRNA)를 포함하는 복제 전략을 가지고 있다. 이러한 바이러스가 세포를 감염시키면 RNA 분자를 방출하고, 이는 즉시 다이서라고 하는 단백질 복합체에 결합하여 RNA를 더 작은 조각으로 절단한다. RISC 복합체라는 생화학적 경로가 활성화되어 바이러스 mRNA를 분해함으로써 세포 생존을 보장한다. 로타바이러스는 세포 내부에서 완전히 탈피하지 않고 입자의 내부 캡시드의 기공을 통해 새로 생성된 mRNA를 방출함으로써 이러한 방어 기전을 회피하도록 진화했다. 그들의 게놈 dsRNA는 바이리온의 중심부에 보호된 상태로 남아 있다.[145][146]
10. 2. 후천 면역
척추동물의 획득 면역계가 바이러스를 만나면 바이러스에 결합하고 감염성을 없애는 특정 항체를 생성한다. 이를 체액성 면역이라고 한다.[147] 항체에는 두 가지 유형이 있는데, 첫 번째는 IgM으로 바이러스를 중화하는 데 매우 효과적이지만 면역계 세포에 의해 몇 주 동안만 생성된다. 두 번째는 IgG이며, 무기한 생성된다. 숙주의 혈액 내 IgM의 존재는 급성 감염을 검사하는 데 사용되는 반면, IgG는 과거 어느 시점의 감염을 나타낸다.[147] 면역 검사를 수행할 때는 IgG 항체를 측정한다.[148]바이러스가 숙주 세포에 진입한 후에도 항체는 효과적인 방어 기전으로 계속 작용할 수 있다. 세포 내에 존재하는 TRIM21이라는 단백질은 바이러스 입자 표면의 항체에 부착될 수 있다. 이는 세포의 프로테아좀 시스템의 효소에 의한 바이러스의 후속 파괴를 준비한다.[149]
척추동물의 바이러스에 대한 두 번째 방어는 세포 매개 면역이라고 하며, T 세포라고 알려진 면역 세포를 포함한다. 신체의 세포는 세포 표면에 단백질의 짧은 단편을 지속적으로 표시하며, T 세포가 의심스러운 바이러스 단편을 인식하면 '살해 T' 세포에 의해 숙주 세포가 파괴되고 바이러스 특이적 T 세포가 증식한다. 대식세포와 같은 세포는 이러한 항원 제시의 전문가이다.[150] 인터페론의 생성은 중요한 숙주 방어 기전이다. 인터페론은 바이러스가 존재할 때 신체에서 생성되는 호르몬으로, 면역에서의 역할은 복잡하며, 결국 감염된 세포와 그 주변 세포를 죽임으로써 바이러스가 복제되는 것을 막는다.[151]
모든 바이러스 감염이 이러한 방식으로 보호 면역 반응을 생성하는 것은 아니다. HIV는 바이리온 표면의 단백질의 아미노산 서열을 지속적으로 변경함으로써 면역계를 회피한다. 이는 바이러스 에피토프가 숙주 면역 반응에 의한 인식을 피하기 때문에 "탈출 돌연변이"로 알려져 있다. 이러한 지속적인 바이러스는 격리, 항원 제시 차단, 사이토카인 저항성, 자연 살해 세포 활동 회피, 세포자멸사 회피 및 항원 변이를 통해 면역 조절을 회피한다.[152] '신경친화성 바이러스'라고 하는 다른 바이러스는 신경 확산에 의해 전파되며, 면역 특권으로 인해 면역계가 도달할 수 없을 수 있다.[153]
11. 예방 및 치료
바이러스 감염은 백신과 항바이러스제를 통해 예방 및 치료할 수 있다.
11. 1. 백신
예방접종은 바이러스 감염을 예방하는 저렴하고 효과적인 방법이다. 바이러스가 발견되기 훨씬 전부터 백신이 바이러스 감염 예방에 사용되었다. 백신 사용으로 폴리오, 홍역, 볼거리, 풍진과 같은 바이러스 감염 관련 질병 발생률과 사망률이 극적으로 감소했다.[154] 천연두 감염은 근절되었다.[155] 13가지가 넘는 인간 바이러스 감염을 예방하는 백신이 있으며,[156] 동물 바이러스 감염 예방을 위해 더 많은 백신이 사용된다.[157] 백신은 생백신, 사백신, 바이러스 단백질(항원), mRNA으로 구성될 수 있다.[158][159] 생백신은 약화된 형태의 바이러스를 포함하며, 질병을 일으키지는 않지만 면역력을 부여한다. 이러한 바이러스를 약독화 바이러스라고 한다. 면역력이 약한 사람(면역 저하자)에게 생백신을 투여하면 약화된 바이러스가 원래 질병을 일으킬 수 있어 위험할 수 있다.[160] 생명공학과 유전공학 기술은 소단위 백신을 생산하는 데 사용된다. 소단위 백신은 바이러스의 캡시드 단백질만을 사용한다. B형 간염 백신이 이러한 유형의 백신이다.[161] 소단위 백신은 면역 저하자 환자에게 안전하다.[162] 17D라는 약독화 균주인 황열 바이러스 백신은 지금까지 개발된 가장 안전하고 효과적인 백신일 것이다.[163]11. 2. 항바이러스제
항바이러스제는 바이러스 복제를 선택적으로 방해하는 약물이다. 바이러스는 숙주 세포 내에서 복제에 필요한 대사 경로를 이용하기 때문에, 숙주 세포에 독성을 유발하지 않고 바이러스를 제거하기는 어렵다. 따라서 바이러스 질환에 대한 가장 효과적인 방법은 감염에 대한 면역력을 제공하는 예방접종과 항바이러스제이다.[179][180]12. 다른 종에서의 감염
바이러스는 모든 세포 생명체에 감염되며, 각 세포 종은 종종 그 종만 감염시키는 고유한 범위를 갖는다.[4] 위성이라고 불리는 일부 바이러스는 다른 바이러스에 이미 감염된 세포 내에서만 복제될 수 있다.[23]
12. 1. 동물 바이러스
바이러스는 가축에게 중요한 병원체이다. 구제역과 양푸른혀병과 같은 질병은 바이러스에 의해 발생한다.[170] 고양이, 개, 말과 같은 반려동물은 예방 접종을 하지 않으면 심각한 바이러스 감염에 취약하다. 개 파르보바이러스는 작은 DNA 바이러스에 의해 발생하며, 감염은 종종 강아지에게 치명적이다.[171] 모든 무척추동물과 마찬가지로 꿀벌도 많은 바이러스 감염에 취약하다.[172] 대부분의 바이러스는 숙주 내에서 무해하게 공존하며 질병의 징후나 증상을 나타내지 않는다.[4]12. 2. 식물 바이러스
식물 바이러스는 여러 종류가 있지만, 대부분 수확량 감소만 초래하며 경제적으로 방제하기 어려운 경우가 많다. 식물 바이러스는 종종 매개체라고 알려진 생물체를 통해 식물에서 식물로 퍼진다. 이 매개체는 보통 곤충이지만, 일부 균류, 선충, 원생동물, 기생식물도 매개체 역할을 한다.[173] 식물 바이러스 감염 방제가 경제적으로 타당하다고 판단될 경우(다년생 과일 등), 매개체를 제거하고 잡초와 같은 대체 기주를 제거하는 데 중점을 둔다.[4] 식물 바이러스는 살아있는 식물 세포에서만 증식할 수 있기 때문에 사람과 다른 동물을 감염시키지 못한다.[4]
페루가 원산지인 감자는 전 세계적으로 주요 식량 작물이 되었다.[174] 감자 Y 바이러스는 감자와 토마토, 고추 등 관련 종에 질병을 일으킨다. 1980년대에 종자 감자 작물에서 방제가 어려워짐에 따라 이 바이러스는 경제적으로 중요해졌다. 진딧물에 의해 전파되는 이 바이러스는 수확량을 최대 80%까지 감소시켜 감자 수확량에 상당한 손실을 초래한다.[175]
식물은 바이러스에 대한 정교하고 효과적인 방어 메커니즘을 가지고 있다. 가장 효과적인 방법 중 하나는 소위 저항성(R) 유전자의 존재이다. 각 R 유전자는 감염된 세포 주변의 국소적인 세포 사멸 영역을 유발하여 특정 바이러스에 대한 저항성을 부여하며, 이는 종종 육안으로 큰 반점으로 관찰할 수 있다. 이는 감염이 확산되는 것을 막는다.[176] RNA 간섭 또한 식물에서 효과적인 방어 메커니즘이다.[4] 감염되면 식물은 살리실산, 일산화질소, 활성 산소 분자와 같은 바이러스를 죽이는 천연 살균제를 생성한다.[177]
식물 바이러스 입자 또는 바이러스 유사 입자(VLPs)는 생명공학과 나노기술 모두에 응용된다. 대부분의 식물 바이러스 캡시드는 단순하고 견고한 구조이며, 식물 감염 또는 다양한 이종 시스템에서의 발현을 통해 대량으로 생산될 수 있다. 식물 바이러스 입자는 유전적으로나 화학적으로 변형되어 이종 물질을 캡슐화할 수 있으며, 생명공학에 사용하기 위해 초분자 구조에 통합될 수 있다.[178]
12. 3. 세균 바이러스 (박테리오파지)
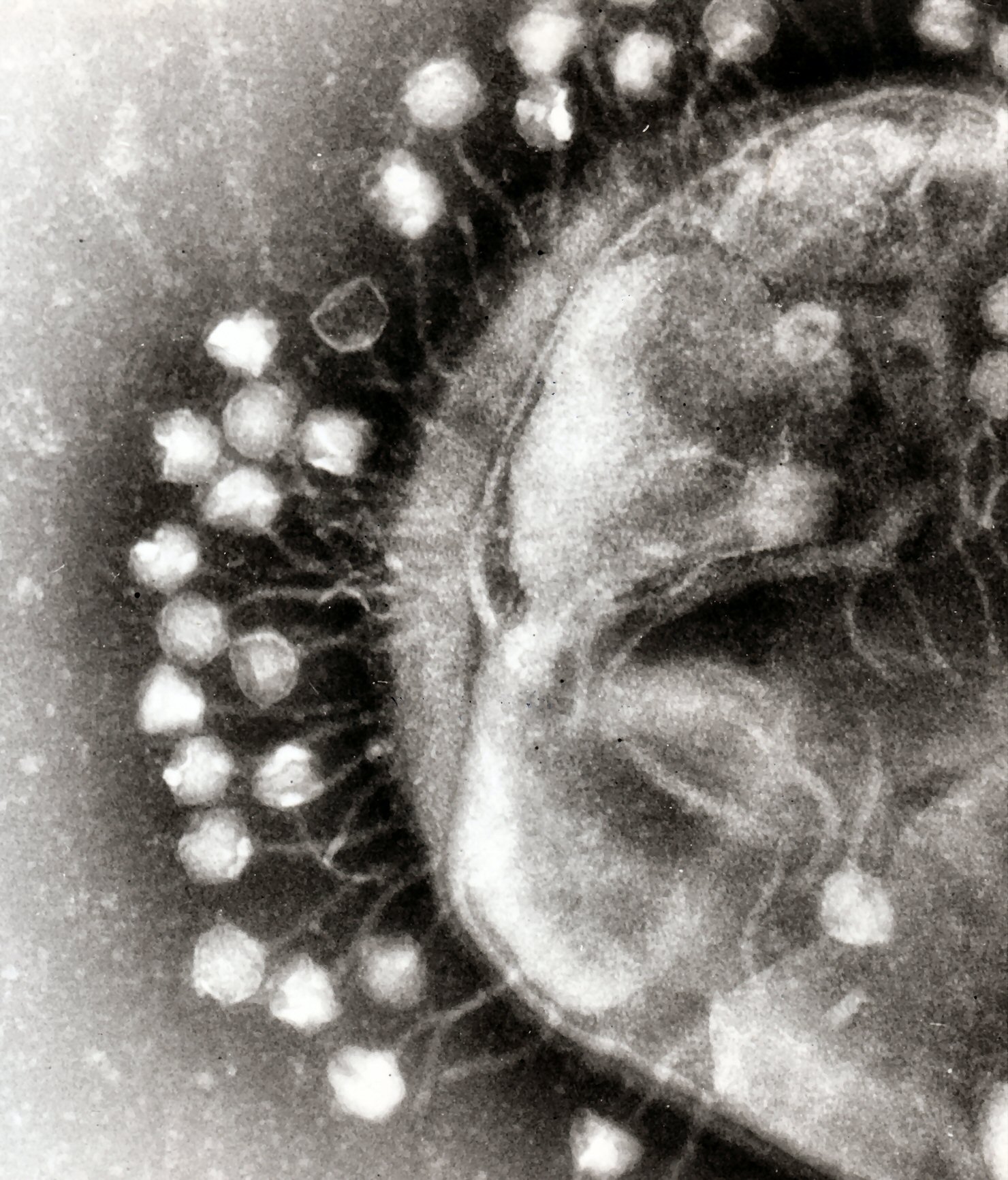
박테리오파지(bacteriophage)는 세균을 숙주로 삼아 파괴하는 바이러스이다. 항생제의 남용으로 슈퍼박테리아가 등장했지만, 박테리오파지를 이용한 파지 요법으로 이를 해결할 수 있다는 가능성이 제기되고 있다. 과거 파지 요법 연구는 중단되었으나, 항생제 내성 문제로 인해 최근 다시 주목받고 있다.
박테리오파지는 매우 흔하고 다양한 바이러스 그룹으로, 수생 환경에서 가장 풍부한 생물체이다. 해양에는 박테리아보다 최대 10배나 많은 박테리오파지가 존재하며,[179] 해수 1밀리리터당 2억 5천만 개에 달한다.[180] 이 바이러스는 특정 박테리아의 표면 수용체 분자에 결합하여 세포 내로 침투한다. 이후 박테리아의 중합효소를 이용하여 바이러스 mRNA를 단백질로 번역한다. 이 단백질들은 새로운 바이리온(virion)을 구성하거나, 바이리온 조립을 돕거나, 세포 용해에 관여한다. T4 파지의 경우, 바이러스 효소가 세포막 분해를 돕고 주입 후 20여 분 만에 300개 이상의 파지가 방출될 수 있다.[4]
박테리아는 박테리오파지로부터 자신을 보호하기 위해 외래 DNA를 파괴하는 제한 효소를 생산한다. 이 효소는 박테리오파지가 주입한 바이러스 DNA를 절단한다.[181] 또한, 박테리아는 이전에 접촉한 바이러스의 게놈 조각을 보유하는 CRISPR 서열을 이용하여 RNA 간섭 형태로 바이러스 복제를 차단하는 시스템을 갖추고 있다.[182][183] 이는 박테리아에게 감염에 대한 획득 면역을 제공한다.[184]
일부 박테리오파지는 온화성을 띠며, 숙주 세포를 즉시 파괴하지 않고 잠복 감염을 일으킨다. 이들의 DNA는 프로파지 형태로 숙주 세포 DNA에 통합된다. 이러한 잠복 감염은 환경 변화 등의 자극에 의해 프로파지 DNA가 활성화되면서 생산적으로 전환될 수 있다.[186] 사람을 포함한 동물의 장에는 온화한 박테리오파지가 존재하며, 식단 변화나 항생제 등 다양한 자극에 의해 활성화된다.[185] HIV를 포함한 많은 다른 바이러스들도 프로바이러스를 형성하는 것으로 알려져 있는데, 이는 박테리오파지에서 처음 관찰된 현상이다.[186][187]
12. 4. 고세균 바이러스
일부 바이러스는 고세균 내에서 복제된다. 이들은 특이하고 때로는 독특한 모양을 가진 DNA 바이러스이다.[188][48] 이러한 바이러스는 특히 Sulfolobales목과 Thermoproteales목의 호열성 고세균에서 가장 자세하게 연구되었다.[189] 이러한 바이러스에 대한 방어에는 고세균 게놈 내의 반복 DNA 서열로부터의 RNA 간섭이 포함되는데, 이는 바이러스의 유전자와 관련이 있다.[190][191] 대부분의 고세균은 바이러스에 대한 적응 방어 메커니즘으로 CRISPR–Cas 시스템을 가지고 있다. 이를 통해 고세균은 바이러스 DNA의 일부를 보유할 수 있으며, 이는 RNA 간섭과 유사한 과정을 사용하여 후속 바이러스 감염을 표적으로 삼아 제거하는 데 사용된다.[192]13. 수생 생태계에서의 역할
바이러스는 수생 환경에서 가장 풍부한 생물체이다.[2] 한 스푼의 바닷물에는 약 천만 개의 바이러스가 있다.[193] 이들 바이러스 대부분은 박테리오파지로, 종속영양 박테리아를 감염시키며, 시아노파지는 시아노박테리아를 감염시킨다. 이들은 바닷물과 담수 생태계 조절에 필수적이다.[194]
박테리오파지는 식물과 동물에는 무해하며, 해양 및 담수 생태계 조절에 필수적이다.[195] 먹이사슬의 기초를 이루는 식물플랑크톤의 중요한 사망 원인이다.[196] 이들은 수생 미생물 군집에서 박테리아를 감염시켜 파괴하며, 해양 환경에서 탄소 재순환과 영양염 순환의 가장 중요한 메커니즘 중 하나이다. 죽은 박테리아 세포에서 방출되는 유기 분자는 바이러스 션트라고 알려진 과정에서 새로운 박테리아와 조류의 성장을 자극한다.[197] 바이러스에 의한 박테리아 용해는 질소 순환을 강화하고 식물플랑크톤 성장을 자극한다.[198] 바이러스 활동은 탄소가 심해에 격리되는 과정인 생물 펌프에도 영향을 미칠 수 있다.[199]
미생물은 바다 생물량의 90% 이상을 차지한다. 바이러스가 매일 이 생물량의 약 20%를 죽이고, 바다에는 박테리아와 고세균보다 10배에서 15배 많은 바이러스가 있는 것으로 추정된다.[200] 바이러스는 유해 조류 번성을 포함한 식물플랑크톤 파괴의 주요 원인이다.[201] 바다에서 바이러스의 수는 더 먼 바다와 더 깊은 물 속으로 갈수록 감소하는데, 이곳에는 숙주 생물이 더 적기 때문이다.[199]
2018년 1월, 과학자들은 주로 해양 기원의 8억 개의 바이러스가 매일 지구의 대기에서 지구 표면의 매 평방미터에 침착된다는 것을 보고했다. 이는 일반 항공 여행 고도 아래의 기상 시스템 위에서 순환하는 전 세계적인 바이러스 대기 흐름의 결과로, 전 세계에 바이러스를 분포시킨다.[202][203]
모든 생물체와 마찬가지로 해양 포유류는 바이러스 감염에 취약하다. 1988년과 2002년 유럽에서는 수천 마리의 항구물범이 포시네 디스템퍼 바이러스에 의해 폐사했다.[204] 칼리시바이러스, 헤르페스바이러스, 아데노바이러스, 파르보바이러스를 포함한 많은 다른 바이러스가 해양 포유류 개체군에서 순환한다.[199]
2022년 12월, 과학자들은 담수 환경에서 녹조류를 일반적으로 감염시키는 클로로바이러스를 포함한 연못 물에 대한 실험을 통해 바이로보어 즉, 바이러스를 섭취하는 생물의 첫 번째 관찰을 보고했다. 물에서 다른 모든 미생물 먹이 공급원이 제거되었을 때, 섬모충류 할테리아는 일반적인 박테리보어 식단 대신 클로로바이러스를 적극적으로 섭취함으로써 개체 수가 증가한 것으로 관찰되었다.[205][206]
14. 진화에서의 역할
바이러스는 서로 다른 종 사이에서 유전자를 전달하는 중요한 자연적 수단이며, 이는 유전적 다양성을 증가시키고 진화를 촉진한다.[207][208][209] 바이러스는 최후의 만능 공통 조상이 박테리아, 고세균 및 진핵생물로 분화되기 이전 초기 진화에서 중추적인 역할을 했던 것으로 생각된다.[210] 바이러스는 여전히 지구상에서 가장 큰 미개척 유전적 다양성 저장소 중 하나이다.[199]
15. 응용
바이러스는 분자생물학 및 세포생물학 연구에 중요한 도구로 사용되는데, 세포 기능을 조작하고 조사하는 데 사용될 수 있는 단순한 시스템을 제공하기 때문이다.[4] 또한 유전학자들은 바이러스를 벡터로 사용하여 세포에 유전자를 도입하여 바이러스 치료법을 연구하기도 한다.[212] 동유럽 과학자들은 항생제 내성 때문에 항생제의 대안으로 파지 치료법을 오랫동안 사용해 왔으며, 이에 대한 관심이 증가하고 있다.[212]
바이러스에 의한 이종 단백질 발현은 백신 항원과 항체와 같은 다양한 단백질 생산에 사용되는 여러 제조 공정의 기반이 되기도 한다.[213]
바이러스 치료법은 질병 치료를 위해 유전적으로 변형된 바이러스를 사용한다.[214] 과학자들은 암세포에서 증식하여 파괴하지만 건강한 세포는 감염시키지 않도록 바이러스를 변형시키는데, 예를 들어 탈리모젠 라헤르파렙벡(T-VEC)이 있다. 2015년 말, T-VEC는 흑색종 치료제로 승인받았다.[216] 암세포를 죽이도록 재프로그래밍된 바이러스를 종양 용해 바이러스라고 한다.[217]
바이러스는 유기 나노입자로 간주될 수 있다.[218] 바이러스는 크기, 모양, 명확하게 정의된 화학 구조 때문에 나노 스케일에서 재료를 구성하는 템플릿으로 사용되어 왔다. 예를 들어, 미 해군 연구소에서 콩 모자이크 바이러스(CPMV) 입자를 사용하여 DNA 마이크로어레이 기반 센서의 신호를 증폭하는 연구가 진행되었다.[220]
최초의 합성 바이러스는 2002년에 만들어졌다.[222]
바이러스는 인류 사회에 파괴적인 전염병을 일으킬 수 있어 생물학전에 이용될 수 있다는 우려가 있다. 악명 높은 1918년 인플루엔자 바이러스가 실험실에서 성공적으로 재현된 것도 이러한 우려를 더욱 증폭시켰다.[225]
천연두 바이러스는 박멸되기 전까지 역사 전반에 걸쳐 수많은 사회를 황폐화시켰다. 전 세계적으로 WHO의 허가를 받아 천연두 바이러스를 보관하는 곳은 단 두 곳뿐이다.[226] 천연두 바이러스는 무기로 사용될 수 있으며,[226] 현대 인류 대부분은 천연두에 대한 저항력이 거의 없어 바이러스에 취약하다.[226]
15. 1. 생명 과학 및 의학
바이러스는 분자 및 세포생물학 연구에 중요한 도구인데, 세포 기능을 조작하고 조사하는 데 사용될 수 있는 단순한 시스템을 제공하기 때문이다.[4] 바이러스 연구는 DNA 복제, 전사, RNA 처리, 번역, 단백질 수송 및 면역학과 같은 분자유전학의 기본 메커니즘을 이해하는 데 도움을 주었다.[211]유전학자들은 종종 바이러스를 벡터로 사용하여 세포에 유전자를 도입한다. 이는 세포가 외부 물질을 생산하게 하거나, 새로운 유전자를 게놈에 통합하는 효과를 연구하는 데 유용하다. 바이러스 치료법은 특정 세포와 DNA를 표적으로 삼아 다양한 질병을 치료하는 벡터로 바이러스를 활용한다. 이는 암 치료와 유전자 치료에 유망하게 활용된다. 동유럽 과학자들은 항생제 내성 때문에 항생제의 대안으로 파지 치료법을 오랫동안 사용해 왔으며, 이에 대한 관심이 증가하고 있다.[212]
바이러스에 의한 이종 단백질 발현은 백신 항원과 항체와 같은 다양한 단백질 생산에 사용되는 여러 제조 공정의 기반이다. 최근 바이러스 벡터를 사용하는 산업 공정이 개발되었으며, 여러 제약 단백질이 현재 전임상 및 임상 시험 중이다.[213]
바이러스 치료법은 질병 치료를 위해 유전적으로 변형된 바이러스를 사용한다.[214] 과학자들은 암세포에서 증식하여 파괴하지만 건강한 세포는 감염시키지 않도록 바이러스를 변형시켰다. 예를 들어, 탈리모젠 라헤르파렙벡(T-VEC)은 건강한 세포에서 바이러스 복제에 필요한 유전자가 삭제되고 면역을 자극하는 인간 유전자(GM-CSF)로 대체된 변형된 헤르페스 심플렉스 바이러스이다. 이 바이러스가 암세포를 감염시키면 암세포를 파괴하고, 수지상 세포를 유인한다. 수지상 세포는 죽은 암세포를 처리하고 그 구성 요소를 면역 체계의 다른 세포에 제시한다.[215] 2015년 말, 이 바이러스는 흑색종 치료제로 승인받았다.[216] 암세포를 죽이도록 재프로그래밍된 바이러스를 종양 용해 바이러스라고 한다.[217]
15. 2. 재료 과학 및 나노 기술
바이러스는 유기 나노입자로 간주될 수 있다.[218] 바이러스 표면에는 숙주 세포의 장벽을 통과할 수 있도록 하는 특정 도구가 있다. 바이러스의 크기, 모양, 그리고 표면에 있는 작용기의 수와 특성은 정확하게 정의되어 있다. 따라서 바이러스는 공유 결합 표면 개질을 위한 스캐폴드로 재료 과학에서 일반적으로 사용된다. 바이러스의 특별한 특징은 유전자 조작을 통해 조절할 수 있다는 것이다. 생명 과학에서 개발된 강력한 기술은 나노 재료를 위한 공학적 접근 방식의 기반이 되어, 생물학 및 의학을 훨씬 넘어 광범위한 응용 분야를 열고 있다.[219]바이러스는 크기, 모양, 명확하게 정의된 화학 구조 때문에 나노 스케일에서 재료를 구성하는 템플릿으로 사용되어 왔다. 예를 들어, 워싱턴 D.C.의 미 해군 연구소에서 콩 모자이크 바이러스(CPMV) 입자를 사용하여 DNA 마이크로어레이 기반 센서의 신호를 증폭하는 연구가 진행되었다. 이 응용 분야에서 바이러스 입자는 신호에 사용되는 형광 염료를 분리하여 비형광 이합체(다이머)의 형성을 방지함으로써 형광 소광제 역할을 한다.[220] 또 다른 예로는 CPMV를 분자 전자 장치를 위한 나노 스케일 기판으로 사용하는 것이 있다.[221]
15. 3. 합성 바이러스
많은 바이러스는 '생성'(de novo, "from scratch")될 수 있다. 최초의 합성 바이러스는 2002년에 만들어졌다.[222] 다소 오해의 소지가 있지만, 실제 바이러스가 합성되는 것이 아니라, DNA 바이러스의 경우 DNA 게놈, RNA 바이러스의 경우 게놈의 cDNA 복제본이 합성된다. 많은 바이러스과의 경우, 합성된 DNA 또는 RNA(합성 cDNA에서 효소적으로 다시 전환된 경우)는 세포에 도입될 때 감염성을 띤다. 즉, 새로운 바이러스를 생성하는 데 필요한 모든 정보를 포함하고 있다. 이 기술은 현재 새로운 백신 전략을 조사하는 데 사용되고 있다.[223]15. 4. 무기
바이러스는 인류 사회에 파괴적인 전염병을 일으킬 수 있어 생물학전에 이용될 수 있다는 우려가 있다. 악명 높은 1918년 인플루엔자 바이러스가 실험실에서 성공적으로 재현된 것도 이러한 우려를 더욱 증폭시켰다.[225]천연두 바이러스는 박멸되기 전까지 역사 전반에 걸쳐 수많은 사회를 황폐화시켰다. 전 세계적으로 WHO의 허가를 받아 천연두 바이러스를 보관하는 곳은 러시아의 벡터 국립 바이러스학 및 생물기술 연구센터(State Research Center of Virology and Biotechnology VECTOR)와 미국의 질병통제예방센터(Centers for Disease Control and Prevention) 두 곳뿐이다.[226] 천연두 바이러스는 무기로 사용될 수 있으며,[226] 천연두 백신의 심각한 부작용 때문에 더 이상 어떤 국가에서도 일상적으로 사용되지 않는다. 따라서 현대 인류 대부분은 천연두에 대한 저항력이 거의 없어 바이러스에 취약하다.[226]
참조
[1]
뉴스
There are more viruses than stars in the universe. Why do only some infect us? – More than a quadrillion quadrillion individual viruses exist on Earth, but most are not poised to hop into humans. Can we find the ones that are?
https://www.national[...]
2020-04-15
[2]
논문
The ancient Virus World and evolution of cells
2006-09-00
[3]
뉴스
The Secret Life of a Coronavirus - An oily, 100-nanometer-wide bubble of genes has killed more than two million people and reshaped the world. Scientists don't quite know what to make of it.
https://www.nytimes.[...]
2021-02-26
[4]
논문
Viral metagenomics
2005-06-00
[5]
논문
Here a virus, there a virus, everywhere the same virus?
2005-06-00
[6]
논문
The classification of organisms at the edge of life, or problems with virus systematics
[7]
논문
Norovirus
2015-01-00
[8]
백과사전
OED Online
Oxford University Press
2015-03-00
[9]
웹사이트
virus
http://www.etymonlin[...]
[10]
백과사전
OED Online
Oxford University Press
2015-03-00
[11]
웹사이트
virulent
http://www.etymonlin[...]
[12]
서적
Handbook of Laboratory Animal Science
CRC Press
2003-00-00
[13]
서적
Botanical Latin. History, Grammar, Syntax, Terminology and Vocabulary.
David & Charles
[14]
웹사이트
viral
http://www.etymonlin[...]
[15]
웹사이트
virion
http://www.etymonlin[...]
[16]
서적
Desk Encyclopedia of General Virology
Academic Press
[17]
논문
Evolutionary genomics of nucleo-cytoplasmic large DNA viruses
https://zenodo.org/r[...]
2006-04-00
[18]
논문
Viral mutation rates
2010-10-00
[19]
논문
Origin of viruses: primordial replicators recruiting capsids from hosts
https://hal-pasteur.[...]
2019-07-00
[20]
논문
The origin and behavior of mutable loci in maize
1950-06-00
[21]
서적
Desk Encyclopedia of General Virology
Academic Press
[22]
논문
Viroids
2008-11-00
[23]
논문
The virophage as a unique parasite of the giant mimivirus
2008-09-00
[24]
서적
[25]
논문
From Contagium vivum fluidum to Riboviria: A Tobacco Mosaic Virus-Centric History of Virus Taxonomy
2022-09-00
[26]
논문
Are viruses alive? The replicator paradigm sheds decisive light on an old but misguided question
2016-10-00
[27]
논문
Viral evolution in the genomic age
2007-10-00
[28]
논문
Synthetic viruses: a new opportunity to understand and prevent viral disease
2009-12-00
[29]
논문
Chlamydiae as symbionts in eukaryotes
[30]
논문
Laboratory maintenance of Rickettsia rickettsii
2008-11-00
[31]
논문
The virocell concept and environmental microbiology.
[32]
논문
Towards an integrative view of virus phenotypes
2022-02-00
[33]
논문
Negative staining of proteins
[34]
논문
Physical principles in the construction of regular viruses
[35]
논문
Structure of small viruses
1956-03-00
[36]
논문
Manipulation of individual viruses: friction and mechanical properties
1997-03-01
[37]
논문
Imaging of viruses by atomic force microscopy
2001-09-01
[38]
서적
Virus Protein and Nucleoprotein Complexes
2018-01-01
[39]
논문
Protruding Features of Viral Capsids Are Clustered on Icosahedral Great Circles
[40]
서적
Desk Encyclopedia of General Virology
Academic Press
[41]
논문
Coronavirus Disease 2019-COVID-19
2020-09-01
[42]
논문
The bacteriophage T4 DNA injection machine
2004-04-01
[43]
논문
Experience with electron microscopy in the differential diagnosis of smallpox
1970-09-01
[44]
논문
Genomic and evolutionary aspects of Mimivirus
2006-04-01
[45]
논문
Distant Mimivirus relative with a larger genome highlights the fundamental features of Megaviridae
2011-10-01
[46]
논문
Pandoraviruses: amoeba viruses with genomes up to 2.5 Mb reaching that of parasitic eukaryotes
https://hal-cea.arch[...]
2013-07-01
[47]
논문
Giant Viruses-Big Surprises
2019-04-01
[48]
논문
Viruses of the Archaea: a unifying view
2006-11-01
[49]
웹사이트
NCBI Viral Genome database
https://www.ncbi.nlm[...]
ncbi.nlm.nih.gov
2017-01-15
[50]
논문
Microbiology. Going viral: exploring the role of viruses in our bodies
2011-03-01
[51]
논문
Redefining the invertebrate RNA virosphere
2016-12-01
[52]
서적
Virology: principles and applications
John Wiley & Sons
[53]
논문
Sequences from ancestral single-stranded DNA viruses in vertebrate genomes: the parvoviridae and circoviridae are more than 40 to 50 million years old
2010-12-01
[54]
논문
Gene overlapping and size constraints in the viral world
2016-05-01
[55]
논문
Divided genomes and intrinsic noise
[56]
논문
Validation of high rates of nucleotide substitution in geminiviruses: phylogenetic evidence from East African cassava mosaic viruses
2009-06-01
[57]
논문
Discordant antigenic drift of neuraminidase and hemagglutinin in H1N1 and H3N2 influenza viruses
2011-12-01
[58]
논문
Targeting pandemic influenza: a primer on influenza antivirals and drug resistance
2010-06-01
[59]
논문
The influenza viruses
2006-11-01
[60]
논문
Detection and significance of minority quasispecies of drug-resistant HIV-1
2006-12-01
[61]
서적
Viral Sex
Oxford Univ Press
[62]
논문
Evolutionary aspects of recombination in RNA viruses
1999-10-01
[63]
논문
Role of recombination in evolution of enteroviruses
[64]
논문
Mechanism and application of genetic recombination in herpesviruses
1999-07-01
[65]
논문
Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses
2016-06-01
[66]
논문
How RNA viruses maintain their genome integrity
2010-06-01
[67]
논문
HIV-1 assembly, release and maturation
2015-08-01
[68]
논문
Kinetic Modeling of Virus Growth in Cells
2018-06-01
[69]
서적
Structure and Physics of Viruses
2013-01-01
[70]
논문
Virus-host interactions during movement processes
2005-08-01
[71]
논문
Viral entry pathways: the example of common cold viruses
2016-05-00
[72]
논문
Coordination of late gene transcription of human cytomegalovirus with viral DNA synthesis: recombinant viruses as potential therapeutic vaccine candidates
2013-02-00
[73]
논문
Transport of viral proteins to the apical membranes and interaction of matrix protein with glycoproteins in the assembly of influenza viruses
2001-09-00
[74]
논문
Endogenous pararetroviruses: two-faced travelers in the plant genome
2006-10-00
[75]
논문
Viruses and apoptosis
[76]
서적
Human Cytomegalovirus
[77]
논문
B cells and herpesviruses: a model of lymphoproliferation
2007-12-00
[78]
논문
HPV and cervical cancer: updates on an established relationship
2008-11-00
[79]
논문
Human cytomegalovirus: Latency and reactivation in the myeloid lineage
2008-03-00
[80]
논문
Latent herpesviruses of humans
1984-06-00
[81]
논문
Latency and reactivation of human cytomegalovirus
2002-02-00
[82]
서적
Viruses: A Very Short Introduction
Oxford University Press, US
[83]
논문
Phage typing of Salmonella Typhimurium – is it still a useful tool for surveillance and outbreak investigation?
http://www.eurosurve[...]
2014-12-19
[84]
논문
An Ecological Framework of the Human Virome Provides Classification of Current Knowledge and Identifies Areas of Forthcoming Discovery
2016-09-00
[85]
논문
Human viruses: discovery and emergence
2012-10-00
[86]
논문
[A virus system]
1962-06-00
[87]
논문
A system of viruses
[88]
논문
International Committee on Taxonomy of Viruses and the 3,142 unassigned species
2005-08-00
[89]
논문
The New Scope of Virus Taxonomy: Partitioning the Virosphere Into 15 Hierarchical Ranks
2020-05-00
[90]
논문
Norovirus Gastroenteritis Outbreaks, Genomic Diversity and Evolution: An Overview
2021-07-00
[91]
논문
HIV types, groups, subtypes and recombinant forms: errors in replication, selection pressure and quasispecies
http://nbn-resolving[...]
2012-00-00
[92]
논문
The new scope of virus taxonomy: partitioning the virosphere into 15 hierarchical ranks
2020-05-00
[93]
논문
Viral metagenomics
[94]
웹사이트
Virus Taxonomy: 2022 Release
https://ictv.global/[...]
International Committee on Taxonomy of Viruses
2023-04-27
[95]
논문
RNA-directed DNA synthesis and RNA tumor viruses
[96]
논문
The strategy of RNA viruses
[97]
논문
Emerging issues in virus taxonomy
2004-01-00
[98]
논문
Developments in plant virus taxonomy since the publication of the 6th ICTV Report. International Committee on Taxonomy of Viruses
[99]
논문
Classification of papillomaviruses
2004-06-00
[100]
서적
Lippincott's Illustrated Reviews: Microbiology
Lippincott Williams & Wilkins
[101]
논문
Is human herpesvirus-6 a trigger for chronic fatigue syndrome?
2006-12-00
[102]
논문
High seroprevalence of Borna virus infection in schizophrenic patients, family members and mental health workers in Taiwan
1999-01-00
[103]
논문
Spontaneous reactivation of herpes simplex virus type 1 in latently infected murine sensory ganglia
2007-10-00
[104]
논문
Herpes simplex virus infections
2001-05-00
[105]
논문
Herpesvirus latency confers symbiotic protection from bacterial infection
2007-05-00
[106]
논문
Immune response and tolerance during chronic hepatitis B virus infection
2007-10-00
[107]
논문
Significance of HBV DNA by PCR over serological markers of HBV in acute and chronic patients
[108]
논문
Highly endemic hepatitis B infection in rural Vietnam
2007-12-00
[109]
논문
Reducing the risk of mother-to-child human immunodeficiency virus transmission: past successes, current progress and challenges, and future directions
2007-09-00
[110]
논문
The congenital varicella syndrome
2000-12-00
[111]
논문
The evolution of transmission mode
2017-05-00
[112]
논문
Role of herd immunity in determining the effect of vaccines against sexually transmitted disease
2005-02-00
[113]
논문
[The influence of weather conditions on the epidemiology of vector-borne diseases by the example of West Nile fever in Russia]
[114]
논문
Predicting undetected infections during the 2007 foot-and-mouth disease outbreak
2009-12-00
[115]
논문
The geography and mortality of the 1918 influenza pandemic
[116]
논문
Updating the accounts: global mortality of the 1918-1920 "Spanish" influenza pandemic
[117]
논문
1
2018-03-00
[118]
논문
[History of influenza pandemics in China during the past century]
2018-08-00
[119]
논문
Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes
1999-02-00
[120]
웹사이트
Fact Sheet
https://www.unaids.o[...]
2019-12-12
[121]
웹사이트
UN AIDS DATA2019
https://www.unaids.o[...]
2019-12-05
[122]
논문
The third phase of HIV pandemic: social consequences of HIV/AIDS stigma & discrimination & future needs
http://www.icmr.nic.[...]
2014-12-19
[123]
웹사이트
Status of the global HIV epidemic
http://data.unaids.o[...]
UNAIDS
2014-12-19
[124]
논문
Marburgvirus genomics and association with a large hemorrhagic fever outbreak in Angola
2006-07-00
[125]
웹사이트
World Health Organisation report, 24 September 2014
http://apps.who.int/[...]
[126]
웹사이트
Virology Journal
https://virologyj.bi[...]
[127]
서적
Coronavirus pathogenesis
[128]
논문
From SARS to Avian Influenza Preparedness in Hong Kong
2017-05-00
[129]
논문
Insights into the Recent 2019 Novel Coronavirus (SARS-CoV-2) in Light of Past Human Coronavirus Outbreaks
2020-03-00
[130]
논문
Characteristics of and Public Health Responses to the Coronavirus Disease 2019 Outbreak in China
2020-02-00
[131]
논문
Coronavirus 2019-nCoV: A brief perspective from the front line
2020-04-00
[132]
뉴스
Coronavirus Travel Restrictions, Across the Globe
https://www.nytimes.[...]
2020-03-16
[133]
웹사이트
US takes more big pandemic response steps; Europe COVID-19 cases soar
http://www.cidrap.um[...]
2020-03-15
[134]
논문
Clinician's guide to human papillomavirus immunology: knowns and unknowns
2009-06-00
[135]
논문
T antigen mutations are a human tumor-specific signature for Merkel cell polyomavirus
2008-10-00
[136]
논문
Merkel cell carcinoma: review
2009-05-00
[137]
논문
Hepatitis C virus contributes to hepatocarcinogenesis by modulating metabolic and intracellular signaling pathways
2007-06-00
[138]
서적
Aids-Associated Viral Oncogenesis
[139]
논문
Telomerase: a crucial player in HTLV-I-induced human T-cell leukemia
[140]
논문
Human papillomavirus and cervical cancer
2007-09-00
[141]
논문
Epstein-Barr virus infection in humans: from harmless to life endangering virus-lymphocyte interactions
2007-02-00
[142]
논문
Novel human polyomaviruses – re-emergence of a well known virus family as possible human carcinogens
2008-07-00
[143]
서적
Molecular Biology of the Cell
https://www.ncbi.nlm[...]
Garland Science
[144]
논문
Antiviral immunity directed by small RNAs
2007-08-00
[145]
논문
Replication and transcription of the rotavirus genome
[146]
논문
Emerging themes in rotavirus cell entry, genome organization, transcription and replication
2004-04-00
[147]
논문
Viral serology and detection
1995-12-00
[148]
논문
Serum levels of rubella virus antibodies indicating immunity: response to vaccination of subjects with low or undetectable antibody concentrations
1997-04-00
[149]
논문
Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21)
2010-11-00
[150]
논문
Novel functions of B cells
[151]
논문
Interferon activation and innate immunity
[152]
논문
Strategies and mechanisms for host and pathogen survival in acute and persistent viral infections
2004-10-00
[153]
서적
Neurovirology
2014-00-00
[154]
논문
Measles in the United Kingdom: can we eradicate it by 2010?
2006-10-00
[155]
서적
Mass Vaccination: Global Aspects — Progress and Obstacles
[156]
논문
New viral vaccines
2006-01-00
[157]
논문
Conclusions--future trends in veterinary vaccinology
2007-08-00
[158]
논문
Making better influenza virus vaccines?
2006-01-00
[159]
논문
Review the safety of Covid-19 mRNA vaccines: a review
2021-05-00
[160]
논문
Live attenuated versus killed virus vaccines
[161]
논문
Development of vaccines against hepatitis A and hepatitis B
[162]
논문
Vaccination of the immunocompromised child
2005-10-00
[163]
논문
Yellow fever vaccines and international travelers
2008-07-00
[164]
논문
Approved Antiviral Drugs over the Past 50 Years
2016-07-00
[165]
논문
Inhibitors of virus replication: recent developments and prospects
2005-03-00
[166]
논문
Genital herpes - the disease and its treatment including intravenous acyclovir
1983-09-00
[167]
논문
A brief history of antiretroviral therapy of HIV infection: success and challenges
2011-00-00
[168]
논문
Oral Direct-Acting Agent Therapy for Hepatitis C Virus Infection: A Systematic Review
2017-05-00
[169]
논문
Hepatitis B Virus: Advances in Prevention, Diagnosis, and Therapy
2020-03-00
[170]
논문
Potential of antiviral therapy and prophylaxis for controlling RNA viral infections of livestock
2008-04-00
[171]
논문
An annotated historical account of canine parvovirus
[172]
논문
Multiple virus infections in the honey bee and genome divergence of honey bee viruses
http://digitalcommon[...]
2004-10-00
[173]
서적
Matthews' Plant Virology
Academic Press
2022-02-21
[174]
논문
Potato Production, Usage, and Nutrition – A Review
2016-00-00
[175]
논문
Potato virus Y; the Andean connection
2019-07-00
[176]
논문
Structure-function analysis of the tobacco mosaic virus resistance gene N
2000-12-00
[177]
논문
Mechanisms of plant resistance to viruses
2005-10-00
[178]
서적
Recent Advances in Plant Virology
Caister Academic Press
[179]
논문
Virioplankton: viruses in aquatic ecosystems
2000-03-00
[180]
논문
High abundance of viruses found in aquatic environments
1989-08-00
[181]
논문
Biology of DNA restriction
1993-06-00
[182]
논문
CRISPR provides acquired resistance against viruses in prokaryotes
2007-03-00
[183]
논문
Small CRISPR RNAs guide antiviral defense in prokaryotes
2008-08-00
[184]
논문
The discovery of CRISPR in archaea and bacteria
2016-09-00
[185]
논문
Prophage Activation in the Intestine: Insights Into Functions and Possible Applications
2021-00-00
[186]
논문
Viruses, Genes, and Cancer
2017-00-00
[187]
논문
Endogenous Retroviruses as Modulators of Innate Immunity
2023-01-00
[188]
논문
Structural and functional studies of archaeal viruses
2009-05-00
[189]
논문
Exceptionally diverse morphotypes and genomes of crenarchaeal hyperthermophilic viruses
https://curis.ku.dk/[...]
2004-04-00
[190]
논문
Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements
2005-02-00
[191]
논문
A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action
2006-03-00
[192]
논문
Unravelling the structural and mechanistic basis of CRISPR-Cas systems
2014-07-00
[193]
논문
A Review on Viral Metagenomics in Extreme Environments
2019-00-00
[194]
논문
Diversity, evolutionary contribution and ecological roles of aquatic viruses
2018-12-00
[195]
논문
An ocean of viruses
https://www.the-scie[...]
[196]
논문
Viruses in the sea
2005-09-00
[197]
논문
Viruses and nutrient cycles in the sea: viruses play critical roles in the structure and function of aquatic food webs
[198]
논문
Virus-mediated transfer of nitrogen from heterotrophic bacteria to phytoplankton
https://www.biogeosc[...]
[199]
논문
Marine viruses – major players in the global ecosystem
2007-10-00
[200]
논문
Re-examination of the relationship between marine virus and microbial cell abundances
http://www.vliz.be/i[...]
2016-01-00
[201]
논문
Viral control of phytoplankton populations – a review
[202]
뉴스
Trillions Upon Trillions of Viruses Fall From the Sky Each Day
https://www.nytimes.[...]
2018-04-13
[203]
논문
Deposition rates of viruses and bacteria above the atmospheric boundary layer
2018-04-00
[204]
논문
Phocine distemper virus in the North and European Seas – data and models, nature and nurture
[205]
논문
The consumption of viruses returns energy to food chains
2023-01-00
[206]
뉴스
First "virovore" discovered: An organism that eats viruses
https://newatlas.com[...]
New Atlas
2022-12-28
[207]
논문
Phage as agents of lateral gene transfer
2003-08-00
[208]
논문
What viruses tell us about evolution and immunity: beyond Darwin?
2019-00-00
[209]
서적
Viruses, Underestimated Drivers of Ecology and Evolution of Life
Springer, Cham
[210]
논문
The last universal common ancestor (LUCA), simple or complex?
1999-06-00
[211]
서적
Molecular Cell Biology
W. H. Freeman
2000
[212]
학술지
Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases
2005-10-00
[213]
서적
Recent Advances in Plant Virology
Caister Academic Press
[214]
학술지
The mechanisms of genetically modified vaccinia viruses for the treatment of cancer
2015-09-00
[215]
학술지
A review of novel therapies for melanoma
2014-08-00
[216]
뉴스
FDA approves Amgen's injected immunotherapy for melanoma
https://www.reuters.[...]
2020-01-24
[217]
학술지
Oncolytic viruses: perspectives on clinical development
2015-08-00
[218]
학술지
Filamentous Phages As a Model System in Soft Matter Physics
2016-00-00
[219]
학술지
Viruses as building blocks for materials and devices
[220]
학술지
Fluorescent signal amplification of carbocyanine dyes using engineered viral nanoparticles
https://figshare.com[...]
2006-04-00
[221]
학술지
An engineered virus as a scaffold for three-dimensional self-assembly on the nanoscale
2005-07-00
[222]
학술지
Chemical synthesis of poliovirus cDNA: generation of infectious virus in the absence of natural template
2002-08-00
[223]
학술지
Virus attenuation by genome-scale changes in codon pair bias
2008-06-00
[224]
웹사이트
NIH viral genome database
https://www.ncbi.nlm[...]
Ncbi.nlm.nih.gov
2021-06-28
[225]
학술지
A brief history of biological weapons programmes and the use of animal pathogens as biological warfare agents
2017-08-00
[226]
학술지
Smallpox vaccines for biodefense: need and feasibility
2008-10-00
[227]
웹사이트
Virus Taxonomy: 2021 Release
https://talk.ictvonl[...]
2022-04-19
[228]
서적
標準微生物学 第14版
https://www.igaku-sh[...]
医学書院
2021-00-00
[229]
서적
あなたの医学書 C型肝炎・肝がん
誠文堂新光社
2009
[230]
뉴스
ウイルスは生命体
朝日新聞GLOBE
2020-09-06
[231]
뉴스
病気を引き起こすのは「氷山の一角」
朝日新聞GLOBE
2020-09-06
[232]
뉴스
【環境】パンデミックを防ぐため、世界的な自然保護政策を、報告書/哺乳類や鳥類に未知のウイルスは推定170万種、うち85万が人間に感染する恐れ
https://natgeo.nikke[...]
ナショナルジオグラフィック
2020-11-04
[233]
웹사이트
見えざるウイルスの世界
https://mhm.m.u-toky[...]
東京大学医学部・東京大学医学部附属病院 健康と医学の博物館
2021-08-22
[234]
웹사이트
Definition of "virus" > Translations for 'virus'
http://www.collinsdi[...]
[235]
서적
Botanical Latin. History, Grammar, Syntax, Terminology and Vocabulary.
David & Charles
1983
[236]
웹사이트
Pons: virus
http://de.pons.com/%[...]
[237]
서적
Cambridge History of Medicine: Spreading Germs: Disease Theories and Medical Practice in Britain, 1865-1900
Cambridge University Press
2000
[238]
서적
Diabetic Animal Models
CRC Press
2003
[239]
서적
文章表現辞典
東京堂出版
1965
[240]
학술지
学術集談会演説要旨
1937
[241]
학술지
植物のヷイラス病
1935
[242]
학술지
インフルエンザ・ヴイールスの赤血球による收着
1951
[243]
학술지
日本脳炎ウイールスの赤血球凝集反応 (第1報)
1952
[244]
학술지
家兎ニヨル發疹チフス病毒ノ實驗的研究
1930
[245]
기타
[246]
웹사이트
労働安全衛生規則(昭和四十七年労働省令第三十二号)第61条第1項第1号
https://laws.e-gov.g[...]
総務省行政管理局
2019-12-17
[247]
웹사이트
日本ウイルス学会について
http://jsv.umin.jp/a[...]
2020-04-06
[248]
서적
植物病理学事典
養賢堂
[249]
서적
カラー生化学
西村書店
2003-05-15
[250]
웹사이트
細菌とウイルスとの違い?
https://www.toholab.[...]
[251]
논문
Polintons: a hotbed of eukaryotic virus, transposon and plasmid evolution
https://www.ncbi.nlm[...]
2015-02-01
[252]
서적
人類と感染症の歴史 未知なる恐怖を越えて
丸善出版
2013-03-30
[253]
웹사이트
Wendell M. Stanley - Facts
http://www.nobelpriz[...]
2020-04-06
[254]
웹사이트
ハーシーとチェイスの実験
http://www.sci.toho-[...]
2020-04-06
[255]
뉴스
驚異のウイルスたち(3)「巨大」出現 新生命体へ進化?多数の遺伝子 揺らぐ定義
https://www.nikkei.c[...]
日本経済新聞
2020-06-07
[256]
웹사이트
Coronavirus Resource Center
https://www.health.h[...]
2020-02-28
[257]
뉴스
日本ウイルス療法学会が発足、理事長は東大医科研の藤堂具紀教授
https://bio.nikkeibp[...]
日経バイオテク
2022-10-31
[258]
논문
병독
https://en.wiktionar[...]
2020-03-08
[259]
논문
Louis Pasteur (1822–1895)
[260]
서적
[261]
서적
[262]
서적
[263]
서적
[264]
서적
Desk Encyclopedia of General Virology
Academic Press
[265]
서적
생명과학개론 13판
[266]
논문
The strategy of RNA viruses
[267]
논문
Characteristics of Viruses and the Infection Control
http://dx.doi.org/10[...]
2020-12-31
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com


