위장관 기질 종양
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
위장관 기질 종양(GIST)은 위장관에서 발생하는 육종의 일종으로, 1983년 진단 용어로 도입되었다. GIST는 c-KIT 유전자 변이와 관련이 있으며, 징후로는 삼킴 곤란, 위장관 출혈 등이 나타날 수 있다. 진단은 CT, MRI 등의 영상 검사를 통해 이루어지며, 악성 GIST는 간, 대망, 복막 등으로 전이될 수 있다. 치료는 수술이 기본이며, 수술이 불가능하거나 재발한 경우 이마티닙, 수니티닙 등의 약물 치료를 시행한다. GIST는 인구 백만 명당 10~20명에게 발생하며, 50~70세에 주로 나타난다.
더 읽어볼만한 페이지
- 소화기 질환 - 식도암
식도암은 식도 상피세포에서 발생하는 악성 종양으로, 편평상피세포암과 선암이 주된 유형이며, 진행될수록 연하곤란, 체중 감소, 흉통 등이 나타나고 흡연, 음주 등이 위험 요인으로 작용하며, 내시경 검사, 조직검사 등으로 진단하고 수술, 화학요법 등으로 치료하며 예방을 위해서는 금연, 절주 등이 중요하다. - 소화기 질환 - 위염
위염은 헬리코박터 파일로리 감염, 비스테로이드성 소염제, 알코올, 스트레스 등으로 인해 위 점막에 염증이 생기는 질환으로, 상복부 통증, 메스꺼움, 구토 등의 증상이 나타나거나 무증상일 수 있으며, 급성 또는 만성으로 분류되고, 내시경 검사 등으로 진단하여 제산제, 항생제 등으로 치료한다.
2. 분류
위장관 기질 종양(GIST)은 1983년에 진단 용어로 도입되었다. 1990년대 후반까지 위장관에서 발생한 다양한 비상피 종양이 GIST로 불렸다. 당시 조직 병리학자들은 분자적으로 다른 유형들을 구별할 수 없었다. 이후 CD34와 CD117(c-KIT)이 GIST를 구별하는 표지자로 확인되었다.
GIST 생물학에 대한 이해는 GIST의 분자적 기반, 특히 c-KIT이 확인되면서 크게 발전했다. 분자적 정의 이전에는 GIST의 70-80%가 양성이라고 주장되었으나, 분자적 기반이 밝혀지면서 이전의 GIST 중 상당수가 제외되고, 다른 유형의 육종 및 미분화 암종으로 분류되었던 종양들이 GIST로 포함되었다. 예를 들어, 과거 위 및 소장의 평활근육종으로 진단되었던 일부는 면역조직화학 염색을 통해 GIST로 재분류될 수 있다. 현재 모든 GIST는 악성 잠재력을 가진 것으로 간주되며, "양성"으로 확정적으로 분류될 수 없다. 모든 GIST는 AJCC(7판) / UICC에서 암 병기 설정에 적합하다.[2] GIST는 기원 부위, 크기, 유사 분열 수에 따라 재발 또는 전이 위험이 다르다.
최근 다중 오믹스 연구를 통해 GIST의 새로운 분자 분류가 도입되었고, 잠재적인 종양 억제 유전자 ''YLPM1''이 확인되었다.[3] 이 연구는 ''KIT/PDGFRA'' 변이 GIST를 4가지 분자 아형으로 분류했다.
- C1, C4 아형: 기존 위험 분류와 일치하며, 기존 치료 전략 및 예후 결과를 뒷받침한다.[6]
- C2 아형: CD8+ T 세포가 풍부하여 면역 요법에 반응할 가능성이 있다.[4]
- C3 아형: ''CDKN2A'' 이상이 빈번하며, ''KIT'' 및 ''CDK4/6'' 억제제 조합으로 치료 효과를 볼 수 있다.[5]
이러한 새로운 분자 분류는 맞춤형 치료를 안내하는 데 중요한 통찰력을 제공한다.[7]
2000년 이전의 임상 치료 경로는 정의의 변화로 인해 현재는 크게 의미가 없다.
GIST는 대략적으로 근원성 종양, 신경성 종양, 그리고 GIST를 포함한 그 외의 종양으로 분류된다. "그 외의 종양" 중, 수용체형 티로신 키나아제의 일종인 KIT 단백질(줄기 세포 인자 수용체)을 합성하는 유전자 ''c-kit''에 돌연변이가 발생하여 과발현되거나, 또는 그러한 종양과 구별할 수 없는 것(예: KIT 단백질의 존재는 증명할 수 없지만, 평활근이나 신경초로의 분화도 증명할 수 없고, CD34 등의 특이적 항원이 인정되는 경우. 대부분 혈소판 유래 성장 인자 수용체 α 서브타입을 합성하는 유전자 ''PDGFRA''에 돌연변이가 있다.)이 GIST로 정의된다.
GIST의 기원이 되는 정상 세포는 '''카할 간질 세포'''(ICC)로 알려져 있다. ICC는 소화관 운동의 페이스 메이커 세포로 기능하며, 세포막을 관통하는 KIT 단백질이라는 표면 항원을 가진다. 이 단백질은 c-kit 유전자에 의해 코드되며, 수용체형 티로신 키나아제로 기능한다. 선천적으로 KIT 단백질이 결여된 개체는 ICC 결손을 보인다.
3. 징후 및 증상
삼킴 곤란, 위장관 출혈, 또는 전이(주로 간)가 나타날 수 있다. 종양의 외부 성장 패턴으로 인해 장 폐쇄는 드물다. 종종 모호한 복통이나 불편함이 느껴질수 있으며, 진단 시점에 종양이 상당히 커져 있는 경우가 많다.[1]
4. 병태생리학
GIST는 결합 조직에서 발생하는 육종의 일종으로, 대부분의 위장관 종양과 달리 비상피성이다. GIST는 위장관의 자율 신경계의 일부인 카할 간질 세포(ICC)에서 발생하는 것으로 생각된다. ICC는 위장관 운동성을 조절하는 페이스메이커 기능을 한다.
GIST는 수용체형 티로신 키나아제의 일종인 KIT 단백질(줄기 세포 인자 수용체)을 합성하는 유전자 ''c-kit''에 돌연변이가 있거나, 혈소판 유래 성장 인자 수용체 α 서브타입을 합성하는 유전자 ''PDGFRA''에 돌연변이가 있는 경우가 해당된다.
GIST의 기원이 되는 정상 세포로는 카할 간질 세포(ICC)가 유력하게 여겨지고 있다. ICC는 소화관 운동의 페이스메이커 세포로 기능하며, 세포막을 관통하는 KIT 단백질이라는 표면 항원을 가지고 있다.
4. 1. 유전학
대부분의 위장관 기질 종양(GIST)는 산발적으로 발생한다. 5% 미만은 유전 질환과 관련된 가족성 또는 특발성 다발성 종양 증후군의 일부로 발생한다. 여기에는 빈도순으로 신경섬유종증 레클링하우젠(NF-1), 카르니 삼증후군(위 GIST, 폐 연골종, 부신 외 부신경절종), 생식세포의 기능 획득 돌연변이가 c-KIT/PDGFRA에서 발생하며, 카르니-스트라타키스 증후군이 포함된다. 카르니-스트라타키스 증후군은 쌍극의 유전성 GIST와 부신경절종이며, 이는 숙신산 탈수소 효소 (SDH) 서브유닛 SDHD, SDHC 및 SDHB를 포함하는 미토콘드리아 종양 억제 유전자 경로에서 발생하는 생식세포 돌연변이에 의해 유발된다.4. 2. c-KIT 돌연변이
위장관 기질 종양(GIST)의 약 85%는 비정상적인 ''c-KIT'' 경로와 관련이 있다. ''c-KIT''는 줄기 세포 인자(scf)라는 성장 인자에 대한 막횡단 수용체를 암호화하는 유전자이다. 비정상적인 ''c-KIT'' 경로는 가장 흔하게(85%) 유전자 자체의 돌연변이로 인해 발생한다. c-KIT 관련 GIST의 작은 하위 집합은 면역블로팅에 의해 발견된 ''KIT'' 효소 경로의 구성적 활성과 관련이 있다. c-KIT 생성물/CD117은 ICC와 주로 골수 세포, 비만 세포, 멜라닌 세포 및 기타 여러 세포에서 발현된다. 그러나 장에서는 CD117에 양성으로 염색되는 덩어리가 ICC 세포에서 발생하여 GIST일 가능성이 높다.c-KIT 분자는 긴 세포외 도메인, 막횡단 세그먼트 및 세포내 부분을 포함한다. 돌연변이는 일반적으로 다른 효소를 활성화하는 티로신 키나제 역할을 하는 세포내 부분을 암호화하는 DNA에서 발생한다(엑손 11). 돌연변이는 ''scf''에 의한 활성화와 독립적으로 c-KIT 기능을 만들고, 높은 세포 분열 속도와 잠재적으로 게놈 불안정성을 초래한다. ''c-KIT'' 돌연변이가 있는 세포가 GIST로 발달하려면 추가 돌연변이가 필요할 가능성이 높지만, ''c-KIT'' 돌연변이가 이 과정의 첫 번째 단계일 가능성이 높다.
''c-KIT'' 유전자의 엑손 11, 9, 드물게 13 및 17에서 돌연변이가 발생하는 것으로 알려져 있다. ''c-KIT''의 티로신 키나제 기능은 GIST의 의학적 치료에서 중요하다.
- c-KIT 엑손 17의 KIT-D816V 점 돌연변이는 티로신 키나제 억제제인 이마티닙 메실산염과 같은 표적 치료 약물에 대한 내성을 담당한다.
- KIT-p.D419del(엑손 8) — 이전에 야생형 종양으로 간주되었던 GIST의 하위 집합은 KIT 엑손 8(p.D419del)에서 체세포 활성화 돌연변이를 갖는다.[9]
4. 3. PDGFRA 돌연변이
c-KIT 유전자가 변이되지 않은(야생형) 대부분의 위장관 기질 종양 세포는 이와 관련된 티로신 키나아제인 혈소판 유래 성장 인자 수용체 알파 유전자에 변이를 보인다.[29] ''c-KIT''과 ''PDGFrA''의 변이는 상호 배타적이다.[29]4. 4. 야생형 종양
위장관 기질 종양(GIST) 중 일부는 c-KIT 또는 PDGFR-α 이상과 관련이 없는 것으로 보인다. GIST의 약 10~15%는 KIT 및 혈소판 유래 성장 인자 수용체 알파(PDGFRA)의 모든 핫스팟에서 야생형 서열을 갖는다(wt-GIST). 이러한 종양은 현재 KIT 유전자의 엑손 9, 11, 13, 17 및 PDGFRA 유전자의 엑손 12, 14, 18에 돌연변이가 없는 것으로 정의된다.[9]5. 진단
위장관 기질 종양의 진단은 내시경, CT, 초음파 유도하 세침 흡인술(EUS-FNA) 등을 통해 이루어진다. 최종 진단은 생검을 통해 이루어지며, 병리학자가 현미경으로 조직병리학적 특징을 확인한다. GIST의 특징적인 조직 소견은 방추세포(70-80%), 상피양세포(20-30%)이다. 작은 종양은 대개 장벽의 고유근층에 국한되지만, 큰 종양은 장벽 바깥쪽으로 성장하며 내부 괴사를 동반하고 장 내강과 소통하는 공동을 형성할 수 있다.
GIST가 의심되는 경우, 면역조직화학 염색을 통해 CD117(c-kit), CD34, DOG-1, desmin, vimentin 등의 마커를 확인한다. GIST의 95%는 CD117 양성이지만, 비만 세포도 CD117 양성 반응을 보일 수 있다. CD117 염색이 음성이면 DOG-1 항체를 사용하거나 KIT 및 PDGFRA 유전자 염기 서열 분석을 시행한다.
- '''내시경''': GIST는 대부분 정상 점막으로 덮여 있어 점막하 종양(SMT) 형태를 보인다. 일반적인 생검으로는 점막 표면 조직만 채취 가능하므로, 굴착 생검(boring biopsy)이나 초음파 내시경 유도하 세침 흡인술(EUS-FNA)이 필요하다. EUS-FNA는 복강 내 파종 위험이 있어 주의해야 한다.[23][24] 종양이 커져 궤양을 형성하고 소화관강에 노출된 경우에는 일반 생검으로도 평가 가능하다.
- '''CT・MRI''': 종양의 형태를 종합적으로 평가하는 데 사용된다.
면역 염색을 통해 KIT 단백 및 CD34(혈관 내피와 어린 조혈 줄기 세포의 표면 항원)를 확인하여 평활근 조직이나 말초 신경 유래 종양과 감별한다. 소화관 근층 내에서 CD34와 KIT를 모두 발현하는 세포는 카할 간질 세포(ICC)뿐이다.
5. 1. 영상 검사
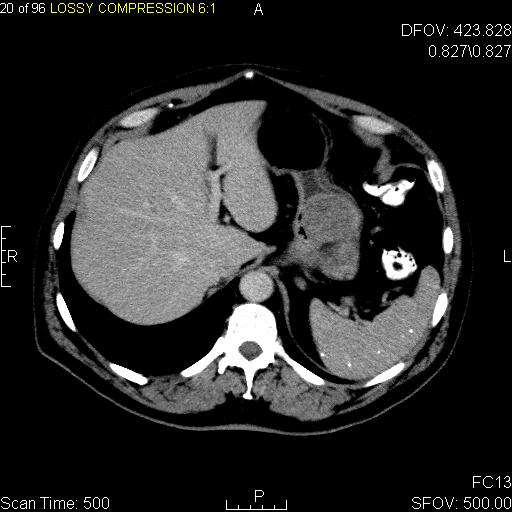
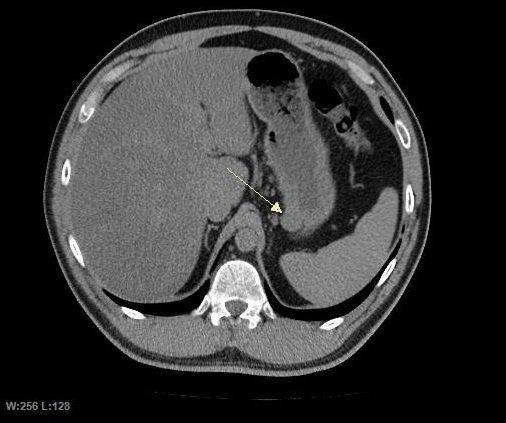
CT 스캔과 MRI는 GIST를 평가하는 데 선호되는 영상 검사 방법이다. 작은 GIST는 대개 점막하 종양 또는 장벽 내 종괴로 나타난다. 바륨 연하 검사에서 이러한 GIST는 인접한 장벽과 직각 또는 둔각을 이루는 매끄러운 경계로 나타나며, 점막 표면은 대개 손상되지 않지만, 50%에서 궤양이 나타나기도 한다. 궤양은 바륨으로 채워져 과녁 또는 표적 병변처럼 보인다. 조영 증강 CT에서 작은 GIST는 균질한 감쇠를 보이는 매끄럽고 선명하게 정의된 장벽 내 종괴로 보인다.큰 GIST는 장 밖으로 튀어나오거나 장 내부로 성장할 수 있으며, 내부에서 괴사(죽음)하여 결국 장 내강과 소통하게 될 수 있는 공동을 형성한다. 공동 형성이 있는 경우, 단순 방사선 촬영에서 종양 내 공기 덩어리가 나타날 것이다. 석회화는 GIST의 드문 특징이지만, 존재할 경우 단순 촬영에서 볼 수 있다.
악성 GIST는 국소 침윤과 전이를 특징으로 하며, 전이는 주로 간, 대망, 복막으로 발생한다. 그러나 뼈, 흉막, 폐, 후복막으로의 전이 사례도 보고되었다. 위 선암종 또는 위/소장 림프종과 달리, 악성 림프절병증 (부어오른 림프절)은 드물며 (<10%) 따라서 영상 검사에서는 림프절 비대가 없는 경우가 많다. 전이가 없는 경우, 악성을 시사하는 다른 방사선학적 특징으로는 크기 (>5 cm), 조영제 투여 후의 불균일한 조영 증강 및 궤양이 있다.[12]
6. 치료
국소적이고 절제 가능한 위장관 기질 종양(GIST)의 경우, 해부학적, 생리학적으로 가능하다면 수술이 일차적인 치료법이다. 수술은 잠재적 완치를 기대할 수 있지만, 신중하게 선택된 작은 종양의 경우에는 주의 깊게 경과를 관찰하는 것도 고려할 수 있다. 림프절 전이는 드물기 때문에 림프절 절제술은 일반적으로 필요하지 않다.[13]
복강경 수술은 망원경과 특수 기구를 사용하여 큰 절개 없이 종양을 제거하는 효과적인 방법이다. 1cm 정도의 절제면으로 충분하며, 더 광범위한 절제는 이점을 제공하지 않고 오히려 합병증 위험을 증가시킬 수 있다.[13] 종양의 크기, 위치, 성장 패턴에 따라 복강경 수술의 적절성이 결정된다.
방사선 치료는 역사적으로 GIST에 효과적이지 않았으며, GIST는 대부분의 화학 요법 약물에 반응하지 않고 5% 미만의 반응률을 보인다.
6. 1. 약물 치료
기본적으로 외과적 절제가 우선적인 선택이다. 그러나 전이 등으로 수술적 절제가 어려운 경우에는 항암제 치료(화학 요법)가 시행된다.[25][26]절제가 불가능한 경우나 수술 후 병리 결과에 따른 보조 요법으로 다음과 같은 항암제 치료가 시행된다.
- '''이마티닙'''(imatinib, 글리벡): 거의 첫 번째 선택으로 사용된다. 티로신 키나제 억제제로, KIT 단백질 억제를 통해 GIST의 증식을 억제한다.
- '''수니티닙'''(sunitinib, 수텐트): 이마티닙에 저항성을 보이는 경우 사용되는 티로신 키나제 억제제이다.
- '''레고라페닙'''(regorafenib, 스티바르가): 이마티닙이나 수니티닙에 내성을 보이는 경우에 사용되는 멀티키나제 억제제이다.[25][26]
이마티닙은 D842V를 제외한 ''c-KIT'' 티로신 키나아제 돌연변이와 PDGFRA 돌연변이를 모두 억제하며, 여러 상황에서 GIST 치료에 유용하다. PDGFRA 돌연변이의 특정 아형인 D842V는 이마티닙에 민감하지 않다.[16][17]
6. 2. 수술 후 보조 요법
이마티닙(글리벡)은 만성 골수성 백혈병 치료를 위해 개발되었지만, D842V를 제외한 ''c-KIT'' 티로신 키나아제 돌연변이와 PDGFRA 돌연변이를 억제하여 GIST 치료에도 효과적이다.[30]종양 크기, 유사 분열 수, 위치 등을 고려하여 재발 위험이 높은 경우, 수술 후 보조 요법으로 이마티닙을 사용할 수 있다.[32] GIST의 외과적 절제 후 이마티닙을 사용한 보조 치료는 고위험군에서 질병 재발 위험을 감소시킨다. 일부 고위험군에서는 이마티닙을 3년 동안 사용한다.
7. 예후
GIST는 증식 형태, 세포 분열 수, 세포 이형성 등에 따라 예후가 달라진다. 낮은 악성도의 종양도 때로는 원격 전이를 일으키는 경우가 있어, 임상적으로는 낮은 악성도의 종양으로 취급된다. 드물게는, 명백히 육종으로서의 형태를 보이는 것도 있으며, 이는 고악성도의 종양으로 나타난다.
8. 역학
위장관 기질 종양(GIST)은 인구 백만 명당 10~20명에게 발생한다. 새로운 실험 방법이 위장관 기질 종양 진단에 더 민감하므로 실제 발생률은 더 높을 수 있다. 미국의 위장관 기질 종양 연간 추정 발생률은 약 5,000건이다. 이는 위장관 기질 종양이 70가지 이상의 암 유형을 구성하는 육종의 가장 흔한 형태임을 나타낸다.
위장관 기질 종양은 주로 50~70세에 나타난다. 대부분의 연령대에서 위장관 기질 종양의 발생률은 남성과 여성이 비슷하다.
성인 위장관 기질 종양은 40세 이전에 드물게 발생한다. 소아 위장관 기질 종양은 생물학적으로 뚜렷한 것으로 간주된다. 다른 연령대의 위장관 기질 종양과 달리 소아 위장관 기질 종양은 여자와 젊은 여성에게 더 흔하다. 이들은 KIT와 PDGFRA 모두에서 발암성 활성 티로신 키나아제 돌연변이가 없는 것으로 보인다. 소아 위장관 기질 종양은 성인 위장관 기질 종양과 다르게 치료된다. 일반적으로 받아들여지는 소아 위장관 기질 종양의 정의는 18세 이하의 나이에 진단되는 종양이지만, "소아형" 위장관 기질 종양은 성인에게서도 나타날 수 있으며, 이는 위험 평가, 림프절 절제술의 역할, 치료 선택에 영향을 미친다.
참조
[1]
논문
Heterotopic pancreas in the gastrointestinal tract.
2009-08-07
[2]
문서
AJCC manual
[3]
논문
Genomic and transcriptomic landscape of human gastrointestinal stromal tumors
https://www.nature.c[...]
2024-11-03
[4]
웹사이트
Multi-omics-based classification of gastrointestinal stromal tumors lays groundwork for precision treatment
https://www.news-med[...]
2024-11-15
[5]
웹사이트
New classification of gastrointestinal stromal tumors guides precision treatment
https://medicalxpres[...]
2024-11-15
[6]
웹사이트
New Classification of Gastrointestinal Stromal Tumors Guides Precision Treatment {{!}} Nature Communications
https://www.bgi.com/[...]
2024-11-15
[7]
웹사이트
Genetic Map Paves Way for Targeted GIST Treatment
https://www.emjrevie[...]
2024-11-15
[8]
논문
Gastrointestinal stromal tumors: a comprehensive review
2019-02
[9]
논문
A subset of gastrointestinal stromal tumors previously regarded as wild-type tumors carries somatic activating mutations in KIT exon 8 (p.D419del)
[10]
논문
Wnt/β-catenin signaling pathway in uterine leiomyoma: role in tumor biology and targeting opportunities.
[11]
논문
Immunohistochemistry for beta-catenin in the differential diagnosis of spindle cell lesions: analysis of a series and review of the literature.
[12]
논문
Gastrointestinal stromal tumours: CT findings
[13]
논문
Laparoscopic resection of gastric GIST tumor
[14]
논문
Surgical treatment of gastrointestinal stromal tumour of the rectum in the era of imatinib
2015-08
[15]
논문
Adjuvant treatment of GIST: patient selection and treatment strategies
2012-06-01
[16]
논문
Adjuvant therapy for high-risk gastrointestinal stromal tumour: considerations for optimal management
2012-10-22
[17]
문서
ASCO-SEP 3rd ed
[18]
논문
FDA approves avapritinib for gastrointestinal stromal tumor with a rare mutation
https://www.fda.gov/[...]
2020-01-09
[19]
논문
Avapritinib in advanced gastrointestinal stromal tumor: case series and review of the literature from a tertiary care center in India
2021
[20]
웹사이트
GIST(消化管間質腫瘍)(じすと(しょうかかんかんしつしゅよう))
https://www.ncc.go.j[...]
国立がん研究センター希少がんセンター
[21]
웹사이트
EUS-FNAでの正確な組織診断
https://www.ncc.go.j[...]
2019-04-04
[22]
웹사이트
超音波内視鏡:EUS(すい臓・胆管検査)
http://syoukaki-oita[...]
2019-04-04
[23]
논문
Melanoma seeding of an EUS-guided fine needle track
[24]
논문
Resected tumor seeding in stomach wall due to endoscopic ultrasonography-guided fine needle aspiration of pancreatic adenocarcinoma
WJG Press
2015-07
[25]
간행물
バイエル薬品株式会社 2012年9月27日広報
http://byl.bayer.co.[...]
[26]
간행물
2013/03/25 バイエルヘルスケア 「経口マルチキナーゼ阻害剤「スチバーガ錠」の製造販売承認を取得」
http://byl.bayer.co.[...]
[27]
논문
Heterotopic pancreas in the gastrointestinal tract.
2009-08-07
[28]
문서
AJCC manual
[29]
논문
Gastrointestinal stromal tumors: a comprehensive review
[30]
논문
Surgical treatment of gastrointestinal stromal tumour of the rectum in the era of imatinib
[31]
논문
Adjuvant treatment of GIST: patient selection and treatment strategies
[32]
논문
Adjuvant therapy for high-risk gastrointestinal stromal tumour: considerations for optimal management
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

