클로로메테인
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
클로로메테인은 1835년에 발견된 유기 염소 화합물로, 현재는 주로 다이메틸다이클로로실레인 및 관련 유기 실리콘 화합물의 생산에 사용된다. 자연적으로는 해양 식물성 플랑크톤과 일부 해조류에서 발생하며, 사탕수수 산업 폐기물 소각 시에도 배출된다. 과거에는 냉매, 가솔린 첨가제 등으로 사용되었으나 독성으로 인해 사용이 중단되었다. 클로로메테인은 대기 중으로 방출되어 약 10개월의 수명을 가지며, 흡입 시 중추신경계에 영향을 미쳐 마비, 발작 등을 일으킬 수 있다.
더 읽어볼만한 페이지
- 메틸화제 - 메틸리튬
메틸리튬(CH3Li)은 자연발화성을 가진 유기금속 화합물로, 강한 염기성과 친핵성을 이용하여 메틸 음이온 신톤 합성, 3급 알코올 생성, 비금속 할로겐화물 메틸화 등에 활용되며 사량체, 육량체 구조로 존재하고 용매에 따라 응집 정도가 달라 안전을 위해 불활성 기체 하 보관 및 물과의 접촉을 피해야 한다. - 메틸화제 - 아이오딘화 메틸
아이오딘화 메틸은 화학식 CH3I를 갖는 유기 화합물로, SN2 치환 반응에 효과적인 기질로 사용되는 메틸화제이며, 아세트산 생산의 중간체, 살충제나 토양 소독제로 사용되지만 독성 및 발암성 논란이 있는 물질이다. - 클로로알케인 - 클로로포름
클로로포름은 화학식 CHCl3을 갖는 무색의 휘발성 액체 유기 화합물로, 마취 효과가 있어 과거에 마취제로 사용되었으나 독성 문제로 현재는 냉매 생산, 유기 용매 등으로 사용되며, 발암 가능성과 유독 물질 생성 위험으로 취급에 주의가 필요하고 사용을 줄이는 추세이다. - 클로로알케인 - 클로로에테인
클로로에테인은 화학식 C2H5Cl를 갖는 할로젠화 알킬로, 과거 테트라에틸납 생산에 주로 사용되었으나 현재는 에틸 셀룰로스 합성, 국소 마취제, 오락용 흡입제 등으로 사용되며 폭발성과 마취 작용의 위험이 있다. - 할로젠화 용매 - 클로로포름
클로로포름은 화학식 CHCl3을 갖는 무색의 휘발성 액체 유기 화합물로, 마취 효과가 있어 과거에 마취제로 사용되었으나 독성 문제로 현재는 냉매 생산, 유기 용매 등으로 사용되며, 발암 가능성과 유독 물질 생성 위험으로 취급에 주의가 필요하고 사용을 줄이는 추세이다. - 할로젠화 용매 - 염화 플루오린화 탄소
염화 플루오린화 탄소(CFC)는 냉매, 발포제 등으로 사용되었으나 오존층 파괴의 주범으로 규제되어 몬트리올 의정서에 의해 단계적으로 폐지되었고, 수소염화불화탄소(HCFC), 수소불화탄소(HFC) 등의 대체 물질이 개발되었다.
2. 역사
1835년 프랑스 화학자 장바티스트 뒤마와 우제느-멜시오르 펠리고(Eugène-Melchior Péligot)가 메탄올, 황산, 염화 나트륨을 가열하여 얻는 것을 발견했다. 현재에도 비슷한 방법이 사용된다. 이후 우주에서도 발견되었다.
2. 1. 우주에서의 발견
클로로메테인은 아타카마 대형 밀리미터/서브밀리미터 전파 간섭계(ALMA)를 사용하여 저질량 Class 0 원시별 바이너리 IRAS 16293-2422에서 검출되었다. 또한 로제타 궤도선의 이온 및 중성 분석을 위한 로제타 궤도선 분광계(ROSINA)를 사용하여 혜성 67P/추류모프-게라시멘코(67P/C-G)에서도 검출되었다.[12] 이러한 검출은 클로로메테인이 행성이나 생명체가 형성되기 전에 별 형성 영역에서 형성될 수 있음을 보여준다.
3. 발생원
클로로메테인은 대기 중에 다량 존재하는 유기할로겐 화합물로, 인위적 또는 자연적으로 발생한다. 자연적인 발생원과 인위적인 발생원으로 나눌 수 있다.
클로로메테인은 아타카마 대형 밀리미터/서브밀리미터 전파 간섭계(ALMA)를 사용하여 저질량 Class 0 원시별 바이너리 IRAS 16293-2422에서 검출되었다. 또한 로제타 궤도선의 이온 및 중성 분석을 위한 로제타 궤도선 분광계(ROSINA)를 사용하여 혜성 67P/추류모프-게라시멘코 (67P/C-G)에서도 검출되었다.[12] 이러한 검출은 클로로메테인이 행성이나 생명체가 형성되기 전에 별 형성 영역에서 형성될 수 있음을 보여준다.
3. 1. 자연적 발생원
클로로메테인은 대기 중에 다량 존재하는 유기할로겐 화합물로, 인위적 또는 자연적으로 발생한다. 자연적인 발생원은 연간 약 41억kg으로 추정된다.[5]해양 식물성 플랑크톤 (''Phaeodactylum tricornutum'', ''Phaeocystis'' sp., ''Thalassiosira weissflogii'', ''Chaetoceros calcitrans'', ''Isochrysis'' sp., ''Porphyridium'' sp., ''Synechococcus'' sp., ''Tetraselmis'' sp., ''Prorocentrum'' sp. 및 ''Emiliana huxleyi'')의 실험 배양에서는 CH3Cl이 생성되지만, 비교적 미미한 양이다.[6][7] 극지 거대 조류 30종에 대한 광범위한 연구에서, CH3Cl의 상당한 방출은 ''Gigartina skottsbergii''와 ''Gymnogongrus antarcticus''에서만 발견되었다.[8]
염생 습지 식물인 ''바티스 마리티마''는 S-아데노실-L-메티오닌과 염화물을 이용해 CH3Cl을 합성하는 효소인 메틸 클로라이드 전이효소를 함유하고 있다.[9] 이 단백질은 정제되어 ''대장균''에서 발현되었으며, 흰색 부패 곰팡이 (''펠리누스 포마세우스''), 홍조류 (''엔도클라디아 무리카타''), 그리고 아이스 플랜트(''메셈브리안테뭄 크리스탈리눔'')와 같은 다른 유기체에도 존재하는 것으로 보이며, 이들은 모두 CH3Cl 생산자로 알려져 있다.[9][10]
클로로메테인은 아타카마 대형 밀리미터/서브밀리미터 전파 간섭계(ALMA)를 사용하여 저질량 Class 0 원시별 바이너리 IRAS 16293-2422에서 검출되었다. 또한 로제타 궤도선의 이온 및 중성 분석을 위한 로제타 궤도선 분광계(ROSINA)를 사용하여 혜성 67P/추류모프-게라시멘코 (67P/C-G)에서도 검출되었다.[12] 이러한 검출은 클로로메테인이 행성이나 생명체가 형성되기 전에 별 형성 영역에서 형성될 수 있음을 보여준다.
3. 2. 인위적 발생원
사탕수수 산업에서 유기성 폐기물은 일반적으로 열병합 발전 과정에서 태워진다. 염소로 오염된 이 폐기물은 연소 시 대기 중으로 클로로메테인을 방출한다.[11]4. 생산
클로로메테인은 "메틸렌의 염산염"이라고 불렸으며, 1835년 프랑스 화학자 장바티스트 뒤마와 외젠 멜키오르 펠리고가 메탄올, 황산, 염화 나트륨의 혼합물을 끓여서 합성하면서 발견되었다.[14] 해양에서는 미생물이 햇빛과 염소를 이용하여 대량의 클로로메탄을 생산하고 있지만, 사람이 사용하는 클로로메탄은 전량이 공업적으로 생산되고 있다.
4. 1. 메탄올과 염산의 반응
1835년 프랑스 화학자 장바티스트 뒤마와 외젠 멜키오르 펠리고가 메탄올, 황산, 염화 나트륨의 혼합물을 끓여서 클로로메테인을 합성하였다.[14] 이 방법은 오늘날 사용되는 방법의 선구자이며, 오늘날에는 황산과 염화 나트륨 대신 염화 수소를 사용한다.[15]클로로메테인은 화학 반응식에 따라 메탄올을 염산 또는 염화 수소로 처리하여 상업적으로 생산된다.[16]
: CH3OH + HCl → CH3Cl + H2O
대부분의 클로로메탄은 메탄올과 염화 수소를 반응시켜 얻는다. 구체적으로는 가열된 메탄올에 염화 수소를 통과시키거나, 350℃로 가열된 메탄올 가스와 염화 수소를 산화 알루미늄 촉매 중에서 반응시켜 얻는다. 전자의 방법에서는 염화 아연이 촉매로 사용되기도 한다.
4. 2. 메테인의 염소화
클로로메테인은 1835년 프랑스 화학자 장바티스트 뒤마와 외젠 멜키오르 펠리고가 메탄올, 황산, 염화 나트륨의 혼합물을 끓여서 합성하면서 발견된 초기 유기염소화학 화합물 중 하나이다.[14] 이 방법은 오늘날 사용되는 방법의 선구자이며, 오늘날에는 황산과 염화 나트륨 대신 염화 수소를 사용한다.[15]클로로메테인은 화학 반응식에 따라 메탄올을 염산 또는 염화 수소로 처리하여 상업적으로 생산된다.[16]
: CH3OH + HCl → CH3Cl + H2O
더 적은 양의 클로로메테인은 메테인과 염소의 혼합물을 고온에서 처리하여 생산된다. 그러나 이 방법은 다이클로로메테인, 클로로포름, 사염화 탄소와 같은 고도로 염소화된 화합물도 생성한다. 이러한 이유로 메탄 염소화는 일반적으로 다른 제품도 원하는 경우에만 수행된다. 이 염소화 방법은 또한 처리 문제로 이어지는 염화 수소를 함께 생성한다.[16]
: CH4 + Cl2 -> CH3Cl + HCl
: CH3Cl + Cl2 -> CH2Cl2 + HCl
: CH2Cl2 + Cl2 -> CHCl3 + HCl
: CHCl3 + Cl2 -> CCl4 + HCl
대부분의 클로로메테인은 메탄올과 염화 수소를 반응시켜 얻는다.
: CH3OH + HCl → CH3Cl + H2O
구체적으로는 가열된 메탄올에 염화 수소를 통과시키거나, 350℃로 가열된 메탄올 가스와 염화 수소를 산화 알루미늄 촉매 중에서 반응시켜 얻는다. 전자의 방법에서는 염화 아연이 촉매로 사용되기도 한다.
일부에서는 메탄과 염소를 400℃ 이상으로 가열하여 생산한다. 그러나 이 방법에서는 다염소화 반응이 일어나 클로로메탄과 동시에 다이클로로메테인, 클로로포름, 사염화 탄소가 부산물로 생산된다.
: CH4 + Cl2 → CH3Cl + HCl
5. 용도
클로로메테인은 다양한 용도로 사용되어 왔으며, 현재는 주로 실리콘 화합물 생산에 사용되지만 과거에는 냉매나 가솔린 첨가제 등으로 사용되기도 했다.
클로로메테인의 주요 용도는 다음과 같이 정리할 수 있다.
- '''실리콘 화합물 생산:''' 다이메틸다이클로로실레인 등 유기 실리콘 화합물 생산에 대규모로 사용된다.
- '''기타 용도:''' 부틸 고무 제조, 석유 정제 용매, 메틸 셀룰로스 생산, 추출제, 추진제, 발포제, 국소 마취제, 의약품 제조 중간체, 중합 시 촉매 담체, 온도계 및 자동 온도 조절 장치 유체, 제초제 등으로 사용된다.
5. 1. 현재의 용도
클로로메테인은 다이메틸다이클로로실레인 및 관련 유기 실리콘 화합물 생산에 대규모로 사용된다.[16] 직접 공정을 통해 생성되는 관련 반응은 다음과 같다(Me = CH3)::x MeCl + Si → Me3SiCl, Me2SiCl2, MeSiCl3, Me4Si2Cl2, ...
다이메틸다이클로로실레인(Me2SiCl2)은 실리콘의 전구체로서 특히 중요하며, 트라이메틸실릴 클로라이드(Me3SiCl)와 메틸트라이클로로실레인(MeSiCl3) 또한 가치가 있다. 더 적은 양은 부틸 고무 제조 및 석유 정제에서 용매로 사용된다.
클로로메테인은 메틸화 및 염소화제로 사용되며, 메틸 셀룰로스 생산에 사용된다. 또한, 석유의 그리스, 오일, 수지 추출제, 폴리스티렌 폼 생산의 추진제 및 발포제, 국소 마취제, 약물 제조의 중간체, 저온 중합에서의 촉매 담체, 온도계 및 자동 온도 조절 장치의 유체, 제초제 등 다양한 분야에서 사용된다.
과거에는 에어컨[26]이나 냉장고의 냉매로 널리 사용되었으나, 독성으로 인해 사용되지 않게 되었다. 또한 한때 가솔린 첨가제가 되는 납 화합물의 제조에도 사용되었지만, 환경 보호의 관점에서 납 첨가 자체가 감소하면서 이용도 줄어들었다.
이후 중요한 용도로 부상한 것은 실리콘 폴리머의 제조 중간체로서의 이용이다. 또한 인공 고무의 제조에도 사용될 수 있다. 유기 화학에서는 메틸화제 또는 염소화제로 사용된다. 그 외에 유지·석유·수지 등의 추출제로, 또한 폴리스티렌 발포체 제조 시의 발포제로 사용된다. 그 외에도 국소 마취제, 의약품 제조 시의 중간체, 저온 중합 시의 촉매 담체, 온도 측정 기재 및 항온 기재 등에 사용되는 유동체, 제초제 등 다양한 곳에서 사용되고 있다.
5. 2. 과거의 용도
클로로메테인은 널리 사용된 냉매였으나, 독성으로 인해 사용이 중단되었다. 1930년대 일반적인 냉매 중 클로로메테인은 독성, 인화성, 무취함이 결합되어 이산화 황 및 암모니아와 같은 다른 독성 냉매에 비해 특히 위험했다.[24] 또한 클로로메테인은 한때 납 기반 가솔린 첨가제 (테트라메틸납)를 생산하는 데 사용되었다.과거에는 에어컨[26]이나 냉장고의 냉매로 널리 사용되었으나, 독성으로 인해 사용되지 않게 되었다. 또한 한때 가솔린 첨가제가 되는 납 화합물의 제조에도 사용되었지만, 환경 보호의 관점에서 납 첨가 자체가 감소하면서 이용도 줄어들었다.
6. 환경 내 분산
환경에 존재하는 대부분의 클로로메테인은 대기로 방출된다. 공기 중으로 방출된 후, 이 물질의 대기 중 수명은 약 10개월이며, 해양, 성층권으로의 이동, 토양 등과 같은 여러 자연적인 제거 경로를 거친다.[17][18][19]
반면에 방출된 클로로메테인이 물에 방출되면 휘발에 의해 빠르게 손실된다. 강, 석호 및 호수에서 휘발과 관련된 이 물질의 반감기는 각각 2.1시간, 25시간 및 18일이다.[20][21]
성층권에 있는 클로로메테인의 양은 연간 200만 톤으로 추정되며, 이는 매년 성층권으로 방출되는 총 염소량의 20~25%를 차지한다.[22][23]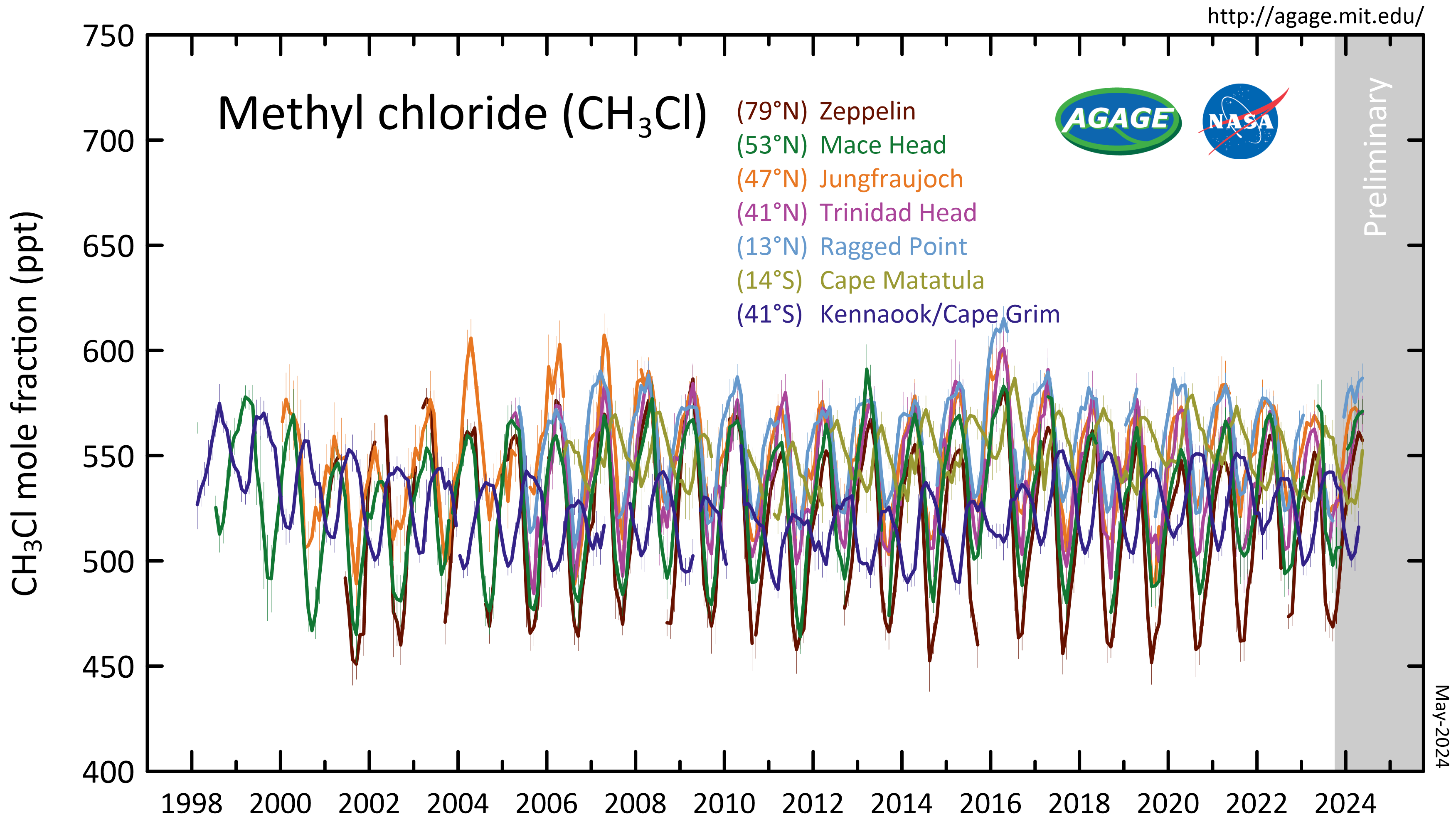
7. 반응
클로로메테인은 규소 (Si)와 반응하여 다양한 메틸클로로실레인을 생성한다. 대표적인 반응식은 다음과 같다.[1]
8. 안전성
클로로메테인 가스를 흡입하면 알코올 중독과 비슷한 중추신경계 영향을 미칠 수 있다. 장기간 노출되면 돌연변이적 영향을 줄 수 있다.[31] TLV는 50ppm이며, MAC도 같다.[16]
고농도의 클로로메테인 가스를 흡입하면 중추신경계가 중독된다. 졸음, 현기증, 숨가쁨, 호흡 곤란, 보행 곤란, 대화 곤란 등의 증상이 나타나며, 심하면 마비, 발작, 혼수 등을 일으킬 수 있다. 경구 섭취 시에는 메스꺼움과 구토를 유발하며, 액체 상태의 클로로메테인이 피부에 닿으면 동상을, 눈에 접촉하면 시야 흐림을 유발할 수 있다.
마우스를 이용한 실험에서 만성 노출 시 변이원성이 확인되었다. 인간의 경우 태아의 척추, 골반, 다리 발육에 영향을 줄 수 있다고 추정되지만, 아직 완전히 증명되지는 않았다. 국제 암 연구 기관은 클로로메테인을 발암성 평가가 불가능한 그룹 3 물질로 분류하고 있다.
클로로메테인은 가연성 및 인화성 기체이다. 1942년 11월 28일 보스턴의 나이트클럽 Cocoanut Grove에서 발생한 대화재(영어판)는 냉장고 냉매로 사용되던 클로로메탄 누출 및 인화가 원인으로 1997년 결론 내려졌다.
참조
[1]
서적
Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013
The Royal Society of Chemistry
2014
[2]
간행물
[3]
간행물
[4]
간행물
Methyl chloride
[5]
서적
Naturally Occurring Organohalogen Compounds
Springer Nature
[6]
논문
Production of Methyl Chloride and Methyl Bromide in Laboratory Cultures of Marine Phytoplankton
[7]
논문
Production of Methyl Bromide and Methyl Chloride in Laboratory Cultures of Marine Phytoplankton II
[8]
논문
Marine Macroalgae in Polar Regions as Natural Sources for Volatile Organohalogens
[9]
논문
cDNA Cloning of ''Batis maritima'' Methyl Chloride Transferase and Purification of the Enzyme
[10]
논문
Expression of ''Batis maritima'' Methyl Chloride Transferase in ''Escherichia coli''
[11]
논문
Global chlorine emissions from biomass burning: Reactive Chlorine Emissions Inventory
[12]
웹사이트
ALMA and Rosetta Detect Freon-40 in Space
https://www.eso.org/[...]
[13]
웹사이트
ALMA and Rosetta Detect Freon-40 in Space - Dashing Hopes that Molecule May be Marker of Life
https://www.eso.org/[...]
2017-10-03
[14]
서적
Annales de chimie et de physique
https://books.google[...]
Chez Crochard
1835
[15]
웹사이트
Chloromethane
https://www.acs.org/[...]
2022-05-13
[16]
간행물
Chlorinated Hydrocarbons
[17]
논문
Global stratospheric distribution of halocarbons
1996
[18]
논문
Methyl Chloride and Methyl Bromide Production and Consumption in Coastal Antarctic Tundra Soils Subject to Sea Animal Activities
2020
[19]
논문
Update on ODSs and Other Gases of Interest to the Montreal Protocol
https://www.esrl.noa[...]
2014
[20]
서적
Handbook of chemical property estimation methods
https://archive.org/[...]
McGraw-Hill
1982
[21]
서적
Toxicological profile for chloromethane
https://www.ncbi.nlm[...]
Agency for Toxic Substances and Disease Registry (US)
1990
[22]
논문
Long term trend of selected halogenated hydrocarbons
https://ntrs.nasa.go[...]
NASA
1994
[23]
논문
The tropospheric budgets of the anthropogenic chlorocarbons CO, CH4, CH3Cl and the effect of various NOx sources on tropospheric ozone
1983
[24]
간행물
Consumers Union Reports
https://archive.org/[...]
Consumer Reports
1936-07
[25]
뉴스
地球外生命の指標として不適格か、赤ちゃん星にもクロロメタンが存在
https://www.astroart[...]
アストロアーツ
2017-10-11
[26]
뉴스
冷房食堂車が試運転
大阪毎日新聞
1936-08-16
[27]
서적
Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013
The Royal Society of Chemistry
2014
[28]
간행물
[29]
간행물
[30]
간행물
Methyl chloride
[31]
간행물
Chlorinated Hydrocarbons
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
