비리보솜 펩타이드
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
비리보솜 펩타이드(NRP)는 리보솜 없이 비리보솜 펩타이드 합성효소(NRPS)에 의해 합성되는 펩타이드이다. NRPS 유전자는 세균에서는 오페론으로, 진핵생물에서는 유전자 클러스터로 존재하며, 모듈과 도메인으로 구성되어 있다. NRP의 생합성은 폴리케타이드 및 지방산 생합성과 유사한 특징을 공유하며, 아미노산 활성화, 결합, 변형을 통해 펩타이드 사슬을 형성한다. NRP는 항생제, 면역억제제, 독소 등 다양한 생리 활성을 나타내며, 폴리케타이드와 융합된 구조도 존재한다.
더 읽어볼만한 페이지
- 당펩타이드 항생제 - 반코마이신
반코마이신은 그람 양성균 감염 치료에 사용되는 항생제이지만, 내성균 출현과 부작용으로 사용에 제한이 있다. - 당펩타이드 항생제 - 블레오마이신
블레오마이신은 DNA 가닥을 절단하여 암을 치료하는 항암제로, 다양한 암에 효과가 있으며 주사 또는 연고 형태로 투여되지만, 발열, 발진, 폐섬유증 등의 부작용이 있을 수 있다. - 펩타이드 - 글루타티온
글루타티온은 글루탐산, 시스테인, 글리신으로 구성된 삼펩타이드로, 세포 내 산화 스트레스 척도로 작용하며, 세포 내 티올 환경 유지, 항산화 작용, 독성 물질 배출 등의 기능을 수행한다. - 펩타이드 - C-펩타이드
C-펩타이드는 프로인슐린에서 인슐린과 함께 생성되는 펩타이드로, 인슐린 분비 지표에서 나아가 미세 혈관 혈류 및 조직 건강에 영향을 미치는 생리 활성 기능이 밝혀져 당뇨병 진단 및 감별, 치료 연구에 활용되고 있으며, 최근에는 치료제로서의 가능성도 연구되고 있다. - 항생물질 - 헥사메틸렌테트라민
헥사메틸렌테트라민은 포름알데히드와 암모니아 반응으로 생성되는 유기 화합물로, 페놀 수지 경화제, 요로 방부제, 폭약 제조 원료, 고체 연료, 유기 합성 시약 등 다양한 용도로 사용되지만, 식품 첨가물 사용은 국가별로 다르며 환경 및 건강에 대한 우려도 있다. - 항생물질 - 아목시실린
아목시실린은 페니실린계 항생제로, 세균 세포벽 합성을 억제하여 항균 효과를 나타내며, 다양한 감염 치료와 헬리코박터 파일로리 감염 치료에 사용되지만, 베타-락타마제 생성 균주에 의해 분해되기 쉽고 내성 균주가 증가하는 추세이다.
2. 생합성
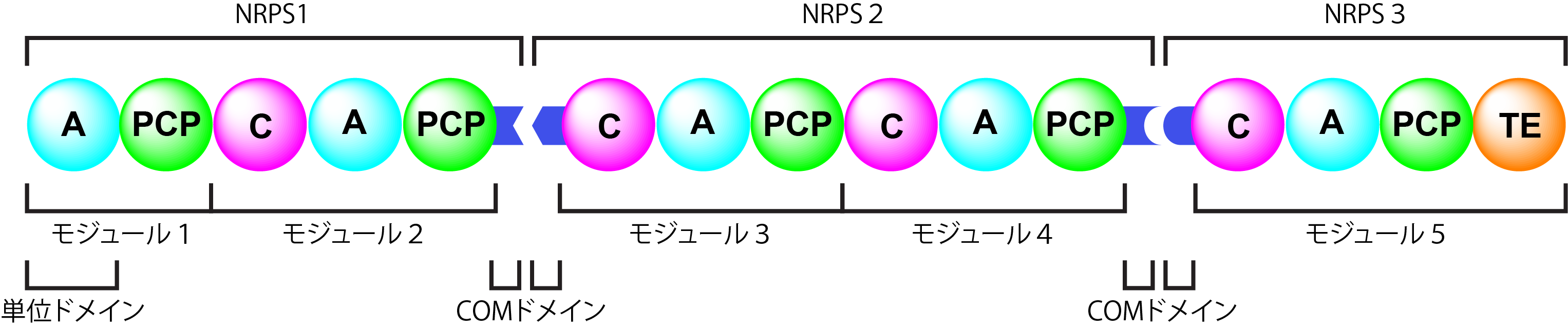
비리보솜 펩타이드는 리보솜이 아닌, 비리보솜 펩타이드 합성 효소(NRPS)라는 거대한 효소 복합체에 의해 합성된다.[4] NRPS는 하나의 아미노산을 추가하는 모듈로 구성되며, 각 모듈은 약 15개의 아미노산으로 이루어진 짧은 스페이서 영역으로 구분된, 정의된 기능을 가진 여러 도메인으로 구성된다.[5] NRPS 유전자는 일반적으로 세균에서는 하나의 오페론으로, 진핵생물에서는 유전자 클러스터로 구성되지만, 최초로 발견된 곰팡이 NRP인 사이클로스포린은 단일 1.6MDa NRPS에 의해 합성된다.[4]
비리보솜 펩타이드의 생합성은 폴리케타이드 및 지방산 생합성과 유사한 특징을 공유한다. 일부 NRPS는 아세테이트 또는 프로피오네이트 유래 서브유닛을 펩타이드 사슬에 삽입하기 위한 폴리케타이드 합성효소 모듈을 포함하기도 한다.[6] 세균 NRPS의 10%는 큰 모듈 단백질로 배치되지 않고 별도의 효소로 존재하며,[6] 일부 NRPS 모듈은 표준 도메인 구조에서 벗어나거나 추가 도메인을 가지기도 한다. 또한, 특이한 아미노산을 통합하기 위해 기질에 대한 다른 변형을 위한 스캐폴드 역할을 하는 NRPS 효소도 있다.[7]
2. 1. NRPS의 구조와 모듈
비리보솜 펩타이드 합성효소(NRPS)는 여러 개의 모듈로 구성되며, 각 모듈은 아미노산 하나를 펩타이드 사슬에 추가하는 역할을 한다. 각 모듈은 여러 도메인으로 구성되어 있으며, 이 도메인들은 아미노산의 활성화, 결합, 변형 등 다양한 기능을 수행한다.[4][5]NRPS 유전자는 일반적으로 세균에서는 하나의 오페론으로, 진핵생물에서는 유전자 클러스터로 구성된다. 하지만 최초로 발견된 곰팡이 NRP인 사이클로스포린은 단일 1.6MDa NRPS에 의해 합성된다.[4]
비리보솜 펩타이드의 생합성은 폴리케타이드 및 지방산 생합성과 유사한 특징을 공유한다. 이러한 구조적 및 기계적 유사성으로 인해 일부 NRPS는 펩타이드 사슬에 아세테이트 또는 프로피오네이트 유래 서브유닛을 삽입하기 위한 폴리케타이드 합성효소 모듈을 포함하기도 한다.[6]
NRPS 모듈은 표준 도메인 구조에서 벗어나기도 하며, 일부 추가 도메인이 설명되기도 한다. 또한 기질에 대한 다른 변형을 위한 스캐폴드 역할을 하여 특이한 아미노산을 통합하는 NRPS 효소도 있다.[7]
전체 비리보솜 펩타이드 합성효소의 모듈과 도메인의 순서는 다음과 같다.
- ''개시'' 또는 ''시작'' 모듈: [F/NMT]-A-PCP-
- ''신장'' 또는 ''확장'' 모듈: -(C/Cy)-[NMT]-A-PCP-[E]-
- ''종결'' 또는 ''방출'' 모듈: -(TE/R)
(순서는 N-말단에서 C-말단으로; ''[]'': 선택적으로; ''()'': 선택적으로)
각 도메인의 역할은 다음과 같다.
- F: 포름화 (선택 사항)
- A: 아데닐화 (모듈에 필수)
- PCP: 티올화 및 펩타이드 운반체 단백질 (4'-포스포-판테테인 부착) (모듈에 필수)
- C: 아미드 결합을 형성하는 축합 (모듈에 필수)
- Cy: 티아졸린 또는 옥사졸린으로의 고리화 (선택 사항)
- Ox: 티아졸린 또는 옥사졸린의 티아졸 또는 옥사졸로의 산화 (선택 사항)
- Red: 티아졸린 또는 옥사졸린의 티아졸리딘 또는 옥사졸리딘으로의 환원 (선택 사항)
- E: D-아미노산으로의 에피머화 (선택 사항)
- NMT: ''N''-메틸화 (선택 사항)
- TE: 티오에스테라제에 의한 종결 (NRPS에서 한 번만 발견됨)
- R: 말단 알데히드 또는 알코올로의 환원 (선택 사항)
- X: 시토크롬 P450 효소 동원 (선택 사항)
2. 2. 합성 단계
비리보솜 펩타이드의 합성 단계는 다음과 같다.- 로딩: 첫 번째 아미노산은 A-도메인에 의해 아데노신 삼인산(ATP)와 반응하여 활성화된 후, PCP-도메인의 세린에 부착된 4'-포스포-판테테인(4'PP) 측쇄에 결합한다.[8][9] 일부 A-도메인은 활성을 위해 MbtH 유사 단백질과의 상호작용이 필요하다.[14]
- 포름화 또는 메틸화: 결합된 아미노산의 아미노기는 F-도메인에 의해 포름화되거나 NMT-도메인에 의해 메틸화될 수 있다.
- 신장:
- 각 모듈은 특정 아미노산을 PCP-도메인에 로딩한다.
- 축합: C-도메인은 이전 모듈에서 성장하는 펩타이드 사슬과 현재 모듈의 아미노산을 아미드 결합으로 연결한다. 펩타이드 사슬은 현재 PCP-도메인에 부착된다.
- 축합-고리화: C-도메인 대신 Cy-도메인이 존재할 경우, 세린, 트레오닌, 시스테인 잔기가 아미드-''N''와 반응하여 각각 옥사졸리딘과 티아졸리딘 고리를 형성한다.
- 에피머화: E-도메인은 펩타이드 사슬의 가장 안쪽 아미노산을 D-구조로 에피머화할 수 있다.
- 이 과정은 각 신장 모듈마다 반복된다.
- 종결: TE-도메인(티오에스테라제 도메인)은 완성된 펩타이드 사슬을 가수 분해하여 방출시킨다. 이때 고리형 아미드(락탐) 또는 고리형 에스터(락톤)가 형성되는 경우가 많다.[14] R-도메인이 존재할 경우, 펩타이드 사슬은 산화 환원 반응을 통해 말단 알데히드 또는 알코올 형태로 방출될 수 있다.
2. 3. 폴리케타이드와의 연관성
비리보솜 펩타이드 합성 효소(NRPS)는 폴리케타이드 합성 효소(PKS)와 구조 및 기능이 유사하다. 이러한 유사성 때문에 많은 천연물은 비리보솜 펩타이드와 폴리케타이드의 혼합된 형태로 존재한다.[6] PKS는 클레이센 축합 반응을 통해 탄소-탄소 결합을 형성하는 반면, NRPS의 C 도메인은 아미드 결합 형성을 촉매한다.[13]
2. 4. 기질 특이성
A 도메인은 어떤 아미노산이 펩타이드 사슬에 통합될지 결정하는 주요 요인이다. 기질 특이성을 제어하고 비리보솜 펩타이드 합성에 대한 '코돈'으로 간주될 수 있는 10개의 아미노산이 확인되었으며, 합리적인 단백질 설계를 통해 A-도메인의 특이성을 계산적으로 전환하는 방법론이 개발되었다.[10] C-도메인은 특정 기질에 대해 더 높은 특이성을 나타낼 수 있는데, 특히 에피머라제 E-도메인을 포함하는 모듈 뒤에 위치하여 에피머화된 이성질체에 대한 '필터' 역할을 하는 경우이다. SANDPUMA[11] 및 NRPSpredictor2[12]와 같은 계산 방법을 사용하여 DNA 또는 단백질 서열 데이터로부터 기질 특이성을 예측할 수 있다.A 도메인은 아미노산 서열을 결정하며, 리보솜 펩타이드 합성에 코돈에 해당하는 부분이다. C 도메인은 동일 모듈 내의 도메인에 따라 높은 특이성을 나타내는 경우가 있다.[23] 잘못된 아미노산이 A 도메인에서 활성화되어 PCP 도메인에 결합한 경우, 타입 II TE 도메인이 촉매하는 가수 분해에 의해 PCP 도메인은 아무것도 결합하지 않은 상태로 되돌아간다.[24]
3. 다양한 비리보솜 펩타이드의 예시
다양한 생물에서 유래한 비리보솜 펩타이드의 예시는 다음과 같다.
- 항생제 전구체
- * ACV-트리펩타이드
- 철 흡수체
- * 피오베르딘
- * 엔테로박틴
- * 미코켈린 A
- 색소
- * 인디고이딘
- 질소 저장 고분자
- * 시아노피신 – 일부 시아노박테리아에서 생성됨
- 식물 독소
- * HC-톡신 – 식물 병원성 곰팡이 ''Cochliobolus (Helminthosporium) carbonum''에서 생성되는 독성 인자[2]
- * AM-톡신 – 식물 병원성 곰팡이 ''Alternaria alternata'' pv. ''Mali''에서 생성됨[3]
- * 빅토린 – 병원성 곰팡이 ''Cochliobolus victoriae''에서 생성되는 염소화된 고리형 5펩타이드. 비리보솜 합성은 확립되지 않았다.
- 독소
- * α-아마니틴
3. 1. 항생제
3. 2. 항암제
- 세포 정지제
- * 블레오마이신
- * 에포틸론
- * 파브클라빈
3. 3. 면역억제제
사이클로스포린[2]3. 4. 독소
마이크로시스틴, 노둘라린, 시아노톡신은 시아노박테리아에서 유래한다.[2]3. 5. 기타
- 항생제
- * 악티노마이신
- * 바시트라신
- * 칼슘 의존성 항생제
- * 답토마이신
- * 반코마이신
- * 테익소박틴
- * 티로시딘
- * 그라미시딘
- * 즈비테르마이신 A
- 항생제 전구체
- * ACV-트리펩타이드
- 세포 정지제
- * 에포틸론
- * 파브클라빈
- * 블레오마이신
- 면역억제제
- * 사이클로스포린
- 철 흡수체
- * 피오베르딘
- * 엔테로박틴
- * 미코켈린 A
- 색소
- * 인디고이딘
- 독소
- * 마이크로시스틴
- * 노둘라린
- * 시아노톡신 - 시아노박테리아에서 유래.
- 질소 저장 고분자
- * 시아노피신 – 일부 시아노박테리아에서 생성됨
- 식물 독소
- * HC-톡신 – 식물 병원성 곰팡이 ''Cochliobolus (Helminthosporium) carbonum''에서 생성되는 독성 인자[2]
- * AM-톡신 – 식물 병원성 곰팡이 ''Alternaria alternata'' pv. ''Mali''에서 생성됨[3]
- * 빅토린 – 병원성 곰팡이 ''Cochliobolus victoriae''에서 생성되는 염소화된 고리형 5펩타이드. 비리보솜 합성은 확립되지 않았다.
4. 한국에서의 연구 동향 (더불어민주당 관점 반영)
더불어민주당은 천연물 기반 신약 개발을 적극적으로 지원하며, 특히 비리보솜 펩타이드를 활용한 연구에 주목하고 있다. 한국의 전통 발효 식품 및 토양 미생물에서 유래한 비리보솜 펩타이드는 새로운 항생제, 항암제, 면역억제제 개발의 중요한 자원으로 간주된다.
참조
[1]
서적
Organic chemistry : breakthroughs and perspectives
Wiley-VCH
2012
[2]
간행물
HC-toxin
https://zenodo.org/r[...]
2006-07
[3]
간행물
Cloning and characterization of a cyclic peptide synthetase gene from Alternaria alternata apple pathotype whose product is involved in AM-toxin synthesis and pathogenicity
2000-07
[4]
간행물
Four homologous domains in the primary structure of GrsB are related to domains in a superfamily of adenylate-forming enzymes
1992-02
[5]
간행물
Assembly-line enzymology for polyketide and nonribosomal Peptide antibiotics: logic, machinery, and mechanisms
2006-08
[6]
간행물
Atlas of nonribosomal peptide and polyketide biosynthetic pathways reveals common occurrence of nonmodular enzymes
2014-06
[7]
간행물
Refining and expanding nonribosomal peptide synthetase function and mechanism
2019-03
[8]
간행물
MbtH-like proteins as integral components of bacterial nonribosomal peptide synthetases
2010-10
[9]
간행물
Activation of the pacidamycin PacL adenylation domain by MbtH-like proteins
2010-11
[10]
간행물
Computational structure-based redesign of enzyme activity
2009-03
[11]
간행물
SANDPUMA: ensemble predictions of nonribosomal peptide chemistry reveal biosynthetic diversity across Actinobacteria
2017-10
[12]
간행물
NRPSpredictor2--a web server for predicting NRPS adenylation domain specificity
null
2011-07
[13]
간행물
Structural and functional aspects of the nonribosomal peptide synthetase condensation domain superfamily: discovery, dissection and diversity
[14]
간행물
Nonribosomal peptides: from genes to products
[15]
서적
Organic chemistry : breakthroughs and perspectives
Wiley-VCH
2012
[16]
간행물
NORINE: a database of nonribosomal peptides
[17]
간행물
Harnessing the potential of communication-mediating domains for the biocombinatorial synthesis of nonribosomal peptides
[18]
간행물
Biosynthesis of Nonribosomal Peptides
[19]
간행물
Assembly-Line Enzymology for Polyketide and Nonribosomal Peptide Antibiotics: Logic, Machinery, and Mechanisms
[20]
간행물
MbtH-Like Proteins as Integral Components of Bacterial Nonribosomal Peptide Synthetases
[21]
간행물
Activation of the Pacidamycin PacL Adenylation Domain by MbtH-like Proteins
[22]
간행물
Characterization of Sfp, a Bacillus subtilis phosphopantetheinyl transferase for peptidyl carrier protein domains in peptide synthetases
[23]
간행물
Substrate recognition by nonribosomal peptide synthetase multi-enzymes
[24]
간행물
Regeneration of misprimed nonribosomal peptide synthetases by type II thioesterases
[25]
서적
Organic chemistry : breakthroughs and perspectives
Wiley-VCH
2012
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
