수소-칼륨 ATP가수분해효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
수소-칼륨 ATP가수분해효소는 위에서 양성자 펌프 역할을 수행하는 효소로, 위 내강의 칼륨 이온을 세포질의 하이드로늄 이온과 교환하며 위 내용물을 산성으로 만들어 소화효소인 펩신을 활성화시킨다. 이 효소는 주로 위 벽세포에서 발견되며, 두 개의 유전자(ATP4A, ATP4B)에 의해 암호화되는 이종이량체 단백질이다. H+/K+ ATP가수분해효소는 P형 ATP가수분해효소의 일종으로, ATP를 가수분해하여 이온을 농도 차이에 역행하여 운반한다. 이 효소는 위산 관련 질환 치료에 사용되며, 억제제로는 H2 수용체 길항제, 프로톤 펌프 억제제(PPI), 칼륨 경쟁적 산 차단제(PCAB) 등이 있다. 억제는 무산증으로 인한 철분 흡수 문제, 빈혈, 치매 등의 부작용을 일으킬 수 있다.
더 읽어볼만한 페이지
- 수소생물학 - 유기영양생물
유기영양생물은 1946년 앙드레 르보프와 동료들이 처음 제안한 용어이다. - 인간 13번 염색체상 유전자 - GJA3
GJA3는 밀착연접 단백질 1과 상호작용하여 세포 간 연결 및 신호 전달에 관여하는 단백질이다. - 인간 13번 염색체상 유전자 - KLF12
KLF12는 이 문서의 주제이나, 구체적인 정보는 제공되지 않는다. - EC 3.6.3 - 나트륨-칼륨 펌프
나트륨-칼륨 펌프는 ATP 에너지를 사용하여 나트륨 이온과 칼륨 이온을 세포 내외로 능동 수송하는 막 단백질로, 세포의 휴지 전위 유지, 물질 수송, 세포 부피 조절 등 생리적 기능 수행 및 세포 활동 조절에 중요한 역할을 한다. - EC 3.6.3 - ATP가수분해효소
ATP가수분해효소는 아데노신 삼인산을 아데노신 이인산과 무기 인산으로 분해하여 에너지를 방출하고, 이 에너지는 근수축, 세포 내 물질 수송, 이온 농도 기울기 생성과 같은 생체 내 작용에 사용되며, 워커 모티프를 특징으로 하는 ATP 합성 효소, P형 ATP가수분해효소, ABC ATP가수분해효소 등이 있다.
2. 생물학적 기능
H+/K+ ATP가수분해효소는 위의 양성자 펌프로, 위 내강의 칼륨 이온을 세포질의 하이드로늄 이온과 교환한다.[2] 이 효소는 위 내용물을 산성으로 만들어 소화 효소인 펩신을 활성화하는 주된 역할을 한다.[3]
2. 1. 위에서의 역할
H+/K+ ATP가수분해효소는 위에서 양성자 펌프의 역할을 하는데, 위 내강의 칼륨 이온을 세포질의 하이드로늄 이온과 교환한다.[31] 또한 위 내용물을 산성으로 만들어 소화효소인 펩신을 활성화시키는 데에 주된 역할을 맡는다.[32]H+/K+ ATP가수분해효소는 주로 벽세포에서 발견된다. 벽세포는 위의 점막에 위치한 고도로 특수화된 상피세포이다. 벽세포는 광범위한 분비막 시스템을 가지고 있으며 H+/K+ ATP가수분해효소는 벽세포 막을 구성하는 주된 분비 단백질이다. 콩팥속질에서도 약간의 H+/K+ ATP가수분해효소가 발현된다.[30]
2. 2. 콩팥에서의 발현
소량의 H+/K+ ATP가수분해효소가 신장 수질에서도 발견된다.[30]3. 유전자와 단백질 구조
H+/K+ ATP가수분해효소는 ATP4A와 ATP4B 두 유전자로부터 생성되는 α, β 소단위체로 구성된 이종이량체 단백질이다.[33][36] α 소단위체는 ATP4A 유전자[33]에 의해 암호화되며, β 소단위체는 ATP4B 유전자[36]에 의해 암호화된다.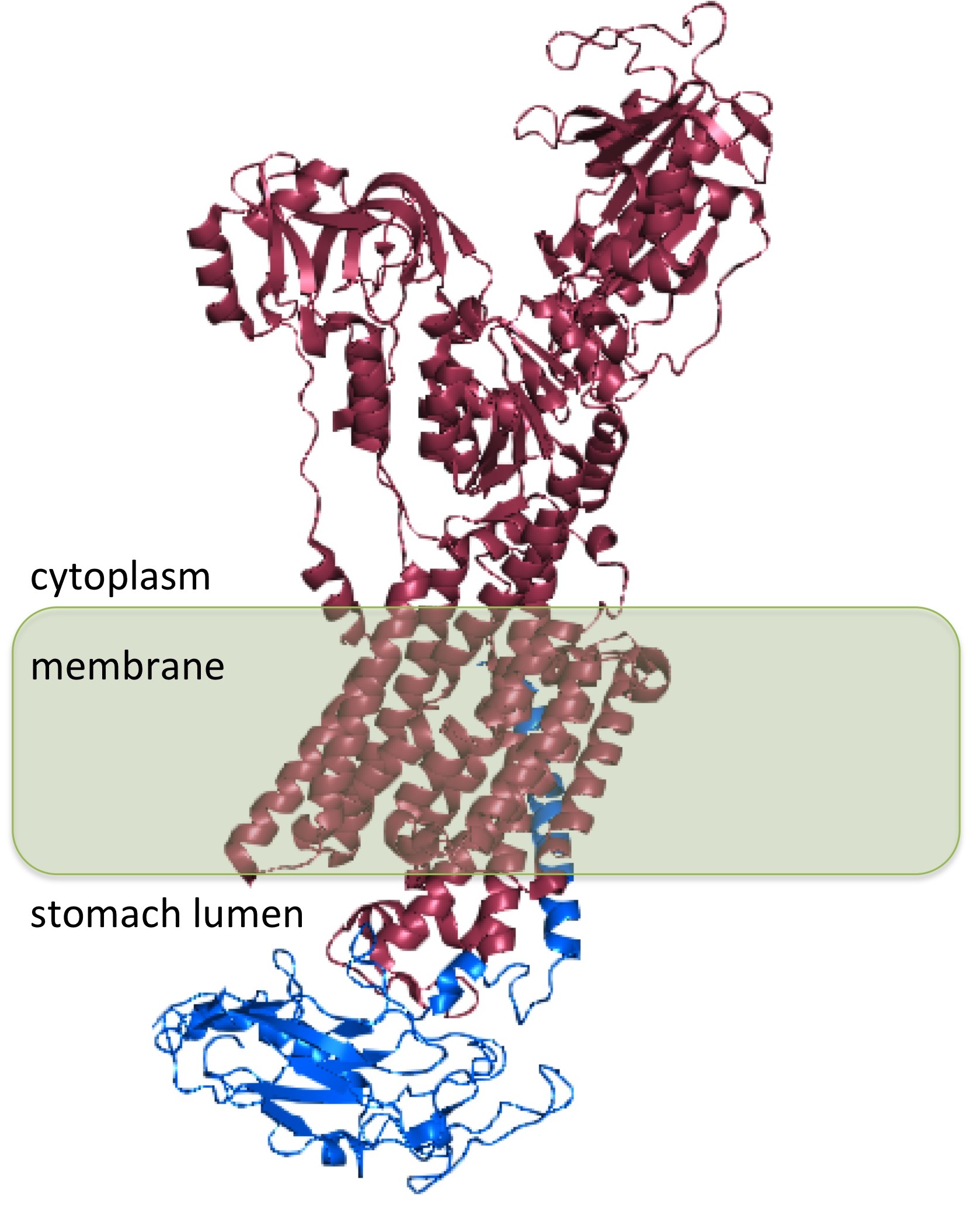
3. 1. α 소단위체
H+/K+ ATP가수분해효소 α 소단위체는 ''ATP4A'' 유전자[33]에 의해 암호화되는 단백질이다. α 소단위체는 약 1000개의 아미노산으로 구성되어 있으며, 효소의 활성 부위를 포함하고 있다. 또한 세포막에 구멍을 형성하여 이온이 수송될 수 있도록 한다. 하이드로늄 이온(H3O+)은 α 소단위체에 존재하는 두 개의 활성 부위에 결합한다.[34] α 소단위체는 인산화 부위(Asp385)를 가지고 있다.[35]3. 2. β 소단위체
H+/K+ ATP가수분해효소의 β 소단위체는 ''ATP4B'' 유전자[36]에 의해 암호화된다. β 소단위체는 대략 300개의 아미노산으로 구성되어 있으며, 36개 아미노산으로 구성된 N-말단 세포질 도메인, 하나의 막관통 도메인, 그리고 고도로 글리코실화되어 있는 세포외 도메인을 포함하고 있다.H+/K+ ATP가수분해효소의 β 소단위체는 α 소단위체를 안정화시키고 효소 기능에 필수적이다. β 소단위체는 수소-칼륨 펌프가 거꾸로 작동하는 것을 막으며,[37] 이종이량체 단백질이 세포 안에서 세포막으로 이동하도록 하는 신호를 포함하고 있다. 이러한 신호 중 일부는 α 소단위체에서 발견되는 신호에 종속적이다.
H+/K+ ATP가수분해효소의 구조는 사람, 개, 돼지, 쥐, 토끼에서 완전히 밝혀져 있으며 모든 종에서 98%의 상동성을 보인다.[30]
3. 3. 종간 상동성
H+/K+ ATP가수분해효소의 구조는 사람, 개, 돼지, 쥐, 토끼에서 완전히 밝혀졌으며, 모든 종에서 98%의 상동성을 보인다.[30]4. 효소 기전과 활성
H+/K+ ATP가수분해효소는 P형 ATP가수분해효소 중 진핵생물 클래스인 P2형 ATP가수분해효소의 일종이다.[38] Ca2+이나 Na+/K+ ATP가수분해효소처럼 α, β 기본단위체로 기능하며,[39] 다른 진핵생물 ATP가수분해효소와 달리 전기적으로 중성이다.[38]
4. 1. 작동 원리
H+/K+ ATP가수분해효소는 P형 ATP가수분해효소 중 진핵생물 클래스인 P2형 ATP가수분해효소의 일종이다.[38] 다른 진핵생물 ATP가수분해효소와 달리, H+/K+ ATP가수분해효소는 하나의 양성자를 위 내강으로 이동시키고 하나의 칼륨 이온을 위 내강으로부터 내보내므로 전기 중립(electroneutral)이다.[38] ATP를 가수분해시켜 얻은 에너지로 이온을 농도 차이에 역행하여 운반하는 이온 펌프이다. 다른 P형 ATP가수분해효소처럼 ATP의 인산기가 수송 과정 중 H+/K+ ATP가수분해효소로 전달되며, 이 인산기는 효소의 형태 변화를 일으켜 이온 수송을 돕는다.H+/K+ ATP가수분해효소는 장크롬친화성유사세포(ECL 세포)에서 히스타민을 방출하게 만드는 가스트린에 의해 간접적으로 활성화된다.[40] 히스타민은 벽세포의 H2 수용체에 결합하여 cAMP 의존성 경로를 활성화시키고, 이는 효소가 세포질에서 자극된 벽세포 막의 소관(canaliculi)으로 이동하도록 한다.[30] H+/K+ ATP가수분해효소는 일단 위치를 이동한 후에는 E1과 E2 형태를 오가면서 이온을 막 너머로 수송한다.
E1 형태는 ATP의 인산기와 세포질 쪽의 하이드로늄 이온을 결합한다. 이후 효소는 E2 형태로 바뀌어 하이드로늄 이온을 내강으로 방출한다. E2 형태는 칼륨을 결합하고, 인산염과 K+를 세포질로 방출하기 위해 E1 형태로 되돌아가며, 다른 ATP가 가수분해되어 주기를 반복한다.[2] β 소단위체는 E2-P 형태가 E1-P 형태로 되돌아가는 것을 막아 양성자 펌핑을 단방향으로 만든다.[8] ATP당 수송되는 이온의 수는 위장의 pH에 따라 2H+/2K+에서 1H+/1K+까지 다양하다.[12]
4. 2. 활성화 과정
장크롬친화성유사세포(ECL 세포)가 히스타민을 방출하게 만드는 가스트린에 의해 H+/K+ ATP가수분해효소는 간접적으로 활성화된다.[40] 히스타민은 벽세포의 H2 수용체에 결합하여 cAMP 의존성 경로를 활성화시킨다. cAMP 의존성 경로는 효소가 세포질에서 자극된 벽세포 막의 소관(canaliculi)으로 이동하도록 한다.[30] H+/K+ ATP가수분해효소는 E1과 E2 형태를 오가면서 이온을 막 너머로 수송한다.E1 형태는 ATP에서 인산기와 세포질 쪽의 하이드로늄 이온을 결합한다. 그런 다음 효소는 E2 형태로 바뀌어 하이드로늄이 내강으로 방출되게 한다. E2 형태는 칼륨을 결합하고, 인산염과 K+를 세포질로 방출하기 위해 E1 형태로 되돌아가, 다른 ATP가 가수분해되어 주기를 반복할 수 있다.[2] β 소단위체는 E2-P 형태가 E1-P 형태로 되돌아가는 것을 방지하여 양성자 펌핑을 단방향으로 만든다.[8] ATP당 수송되는 이온의 수는 위장의 pH에 따라 2H+/2K+에서 1H+/1K+까지 다양하다.[12]
5. 임상적 관련성
H+/K+ ATPase는 위산 관련 질환 치료제의 중요한 표적이 된다. 프로톤 펌프 억제제(PPI)와 치매의 연관성이 독일에서 보고되었으며,[19] 아스테미졸 및 란소프라졸과 같은 벤즈이미다졸 유도체가 타우 단백질의 이상 응집체(신경섬유 매듭)와 상호 작용하는 방식에 대한 연구도 발표되었다.[20][21] 뇌의 나트륨-칼륨 펌프에 대한 비선택적 차단이 세포의 삼투압 불균형이나 부종을 유발한다는 가설이 있다.
PPI와 디곡신, 와파린 등 나트륨-칼륨 펌프에 영향을 미치는 다른 약물과의 상호작용은 잘 알려져 있다.[22] 기억력은 별아교세포와 수소/나트륨-칼륨 펌프에서 발견되는 아데노신 수용체의 알파3 서브유닛과 관련이 있으며, 이는 치매의 초점이 될 수 있다.[23][24][25] PPI를 장기간 사용하면 알파3 서브유닛이 하향 조절되어 별아교세포 손상이 증가할 수 있다.[26] TCIRG1 유전자를 통한 골연화증은 노년기 치매와 강한 연관성을 보인다.[27][28]
5. 1. 위산 관련 질환 치료
위 식도 역류병(GERD)이나 소화성 궤양 치료에 H+/K+ ATP가수분해효소 억제제를 사용하여 위의 산도를 낮출 수 있다.[41] 이는 증상 완화에는 효과적이지만, 아래식도조임근의 비정상적 이완(GERD의 근본 원인)이나 위나선균(헬리코박터 파일로리) 감염, 비스테로이드 항염증제(NSAIDs) 사용(소화성 궤양의 흔한 원인)과 같은 근본적인 원인을 해결하지는 못한다.[42]H+/K+ ATP가수분해효소를 억제하기 위해 사용되는 약물에는 세 가지 계열이 있다. H2 수용체 길항제는 시메티딘과 같이 ATPase 활성화를 유발하는 신호 전달 경로를 억제한다. 이 억제제는 궤양 치료에 효과적이지만 궤양 형성을 막지는 못하며, 약 1주일 후 내성이 생겨 효과가 50% 감소한다.[15] 프로톤 펌 억제제(PPI)는 활성 펌프에 공유 결합하여 수소-칼륨 ATPase를 억제하는 산 활성화 전구 약물이다.[16] 오메프라졸은 현재 사용되는 PPI 중 하나이며, 반감기는 약 90분이다.[17] 산 펌프 길항제(APA) 또는 칼륨 경쟁적 산 차단제(PCAB)는 K+ 활성 부위에 결합하여 산 분비를 차단하는 억제제이다.[15] APA는 산 활성화가 필요 없으므로 PPI보다 빠르게 억제 효과를 나타낸다. 레바프라잔은 동아시아에서 임상적으로 사용된 최초의 APA이며, 다른 APA들도 개발 중이다.[17]
프로톤 펌프 비활성화는 건강 문제를 일으킬 수 있다. 쥐 연구에서 펌프 α-서브유닛 돌연변이는 무산증을 유발하여 철분 흡수 문제를 일으키고 철분 결핍 및 빈혈을 유발했다.[18] H+/K+ ATPase는 철분 흡수를 돕는 것으로 생각되지만, PPI 사용이 빈혈 위험 증가와 관련이 없으므로 필수적인 것은 아니다.[18]
5. 2. 억제제의 종류
H+/K+ ATP가수분해효소를 억제하는 데에는 세 가지 종류의 약물이 사용된다.[15]- H2 수용체 길항제: 시메티딘과 같이 ATPase 활성화를 유발하는 신호 전달 경로를 억제한다. 궤양 치료에는 효과적이지만 궤양 형성을 방지하지는 못하며, 약 1주일 후 환자에게 내성이 생겨 효능이 50% 감소한다.[15]
- 프로톤 펌프 억제제(PPI): 1975년 티모프라졸을 시작으로 개발되었다.[15] 활성 펌프에 공유 결합하여 수소-칼륨 ATPase를 억제하는 산 활성화 전구 약물이다.[16] 오메프라졸은 대표적인 PPI로 반감기가 약 90분으로 짧다.[17]
- 산 펌프 길항제(APA) 또는 칼륨 경쟁적 산 차단제(PCAB): K+ 활성 부위에 결합하여 산 분비를 차단하는 억제제이다.[15] 산 활성화를 필요로 하지 않기 때문에 PPI보다 더 빠른 억제를 제공한다. 레바프라잔은 동아시아에서 임상적으로 사용된 최초의 APA였으며, 임상 시험에서 더 나은 산 조절을 제공하는 것으로 나타나 다른 APA들이 개발되고 있다.[17]
5. 3. 부작용 및 기타 관련 질환
H+/K+ ATP가수분해효소 비활성화는 쥐 연구에서 무산증을 유발하여 철분 흡수 문제를 일으키고, 철 결핍 및 빈혈을 유발하는 것으로 나타났다.[18] 그러나 프로톤 펌프 억제제(PPI) 사용은 빈혈 위험 증가와 관련이 없으므로, H+/K+ ATP가수분해효소가 철분 흡수를 돕지만 반드시 필요한 것은 아니다.[18]최근 독일에서 PPI와 치매의 연관성이 보고되었으며,[19] 아스테미졸 및 란소프라졸과 같은 벤즈이미다졸 유도체가 타우 단백질의 이상 응집체(신경섬유 매듭)와 상호 작용하는 방식에 대한 연구도 발표되었다.[20][21] 현재 제기되는 가설로는 뇌의 나트륨-칼륨 펌프에 대한 비선택적 차단으로 인한 세포의 삼투압 불균형, 부종 발생 등이 있다.
PPI와 디곡신, 와파린 등 나트륨-칼륨 펌프에 영향을 미치는 다른 약물과의 상호작용은 잘 알려져 있다.[22] 기억력은 별아교세포와 수소/나트륨-칼륨 펌프에서 발견되는 아데노신 수용체의 알파3 서브유닛과 관련이 있는데, 이는 치매의 초점이 될 수 있다.[23][24][25] PPI를 장기간 사용하면 알파3 서브유닛이 하향 조절되어 별아교세포 손상이 증가할 수 있다.[26] TCIRG1 유전자를 통한 골연화증은 노년기 치매와 강한 연관성을 보인다.[27][28]
참조
[1]
서적
The Alkali Metal Ions: Their Role in Life
Springer
2016
[2]
논문
The gastric HK-ATPase: structure, function and inhibition.
2009
[3]
서적
Biochemistry
W.H. Freeman and Company
[4]
문서
ATP4A ATPase H+/K+ transporting alpha subunit
https://www.ncbi.nlm[...]
[5]
논문
Proton binding sites and conformational analysis of H+K+-ATPase
2005
[6]
논문
Conformational changes in gastric H+/K+-ATPase monitored by difference Fourier-transform infrared spectroscopy and hydrogen/deuterium exchange
2004
[7]
문서
ATP4B ATPase H+/K+ transporting beta subunit
https://www.ncbi.nlm[...]
[8]
논문
Inter-subunit interaction of gastric H+,K+-ATPase prevents reverse reaction of the transport cycle
2009
[9]
논문
Ion Motive ATPases: P-type ATPases
2009
[10]
논문
Active Detergent-solubilized H+,K+-ATPase Is a Monomer
2012
[11]
논문
Acid secretion and the H,K ATPase of stomach
1992
[12]
논문
Cryo-EM structure of gastric H+,K+-ATPase with a single occupied cation-binding site
2012
[13]
논문
Molecular mechanisms in therapy of acid-related diseases
2008
[14]
논문
The ulcer sleuths: The search for the cause of peptic ulcers
2011
[15]
논문
The Gastric H,K ATPase as a Drug Target: Past, Present and Future
2007
[16]
논문
Pharmacology of Proton Pump Inhibitors
[17]
논문
Long lasting inhibitors of the gastric H,K-ATPase
2009
[18]
논문
Mutation of the gastric hydrogen-potassium ATPase alpha subunit causes iron-deficiency anemia in mice
2011
[19]
논문
Association of Proton Pump Inhibitors With Risk of Dementia: A Pharmacoepidemiological Claims Data Analysis
http://archneur.jama[...]
[20]
논문
Selective interaction of lansoprazole and astemizole with tau polymers: potential new clinical use in diagnosis of Alzheimer's disease
[21]
논문
High affinity radiopharmaceuticals based upon lansoprazole for PET imaging of aggregated tau in Alzheimer's disease and progressive supranuclear palsy: synthesis, preclinical evaluation, and lead selection
[22]
논문
Interaction risk with proton pump inhibitors in general practice: significant disagreement between different drug-related information sources
[23]
논문
Adenosine A1 and A3 receptors protect astrocytes from hypoxic damage
[24]
논문
Glial ephrin-A3 regulates hippocampal dendritic spine morphology and glutamate transport
[25]
논문
Elusive roles for reactive astrocytes in neurodegenerative diseases
[26]
논문
A(1) and A(3) adenosine receptors inhibit LPS-induced hypoxia-inducible factor-1 accumulation in murine astrocytes
[27]
웹사이트
TCIRG1
http://ghr.nlm.nih.g[...]
[28]
논문
Osteopetrosis and thalamic hypomyelinosis with synaptic degeneration in DAP12-deficient mice
[29]
서적
The Alkali Metal Ions: Their Role in Life
Springer
2016
[30]
논문
The gastric HK-ATPase: structure, function and inhibition.
2009
[31]
논문
The gastric HK-ATPase: structure, function and inhibition.
2009
[32]
서적
Biochemistry
https://archive.org/[...]
W.H. Freeman and Company
[33]
문서
ATP4A ATPase H+/K+ transporting alpha subunit
https://www.ncbi.nlm[...]
[34]
논문
Proton binding sites and conformational analysis of H+K+-ATPase
2005
[35]
논문
Conformational changes in gastric H+/K+-ATPase monitored by difference Fourier-transform infrared spectroscopy and hydrogen/deuterium exchange
2004
[36]
웹사이트
ATP4B ATPase H+/K+ transporting beta subunit
https://www.ncbi.nlm[...]
[37]
논문
Inter-subunit interaction of gastric H+,K+-ATPase prevents reverse reaction of the transport cycle
2009
[38]
논문
Ion Motive ATPases: P-type ATPases
2009
[39]
논문
Active Detergent-solubilized H+,K+-ATPase Is a Monomer
2012
[40]
논문
Acid secretion and the H,K ATPase of stomach
1992
[41]
논문
Molecular mechanisms in therapy of acid-related diseases
https://archive.org/[...]
2008
[42]
논문
The ulcer sleuths: The search for the cause of peptic ulcers
2011
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

