탄소 고정
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
탄소 고정은 대기 중 이산화 탄소를 탄수화물로 변환하는 생물학적 과정으로, 광합성의 캘빈 회로를 중심으로 이루어진다. 6가지 자가영양 탄소 고정 경로가 알려져 있으며, 캘빈 회로가 가장 널리 사용된다. 캘빈 회로는 식물, 조류, 시아노박테리아 등에서 발견되며, 역 크렙스 회로, 환원성 아세틸-CoA 경로 등 다른 경로들은 세균이나 고세균에서 발견된다. 탄소 고정은 광합성 생물과 화학 합성 생물에 의해 수행되며, 연간 2,500억 톤의 이산화 탄소가 광합성을 통해 전환된다. 토양 미생물은 유기물을 분해하고 탄소를 격리하여 토양 비옥도와 탄소 격리에 기여한다. 탄소 고정은 기후 변화 완화와 지속 가능한 토지 관리에 중요한 역할을 한다.
탄소 고정 메커니즘은 원시적인 조류에서부터 가장 발달한 속씨식물에 이르기까지 광합성의 탄소 환원 회로, 즉 캘빈 회로를 중심으로 이루어진다. 캘빈 회로에서는 대기 중의 이산화 탄소(CO2)를 탄수화물로 환원시키는데, 이 과정에서 명반응을 통해 생성된 ATP와 NADPH가 사용된다.[8]
2. 탄소 고정의 메커니즘
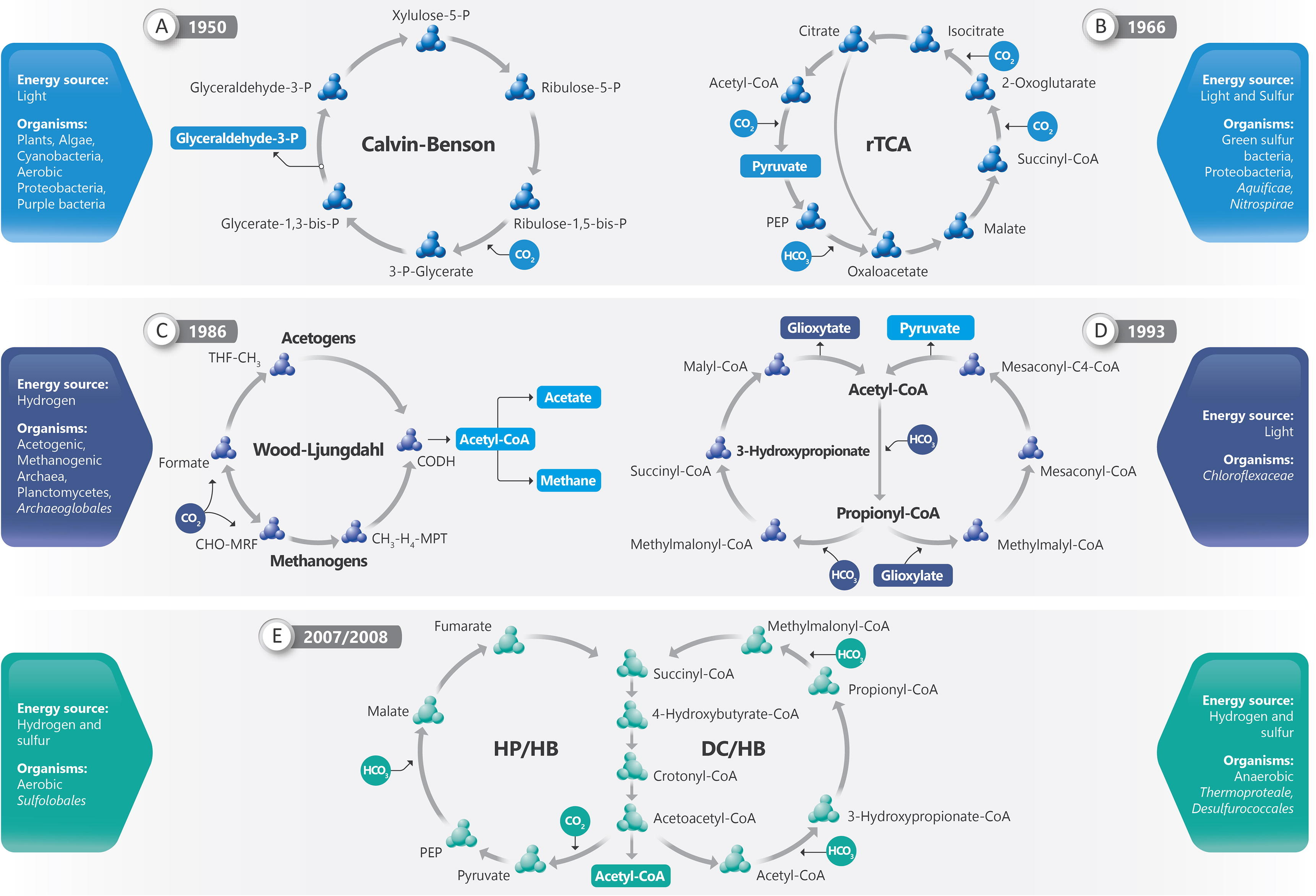
현재까지 6가지의 자가영양 탄소 고정 경로가 알려져 있다.[8] 이들은 캘빈 회로, 역 크렙스 회로 (환원적 시트르산 회로), 환원성 아세틸-CoA 경로 (우드-륀달 경로), 3-하이드록시프로피오네이트(3-HP) 회로, 3-HP/4-HB 회로, DC/4-HB 회로이다.
캘빈 회로는 식물, 조류, 시아노박테리아뿐만 아니라 자주색 세균과 같은 Pseudomonadota에서도 발견된다.[3] 역 크렙스 회로와 3-하이드록시프로피오네이트 사이클은 세균에서만, 3-하이드록시프로피오네이트 사이클의 두 가지 변형은 고세균에서만, 환원성 아세틸 CoA 경로는 세균과 고세균 모두에서 발견된다. 황 및 수소 산화 세균은 칼빈 회로 또는 환원성 시트르산 회로를 사용한다.[10]
2. 1. 캘빈 회로 (환원적 펜토스 인산 회로)
캘빈 회로는 원시적 조류에서 가장 발달한 속씨식물까지 광합성의 탄소 환원 회로를 중심으로 이루어진다. 캘빈 회로에서는 대기 중에서 얻은 CO2(산화수 +4)를 탄수화물(산화수 0)로 환원시킨다. 이 과정에서 명반응에서 만들어진 아데노신 삼인산(ATP)와 니코틴아마이드 아데닌 디뉴클레오타이드 인산(NADPH)이 사용된다.[8]
캘빈 회로는 이산화 탄소를 글리세르알데히드 3-인산(GAP)과 다이하이드록시아세톤 인산(DHAP)과 같은 트리오스 인산(TP)이라는 당으로 전환한다.[11] 반응식은 다음과 같다.
:3 CO2 + 6 NADPH + 6 H+ + 9 ATP + 5 H2O → TP + 6 NADP+ + 9 ADP + 8 Pi
(여기서 Pi는 무기 인산염(HOPO32− + 2H+)을, 트리오스와 TP는 각각 C2H3O2-CH2OH 및 C2H3O2-CH2OPO32− + 2H+를 나타낸다.)
캘빈 회로는 생물학적 탄소 고정의 90%를 차지하며, 식물의 캘빈 회로는 육상에서, 조류와 시아노박테리아의 캘빈 회로는 해양에서 탄소 고정의 우위를 차지한다. 캘빈 회로는 식물과 조류의 엽록체와 시아노박테리아에서 탄소를 고정하며, Pseudomonadota의 일종인 자주색 세균에서 무산소 광합성과 일부 비광합성 Pseudomonadota에서도 탄소를 고정한다.[9]
대부분의 광합성 생물은 캘빈 회로를 이용하며, 이는 오늘날 지구 환경에서 가장 널리 분포하는 탄소 고정 회로이다. 광합성은 빛 에너지에 의해 일어나는 광화학 반응(명반응)과 탄소 고정(암반응)으로 구성된다. 모든 진핵생물 및 많은 광합성 세균에서는 환원적 펜토스 인산 회로가 암반응을 담당한다. 명반응 과정에서 발생하는 ATP와 NADPH를 이용하여 암반응에서는 이산화 탄소(CO2)가 글루코스 등 유기 화합물로 변환된다.
CO2는 리불로스-1,5-비스인산 카르복실라제/옥시게나제(RubisCO)에 의해 리불로스-1,5-비스인산(RuBP)과 결합하여 3-포스포글리세르산(G3P)으로 변환됨으로써 생체에 흡수된다. 환원적 펜토스 인산 회로는 RuBP의 재생을 수반하는 순환 회로를 형성한다. C4 광합성 및 CAM 광합성을 하는 식물은 CO2를 탄산 이온(HCO3-)으로 효소적으로 변환한 후 옥살아세트산 형태로 흡수하는 기구를 갖는다. 이 기구는 생체 내 CO2 농도를 높여 환원적 펜토스 인산 회로에 의한 탄소 고정 효율을 높인다. 환원적 펜토스 인산 회로는 고세균에서는 발견되지 않았으며, 현재 이 회로의 기원은 시아노박테리아에 있다고 생각된다.[40]
산소 발생형 광합성에서는 명반응에서 물이 광분해되어 산소가 발생한다. 산소 비발생형 광합성에서는 물 이외의 물질(수소, 황화 수소, 티오황산 등)이 전자 공여체로 이용되므로 물의 광분해는 일어나지 않고 산소도 발생하지 않는다.
물질 수지
산소 발생형 광합성을 수행하는 생물(진핵생물 및 시아노박테리아)은 모두 환원적 펜토스 인산 회로에서 탄소 고정을 수행하는 반면, 산소 비발생형 광합성을 수행하는 생물(혐기성 세균)은 종에 따라 탄소 고정 회로가 다르다.[38][39][40]
환원적 펜토스 인산 회로 이용 생물
2. 1. 1. 카복시화 단계
캘빈 회로는 일반적으로 세 단계로 구분되어 탄소를 고정하는데, 그 중 카복시화 단계에서는 외부에서 들어온 CO2와 H2O가 수용체인 리불로오스-1,5-이인산(RuBP)에 결합하여, 안정한 두 분자의 3-포스포글리세르산(3-PGA)을 만든다. 이 반응을 촉매하는 것은 흔히 루비스코(RuBisCO)라고 불리는 리불로오스-1,5-이인산 카복시화효소/산소화효소이다. 루비스코는 RuBP의 2번 탄소에 CO2를 부착시켜 불안정한 중간 산물을 만들어내고, 이것은 곧 두 분자의 3-PGA로 바뀐다. RuBP의 카복시화에서의 자유 에너지 변화는 큰 음의 값이며, CO2에 대한 루비스코의 친화도가 매우 높기 때문에 이 반응에서는 정반응이 매우 우세하게 일어난다.[11]2. 2. 역 TCA 회로 (환원적 시트르산 회로)
'''역 TCA 회로'''(rTCA) 또는 '''환원적 시트르산 회로'''는 표준 캘빈 회로의 탄소 고정 방식의 대안이다. 이는 엄격한 혐기성 또는 미호기성 세균 (예: ''Aquificales'')과 혐기성 고세균에서 발견되었다. 1966년 광합성 녹황세균 ''Chlorobium limicola''를 연구하던 에반스(Evans), 뷰캐넌(Buchanan), 아논(Arnon)에 의해 발견되었다.[12] 특히, 이는 열수 분출공에서 Campylobacterota에 의해 가장 많이 사용되는 경로 중 하나이다.[13] 이 특징은 해양의 무광 환경 또는 "어두운 일차 생산"에서 일차 생산을 가능하게 한다.[14] 이것이 없다면 무광 환경에서 일차 생산이 이루어지지 않아 생명체가 없는 서식지가 생길 것이다.이 회로는 두 분자의 CO2로부터 아세틸-CoA를 생합성하는 것을 포함한다.[18] 역 크렙스 회로의 주요 단계는 다음과 같다.
- 옥살아세트산을 말산으로 전환, NADH + H+ 사용
- :
옥살아세트산 + NADH/H+ -> 말산 + NAD+ - 푸마르산을 숙신산으로 전환, 산화환원효소 푸마르산 환원효소에 의해 촉매됨
- :
푸마르산 + FADH2 <=> 숙신산 + FAD - 숙신산을 숙시닐-CoA로 전환, ATP 의존적 단계
- :
숙신산 + ATP + CoA -> 숙시닐-CoA + ADP + Pi - 숙시닐-CoA를 알파-케토글루타르산으로 전환, CO2 분자 1개 사용
- :
숙시닐-CoA + CO2 + Fd{(red)} -> 알파-케토글루타르산 + Fd{(ox)} - 알파-케토글루타르산을 이소시트르산으로 전환, NADPH + H+와 CO2 분자 1개 사용
- :
알파-케토글루타르산 + CO2 + NAD(P)H/H+ -> 이소시트르산 + NAD(P)+ - 시트르산을 옥살아세트산과 아세틸-CoA로 전환, 이는 ATP 의존적 단계이며 주요 효소는 ATP 시트르산 분해효소이다.
- :
시트르산 + ATP + CoA -> 옥살아세트산 + 아세틸-CoA + ADP + Pi
이 경로는 옥살아세트산이 재생되기 때문에 순환적이다.[15]
세균 감마프로테오박테리아와 ''Riftia pachyptila''는 H2S 농도에 반응하여 캘빈-벤슨 회로에서 rTCA 회로로 전환한다.[16]
혐기성 또는 미호기성 화학 합성 세균 (아쿠이펙스나 엡실론프로테오박테리아 등)이나 일부 산소 비발생형 광합성 세균 (녹색유황세균) 등에서 발견된다.[40] 물과 CO2를 이용하여 탄소 고정을 수행하며, 수소, 황화 수소, 티오황산 등이 전자 공여체로 이용된다. 이 회로는 크렙스 회로의 역반응으로, 2개의 CO2 분자로부터 아세틸 CoA를 생성한다. 대부분의 효소는 어느 방향으로든 공통적으로 작용하지만, 일부 효소는 다르다. 옥살아세트산의 재생을 동반하는 순환 회로이다.
환원적 크렙스 회로는 한때 일부 고세균에서도 분포한다고 생각되었지만[48], 현재는 이들 고세균이 디카르복실레이트/4-히드록시부티르산 사이클을 사용하여 탄소 고정을 수행하는 것으로 확인되었다.[49] 따라서 환원적 크렙스 회로는 세균에서만 발견된다.[40]
2. 3. 환원적 아세틸-CoA 경로 (우드-륑달 경로)
환원적 아세틸-CoA 경로(CoA) 경로는 우드-륑달 경로라고도 불리며, 이산화 탄소(CO2)를 전자 수용체 및 탄소원으로 사용하고, 수소(H2)를 전자 공여체로 사용하여 아세트산을 형성한다.[17] 이 대사 과정은 Bacillota 문 내, 특히 Clostridia에서 널리 퍼져 있다.[19]이 경로는 또한 주로 Euryarchaeota인 메탄 생성균과 황산염 환원 박테리아 및 고세균과 같은 여러 혐기성 화학 독립영양생물에 의해 사용된다. 또한 혐기성 조건에서 암모니아를 산화시키는 Planctomycetota의 한 순서인 Brocadiales에 의해 수행될 가능성이 있다.[18] [19][20] 특정 고세균에서만 발견되며 전 세계 메탄 생성의 80%를 차지하는 수소 영양성 메탄 생성도 환원적 아세틸-CoA 경로에 기반한다.
일산화탄소 탈수소효소/CO-메틸화 아세틸-CoA 합성효소는 여러 반응에서 CO2를 일산화 탄소(CO)로 환원시키고 아세틸-CoA를 합성하는 산소에 민감한 효소이다.[21]
이 경로의 한 분지인 메틸 분지는 박테리아와 고세균 사이에서 유사하지만 상동성이 없다. 이 분지에서는 CO2가 보조 인자에 결합된 메틸 잔기로 환원된다. 중간체는 박테리아의 경우 포름산염이고 고세균의 경우 포르밀-메탄노푸란이며, 운반체인 테트라하이드로폴레이트와 테트라하이드로프테린은 박테리아와 고세균에서 각각 다르며, 보조 인자에 결합된 메틸 그룹을 형성하는 효소도 다르다.[18]
카르보닐 분지는 두 도메인 간에 상동성을 가지며, CO 탈수소효소/아세틸-CoA 합성효소에 의해 촉매되는 효소에 결합된 또 다른 CO2 분자의 카르보닐 잔기로의 환원으로 구성된다. 이 핵심 효소는 또한 이전 반응, 즉 메틸 및 카르보닐 잔기의 생성물로부터 시작하여 아세틸-CoA를 형성하는 촉매 작용을 한다.[21]
이 탄소 고정 경로는 한 분자의 피루브산을 생성하는 데 ATP 분자 1개만 필요하므로, 이 과정은 에너지 제한적이고 혐기성 조건에서 사는 화학 독립영양생물에게 주요 선택 사항 중 하나가 된다.[18]
혐기성 호흡을 통해 메탄을 생성하는 고세균(메탄균)이나 아세트산을 생성하는 세균(아세토젠), 혐기성 암모니아 산화 반응(Anammox)을 수행하는 세균(아나목스 세균) 등에서 발견된다.[43][40] 이들은 수소(H2)를 전자 공여체로 이용한다. 그 기원은 탄소 고정 회로 중 가장 오래된 것으로 추정되며,[44][45] 현재 이 회로가 발견된 것은 혐기성 화학합성 생물뿐이다. 다른 탄소 고정 회로와 달리 회로가 순환하지 않는다. 이 회로는 ATP 분자를 1개만 필요로 하므로 혐기성 조건에서 에너지원이 제한된 환경에서 유리하다.[40]
환원적 아세틸 CoA 회로에서는 2개의 CO2 분자가 메틸기 및 일산화 탄소(CO)로 환원된다. 각각 메틸 경로(methyl branch), 카르보닐 경로(carbonyl branch)라고도 불린다. 생성된 메틸기와 CO는 코엔자임 A(CoA)와 결합하여 아세틸 CoA를 생성한다. 고세균(메탄균)과 세균(아세토젠 등)에서는 메틸 경로에 차이가 있다.[36] 메탄균에서는 CO2가 메타노푸란에 결합하여 알데하이드기가 되는 반면(포르밀 메타노푸란 탈수소 효소), 아세토젠에서는 CO2가 NADPH를 이용하여 포름산이 된다(포름산 탈수소 효소 (NADP+)). 어느 경우든 CO2는 최종적으로 테트라히드로프테린에 부착된 메틸기의 형태로 흡수된다. 또 다른 CO2는 이중 기능성 일산화 탄소 탈수소 효소/아세틸 CoA 합성 효소(CODH/ACS)[46]에 의해 CO로 환원된 후, 동일한 효소가 CO와 위에서 언급한 메틸기를 CoA에 합체시켜 아세틸 CoA를 생성한다. 세균과 고세균 사이에서 보존되는 것은 CODH/ACS(카르보닐 경로)뿐이다.
환원적 아세틸 CoA 경로는 역방향으로도 진행된다. 예를 들어, 메탄균은 아세트산을 메틸기와 CO로 분해하고, 메틸기는 메탄으로 환원하는 한편, CO는 CO2로 산화한다.[46] 또한, 황산 환원 세균은 황산 환원과 함께 아세트산을 CO2와 H2까지 산화시킨다.[47]
2. 4. 3-하이드록시프로피온산 회로 (3-HP 회로)
3-하이드록시프로피온산 회로(3-HP 회로)는 1989년에 발견되었으며, 클로로플렉수스과의 녹색 비황 광합성 세균인 ''클로로플렉수스 아우란티아쿠스''가 사용한다.[22] 이 경로는 두 개의 사이클로 구성되며, 경로의 이름은 특징적인 중간체인 3-하이드록시프로피오네이트에서 유래되었다.
첫 번째 사이클은 글리옥실산의 합성 경로이다. 이 사이클 동안, 두 개의 탄산수소염 분자가 두 가지 효소의 작용에 의해 고정된다. 아세틸-CoA 카복실라아제는 아세틸-CoA를 말로닐-CoA로 카복실화하고, 프로피오닐-CoA 카복실라아제는 프로피오닐-CoA를 메틸말로닐-CoA로 카복실화한다. 이 지점부터 일련의 반응을 통해 글리옥실산이 형성되며, 이는 두 번째 사이클의 일부가 된다.[23][24]

두 번째 사이클에서 글리옥실산은 약 한 개의 프로피오닐-CoA와 반응하여 메틸말로닐-CoA를 형성한다. 이어서, 이 메틸말로닐-CoA는 일련의 반응을 통해 시트라말릴-CoA로 변환된다. 시트라말릴-CoA는 효소 MMC 리아제에 의해 피루브산과 아세틸-CoA로 분해된다. 이 지점에서 피루브산은 방출되고, 아세틸-CoA는 재사용되어 말로닐-CoA에서 다시 카복실화되어 사이클을 재구성한다.[25]
3-하이드록시프로피오네이트 회로에는 총 19개의 반응이 관여하며, 13개의 다기능 효소가 사용된다. 이러한 효소의 다기능성은 이 경로의 중요한 특징이며, 이를 통해 세 개의 탄산수소염 분자를 고정할 수 있다.[25]
이 경로는 매우 많은 에너지를 소모한다. 새로운 피루브산 합성에 7개의 ATP 분자가 사용되며, 인산 삼탄당 합성에 3개의 ATP가 사용된다.[24]
이 사이클의 중요한 특징은 다양한 화합물의 동화작용을 허용하여 혼합영양생물에 적합하다는 것이다.[24]
일부 녹색 비황 세균이 이 회로를 가지고 있다. 이 회로는 두 개의 순환 경로로 이루어져 있다. 첫 번째 경로는 아세틸 CoA로부터 3-히드록시프로피온산을 거쳐 석시닐 CoA에 이르고, 다시 아세틸 CoA로 돌아온다. 그 과정에서 글리옥실산염이 생성된다. 이 경로는 부분적으로 3-히드록시프로피온산/4-히드록시부티르산 사이클과 동일하다. 두 번째 경로는 글리옥실산염을 섭취하면서 아세틸 CoA로부터 메틸마릴 CoA를 거쳐 다시 아세틸 CoA로 돌아온다. 이 회로에서도 CO2는 HCO3- 형태로 섭취된다.
2. 5. 기타 탄소 고정 경로
6가지 자가영양 탄소 고정 경로가 알려져 있다.[8] 칼빈 회로, 역 크렙스 회로, 환원성 아세틸-CoA 경로, 3-HP 자전거 경로, 3-HP/4-HB 사이클, DC/4-HB 사이클이 그것이다.
칼빈 회로는 식물과 조류의 엽록체와 시아노박테리아에서 탄소를 고정한다.[3] 또한 Pseudomonadota의 일종인 자주색 세균에서 무산소 광합성과 일부 비광합성 Pseudomonadota에서 탄소를 고정한다.[9] 황 및 수소 산화 세균은 종종 칼빈 회로 또는 환원성 시트르산 회로를 사용한다.[10]
다른 자가영양 경로 중 두 가지는 세균에서만 알려져 있고 (역 크렙스 회로와 3-하이드록시프로피오네이트 사이클), 두 가지는 고세균에서만 알려져 있으며 (3-하이드록시프로피오네이트 사이클의 두 가지 변종), 하나는 세균과 고세균 모두에서 알려져 있다 (환원성 아세틸 CoA 경로).
3-하이드록시프로피오네이트 회로의 변형은 호기성 극호열성 산성 고세균 ''Metallosphaera sedula''에서 작동하는 것으로 밝혀졌다. 이 경로는 3-하이드록시프로피오네이트/4-하이드록시부티레이트(3-HP/4-HB) 회로라고 불린다.[26]
3-하이드록시프로피오네이트 회로의 또 다른 변형은 디카르복실레이트/4-하이드록시부티레이트(DC/4-HB) 회로이다. 이는 혐기성 고세균에서 발견되었다. 2008년 초고온성 고세균 ''Ignicoccus hospitalis''에서 제안되었다.[27]
산소 발생형 광합성을 수행하는 생물(진핵생물 및 시아노박테리아)은 모두 환원적 펜토스 인산 회로에서 탄소 고정을 수행하는 반면, 산소 비발생형 광합성을 수행하는 생물(혐기성 세균만 해당)은 종에 따라 탄소 고정 회로가 다르다.[38][39][40]
탄소 고정의 메커니즘은 원시적 조류에서 가장 발달한 속씨식물까지 광합성의 탄소 환원 회로, 또는 캘빈 회로를 중심으로 이루어진다. 캘빈 회로에서는 대기 중에서 얻은 CO2(산화수 +4)를 탄수화물(산화수 0)로 환원시킨다. 탄소를 고정하면서, 명반응에서 만들어진 ATP와 NADPH를 사용한다.[40]
이 외의 광영양 세균은 종속영양생물이며, 탄소 고정 능력을 갖지 않는다(헬리오박테리아, 일부 아시도박테리아, 일부 녹색 비황 세균 등). 또한 광합성 생물이 널리 이용하는 클로로필 (또는 박테리오클로로필)을 사용한 광화학계와는 별개로, 박테리오로돕신을 사용한 광화학계를 이용하는 생물이 존재하지만(고도호염균 등), 이 중에서 탄소 고정을 수행할 수 있는 생물은 발견되지 않았다.
일부 녹색 비황 세균은 3-히드록시프로피온산 이중 사이클 회로를 가지고 있다. 이 회로는 두 개의 순환 경로로 구성된다. 첫 번째 경로는 아세틸 CoA로부터 3-히드록시프로피온산을 거쳐 석시닐 CoA에 이르고, 다시 아세틸 CoA로 돌아오며, 이 과정에서 글리옥실산염이 생성된다. 이 경로는 부분적으로 3-히드록시프로피온산/4-히드록시부티르산 사이클과 동일하다. 두 번째 경로는 글리옥실산염을 섭취하면서 아세틸 CoA로부터 메틸마릴 CoA를 거쳐 다시 아세틸 CoA로 돌아온다. 이 회로에서도 CO2는 HCO3- 형태로 섭취된다.
3. 탄소 고정의 종류
탄소 고정은 원시적인 조류부터 가장 발달한 속씨식물까지 캘빈 회로를 중심으로 이루어진다. 캘빈 회로에서는 대기 중의 이산화 탄소(CO2)를 탄수화물로 환원시키며, 이 과정에서 명반응에서 만들어진 ATP와 NADPH를 사용한다.[5][6]
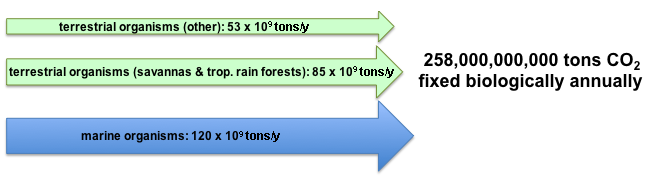
주로 이산화 탄소(CO2) 형태로 고정되며, 연간 약 2,500억 톤의 이산화 탄소가 광합성을 통해 전환된다. 육상 환경, 특히 열대 지역에서 대부분의 탄소 고정이 발생한다. 광합성 후 약 40%가 호흡에 의해 소비되므로 실제 고정되는 이산화 탄소의 총량은 훨씬 더 크다. 역사적으로 생명 기원 이후 약 2×1011 톤의 탄소가 고정된 것으로 추정된다.[7]
지금까지 6종류의 탄소 고정 회로가 발견되었다.[36][37] 원래는 환원적 펜토스 인산 회로만이 유일한 탄소 고정 회로로 알려졌으나, 20세기 후반 이후 새로운 회로들이 잇따라 발견되었다.
산소 발생형 광합성을 하는 생물(진핵생물 및 시아노박테리아)은 모두 환원적 펜토스 인산 회로를 통해 탄소를 고정한다. 반면, 산소 비발생형 광합성을 하는 생물(혐기성 세균)은 종에 따라 다른 탄소 고정 회로를 사용한다.[38][39][40]
헬리오박테리아, 일부 아시도박테리아, 일부 녹색 비황 세균 등은 종속영양생물이며 탄소 고정 능력이 없다. 또한, 박테리오로돕신을 이용하는 생물 중에는 탄소 고정을 할 수 있는 생물이 발견되지 않았다.
혐기성 호흡을 통해 메탄을 생성하는 고세균(메탄균)이나 아세트산을 생성하는 세균(아세토젠), 혐기성 암모니아 산화 반응(Anammox)을 수행하는 세균(아나목스 세균) 등은 환원적 아세틸-CoA 회로를 사용한다.[43][40] 이들은 수소(H2)를 전자 공여체로 이용하며, 이 회로는 탄소 고정 회로 중 가장 오래된 것으로 추정된다.[44][45] ATP 분자를 1개만 필요로 하므로 혐기성 조건에서 에너지원이 제한된 환경에 유리하다.[40]
환원적 아세틸 CoA 회로에서는 2개의 CO2 분자가 메틸기 및 일산화 탄소(CO)로 환원된다. 생성된 메틸기와 CO는 코엔자임 A(CoA)와 결합하여 아세틸 CoA를 생성한다. 고세균(메탄균)과 세균(아세토젠 등)에서는 메틸 경로에 차이가 있다.[36] 메탄균에서는 CO2가 메타노푸란에 결합하여 알데히드기가 되는 반면(포르밀-메타노푸란 탈수소 효소), 아세토젠에서는 CO2가 NADPH를 이용하여 포름산이 된다(포름산 탈수소 효소). 어느 경우든 CO2는 최종적으로 테트라히드로프테린에 부착된 메틸기의 형태로 흡수된다. 또 다른 CO2는 이중 기능성일산화 탄소 탈수소 효소/아세틸 CoA 합성 효소(CODH/ACS)[46]에 의해 CO로 환원된 후, 동일한 효소가 CO와 위에서 언급한 메틸기를 CoA에 합체시켜 아세틸 CoA를 생성한다. 세균과 고세균 사이에서 보존되는 것은 CODH/ACS(카르보닐 경로)뿐이다.
환원적 아세틸 CoA 회로는 역방향으로도 진행된다. 예를 들어, 메탄균은 아세트산을 메틸기와 CO로 분해하고, 메틸기는 메탄으로 환원하는 한편, CO는 CO2로 산화한다.[46] 또한, 황산 환원 세균은 황산 환원과 함께 아세트산을 CO2와 H2까지 산화시킨다.[47]
환원적 시트르산 회로는 혐기성 또는 미호기성 화학 합성 세균(아쿠이펙스나 엡실론프로테오박테리아 등)이나 일부 산소 비발생형 광합성 세균(녹색유황세균) 등에서 발견된다.[40] 물과 CO2를 이용하여 탄소 고정을 수행하며, 수소, 황화 수소, 티오황산 등이 전자 공여체로 이용된다. 이 회로는 크렙스 회로의 역반응으로, 2개의 CO2 분자로부터 아세틸 CoA를 생성한다. 옥살아세트산의 재생을 동반하는 순환 회로이다.
환원적 크렙스 회로는 한때 일부 고세균에서도 분포한다고 생각되었지만[48], 현재는 이들 고세균이 디카르복실레이트/4-히드록시부티르산 사이클을 사용하는 것으로 확인되었다.[49] 따라서 환원적 크렙스 회로는 세균에서만 발견된다.[40]
디카르복실레이트/4-하이드록시부티르산 사이클은 고세균(크렌고세균)에서만 발견된다. 회로 전체는 크게 두 부분으로 나눌 수 있다. 첫 번째는 아세틸 CoA로부터 디카르복실레이트를 거쳐 석시닐 CoA가 생성될 때까지, 두 번째는 석시닐 CoA로부터 4-하이드록시뷰티르산을 거쳐 2분자의 아세틸 CoA로 되돌아갈 때까지이다.[36] 두 아세틸 CoA 중 하나는 다음 사이클에 재사용되고, 다른 하나는 다른 유기 물질의 합성에 사용된다. 이 회로는 혐기성 조건을 필요로 한다.
3-하이드록시프로피온산/4-하이드록시부티르산 사이클은 고세균(크렌고세균)에서만 발견된다. 석시닐-CoA에서 4-히드록시부티르산을 거쳐 아세틸-CoA로 되돌아가는 부분은, 디카르복실레이트/4-히드록시부티르산 회로와 공통된다. 한편, 아세틸-CoA에서 석시닐-CoA까지는 3-히드록시프로피온산을 거친다. CO2는 HCO3- 형태로 흡수된다. HCO3-로의 변환(카르복실화)은 비오틴 의존성 아세틸-CoA/프로피오닐-CoA 카르복실레이스가 촉매한다.
3-히드록시프로피온산 이중 사이클은 일부 녹색 비황 세균이 가지고 있다. 이 회로는 두 개의 순환 경로로 이루어져 있다. 첫 번째 경로는 아세틸 CoA로부터 3-히드록시프로피온산을 거쳐 석시닐 CoA에 이르고, 다시 아세틸 CoA로 돌아온다. 그 과정에서 글리옥실산염이 생성된다. 이 경로는 부분적으로 3-히드록시프로피온산/4-히드록시부티르산 사이클과 동일하다. 두 번째 경로는 글리옥실산염을 섭취하면서 아세틸 CoA로부터 메틸마릴 CoA를 거쳐 다시 아세틸 CoA로 돌아온다. 이 회로에서도 CO2는 HCO3- 형태로 섭취된다.
탄소 고정의 기원에 관해서는 널리 지지받는 결론은 아직 없다. 다만, 몇몇 탄소 고정 회로가 현존하는 모든 생물의 공통 조상(LUCA) 이전 시대로 거슬러 올라갈 가능성이 있으며, 최초로 탄생한 생명이 독립 영양 생물이었을 가능성이 논의되고 있다.[44][50][51][52] 최근 연구에서는 LUCA가 환원적 아세틸-CoA 회로를 가지고 있었다는 것이 시사되었다.[45][53] 환원적 아세틸-CoA 회로의 핵심인 CODH/ACS는 산소에 의해 활동이 저해되므로, 혐기성 조건 하에서만 기능한다. 탄소 고정 회로 중 혐기성 조건을 필요로 하는 것은 환원적 아세틸-CoA 회로, 환원적 시트르산 회로, 그리고 디카르복실레이트/4-히드록시부티르산 사이클이 있지만, 세균 및 고세균 모두에서 존재가 확인된 탄소 고정 회로는 환원적 아세틸-CoA 회로뿐이다.[40]
한편, 호기성 조건 하에서 가장 성공적인 탄소 고정 회로인 환원적 펜토스 인산 회로의 기원은 산소 발생형 광합성을 만들어낸 시아노박테리아 이전으로 거슬러 올라가지 않는다. 환원적 펜토스 인산 회로가 갖는 RubisCO와 상동성을 가진 단백질(RubisCO-like proteins; RLPs)은 세균·고세균에 널리 분포하며, 광합성의 유무, 탄소 고정의 유무와 관계가 없다. 실제로 RLPs는 RubisCO와는 다른 기능을 가지고 있다. 따라서 RLPs와 RubisCO의 공통 조상은 원래 탄소 고정과 다른 기능을 가지고 있었을 것으로 추측된다.[54]
4. 광합성 생물과 탄소 고정
대부분의 광합성 생물에 이용되며, 오늘날 지구 환경에서 가장 널리 분포하는 탄소 고정 회로이다. 광합성은 빛 에너지에 의해 일어나는 광화학 반응(명반응) 및 그에 이은 탄소 고정(암반응)으로 구성된다. 광합성을 하는 모든 진핵생물 및 많은 광합성 세균에서는 환원적 펜토스 인산 회로가 암반응을 담당한다. 명반응 과정에서 발생하는 ATP와 NADPH를 이용하여 암반응에서는 이산화 탄소 (CO2)가 글루코스 등 유기 화합물로 변환된다. CO2는 리불로스 비스인산 카르복실라제(RubisCO)에 의해 리불로스-1,5-비스인산 (RuBP)과 결합하여 3-포스포글리세르산 (G3P)으로 변환됨으로써 생체에 흡수된다. 환원적 펜토스 인산 회로는 RuBP의 재생을 수반하는 순환 회로를 형성한다. 덧붙여 C4 광합성 및 CAM 광합성을 하는 식물은 CO2를 탄산 이온 (HCO3-)으로 효소적으로 변환한 후 일단 옥살아세트산 형태로 흡수하는 기구를 갖는다. 이 기구에 의해 생체 내 CO2 농도를 높여 그 다음에 이어지는 환원적 펜토스 인산 회로에 의한 본래의 탄소 고정 효율을 높인다. [40]
산소 발생형 광합성에서는 명반응에서 물이 광분해되어 산소가 발생한다. 산소 비발생형 광합성에서는 물 이외의 물질 (수소, 황화 수소, 티오황산 등)이 전자 공여체로 이용되므로 물의 광분해는 일어나지 않고 산소도 발생하지 않는다. 물질 수지는 아래와 같다.
::
:** 황화수소 이용:
:** 수소 이용:
산소 발생형 광합성을 수행하는 생물(진핵생물 및 시아노박테리아)은 모두 환원적 펜토스 인산 회로에서 탄소 고정을 수행하는 반면, 산소 비발생형 광합성을 수행하는 생물(혐기성 세균만 해당)은 종에 따라 탄소 고정 회로가 다르다.[38][39][40]
5. 탄소 고정의 기원과 진화
탄소 고정 메커니즘은 원시 조류에서 가장 발달한 속씨식물까지 캘빈 회로를 중심으로 이루어진다. 캘빈 회로에서는 대기 중의 이산화 탄소(CO2)를 탄수화물로 환원시키며, 이 과정에서 명반응에서 생성된 ATP와 NADPH를 사용한다.
메탄균이나 아세토젠과 같은 혐기성 호흡을 하는 생물, 그리고 혐기성 암모니아 산화 반응(Anammox)을 수행하는 아나목스 세균 등에서는 환원적 아세틸 CoA 경로가 발견된다.[43][40] 이 경로는 수소(H2)를 전자 공여체로 이용하며, 가장 오래된 탄소 고정 회로로 추정된다.[44][45] 이 회로는 ATP를 1개만 소모하므로 혐기성 조건에서 에너지원이 제한된 환경에 유리하다.[40]
환원적 아세틸 CoA 회로에서는 2개의 CO2 분자가 메틸기와 일산화 탄소(CO)로 환원된 후, 코엔자임 A(CoA)와 결합하여 아세틸 CoA를 생성한다. 메탄균과 아세토젠은 메틸 경로에서 차이를 보인다.[36] 메탄균에서는 CO2가 메타노푸란에 결합하여 알데히드기가 되는 반면(포르밀-메타노푸란 탈수소 효소), 아세토젠에서는 CO2가 NADPH를 이용하여 포름산이 된다(포름산 탈수소 효소). 또 다른 CO2는 일산화 탄소 탈수소 효소/아세틸 CoA 합성 효소(CODH/ACS)[46]에 의해 CO로 환원된 후, 동일 효소가 CO와 메틸기를 CoA에 합쳐 아세틸 CoA를 생성한다.
환원적 아세틸 CoA 회로는 역방향으로도 진행된다. 예를 들어, 메탄균은 아세트산을 메틸기와 CO로 분해하고, 메틸기는 메탄으로 환원하는 한편, CO는 CO2로 산화한다.[46] 황산 환원 세균은 황산 환원과 함께 아세트산을 CO2와 H2까지 산화시킨다.[47]
역 크렙스 회로는 혐기성 또는 미호기성 화학 합성 세균(아쿠이펙스, 엡실론프로테오박테리아)이나 일부 산소 비발생형 광합성 세균(녹색유황세균) 등에서 발견된다.[40] 물과 CO2를 이용하여 탄소 고정을 수행하며, 수소, 황화 수소, 티오황산 등이 전자 공여체로 이용된다. 이 회로는 크렙스 회로의 역반응으로, 2개의 CO2 분자로부터 아세틸 CoA를 생성한다.
환원적 크렙스 회로는 한때 일부 고세균에서도 분포한다고 생각되었지만,[48] 현재는 세균에서만 발견된다.[40]
탄소 고정의 기원에 대해서는 아직 널리 지지받는 결론은 없다. 다만, 몇몇 탄소 고정 회로가 현존하는 모든 생물의 공통 조상(LUCA) 이전 시대로 거슬러 올라갈 가능성이 있으며, 최초의 생명이 독립 영양 생물이었을 가능성이 논의되고 있다.[44][50][51][52] 최근 연구에서는 LUCA가 환원적 아세틸-CoA 회로를 가지고 있었다는 것이 시사되었다.[45][53] 환원적 아세틸-CoA 회로의 핵심인 CODH/ACS는 산소에 의해 활동이 저해되므로, 혐기성 조건 하에서만 기능한다. 혐기성 조건을 필요로 하는 탄소 고정 회로는 환원적 아세틸-CoA 회로, 환원적 시트르산 회로, 그리고 디카르복실레이트/4-히드록시부티르산 사이클이 있지만, 세균 및 고세균 모두에서 존재가 확인된 탄소 고정 회로는 환원적 아세틸-CoA 회로뿐이다.[40]
한편, 호기성 조건에서 가장 성공적인 탄소 고정 회로인 환원적 펜토스 인산 회로의 기원은 산소 발생형 광합성을 만들어낸 시아노박테리아 이전으로 거슬러 올라가지 않는다. 환원적 펜토스 인산 회로가 갖는 RubisCO와 상동성을 가진 단백질(RLPs)은 세균·고세균에 널리 분포하며, 광합성이나 탄소 고정과 관련이 없다. 따라서 RLPs와 RubisCO의 공통 조상은 원래 탄소 고정과 다른 기능을 가지고 있었을 것으로 추측된다.[54]
6. 종속 영양 생물의 탄소 고정
이화 자가영양생물은 생합성에서 이산화 탄소를 사용하지 않지만, 일부 이산화 탄소는 대사 과정에 통합된다.[29] 특히, 피루브산 카복실화 효소는 포도당신생성의 일부로 이산화 탄소(중탄산염 이온 형태)를 소비하며, 이산화 탄소는 다양한 충전 반응에서 소비된다.
6-포스포글루콘산 탈수소 효소는 높은 CO2 농도 하에서 ''대장균''에서 리불로스 5-인산의 환원적 카복실화를 촉매하여 6-포스포글루콘산을 생성한다.[30] 종속영양생물은 기본적으로 무기 탄소(CO2)를 섭취할 수 없다. 하지만 일부 생물에 대해서는 CO2를 섭취할 수 있음이 확인되었다. 이러한 경로는 주요 대사 경로의 중간 물질을 보충하기 위한 화학 반응(아나플레로틱 반응)에서 나타난다. 즉, 독립영양생물처럼 CO2를 섭취하는 것을 목적으로 하는 회로를 가지고 있는 것이 아니라, 어디까지나 다른 대사 경로의 보조 형태로 CO2가 일부 섭취된다. 잘 알려진 예시로, 시트르산 회로의 중간 물질인 옥살아세트산을 피루브산으로부터 생성하는 경로가 있다.[55][56] 생체 내에서 일부 CO2는 탄산 이온(HCO3-)으로 존재한다. 이 탄산 이온이 피루브산 카복실레이스에 의해 옥살아세트산으로 변환되어 시트르산 회로에 섭취된다.
7. 탄소 격리
생물의 탄소 고정 기능을 이용하여 대기 중의 이산화 탄소를 삭감하는 방안이 고려되고 있다.
8. 토양에서의 생물학적 탄소 고정
생합성 및 화학합성 과정 외에도, 토양에서 박테리아, 곰팡이와 같은 미생물의 활동을 통해 생물학적 탄소 고정이 발생한다. 이러한 토양 미생물은 분해된 유기물로부터 탄소를 격리하고 다시 토양으로 재활용하여 토양 비옥도와 생태계 생산성에 기여함으로써 지구 탄소 순환에서 중요한 역할을 한다.[34]
토양 환경에서 죽은 식물과 동물의 유기물은 다양한 미생물 군집에 의해 분해 과정을 거친다. 분해 과정에서 복잡한 유기 화합물은 박테리아, 곰팡이 및 기타 토양 유기체가 생산하는 효소의 작용으로 더 간단한 분자로 분해된다. 유기물이 분해됨에 따라 탄소는 이산화탄소(CO2)와 용존 유기 탄소(DOC)를 포함한 다양한 형태로 방출된다.
하지만 분해 과정에서 방출된 모든 탄소가 즉시 대기 중으로 손실되는 것은 아니며, 상당 부분은 토양 탄소 격리라고 통칭되는 과정을 통해 토양에 유지된다. 토양 미생물, 특히 박테리아와 곰팡이는 분해된 유기 탄소를 자신의 생물체에 통합하거나 부식질 및 토양 유기물과 같은 안정적인 유기 화합물 형성을 촉진함으로써 이 과정에서 중요한 역할을 한다.[35]
토양 미생물이 탄소를 격리하는 주요 메커니즘 중 하나는 미생물 생물량 생산 과정이다. 박테리아와 곰팡이는 성장하고 번식하면서 분해된 유기물에서 탄소를 세포 구조에 동화한다. 이러한 미생물 생물량은 토양에 저장된 탄소의 저장소 역할을 하여 대기에서 탄소를 효과적으로 격리한다.
또한, 토양 미생물은 세포외 고분자 물질, 효소 및 기타 [https://bio.libretexts.org/Bookshelves/Human_Biology/Human_Biology_(Wakim_and_Grewal)/03%3A_Chemistry_of_Life/3.04%3A_Biochemical_Compounds 생화학 화합물]의 합성을 통해 안정적인 토양 유기물의 형성에 기여한다. 이러한 물질은 [https://www.soils4teachers.org/physical-properties/#:~:text=The%20particles%20that%20make%20up,what%20give%20soil%20its%20texture. 토양 입자]를 함께 결합하여 유기 탄소를 미생물 분해와 물리적 침식으로부터 보호하는 집합체를 형성하는 데 도움이 된다. 시간이 지남에 따라 이러한 집합체는 토양에 축적되어 수 세기에서 수천 년 동안 지속될 수 있는 토양 유기물을 형성한다.
토양에 탄소를 격리하면 대기 중 CO2 축적을 완화하고 기후 변화를 완화할 뿐만 아니라 토양 비옥도, 물 보존 및 영양 순환을 향상시켜 식물 성장과 생태계 생산성을 지원한다. 결과적으로, 생물학적 탄소 고정에서 토양 미생물의 역할을 이해하는 것은 토양 건강을 관리하고, 기후 변화를 완화하며, 지속 가능한 토지 관리 관행을 촉진하는 데 필수적이다.
생물학적 탄소 고정은 대기 중 CO2 수준을 조절하고, 식물 및 기타 광합성 유기체의 성장을 지원하며, 생태적 균형을 유지함으로써 지구상의 생명을 유지하는 근본적인 과정이다.
참조
[1]
논문
Natural carbon fixation and advances in synthetic engineering for redesigning and creating new fixation pathways
2023-05-01
[2]
서적
Stryer Biochemie
http://dx.doi.org/10[...]
2013
[3]
논문
Natural carbon fixation and advances in synthetic engineering for redesigning and creating new fixation pathways
2023-05-01
[4]
논문
Primary productivity of planet earth: biological determinants and physical constraints in terrestrial and aquatic habitats
[5]
논문
Primary productivity of planet earth: biological determinants and physical constraints in terrestrial and aquatic habitats
[6]
서적
"PHOTOSYNTHESIS AND PARTITIONING | C3 Plants"
Elsevier
2003-01-01
[7]
논문
The geologic history of primary productivity
https://doi.org/10.1[...]
2023-11
[8]
논문
Natural carbon fixation and advances in synthetic engineering for redesigning and creating new fixation pathways
2023-05-01
[9]
논문
Potential for chemolithoautotrophy among ubiquitous bacteria lineages in the dark ocean
2011-09
[10]
서적
Encyclopedia of Microbiology
https://books.google[...]
Academic Press
[11]
논문
The Calvin cycle revisited
https://doi.org/10.1[...]
2003-01-01
[12]
논문
Alternative pathways of carbon dioxide fixation: insights into the early evolution of life?
2011-10-13
[13]
논문
Metagenome analysis of an extreme microbial symbiosis reveals eurythermal adaptation and metabolic flexibility
2008-11
[14]
논문
Is dark carbon fixation relevant for oceanic primary production estimates?
https://www.biogeosc[...]
2019-06-11
[15]
논문
A reverse KREBS cycle in photosynthesis: consensus at last
1990-04
[16]
논문
Physiological proteomics of the uncultured endosymbiont of Riftia pachyptila
2007-01
[17]
논문
A life with acetogens, thermophiles, and cellulolytic anaerobes
2009
[18]
논문
Beyond the Calvin cycle: autotrophic carbon fixation in the ocean
2011-01-15
[19]
논문
Old acetogens, new light
2008-03
[20]
논문
Deciphering the evolution and metabolism of an anammox bacterium from a community genome
2006-04
[21]
논문
Role of carbon monoxide dehydrogenase in the autotrophic pathway used by acetogenic bacteria
1984-10
[22]
논문
Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle
1993-08
[23]
논문
L-Malyl-coenzyme A lyase/beta-methylmalyl-coenzyme A lyase from Chloroflexus aurantiacus, a bifunctional enzyme involved in autotrophic CO2 fixation
2002-11
[24]
논문
Ecological aspects of the distribution of different autotrophic CO2 fixation pathways
2011-03
[25]
논문
Identifying the missing steps of the autotrophic 3-hydroxypropionate CO2 fixation cycle in Chloroflexus aurantiacus
2009-12
[26]
논문
A 3-hydroxypropionate/4-hydroxybutyrate autotrophic carbon dioxide assimilation pathway in Archaea
2007-12
[27]
논문
A dicarboxylate/4-hydroxybutyrate autotrophic carbon assimilation cycle in the hyperthermophilic Archaeum Ignicoccus hospitalis
2008-06
[28]
논문
A synthetic pathway for the fixation of carbon dioxide in vitro
[29]
논문
The Discovery of Heterotrophic Carbon Dioxide Fixation by Harland G. Wood
http://www.jbc.org/c[...]
[30]
논문
Awakening a latent carbon fixation cycle in Escherichia coli
null
2020-11
[31]
논문
Genetic control of water use efficiency and leaf carbon isotope discrimination in sunflower (Helianthus annuus L.) subjected to two drought scenarios
2014-07-03
[32]
논문
Carbon Isotope Discrimination and Photosynthesis
1989-06
[33]
논문
Carbon isotopes and water use efficiency: sense and sensitivity
2008-03
[34]
서적
Stryer Biochemie
http://dx.doi.org/10[...]
2013
[35]
서적
Stryer Biochemie
http://dx.doi.org/10[...]
2013
[36]
논문
Alternative Pathways of Carbon Dioxide Fixation: Insights into the Early Evolution of Life?
http://www.annualrev[...]
2011-10-13
[37]
논문
Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO 2 Fixation
https://pubs.acs.org[...]
2013-08-14
[38]
서적
Sulfur Metabolism in Phototrophic Sulfur Bacteria
https://linkinghub.e[...]
Elsevier
2008
[39]
논문
Carbon Metabolic Pathways in Phototrophic Bacteria and Their Broader Evolutionary Implications
http://journal.front[...]
2011
[40]
논문
Beyond the Calvin Cycle: Autotrophic Carbon Fixation in the Ocean
http://www.annualrev[...]
2011-01-15
[41]
논문
The Calvin Benson cycle in bacteria: New insights from systems biology
https://www.scienced[...]
2024-03-01
[42]
논문
Both Forward and Reverse TCA Cycles Operate in Green Sulfur Bacteria
https://linkinghub.e[...]
2010-11
[43]
논문
Acetogenesis and the Wood–Ljungdahl pathway of CO2 fixation
https://linkinghub.e[...]
2008-12
[44]
논문
Older Than Genes: The Acetyl CoA Pathway and Origins
https://www.frontier[...]
2020-06-04
[45]
논문
The physiology and habitat of the last universal common ancestor
http://www.nature.co[...]
2016-09
[46]
논문
Structure, Function, and Mechanism of the Nickel Metalloenzymes, CO Dehydrogenase, and Acetyl-CoA Synthase
https://pubs.acs.org[...]
2014-04-23
[47]
논문
Anaerobic acetate oxidation to CO2 by Desulfotomaculum acetoxidans: Demonstration of enzymes required for the operation of an oxidative acetyl-CoA/carbon monoxide dehydrogenase pathway
http://link.springer[...]
1988-08
[48]
논문
Reconstruction of the Central Carbohydrate Metabolism of Thermoproteus tenax by Use of Genomic and Biochemical Data
https://journals.asm[...]
2004-04
[49]
논문
Autotrophic Carbon Dioxide Assimilation in Thermoproteales Revisited
https://journals.asm[...]
2009-07
[50]
논문
On the Origin of Heterotrophy
https://doi.org/10.1[...]
2016-01
[51]
논문
Iron catalysis at the origin of life
https://onlinelibrar[...]
2017-06
[52]
논문
Metals likely promoted protometabolism in early ocean alkaline hydrothermal systems
https://advances.sci[...]
2019-06
[53]
논문
The Emergence and Early Evolution of Biological Carbon-Fixation
https://journals.plo[...]
2012-04-19
[54]
논문
A short history of RubisCO: the rise and fall (?) of Nature's predominant CO2 fixing enzyme
https://linkinghub.e[...]
2018-02
[55]
논문
Uptake of Atmospheric Carbon Dioxide into Silk Fiber by Silkworms
https://pubs.acs.org[...]
2003-05
[56]
논문
The Key Role of Anaplerosis and Cataplerosis for Citric Acid Cycle Function
https://linkinghub.e[...]
2002-08
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
